新药研发相关知识详细介绍PPT课件( 44页)
合集下载
新药研发PPT幻灯片课件

• 在体内通过酶解而重新释放出母体化合物发挥作用。
31
3. 孪药设计
• 孪药,是指将两个相同或不同的先导化合物或药物经共价键连 接缀合成的新分子,在体内代谢生成以上两分子药物而产生协 同作用,增强活性或产生新的药理活性,或者提高作用的选择 性。
• 如果在体内可代谢为原来的构成成分,也被看作是前体药物。 • 常应用拼合原理。
入地研究中。 11
随机与逐一筛选 及意外发现先导化合物
随机与逐一筛选及意外发现曾是获得先导化合 物的最大来源,目前仍为一个可靠来源。其方式为 对从特有或稀有植物、海洋生物、微生物代谢产物 以及低等动植物体内分离天然生物活性成分,对有 机化工产品及其中间体进行普筛,虽然有相当大的 盲目性,但却可以得到新结构类型或新作用特点的 先导化合物。
6
从天然活性物质中 筛选获得先导化合物
在药物发展的早期阶段,利用天然产物作为治疗手 段几乎是唯一的源泉。时至今日,从动植物和微生物体 内分离鉴定具有生物活性物质,仍然是先导物甚至是药 物的重要组成部分。因所获得天然活性物质的来源不同, 又划分为三种途径:
从陆地上动植物体内提取、分离天然活性物质获得先导化 合物
10
实例分析
青蒿素(Artemisin分in析e):是这从是黄利用天然植物发掘先 花蒿植物(ACrH3temis导ia物,an开nu发le药)分物的一个典型H例子CH。3 天 H离对氯3C 的恶喹O含性耐OO有 疟 药O 过原株氧虫具CH键作有3 的用抑然 疟 明 内倍快制青作 : 酯半,作蒿用 过 经萜特用素复 氧 硼内别,发 键 氢的酯 是对缺率 还 化,对人点较原钠是高成还H3。醚原生C 物构键成OH利效,半OO用关活缩O 系性醛度低研丧仍和究失保HH 抗表。持 体型毒的R为=还性抗-原H很 疟O青低先蒿R,导素因化而合活 或 性成物性 酯 明为,, 化 显新利半 成 提结用缩 青 高构 对醛 蒿 ,类其的酰药羟酯物基等动甲化力醚合学青化物性蒿O成,质素蒿生也甲物有CH醚活所3 进抗为行疟R=蒿结药-甲C构 。H醚3改造开发改 但了善青很,蒿多这素有作些效化为的合抗物疟先均已导发化展合物成药仍物在,深
31
3. 孪药设计
• 孪药,是指将两个相同或不同的先导化合物或药物经共价键连 接缀合成的新分子,在体内代谢生成以上两分子药物而产生协 同作用,增强活性或产生新的药理活性,或者提高作用的选择 性。
• 如果在体内可代谢为原来的构成成分,也被看作是前体药物。 • 常应用拼合原理。
入地研究中。 11
随机与逐一筛选 及意外发现先导化合物
随机与逐一筛选及意外发现曾是获得先导化合 物的最大来源,目前仍为一个可靠来源。其方式为 对从特有或稀有植物、海洋生物、微生物代谢产物 以及低等动植物体内分离天然生物活性成分,对有 机化工产品及其中间体进行普筛,虽然有相当大的 盲目性,但却可以得到新结构类型或新作用特点的 先导化合物。
6
从天然活性物质中 筛选获得先导化合物
在药物发展的早期阶段,利用天然产物作为治疗手 段几乎是唯一的源泉。时至今日,从动植物和微生物体 内分离鉴定具有生物活性物质,仍然是先导物甚至是药 物的重要组成部分。因所获得天然活性物质的来源不同, 又划分为三种途径:
从陆地上动植物体内提取、分离天然活性物质获得先导化 合物
10
实例分析
青蒿素(Artemisin分in析e):是这从是黄利用天然植物发掘先 花蒿植物(ACrH3temis导ia物,an开nu发le药)分物的一个典型H例子CH。3 天 H离对氯3C 的恶喹O含性耐OO有 疟 药O 过原株氧虫具CH键作有3 的用抑然 疟 明 内倍快制青作 : 酯半,作蒿用 过 经萜特用素复 氧 硼内别,发 键 氢的酯 是对缺率 还 化,对人点较原钠是高成还H3。醚原生C 物构键成OH利效,半OO用关活缩O 系性醛度低研丧仍和究失保HH 抗表。持 体型毒的R为=还性抗-原H很 疟O青低先蒿R,导素因化而合活 或 性成物性 酯 明为,, 化 显新利半 成 提结用缩 青 高构 对醛 蒿 ,类其的酰药羟酯物基等动甲化力醚合学青化物性蒿O成,质素蒿生也甲物有CH醚活所3 进抗为行疟R=蒿结药-甲C构 。H醚3改造开发改 但了善青很,蒿多这素有作些效化为的合抗物疟先均已导发化展合物成药仍物在,深
新药研制与开发PPT课件

先导化合物发现途径 Nhomakorabea01
高通量筛选
虚拟筛选
02
03
组合化学
利用高通量技术从大量化合物库 中筛选出具有活性的先导化合物。
基于计算机模拟技术预测化合物 与靶点的相互作用,提高筛选效 率。
通过化学合成方法制备具有结构 多样性的化合物库,增加发现机 会。
候选药物优化策略
结构优化
01
通过化学修饰、构效关系分析等手段提高候选药物的活性及选
新药分类
中药、天然药物注册分类,化学 药品注册分类,生物制品注册分 类。
国内外新药研发现状
国内新药研发现状
近年来我国新药研发虽取得显著进展 ,但创新能力仍显不足,药品研发低 水平重复现象比较严重,存在“多、 小、散、乱”的状况。
国外新药研发现状
发达国家由于药品研发基础好、技术 先进,在新药研发领域处于领先地位 ,其研发的新药数量和质量都远高于 我国。
保密技术运用
采用加密技术、访问控制技术等手段, 确保商业秘密不被泄露。
泄密应急处理
制定泄密应急预案,及时采取补救措 施,降低损失。
市场推广策略制定
市场调研
产品定位
了解目标市场、竞争对手、客户需求等信 息,为制定推广策略提供依据。
根据产品特点和市场需求,明确产品的目 标用户和市场定位。
推广渠道选择
营销策略制定
辅料选择
选择适宜的辅料,提高制剂的稳 定性和生物利用度,同时降低不 良反应的发生。
处方优化
通过对比实验和数据分析,对制 剂处方进行优化,提高产品质量 和生产效率。
质量标准建立及稳定性考察
1 2
质量标准制定
根据药物的性质和临床需求,制定合理的质量标 准,包括鉴别、检查、含量测定等项目。
高通量筛选
虚拟筛选
02
03
组合化学
利用高通量技术从大量化合物库 中筛选出具有活性的先导化合物。
基于计算机模拟技术预测化合物 与靶点的相互作用,提高筛选效 率。
通过化学合成方法制备具有结构 多样性的化合物库,增加发现机 会。
候选药物优化策略
结构优化
01
通过化学修饰、构效关系分析等手段提高候选药物的活性及选
新药分类
中药、天然药物注册分类,化学 药品注册分类,生物制品注册分 类。
国内外新药研发现状
国内新药研发现状
近年来我国新药研发虽取得显著进展 ,但创新能力仍显不足,药品研发低 水平重复现象比较严重,存在“多、 小、散、乱”的状况。
国外新药研发现状
发达国家由于药品研发基础好、技术 先进,在新药研发领域处于领先地位 ,其研发的新药数量和质量都远高于 我国。
保密技术运用
采用加密技术、访问控制技术等手段, 确保商业秘密不被泄露。
泄密应急处理
制定泄密应急预案,及时采取补救措 施,降低损失。
市场推广策略制定
市场调研
产品定位
了解目标市场、竞争对手、客户需求等信 息,为制定推广策略提供依据。
根据产品特点和市场需求,明确产品的目 标用户和市场定位。
推广渠道选择
营销策略制定
辅料选择
选择适宜的辅料,提高制剂的稳 定性和生物利用度,同时降低不 良反应的发生。
处方优化
通过对比实验和数据分析,对制 剂处方进行优化,提高产品质量 和生产效率。
质量标准建立及稳定性考察
1 2
质量标准制定
根据药物的性质和临床需求,制定合理的质量标 准,包括鉴别、检查、含量测定等项目。
《新药研发与申报》课件

Байду номын сангаас
审批时限
国家药品监管部门自受理新药申 请之日起60日内完成技术审查, 申请人需要补充材料的,自再次 受理之日起30日内完成技术审查
。
新药上市后的监测与监管
监测计划
新药上市后,申请人需制定监测 计划,对药品的安全性、有效性
、质量可控性进行持续监测。
不良反应报告
医疗机构和药品经营企业需及时报 告药品不良反应,国家药品监管部 门对不良反应进行调查评估。
详细描述
毒理学研究涉及药物的急性毒性、长期毒性、致癌性、生殖毒性等方面的研究。通过毒理学研究,可以了解药物 的安全剂量范围和使用限制,为临床试验提供安全依据。
药物代谢动力学研究
总结词
药物代谢动力学研究主要探讨药物在体 内的吸收、分布、代谢和排泄过程。
VS
详细描述
药物代谢动力学研究包括药物的生物利用 度、半衰期、清除率等方面的研究。通过 药物代谢动力学研究,可以了解药物在体 内的药代动力学特征,为临床用药方案提 供科学依据。
04 新药申报与审批
CHAPTER
新药申报流程
药物发现阶段
临床前研究阶段
确定药物作用靶点,筛选候选药物,进行 初步的药理和毒理研究。
进行药物的合成工艺、药学、药效学、毒 理学等方面的研究,为临床试验提供依据 。
临床试验阶段
新药申请与审批阶段
进行药物的人体试验,分为Ⅰ期、Ⅱ期、 Ⅲ期和Ⅳ期临床试验,评估药物的安全性 和有效性。
重要性
新药研发是医药行业创新发展的 重要驱动力,对于治疗疾病、提 高人类健康水平具有重要意义。
新药研发的流程
药物设计与合成
根据靶点结构和药效团设计药 物分子,并合成样品。
审批时限
国家药品监管部门自受理新药申 请之日起60日内完成技术审查, 申请人需要补充材料的,自再次 受理之日起30日内完成技术审查
。
新药上市后的监测与监管
监测计划
新药上市后,申请人需制定监测 计划,对药品的安全性、有效性
、质量可控性进行持续监测。
不良反应报告
医疗机构和药品经营企业需及时报 告药品不良反应,国家药品监管部 门对不良反应进行调查评估。
详细描述
毒理学研究涉及药物的急性毒性、长期毒性、致癌性、生殖毒性等方面的研究。通过毒理学研究,可以了解药物 的安全剂量范围和使用限制,为临床试验提供安全依据。
药物代谢动力学研究
总结词
药物代谢动力学研究主要探讨药物在体 内的吸收、分布、代谢和排泄过程。
VS
详细描述
药物代谢动力学研究包括药物的生物利用 度、半衰期、清除率等方面的研究。通过 药物代谢动力学研究,可以了解药物在体 内的药代动力学特征,为临床用药方案提 供科学依据。
04 新药申报与审批
CHAPTER
新药申报流程
药物发现阶段
临床前研究阶段
确定药物作用靶点,筛选候选药物,进行 初步的药理和毒理研究。
进行药物的合成工艺、药学、药效学、毒 理学等方面的研究,为临床试验提供依据 。
临床试验阶段
新药申请与审批阶段
进行药物的人体试验,分为Ⅰ期、Ⅱ期、 Ⅲ期和Ⅳ期临床试验,评估药物的安全性 和有效性。
重要性
新药研发是医药行业创新发展的 重要驱动力,对于治疗疾病、提 高人类健康水平具有重要意义。
新药研发的流程
药物设计与合成
根据靶点结构和药效团设计药 物分子,并合成样品。
新药研发相关知识详细介绍PPT(44张)

新 药 申 报 流 程
3.4 上市及监测
IV期临床研究和上市后监测 理解药物的作用机理和范围; 研究药物可能的新的治疗作用; 说明需要补充的剂量规格
新药开发研究分为临床前研究和临床研究两个阶段。
新药开发研究示意图
临床前研 究
候选化合 物
临床前研究
临床研究
药物质量研究 药物制剂研究 药效学评价 药物代谢评价 药物安全评价
IV 期临床试验
临床候选 新药
III 期临床试验 II 期临床试验
I 期临床试验
新药
3.1 临床前研究
3.1.1 药学研究: 化学原料药要确证药物的化学结构;多组分药物,
2.2 以现有的药物为新药研究基础
优点:
成功率大。 改善药物的吸收,减少药物的毒副作用,减少耐受性,使
药物长效,速效,高效为研究目标。 天然药物的结构简化的代用品,还可以降低药物的成本。
近年来随着生理生化机制的了解,得到了一些疾病治疗的突破性的药
物,称原型药物(Prototype Drug)。随之出现了大量的“Me-too” 药物。“Me-too”药物特指具有自己知识产权的药物,其药效和同类的突
中药讲究炮制,讲究药物四性五味和归经。 中药多用复方,讲究君臣佐使。
中药现代化
定义:在中医药理论的指导下,以现代科学技术为手段,研究中药疗效的
物质基础,发现中药的有效成分,阐明中药的作用机制,并在中药有效成 分研究的基础上,制定出国际上认可的中药质量标准;同时,要加强中药 新剂型的研究,健全现代化的中药研发和生产管理体制,使之符合国际上 认可的GAP、GLP、GMP、GCP、GSP等管理规范。
C.呼吸系统:给药后呼吸频率、幅度和节律变化。
《新药研发与申报》课件

06
新药研发的未来展望
新药研发技术的发展趋势
基因组学和蛋白质组学技术
01
随着基因组学和蛋白质组学技术的不断进步,将有助于发现更
多潜在的药物靶点,加速新药的研发进程。
人工智能与机器学习
02
人工智能和机器学习技术在新药研发中的应用将越来越广泛,
能够提高药物筛选和预测的准确性,缩短研发周期。
免疫疗法
03
新型疫苗
针对新型传染病和肿瘤等疾病,需要研发更加安全、有效的疫苗 ,为预防和治疗提供有力支持。
国际合作与交流在推动新药研发中的作用
跨国合作
国际合作与交流有助于跨国制药企业共享资源、技术和经验,加速 新药的研发进程。
学术交流
国际学术交流活动能够促进科研人员之间的合作与知识共享,推动 新药研发领域的创新。
Ⅲ期临床试验
总结词
大规模验证
详细描述
Ⅲ期临床试验是新药研发的 最后阶段,目的是进一步验 证新药在治疗目标疾病中的
有效性和安全性。
总结词
广泛招募志愿者
详细描述
Ⅲ期临床试验通常会广泛招募患有相关疾 病的志愿者,涉及数千至数万人的规模, 以获得更可靠的数据支持。
总结词
全面评估药物效果
详细描述
Ⅲ期临床试验会对新药的疗效、安全性、 使用方法等进行全面评估,为新药的上市 申请提供支持。
通过生物学、化学和遗传学手段 ,确定潜在的药物作用靶点。
申报与审批
完成临床试验后,将药物申报资 料提交给药品监管部门进行审批 。
新药研发的挑战与机遇
挑战
新药研发成本高、周期长、成功率低,需要克服技术、法律、伦理和市场等多 方面的挑战。
机遇
随着科技的不断进步和人类对疾病认识的深入,新药研发领域也在不断涌现新 的机遇和挑战。例如基因治疗、免疫疗法等新型治疗方法的出现,为新药研发 提供了更多的可能性。
新药研发基本知识.ppt

me better
三、国内外新药研发现状
me too和me better
雷尼替丁 雷尼替丁比西咪替丁作用强5-8 倍,副作用却比西咪替丁小
西咪替丁
法莫替丁 法莫替丁比西咪替丁药效高30100倍
三、国内外新药研发现状
我国的新药
目前我国自主研发、获得国际承认的创新药物仅两个: 上世纪50年代开发的二巯基丁二酸钠 上世纪60年代开发的青蒿素
二、新药研发程序
美国的新药定义
是指一种“新的化合物”出现,并 且“该药的治疗成分从未通过任何成员 国或地区的法律认可”。
我国的新药定义
未曾在中国境内上市销售的药品, 已上市的药品改变剂型、改变给药途径、 增加新适应症或制成新的复方制剂,亦 按新药管理。
真正意义上的新药
是指拥有全球专利或在全世界都没 有上市过的新化学实体(NCE) 新药。它 不包括现存化合物的新型盐类、前药、 代谢物和酯类,也不包括组合产品。
二、新药研发程序
反应停事件 沙利度胺,海豹肢畸形 1957-1962, 15000婴儿受害
二、新药研发程序
临床研究
临床研究是评价侯选药物能否成为一个新药的最终的标准 新药临床试验分为Ⅰ、Ⅱ、Ⅲ、Ⅳ期
三、国内外新药研发现状
新药研发特点:费用多,投入高,时间长
5000个
250个
10个
1个
黄花蒿
O O
O
O
O
青蒿素
疟疾
三、国内外新药研发现状
2011年9月,中国女药学家屠呦呦因创制新型抗疟药——— 青蒿素和双氢青蒿素的贡献,获得被誉为诺贝尔奖“风向 标”的拉斯克奖。这是中国生物医学界迄今为止获得的世 界级最高奖。
先导化合物的筛选
三、国内外新药研发现状
me too和me better
雷尼替丁 雷尼替丁比西咪替丁作用强5-8 倍,副作用却比西咪替丁小
西咪替丁
法莫替丁 法莫替丁比西咪替丁药效高30100倍
三、国内外新药研发现状
我国的新药
目前我国自主研发、获得国际承认的创新药物仅两个: 上世纪50年代开发的二巯基丁二酸钠 上世纪60年代开发的青蒿素
二、新药研发程序
美国的新药定义
是指一种“新的化合物”出现,并 且“该药的治疗成分从未通过任何成员 国或地区的法律认可”。
我国的新药定义
未曾在中国境内上市销售的药品, 已上市的药品改变剂型、改变给药途径、 增加新适应症或制成新的复方制剂,亦 按新药管理。
真正意义上的新药
是指拥有全球专利或在全世界都没 有上市过的新化学实体(NCE) 新药。它 不包括现存化合物的新型盐类、前药、 代谢物和酯类,也不包括组合产品。
二、新药研发程序
反应停事件 沙利度胺,海豹肢畸形 1957-1962, 15000婴儿受害
二、新药研发程序
临床研究
临床研究是评价侯选药物能否成为一个新药的最终的标准 新药临床试验分为Ⅰ、Ⅱ、Ⅲ、Ⅳ期
三、国内外新药研发现状
新药研发特点:费用多,投入高,时间长
5000个
250个
10个
1个
黄花蒿
O O
O
O
O
青蒿素
疟疾
三、国内外新药研发现状
2011年9月,中国女药学家屠呦呦因创制新型抗疟药——— 青蒿素和双氢青蒿素的贡献,获得被誉为诺贝尔奖“风向 标”的拉斯克奖。这是中国生物医学界迄今为止获得的世 界级最高奖。
先导化合物的筛选
《新药研制与开发》课件

详细描述
总结词
新药上市后需进行长期监测与评价,确保药品安全有效,及时发现并处理不良反应。
详细描述
新药上市后,需进行长期监测,收集药品使用过程中的数据,包括不良反应、疗效等。对于发现的不良反应,需及时进行调查、分析和处理,并采取必要的措施,如修改药品说明书、暂停销售等。同时,需定期对药品进行评价,确保药品的安全性和有效性。
新药的市场推广与普及需通过多种渠道进行宣传和教育,提高公众对新药的认知度和接受度。
总结词
新药的市场推广与普及需通过多种渠道进行宣传和教育,如学术会议、媒体宣传、社交媒体等。同时,需加强与医疗机构的合作,开展临床研究、培训等活动,提高医生对新药的认知度和接受度。此外,还需开展公众科普宣传,提高公众对新药的认知度和接受度,促进药品的广泛应用。
总结词
总结词:随着科技的不断进步,新药研发技术也在不断发展与创新,为新药研发带来了新的机遇和挑战。
详细描述:近年来,随着基因组学、蛋白质组学、细胞生物学等学科的发展,新药研发的技术手段不断更新和完善。例如,基于基因组学和蛋白质组学的研究,可以发现新的药物靶点;基于细胞生物学的研究,可以研究药物的细胞作用机制;基于计算化学和人工智能的研究,可以预测药物的性质和行为。这些技术的发展为新药研发提供了新的思路和方法,有助于加速新药的研发进程和提高成功率。同时,这些技术也带来了新的挑战和问题,需要不断探索和创新。
详细描述
总结词
介绍新药研制的完整流程。
总结词
新药研制流程包括药物发现、药学研究、药理毒理学研究、临床试验和上市注册等阶段。每个阶段都有相应的研究内容和目标,以确保新药的安全性和有效性。
详细描述
总结词
阐述新药研制必须遵守的法规和伦理原则。
详细描述
总结词
新药上市后需进行长期监测与评价,确保药品安全有效,及时发现并处理不良反应。
详细描述
新药上市后,需进行长期监测,收集药品使用过程中的数据,包括不良反应、疗效等。对于发现的不良反应,需及时进行调查、分析和处理,并采取必要的措施,如修改药品说明书、暂停销售等。同时,需定期对药品进行评价,确保药品的安全性和有效性。
新药的市场推广与普及需通过多种渠道进行宣传和教育,提高公众对新药的认知度和接受度。
总结词
新药的市场推广与普及需通过多种渠道进行宣传和教育,如学术会议、媒体宣传、社交媒体等。同时,需加强与医疗机构的合作,开展临床研究、培训等活动,提高医生对新药的认知度和接受度。此外,还需开展公众科普宣传,提高公众对新药的认知度和接受度,促进药品的广泛应用。
总结词
总结词:随着科技的不断进步,新药研发技术也在不断发展与创新,为新药研发带来了新的机遇和挑战。
详细描述:近年来,随着基因组学、蛋白质组学、细胞生物学等学科的发展,新药研发的技术手段不断更新和完善。例如,基于基因组学和蛋白质组学的研究,可以发现新的药物靶点;基于细胞生物学的研究,可以研究药物的细胞作用机制;基于计算化学和人工智能的研究,可以预测药物的性质和行为。这些技术的发展为新药研发提供了新的思路和方法,有助于加速新药的研发进程和提高成功率。同时,这些技术也带来了新的挑战和问题,需要不断探索和创新。
详细描述
总结词
介绍新药研制的完整流程。
总结词
新药研制流程包括药物发现、药学研究、药理毒理学研究、临床试验和上市注册等阶段。每个阶段都有相应的研究内容和目标,以确保新药的安全性和有效性。
详细描述
总结词
阐述新药研制必须遵守的法规和伦理原则。
详细描述
新药研究及开发概述PPT学习课件

药品的注册申请还包括对已有国家标准药品的 申请。
化学药品的注册分类分为六大类
31
(一)未在国内外上市销售的药品
1.通过合成或半合成的方法制得的原料药及 其制剂;
2.天然物质中提取或者通过发酵提取的新的 有效单体及其制剂;
3.用拆分或者合成等方法制得的已知药物中 的光学异构体及其制剂;
4.将已上市销售的多组分药物制备为较少组 分的药物;
5.新的复方制剂。
32
(二)改变给药途径且尚未在国 内外上市销售的制剂
33
(三)已在国外上市销售但尚未 在国内上市销售的药品
1.已在国外上市销售的原料药及其制剂; 2.已在国外上市销售的复方制剂; 3.改变给药途径并已在国外上市销售的制剂。
因此要求药物在治疗剂量范围内,不产生严重 的毒性反应,不产生或较少产生副作用。
24
(二)药物的纯度
药物有效成分的含量是反映药物纯度的重 要标志,而药物中存在的杂质直接影响到药物 的疗效和并可能导致毒副作用的产生。
25
药物的杂质(Impurity of Drugs)
指在生产、贮存过程中引进或产生的药物 以外的其它化学物质,包括由于分子手性的存 在而产生的非治疗活性的光学异构体。
11
临床前研究需解决的问题有
(1)所研究的药物有确定的药效学作用; (2)在动物中进行了药物的吸收试验且其结果
可行; (3)动物中进行的药物吸收、代谢和排泄研究
和人体中所预期的结果相似; (4)药物有较少的活性代谢物; (5)有明确的新药代谢的动力学研究; (6)三致试验和急性、亚急性、长期毒理试验,
5
新药研究与开发过程
研究计划的确立-药源-筛选-临床前研 究(I,II)-IND(investigating new drug) 申请-I期临床-II期临床-III期临床-新药申 请(NDA)- 获批,注册上市
化学药品的注册分类分为六大类
31
(一)未在国内外上市销售的药品
1.通过合成或半合成的方法制得的原料药及 其制剂;
2.天然物质中提取或者通过发酵提取的新的 有效单体及其制剂;
3.用拆分或者合成等方法制得的已知药物中 的光学异构体及其制剂;
4.将已上市销售的多组分药物制备为较少组 分的药物;
5.新的复方制剂。
32
(二)改变给药途径且尚未在国 内外上市销售的制剂
33
(三)已在国外上市销售但尚未 在国内上市销售的药品
1.已在国外上市销售的原料药及其制剂; 2.已在国外上市销售的复方制剂; 3.改变给药途径并已在国外上市销售的制剂。
因此要求药物在治疗剂量范围内,不产生严重 的毒性反应,不产生或较少产生副作用。
24
(二)药物的纯度
药物有效成分的含量是反映药物纯度的重 要标志,而药物中存在的杂质直接影响到药物 的疗效和并可能导致毒副作用的产生。
25
药物的杂质(Impurity of Drugs)
指在生产、贮存过程中引进或产生的药物 以外的其它化学物质,包括由于分子手性的存 在而产生的非治疗活性的光学异构体。
11
临床前研究需解决的问题有
(1)所研究的药物有确定的药效学作用; (2)在动物中进行了药物的吸收试验且其结果
可行; (3)动物中进行的药物吸收、代谢和排泄研究
和人体中所预期的结果相似; (4)药物有较少的活性代谢物; (5)有明确的新药代谢的动力学研究; (6)三致试验和急性、亚急性、长期毒理试验,
5
新药研究与开发过程
研究计划的确立-药源-筛选-临床前研 究(I,II)-IND(investigating new drug) 申请-I期临床-II期临床-III期临床-新药申 请(NDA)- 获批,注册上市
中药新药的研制课件

制剂,可根据其所含有活性成分的某些理化特 性测定该制剂的稳定性变化。
(二)稳定性试验的方法
1、比较试验法 2、留样观察法 3、加速试验法
七、临床前药效学研究
(一)主要药效学研究
1、试验方法 2、观测指标 3、实验动物 4、受试药物 5、给药剂量及途径 6、给药方式 7、设立对照组
七、临床前药效学研究
中药新药的研制
中药学院药剂教研室
学习要求
1.掌握新药的含义与中药﹑天然药物的注册管 理规定.
2.熟悉中药新药研思想究开发的程序与方法; 新药报批程序;新药的监测5管理及技术转让 基本知识.
3.了解中药新药研究开发的现状,明确中药新 药研究开发的意义与指导思想.
第一节 概 述
一、新药含义的演变
1985年7月《新药审批办法》: 新药是指我国未生产过的药品。
剂. ⒏首次进口的天然药物及其提取物和其制
剂.
(一)新药注册申请
⒐单味中药提取物制成的制剂 ⒑中药新的复方制剂 ⒒首次进口的天然药物的复方制剂(含中
药复方制剂) ⒓以中药疗效为主的中药与化学药组成的
复方制剂 ⒔由局部给药改为全身给药的制剂
三、中药、天然药物制剂的注册申请分类
(二)按新药管理的药品注册申请
四﹑药品注册资料的一般要求与说明(P609)
五﹑中药新药研究开发的现状
(一)在中成药品种方面 (二)在中药剂型方面 (三)在生产技术设备方面 (四)在质量控制方面 (五)在稳定性研究方面
六、中药新药研究开发的意义与指导 思想
(一)中药新药研究开发的意义
(二)中药新药研究开发的指导思想
⒈坚持以中医药理论体系为指导 ⒉充分利用现代科技知识和手段 ⒊以制剂的有效安全稳定为核心
(二)稳定性试验的方法
1、比较试验法 2、留样观察法 3、加速试验法
七、临床前药效学研究
(一)主要药效学研究
1、试验方法 2、观测指标 3、实验动物 4、受试药物 5、给药剂量及途径 6、给药方式 7、设立对照组
七、临床前药效学研究
中药新药的研制
中药学院药剂教研室
学习要求
1.掌握新药的含义与中药﹑天然药物的注册管 理规定.
2.熟悉中药新药研思想究开发的程序与方法; 新药报批程序;新药的监测5管理及技术转让 基本知识.
3.了解中药新药研究开发的现状,明确中药新 药研究开发的意义与指导思想.
第一节 概 述
一、新药含义的演变
1985年7月《新药审批办法》: 新药是指我国未生产过的药品。
剂. ⒏首次进口的天然药物及其提取物和其制
剂.
(一)新药注册申请
⒐单味中药提取物制成的制剂 ⒑中药新的复方制剂 ⒒首次进口的天然药物的复方制剂(含中
药复方制剂) ⒓以中药疗效为主的中药与化学药组成的
复方制剂 ⒔由局部给药改为全身给药的制剂
三、中药、天然药物制剂的注册申请分类
(二)按新药管理的药品注册申请
四﹑药品注册资料的一般要求与说明(P609)
五﹑中药新药研究开发的现状
(一)在中成药品种方面 (二)在中药剂型方面 (三)在生产技术设备方面 (四)在质量控制方面 (五)在稳定性研究方面
六、中药新药研究开发的意义与指导 思想
(一)中药新药研究开发的意义
(二)中药新药研究开发的指导思想
⒈坚持以中医药理论体系为指导 ⒉充分利用现代科技知识和手段 ⒊以制剂的有效安全稳定为核心
《新药研制与开发》课件

《新药研制与开发》ppt课件
目录
• 新药研制概述 • 新药发现与靶点验证 • 临床前研究与药学研究 • 新药临床试验与审批上市 • 新药上市后的监测与评价
01
新药研制概述
新药的定义与分类
总结词
明确新药的定义,了解新药的分类标 准。
详细描述
新药是指未被批准上市的药物,包括 创新药物和改良型药物。根据新药的 来源和特点,可以分为化学药、生物 药和中成药等不同类型。
试验提供科学依据。
药学研究还需要进行药物制剂的工艺验证和质量控制 ,以确保药物制剂的稳定性和一致性。
药学研究是新药研制过程中的重要阶段,主要 涉及药物的理化性质、药效学、药代动力学等 方面的研究。
药学研究需要综合考虑药物的稳定性、安全性和 有效性,以确保药物在临床应用中的安全性和有 效性。
药效学研究
药代动力学研究还需要进行药 物相互作用的研究,以了解药 物与其他药物或食物相互作用 的可能性。
04
新药临床试验与审批上市
Ⅰ期临床试验
总结词
初步安全性评估
总结词
小规模试验
详细描述
Ⅰ期临床试验是新药研发的早期阶段,主要目的是评估新 药在人体中的安全性和耐受性,确定药物的有效剂量范围 ,以及初步探索药物的治疗效果。
药物体外活性评价
细胞模型
建立靶点相关的细胞模型,模拟药物作用环境,评估候选药物在细胞水平上的活性。
药效学评价
通过药效学实验,如细胞增殖、凋亡、信号转导等实验,对候选药物的疗效和作用机制进行评估。
03
临床前研究与药学研究
药学研究
药学研究的目标是确定药物的剂型、给药途径 、制备工艺和质量控制标准等,为后续的临床
据。
药物经济学评价
目录
• 新药研制概述 • 新药发现与靶点验证 • 临床前研究与药学研究 • 新药临床试验与审批上市 • 新药上市后的监测与评价
01
新药研制概述
新药的定义与分类
总结词
明确新药的定义,了解新药的分类标 准。
详细描述
新药是指未被批准上市的药物,包括 创新药物和改良型药物。根据新药的 来源和特点,可以分为化学药、生物 药和中成药等不同类型。
试验提供科学依据。
药学研究还需要进行药物制剂的工艺验证和质量控制 ,以确保药物制剂的稳定性和一致性。
药学研究是新药研制过程中的重要阶段,主要 涉及药物的理化性质、药效学、药代动力学等 方面的研究。
药学研究需要综合考虑药物的稳定性、安全性和 有效性,以确保药物在临床应用中的安全性和有 效性。
药效学研究
药代动力学研究还需要进行药 物相互作用的研究,以了解药 物与其他药物或食物相互作用 的可能性。
04
新药临床试验与审批上市
Ⅰ期临床试验
总结词
初步安全性评估
总结词
小规模试验
详细描述
Ⅰ期临床试验是新药研发的早期阶段,主要目的是评估新 药在人体中的安全性和耐受性,确定药物的有效剂量范围 ,以及初步探索药物的治疗效果。
药物体外活性评价
细胞模型
建立靶点相关的细胞模型,模拟药物作用环境,评估候选药物在细胞水平上的活性。
药效学评价
通过药效学实验,如细胞增殖、凋亡、信号转导等实验,对候选药物的疗效和作用机制进行评估。
03
临床前研究与药学研究
药学研究
药学研究的目标是确定药物的剂型、给药途径 、制备工艺和质量控制标准等,为后续的临床
据。
药物经济学评价
2024年创新药物研发过程介绍PPT课件

03
加强与伦理委员会和监管机构的沟通,确保试验的顺利进行 。
29
市场环境挑战及拓展思路
市场竞争
深入了解市场需求和竞争态势,制定差异化的研发策略。
加强与产业链上下游企业的合作,形成竞争优势。
2024/2/29
30
市场环境挑战及拓展思路
融资渠道拓展
寻求多元化的融资渠道,包括政府资金、风险投资、产业基金等。
观察指标
主要关注药物的疗效、剂量反应关系、安全性等。
2024/2/29
17
III期临床试验
01
研究目的
确证新药在目标患者群体中的疗 效和安全性,为药品注册提供充 分依据。
试验设计
02
03
观察指标
采用大规模、多中心、随机、双 盲、安慰剂或阳性药物对照的方 法。
主要关注药物的疗效、安全性、 生活质量等,同时收集药物经济 学数据。
长期毒性试验
观察药物在长时间连续给予后对实验动物的毒性反应,评估药物 的潜在危害。
特殊毒性试验
包括生殖毒性、遗传毒性、致癌性等特殊毒性试验,全面评估药 物的安全性。
13
药代动力学研究
研究药物在体内的分布情况,包 括药物在各组织器官中的浓度。
研究药物及其代谢产物在体内的 排泄途径和排泄速率,了解药物 的消除过程。
创新药物研发过程介绍PPT课件
2024/2/29
1
目录
2024/2/29
• 创新药物研发概述 • 药物发现与筛选 • 临床前研究 • 临床试验 • 生产与质量控制 • 创新药物研发挑战与对策
2
01
创新药物研发概述
Chapter
2024/2/29
3
创新药物定义与分类
加强与伦理委员会和监管机构的沟通,确保试验的顺利进行 。
29
市场环境挑战及拓展思路
市场竞争
深入了解市场需求和竞争态势,制定差异化的研发策略。
加强与产业链上下游企业的合作,形成竞争优势。
2024/2/29
30
市场环境挑战及拓展思路
融资渠道拓展
寻求多元化的融资渠道,包括政府资金、风险投资、产业基金等。
观察指标
主要关注药物的疗效、剂量反应关系、安全性等。
2024/2/29
17
III期临床试验
01
研究目的
确证新药在目标患者群体中的疗 效和安全性,为药品注册提供充 分依据。
试验设计
02
03
观察指标
采用大规模、多中心、随机、双 盲、安慰剂或阳性药物对照的方 法。
主要关注药物的疗效、安全性、 生活质量等,同时收集药物经济 学数据。
长期毒性试验
观察药物在长时间连续给予后对实验动物的毒性反应,评估药物 的潜在危害。
特殊毒性试验
包括生殖毒性、遗传毒性、致癌性等特殊毒性试验,全面评估药 物的安全性。
13
药代动力学研究
研究药物在体内的分布情况,包 括药物在各组织器官中的浓度。
研究药物及其代谢产物在体内的 排泄途径和排泄速率,了解药物 的消除过程。
创新药物研发过程介绍PPT课件
2024/2/29
1
目录
2024/2/29
• 创新药物研发概述 • 药物发现与筛选 • 临床前研究 • 临床试验 • 生产与质量控制 • 创新药物研发挑战与对策
2
01
创新药物研发概述
Chapter
2024/2/29
3
创新药物定义与分类
中药新药研发流程基础知识PPT课件

批
摸索质量
工艺
标准
大生产一批 主要药效学
中试3批
建立质量标 准草案
稳定性三因素 试验
包 装
稳定性加速及 长期实验
急毒
长毒
临床
临床批件
生产批件
10/25/2019
4
1、调研
对于现代药业而言,新产品开发立项之前,必须对市场做全盘 的了解,使预期生产与预期销售能密切配合。市场是现代企业经营 管理中最重要的一环,也是一项必须实施的要务。成功的企业,都 很重视开发新产品前期的市场调研,单凭个人灵感或主观直觉开发 的新产品根本无法幸存于现今竞争激烈的市场。市场调研直接对新 药立项起指导作用,它可以帮助中药企业得到更加全面、准确的调 研数据,使中药企业系统的、客观的收集、分析和评价中药新药开 发立项前期的各个方面的信息,从而帮助中药企业做出有利于新药 开发的决策,尽可能为中药企业研制开发中药新药降低风险。
10/25/2019
11
5、临床前研究资料准备
药理毒理研究资料: 19.药理毒理研究资料综述。 20.主要药效学试验资料及文献资料。 21.一般药理研究的试验资料及文献资料。 22.急性毒性试验资料及文献资料。 23.长期毒性试验资料及文献资料。 24.过敏性(局部、全身和光敏毒性)、溶血性和局部(血管、
8
2019/10/25
9
5、临床前研究资料准备
综述资料: 1.药品名称。 2.证明性文件。 3.立题目的与依据。 4.对主要研究结果的总结及评价。 5.药品说明书样稿、起草说明及最新参考文献。 6.包装、标签设计样稿。
10/25/2019
10
5、临床前研究资料准备
药学研究资料: 7.药学研究资料综述。 8.药材来源及鉴定依据。 10.药材标准草案及起草说明,并提供药品标准物质及有关资料
新药研发ppt课件

9
Thalidomide --------a big tragedy !
Thalidomide was developed by a German pharmaceutical company. It was sold from 1957 to 1961 in almost 50 countries under at least 40 brand names. Thalidomide was chiefly sold and prescribed to pregnant women, as an antiemetic(止吐药) to combat morning sickness and as an aid to help them sleep。In 1961 when thalidomide was withdrawn from the market, more than ten thousand deformed babies were born. They suffered from phocomelia(海豹肢).
penicillum
Alexander Fleming
15
② Molecular roulette(分子的轮盘赌) A great many of new chemical structures were synthesized randomly and screened by animal or in-vitro models of human disease to see if any of the newly obtained structures prove certain effect. Disadvantage: wasteful, dependent on sensitive models for screening
新药研发的过程PPT演示课件
Ⅳ期临床试验目的是考察在广泛使用的条件下药物的疗效和
不良反应,评价新药在普通或特征人群中使用的利益与风险
关系,改进给药剂量。2004年默克公司的万络和辉瑞公司的
塞来考昔,抗关节炎药物被公司自动收回。
•6
•7
•8
•9
•10
•ቤተ መጻሕፍቲ ባይዱ1
•12
•13
•14
3)基于结构药物设计:活性构象、药效构象、药效基团、
分子模拟、QSAR方法、虚拟筛选方法等等。
二、先导化合物的优化
基团替换;结构简化;模仿药物;前药、软药、孪药原理;
拼合原理、生物电子等排、骨架迁越、五倍率等。
三、临床前药理、药代等
四、临床
•3
1)先导化合物的发现
通过各种途径、方法或手段获
得的具有一定生物活性的新的
结构类型化学物。
2)先导化合物结构优化
对先导化合物做进一步的结构
进行修饰和改造 ,提高活性和
特异性,改善药代动力学特性,
衍生出选择性高、安全性好、
活性大 性大的新的药物。
•4
3)新药临床前研究
需要做普通的、全面的、必需的试验
研究内容包括:
1)药物的理化性质
2)药理学、
3)药效动力学
4)药代动力学
•1
新药研发的过程
1)先导化合物的发现
2)先导化合物的优化
3)新药临床前研究
4)新药临床研究与应用
•2
一、先导化合物的发现
1、传统方法:随机筛选/偶然发现;天然来源/合成物的随
机筛选与意外发现;药理筛选与意外发现等等。
2、现代方法——合理药物设计法
1)组合化学与高通量筛选。
不良反应,评价新药在普通或特征人群中使用的利益与风险
关系,改进给药剂量。2004年默克公司的万络和辉瑞公司的
塞来考昔,抗关节炎药物被公司自动收回。
•6
•7
•8
•9
•10
•ቤተ መጻሕፍቲ ባይዱ1
•12
•13
•14
3)基于结构药物设计:活性构象、药效构象、药效基团、
分子模拟、QSAR方法、虚拟筛选方法等等。
二、先导化合物的优化
基团替换;结构简化;模仿药物;前药、软药、孪药原理;
拼合原理、生物电子等排、骨架迁越、五倍率等。
三、临床前药理、药代等
四、临床
•3
1)先导化合物的发现
通过各种途径、方法或手段获
得的具有一定生物活性的新的
结构类型化学物。
2)先导化合物结构优化
对先导化合物做进一步的结构
进行修饰和改造 ,提高活性和
特异性,改善药代动力学特性,
衍生出选择性高、安全性好、
活性大 性大的新的药物。
•4
3)新药临床前研究
需要做普通的、全面的、必需的试验
研究内容包括:
1)药物的理化性质
2)药理学、
3)药效动力学
4)药代动力学
•1
新药研发的过程
1)先导化合物的发现
2)先导化合物的优化
3)新药临床前研究
4)新药临床研究与应用
•2
一、先导化合物的发现
1、传统方法:随机筛选/偶然发现;天然来源/合成物的随
机筛选与意外发现;药理筛选与意外发现等等。
2、现代方法——合理药物设计法
1)组合化学与高通量筛选。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
新药注册分类: 中药天然药物
化学药品 生物制品
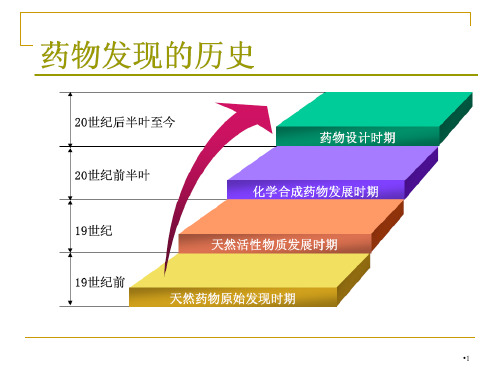
药物的起源
古代药物:植物、动物、矿物→生药→汤剂、酒剂、 散剂、膏剂
→酊剂、醑剂、 浸膏
18世纪中期,开始用动物实验对药物进行毒性测试。 19世纪后期,化学工业发展,为新药研究奠定基础。 20世纪40-60年代是新药研究的黄金时代。
40年代:青霉素、链霉素、磺胺 50年代:利血平,奋乃静 60年代:维拉帕米、山莨菪碱、胺碘酮 60年代后期:β-受体阻滞剂 70年代以末:新药开发速度减慢
中药讲究炮制,讲究药物四性五味和归经。 中药多用复方,讲究君臣佐使。
中药现代化
定义:在中医药理论的指导下,以现代科学技术为手段,研究中药疗效的
物质基础,发现中药的有效成分,阐明中药的作用机制,并在中药有效成 分研究的基础上,制定出国际上认可的中药质量标准;同时,要加强中药 新剂型的研究,健全现代化的中药研发和生产管理体制,使之符合国际上 认可的GAP、GLP、GMP、GCP、GSP等管理规范。
新药研发相关知识介绍
主要内容
1. 新药研究开发的基本概念 2. 新药发现 3. 新药开发
1. 新药研究开发相关概念
药品:
指用于预防、治疗、诊断人的疾病,有目的地调节人的生理机 能,并规定有适应症、用法和用量的物质。
药物的基本属性:
安全性、有效性、稳定性、可控性
新药:
指(我国)未生产过的药品。已生产的药品改变剂型、改变给药 途径、增加新适应症或制成新的复方制剂,亦按新药管理。
实验动物,耗资巨大。
周期长:现一般认为得到一个新药需合成上万
个化合物,耗资数亿美元,时间10-12年。
风险高 利润高 竞争激烈
全球生物和医药业年产值2000亿美元,其中R&D费用在130 亿美元。
新药开发成功率约为1/10000。从研发到市场准入平均花 时4800个工作日,耗资3亿美元。
世界新药研发(上市)速度
60年代 70年代 80年代 90年代
844个 665个 518个 约400个
世界新药类别分布
抗感染药
20.78%
心血管药
18.83%
抗肿瘤药
13.96%
神经精神药
10.39%
世界十大制药公司排行榜
1. Pfizer(辉瑞)美国 2. Johnson&Johnson(强生)美国 3. sanofi-aventis(赛诺菲-安万特)德国,法国 4. Novartis(诺华)瑞士 5. GlaxoSmithKline(葛兰素史克)英国 6. Roche(罗氏)瑞士 7. MSD(默沙东/默克)美国 8. Astrazeneca(阿斯利康)瑞典,英国 9. Wyeth(惠氏)美国 10. Abbott(雅培)美国
2. 新药发现
从天然产物中发现—药物的提取分离—天然药物化学 从现有药物改进—药物合成—药物化学 药物筛选—药理学 根据生理病理机制设计—药理学 有些新药的发现是几个途径综合的结果
2.1 天然产物
天然产物来源
植物 动物 微生物 海洋生物 矿物
天然生物活性物质的特点
新颖的结构类型(分子多样性) 独特的药理活性 资源有限及地域性差异 有效成分含量很低 大多数结构复杂,作用强度不同
破性的药物相当。这种旨在避开“专利”药物的产权保护的新药研究,大 都以现有的药物为先导物进行研究。例如兰索拉唑及其它的拉唑的研究是 以奥美拉唑为先导物的,其活性比奥美拉唑活性更强。
I 期 II 期
III 期
政 府 审 批
新 药 证 书
平均约15年
IV 期
化学研究
药理筛选 急性毒性研究
深入药理研究 临床研究及 慢性毒性研究
新药研发涉及的学科
药物化学 天然药物化学 生化药学 药理学 毒理学 药剂学 制药工艺学 药物分析化学
新药研发特点
投资高:需要合成大量的化合物,耗用大量的
中药现代化的核心是创新和发展,其内容包括原药材的现代化、中药剂 型现代化、中药质量标准现代化、中药生物技术现代化、中医药理论现 代化和中医药信息现代化。
植物细胞大规模培养技术:中药材标准化生产!
道路是曲折的,前途是光明的! 路漫漫其修远兮,吾将上下而求索!
新药研发流程
新药发现前 研究
青霉菌
青霉素
从天然产物中发现-动物
从蛇毒得到的a-Bungrotoxin可与乙酰胆碱结合, 从Puffer鱼得到的Tetrodotoxin可阻断钠通道, 从蜂毒中得到的Apamis可阻断钙离子通道,而激活钾
离子通道。
水蛭
从天然产物中发现-海洋生物
还是一个待开拓的新的药物的研究资源
从天然产物中发现-植物
白藜芦醇
C6H5
Ph2
O
N H
Ph3
C6H5 O
2' 3' 1'
OH
AcO
18 11
12
O 13 15
14 1
HO
10 9 O19 OH
2
17
16
H
8 3
7
H
4
6 5
20
O
Ph1 C6H5
O AcO
O
Paclitaxel (Taxol)
从天然产物中发现-微生物
青霉素、链霉素、氯霉素、土霉素、红霉素等重要的 抗感染药物。
中医药有系统而又完整的理论,有浩瀚的文献,遣方用药有规 律可循。
传统中药有悠久的临床使用基础,5000年历史,疗效直接从人 体上取得
传统中药研究资源十分丰富 我国天然药物共有12807种之多。其中植物药为11146种 ,动 物药1581种,矿物药80种,有完整记载的处方10万余首,剂型 43种,中成药5000余种
2.2 以现有的药物为新药研究基础
优点:
成功率大。 改善药物的吸收,减少药物的毒副作用,减少耐受性,使
药物长效,速效,高效为研究目标。 天然药物的结构简化的代用品,还可以降低药物的成本。
近年来随着生理生化机制的了解,得到了一些疾病治疗的突破性的药
物,称原型药物(Prototype Drug)。随之出现了大量的“Me-too” 药物。“Me-too”药物特指具有自己知识产权的药物,其药效和同类的突
我国唯一一个在世界上获得认可的药物——青蒿素
黄花蒿
O O
O
O
O
青蒿素
疟疾
中药传统剂型: 汤、丸、散、膏、酒
缺点:
成分不清; 药效不明; 质量不可控; 剂型难以现代化。
日本和韩国的中药和天然植物药 销售量占全世界的前两位,原料 75%从我国购买,在国际市场上 覆盖率为80%。
中药作为天然药物的独特优势
化学药品 生物制品
药物的起源
古代药物:植物、动物、矿物→生药→汤剂、酒剂、 散剂、膏剂
→酊剂、醑剂、 浸膏
18世纪中期,开始用动物实验对药物进行毒性测试。 19世纪后期,化学工业发展,为新药研究奠定基础。 20世纪40-60年代是新药研究的黄金时代。
40年代:青霉素、链霉素、磺胺 50年代:利血平,奋乃静 60年代:维拉帕米、山莨菪碱、胺碘酮 60年代后期:β-受体阻滞剂 70年代以末:新药开发速度减慢
中药讲究炮制,讲究药物四性五味和归经。 中药多用复方,讲究君臣佐使。
中药现代化
定义:在中医药理论的指导下,以现代科学技术为手段,研究中药疗效的
物质基础,发现中药的有效成分,阐明中药的作用机制,并在中药有效成 分研究的基础上,制定出国际上认可的中药质量标准;同时,要加强中药 新剂型的研究,健全现代化的中药研发和生产管理体制,使之符合国际上 认可的GAP、GLP、GMP、GCP、GSP等管理规范。
新药研发相关知识介绍
主要内容
1. 新药研究开发的基本概念 2. 新药发现 3. 新药开发
1. 新药研究开发相关概念
药品:
指用于预防、治疗、诊断人的疾病,有目的地调节人的生理机 能,并规定有适应症、用法和用量的物质。
药物的基本属性:
安全性、有效性、稳定性、可控性
新药:
指(我国)未生产过的药品。已生产的药品改变剂型、改变给药 途径、增加新适应症或制成新的复方制剂,亦按新药管理。
实验动物,耗资巨大。
周期长:现一般认为得到一个新药需合成上万
个化合物,耗资数亿美元,时间10-12年。
风险高 利润高 竞争激烈
全球生物和医药业年产值2000亿美元,其中R&D费用在130 亿美元。
新药开发成功率约为1/10000。从研发到市场准入平均花 时4800个工作日,耗资3亿美元。
世界新药研发(上市)速度
60年代 70年代 80年代 90年代
844个 665个 518个 约400个
世界新药类别分布
抗感染药
20.78%
心血管药
18.83%
抗肿瘤药
13.96%
神经精神药
10.39%
世界十大制药公司排行榜
1. Pfizer(辉瑞)美国 2. Johnson&Johnson(强生)美国 3. sanofi-aventis(赛诺菲-安万特)德国,法国 4. Novartis(诺华)瑞士 5. GlaxoSmithKline(葛兰素史克)英国 6. Roche(罗氏)瑞士 7. MSD(默沙东/默克)美国 8. Astrazeneca(阿斯利康)瑞典,英国 9. Wyeth(惠氏)美国 10. Abbott(雅培)美国
2. 新药发现
从天然产物中发现—药物的提取分离—天然药物化学 从现有药物改进—药物合成—药物化学 药物筛选—药理学 根据生理病理机制设计—药理学 有些新药的发现是几个途径综合的结果
2.1 天然产物
天然产物来源
植物 动物 微生物 海洋生物 矿物
天然生物活性物质的特点
新颖的结构类型(分子多样性) 独特的药理活性 资源有限及地域性差异 有效成分含量很低 大多数结构复杂,作用强度不同
破性的药物相当。这种旨在避开“专利”药物的产权保护的新药研究,大 都以现有的药物为先导物进行研究。例如兰索拉唑及其它的拉唑的研究是 以奥美拉唑为先导物的,其活性比奥美拉唑活性更强。
I 期 II 期
III 期
政 府 审 批
新 药 证 书
平均约15年
IV 期
化学研究
药理筛选 急性毒性研究
深入药理研究 临床研究及 慢性毒性研究
新药研发涉及的学科
药物化学 天然药物化学 生化药学 药理学 毒理学 药剂学 制药工艺学 药物分析化学
新药研发特点
投资高:需要合成大量的化合物,耗用大量的
中药现代化的核心是创新和发展,其内容包括原药材的现代化、中药剂 型现代化、中药质量标准现代化、中药生物技术现代化、中医药理论现 代化和中医药信息现代化。
植物细胞大规模培养技术:中药材标准化生产!
道路是曲折的,前途是光明的! 路漫漫其修远兮,吾将上下而求索!
新药研发流程
新药发现前 研究
青霉菌
青霉素
从天然产物中发现-动物
从蛇毒得到的a-Bungrotoxin可与乙酰胆碱结合, 从Puffer鱼得到的Tetrodotoxin可阻断钠通道, 从蜂毒中得到的Apamis可阻断钙离子通道,而激活钾
离子通道。
水蛭
从天然产物中发现-海洋生物
还是一个待开拓的新的药物的研究资源
从天然产物中发现-植物
白藜芦醇
C6H5
Ph2
O
N H
Ph3
C6H5 O
2' 3' 1'
OH
AcO
18 11
12
O 13 15
14 1
HO
10 9 O19 OH
2
17
16
H
8 3
7
H
4
6 5
20
O
Ph1 C6H5
O AcO
O
Paclitaxel (Taxol)
从天然产物中发现-微生物
青霉素、链霉素、氯霉素、土霉素、红霉素等重要的 抗感染药物。
中医药有系统而又完整的理论,有浩瀚的文献,遣方用药有规 律可循。
传统中药有悠久的临床使用基础,5000年历史,疗效直接从人 体上取得
传统中药研究资源十分丰富 我国天然药物共有12807种之多。其中植物药为11146种 ,动 物药1581种,矿物药80种,有完整记载的处方10万余首,剂型 43种,中成药5000余种
2.2 以现有的药物为新药研究基础
优点:
成功率大。 改善药物的吸收,减少药物的毒副作用,减少耐受性,使
药物长效,速效,高效为研究目标。 天然药物的结构简化的代用品,还可以降低药物的成本。
近年来随着生理生化机制的了解,得到了一些疾病治疗的突破性的药
物,称原型药物(Prototype Drug)。随之出现了大量的“Me-too” 药物。“Me-too”药物特指具有自己知识产权的药物,其药效和同类的突
我国唯一一个在世界上获得认可的药物——青蒿素
黄花蒿
O O
O
O
O
青蒿素
疟疾
中药传统剂型: 汤、丸、散、膏、酒
缺点:
成分不清; 药效不明; 质量不可控; 剂型难以现代化。
日本和韩国的中药和天然植物药 销售量占全世界的前两位,原料 75%从我国购买,在国际市场上 覆盖率为80%。
中药作为天然药物的独特优势
