DNA琼脂糖凝胶电泳-染料分析
生物化学经典实验DNA琼脂糖凝胶电泳的原理、步骤、试剂配制、结果分析分析

凝胶冷却至50°C,加EB至终浓度0.5μg/ml
铺
胶
凝胶凝固后取出梳子
加电泳缓冲液
准备样品
点
样
电
泳
注意观察溴酚蓝染液的迁移
紫外灯下观察电泳结果
照
相
DNA琼脂糖凝胶电泳
实验原理
琼脂糖为链状多糖 →绳状琼脂糖束→大网孔型凝
胶 ——分离、鉴定、纯化DNA
在 pH 值为 8.0~8.3 时,核酸分子碱基几乎不解
离,磷酸全部解离,核酸分子带负电,在电泳时 向正极移动。
采用适当浓度的凝胶介质作为电泳支持物,在分
子筛的作用下,使分子大小和构象不同的核酸分
子泳动率出现较大的差异,从而达到分离核酸片 段检测其大小的目的。
实验原理
当用低浓度的荧光嵌入染料溴化乙啶(Ethidium
bromide, EB)染色, 在紫外光下至少可以检出110ng的DNA条带, 从而可以确定DNA片段在凝胶 中的位置。
此外, 还可以从电泳后的凝胶中回收特定的DNA
条带, 用于以后的克隆操作。
状DNA>开环DNA
DNA片段越长,泳动速度越慢
在低电压时,泳动速度与电场强度成正比
不同浓度琼脂糖分离DNA分子的范围
琼脂糖浓度(W/V,%) 分离范围(kb)
0.3
0.6 0.7 0.9 1.2
5-60
1-20 0.8-10 0.5-7 0.4-6
1.5
2.0
0.2-4
0.1-3
DNA电泳迁移率的对数与凝胶浓度成线性关系。
胶浓(%) 0.6 溴酚蓝 b 0.15kb
2kb
1.6kb
操作步骤
琼脂糖凝胶的制备:溶化,冷却,EB 凝胶板的制备:加梳子,倒胶 样品的制备:样品+1/5体积溴酚蓝
实验技术 DNA的琼脂糖凝胶电泳鉴定(修改后)SDS-PAGE

0.3 0.5 0.6 0.7 1.0 1.2 1.5 2.0
5-60 1-30 1-20 0.8-12 0.5-10 0.4-6 0.2-4 0.1-3
操作步骤
♦琼脂糖凝胶的制备:溶化,冷却,核酸染料 琼脂糖凝胶的制备:溶化,冷却, ♦凝胶板的制备:加梳子,倒胶 凝胶板的制备:加梳子, ♦样品的制备:样品 样品的制备:样品+1/5体积溴酚蓝 体积溴酚蓝 ♦加样:加样端为负极(黑) 加样:加样端为负极( ♦电泳:5V/cm 电泳: ♦观察:紫外灯下观察,照相 观察:紫外灯下观察,
DNA分子在琼脂糖凝胶中泳动时,有电 分子在琼脂糖凝胶中泳动时, 分子在琼脂糖凝胶中泳动时 荷效应与分子筛效应。不同的 荷效应与分子筛效应。不同的DNA,分 , 子量大小及构型不同, 子量大小及构型不同,电泳时的泳动率 就不同, 就不同,从而分出不同的区带 琼脂糖凝胶电泳法分离DNA,是利用分 , 琼脂糖凝胶电泳法分离 子筛效应, 子筛效应,迁移速度与分子量的对数值 成反比关系
开环 线性 超螺旋
质粒DNA的3种形式泳动速度 超螺旋 线性 开环 的 种形式泳动速度 超螺旋>线性 种形式泳动速度:超螺旋 线性>开环 质粒
分离不同大小DNA 分离不同大小DNA片段的 DNA片段的 合适琼脂糖凝胶浓度
琼脂糖含( ) 琼脂糖含(%) DNA片段的有效分离范围 片段的有效分离范围(kb) 片段的有效分离范围
主要实验器材
电泳仪
缓冲液 琼脂糖
凝胶槽
梳子 电泳槽
取液器 溴酚蓝
铺
胶
凝胶凝固后取出梳子
加缓冲液
准备样品
点
样
电
泳
注意观察溴酚蓝染液的迁移
紫外灯下观察电泳结果
dna琼脂糖凝胶电泳实验报告

dna琼脂糖凝胶电泳实验报告DNA琼脂糖凝胶电泳实验报告引言:DNA琼脂糖凝胶电泳是一种常用的分子生物学实验技术,用于分离和分析DNA 分子。
本实验旨在通过琼脂糖凝胶电泳技术,对DNA分子进行分离和鉴定,以便更好地了解DNA的结构和功能。
实验材料和方法:实验所需的材料包括琼脂糖凝胶、DNA标准品、DNA样品、缓冲液和电泳仪等。
首先,我们制备了琼脂糖凝胶,然后将DNA标准品和待测DNA样品与DNA加载缓冲液混合。
接下来,将混合液注入琼脂糖凝胶槽中,并进行电泳。
实验结果:经过电泳后,我们观察到琼脂糖凝胶上出现了一系列DNA条带。
根据标准品的条带迁移距离,我们可以推断出待测DNA样品的分子大小。
通过比较待测样品与标准品的条带迁移距离,我们可以进一步确定待测样品中的DNA分子的大小。
讨论:琼脂糖凝胶电泳是一种基于DNA分子大小的分离技术。
在琼脂糖凝胶中,DNA 分子会受到凝胶孔隙的阻碍,较大的DNA分子迁移速度较慢,而较小的DNA分子则迁移速度较快。
通过测量DNA分子的迁移距离,我们可以推断出其分子大小。
在实验中,我们使用了DNA标准品作为参照物,通过标准品的迁移距离,我们可以建立一个标准曲线,从而对待测样品中的DNA分子大小进行估计。
这种方法可以应用于DNA样品的定性和定量分析。
需要注意的是,琼脂糖凝胶电泳实验的结果受到多种因素的影响,如琼脂糖凝胶浓度、电场强度和电泳时间等。
因此,在进行实验时,我们需要控制这些因素,以确保实验结果的准确性和可靠性。
结论:通过DNA琼脂糖凝胶电泳实验,我们成功地分离和鉴定了DNA分子。
这项实验为我们进一步研究DNA的结构和功能提供了基础。
同时,琼脂糖凝胶电泳技术也广泛应用于生物医学研究、法医学和遗传学等领域,为科学研究和医学诊断提供了重要的工具和方法。
总结:DNA琼脂糖凝胶电泳是一种常用的DNA分离和鉴定技术。
通过电泳实验,我们可以分离不同大小的DNA分子,并通过测量其迁移距离来推断其分子大小。
琼脂糖凝胶电泳实验原理和实验方法

琼脂糖凝胶电泳实验原理和实验方法琼脂糖凝胶电泳实验原理和实验方法[实验原理]电泳是现在用于分离和纯化DNA片段的最常用技术。
包含电解质的多孔支持介质----“胶”并把它置于静电场中。
则DNA分子将向阳极移动,这是因为DNA分子沿其双螺旋骨架两侧带有含负电荷的磷酸根残基。
当DNA长度增加时,来自电场的驱动力和来自凝胶的阻力之间的比率就会降低,不同长度的DNA片段就会表现出不同的迁移率。
因而就可依据DNA分子的大小来使其分离。
该过程通过把示踪染料(Purple Loading Dye)或分子量标准参照物(Ladder)和样品(DNA&RNA)一起进行电泳而得到检测。
分子量标准参照物也可以提供一个用于确定DNA片段大小的标准。
琼脂糖凝胶适用于分离大小在0.2-50Kb范围内的DNA片段。
[实验用品]1.琼脂糖 1.0%1.0g琼脂糖+100ml电泳缓冲液(TAE),微波炉中火30秒至沸腾,熔化的琼脂物冷却至60℃时可加入10mg/ml溴化乙锭10μl,充分混匀,将温热的凝胶倒入已置好梳子(鉴定胶用细密点的梳子;回收胶用粗稀的梳子)的胶膜中在室温下放置30-45min后现进行电泳。
1.5%:琼脂糖1.5g。
2.电泳缓冲液50×TAE Tris 乙酸 Tris 242g 终2 mol/L乙酸57.1ml 终1mol/L0.5M EDTA200ml pH8.0 终100mmol/LdH2O 补足至1000ml使用时稀释1×TAE。
5×TBE Tris 硼酸 Tris 54g 终445mmol/L硼酸27.5g 终445mmol/L0.5M EDTA20ml pH8.0 终10mmol/LdH2O 补足至1000ml使用时稀释10倍成0.5倍如50ml贮存液+450ml水→500ml工作液。
[实验内容与方法]1.移取适量的琼脂糖(如制备1%的琼脂糖胶液就移1g的琼脂糖溶于100ml TAE缓冲液中)微波炉加热使其溶于TAE缓冲液中。
DNA琼脂糖凝胶电泳原理
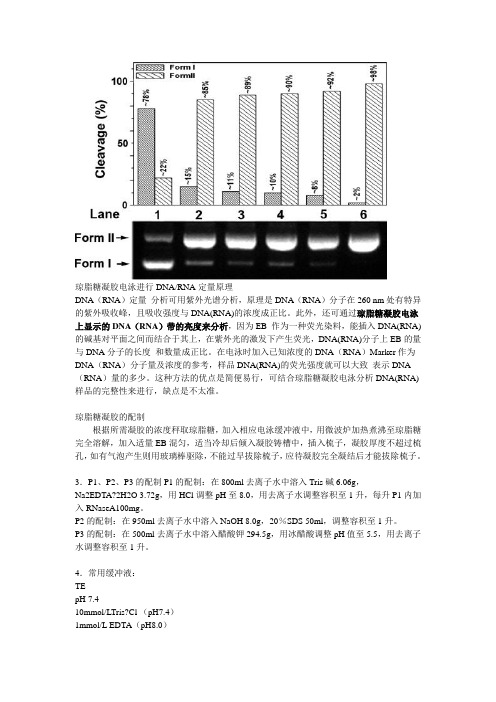
琼脂糖凝胶电泳进行DNA/RNA定量原理DNA(RNA)定量分析可用紫外光谱分析,原理是DNA(RNA)分子在260 nm处有特异的紫外吸收峰,且吸收强度与DNA(RNA)的浓度成正比。
此外,还可通过琼脂糖凝胶电泳上显示的DNA(RNA)带的亮度来分析,因为EB 作为一种荧光染料,能插入DNA(RNA)的碱基对平面之间而结合于其上,在紫外光的激发下产生荧光,DNA(RNA)分子上EB的量与DNA分子的长度和数量成正比。
在电泳时加入已知浓度的DNA(RNA)Marker作为DNA(RNA)分子量及浓度的参考,样品DNA(RNA)的荧光强度就可以大致表示DNA (RNA)量的多少。
这种方法的优点是简便易行,可结合琼脂糖凝胶电泳分析DNA(RNA)样品的完整性来进行,缺点是不太准。
琼脂糖凝胶的配制根据所需凝胶的浓度秤取琼脂糖,加入相应电泳缓冲液中,用微波炉加热煮沸至琼脂糖完全溶解,加入适量 EB 混匀,适当冷却后倾入凝胶铸槽中,插入梳子,凝胶厚度不超过梳孔,如有气泡产生则用玻璃棒驱除,不能过早拔除梳子,应待凝胶完全凝结后才能拔除梳子。
3.P1、P2、P3的配制P1 的配制:在 800ml 去离子水中溶入 Tris 碱 6.06g,Na2EDTA?2H2O 3.72g,用 HCl 调整 pH 至 8.0,用去离子水调整容积至1升,每升P1内加入RNaseA100mg。
P2 的配制:在 950ml 去离子水中溶入 NaOH 8.0g,20%SDS 50ml,调整容积至 1 升。
P3 的配制:在 500ml 去离子水中溶入醋酸钾 294.5g,用冰醋酸调整 pH 值至 5.5,用去离子水调整容积至1升。
4.常用缓冲液:TEpH 7.410mmol/LTris?Cl (pH7.4)1mmol/L EDTA(pH8.0)pH 7.610mmol/LTris?Cl (pH7.6)1mmol/L EDTA(pH8.0)pH 8.010mmol/LTris?Cl (pH8.0)1mmol/L EDTA(pH8.0)STE(亦称 TEN)0.1mmol/L NaCl10mmol/LTris?Cl (pH8.0)1mmol/L EDTA(pH8.0)STET0.1mmol/L NaCl10mmol/LTris?Cl (pH8.0)1mmol/L EDTA(pH8.0)5%Triton X-100TNT10mmol/LTris?Cl (pH8.0)150mmol/L NaCl0.05% Tween 20电泳缓冲液Tris-乙酸(TAE):50×浓贮存液(每升):242g Tris 碱5 7.1ml 冰乙酸100ml 0.5mmol/L EDTA(pH8.0)使用时再稀释50倍。
pcr扩增产物的电泳分析

pcr扩增产物的电泳分析PCR扩增是一种基本技术,它可以在短时间内制备大量DNA片段。
通过PCR扩增,可以在多样本(包括细胞、组织、体液等)中迅速检测到特定的基因或其他分子。
PCR扩增还可以用于DNA测序、基因工程研究等领域。
但是PCR扩增产物的电泳分析更是重要的检测手段之一。
PCR扩增产物的电泳分析有两种常用的方法:琼脂糖凝胶电泳和聚丙烯酰胺凝胶电泳。
琼脂糖凝胶电泳分析常用来检测较短的DNA片段(200-800bp),而聚丙烯酰胺凝胶电泳则用于检测长的DNA片段(500bp以上)。
琼脂糖凝胶电泳需要制备一定浓度的琼脂糖凝胶,通常是1%的琼脂糖缓冲液。
将PCR扩增产物混合掉在凝胶上的样品孔中,通电引导电离之后,DNA分子按大小迁移至凝胶较低位置。
然后,将凝胶浸泡在DNA荧光染料中,使DNA片段变得可见。
通过比较待测样品和一系列不同大小的DNA片段标准的迁移距离,我们可以确定PCR扩增产物的大小和数量。
聚丙烯酰胺凝胶电泳是电泳分析PCR扩增产物的另一种方法。
与琼脂糖凝胶电泳不同,聚丙烯酰胺凝胶是一种合成的聚合物,其孔隙大小可以根据所需精度而调节。
它还具有耐久性,重复使用方便。
使用聚丙烯酰胺凝胶电泳,样品的迁移距离与琼脂糖凝胶电泳相同,通过荧光染料检测到PCR扩增产物。
无论采用哪种方法,PCR扩增产物的电泳分析都需要严格控制实验条件,并采用多个标准参照来验证结果的可靠性。
另外,一些常见问题也需要被考虑和解决,例如对碱基偏差,电泳实验的鲁棒性等。
总体来说,PCR扩增产物的电泳分析提供了一种简单且准确的定量PCR扩增产物的手段,广泛应用于分子生物学、医学以及生物技术工业。
DNA琼脂糖凝胶电泳分析报告

DNA琼脂糖凝胶电泳分析报告
DNA 凝胶电泳是用于分析检测 DNA 分子大小的生物化学分析方法,它可以用来比较
和筛选 DNA 样品。
它是一种分子遗传学研究的非常有用的技术,它可以检测到变异位点,以及不同样品之间 DNA 分子大小分布的差异。
DNA 凝胶电泳使用凝胶分离 DNA 胺基酸、核苷酸和外源 DNA 等其他分子,它可以在
短时间内产生准确的结果,是一种常用的实验方法。
由于 DNA 的电荷特性,当 DNA 从静
电场中移动时,它将分离成带电和不带电的不同分子,这就是用凝胶进行 DNA 分离的原理。
DNA 凝胶糖凝胶电泳通常使用琼脂糖凝胶来分离特定的 DNA 分子。
琼脂糖凝胶是一
种温和的添加剂,它可以减小电泳淤积,使 DNA 分子从膜上被吸附,从而更快地被分离
出来。
此外,琼脂糖凝胶还能够稳定化学反应,使 DNA 分子得到更好的保护,减少 DNA
的降解反应。
DNA 凝胶糖凝胶电泳在分子生物学实验中被广泛使用,以表达 DNA 片段大小,比较
和检测 DNA 样品之间的差异,提取和测量 DNA 片段,识别多态性,以及复制和定位 DNA 片段等。
DNA 凝胶糖凝胶电泳的数据显示,DNA 分子的大小可以用来确定正确的 DNA 分
子类型和多态性,并且能够说明各样品之间 DNA 分子的差异情况,因此有助于医学研究
等多种领域的发展。
琼脂糖凝胶电泳检测dna实验报告

琼脂糖凝胶电泳检测dna实验报告琼脂糖凝胶电泳检测DNA实验报告引言:DNA是生物体中的重要遗传物质,通过检测和分析DNA可以揭示生物体的遗传信息。
琼脂糖凝胶电泳是一种常用的DNA分析方法,本实验旨在通过琼脂糖凝胶电泳技术检测DNA样品的大小和纯度。
实验材料与方法:1. 实验材料:- DNA样品- DNA标准品- TBE缓冲液- 碱基对应的引物- DNA扩增反应体系- 琼脂糖凝胶- DNA电泳仪2. 实验方法:1) 准备琼脂糖凝胶:a. 取适量琼脂糖粉末加入TBE缓冲液中,搅拌均匀。
b. 将混合液加热至溶解,然后冷却至室温。
c. 将琼脂糖凝胶液倒入电泳槽中,插入梳子,待凝固。
2) 准备DNA样品:a. 取DNA样品,加入适量的DNA扩增反应体系。
b. 在PCR仪中进行DNA扩增反应,得到待检测的DNA样品。
3) 进行电泳检测:a. 取一定量的DNA样品和DNA标准品,加入电泳槽中的样品槽。
b. 打开电泳仪,设定适当的电压和时间。
c. 开始电泳,观察DNA在琼脂糖凝胶中的迁移情况。
结果与讨论:通过琼脂糖凝胶电泳检测,我们可以观察到DNA样品在电场作用下在琼脂糖凝胶中的迁移情况。
根据DNA片段的大小,我们可以通过比较DNA样品与DNA标准品的迁移距离,确定DNA样品的大小。
在实验中,我们发现不同大小的DNA片段会以不同的速度迁移,较小的DNA片段迁移速度较快,较大的DNA片段迁移速度较慢。
这是因为琼脂糖凝胶的孔径大小会影响DNA片段的迁移速度,较小的孔径会使DNA片段迁移速度变慢。
此外,我们还可以通过观察琼脂糖凝胶中DNA样品的带状图案来评估DNA样品的纯度。
如果带状图案清晰且无杂带,说明DNA样品较纯;而如果带状图案模糊或有多个杂带,说明DNA样品可能存在杂质或降解。
总结:琼脂糖凝胶电泳是一种常用的DNA分析技术,通过观察DNA片段在琼脂糖凝胶中的迁移情况,我们可以确定DNA样品的大小和纯度。
这种技术在生物学研究和医学诊断中具有重要意义,可以帮助科学家们更好地理解生物体的遗传信息。
琼脂糖凝胶电泳中染料的使用

现在一种染料叫做GoldView可以代替EB,这种染料的毒性比EB低毒了很多,而且是琼脂糖加热,温度降低后再加的,染色效果还不错,而且比较方便,跑完胶就可以直接在紫外下看!但是跟EB 还有一定的差距(同样的体系亮度没有EB亮)。
我们一般采用GoldView做一般性的实验,要发文章的图再拿去用EB染,这样会比较好一点。
以下是一点个人心得:goldview对RNA没有任何的显色能力!!!。
实际上这是很大的问题。
鉴于EB的强致癌作用,很多明智的老板在选用goldview的时候基本上就废止了EB的生存空间。
但对于RNA试验来说,这无疑是致命的。
第一次提RNA的时候就用goldview跑,结果什么都没有,气了好几天,结果今下午终于知道原因了,不知咱RNA提的不好,是染料的原因啊!各位提RNA的同学一定要小心这个东西啊!——RNA杀手!!!原则上讲,为健康着想,goldview还是值得肯定的实验室使用新的核酸染料-goldview,取代原先用的溴化乙锭-EB.goldview现在是由赛百盛出售.以下摘自官方网站:GoldViewTM 核酸染料——使用说明概述GoldViewTM是一种可代替溴化乙锭(EB)的新型核酸染料,采用琼脂糖电泳检测DNA时,GoldViewTM与核酸结合后能产生很强的荧光信号,其灵敏度与EB相当,使用方法与之完全相同。
在紫外透射光下双链DNA呈现绿色荧光,而单链DNA呈红色荧光。
GoldView不仅能染DNA,也可用于染RNA。
通过Ames试验、小鼠骨髓嗜多染红细胞微核试验、小鼠睾丸精母细胞染色体畸变试验,致突变性结果均为阴性;而溴化乙锭(EB)是一种强致癌剂。
因此用GoldviewTM代替EB不失为一种明智的选择。
使用方法1. 将100ml琼脂糖凝胶溶液(浓度一般为0.8%~2%)在微波炉中融化。
2. 加入5µl GoldView,轻轻摇匀,避免产生气泡。
3. 冷却至不烫手时倒胶,待琼脂糖凝胶完全凝固后上样电泳。
DNA琼脂糖凝胶电泳实验原理和方法步骤

DNA琼脂糖凝胶电泳实验原理和方法步骤实验原理:DNA是带有负电荷的分子,当在电场力作用下,可以根据分子的大小和形状移动到琼脂糖凝胶上。
琼脂糖凝胶的作用是形成一个微孔状的网状结构,可以筛选DNA根据大小进行分离。
较小的DNA片段能够通过网状结构移动较快,而较大的DNA片段则移动较慢。
通过观察DNA在凝胶上的迁移距离和与各种标准DNA片段的比较,可以确定样品中DNA片段的大小。
方法步骤:准备工作:1.准备琼脂糖凝胶:按照产品说明书或实验方案将琼脂糖溶解在适量的缓冲液中,同时加热至完全溶解。
2.准备电泳槽:将琼脂糖凝胶倒入电泳槽中并插入电极,确保凝胶充分固化并全部覆盖缓冲液。
样品处理:1.提取DNA样品:根据实验需求,从细胞或组织中提取DNA。
2.消化DNA:将DNA溶液加入适量的限制性内切酶反应缓冲液,并在适当的温度下孵育一段时间,以消化DNA并产生DNA片段。
3.加入标记:对DNA样品进行标记,如使用荧光染料或放射性同位素。
4.加入加载缓冲液:将DNA样品与适量的加载缓冲液混合,以便在电泳过程中均匀加载样品。
电泳:1.装载样品:将标记好的DNA样品加载到琼脂糖凝胶的孔上。
可以使用微量吸管或特殊的装载器具,确保每个孔中加载相同数量的DNA。
2.加载DNA标准:在其中一个孔中加载大小已知的DNA标准,以用于分析和确定样品中的DNA片段大小。
3.电泳运行:将电泳槽连接到电源,并设定合适数值的电流和电压。
运行电泳直到DNA杂质和标准DNA片段迁移到适当位置(通常为30分钟至数小时)。
染色和可视化:1.染色:将琼脂糖凝胶浸入DNA染色剂溶液中,以便可视化DNA片段。
2.可视化和记录:使用紫外光或其他适当的光源照射琼脂糖凝胶,观察DNA片段的迁移情况,并使用相机、成像系统或适当的分析软件记录和分析结果。
解释结果:通过比较标准DNA片段的迁移速度和位置,可以判断样品中DNA片段的大小。
较小的DNA片段会迁移至凝胶上更远的位置,而较大的DNA片段则更接近插孔。
琼脂糖凝胶电泳检测DNA

琼脂糖凝胶电泳检测DNA(agarose gel electrophoresis)目的和要求学习和掌握琼脂糖凝胶电泳的原理和基本操作实验原理1. 琼脂糖凝胶电泳是最常用的鉴定DNA的方法,基本原理与蛋白质电泳相似:简便易行,只需少量DNA2. 琼脂糖是一种天然聚合长链状分子,可形成具有刚性的滤孔,凝胶孔径的大小决定于琼脂糖的浓度3. DNA分子在琼脂糖凝胶中泳动时具有电荷效应与分子筛效应,迁移速率与其相对分子质量的对数反相关4. 琼脂糖凝胶中的DNA可利用荧光染料GoodView染色并在在紫外灯照射下观察主要试剂和器材一、试剂50ⅹTAE缓冲液(pH8);凝胶上样缓冲液(0.2%溴酚蓝,50%蔗糖)GoodView (溴化乙锭EB替代物);琼脂糖二、器材电泳仪、水平电泳槽、紫外检测仪基本操作方法1. 琼脂糖凝胶制备:称取0.45g琼脂糖,放入锥形瓶中,加入30ml TAE缓冲液,保鲜膜封口,置微波炉加热至完全澄清透明取出摇匀(琼脂糖浓度为1.5%);待凝胶溶液冷却至50℃(不烫手),加入3ml GoodView (终浓度0.5 g/ml) 2. 凝胶板制备:用制胶器将紫外透光凝胶盘固定好,采用水平仪调整平衡使凝胶盘位于同一水平面;将适宜的梳子垂直架在凝胶盘内槽的一端;将冷却至50℃的琼脂糖凝胶缓缓倒入凝胶盘内槽,厚度适宜(不要有气泡)3. 点样:待凝胶凝固后,小心取出梳齿,将凝胶盘放入电泳槽內,加入足够的TAE 电泳缓冲液,使液面略高出凝胶面;取5微升PCR扩增产物,向其中加入1微升的上样缓冲液,混匀后用移液器将其加入加样孔,记录样品点样次序与点样量4. 电泳:接通电泳槽与电泳仪的电源,调节电压90V,当溴酚蓝染料移动到距凝胶前沿1-2cm处,停止电泳5. 观察:在紫外灯下观察凝胶,有DNA处应显出荧光条带,记录电泳结果注意事项:1. 倒胶时把握好胶的温度,不要高于60℃,否则温度太高会使凝胶盘变形2. 胶一定要凝固好才能拔梳子,方向一定要竖直向上,不要弄坏点样孔3. 点样时枪头下伸,点样孔内不能有气泡思考题DNA在电场中的迁移率取决于哪些因素?。
分子生物学:DNA RNA的琼脂糖凝胶电泳检测

增加,不同长度的DNA/RNA片段就会出现不同的迁
移率。因而就可依据DNA/RNA分子的大小使其分离。
琼脂糖凝胶电泳 凝胶电泳 聚丙烯酰胺凝胶电泳
分离长度 200bp—近50kb
5—500bp 分辨率高
采用不同浓度的凝胶可以分辨范围广泛的DNA分子。
实验原理
含不同量琼脂糖的凝胶的分离范围
凝胶中的琼脂糖含量 [%(W/V)] 0.3 0.6 0.7 0.9 1.2 1.5 2
实验原理
缓冲液
常用的电泳缓冲液的配制
使用液
浓贮存液(每升)
Tris—乙酸 (TAE)
1×:0.04moL/L Tris—乙酸 0.001moL/L EDTA
50×:242g Tris碱 57.7mL 冰乙酸
100mL 0.5moL/L EDTA (PH8.0)
Tris—磷酸 1×:0.09moL/L Tris—磷酸
实验步骤
➢ 胶凝固后,取出梳子,取下橡皮膏,放在电泳槽 内。加入电泳缓冲液至电泳槽中,让缓冲液盖过 凝胶。
➢ 加样:用移液枪将上样缓冲液与DNA样品按1:5 比例混合,加入加样孔中(记录点样顺序及点样 量)。每次上样量约10μl。
实验步骤
➢ 电泳 ①接通电泳槽与电泳仪的电源(注意正负极, DNA片段从负极向正极移动)。DNA的迁移速度与电 压成正比,最高电压不超过5V/cm。②当溴酚蓝染料移 动到距凝胶前沿1~2cm处,停止电泳。 ③将染色后的 凝胶放入凝胶成像仪中拍照。
DNA/RNA的琼脂糖凝胶电泳检测
王欢欢 二零一二.九
实验目的
1、学习和掌握琼脂糖凝胶电泳检测DNA的 实验技术和原理。 2、了解大分子染料染色检测核酸的实验技术。
简答琼脂糖凝胶电泳检测核酸dna的原理及加入核酸染料的作用。

简答琼脂糖凝胶电泳检测核酸dna的原理及加入核
酸染料的作用。
琼脂糖凝胶电泳是一种常用的分离和检测生物大分子的方法,其原理是基于核酸分子在电场力的作用下移动速率的差异实现分离。
其具体步骤包括:将DNA样本混合导入琼脂糖凝胶孔中,然后在电场下进行电泳。
当DNA分子通过胶状基质(琼脂糖)时,分子将被分离成大小不同的带,带的大小反映了各种分子的大小和电荷。
加入核酸染料的作用是帮助观察和识别核酸带。
例如,常用的核酸染料乙溴铵(EtBr)可以与DNA结合并发出荧光信号,从而使分离的DNA带变得更清晰,帮助识别DNA大小和量的区别。
此外,核酸染料还可以通过荧光探测器快速和准确的检测到目标分子,提高检测的灵敏度和可靠性。
琼脂糖凝胶电泳检测dna实验报告

琼脂糖凝胶电泳检测dna实验报告琼脂糖凝胶电泳是一种常用的分离和检测DNA的方法,通过琼脂糖凝胶电泳可以对DNA进行分离和鉴定,广泛应用于分子生物学和遗传学领域。
本实验旨在通过琼脂糖凝胶电泳检测DNA,以便对DNA进行分析和鉴定。
实验材料和方法:1. 实验材料,琼脂糖凝胶、DNA样品、电泳缓冲液、DNA分子量标准品、电泳仪等。
2. 实验方法:a. 制备琼脂糖凝胶,按照说明书将琼脂糖加入电泳缓冲液中,加热至完全溶解后倒入凝胶板中,待凝固后形成琼脂糖凝胶。
b. 加载DNA样品,将待检测的DNA样品与DNA分子量标准品混合后加入琼脂糖凝胶槽中。
c. 进行电泳,将装有琼脂糖凝胶的电泳槽连接至电泳仪,设定合适的电压和时间进行电泳。
d. 染色和观察,电泳结束后,取出琼脂糖凝胶进行染色,并在紫外透射仪下观察DNA条带的分离情况。
实验结果:经过琼脂糖凝胶电泳检测,我们观察到了DNA在琼脂糖凝胶上的分离情况。
通过比对DNA分子量标准品的条带位置,我们可以初步确定待检测DNA的分子量。
同时,根据DNA条带的数量和位置,我们还可以初步判断待检测DNA的纯度和完整性。
实验讨论:琼脂糖凝胶电泳是一种简单而有效的DNA检测方法,通过该方法可以对DNA进行分离和鉴定。
然而,在实际操作中,我们也需要注意一些问题,比如加载样品时要均匀、染色后要及时观察等。
另外,电泳条件的选择也会对实验结果产生影响,需要根据实际情况进行调整。
结论:通过本次实验,我们成功地利用琼脂糖凝胶电泳对DNA进行了检测,初步确定了待检测DNA的分子量、纯度和完整性。
这为我们进一步的DNA分析和研究奠定了基础。
总结:琼脂糖凝胶电泳是一种常用的DNA检测方法,通过该方法可以对DNA进行分离和鉴定。
在实际操作中,我们需要严格控制实验条件,以确保实验结果的准确性和可靠性。
希望本次实验结果能对相关研究工作提供一定的参考和帮助。
DNA的琼脂糖凝胶电泳分析

注意事项
❖ 1、倒胶时把握好胶的温度,不要高于60℃, 否则温度太高会使制胶板变形。
❖ 2、胶一定要凝固好才能拔梳子,方向一定 要垂直向上,不要弄坏点样孔。
❖ 3、点样时枪头下伸,点样孔内不能有气泡, 不要刺穿点样孔。
实验器材与试剂
❖ (一)器材 : 电泳槽 电泳仪 微波炉
❖ (二)试剂
❖ 1、 6×上样缓冲液:0.25%溴酚蓝;0.25% 二甲苯青;30%甘油水溶液。( 由甘油、溴 酚蓝指示剂以及DNA稳定剂按一定比例混合 而成,经去核酸酶处理,适用于DNA样品的 电泳检测,在自然光线下呈现暗红色,与核 酸样品混合后,受样品pH值的影响,通常变 为蓝紫色。其中的溴酚蓝在不同浓度琼脂糖 凝胶和不同电泳缓冲液中的迁移率不同 ,其 迁移位置可作为DNA条带电泳位置的参照 物。)
❖ 2、 50×TAE电泳缓冲液:称取242gTris碱 (即三羟甲基氨基甲烷, Tris为弱碱,在室 温(25℃)下,它的pKa为8.1;根据缓冲理 论,Tris缓冲液的有效缓冲范围在pH7.0到 9.2之间。Tris碱的水溶液pH在10.5左右,一 般加入盐酸以调节pH值至所需值,即可获得 该pH值的缓冲液。但同时应注意温度对于 Tris的pKa的影响 ), ,加H2O800ml,待 完全溶解后,加57.1ml冰乙酸, 100ml0.5mol/LEDAT(pH8.0),用H2O定 容至1000ml。临用前用H2O稀释成1×TAE 电泳缓冲液。
❖ 4、配胶和灌电泳槽需使用同一批缓冲液。 因为pH 或离子强度很小的差别也会在凝胶 前部造成紊乱,影响DNA 片段的泳动。
❖ 5、溴化乙锭见光易分解,应储存在棕色瓶中于 4℃条件下保存。溴化乙锭在紫外灯下放置时间 过长,荧光会猝灭。
琼脂糖凝胶电泳鉴定DNA

琼脂糖凝胶电泳鉴定DNADNA通过实验掌握琼脂糖凝胶电泳鉴定DNA的原理与方法。
琼脂糖是从海藻中提取出来的一种杂聚多糖,是由D型和L型半乳糖以α-1,3和β-1,4糖苷键相连形成的线状高聚物(如下图所示)。
琼脂糖遇冷水膨胀,溶于热水成溶胶,冷却后成为孔径范围从50nm到大于200nm的凝胶。
琼脂糖凝胶电泳是分离、鉴定和纯化DNA片段最为常用的方法之一,这种方法简便易行。
而且琼脂糖可以灌制成各种形状、大小和孔径,在不同的装置中进行电泳,如果有必要,还能够从凝胶中回收DNA谱带。
琼脂糖凝胶的分离范围较广,选择不同凝胶浓度和装置,从50个碱基对到几兆不同长度的DNA都可以实现分离。
使用电场强度和电泳方向恒定的水平板琼脂糖凝胶电泳的方法,可以很好的分离长度在50-20,000 bp 的DNA片段。
DNA在琼脂糖凝胶中的迁移率受多种因素影响。
例如DNA分子的大小;琼脂糖的浓度;所加电压等等。
DNA片段越长,泳动速度越慢,而且泳动速度与电场强度成正比。
一个给定大小的线性DNA片段,在不同浓度的琼脂糖凝胶中迁移率不同,DNA电泳迁移率的对数与凝胶浓度成线性关系。
用低浓度的荧光染料如溴化乙啶染色后,凝胶中的DNA可以直接被检测出来。
紫外灯下可以直接检测到20pg的双链DNA。
1.水平板电泳槽;灌胶模具及梳齿;电泳仪;55?水浴;沸水浴;微量移液器(1)DNA样品;DNA标准分子量标记物;琼脂糖;1x电泳缓冲液TBE;6x样品缓冲液(2)溴化乙锭:水中加入溴化乙啶,搅拌数小时至溶解。
将配好的10 mg/ml 溴化乙啶溶液装在棕色瓶中,室温保存,使用时稀释至0.5μg/ml。
缓冲溶液配制表缓冲溶液工作溶液储存溶液(每升) TBE 0.5x 5x0.045mol/L Tris-硼酸 54 g Tris 碱0.001mol/L EDTA 27.5g 硼酸20ml 0.5mol/L EDTA (pH8.0)0.2% 溴酚蓝储存温度4? 6x样品缓冲液50% (w/v) 蔗糖水液1. 照厂家说明准备好灌胶模具,置于水平面上(实验操作示意图如下)。
DNA琼脂糖凝胶电泳分析

• 13、无论才能知识多么卓著,如果缺乏热情,则无异 纸上画饼充饥,无补于事。Sunday, December 13, 20201
3-Dec-2020.12.13
• 14、我只是自己不放过自己而已,现在我不会再逼自 己眷恋了。20.12.1303:55:0413 December 202003:55
• 样品: DNA分子量标准品,质粒 • 试剂
– 琼脂糖 – 1×电泳缓冲液(TBE) – 6×上样缓冲液 – 溴化乙锭(EB) :10mg/ml
上样缓冲液
• 0.25%溴酚兰;0.25%二甲苯青;30%甘 油水溶液
• 作用: – ①增加样品密度,使其比重增加,以 确保DNA均匀沉入加样孔内 – ②在电泳中形成肉眼可见的指 示带,可预测核酸电泳的速度和位置 – ③使样品呈色,使加样操作更方便
3 、点样时枪头下伸,点样孔内不能有气泡,不 要刺穿凝胶;
4、EB有毒,切勿用手接触,更不要污染环境, 胶勿乱扔;
5 、紫外线照射不要太久。
•
1、有时候读书是一种巧妙地避开思考 的方法 。20.1 2.1320. 12.13Sunday, December 13, 2020
•
2、阅读一切好书如同和过去最杰出的 人谈话 。03:5 5:0403: 55:0403 :5512/ 13/2020 3:55:04 AM
– 银染色
影响琼脂糖凝胶电泳的因素
• DNA分子的大小:实验证明, DNA片段迁移距离与其分子量 的对数成反比;
• 琼脂糖的浓度:一定大小的 DNA片段在不同浓度的琼脂凝 胶中,电泳迁移率不相同;
• DNA分子的构型:不同构型的 DNA在琼脂糖凝胶中的电泳速 度差别较大
琼脂糖凝胶的优点
DNA琼脂糖凝胶电泳(agarose gel electrophoresis)分析

DNA琼脂糖凝胶电泳(agarose gel electrophoresis)分析一、原理琼脂糖凝胶具有分子筛效应。
在中性ppH值的电泳缓冲液体系中,DNA分子由于带负电荷,所以在电场作用下由负极向正极泳动。
由于DNA分子的大小和构型不同,在相同的时间内迁移至不同的位置。
凝胶经溴化乙锭染色后,紫外检测仪下观察,即可看见DNA片段按大小不同呈条带分布。
由于在一定条件下,DNA的迁移率与分了量的对数值成反比,所以通过与已知分子量的标准DNA片段进行比较,即可知道未知D NA片段的大小。
琼脂糖凝胶电泳分析还可用于DNA酶切分析、纯度鉴定、分离纯化、Southern杂交等。
二、目的了解pDNA琼脂糖凝胶电泳原理与用途,掌握DNA琼脂糖凝胶电泳的基本操作方法。
三、材料、试剂和器材1、pDNA样品。
2、琼脂糖。
3、p10×TBE缓冲液:0.9M Tris-硼酸,0.02M EDTA(pH 8.0)。
4、溴化乙锭储备液:p10mg/ml水溶液。
5、上样缓冲液:p0.25%溴酚蓝,40%(W/V)蔗糖水溶液。
6、标准pDNA分子。
7、电泳槽、电泳仪、紫外检测仪、微量加样枪、石蜡膜。
四、操作步骤1、琼脂糖凝胶液配制称取p1克琼脂糖,置于干净的三角瓶中,加入100ml 1×TBE缓冲液,在沸水浴或微波炉中加热,使之彻底融化。
之后,加入5ul EB储备液混合(终浓度0.5pmg/ml),即制成1%的琼脂糖溶液。
2、凝胶板模具的准备将电泳装置所配备的塑料盘两端的开口用胶布或透明胶带封住,或取一适当大小干净干燥的长方形玻璃板,用胶布或透明胶带封住边缘,作成槽状,水平地放在桌面上。
在胶模的一端放上样品梳,距底板p0.5-1mm,以便加入琼脂糖后形成完好的加样孔。
3、凝胶板的制备将上述琼脂糖溶液放在室温下,待温度下降至p60℃时,倒在凝胶板模具上,室温放置0.5-1小时。
待琼脂糖彻底凝固后,轻轻拔出样品梳,撕去凝胶板模具两端(或四周)的胶带。
生物化学经典实验DNA琼脂糖凝胶电泳的原理步骤试剂配制结果分析分析

生物化学经典实验DNA琼脂糖凝胶电泳的原理步骤试剂配制结果分析分析DNA琼脂糖凝胶电泳是一种常用的生物化学分离和分析方法,可以根据DNA片段的大小进行分离和鉴定。
它通过将DNA样品加载在琼脂糖凝胶孔隙中,利用电场的作用使DNA片段沿电场方向迁移,从而实现分离和鉴定。
以下是关于DNA琼脂糖凝胶电泳的原理、步骤、试剂配制和结果分析的详细解释。
原理:DNA琼脂糖凝胶电泳原理是根据DNA片段的大小和电荷来进行分离。
琼脂糖凝胶是一种大分子网状结构,DNA片段在凝胶中迁移时受到阻碍,较短的DNA片段能够比较快速地通过凝胶,而较长的DNA片段迁移速度较慢。
步骤:1.准备琼脂糖凝胶:将琼脂糖粉溶解在缓冲液中,加热,混合均匀后倒入电泳槽。
插入槽糖待凝固。
2.准备DNA样品:将待测的DNA样品加入到琼脂糖样品缓冲液中。
可加入染料以便可视化DNA迁移。
3.加载DNA样品:将DNA样品缓冲液均匀地加载到琼脂糖凝胶孔隙中。
4.进行电泳:将电泳槽两端连接上电源,设定合适的电场强度和电泳时间,使DNA片段在凝胶中迁移。
5.可视化DNA片段:停止电泳后,将琼脂糖凝胶转移到紫外可视化仪中,或者使用DNA染料染色,然后观察和记录DNA片段的迁移位置。
试剂配制:1. 缓冲液(TAE缓冲液):配制1X TAE缓冲液的方法是将0.4 MTris(pH 8.0)、0.2 M醋酸和0.01 M EDTA混合,在加75 ml水至1 L,将该缓冲液与琼脂糖按比例混合。
2. DNA染料:可以使用SYBR Green I等DNA染料,按照厂家说明进行稀释。
结果分析:DNA琼脂糖凝胶电泳的结果主要通过观察和记录DNA片段的迁移位置来进行分析。
根据DNA片段的大小,可以判断不同样品中的DNA片段是否存在,或者根据已知大小的DNA片段作为标记物,来确定未知DNA片段的大小。
通常,较小的DNA片段迁移得更快,迁移距离较大,而较大的DNA片段迁移得更慢,迁移距离较短。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
核酸凝胶电泳染料的选择
1.EB
溴化乙锭(EB)由于其价格便宜、使用方便已成为最常用的核酸染料,被广泛应用于观察、检测琼脂糖凝胶与聚丙烯酰胺凝胶中的DNA或RNA。
然而EB是一种强诱变剂,具有中等毒性,对皮肤、眼睛、口腔和上呼吸道系统有刺激性作用,对人体有潜在危害性。
且废弃的EB染液易污染环境。
EB本身在紫外下不发光,与单链、双链或三链DNA结合后发出明亮的荧光,EB-DNA结合物会导致染料的光漂白和DNA单链断裂,且具有潜在的诱变作用。
EB的使用方法简单,可在制胶时将其加入进行前染,也可在电泳结束后进行后染。
前染有利于节约时间,但是易出现条带变形拖尾等问题,后染较费时,但效果较好。
2.GeneFinder
GeneFinder TM是新型的核酸染料,可以代替EB作为各种核酸电泳的染色剂。
与强致癌性的EB不同,GeneFinder TM属于花青类染料,毒性较低,GeneFinder TM与dsDNA结合发出荧光,其检测核酸的灵敏度比EB染色法高。
GeneFinder TM染料最大吸收峰为470nm,与该染料结合的核酸在紫外线下呈现绿色荧光,另外,该染料同样能引起有机体突变,在使用时候一样要采取适当的保护措施。
3.GoldView
GoldView TM也是一种可代替溴化乙锭(EB)的新型核酸染料,采用琼脂糖电泳检测DNA时,GoldView TM与核酸结合后能产生很强的荧光信号,其灵敏度与EB相当,使用方法与之完全相同。
GoldView对于大片段DNA的染色效果较好,但对于500 bp以下的片段效果并不理想,而且它的荧光基团在紫外灯下非常容易淬灭,一般约5-10min条带就会消失。
所以应尽快拍照、观察。
另外,GoldView 灵敏度差,本底色严重,不适用于切胶回收。
且其毒性较大,尤其在紫外灯下,其诱导突变能力极高。
4.SybrGreenI
SybrGreenI也是一种常用的核酸染料,它与双链DNA(dsDNA)结合后,荧光大大增强,检测的灵敏度也高于EB。
在紫外照射透视下,与双链DNA接合的SybrGreenI 呈现明亮的绿色荧光,但其稳定性较差(怕光、怕热),使得染色的重复性较低。
它对于50bp以下的DNA片段染色能力缺失而对小于l00 bp的DNA片段检测灵敏度也较低。
SybrGreenI的使用同样简单,致变性也比EB低,但仍然不能保证实验者的安全性,同时其高昂的价格也限制了它的广泛使用。
5. GelRed和GelGreen
GelRed和GelGreen是集高灵敏、安全和高稳定性于一身极佳的荧光核酸染料。
其通过美国环保局安全认定,废弃物可直接倒入下水道,而不会造成任何环境污染。
目前大多数商业化的核酸染料总是在灵敏度、稳定性和安全性等方面不完全令人满意,而GelRed和GelGreen的上市改变了这一现状。
GelRed和GelGreen 无论用于预制凝胶染色还是凝胶电泳后的染色,都表现出了极好的实验效果。
为配合紫外凝胶成像系统而设计的GelRed,其使用方法与EB一样极其方便简单。
GelRed在预制凝胶中使用时仍然有极高的灵敏度,且在检测低浓度、微量DNA 方面也表现出极高的灵敏度,尤其对小分子量的DNA检测非常灵敏。
GelGreen 则可以满足使用蓝色可见光激光凝胶扫描仪或者可见光激发的DarkReader的研究人员的使用。
GelGreen无论是在预制凝胶还是凝胶电泳后的染色中都优于SybrGreenI,且不存在后者的不稳定性问题。
GelRed和GelGreen均有较强的稳定性,可以长期在室温下保存,且这两种染料的热稳定性也极高,在电泳缓冲溶
液中时,均可用微波炉加热且不发生变性。
含有染料的预制凝胶可成批制备,长期保存备用。
GelRed和GelGreen与EB或SybrGreenI等其他核酸染料相比安全性得到了极大的提高。
独立的测试服务公司进行的标准艾姆斯氏测试结果表明,GelRed和GelGreen的特殊化学结构使其难以穿透细胞膜进入细胞,正是这一特性保证了实验者的安全,使实验者可以更加放心做实验。
