林学院生物化学问答小抄
生物化学问答题

1、蛋白质变性后,其性质有哪些变化?答:蛋白质变性的本质是特定空间结构被破坏。
变性后其性质的变化为:生物活性丧失,其次是理化性质改变,如溶解度降低,结晶能力丧失,易被蛋白酶消化水解。
2、参与维持蛋白质空间结构的历有哪些?答:氢键二硫键疏水作用范德华力盐键配位键3、什么是蛋白质的变性作用?引起蛋白质变性的因素有哪些?答:蛋白质分子在变性因素的作用下,失去生物活性的现象为蛋白质变性作用。
物理因素:热、紫外线照射、X—射线照射、超声波、高压、震荡、搅拌等化学因素:强酸、强碱、重金属、三氯乙酸、有机溶剂等。
4、什么是蛋白质的构像?构像与构型有何区别?答:在分子中由于共价键的旋转所表现出的原子或基团的不同空间排布。
构象的改变不涉及共价键的断裂和重新组成,也没有光学活性的变化,构象形式有无数种。
在立体异构体中的原子或取代基团的空间排列关系。
构型有两种,即L—构型和D—构型。
构型改变要有共价键的断裂和重新组成,从而导致光学活性的变化。
5、乙酰辅酶A可进入哪些代谢途径?请列出。
答:①进入三羧酸循环氧化分解为二氧化碳和水,产生大量能量②以乙酰辅酶A为原料合成脂肪酸,进一步合成脂肪和磷脂等③以乙酰辅酶A为原料合成酮体作为肝输出能源方式④以乙酰辅酶A为原料合成胆固醇。
6、为什么摄入糖过多容易长胖?答:①糖类在体内经水解产生单糖,像葡萄糖可通过有氧氧化生成乙酰辅酶A,作为脂肪酸合成原料合成脂肪酸,因此脂肪是糖储存形式之一。
②糖代谢过程中产生的磷酸二羟丙酮可转变为磷酸甘油,也可作为脂肪合成甘油的来源。
7、在糖代谢过程中生成的丙酮酸可进入哪些代谢途径?答:(1)在供氧不足时,丙酮酸在乳酸脱氢酶的催化下,有还原型的辅酶Ⅰ供氢,还原成乳酸。
(2)在供氧充足时,丙酮酸进入线粒体在丙酮酸脱氢酶系的作用下,氧化脱羧生成乙酰辅酶A, 乙酰辅酶A进入三羧酸循环被氧化为二氧化碳和水及ATP。
(3)丙酮酸进入线粒体在丙酮酸羧化酶的作用下生成草酰乙酸,后者经磷酸烯醇式丙酮酸羧激酶催化下生成磷酸烯醇式丙酮酸,在异生成糖。
生物化学简答题

生物化学简答题1. 产生ATP的途径有哪些,试举例说明。
答:产生ATP的途径主要有氧化磷酸化和底物水平磷酸化两条途径。
氧化磷酸化是需氧生物ATP生成的主要途径,是指与氢和电子沿呼吸链传递相偶联的ADP磷酸化过程。
例如三羧酸循环第4步,α-酮戊二酸在α-酮戊二酸脱氢酶系的催化下氧化脱羧生成琥珀酰CoA的反应,脱下来的氢给了NAD+而生成NADH+H+,1分子NADH+H+进入呼吸链,经过呼吸链递氢和递电子,可有2.5个ADP 磷酸化生成ATP的偶联部位,这就是通过氧化磷酸化产生了ATP。
底物水平磷酸化是指直接与代谢底物高能键水解相偶联使ADP磷酸化的过程。
例如葡萄糖无氧氧化第7步,1,3-二磷酸-甘油酸在磷酸甘油酸激酶的催化下生成3-磷酸甘油酸,在该反应中由于底物1,3-二磷酸-甘油酸分子中的高能磷酸键水解断裂能释放出大量能量,可偶联推动 ADP磷酸化生成ATP,这就是通过底物水平磷酸化产生了ATP。
2( 简述酶作为生物催化剂与一般化学催化剂的共性及其特性。
(1) 共性:用量少而催化效率高;仅能改变化学放映速度,不能改变化学反应的平衡点,酶本身在化学反应前后也不改变;可降低化学反应的活化能。
(2) 特性:酶作为生物催化剂的特点是催化效率更高,具有高度专一性,容易失活,活力受条件的调节控制,活力与辅助因子有关。
3( 什么是乙醛酸循环,有何生物学意义,乙醛酸循环是一个有机酸代谢环,它存在于植物和微生物中,在动物组织中尚未发现。
乙醛酸循环反应分为五步(略)。
总反应说明,循环每转1圈需要消耗两分子乙酰辅酶A,同时产生一份子琥珀酸。
琥珀酸产生后,可进入三羧酸循环代谢,或者变为葡萄糖乙醛酸循环的意义分为以下几点:(1)乙酰辅酶A经乙醛酸循环可生成琥珀酸等有机酸,这些有机酸可作为三羧酸循环中的基质。
(2)乙醛酸循环是微生物利用乙酸作为碳源建造自身机体的途径之一。
(3)乙醛酸循环是油料植物将脂肪酸转变为糖的途径。
生物化学(简答题、问答题)

简答题、问答题1.组成蛋白质的氨基酸有多少种?其结构特点是什么?答:组成蛋白质的氨基酸有20种。
结构特点:(1)除脯氨酸是α-亚氨基酸外,所有氨基酸均为α-氨基酸;(2)除甘氨酸外,其它氨基酸的α-碳原子(分子中第二个碳,Cα)均为不对称碳原子,D-型和L-型两种立体异构体,但天然蛋白质中的氨基酸都是L-型氨基酸;(3)氨基酸之间的不同,主要在于侧链R 的不同。
2.蛋白质分子结构可分为几级?维持各级结构的化学键是什么?答:蛋白质分子结构分为一、二、三、四级;维持各级结构的化学键分别是肽键、二硫键,氢键,次级键(疏水键),次级键(疏水键)。
3、酶作为一种生物催化剂有何特点?答:酶具有高效性、专一性、活性可调性。
4、解释酶的活性部位、必需基团二者之间的关系。
答:必需基团5、说明米氏常数的意义及应用。
答:米氏常数等于酶促反应速度为最大反应速度一半时的底物浓度。
应用:(1)米氏常数是酶的特征性常数,每一种酶都有它的Km 值,与酶的性质、催化的底物和酶促反应条件(如温度、pH 、有无抑制剂等)有关,而与酶浓度无关。
(2)K m 值可用于表示酶和底物亲和力的大小。
(3)当使用酶制剂时,可以根据K m 值判断使酶发挥一定反应速度时需要多大的底物浓度;在已规定底物浓度时,也可根据K m 值估算出酶能够获得多大的反应速度。
6、什么是竞争性和非竞争性抑制?试用一两种药物举例说明不可逆抑制剂和可逆抑制剂对酶的抑制作用?答:竞争性抑制:抑制剂结构与底物的结构相似,它和底物同时竞争酶的活性中心,因而妨碍了底物与酶的结合,减少了酶分子的作用机会,从而降低了酶的活性。
非竞争性抑制:抑制剂和底物不在酶的同一部位结合,抑制剂与底物之间无竞争性,酶与底物结合后,还可与抑制剂结合,或者酶和抑制剂结合后,也可再同底物结合,其结果是形成了三元复合物(ESI)。
可逆抑制剂:增效联磺的杀菌作用:增效联磺抑制细菌的二氢叶酸合成酶、二氢叶酸还原酶德活性,使细菌体内四氢叶酸的合成受到双重抑制,使细菌因核酸的合成受阻而死亡。
生物化学 问答题

1.酮体生成的意义:酮体是肝脏输出能源的一种形式。
并且酮体可通过血脑屏障,是脑组织的重要能源。
酮体利用的增加可减少糖的利用,有利于维持血糖水平恒定,节省蛋白质的消耗。
2.氨基酸脱氨基作用有哪几种方式?转氨基作用,氧化脱氨基,联合脱氨基,非氧化脱氨基3.简述一碳单位的定义、来源和生理意义某些氨基酸在分解代谢过程中产生的只含有一个碳原子的基团,称为一碳单位。
能作为合成嘌呤和嘧啶的原料,把氨基酸代谢和核酸代谢联系起来需要四氢叶酸载体。
4.维生素B12缺乏与巨幼红细胞贫血的关系是什么?由叶酸、维生素B12缺乏引起的一种大细胞性贫血。
这种贫血的特点是骨髓里的幼稚红细胞增多,红细胞核发育不良,成为特殊的巨幼红细胞。
5.鸟氨酸循环的主要过程及生理意义是什么?氨基甲酰磷酸的合成,瓜氨酸的合成,精氨酸代琥珀酸的生成,精氨酸的生成,精氨酸水解生成尿素最重要的意义是将体内蛋白质代谢产生的较高毒性的氨转化为低毒的尿素,从而排出体外。
鸟氨酸循环也叫尿素循环。
6.补救合成的生理意义补救合成节省从头合成时的能量和一些氨基酸的消耗。
体内某些组织器官,如脑、骨髓等只能进行补救合成。
7. 列举影响核苷酸合成的抗代谢物及其抗癌作用原理.6-巯基鸟嘌呤与次黄嘌呤的结构相似,可抑制次黄嘌呤核苷酸向腺苷酸和鸟甘酸的转变。
8.为什么说细胞水平的调节是机体代谢调节的基础?细胞水平调节主要通过细胞内代谢物浓度的变化,对酶的活性及含量进行调节,是最基础的代谢调节。
9.机体代谢调节方式有多种,相互之间如何联系?物质代谢通过各代谢途径的共同中间产物相互联系,但在相互转变的程度上差异很大,有些代谢反应是不可逆的。
乙酰CoA 是糖、脂、氨基酸代谢共有的重要中间代谢物,三羧酸循环是三大营养物最终代谢途径,是转化的枢纽。
10.平时与饥饿时机体内能量主要来源有何不同平时能量主要来源于对葡萄糖的利用在饥饿时整体水平的代谢调节发挥作用:(1)糖代谢变化糖异生加强,组织对葡萄糖利用降低(2)蛋白质代谢变化分解加强,氨基酸异生成糖(3)脂代谢变化脂肪动员加强,酮体生成增多11.血浆蛋白质的功能。
生物化学简答题整理

生物化学简答题一、糖类化合物1、糖类物质在生物体内起什么作用?(1)糖类物质是异氧生物的主要能源之一,糖在生物体内经一系列的降解而释放大量的能量,供生命活动的需要。
(2)糖类物质及其降解的中间产物,可以作为合成蛋白质脂肪的碳架及机体其它碳素的来源。
(3)在细胞中糖类物质与蛋白质核酸脂肪等常以结合态存在,这些复合物分子具有许多特异而重要的生物功能。
(4)糖类物质还是生物体的重要组成成分。
2、血糖正常值是 3.89~6.11mmol/L ,机体是如何进行调节的?⑴肝脏调节:用餐后血糖浓度增高是,肝糖原合成增加,是血糖水平不致因饮食而过度升高;空腹时肝糖原分解,提供葡萄糖;饥饿或禁食,肝脏的糖异生作用加强,提供葡萄糖。
⑵肾脏调节:肾小管重吸收葡萄糖,但是不要超过肾糖阈。
⑶神经调节:用电刺激交感神经系的视丘下部腹内侧核或内脏神经,能促使肝糖原分解,血糖升高;用电刺激副交感神经系的视丘下部外侧或迷走神经时,肝糖原合成增加,血糖浓度升高。
⑷激素调节:若是血糖浓度过高,则胰岛素起作用,若血糖浓度过低,有肾上腺素、胰高血糖素、糖皮质激素、生长素、甲状腺激素等起作用。
3、简述血糖的来源和去路。
⑴血糖的来源:①食物经消化吸收的葡萄糖;②肝糖原分解;③糖异生⑵血糖的去路:①糖酵解或有氧氧化产生能量;②合成糖原;③转变为脂肪及某些非必需氨基酸;④进入磷酸戊糖途径等转变为其它非糖类物质。
4、试述成熟红细胞糖代谢特点及其生理意义。
⑴成熟红细胞不仅无细胞核,而且也无线粒体、核蛋白体等细胞器,不能进行核酸和蛋白质的生物合成,也不能进行有氧氧化,不能利用脂肪酸。
血糖是其唯一的能源。
红细胞摄取葡萄糖属于易化扩散,不依赖胰岛素。
成熟红细胞保留的代谢通路主要是葡萄糖的酵解和磷酸戊糖通路以及2.3一二磷酸甘油酸支路。
⑵通过这些代谢提供能量和还原力(NADH,NADPH)以及一些重要的代谢物,对维持成熟红细胞在循环中约120的生命过程及正常生理功能均有重要作用。
生物化学简答题

生物化学简答题生物化学是研究生物体内的化学成分和生物体内化学反应过程的科学。
它涉及到很多重要的概念和原理,下面我将依次回答几个简答题,以帮助您更好地理解生物化学的基本知识。
1. 什么是酶?酶在生物体中起到什么作用?酶是一类催化生物化学反应的蛋白质分子。
它们能够加速化学反应的速率,使反应达到生物体内所需的程度。
酶可以在非常温和的条件下,提高化学反应的速度。
生物体内的代谢、合成反应、分解反应等都离不开酶的催化作用。
2. DNA和RNA有什么区别?DNA(脱氧核糖核酸)和RNA(核糖核酸)是生物体内两种重要的核酸分子。
它们在结构上和功能上存在着一些差异。
首先,在结构上,DNA是由两条螺旋结构的链组成,而RNA则是单链结构。
其次,在碱基组成上,DNA包含腺嘌呤(A)、鸟嘌呤(G)、胸腺嘧啶(T)和胞嘧啶(C),而RNA则包含腺嘌呤(A)、鸟嘌呤(G)、尿嘧啶(U)和胞嘧啶(C)。
此外,DNA在存储和传递遗传信息方面起到关键作用,而RNA则在蛋白质合成中发挥重要作用。
3. 核糖酸循环是什么?它在生物体内的作用是什么?核糖酸循环,也称为三羧酸循环或Krebs循环,是生物体内的一种重要的代谢途径。
它是将碳源分解为能够供应细胞产生能量所需的化合物的过程。
核糖酸循环主要发生在线粒体中,通过一系列的反应,将葡萄糖、脂肪酸等有机物分解为二氧化碳和水,并在此过程中产生三氧化磷(ATP)等高能化合物。
核糖酸循环是细胞内能量代谢的重要组成部分,也是产生细胞需要的能量的关键过程。
4. 蛋白质是生物体内重要的有机物质,它有什么功能和结构特点?蛋白质是生物体内功能最为多样复杂的有机分子,具有多种重要的功能。
首先,蛋白质是生物体内大部分酶的组成部分,能够催化和调控许多关键的生化反应。
其次,蛋白质在细胞结构和功能的维持中发挥着重要的作用,例如构成细胞骨架、参与免疫反应等。
此外,蛋白质还可以作为激素、抗体和运输分子等。
蛋白质的结构特点包括四级结构:一级结构指由氨基酸残基的线性序列组成;二级结构指由α螺旋和β折叠等基本结构单元组成;三级结构指蛋白质折叠成三维结构的形态;四级结构指多个蛋白质亚单位组合形成功能性蛋白质复合物。
生物化学简答题
2.简述三羧酸循环的生理意义就是什么?它有哪些限速步骤?生理意义:三羧酸循环就是机体获取能量的主要方式;为生物合成提供原料;影响果实品质糖;脂肪与蛋白质代谢的枢纽限速步骤:1)在柠檬酸合酶的作用下,由草酰乙酸与乙酰-CoA合成柠檬酸2)在异柠檬酸脱氢酶催化下,异柠檬酸脱氢形成草酰琥珀酸。
3)在α-酮戊二酸脱氢酶系作用下,α-酮戊二酸氧化、脱羧,生成琥珀酰-CoA、NADH+H+与CO2。
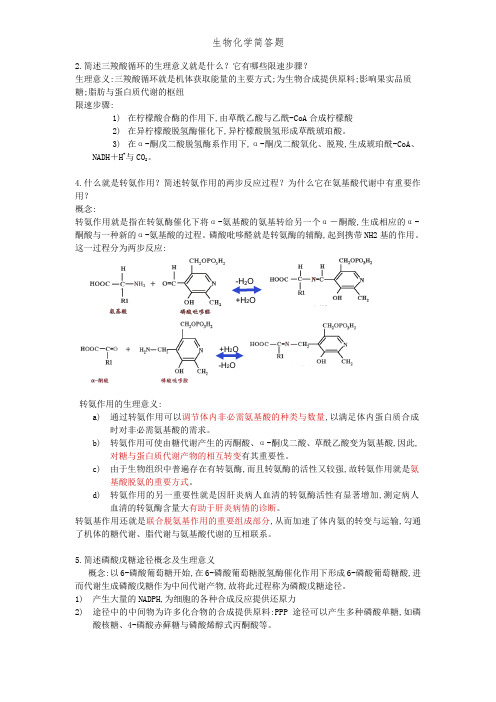
4.什么就是转氨作用?简述转氨作用的两步反应过程?为什么它在氨基酸代谢中有重要作用?概念:转氨作用就是指在转氨酶催化下将α-氨基酸的氨基转给另一个α-酮酸,生成相应的α-酮酸与一种新的α-氨基酸的过程。
磷酸吡哆醛就是转氨酶的辅酶,起到携带NH2基的作用。
这一过程分为两步反应:-H2O+H2O+H2O-H2O转氨作用的生理意义:a)通过转氨作用可以调节体内非必需氨基酸的种类与数量,以满足体内蛋白质合成时对非必需氨基酸的需求。
b)转氨作用可使由糖代谢产生的丙酮酸、α-酮戊二酸、草酰乙酸变为氨基酸,因此,对糖与蛋白质代谢产物的相互转变有其重要性。
c)由于生物组织中普遍存在有转氨酶,而且转氨酶的活性又较强,故转氨作用就是氨基酸脱氨的重要方式。
d)转氨作用的另一重要性就是因肝炎病人血清的转氨酶活性有显著增加,测定病人血清的转氨酶含量大有助于肝炎病情的诊断。
转氨基作用还就是联合脱氨基作用的重要组成部分,从而加速了体内氨的转变与运输,勾通了机体的糖代谢、脂代谢与氨基酸代谢的互相联系。
5.简述磷酸戊糖途径概念及生理意义概念:以6-磷酸葡萄糖开始,在6-磷酸葡萄糖脱氢酶催化作用下形成6-磷酸葡萄糖酸,进而代谢生成磷酸戊糖作为中间代谢产物,故将此过程称为磷酸戊糖途径。
1)产生大量的NADPH,为细胞的各种合成反应提供还原力2)途径中的中间物为许多化合物的合成提供原料:PPP途径可以产生多种磷酸单糖,如磷酸核糖、4-磷酸赤藓糖与磷酸烯醇式丙酮酸等。
生物化学问答题

生物化学问答题生物化学问答题3000字生物化学是研究生物体内各种生物分子的结构、特性、功能以及代谢过程等问题的一门综合性学科。
通过对生物体内的生物分子进行深入的研究,我们可以更好地了解生命的起源、发展和维持,为医学、农业、生物工程等领域的发展提供重要的理论基础。
下面将对生物化学的相关知识进行问答,以帮助大家更好地理解这一学科。
1. 什么是生物分子?生物分子是组成生物体的各种化合物,在生物体内发挥着重要的生理功能。
生物分子主要包括碳水化合物、脂类、蛋白质和核酸等。
这些生物分子在生物体内相互作用,共同维持生命活动的正常进行。
2. 什么是碳水化合物?碳水化合物是由碳、氢、氧三种元素组成的一类常见有机化合物,主要包括单糖、双糖和多糖三类。
碳水化合物是生物体内最主要的能量来源,也是细胞结构的重要组成部分。
3. 什么是脂类?脂类是一类疏水性有机分子,主要包括脂肪酸、甘油与磷脂等多种化合物。
脂类在生物体内主要用于能量储存、细胞膜的构建和信号传导等功能。
4. 什么是蛋白质?蛋白质是由氨基酸通过肽键连接而成的大分子,是生物体内最基本的生物大分子之一。
蛋白质在生命活动中扮演重要的角色,包括酶、激素、抗体等多种功能。
5. 什么是核酸?核酸是由核苷酸通过磷酸二脱水缩合形成的生物大分子,主要包括DNA和RNA两类。
核酸是生命起源和遗传信息传递的重要载体,对细胞的正常功能具有重要的影响。
6. DNA和RNA的结构有何不同?DNA(脱氧核糖核酸)和RNA(核糖核酸)在结构上有几点不同。
首先,DNA是由脱氧核糖、磷酸和碱基组成的双螺旋结构,而RNA是由核糖、磷酸和碱基构成的单链结构。
其次,DNA的碱基包括腺嘌呤(A)、胸腺嘧啶(T)、鸟嘌呤(G)和胞嘧啶(C),而RNA中胸腺嘧啶(T)被尿嘧啶(U)替代。
此外,DNA主要存在于细胞核中,而RNA在细胞质中发挥功能。
7. 生物体内的代谢过程包括哪几类?生物体内的代谢过程主要包括两类:合成代谢和分解代谢。
生物化学考试问答题

生物化学考试问答题1、何谓三羧酸循环?它有何特点和生物学意义?特点。
1。
乙酰CoA进入三羧酸循环后,是六碳三羧酸反应2。
在整个循环中消耗2分子水,1分子用于合成柠檬酸,一份子用于延胡索酸的水和作用。
3在此循环中,最初草酰乙酸因参加反应而消耗,但经过循环又重新生成。
所以每循环一次,净结果为1个乙酰基通过两次脱羧而被消耗。
循环中有机酸脱羧产生的二氧化碳,是机体中二氧化碳的主要来源。
4在三羧酸循环中,共有4次脱氢反应,脱下的氢原子以NADH+H+和FADH2的形式进入呼吸链,最后传递给氧生成水,在此过程中释放的能量可以合成ATP。
5三羧酸循环严格需要氧气6。
琥珀CoA生成琥珀酸伴随着底物磷酸化水平生成一分子GTP,能量来自琥珀酰CoA的高能硫酯键意义。
1三羧酸循环是机体将糖或者其他物质氧化而获得能量的最有效方式2,三羧酸循环是糖,脂和蛋白质3大类物质代谢和转化的枢纽。
2、磷酸戊糖途径有何特点?其生物学意义何在?特点:无ATP生成,不是机体产能的方式。
1)为核酸的生物合成提供5-磷酸核糖,肌组织内缺乏6-磷酸葡萄糖脱氢酶,磷酸核糖可经酵解途径的中间产物3 - 磷酸甘油醛和6-磷酸果糖经基团转移反应生成。
2)提供NADPHa.NADPH是供氢体,参加各种生物合成反应,如从乙酰辅酶A合成脂酸、胆固醇;α-酮戊二酸与NADPH及氨生成谷氨酸,谷氨酸可与其他α-酮酸进行转氨基反应而生成相应的氨基酸。
b.NADPH是谷胱甘肽还原酶的辅酶,对维持细胞中还原型谷胱甘肽的正常含量进而保护巯基酶的活性及维持红细胞膜完整性很重要,并可保持血红蛋白铁于二价。
c.NADPH参与体内羟化反应,有些羟化反应与生物合成有关,如从胆固醇合成胆汁酸、类固醇激素等;有些羟化反应则与生物转化有关。
物学意义1,产生大量的NADPH,为细胞的各种合成反应提供还原力2,1 产生NADPH(注意:不是NADH!NADPH不参与呼吸链)2 生成磷酸核糖,为核酸代谢做物质准备3 分解戊糖意义:1 补充糖酵解2 氧化阶段产生NADPH,促进脂肪酸和固醇合成。
关于生物化学简答题

生化习题简答题1.试简三羧酸循环的意义是氧化功能的主要代谢门路,是三大物质(糖,脂肪,氨基酸)代谢互相联系的枢纽,是三大物质代谢最后的共同通道。
2.与酶高效催化作用相关的要素有哪些?1). 周边定向效应2). 底物的形变和引诱切合3). 亲核催化 / 亲电催化(共价催化4). 酸碱催化5). 微环境的影响3.酶的辅因子依据化学实质可分哪几类 , 请举例说明?1)无机金属元素,如镁离子,己糖激酶的辅因子2)小分子有机物,如 NAD+,脱氢酶的辅因子3)蛋白质类辅酶,如硫氧还蛋白,而磷酸核糖核苷酸复原酶的辅因子4.请列举遗传密码的基本特色,并分别予以解说。
1)连续性 :mRNA的读码方向从 5' 端至 3' 端方向,两个密码子之间无任何核苷酸分开。
mRNA 链上碱基的插入、缺失和重叠,均造成框移突变。
2)简并性 : 指一个氨基酸拥有两个或两个以上的密码子。
密码子的第三位碱基改变常常不影响氨基酸翻译。
3)摇动性 :mRNA上的密码子与转移 RNA(tRNA)J 上的反密码子配对辨识时,大部分状况恪守间几乎不配对原则,但也可出现不严格配对,特别是密码子的第三位碱基与反密码子的第一位碱基配对经常出现不严格碱基互补,这种现象称为摇动配对。
4)通用性 : 无论高等或低等生物,从细菌到人类都拥有一套共同的遗传密码5.真核细胞与原核细胞 DNA复制过程的主要差别有哪些?1)真核生物有多个复制开端位点——复制原点,而原核只有一个复制原点。
2)真核生物复制一旦启动,在达成本次复制前,不可以在再启动新的复制,而原核复制开端位点能够连续开始新的复制,特别是迅速生殖的细胞。
3)真核生物和原核生物的复制调控不一样。
原核生物的调控集中在复制子(一个复制单位)水平的调控,而真核生物不只有复制子水平的调控还有染色体水平的调控和细胞水平的调控。
4)原核的 DNA聚合酶 III复制时形成二聚体复合物,而真核的聚合酶保持分别状态。
生物化学全部简答题

1.合成的多肽多聚谷氨酸,当处在PH3.0以下时,在水溶液中形成α螺旋,而在PH5.0以上时却为伸展状态。
A.解释该现象。
B.在哪种PH条件下多聚赖氨酸会形成α-螺旋?答:(a)由可离子化侧链的氨基酸残基构成的α-螺旋对pH值的变化非常敏感,因为溶液的pH值决定了侧链是否带有电荷,由单一一种氨基酸构成的聚合物只有当侧链不带电荷时才能形成α-螺旋,相邻残基的侧链上带有同种电荷会产生静电排斥力从而阻止多肽链堆积成α-螺旋构象.Glu侧链的pKa约为4.1,当pH值远远低于4.1(大约3左右)时,几乎所有的多聚谷氨酸侧链为不带电荷的状态,多肽链能够形成α-螺旋.在pH值为5或更高时,几乎所有的侧链都带负电荷,邻近电荷之间的静电排斥力阻止螺旋的形成,因此使同聚物呈现出一种伸展的构象.(b)Lys侧链的pK为10.5,当pH值远远高于10.5时,多聚赖氨酸大多数侧链为不带电荷的状态,该多肽可能形成一种α-螺旋构象,在较低的pH值时带有许多正电荷的分子可能会呈现出一种伸展的构象.2.为什么说蛋白质水溶液是一种稳定的亲水胶体?答:①蛋白质表面带有很多极性基因,比如:-NH3,-COO-,-OH,-SH,-CONH2等,和水有高度亲和性,当蛋白质与水相遇时,水很容易被蛋白质吸引,在蛋白质外面形成一种水膜,水膜的存在使蛋白颗粒相互隔开,蛋白之间不会碰撞而聚成大颗粒,因此蛋白质在水溶液中比较稳定而不易沉淀。
②蛋白质颗粒在非等电点状态时带有相同电荷,蛋白质颗粒之间相互排斥保持一定距离,不易沉淀。
3. R侧链对α-螺旋的影响。
答:侧链大小和带电荷性决定了能否形成α-螺旋,即形成α-螺旋的稳定性,肽链上连续出现带有相同电荷的氨基酸,如赖氨酸,天冬氨酸,谷氨酸;由于静电排斥不能形成链内氢键,从而不能形成稳定的α-螺旋,R基较小且不带电荷的氨基酸有利于α-螺旋的形成,R基越大,如异亮氨酸,不易形成α-螺旋,脯氨酸终止α-螺旋。
生物化学简答题汇总

生物化学简答题汇总
1. 什么是生物化学?
生物化学是研究生物体内化学反应和化学组成的学科。
它探讨了生物体内各种分子的结构、功能和相互关系,从而揭示了生命现象的化学基础。
2. 生物大分子有哪些类别?
生物大分子主要包括碳水化合物、脂质、蛋白质和核酸。
3. 什么是酶?
酶是一类生物催化剂,能够加速化学反应速度。
它们通常是蛋白质,具有高度特异性和高效率。
4. DNA和RNA有什么区别?
DNA是脱氧核糖核酸,而RNA是核糖核酸。
它们在化学组成上的主要差异在于核糖的氧原子数目不同,以及DNA中的胸腺嘧啶(T)替代了RNA中的尿嘧啶(U)。
5. ATP是什么?有什么功能?
ATP是腺苷三磷酸,是细胞内广泛存在的一种高能化合物。
它储存并释放细胞所需的能量,参与许多生命活动和代谢过程。
6. 什么是基因?
基因是生物体中遗传信息的基本单位,由DNA编码。
它传递遗传信息,决定了生物体的遗传特性和功能。
7. 糖酵解是什么过程?主要产物是什么?
糖酵解是一种产生能量的代谢过程,将葡萄糖分解为产生ATP 的有机酸,并释放二氧化碳和水。
主要产物包括乳酸或乙醛、丙酮酸和ATP。
8. 光合作用是什么过程?主要产物是什么?
光合作用是植物等自养生物利用光能将二氧化碳和水转化为有机物(如葡萄糖)的过程。
主要产物是葡萄糖和氧气。
以上是对生物化学简答题的汇总,希望对您有所帮助。
生物化学问答题

1、什么是遗传密码,它有哪些性质?答:遗传密码是指核酸中的核苷酸残基序列与蛋白质中的氨基酸残基序列之间的对应关系。
连续的3个核苷酸残基序列为一个密码子,特指一个氨基酸。
它的主要性质如下:(1)密码的基本单位:每个三联体中的三个核苷酸只编码一个氨基酸,核苷酸不重叠使用,无标点,按5’→3’方向编码(阅读);(2)密码的简并性:几种密码子编码一种氨基酸的现象称为密码子的简并性;(3)密码的变偶性:密码子的碱基配对只有第一、二位是严谨的,第三位可有一定变动;(4)密码的通用性和变异性;(5)密码的防错系统。
2、简述脂肪酸β-氧化的过程(5步)。
(1)脂肪酸的活化——脂酰CoA的生成,长链脂肪酸氧化前必须进行活化,活化在细胞液中进行,活化的脂酰CoA通过肉碱携带进入线粒体内才能代谢。
(2)脱氢,脂酰CoA生成反式△2烯脂酰CoA。
(3)加水,反式△2烯脂酰CoA加水生成L-β-羟脂酰CoA。
(4)脱氢,L-β-羟脂酰CoA生成β-酮脂酰CoA。
(5)硫解, β-酮脂酰CoA与CoA作用,硫解产生1分子乙酰CoA和比原来少两个碳原子的脂酰CoA。
3、简述DNA二级结构特点(以B型为例)。
答:(1)DNA分子由两条相互平行但走向相反的脱氧多核苷酸链组成,两链以-脱氧核糖-磷酸-为骨架,以右手螺旋方式绕同一公共轴盘。
螺旋直径为2nm,形成大沟(major groove)及小沟(minor groove)相间。
(2)碱基垂直螺旋轴居双螺旋内側,与对側碱基形成氢键配对(互补配对形式:A=T; G C)。
(3)氢键维持双链横向稳定性,碱基堆积力维持双链纵向稳定性。
(4) 碱基在一条链上的排列顺序不受任何限制4、蛋白质为什么能稳定存在,沉淀蛋白质的方法有哪些?答:蛋白质稳定存在的原因是其分子表面带有水化层和双电层。
沉淀蛋白质的方法如下:(1)盐析法(2)有机溶剂沉淀法(3)重金属盐沉淀法(4)生物碱试剂和某些酸类沉淀法(5)加热变性沉淀法5、什么是生物氧化,它有何特点?答:有机分子在细胞内氧化分解成二氧化碳和水并释放出能量形成ATP的过程,称为生物氧化。
生物化学问答题(含答案)汇总

蛋白质化学1.蛋白质:是一类生物大分子,有一条或多条肽链构成,每条肽链都有一定数量的氨基酸按一定的序列以肽键连接形成。
蛋白质是生命的物质基础,是一切细胞和组织的重要组成成分。
2.标准氨基酸:是可以用于合成蛋白质的20种氨基酸。
7.氨基酸的等电点:氨基酸在溶液中的解离程度受PH值的影响,在某一PH值条件下,氨基酸解离成阳离子和阴离子的程度相等,在溶液中的氨基酸以间性离子形式存在,且净电荷为0,此时溶液的PH值成为该氨基酸的等电点9.缀合蛋白质:含有非氨基酸成分的蛋白质10.蛋白质的辅基:缀合蛋白所含有的非氨基酸成分12.肽键:存在与蛋白质和肽分子中,是有一个氨基酸的ɑ-羧基与另外一个氨基酸的ɑ-氨基缩合时形成的化学键14.肽:是指由2个或多个氨基酸通过肽键连接而成的分子15.氨基酸残基:肽和蛋白质中的氨基酸是不完整的,氨基失去了氢,羧基失去了羟基,因而称为氨基酸残基16.多肽:由10个以上氨基酸通过肽键连接而成的肽18.生物活性肽:是指具有特殊生理功能的肽类物质,它们多为蛋白质多肽链的一个片段,当被降解释放之后就会表现出活性,例如参与代谢调节、神经传导。
食物蛋白质的消化产物也有生物活性肽,它们可以被直接吸收。
20.蛋白质的一级结构:通常叙述为蛋白质多肽链种氨基酸的链接顺序,简称为氨基酸序列,蛋白质的一级结构反应蛋白质分子的共价键结构21.蛋白质的二级结构:是指蛋白质多肽链局部片段的构象,该片段的氨基酸序列式连续的,主链构象通常是规则的23.蛋白质的超二级结构:又称模体基序,是指几个二级结构单元进一步聚合和结合形成的特定构象单元,如ɑɑ、βɑβ、ββ、螺旋-转角-螺旋、亮氨酸拉链等24.蛋白质的三级结构:是指蛋白质分子整条肽链的空间结构,描述其所有原子的空间分布,蛋白质三级结构的形成是肽链在二级结构的基础上进一步折叠的结果。
26.蛋白质的亚基:许多蛋白质分子可以用物理方法分离成不止一个结构单位,每个结构单位可以有不止一条肽链构成,但都有特定且相对独立的三级结构,且是由一个共价键连接的整体,该结构单位称为该蛋白质的一个亚基27.蛋白质的四级结构:多亚基蛋白的亚基与亚基通过非共价键结合,形成特定的空间结构,这一结构层次称为该蛋白质的四级结构35.变构蛋白:具有下列特性蛋白质的统称:它们有两种或多种构象,有两个或多个配体结合位点,配体与其中一个结合位点结合导致蛋白质变构,及从一种构象转换成另一种构象,这种变构影响到其他配体结合位点与配体的结合36.变构剂:导致变构蛋白变构的物质,多为小分子42.蛋白质的等电点:蛋白质是两性的电解质其解离状态受溶液的PH值影响,在某一PH值条件下,蛋白质的净电荷为0,该PH值称为该蛋白质的等电点44.蛋白质变性:由于稳定蛋白质构象的化学键被破坏,造成其四级结构三级结构甚至二级结构被破坏,结果其天然构象部分或全部改变,变性导致蛋白质理化性质改变,生物活性丧失。
生物化学问答题(附答案)

生物化学问答题(附答案)生物化学解答题(一档在手万考不愁)整理:机密下载有淀粉酶制剂1g,用水溶解成1000ml酶液,测定其蛋白质含量和粉酶活力。
结果表明,该酶液的蛋白质浓度为0.1mg/ml;其1ml的酶液每5min分解0.25g 淀粉,计算该酶制剂所含的淀粉酶总活力单位数和比酶活(淀粉酶活力单位规定为:在最适条件下,每小时分解1克淀粉的酶量为一个活力单位)。
答案要点:①1ml的酶液的活力单位是60/5×0.25/1=3(2分)酶总活力单位数是3×1000=3000U(1分)②总蛋白是0.1×1000=100 mg(1分),比活力是3000/100=30(1分)。
请列举细胞内乙酰CoA的代谢去向。
(5分)答案要点:三羧酸循环;乙醛酸循环;从头合成脂肪酸;酮体代谢;合成胆固醇等。
(各1分)酿酒业是我国传统轻工业的重要产业之一,其生化机制是在酿酒酵母等微生物的作用下从葡萄糖代谢为乙醇的过程。
请写出在细胞内葡萄糖转化为乙醇的代谢途径。
答案要点:在某些酵母和某些微生物中,丙酮酸可以由丙酮酸脱羧酶催化脱羧变成乙醛,该酶需要硫胺素焦磷酸为辅酶。
乙醛继而在乙醇脱氢酶的催化下被NADH还原形成乙醇。
葡萄糖+2Pi+2ADP+2H+ 生成2乙醇+2CO2+2ATP+2H2O(6分)脱氢反应的酶: 3-磷酸甘油醛脱氢酶(NAD+),醇脱氢酶(NADH+H+)(2分)底物水平磷酸化反应的酶:磷酸甘油酸激酶,丙酮酸激酶(Mg2+或K+)(2分)试述mRNA、tRNA和rRNA在蛋白质合成中的作用。
答案要点:①mRNA是遗传信息的传递者,是蛋白质生物合成过程中直接指令氨基酸掺入的模板。
(3分)②.tRNA在蛋白质合成中不但为每个三联体密码子译成氨基酸提供接合体,还为准确无误地将所需氨基酸运送到核糖体上提供运送载体。
(4分) ③. rRNA与蛋白质结合组成的核糖体是蛋白质生物合成的场所(3分)。
生物化学简答题必背分享-17

生物化学简答题必背分享-171、什么是新陈代谢,生物体外什么要对新陈代谢进行调节?2、维生素、氨基酸、糖代谢个代谢途径发生的场所?3、简述DNA的半保留复制、半不连续复制4、DNA复制的蛋白质因子及功能5、真核生物与原核生物DNA 聚合酶的种类与功能6、DNA复制过程高保真性的原因答案解析1、什么是新陈代谢,生物体外什么要对新陈代谢进行调节?【答案解析】:(1)新陈代谢的定义在生活的生物体和细胞内,存在着无休止的化学变化,一系列的酶促反应组成复杂的反应的网络。
这些化学反应的总和称为新陈代谢,其是生物体表现其生命活动的重要特征之一。
新陈代谢包括分解代谢和合成代谢两个方面。
(2)新陈代谢的调节机制新陈代谢的调节可以概括的划分为三个不同水平:分子水平、细胞水平和整体水平。
分子水平的调节包括反应物和产物的调节(主要是浓度的调节和酶的调节)。
酶的调节是最基本的代谢调节,包括酶的数量调节以及酶活性的调节等。
酶的数量不只受到合成速率的调节,也受到降解速率的调节。
合成速率和分解速率都具备一系列的调节机制。
在酶的活性调节机制中,比较普遍的调节机制是可逆的变构调节和共价修饰两种形式。
细胞水平的调节是通过细胞的特殊结构与酶结合在一起,使酶的作用具有严格的定位条理性,从而使代谢途径得到分隔控制的调节方式。
多细胞生物还受到在整体水平的调节。
这主要包括激素的调节和神经的调节。
高等真核生物由于分化出执行不同功能的各种细胞器,而使新陈代谢受到合理的安排。
人类还受到高级神经活动的调节。
除上述各方面的调节作用外,还有来自基因表达的调节作用。
(3)代谢调节的生物学意义组成有机体的细胞,由于空间有限,所以对各种反应必须要有相应的调节机制,否则会造成无用循环,拥挤,物质供应不足,有毒代谢物大量积累,最终使细胞走向死亡。
一些共同的中间代谢物可使得代谢调控得以沟通,再加上各种调节机制的协同作用,进而可使得各种代谢反应能着实有效的运转。
总之,代谢调节使生物机体能够适应其内、外复杂的变化环境,维持机体的有序状态,从而得以生存。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
6
1.生物学活3.生物化
αα;
1.DNA 的碱基
2. DN A 的双1.天然聚脱氧核苷酸链组成,一条链的走向为5’到3’,另一条为3’到5’;2.作为不变成分的磷酸和脱氧核糖骨架位于外侧,作为可变成分的碱基位于内侧;
3.螺旋的直径为2nm ,相邻碱基平面
的垂直距离为0.34nm 。
10. rRNA (场所; tRNA (转运RNA ) 在蛋白质合成时起着携带活化氨基酸的作用;mRNA (信使
RNA) 在蛋白质合成中起着模板的作用,编码氨基酸。
酶催化具有高效度专一性;3.酶催化的条件温和
;4.酶活性的可调控子有关。
绝对专一性;2.性。
16.酶的抑制剂中抑制作用的类型:可逆的抑制作用:不可逆的抑制作用。
可你抑制作用类型:1.竞争性抑制作用;2.非
竞争性抑制作用;3.反竞争17反
物、Km 是质有关,不受底物浓度和酶浓度的影响;2、Km 的大小近似的反应了酶与底物结合亲和力的大小;3、如果一种酶可以催化几种底物发生反应,就必然对每一种底物各有一个特定的K m ;4、如果已知某个酶的K m ,可由所求的反应速度,求出应当加入底物的合理浓度;也可根据已知的底物浓度求出该条件下可以达到的反应速度;
5、Km 可以帮助推测某一个代谢反应的活性中心在通常占整个酶分子体积的1-2%;2.酶的活性中心具有三维空间结构,酶的空间结构决定了酶活性中心的空间结构;3.构成酶活性中心的氨基酸,通常在一级结构上相隔很远,但由于折叠和卷曲而彼此相互靠近,形成具有特定空间结构的区域;4.酶的活性中心与底物形状不是正好互补的;5.酶活性中心位于酶分子表面的裂缝内;6.底物通过较弱的次级键与
酶结合;7.酶的活性中心具有柔性或可运动性。
1、与活化分子数增多,酶促反应速度加快,对于许多酶来说,温度系数Q10多为1-2,也就是说每增高反应温度10摄氏度,酶反应速度增加1-2倍;2、由于酶是蛋白质,随着
温度升高而使酶逐渐变性,即通过酶活力的减少而降低酶的反应速度。
1
、膜的不对
铁-
硫蛋色素 较大的传递体依次通过电正性
较大的传递物Ⅲ的电子传递;氰化物、叠氮化物、一氧化碳和硫化氢阻断细胞色素
a a3至341、2、氧化功能;3、糖酵解途径
中形成的许多中间产物,可作为合成其他物质351、A TP 的途径 ;
2、糖类、蛋白质、脂类、核酸等代
谢的枢纽。
3、
为生物体内多种物质36
物体内多种代谢反应,发挥着不同的作用;2、磷酸戊糖途径中的许多中间产物是某些生物合成的原料;3、必要时提供能量;4、磷酸
分解和α-
酮酸成糖、酮体或脂肪酸;3、氧化降解产能。
胺的代谢去向:1、胺类物质的氧化;2 435’-核糖,在此基础上逐步进行嘌呤环的“组装”。
首先形成IMP (次黄嘌呤核苷酸),以后再转化为其它各种嘌呤核苷酸。
嘌呤环各组成成分来源:合成
嘌呤环前体分子中的谷氨酰胺,它提供了嘌呤环上的N3及N9两个原子;天冬氨酸提供N1;甘氨酸提供N7、C4和C5;CO2提供C6;甲酸盐提供C2和C8.
4647
复光活 切除(S OS 修复)48、的序列,将外显子的转录序列连接起来。
2、在3’末端连接上一
段约有20-200个腺苷酸的多聚腺苷酸(poly A )的“尾巴”结构;3、在5’末端连接上一个“帽子”结构;4、在内部少数腺苷酸的腺嘌呤6位氨基发生甲49
、密码3、密码的简并性;4、密码的摆动性;5、密码子的相对通用性;6、起始密码50
起51转肽和移位。
52就是D NA 锁、在信息传递中以一个单位起作用而协调表达的遗传结构,也就是能够决定一个独立生化功能的相关基因表达的调节单位。
包括:结构基因、启动基因和操纵基因。
6
1.生物学活;3.生物化
αα;
1.DNA 的碱基
2. DN A 的双1.天然聚脱氧核苷酸链组成,一条链的走向为5’到3’,另一条为3’到5’;2.作为不变成分
的磷酸和脱氧核糖骨架位于外侧,作为可变成分的碱基位于内侧;3.螺旋的直径为2nm ,相邻碱基平面的垂直距离为0.34nm 。
10. rRNA (场所; tRNA (转运RNA )
在蛋白质合成时起着携带活化氨基酸的作用;mRNA (信使 RNA) 在蛋白质合成中起着模板的作用,编码氨基酸。
酶催化具有
高效度专一性;3.酶催化的条件温和;4.酶活性的可调控子有关。
绝对专一性;2.
性。
16.酶的抑制剂中抑制作用的类型:可逆的抑制作用:不可逆的抑制作用。
可你抑制作用类型:1.竞争性抑制作用;2.非竞争性抑制作用;3.反竞争17
反物、Km 是质有关,不受底物浓度和酶浓度的影响;2、Km 的大小近似的反应了酶与底物结合亲和力的大小;3、如果一种酶可以催化几种底物发生反应,就必然对每一种底物各有一个特定的K m ;4
、如果已知某个酶的K m ,可由所求的反应速度,求出应当加入底物的合理浓度;也可根据已知的底物浓度求出该条件下可以达到的反应速度;5、Km 可以帮助推测某一个代谢反应的活性中心在通常占整个酶分子体积的1-2%;2.酶的活性中心具有三维空间结构,酶的空间结构决定了酶活性中心的空间结构;3.构成酶活性中心的氨基酸,通常在一级结构上相隔很远,但由于折叠和卷曲而彼此相互靠近,形成具有特定空间结构的区域;
4.酶的活性中心与底物形状不是正好互补的;
5.酶活性中心位于酶分子表面的裂缝内;
6.底物通过较弱的次级键与酶结合;
7.酶的活性中心具有柔性或可运动性。
1、与活化分子数增多,酶促反应速度加快,对于许多酶
来说,温度系数Q10多为1-2,也就是说每增高反应温度10摄氏度,酶反应速度增加1-2倍;2、由于酶是蛋白质,随着
温度升高而使酶逐渐变性,即通过酶活力的减少而降低酶的反应速度。
1
、膜的不对
铁-硫蛋白色素
较大的传递体依次通过电正性较大的传递
物Ⅲ的电子传递;氰化物、叠氮化物、一氧化碳和硫化氢阻断细胞色素a a3至341
、2、氧化功能;3、糖酵解途径中形成的许多中间产物,可作为合成其他物质351、
A TP 的途径 ;
2、糖类、蛋白质、脂类、核酸等代
谢的枢纽。
3、为生物体内多种物质36物体内多种代谢反应,发挥着不同的作用;2、磷酸戊糖途径中的许多中间产物是某些生物合成的原料;3、必要时提供能量;4
、磷酸分解和α-
酮酸成糖、酮体或脂肪酸;3、氧化降解产能。
胺的代谢去向:1、胺类物质的氧化;2 435’-核糖,在此基础上逐步进行嘌呤环的“组装”。
首先形成IMP (次黄嘌呤核苷酸),以后再转化为其它各种嘌呤核苷酸。
嘌呤环各组成成分来源
:合成嘌呤环前体分子中的谷氨酰胺,它提供了嘌呤环上的N3及N9两个原子;天冬氨酸提供N1;甘氨酸提供N7、C4和C5;CO2提供C6;甲酸盐提供C2和C8.
4647
复光活 切除(S OS 修复)48、的序列,将外显子的转录序列连接起来。
2、在3’末端连接上一
段约有20-200个腺苷酸的多聚腺苷酸(poly A )的“尾巴”结构;3、在5’末端连接上一个“帽子”结构;4、在内部少数腺苷酸的腺嘌呤6位氨基发生甲49
、密码3、密码的简并性;4、密码的摆动性;5、密码子的相对通用性;6、起始密码50
起51转肽和移位。
52就是D NA 锁、在信息传递中以一个单位起作用而协调表达的遗传结构,也就是能够决定一个独立生化功能的相关基因表达的调节单位。
包括:结构基因、启动基因和操纵基因。
