高中化学无机推断 集锦
高三化学无机化合物推断归纳

颜色现象篇:1.焰色反应:Na 、K2. FeS(黑色,s)↑Fe 3O 4(黑色,s)←Fe →Fe 2+(浅绿色)→Fe (OH )2(白色↓)→Fe (OH )3(红褐色↓)→Fe 2O 3(红棕色)↓Fe 3+(棕黄色)→Fe (SCN )3(血红色,aq )3.Cu (红色s )→Cu 2+(蓝色)→Cu (OH )2(蓝色↓)→Cu 2O(砖红色↓) ↓CuO(黑色,s)←Cu 2(OH)2CO 3(铜绿,s)CuSO 4(白色,s)→CuSO 4.5H 2O(蓝色晶体) 4.黄色:AgBr 、AgI 、Ag 3PO 4、S 、Na 2O 2、 白色:AgCl 、BaSO 4、CaCO 3、Fe (OH )2黑色:Ag 2O 、MnO 2、CuO 、C 、Ag 2S (其他硫化物)5.KMnO 4(紫黑色,s)、MnO 4—(紫红色)、Br 2、NO 2(红棕色↑)、Cl 2(黄绿色↑) 置换篇① 2F 2 + 2H 2O == 4HF + O 2 ②2H 2S + O 2(不足) 2S + 2H 2O③ SiO 2+ 2C Si + 2CO ↑④C + H 2O CO + H 2⑤SiCl 4 + 2H 2Si + 4HCl ⑥8Al + 3Fe 3O 44Al 2O 3 + 9Fe⑦2Al + 2NaOH + 2H 2O == 2NaAlO 2 + 3H 2↑ ⑧2Mg + CO 22MgO + C⑨2Na + 2H 2O == 2Na OH + H 2↑⑩3Fe + 4H 2OFe 3O 4 + 4H 2↑联想篇1. 2Na + 2H 2O == 2Na OH + H 2↑联想:?+ H 2O=?+↑例如:K 、F 2、、C 、Fe 、Na 2O 2、Mg 3N 2 、Al 2S 3、CaC 22. NaOH O Na O Na Na OH O O −−→−−→−−→−222222(固体) 联想:)(222酸或碱D C B A OH O O −−→−−→−−→−323222HNO NO NO NH O H O O −−→−−→−−→−(气体) 42322222SO H SO SO S S H OH O O −−→−−→−→−→−(气体) 322222CO H CO CO C O H O O −−→−−→−−→−(固体)3.联想:A 为弱酸的铵盐:(NH 4)2CO 3或NH 4HCO 3;(NH 4)2S 或NH 4HS ;(NH 4)2SO 3或NH 4HSO 3⎪⎩⎪⎨⎧−−→−−−→−偏铝盐铝盐NaOHHClAl 、Al 2O 3、Al(OH)3→ ⎪⎩⎪⎨⎧−−→−−−→−C B NaOH HClA →4.联想:A+B=↓+↑例如Fe 3+与HCO 3-或CO 32-、Ba(OH)2与(NH 4)2SO 4或(NH 4)2CO 3或(NH 4)2SO 3、Na 2S 2O 3与强酸5.Al 3+→Al(OH)3白色沉淀→NaAlO 2沉淀溶解 联想:A →↓→沉淀溶解例如CO 2与Ca(OH)2、氨水与AgNO 3、强酸与偏铝酸盐 6. Cl 2 + 2OH —== Cl O —+ Cl —+ H 2O 联想:单质+强碱:S 、Al 、Si 、F 27.品红联想:使品红褪色有:Cl 2、次氯酸盐、过氧化钠、过氧化氢、活性炭等工业生产篇1. 煅烧石灰石:CaCO 3CaO+CO 22. 硫酸工业:4FeS 2+11O 2 8SO 2+2 Fe 2O 3.2SO 2 + O 2 2SO 3 SO 3+H 2O H 2SO 43. 合成氨:3H 2 + N 2 2NH 34. 氨的催化氧化:4NH 3+5O 24NO+6H 2O5. 工业制盐酸:H 2 + Cl 2 == 2HCl (点燃燃烧)6. 高炉炼铁:Fe 2O 3+3CO 3CO 2+2Fe7. 工业制水煤气:C + H 2O CO + H28.硅的冶炼与提纯:SiO 2+ 2CSi + 2CO ↑ Si + 2Cl 2SiCl 4SiCl 4 + 2H 2Si + 4HCl9侯氏制碱:(1)NH 3+H 2O+CO 2=NH 4HCO 3(2)NH 4HCO 3+NaCl=NH 4Cl+NaHCO 3↓()()()()()⎪⎩⎪⎨⎧↓−−→−↓+↑−−→−↓+↑−−→−-----+32322323233222OH Al AlO OH Al S H HS S OH Al CO HCO CO Al O H OH O H 与加热SO2褪色复原 燃烧10.电解饱和食盐水:2NaCl + 2HO 2NaOH + Cl2↑+ H2↑反应条件篇1.催化剂、加热条件下的反应2.高温条件下的反应3.通电(电解)条件下的反应。
高中化学无机推断框图题精选(精品)

1.下图为某些物质之间的变化关系(未注明用量的物质间均按恰好充分反应处理)已知A的焰色反应呈黄色,常温下,甲为能使湿润的红色石蕊试纸变蓝的气体,乙为可燃性气体,甲、乙分子中质子数相等。
(1) A的化学式是;乙的化学式是。
(2) X是一种纯净物,X的化学式是;C中含有、。
(填化学式)(3)能否确定B为何种物质?如果能,写出B的化学式;如果不能,请说明理由。
2.甲、乙、丙为短周期元素形成的常见单质,A、B、C、D、E、F、G、X均为常见的化合物。
B、X的式量(分子量)相同,E的式量比D大16,在一定条件下各物质之间相互转化如下图所示:(1) X的电子式是,G的化学式是。
(2)上述物质中能与水发生反应(不考虑单纯的盐的水解)且反应中水既不是氧化剂也不是还原剂的物质的代号是。
(3)反应“D+丙”的化学方程式是。
(4)写出X与D在稀硫酸中反应的离子方程式。
3.甲、乙、丙三种常见的单质,X、Y、Z三种常见的化合物,它们在一定条件下的相互转化关系如下:请填写以下空白:(1)在X、Y、Z三种化合物中肯定含有乙、丙两种元素的化合物是。
(2)在X、Z两种化合物的正价元素的化合价中,是。
A.前者高B.后者高C.不一定原因是。
(3)当X为两种非金属元素组成的化合物时,写出X跟甲反应的化学方程式。
写出丙跟乙反应的化学方程式。
(4)当X为金属元素与非金属元素组成的化合物时,写出X跟甲反应的化学方程式。
写出丙跟乙反应的化学方程式。
4.有X、Y、Z三种单质,常温下X是固体,Y是液体,Z是气体。
它们之间的反应关系如下图所示:请填写下列空白:(1)据此推断X、Y、Z的化学式:X 、Y 、Z 。
(2) X是常见的单质,它是主族元素,还是副族元素,其理由是:。
(3)写出C+Y → A的离子方程式:。
5.根据以下反应关系图,回答下列问题:(1) A溶液所含溶质是:________________________;(2) A溶液跟B溶液反应的化学方程式是:_______________________________;(3) G转变为E的离子方程式是:__________________________________________。
第28题无机推断题-2023年7月浙江省普通高中学业水平考试化学分题(原卷版)

浙江省普通高中学业水平考试选择题第28题无机推断题【题前知道】常见物质的物理性质(物质的颜色、溶解性、密度等)、化学性质、氧化还原反应、分解反应、物质的检验、物质的量计算、质量守恒定律等知识。
具体考查卤族元素的单质及化合物、钠镁铝单质及化合物、氧硫单质及化合物、铁铜单质及化合物的性质及转变。
考查内容:推导物质的化学式、某一转化过程的化学方程式或离子方程式、某一步在操作时要注意的问题等。
一般要推导的无机物不太常见。
如:K2FeO4,KFeO2,Na2S2O3,S2Cl2,KO2,K2S2O8,CuCl,NaN3,CuH,K2S X(X=16),KI3,FeC2O4,Cu2(OH)2SO4,FeC2O4·2H2O,Na2S2O8等。
解题思路:先审题,阅读题目所给的流程图,找到有用的信息,如物质的颜色、性质等,确定物质是什么,根据已知物质确定要推导物质的组成元素是什么,根据给出物质一般为沉淀如硫酸钡,氧化铜,氧化铁等或气体如NH3、CO2的质量算出物质的量,推导出未知物质的组成元素或原子团的物质的量,再根据质量守恒,计算出各元素或原子团的物质的量,物质的量之比就是物质组成各元素原子或原子团的个数之比,推导出该物质的化学式。
如果求算出原子团或原子个数之比不符合电荷守恒,则所推导的物质中还有其它原子或原子团,如碱性盐还有OH等。
沉淀的颜色是一个重要的信息,可以推导出组成的元素或离子。
常考有颜色的离子或物质有:含Cu2+物质的水溶液或含有结晶水的物质为蓝色。
含Fe2+的水溶液为浅绿色,该溶液能使酸性高锰酸钾溶液或氯水溴水褪色。
Fe3+的水溶液为黄色,与KSCN溶液变血红色溶液,通入SO2气体黄色变浅绿色。
Fe2O3为红色(红棕色固体)。
CuO为黑色固体。
Cu2O为砖红色固体。
FeS2为黄色固体。
BaSO4和AgCl白色沉淀。
【真题回顾】1.(2022年7月浙江学考)盐X为某种矿石的主要成分,仅含四种元素,不含结晶水。
高中化学无机推断题带答案
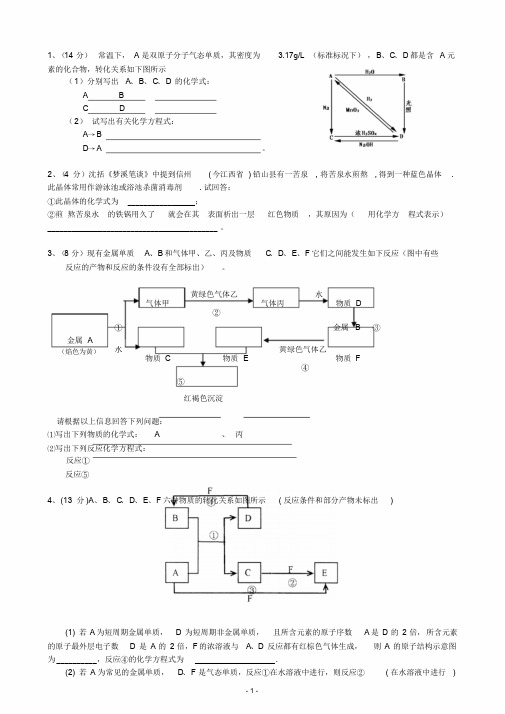
1、(14 分)常温下, A 是双原子分子气态单质,其密度为 3.17g/L (标准标况下),B、C、D 都是含 A 元素的化合物,转化关系如下图所示(1)分别写出A、B、C、D的化学式:A BC D(2)试写出有关化学方程式:A→BD→A 。
2、(4 分)沈括《梦溪笔谈》中提到信州(今江西省) 铅山县有一苦泉, 将苦泉水煎熬, 得到一种蓝色晶体. 此晶体常用作游泳池或浴池杀菌消毒剂. 试回答:①此晶体的化学式为_________________;②煎熬苦泉水的铁锅用久了就会在其表面析出一层红色物质,其原因为(用化学方程式表示)___________________________________________ 。
3、(8 分)现有金属单质A、B 和气体甲、乙、丙及物质C、D、E、F 它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
黄绿色气体乙水气体甲气体丙物质 D②①金属 B ③金属 A(焰色为黄)水黄绿色气体乙物质 C 物质 E 物质 F④⑤红褐色沉淀请根据以上信息回答下列问题:⑴写出下列物质的化学式: A 、丙⑵写出下列反应化学方程式:反应①反应⑤4、(13 分)A、B、C、D、E、F 六种物质的转化关系如图所示( 反应条件和部分产物未标出)(1) 若A 为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数 A 是D的2 倍,所含元素的原子最外层电子数D是A的2 倍,F 的浓溶液与A、D反应都有红棕色气体生成,则A的原子结构示意图为__________,反应④的化学方程式为____________________.(2) 若A 为常见的金属单质,D、F 是气态单质,反应①在水溶液中进行,则反应②( 在水溶液中进行)- 1 -的离子方程式是____________________,已知常温下1g D 与F 反应生成B(气态)时放出92.3kJ 热量,写出反应的热化学方程式____________________ .(3) 若A、D、F 都是短周期非金属元素单质,且A、D所含元素同主族,A、F 所含元素同周期,则反应①的化学方程式为____________________,B 固体属于__________晶体.5. (10 分)短周期常见元素形成的纯净物A、B、C、D、E 的转化关系如下图所示,物质 A 与物质 B 之间的反应不在溶液中进行( E 可.能.与A、B两种物质中的某种相同)。
新思维高中化学无机推断知识总结

新思维高中化学无机推断知识总结1、物质颜色红色:Fe2O3、Fe(OH)3、[Fe(SCN)]2+、Cu2O、Cu、NO2、Br2(g)、P;橙色:Br2的溶液;黄色:S、Na2O2、AgBr、AgI、Ag3PO4、Fe3+(aq)、久置浓HNO3;绿色:Fe2+(aq)、绿矾、铜绿、浓CuCl2、Cu+浓HNO3;蓝色:Cu2+(aq)、胆矾、Cu(OH)2;紫色:石蕊、KMnO4、I2(g);黑色:多数过渡金属的氧化物以及硫化物、C、Fe等;白色:CaCO3、BaSO4、AgCl、Mg(OH)2、Al(OH)3、MgO、Al2O3。
2、物质状态液态单质:Br2、Hg;液态化合物:H2O、H2O2、H2SO4、HNO3等;气态单质:H2、N2、O2、F2、Cl2等;气态化合物:C、N、S的氢化物及氧化物等。
3、反应现象或化学性质(1)焰色反应:黄色—Na;紫色(钴玻璃)—K。
(2)与燃烧有关的现象:①火焰颜色:苍白色:H2在Cl2中燃烧;(淡)蓝色:H2、CH4、CO 等在空气中燃烧;黄色:Na在Cl2或空气中燃烧;②烟、雾现象:棕(黄)色的烟:Cu或Fe 在Cl2中燃烧;白烟:Na在Cl2或P在空气中燃烧;③白雾:有HX等极易溶于水的气体产生;④白色烟雾:P在Cl2中燃烧。
(3)沉淀特殊的颜色变化:白色沉淀变灰绿色再变红褐色:Fe(OH)2→Fe(OH)3;白色沉淀迅速变棕褐色:AgOH→Ag2O。
(4)使湿润的红色石蕊试纸变蓝的气体:NH3;(5)能使品红溶液褪色加热后又复原的气体:SO2;(6)在空气中迅速由无色变成红棕色的气体:NO;(7)使淀粉溶液变蓝的物质:I2;(8)能漂白有色物质的淡黄色固体:Na2O2;(9)在空气中能自燃的固体:P4;(10)遇SCN-变红色、OH-产生红褐色沉淀、苯酚显紫色的离子:Fe3+;(11)不溶于强酸和强碱的白色沉淀:AgCl、BaSO4;(12)遇Ag+生成不溶于硝酸的白色、浅黄色、黄色沉淀的离子分别是:Cl-、Br-、I-。
高中化学推断题100题
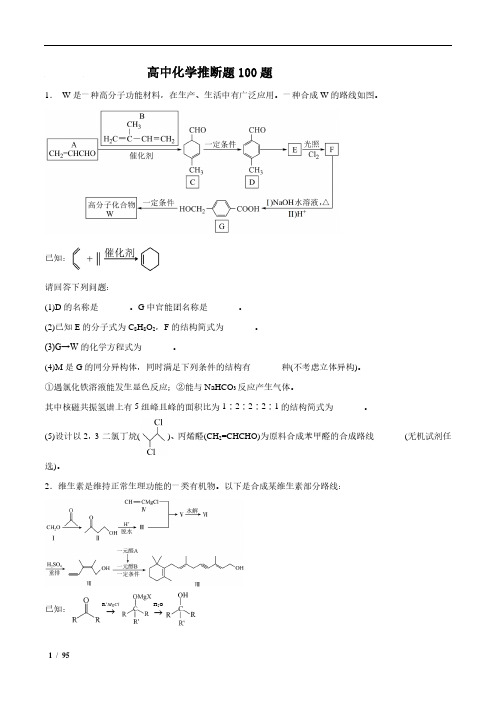
高中化学推断题100题1. W 是一种高分子功能材料,在生产、生活中有广泛应用。
一种合成W 的路线如图。
已知:请回答下列问题:(1)D 的名称是_______。
G 中官能团名称是_______。
(2)已知E 的分子式为C 8H 8O 2,F 的结构简式为_______。
(3)G→W 的化学方程式为_______。
(4)M 是G 的同分异构体,同时满足下列条件的结构有_______种(不考虑立体异构)。
①遇氯化铁溶液能发生显色反应;②能与NaHCO 3反应产生气体。
其中核磁共振氢谱上有5组峰且峰的面积比为1∶2∶2∶2∶1的结构简式为_______。
(5)设计以2,3-二氯丁烷()、丙烯醛(CH 2=CHCHO)为原料合成苯甲醛的合成路线_______(无机试剂任选)。
2.维生素是维持正常生理功能的一类有机物。
以下是合成某维生素部分路线:已知:R MgCl'→2H O→(1)化合物Ⅶ的分子式为________,该分子中处在同一平面的碳原子数为________。
(2)分析一元醛A 的结构特征,预测其可能的化学性质,完成下表 序号 结构特征 反应的试剂 反应形成的新结构 反应类型① -CHO Ag(NH 3)2OH _____ _____ ②_____________________(3)写出由化合物Ⅲ和Ⅳ反应生成化合物V 的方程式:________。
(4)化合物Ⅱ的同分异构体中能发生银镜反应但不能发生水解反应的共________种,其中核磁共振氢谱有3组峰,且峰面积比为6:1:1的同分异构结构简式为________。
(5)聚苯乙烯树脂是一种良好的保温材料,请以苯甲醛为原料,设计路线合成其单体苯乙烯____,其他试剂任选。
3.化合物H 是用于合成某种镇痛药的医药中间体,利用烃A 合成H 的某路线如下图所示:已知:Fe/HCl22R NO R NH ⎯−−⎯⎯→ 回答下列问题:(1)A 的化学名称为___________;D 中的官能团名称为___________。
高中化学无机推断总结及题

“无机框图推断题”题眼方法一:根据物质的特殊颜色推断知识准备:物质颜色1.有色固体:白色:Fe(OH)2、CaCO3、BaSO4、AgCl、BaSO3、铵盐,白色或黄色腊状固体:白磷淡黄色或黄色:S 黄或浅黄、FeS2黄、AgI 黄、Au 黄、Na2O2 浅黄、AgBr 浅黄、Ag3PO4浅黄等。
红色或红棕色:Cu 紫红、Cu2O 红、Fe2O3红棕色、Fe(OH)3红褐色。
黑色:C、CuS、Cu2S 、FeS 、MnO2、FeO、Fe3O4(磁性物质)、CuO、PbS 、Ag2O棕黑、紫黑色:I2紫黑、KMnO4紫黑。
2.有色溶液:Cu2+蓝、MnO4-紫红、Fe2+浅绿、Fe3+ 棕黄、Fe(SCN)3血红、NO2-浅黄。
氯水浅黄绿色、溴水橙黄色、碘水棕黄色、溴的有机溶液橙红—红棕、I2的有机溶液紫红3.气体小结1、有颜色的气体:F2(淡黄绿色),Cl2(黄绿色),NO2(棕色),溴蒸气(红棕色)、I2(紫色)、O3(淡蓝色)。
其余均为无色气体。
2、有刺激性的气体:HF,HCl,HBr,HI,NH3,SO2,NO2,F2,Cl2,溴蒸气。
有臭鸡蛋气味的气体:H2S3、易溶于水的气体:HF,HCl,HBr,HI,NH3,SO2和NO2。
能溶于水的气体:CO2,Cl2,H2S和溴蒸气。
@4、易液化的气体:NH3,SO 2,Cl25、有毒的气体:F2,HF,Cl2,H2S,SO2,CO,NO,NO2和溴蒸气。
6、在空气中易形成白雾的气体:HF,HCl,HBr,HI7、常温下由于发生化学反应而不能共存的气体:H2S和SO2,H2S和Cl2,HI和Cl2,NH3和HCl,NO和O2,F2和H28、其水溶液呈酸性且能使紫色石蕊试液变红色的气体:HF,HCl,HBr,HI,H2S,SO2,CO2,NO2和溴蒸气。
可使紫色石蕊试液先变红后褪色的气体:Cl2。
可使紫色石蕊试纸变蓝且水溶液呈弱碱性的气体:NH39、有漂白作用的气体:Cl2(有水时)和SO2。
高三化学总复习无机推断专题

高三总复习无机推断专题1、A、B、C、D是原子序数由小到大的短周期元素。
已知C和D可形成化合物X,A 和B可形成化合物Y,将少量..X和过量..Y一起放入水中,可放出一种无色无嗅的气体单质,同时得到一种无色澄清的溶液。
向此溶液中滴加过量..X的水溶液时,可生成一种白色胶状沉淀物Z(Z与Y的相对分子质量相等........),过滤后得到一种无色澄清溶液,其中含G,G在焰色反应中火焰呈黄色,向G的水溶液中加入酸化的硝酸银溶液时,能生成一种白色沉淀物,根据以上推断,请完成下列填空:(1)X的化学式是,Y的化学式是。
(2)4molX与6molY在水溶液中发生反应的化学方程式为:。
(3)生成白色胶状沉淀物Z的离子反应方程式为:2、已知B、C为常见的两种金属单质,E、I为常见的两种非金属单质,反应②为D 的浓溶液与C在加热条件下的反应。
P溶液和G溶液中具有相同的阳离子。
请根据要求回答下列问题:(1)写出I的化学式。
(2)写出反应①中阴极发生的电极反应式:,写出反应①的化学反应方程式:。
(3)写出反应④的离子反应方程式:,写出反应⑤的离子反应方程式:,写出反应⑥的离子反应方程式:。
(4)每生成1mol气态K,反应放出98.3kJ热量,该反应的热化学方程式为:。
3、物质A、D及F的水溶液均呈黄色,D是单质,F的溶液遇苯酚显紫色,A是一种重要工业生产中的主要原料。
且A、C、D均含有某一非金属元素,C的相对分子质量与过氧化氢的相对分子质量相等。
反应过程中生成的水等与转化无关的物质已经略去。
这些物质有以下转化关系。
试回答以下问题:(1)A是,C是,F是 (均填化学式)。
(2)A与热盐酸反应的离子反应方程式为(3)写出该框图中由B→E的化学反应方程式4、已知A、B、C、D为中学常见的气体单质,甲、乙、丙、丁为常见的化合物,甲的水溶液呈碱性。
它们之间有如图所示的转化关系(部分产物及反应条件已略去)。
请回答:(1)乙的名称为,丙转化丁的离子方程式为。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
EE气体乙点燃溶液BA、C均为气体,E为液体,下图中箭头上的反应物和反应条件均已略去。
(1)写出下列物质的化学式:B ;D 的同素异形体 (2)写出A 的电子式 ;E 的结构式(3)指出反应①、②、③是吸热反应,还是放热反应① ② ③(4)完成下列反应方程式:反应⑤的离子方程式: 反应④的化学方程式: 12、甲、乙、丙是由短周期元素形成的常见单质,丙在常温下为无色气体,且乙、丙两元素同主族,其余均为常见化合物,它们在一定条件下有如下转化关系:(反应中生成的水已略去)←(1)丙的名称是 ;C 的化学式是 ;X 属 晶体。
(2)A+D →C 的反应属于下列何种反应类型(填序号) 。
A .化合反应 B .氧化还原反应 C .非氧化还原反应 D .离子反。
A .化合反应 B .氧化还原反应 C .非氧化还原反应 D .离子反应 (3)工业生产中,将D 转化为E 的反应条件是 。
(4)写出A 与H 2O 反应的化学方程式: 。
(5)若用如图装置来证明A 和H 2O 的反应: ①是放热反应,②生成了丙。
简单合理的实验 操作是:① ; ② 。
13、(1)A +、B +、C -、D 、E 代表5种微粒(分子或离子),它们分别含10个电子,已知它们有如下转化关系:A ++C -=D+E B ++C -=2D ①A +的电子式为 ;E 分子的空间构型为 。
②C -、D 、E3种微粒结合质子(H +)的能力由强到弱的顺序为(用微粒的化学式表示) ;其理由是(用两个离子方程式表示) , 。
14、已知A ~K 所代表的各物质都是中学化学里常见的物质,且I 是具有磁性的物质,D 和K 都具有两性。
一定条件下,各物质间的相互反应转化关系如下图所示:请回答:(1)写出有关物质化学式:D 是 ,H 是 。
(2)写出下列反应的方程式:①化合物G 的溶液不呈中性,其原因用离子方程式表示为 ,②C+F −→−H +I 。
15、如下图所示,A 、B 、C 、D 、E 五种物质的相互转化关系请回答: (1)若A 通常状态下为固态单质,A →E 分别为(写化学式)A ;B ;C ;D ;E 。
(2)若A 通常状态下为气态单质,则A →E 分别为(写化学式)A ;B ;C ;D ;E 。
(3)写出(2)中物质间转化的离子方程式E →C 16、根据如下转化关系 回答下列问题:(1)物质的分子式:A 、B 、C 、D 、E 、F 。
(2)写E →F 的离子方程式 。
17、A 、B 、C 为三种不溶于水,透明、坚硬的固体。
A 在氧气中完全燃烧只得到一种无色、无臭、密度为氧气密度的1.375倍(标准状况)的气体。
B 的粉末易溶于热的苛性钠溶液,向此溶液中加入过量盐酸时,析出一种不溶于水,酸性比碳酸还弱的酸。
将B 与石灰石,纯碱按一定比例混合高温溶融后得C 。
C 在高温下能软化,但无固定的熔点。
根据以上事实回答:(1)A 、B 、C 的名称:A B C (2)写出有关化学反应的方程式:X 甲乙 A D C B E 丙 + +丙 点燃 +丙 点燃 +丙 一定条件+H 2O回答下列问题:(1)K可能属于的晶体类型是________________。
(2)写出化学式:单质B__________,化合物F____________。
(3)写出下列反应的离子方程式:反应⑤:________ _____反应⑥:_________________________(4)反应④的化学方程式为:________________________A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。
可发生电化腐蚀,写出正极上的电极反应式: 。
(2)将少量W 的饱和溶液滴入热的X 中,反应的化学方程式是 (3)若Z 、W 两溶液的pH 均等于5,则两溶液中由水电离出的H +的物质的量浓度之比为 。
(4)已知5.6L (标准状况)气体丙在甲中完全燃烧放出热量为71.45kJ ,则能正确表示丙燃烧热的热化学方程式为 。
24、图表示A 、B 、C 、D 、E 五种含氮物质相互转 化的关系图。
其中A 、B 、C 、D 常温下都是气体, B 为红棕色,写出A 、B 、C 、D 、E 的化学式和有 关反应的化学方程式。
(1)各物质的化学式为:B. , D. ,(2)写出A →C 的化学方程式和E →C 的离子方程式: A →C : E →C :25、A 、B 、C 、D 为四种单质,常温时,A 、B 是气体,C 、D 是固体。
E 、F 、G 、H 、I 为五种化合物,F 不溶水,E 为气体且极易溶水成为无色溶液,G 溶水得黄棕色溶液。
这九种物质间反应的转化关系如图所示(1)写出四种单质的化学式A_________ B__________ C______ D________ (2)写出E +F →H +I 的离子方程式26、以下三例是常见的化学实验①将通入澄清的石灰水,溶液先浑浊,后澄清CO 2②将稀盐酸逐滴滴入溶液,开始时无现象,后产生气体Na CO 23③将溶液逐滴滴入溶液,先产生白色沉淀,后沉淀消失NaOH AlCl 3回答下列问题: (1)每例中均可用前后两个化学反应方程式来说明变化的现象,试用简要文字,说明这两个反应间的关系______________________(2)每例中若要保证后一个反应发生,必须具备的条件是什么?(3)将各例中前后两个反应方程式叠加,写出一个总的反应方程式。
①___________________________________________________ ②___________________________________________________ ③___________________________________________________27、物质A —H 有下图所示转化关系(部分反应物、生成物没有列出)。
其中,B的浓溶液与单质X 在加热时才能发生反应①,B 的稀溶液与足量X 发生反应②,向C 溶液中滴入KSCN 溶液呈红色。
试填写下列空白:(1)晶体A 是(化学式)________________________。
(2)反应②的离子方程式:______________________。
(3)根据图示信息判断,足量B 的浓溶液与单质X 共热时能否产生E ,说明理由(写出化学方程式回答):____________________。
(4)在反应⑤中,若生成物G 与H 的物质的量之比为4∶1,写出F 溶液与Na 2O 2反应的化学方程式:_______________________。
28、X 、Y 、Z 、W 4种元素都位于短周期, 且原子序数X<Y<Z<W, X 原子与Y 原子的最外层电子数的和跟Z 原子最外层电子数相等, X 原子半径为其阳离子半径的约倍, W 和Y 原子最外层电子数的和为Z 原子最外层电子数的2倍, W 原子的最外层电子数为电子层数的3倍, 写出(1)的电子式__________ ___,(2)X 、Y 、Z 、W 组成的盐, 其原子数比为4:1:1:2, 其名称是________, 结构简式是__________。
29、A 、B 、C 是三种短周期元素的单质,甲、乙是两种常见的化合物。
这些单质和化合物之间存在如右图所示的关系:据此判断:(1) 若单质A 是_____ ___,则单质B 、C 分别为________、________。
(2) 若单质A 是________,则单质B 、C 分别为________、________。
(1)写出下列物质的化学式:试剂x__________、试剂z__________。
晶体E________、固体G_________ (2)写出下列反应的离子方程式:沉淀A+试剂y:__________________滤液D+过量2CO:________________32、已知某些金属氧化物跟熔融烧碱反应可生成盐。
根据下图所示化学反应回答下)单质F的化学式为___________________________。
)写出下列反应的离子方程式C+L—→F+E H+L(过量)—→I)C+L—→E+F,若L改用浓酸,则不能选用的浓酸是_________________。
下列图式中A——N代表的各物质均为中学化学中常见物质,它们在一定条件下有如下转化关系:试写出有关反应的化学方程式(有机物写结构简式)试回答:=AgCl(3)①放热反应②放热反应③放热反应(4)2Fe3++S02十2H2O=SO42-十2Fe2++4H-(5)0.2 mol12、(1)氧气;Na SO;离子。
(2)A、B。
(3)400℃~500Al 4NO2NH323233NOO39、(1)A 是Na 2S 2O 3 E 是FeS X 是HCl(2)①S 2O 32-+2H +===S ↓+SO 2+H 2O⑤2Fe 3++H 2S ===2Fe 2++S ↓+2H +⑥SO 2+2Fe 3++2H 2O ====SO 42-+2Fe 2++4H +40、(1) A 为Na 2SiO 3(2分)B 为BaC 2l 。
(2) [1]--+↑+↑+OH H cl O H cl 222222通电[2]-++↓=++cl H BaSO O H cl SO B a 224223[3] --+++=++24222242SO cl H O H so cl41、⑴Mg ; ⑵NaCl (饱和)+NH 3+CO 2+H 2O==NaHCO 3↓+NH 4Cl ;⑶MgCl 2溶液必须在氯化氢气体中进行蒸发结晶制得MgCl 2晶体,熔融后电解才能制取金属镁42、⑴ MgO 、Mg 3N 2、C N ≡N ⑵ 4NH 3 + 5O 2 △ 4NO + 6H 2O 2NH 3 + 3CuO △N 2 + 3Cu + 3H 2O ⑶ 4NH 3 + 6NO = 5N 2 + 6H 2O。
