有机化学--ch4b
有机化学物 化学式

有机化学物化学式:甲烷:CH4甲烷氧化反应:CH4 + 2O2——点燃——CO2 +2H2O甲烷取代反应:CH4+Cl2----光---CH3Cl+HCl (无色气体)CH3Cl+Cl2----光----CH2Cl2+HCl (难溶于水的无色液体)CH2Cl2+Cl2----光----CHCl3+HCl (氯仿,有机溶剂)CHCl3+Cl2----光----CCl4+HCl (四氯化碳,有机溶剂)烷烃通式:CnH2n+2烷烃CnH2n+2燃烧通式:CnH2n+2---点燃---nCO2+(n+1)H2O 乙烯:C2H4乙烯氧化:CH2=CH2+3 O2---点燃--- 2CO2+H2O乙烯的加成反应:和氢气反应:C2H4+H2=C2H6和氯气反应:C2H4+Cl2=CH2ClCH2Cl和氯化氢反应:C2H4+HCl=CH2ClCH3和水反应:C2H4+H2O=CH3CH2OH使溴的四氯化碳溶液褪色:CH2=CH2 + Br2 → CH2Br-CH2Br烯烃通式:CnH2n烃CnH2n完全燃烧通式:CnHm+(n+m/4)O2---点燃---nCO2+(m/2)H2O苯:C6H6苯燃烧:2C6H6+15O2---点燃---12CO2+6H2O(在空气中剧烈燃烧,燃烧时产生橙黄色火焰,并有大量黑烟)乙醇:C2H6O或C2H5OH(-OH 羟基)乙醇燃烧:C2H60+3O2---点燃---2CO2+2H2O乙醇跟金属钠反应:2CH3CH2OH+2Na----2CH3CH2Na+H2↑乙醇在铜或银做催化剂的条件下,可以与空气中的氧气氧化为乙醛:铜或银2CH3CH2OH+O2-----------------2CH3CHO+2H2O加热乙醇还可以与酸性高锰酸钾溶液或重铬酸钾(K2Gr2O7)溶液反应被直接氧化成乙酸。
乙酸:分子式(C2H4O2,结构简式为CH3COOH,乙酸的官能团为:(—COOH)羧基。
有机化学【烷烃】

烃
二烯烃 如 CH2=CH-CH=CH2
闭链烃 (环 烃)
脂环烃 如 芳(香)烃 如
烷烃的定义:
开链烃亦称脂肪烃。如果其分子中的碳 原子之间都以单键(C-C)相连,其余的 价键都为氢原子所饱和,则称为烷烃,也称 为饱和烃或石蜡烃。
一、烷烃的通式、 同系列和构造异构
烷烃的分子式和构造简式:
CH3CH2CH2_ CH CH2 CH CH2CH2CH2CH3
CH3 CH
CH2
CH3
CH2
CH3
6-丙基-4-异丙基癸烷
命名练习:
1C (. H 3 ) C 2 H C H C 2 H C 2C (H 3 ) 3
2.
3.
1 2 34 56 7 8 9
CH3CH2C CH HC 2H21C CH HC C 2H H22C C 3H H23CH2CH3 CH3 CH2CH3
如果含有几个不同取代基时,取代基 排列的顺序,是将“次序规则” 所规定的 “较优”基团列在后面。
•几种烃基的优先次序为:
•(CH3)3C—> (CH3)2CH— > CH3CH2CH2— > CH3CH2— > CH3—
例:
CH3 CH CH2 CH CH2 CH3
CH3
CH2CH3
2-甲基-4-乙基己烷
例: CH3CH2CH2CH2CH2CH3 (正己烷)
CH3CHCH2CH2CH3 CH3
CH3 CH3—C—CH2 CH3
CH3
(异己烷) (新己烷)
(2)系统命名法:
我国现在使用的有机化合物系统命 名法是参考国际纯粹和应用化学联合会
(International Union of Pure and Applied Chemistry 简称IUPAC)制定的 命名原则,并结合我国的文字特点于1960 年制定,1980年由中国化学会加以增减修 订的《有机化学命名原则》。
有机化学-第五版答案(完整版)

《有机化学》(第五版,李景宁主编)习题答案第一章3、指出下列各化合物所含官能团的名称。
(1) CH3CH=CHCH 3答:碳碳双键(2)CH3CH2Cl答:卤素(氯)(3)CH3CHCH 3OH答:羟基(4) CH3CH2 C=O答:羰基 (醛基 )HCH3CCH3(5)O答:羰基 (酮基 )(6) CH3CH2COOH 答:羧基(7)NH 2答:氨基(8) CH3-C≡C-CH3答:碳碳叁键4、根据电负性数据,用和标明下列键或分子中带部分正电荷和负电荷的原子。
答:6、下列各化合物哪个有偶极矩?画出其方向( 1)Br2()2Cl 2()()CHCl3(5)CH3OH()332CH 3 HI4 6 CH OCH 答:以上化合物中( 2)、( 3)、( 4)、( 5)、( 6)均有偶极矩(2)H2CCl (3)HI(4)HCCl3(5)H3COH(6)H3C OCH37、一种化合物,在燃烧分析中发现含有84%的碳 [Ar (C)=12.0]和 16 的氢 [Ar ( H)=1.0],这个化合物的分子式可能是(1)CH4O(2)C6H14O2(3)C7H16(4)C6H10(5)C14H22答:根据分析结果,化合物中没有氧元素,因而不可能是化合物( 1)和( 2);在化合物( 3)、( 4)、( 5)中根据碳、氢的比例计算(计算略)可判断这个化合物的分子式可能是( 3)。
第二章习题解答1、用系统命名法命名下列化合物(1) 2, 5-二甲基 -3-乙基己烷(3) 3, 4, 4, 6-四甲基辛烷(5) 3, 3, 6, 7-四甲基癸烷(6) 4-甲基 -3, 3-二乙基 -5-异丙基辛烷2、写出下列化合物的构造式和键线式,并用系统命名法命名之。
( 3)仅含有伯氢和仲氢的C5H12答:符合条件的构造式为CH3CH2CH2CH2CH3;键线式为;命名:戊烷。
3、写出下令化合物的构造简式(2)由一个丁基和一个异丙基组成的烷烃答: CH3CH2CH2CH2CH(CH 3)2(4)相对分子质量为 100,同时含有伯、叔、季碳原子的烷烃答:该烷烃的分子式为 C7H16。
有机化学课后习题答案

第一章绪论习题参考答案1. 某化合物的分子量为60,含碳%、含氮%、含氧%,确定该化合物的分子式;解:①由各元素的百分含量,根据下列计算求得实验式该化合物实验式为:CH2O②由分子量计算出该化合物的分子式该化合物的分子式应为实验式的2倍,即:C2H 4 O22. 在C—H、C—O、O—H、C—Br、C—N等共价键中,极性最强的是哪一个解:由表1-4可以查得上述共价键极性最强的是O—H键;3. 将共价键⑴ C—H ⑵ N—H ⑶ F—H ⑷ O—H按极性由大到小的顺序进行排列;解:根据电负性顺序F > O > N > C,可推知共价键的极性顺序为:F—H > O—H > N—H > C—H4. 化合物CH3Cl、CH4、CHBr3、HCl、CH3OCH3中,哪个是非极性分子解:CH4分子为高度对称的正四面体空间结构,4个C—H的向量之和为零,因此是非极性分子;5. 指出下列化合物所含官能团的名称和该化合物所属类型;碳碳三键,炔烃羟基 ,酚酮基 ,酮羧基 ,羧酸醛基 ,醛羟基 ,醇氨基 ,胺6. 甲醚CH3OCH3分子中,两个O—C键的夹角为°;甲醚是否为极性分子若是,用表示偶极矩的方向;解:氧原子的电负性大于碳原子的电负性,因此O—C键的偶极矩的方向是由碳原子指向氧原子;甲醚分子的偶极矩是其分子中各个共价键偶极矩的向量之和,甲醚分子中的两个O—C键的夹角为°,显然分子是具有极性的,其偶极矩的方向如下图所示;7. 什么叫诱导效应什么叫共轭效应各举一例说明之;研读教材第11~12页有关内容8. 有机化学中的离子型反应与无机化学中的离子反应有何区别解:无机化学中的离子反应是指有离子参加的反应,反应物中必须有离子;而有机化学中的离子型反应是指反应物结构中的共价键在反应过程中发生异裂,反应物本身并非一定是离子;第二章链烃习题参考答案1. 写出分子式为C6H14的化合物的所有碳链异构体的构造式,并按系统命名法命名;解:①所有可能的碳架如下:②所有异构体的构造式及名称:己烷 2—甲基戊烷 3—甲基戊烷2,3—二甲基丁烷 2,2—二甲基丁烷2. 写出下列化合物的结构式或名称,并指出分子中的1°、2°、3°、4°碳原子;3. 将下列化合物的结构式改写成键线式4. 写出分子式为C5H10的所有开链异构体的结构式,并用系统命名法命名;5. 完成下列反应式6. 用化学方法鉴别下列各组化合物1 乙烷、乙烯、乙炔解答:分别将三种气体通入溴水中,不能使溴水褪色的是乙烷;将能使溴水褪色的两种气体分别通入银氨溶液中,能使之产生白色沉淀的气体是乙炔,另一个是乙烯;2 丁烷、1—丁炔、2—丁炔解答:分别将三种待测物分别与高锰酸钾酸性溶液混合,不能使高锰酸钾紫红色褪色的是丁烷;将能使高锰酸钾褪色的两种待测物分别与银氨溶液混合,能使之产生白色沉淀的是1—丁炔,另一个是2—丁炔;3 1,3—丁二烯、1—丁炔解答:分别将两种待测物与氯化亚铜氨溶液混合,能使之产生棕红色色沉淀的是1—丁炔,另一个是1,3—丁二烯;7. 以乙炔、丙炔为原料,合成下列化合物其他试剂任选;1 1,2—二氯乙烷2 异丙醇3 2,2—二氯丙烷4 乙烯基乙炔5 丙酮6 苯7 乙烯基乙醚8. 如何除去乙烷中含有的少量丙烯解答:将含有少量丙烯的乙烷气体通入硫酸溶液中,其中的丙烯杂质因与硫酸发生加成反应而被吸收;9. 丁烷和异丁烷分子中哪个氢原子最容易发生卤代反应为什么解答:异丁烷分子中的叔氢原子最易发生卤代反应;有大量实验结果表明,在取代反应中,各种类型氢原子的反应活性顺序为:3°H > 2°H > 1°H ;10. 用杂化轨道理论简述甲烷、乙烯、乙炔的分子结构;解答:1 甲烷的结构根据杂化轨道理论,甲烷分子中的碳原子采取sp3杂化,4个价电子分别位于4个sp3杂化轨道中;4个sp3杂化电子云在空间呈正四面体排布,各个sp3杂化电子云的大头分别指向四面体的四个顶点;C与H成键时,4个H原子的s电子云沿着4个sp3杂化电子云的大头重叠形成4个s-sp3σ键,因此形成的甲烷分子是正四面体型的,键角为109°28/ ;2乙烯的结构乙烯分子中的碳原子采取sp2杂化,4个价电子中有3个分别位于3个sp2杂化轨道中,1个位于2p轨道中;3个sp2杂化电子云在空间呈平面三角形分布,各sp2杂化电子云的大头指向三角形的3个顶点,2p电子云对称轴垂直穿过3个sp2杂化电子云所在的平面;11. 乙烯和乙炔都能使溴水褪色,两者的反应速度有何区别为什么会有此不°同解答:乙烯使溴水褪色的速度较乙炔的快;乙炔碳碳键长较乙烯碳碳键的键长短,因此乙炔分子中的π键较乙烯的π键稳定,反应活性低、反应速度慢;12. 乙烯既能使高锰酸钾溶液褪色,也能使溴水褪色;这两个实验的本质有无区别解答:这两个实验有着本质的区别,乙烯使高锰酸钾溶液褪色是因为乙烯与高锰酸钾发生了氧化还原反应,乙烯使高锰酸钾还原而褪色;乙烯使溴水褪色是因为乙烯与溴发生了加成反应,生成了无色的溴代烷烃;13. 写出分子式C4H6的开链构造异构体的结构式,并用系统命名法命名;1—丁炔 2—丁炔 1,3—丁二烯 1,2—丁二烯14. A,B 两化合物的分子式都是C 6H 12 ,A 经臭氧化并与锌和酸反应后的乙醛和甲乙酮,B 经高锰酸钾氧化只得丙酸,写出A 和B 的结构式;解答:顺—3—甲基—2—戊烯 反—3—甲基—2—戊烯顺—3—己烯 反—3—己烯15. 化合物A 和B 互为同分异构体,二者都能使溴水褪色,A 能与硝酸银的氨溶液反应而B 不能;A 用酸性高锰酸钾溶液氧化后生成CH 32CHCOOH 和CO 2,B 用酸性高锰酸钾溶液氧化后生成CH 3COCOOH 和CO 2;试推测A 和B 的结构式和名称,并写出有关的反应式;解答:化合物A 的有关反应式: 化合物B 的有关反应式:16. 某化合物分子量为82,每摩尔该化合物可吸收2摩尔氢,不与硝酸银的氨溶液反应,当他吸收1摩尔氢时,生成2,3—二甲基—1—丁烯;试写出该化合物的结构式;解答:A. B. CH 2 C CH CH 2CH 3(CH 3)2CHC CH 3—甲基—1—丁炔2—甲基—1,3—丁二烯 CH 2 C C CH 2CH 3CH 3第三章脂环烃习题参考答案1. 命名下列化合物2. 写出下列化合物的结构1 3—甲基环丁烯2 5—甲基二环2.2.2—2—辛烯 3. 用化学方法鉴别下列各组化合物解答:将上述三种试剂分别通入溴水中,不能使溶液棕红色褪色的是CH3CH2CH3;将能使溴水褪色的两种试剂分别通入高锰酸钾酸性溶液中,能使溶液紫红色褪色的是CH3CH=CH2;2 1,1—二甲基环丙烷和环戊烯解答:将两种试剂与高锰酸钾酸性溶液混合,能使溶液紫红色褪色的是环戊烯,不能使溶液褪色的是1,1—二甲基环丙烷;4. 完成下列反应式5. 完成苯基环丙烷与下列试剂的反应;1 HCl2 Cl2Cl43 Br2FeBr34 H2SO46. 回答下列问题:1 在环丙烷中含有少量杂质丙烯,在提纯环丙烷时如何去除杂质解答:将含有少量丙烯杂质的环丙烷气体通入高锰酸钾溶液,丙烯因为与高锰酸钾反应而被溶液吸收去除,然后用排水集气法收集得到不含丙烯的环丙烷气体;2 解释环丙烷的稳定性解答:环丙烷的3个碳原子在同一平面上,其每一个碳原子的sp3杂化电子云夹角为°;因此,当成键时,两个成键电子云是以弯曲方式重叠,形成“弯曲σ键”;与以“头对头”方式正面重叠形成的一般σ键相比,弯曲σ键重叠程度低,而且具有恢复正常重叠方式的自在趋势力——张力,因此不稳定;环丙烷的3个“弯曲σ键”的不稳定决定了环丙烷分子的不稳定性,它容易发生开环加成反应;7. 有一化合物分子式为C7H14,此化合物发生如下反应:1 可以催化加氢,产物分子式为C7H16;2 在室温下不能使高锰酸钾溶液褪色;3 能与HBr反应得产物2—溴—2,3—二甲基戊烷;写出该化合物的结构;解答:CH3CH3或H3CH3C CH3CH3第四章芳香烃习题参考答案1. 命名下列化合物;对乙基甲苯对异丙基甲苯 4—乙基—2—溴甲苯2—环戊基甲苯对二氯苯三苯甲基游离基6—溴—1—萘磺酸 2,4—二硝基甲苯2. 写出下列化合物的结构;1 间甲乙苯2 β-萘酚3 4-氯-2,3-二硝基甲苯4 环戊二烯负离子5 间二乙烯苯6 邻二异丙苯7 6-氯-1-萘磺酸 8 环丙烯正离子3. 完成下列反应;4. 写出下列反应所需试剂,并完成反应,1 苯→甲苯→氯苄2 甲苯→苯甲酸→邻、对硝基苯甲酸3 硝基苯→间硝基氯苯4 萘→邻苯二甲酸5. 用化学方法鉴别下列各组化合物;1 甲苯、1-甲基环己烯、甲基环己烷解答:取三种待测物少许,分别与溴水混合,能使溴水迅速褪色的是1-甲基环己烯;将不能使溴水褪色的两种待测物分别与高锰酸钾溶液混合加热,能使高锰酸钾紫红色褪色的是甲苯,余者为甲基环己烷;2 苯、1,3-己二烯解答:取两种待测物少许,分别与高锰酸钾酸性溶液混合,能使溶液紫红色褪色的是1,3-己二烯;6. 二甲苯的邻、间、对位三个异构体,在进行硝化时,分别得到一个一硝基产物,二个一硝基产物和三个一硝基产物,写出相对应的二甲苯结构;解答:得一个硝基产物的是对二甲苯:得二个硝基产物的是邻二甲苯:得三个硝基产物的是间二甲苯:7. 按照亲电取代反应活性由强到弱的顺序排列下列化合物;1 甲苯、苯、氯苯、硝基苯、苯酚解答:亲电取代反应活性顺序为苯酚 > 甲苯 > 苯 > 氯苯 > 硝基苯2 溴苯、苯甲酸、间二甲苯、甲苯、间硝基苯甲酸解答:亲电取代反应活性顺序为间二甲苯 > 甲苯 > 溴苯 > 苯甲酸 > 间硝基苯甲酸8. 判断下列化合物有无芳香性;1 环戊二烯解答:环戊二烯分子中没有闭合的共轭大π健结构,故不具有芳香性;2 环戊二烯负离子解答:环戊二烯负离子具有闭合的6电子共轭大π健结构,且π电子数6符合“4n+2”;因此根据休克尔规则,环戊二烯负离子具有芳香性;3 环戊二烯正离子解答:环戊二烯正离子具有闭合的4电子共轭大π健结构,但其π电子数4不符合“4n+2”;因此根据休克尔规则,环戊二烯正离子不具有芳香性;4 1,2,3,4-四氢萘解答:1,2,3,4-四氢萘保留了一个完整的苯环,因此具有芳香性;5 1,3,5,7-环辛四烯解答:1,3,5,7-环辛四烯π电子数8不符合“4n+2”;因此根据休克尔规则,1,3,5,7-环辛四烯不具有芳香性;6 环丙烯正离子解答:环丙烯正离子具有闭合的2电子共轭大π健结构,且π电子数2符合“4n+2”;因此根据休克尔规则,环丙烯正离子具有芳香性;9. 以苯为主要原料合成下列化合物;1 叔丁基苯2 2,4-二硝基苯甲酸3 间硝基苯甲酸4 2-甲基-5-硝基苯磺酸5 环戊基苯10. 某芳烃A分子式为C8H10,被酸性高锰酸钾氧化生成分子式为C8H6O4的B;若将B进一步硝化,只得到一种一元硝化产物而无异构体,推出A、B的结构并写出反应式;解答:A和B的结构分别为:相关反应式如下:第五章芳香烃习题参考答案1. 简述卤代烃的结构特点、分类,并举例说明;参见教材第62页2. 写出分子式为C4H9Br所有异构体及名称,并指出它们分别属于伯、仲、叔卤烃的哪一种解答:所有可能的碳链如下所有异构体如下1-溴丁烷 2-溴丁烷 2-甲基-1-溴丙烷 2-甲基-2-溴丙烷伯卤烃仲卤烃伯卤烃叔卤烃3. 解释下列名词并举例说明:1 亲核试剂2 亲核取代反应3 反应底物4 中心碳原子5 离去基团6 消除反应参见教材4. 叙述卤代烷的单分子亲核取代反应SN 1机理和双分子亲核取代反应SN2机理;参见教材解答:1.单分子亲核取代反应SN1以叔溴丁烷的水解反应为例加以讨论;叔溴丁烷的水解反应的分两步进行;第一步:叔丁基溴的C—Br键发生异裂,生成叔丁基碳正离子和溴负离子,此步反应的速率很慢;第二步:生成的叔丁基碳正离子很快地与进攻试剂结合生成叔丁醇;2. 双分子亲核取代反应SN2实验证明,溴甲烷水解反应的机制为SN2,反应一步完成:该反应的反应速率与溴甲烷和碱的浓度有关,称为双分子亲核取代反应,用SN22代表决定反应速率所涉及的两种分子表示;在该反应过程中,OH-从Br的背面进攻带部分正电荷的α-C,C—O键逐渐形成,C—Br键逐渐变弱形成一个过渡状态;然后C—Br 键迅速断裂,C—O键形成,完成取代;5. 简述卤代烷的消除反应和亲核取代反应及二者之间的关系;参见教材6. 用系统命名法命名下列化合物;(1)(2)(3)CH3C(CH3)2CH2Br CH3CH2CHBrCH2I CH2CHCH2CH3Cl 2,2-二甲基-1-溴丙烷 2-溴-1-碘丁烷 1-苯基-2-氯丁烷 3-甲基-3-碘-1-戊烯 3-氯环己烯 2-甲基-1-溴萘间溴甲苯 1-环戊基-2-溴乙烷7. 写出下列化合物的结构式;1 二碘二溴甲烷2 叔丁基溴3 烯丙基氯4 氟烷5 1-溴-1-丙烯6 2,4-二氯甲苯7 苄基氯8 5-溴-1,3-环己二烯8. 完成下列反应式9. 完成下列转变解答:解答:解答:解答:10. 用化学方法鉴别下列各组化合物;1 氯苯、苄基氯、1-苯基-2-氯丙烷解答:各取待测物少许分别与硝酸银醇溶液混合,室温下立即产生白色沉淀的为苄基氯;加热后产生白色沉淀的为1-苯基-2-氯丙烷,余者为氯苯;2 溴苯、溴乙烯、异丙基溴解答:各取待测物少许分别与硝酸银醇溶液混合加热,产生淡黄色沉淀的为异丙基溴;将剩余2种待测物分别与高锰酸钾酸性溶液混合,能使高锰酸钾紫红色褪色的是溴乙烯,余者为溴苯;3 2-氯丙烯、2-氯丙烷、3-氯丙烯、3-碘环戊烯解答:各取待测物少许分别与硝酸银醇溶液混合,立即产生黄色沉淀的为3-碘环戊烯,立即产生白色沉淀的为3-氯丙烯,加热后产生白色沉淀的为2-氯丙烷,余者为2-氯丙烯;4 4-溴-1-丁炔、2-溴-2-丁烯、3-溴环戊烯解答:各取待测物少许分别与硝酸银醇溶液混合,立即产生淡黄色沉淀的为3-溴环戊烯,立即产生白色沉淀的为4-溴-1-丁炔,余者为2-溴-2-丁烯;11. 下列卤代烃与氢氧化钾醇溶液发生消除反应,按反应速率由大到小排列顺序;2-甲基-1-氯丁烷、2-甲基-2-氯丁烷、2-甲基-3-氯丁烷解答:2-甲基-2-氯丁烷 > 2-甲基-3-氯丁烷 > 2-甲基-1-氯丁烷12. 下列卤代烃与硝酸银醇溶液反应,按生成沉淀的快慢顺序排列; 1-溴环己烯、4-溴环己烯、溴化苄、1-甲基-1-溴环己烷解答:溴化苄 > 1-甲基-1-溴环己烷 > 4-溴环己烯 > 1-溴环己烯1. 写出下列化合物的名称或结构简式2,2-二甲基-3-戊烯-1-醇甲基异丙基醚2. 完成下列反应式3. 用化学方法区别下列化合物1 正丁醇、仲丁醇和叔丁醇解答:各取待测物少许分别与卢卡斯试剂浓盐酸+无水ZnCl2混合,室温下立即出现沉淀的是叔丁醇,过5~10分钟出现沉淀的是仲丁醇,无沉淀的是正丁醇;2 苯甲醇和对甲苯酚解答:各取待测物少许分别与FeCl3混合,出现显着颜色变化的是对甲苯酚;3 1,3-丁二醇和2,3-丁二醇解答:各取待测物少许分别与新制CuOH2混合并振摇,CuOH2溶解并得到深蓝色溶液的是2,3-丁二醇,余者为1,3-丁二醇;4. 苯甲醇和苯酚都含有苯环和羟基,为什么他们性质有很大差别解答:苯酚中的羟基与苯环发生了p-π共轭,而苯甲醇中的羟基与苯环相隔一个碳原子没有共轭发生,因此他们的性质大相径庭;5. 推导结构化合物AC9H12O与NaOH、KMnO4均不反应,遇HI生成B和C,B遇溴水立即变为白色浑浊,C经NaOH水解,与Na2Cr2O7的H2SO4溶液反应生成酮D,试写出A、B、C、D的结构简式与相应反应式;解答:A、B、C、D的结构简式为相关反应式如下:A B CD1. 写出下列化合物的结构式14-甲基-3-戊烯-2-酮 2α,γ-二甲基己醛 3甲基异丁基酮43-硝基苯乙酮 5环己酮腙2. 命名下列化合物2,4-戊二酮对甲氧基苯甲醛 3-环己基丙醛 3-戊烯-2-酮 2,8-二羟基-9,10-蒽醌对苯醌单肟3. 写出苯甲醛和环己酮分别与下列化合物的反应如果有的话所得产物的结构式;1 托伦试剂苯甲醛与托伦试剂作用的产物是:环己酮与托伦试剂不反应;,H+,加热2 KMnO4环己酮一般条件下不易被氧化;3 2,4-二硝基苯肼4 NaHSO35 LiAlH46 浓NaOH苯甲醛与之作用的产物为:环己酮与之不反应;7 乙醇,HCl苯甲醛与之作用的产物为:环己酮与之不反应;8 乙基溴化镁苯甲醛与之作用的产物为:环己酮与之作用的产物为:9 稀NaOH苯甲醛和环己酮与稀碱均不作用;4. 完成下列反应式;5. 按照与HCN反应的活性,由高至低顺序排列下列各组化合物;解答:空间位阻的不同造成上述顺序;解答:硝基的吸电子作用增加了羰基碳原子的正电荷有利于亲和加成反应;甲氧基通过p,π-共轭效应供电子使羰基碳原子的正电荷降低不利于亲核加成反应;解答:空间位阻的不同是造成上述顺序的主要因素;6. 用简单方法区别下列各组化合物;1 苯甲醛、苯乙酮、环己酮解答:分别取上述待测物质少许与托伦试剂混合后水浴加热,出现银镜的为苯甲醛;将剩余两种待测物分别与碘的碱溶液混合,出现黄色沉淀的为苯乙酮,余者为环己酮;2 乙醛、丙醛、丁酮、二乙酮解答:取上述待测物少许分别与托伦试剂混合后水浴加热,出现银镜的是乙醛和丙醛,未有银镜出现的是丁酮和二乙酮;将乙醛和丙醛少许分别与碘的氢氧化钠溶液混合,出现黄色沉淀的乙醛,另一个溶液,出现白色结晶的为丁酮,未为丙醛;将丁酮和二乙酮少许分别滴入饱和NaHSO3有沉淀的是二乙酮;3 甲醛、仲丁醇、丁醛、3-戊酮解答:取上述待测物少许分别与西夫试剂混合,出现紫红色的是甲醛和丁醛,然后加入浓硫酸,紫色不退色的为甲醛,紫色褪去的为丁醛;与西夫试剂混合后未有颜色变化的是仲丁醇和3-戊酮;各取它俩少许分别与2,4-二硝基苯肼混合,出现黄色结晶沉淀的为3-戊酮,余者为仲丁醇;4 2-丁烯醛、异丁醛、3-戊酮、异丁醇解答:各取上述待测物少许,分别与溴水混合,能使溴水棕色褪至无色的是2-丁烯醛;将剩余3待测物少许分别与托伦试剂混合后水浴加热,产生银镜的是异丁醛;将最后2个待测物少许分别与2,4-二硝基苯肼混合,出现黄色结晶沉淀的是3-戊酮;7. 用6个碳以下的直链醛或酮合成下列化合物,无机试剂任选;请写出各步反应式;1 2-辛醇2 3-甲基-3-己醇3 正庚醇4 异己烷解答:1合成2-辛醇的方法首先制得格氏试剂己基溴化镁:然后用己基溴化镁与乙醛反应制得2-辛醇: 2合成3-甲基-3-己醇的方法 首先制得格氏试剂丙基溴化镁:然后用丙基溴化镁与丁酮反应制得3-甲基-3-己醇: 3合成正庚醇的方法首先制得格氏试剂己基溴化镁见前题;然后用己基溴化镁与甲醛作用制得正庚醇:4合成异己烷的方法 首先制得2-甲基-3-戊酮:然后用克莱门森还原法制得异己烷:8. 某化合物化学式为C 5H 12OA,A 氧化后得一产物C 5H 10OB;B 可与亚硫酸氢钠饱和溶液作用,并有碘仿反应;A 经浓硫酸脱水得一烯烃C,C 被氧化可得丙酮;写出A 可能的结构式及有关反应式;解答:A 的结构式为: 有关反应式如下:9. 某化合物AC 6H 10O 2可使溴水褪色,可与2,4-二硝基苯肼产生沉淀,并能与三氯化铁显色,无银镜反应;试写出A 的结构式;解答:A 的结构式为:CH 3CHCH(CH 3)2OH第八章 羧酸及其衍生物习题参考答案1. 命名下列化合物β-甲基丁酸 对苯二甲酸 3-苯基丁酸3,7—壬二烯酸 丙酰氯对甲基苯甲酰氯 乙丙酐 二甲基丙二酸二乙酯 乙酸异丙酯 丙酰胺2. 写出下列化合物的结构式1 2,3-二甲基戊酸2 反-2-甲基-2-丁烯酸当归酸3 α,α-二氯丁酸4 丙二酸甲乙酯5 邻苯二甲酸酐6 丙烯酰氯 3. 比较下列化合物酸性的强弱 1 丙酸 丙二酸 乙二酸 解答:乙二酸 > 丙二酸 > 丙酸2 α-氯丙酸 α,α-二氯丙酸 丙酸 β-氯丙酸 解答:α,α-二氯丙酸 >α-氯丙酸>β-氯丙酸> 丙酸 4. 写出乙酸与下列试剂的反应方程式;1 乙醇2 五氯化磷3 氨4 氢化锂铝5. 用化学方法鉴别下列各组化合物 1 甲酸 乙酸 乙醛解答:取上述待测物少许,分别与石蕊试剂混合,不出现红色的是乙醛;将能使石蕊变红的两个化合物分别与高锰酸钾溶液混合,能使高锰酸钾紫红色褪色的是甲酸,余者为乙酸;解答:取上述待测物少许,分别与2,4-二硝基苯肼混合,能使之出现黄色结晶状沉淀的是对-羟基苯乙酮;将余下两种待测物分别与溴水混合,能使溴水褪色的是乙烯基对苯二酚,余者为对甲基苯甲酸;6. 写出下列反应的主要产物或反应所需的条件7. 完成下列转化+CH 3COOH CH 3CH 2CH 3COOC 2H 5+H 2O +CH 3COOH CH 3COCl +HCl PCl +POCl 3+CH 3COOH CH 3COONH NH 3+CH 3CONH 2H 2O CH 3LiAlH4CH 3CH 2OH1 由异丁烯制备2,2-二甲基丙酸解答: 2 由乙炔制乙酸乙酯解答:3 由丙二酸二乙酯制丁酸 解答:8. 写出分子式为C 5H 6O 4的不饱和二元羧酸的各种异构体的结构式,如有顺反异构,则注明Z 、E 构型;解答:9.有三种化合物的分子式均为C 3H 6O 2,其中A 能与NaHCO 3反应放出CO 2,B 和C 则不能;B 和C 在NaOH 溶液中加热均可发生水解,B 的水溶液蒸馏出的液体能发生碘仿反应,而C 的则不能;试推测A 、B 、C 的结构式;解答:MgCO 2H 2O CH 3C CH 2CH 3HBrCH 3C CH 3CH 3Br(CH 3)3(CH 3)3CCOOH KMnO 4 , H H 2O , Hg 2+HC CH CH 3CH 3COOH +CH 3COOC 2H 51. 命名下列化合物;β-羟基丁酸γ-戊酮酸 3-甲基-4-羟基丁酸 2-氨基-3-4-羟基苯基丙酸α-甲基-γ-戊酮酸 4-甲基-3-氯戊酸2. 写出下列化合物的结构式;3. 完成下列反应式;4. 用简单化学方法鉴别下列每组化合物;解答:各取三种待测物少许分别与FeCl3溶液混合,没有出现显色现象的是乳酸;将与FeCl3溶液显色的2种待测物分别与2,4-二硝基苯肼试剂作用,出现黄色结晶的是乙酰乙酸乙酯,余者为水杨酸;解答:各取2种待测物少许分别与FeCl3溶液混合,出现显色现象的是2,4-戊二酮,另一个就是丙酮;3 丙二酸二乙酯与乙酰乙酸乙酯解答:各取2种待测物少许,分别与2,4-二硝基苯肼试剂作用,出现黄色结晶的是乙酰乙酸乙酯,另一个为丙二酸二乙酯;5. 将下列化合物按其酸性从大到小次序排列;6. 将下列化合物写成酮式与烯醇式的互变平衡体系;7. 用乙酰乙酸乙酯及其他必要的试剂合成下列化合物;解答:解答:解答:解答:8. 化合物AC9H10O3,它不溶于水,稀盐酸及稀碳酸氢钠溶液,但能溶于氢氧化钠溶液;A与稀氢氧化钠共热后,冷却酸化得一沉淀BC7H6O3,B能溶于NaHCO3溶液,并放出气体,B遇FeCl3溶液产生紫色,B的一种衍生物是常用药物APC的成分之一;试写出A、B 的结构式及各步反应式;解答:A、B的结构式为:有关反应式如下:1. 下列化合物中,哪些是旋光性物质哪些是非旋光性物质为什么解答:1是非旋光性物质,因为以其结构中的碳原子和2个氯原子所确定的平面是分子的对称面,具有对称面的分子不具有手性;2、3、4、5和6均是旋光性物质,其中2、3、4分子中均含有多个不同的手性碳原子,属于手性分子;5和6两个化合物的空间结构不含有对称面和对称中心等对称因素,因而属于手性分子;2. 下列各对化合物哪些互为对映异构体哪些互为非对映异构体哪些为同一化合物同一个化合物互为对映体互为对映体互为非对映体3. 写出下列旋光性物质所有的光学异构体的费歇尔投影式,并指出它们之间的关系;解答:1的所有光学异构体的费歇尔投影式如下:Ⅰ与Ⅱ互为对映体;Ⅲ是内消旋体,不具有旋光性;Ⅰ与Ⅲ、Ⅱ与Ⅲ的关系为非对映体;2的所有光学异构体的费歇尔投影式如下:Ⅰ与Ⅱ、Ⅲ与Ⅳ互为对映体;Ⅰ和Ⅱ中的任意一个与Ⅲ和Ⅳ中的任意一个互为非对映体;4. 用R、S构型标示方法标示下列化合物中手性碳原子的构型;R S R2R,3S S5. 写出下列光学活性药物的费歇尔投影式,并指出是赤型还是苏型;1 1R,2S---2-甲氨基-1-苯基-1-丙醇左旋麻黄碱2 1R,2R---1-对硝基苯基-2-二氯乙酰氨基-1,3-丙二醇左旋氯霉素6. 写出下列化合物的费歇尔投影式,用R、S构型标示方法标出手性碳原子的构型;S 2R,3R 2S,3R 1R,2R7. 解释下列名词;略8. 某蔗糖溶液在20℃及2dm长的盛液管中测得旋光度为+°,求该蔗糖溶液的浓度;。
有机化学课后习题参考答案完整版(汪小兰第四版)

目录第一章绪论 (1)第二章饱和烃 (2)第三章不饱和烃 (6)第四章环烃 (14)第五章旋光异构 (23)第六章卤代烃 (28)第七章波谱法在有机化学中的应用 (33)第八章醇酚醚 (43)第九章醛、酮、醌 (52)第十章羧酸及其衍生物 (63)第十一章取代酸 (71)第十二章含氮化合物 (77)第十三章含硫和含磷有机化合物 (85)第十四章碳水化合物 (88)第十五章氨基酸、多肽与蛋白质 (99)第十六章类脂化合物 (104)第十七章杂环化合物 (113)Fulin 湛师第一章 绪论1.1扼要归纳典型的以离子键形成的化合物与以共价键形成的化合物的物理性质。
答案:1.2 NaCl 与KBr 各1mol 溶于水中所得的溶液与NaBr 及KCl 各1mol 溶于水中所得溶液是否相同?如将CH 4及CCl 4各1mol 混在一起,与CHCl 3及CH 3Cl 各1mol 的混合物是否相同?为什么? 答案:NaCl 与KBr 各1mol 与NaBr 及KCl 各1mol 溶于水中所得溶液相同。
因为两者溶液中均为Na +,K +,Br -, Cl -离子各1mol 。
由于CH 4与CCl 4及CHCl 3与CH 3Cl 在水中是以分子状态存在,所以是两组不同的混合物。
1.3碳原子核外及氢原子核外各有几个电子?它们是怎样分布的?画出它们的轨道形状。
当四个氢原子与一个碳原子结合成甲烷(CH 4)时,碳原子核外有几个电子是用来与氢成键的?画出它们的轨道形状及甲烷分子的形状。
答案:C+624H CCH 4中C 中有4个电子与氢成键为SP 3杂化轨道,正四面体结构CH 4SP 3杂化2p y2p z2p x2sH1.4写出下列化合物的Lewis 电子式。
a.C 2H 4b.CH 3Clc.NH 3d.H 2Se.HNO 3f.HCHOg.H 3PO 4h.C 2H 6i.C 2H 2j.H 2SO 4 答案:a.C C H H HHCC HH HH或 b.H C H c.H N Hd.H S He.H O NO f.O C H Hg.O POO H H Hh.H C C HHH H HO P O O H HH或i.H C C Hj.O S O HH OH H或1.5下列各化合物哪个有偶极矩?画出其方向。
有机化学课后习题参考答案(全)

第一章绪论 (1)第二章饱和烃 (3)第三章不饱和烃 (7)第四章环烃 (14)第五章旋光异构 (22)第六章卤代烃 (27)第七章波谱分析 (33)第八章醇酚醚 (34)第九章醛、酮、醌 (41)第十章羧酸及其衍生物 (50)第十一章取代酸 (58)第十二种含氮化合物 (65)第十三章含硫和含磷有机化合物 (72)第十四章碳水化合物 (74)第十五章氨基酸、多肽与蛋白质 (78)第十六章类脂化合物 (82)第十七章杂环化合物 (88)第一章绪论1.1 扼要归纳典型的以离子键形成的化合物与以共价键形成的化合物的物理性质。
1.2是否相同?如将CH4 及CCl4各1mol混在一起,与CHCl3及CH3Cl各1mol的混合物是否相同?为什么?答案:NaCl与KBr各1mol与NaBr及KCl各1mol溶于水中所得溶液相同。
因为两者溶液中均为Na+ , K+ , Br-, Cl-离子各1mol。
由于CH4 与CCl4及CHCl3与CH3Cl在水中是以分子状态存在,所以是两组不同的混合物。
1.3 碳原子核外及氢原子核外各有几个电子?它们是怎样分布的?画出它们的轨道形状。
当四个氢原子与一个碳原子结合成甲烷(CH4)时,碳原子核外有几个电子是用来与氢成键的?画出它们的轨道形状及甲烷分子的形状。
答案:C+624HCCH 4中C 中有4个电子与氢成键为SP 3杂化轨道,正四面体结构CH 4SP 3杂化2p y2p z2p x2sH1.4 写出下列化合物的Lewis 电子式。
a. C 2H 4b. CH 3Clc. NH 3d. H 2Se. HNO 3f. HCHOg. H 3PO 4h. C 2H 6i. C 2H 2j. H 2SO 4答案:a.C C H H H HCC HH HH或 b.H C H H c.H N HHd.H S He.H O NO f.O C H Hg.O P O O H H Hh.H C C HHH H HO P O O H HH或i.H C C Hj.O S O HH OO H H或1.5 下列各化合物哪个有偶极矩?画出其方向。
甲烷的立体结构

甲烷的立体结构甲烷,化学式CH4,是一种无色、无臭的气体,也是天然气的主要成分之一。
甲烷分子由一个碳原子和四个氢原子组成,其立体结构对于理解甲烷的性质和反应至关重要。
甲烷的立体结构可以用VSEPR理论(分子的价电子对排斥理论)来解释。
根据这个理论,甲烷的碳原子周围有四个价电子对,它们排列成一个正四面体的形状。
碳原子位于正四面体的中心,四个氢原子均位于四个顶点上。
这种立体结构使得甲烷分子呈现出非极性的特性。
由于四个氢原子均相同,且位于甲烷分子的四个角上,甲烷分子的电负性分布均匀,没有电荷偏移,因此甲烷是一个非极性分子。
甲烷的非极性使其具有一些特殊的性质。
首先,它是一种很稳定的化合物,不容易与其他物质发生反应。
这是因为甲烷分子中的碳-氢键非常强大,需要大量能量才能打破这些键。
此外,由于甲烷是非极性的,它在溶解性和挥发性方面与极性分子有所不同。
甲烷在自然界中广泛存在,特别是在沉积岩层中。
它是一种主要的温室气体,对地球的气候变化有重要影响。
然而,甲烷也是一种重要的能源资源,被广泛用于燃料和化工工业。
甲烷的立体结构对于理解其反应机理也至关重要。
由于甲烷的碳-氢键强度很高,它在常温下不容易发生反应。
但在高温和高压条件下,甲烷可以与氧气反应生成二氧化碳和水,释放出大量的能量。
这是燃烧过程中常见的反应,也是甲烷作为能源的重要特性之一。
甲烷还可以通过一系列的化学反应转化为其他化合物。
例如,它可以与氯气反应生成氯代甲烷,也可以与溴反应生成溴代甲烷。
这些反应都涉及到碳-氢键的断裂和新键的形成,进而改变甲烷分子的立体结构。
甲烷的立体结构对于理解其性质和反应机理至关重要。
通过VSEPR 理论,我们可以知道甲烷分子呈现出正四面体的形状,使其成为一个非极性分子。
这种立体结构决定了甲烷的稳定性、溶解性、挥发性以及与其他物质的反应性。
深入理解甲烷的立体结构,有助于我们更好地应用和探索这一重要的化合物。
有机化学习题答案
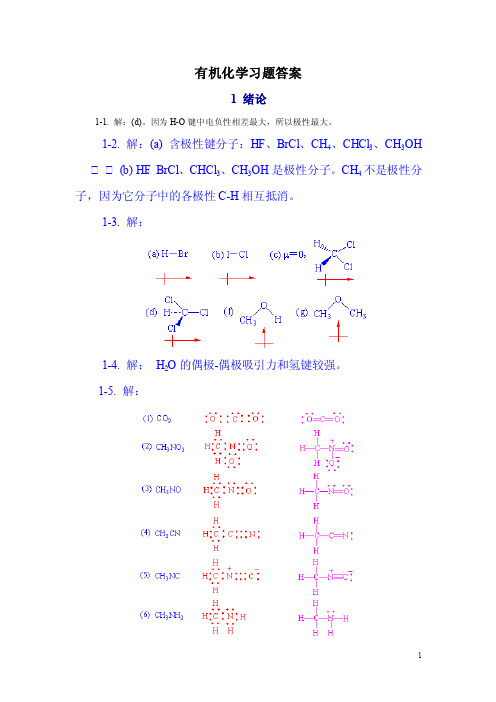
有机化学习题答案1 绪论1-1. 解:(d)。
因为H-O键中电负性相差最大,所以极性最大。
1-2. 解:(a) 含极性键分子:HF、BrCl、CH4、CHCl3、CH3OH(b) HF、BrCl、CHCl3、CH3OH是极性分子。
CH4不是极性分子,因为它分子中的各极性C-H相互抵消。
1-3. 解:1-4. 解:H2O的偶极-偶极吸引力和氢键较强。
1-5. 解:1-6. 解:1-7. 解:1-8. 解:2 烷烃答案2-1.解:分子中只含碳、氢两种元素的有机化合物称烃。
烃分子中碳原子之间仅以单键相互连接成链的称为饱和烃,也称烷烃。
烷烃中碳链为开链的称开链烷烃,而碳碳之间连接成环的称环烷烃。
烃分子中除碳碳单键外,还含碳碳双键(C=C)或碳碳叁键(C≡C)的称为不饱和烃。
2-2.解:当烷烃分子中去掉一个氢原子,生成的一价原子团称为烷基。
常见的烷基有:2-3.解:(1)3-甲基-3-乙基-6-异丙基壬烷(2)2,6-二甲基-3,6-二乙基辛烷(3)3-甲基-4-乙基已烷(4)2,5,6-三甲基辛烷(5)2,6,6-三甲基辛烷(6)5-甲基-5-乙基-4-异丙基-7-仲丁基十一烷烷烃的命名是先取代基后母体,取代基按顺序规则,优先基团后出现的原则排列在母体名称的前面。
相同取代基必须合并,表示取代基位置的阿拉伯数字必须写在相应取代基前面,阿拉伯数字与汉字之间必须用半字格一短横“-”隔开,阿拉伯数字之间用逗号“,”分开。
2-4.解:在烷烃分子中,某碳原子仅与一个其它碳原子相连接时称该碳原子为伯碳原子,当与两个其它碳原子相连接时称该碳原子为仲碳原子,当与三个及四个其它碳原子相连接时,分别称为叔碳原子和季碳原子。
伯、仲、叔碳原子上所连接的氢原子分别称为伯氢、仲氢和叔氢。
2-5.解:2-6.解:对相应烷烃各异构体中伯、仲、叔、季碳原子及伯、仲、叔氢原子的确证及对各异构体中氢原子的化学环境的比较是解此题的关键。
2-7.解:2-甲基丁烷的构造式为分子中具有四种不等价的氢原子,所以当氯取代时可以生成四种不同的一氯取代物:分子中也具有四种不等价的氢原子,同样可以生成四种一氯化取代物:2-8.解:根据季碳、叔碳和仲碳的定义,必须具有如下的状态:其中游离价表示必须与其他碳原子相连接。
有机化学中的烷烃的官能团转化反应

有机化学中的烷烃的官能团转化反应有机化学中的烷烃是一类分子结构简单的有机化合物,由碳和氢组成。
烷烃分子中的碳原子通过单键连接,形成碳链。
烷烃的分子结构缺乏活性官能团,使得其反应性相对较低。
为了赋予烷烃分子更多的化学活性,我们可以通过官能团转化反应引入新的官能团。
本文将介绍几个常见的烷烃的官能团转化反应。
1. 氧化反应烷烃可以通过氧化反应引入氧原子,形成醇、醛、酮等官能团。
常用的氧化剂包括氧气、过氧化氢、高锰酸钾等。
例如,甲烷可以通过氧化反应生成甲醇:CH4 + O2 → CH3OH2. 卤代反应烷烃可以通过与卤素发生反应生成卤代烃。
常用的卤素包括氯、溴、碘等。
例如,乙烷与氯气反应生成氯代乙烷:C2H6 + Cl2 → C2H5Cl + HCl3. 亲电取代反应烷烃可以通过亲电取代反应引入新的官能团。
在亲电取代反应中,亲电试剂攻击烷烃分子中的碳原子,取代其中的氢原子。
常见的亲电试剂包括卤素、质子、磺酸基等。
例如,甲烷可以通过亲电取代反应生成溴代甲烷:CH4 + Br2 → CH3Br + HBr4. 脱氢反应烷烃可以通过脱氢反应生成烯烃或芳香化合物。
脱氢反应常常需要在高温、高压的条件下进行。
例如,乙烷可以通过脱氢反应生成乙烯:C2H6 → C2H4 + H25. 氢解反应烷烃可以通过氢解反应生成较低碳数的烃类化合物。
在氢解反应中,烷烃分子中的碳-碳键被断裂,生成较小碳数的碳氢化合物。
例如,丁烷可以通过氢解反应生成乙烷和甲烷:C4H10 → C2H6 + CH4以上介绍了有机化学中烷烃的几种常见官能团转化反应。
通过这些反应,我们可以在烷烃分子中引入新的官能团,赋予其更多的化学活性。
有机化学中的烷烃的官能团转化反应是许多有机合成的基础,对于有机化学的研究和应用具有重要的意义。
大学有机化学-烷烃

C CH
C(CH3)3
CH CH2
(C) (C) CCH (C) (C)
CH3 C CH3 CH3
(C) (C)
CCH HH
乙炔基
叔丁基
乙烯基
比较 CH CH2 和 (CH3)2CH
的优先次序
9
8
76
54
CH3 CH2 CH CH2 CH2 CH CH2 CH3
CH3
CH3CH22CH1 3 CH3
由此产生的异构体 — 构象异构体
乙烷的构象
H
HH
透 视 式
HH HH
H
H H
重叠式
H
H纽 曼
投
H
H影
H
H
H
HH H
H式
H
H H
交叉式
优势构象
重叠式构象中: 前后两个H原子相距最近,C-H键之
间σ键电子云的斥力最大,所以能量最高。
交叉式构象中: 前后两个H原子相距最远,C-H键之间
σ键电子云的斥力最小,所以能量最低,是优 势构象(最稳定构象)。
取代基位号 2,3,5 取代基位号 2,4,5
98
CH3CH2
CH3 CH2CH3
CH3
CH
7
C6 H2
C5 H2
CH CH
43
C2H2C1H3
( I ) 系列编号:3,4,7-最低系列
12
CH3CH2
CH3 CH2CH3
CH3 C3 H
C4 H2
C5 H2
CH CH
67
C8 H2C9 H3
( II ) 系列编号:3,6,7
H
C CH3 >
常见有机化学的的分子式

常见有机化学的的分子式1. 甲烷:CH4,无色、无臭、易燃的气体,是天然气的主要成分之一。
2. 乙烯:C2H4,无色气体,具有较强的还原性和与氧气的爆炸性。
3. 乙炔:C2H2,无色气体,具有强烈的臭味,易燃、爆炸。
4. 甲醇:CH3OH,无色、透明、有毒、易燃、可引起中毒。
常用作溶剂和燃料。
5. 乙醇:C2H5OH,无色透明液体,具有刺激性气味,可用作溶剂和燃料。
6. 丙酮:C3H6O,无色液体,是一种重要的有机溶剂和中间体。
7. 苯:C6H6,苯环分子,是一种无色液体,是很多有机化合物的基础。
8. 氨:NH3,无色气体,带有刺激性气味,通常用于制造肥料。
9. 硫酸:H2SO4,无色液体,通常用作强酸,可用于许多化学反应。
10. 甲苯:C7H8,无色液体,是一种常见的有机溶剂,用于制造塑料、药品和香料。
11. 二甲苯:C8H10,无色液体,是一种常见的有机溶剂,可用于制药、染料和塑料。
12. 乙酸:C2H4O2,无色液体,是一种常见的有机酸,可用作溶剂和中间体。
13. 丙酸:C3H6O2,无色液体,常用于制药、染料和香精。
14. 奎宁:C20H24N2O2,是一种有机碱,常用于治疗疟疾。
15. 对苯二酚:C6H4(OH)2,无色晶体,常用于制造合成树脂和染料。
16. 芳香醛:C7H6O,无色液体,常用于制造香料和涂料。
17. 醋酸乙酯:C4H8O2,无色液体,是一种常见的溶剂和香料成分。
18. 氰化物:CN-,无色液体或固体,具有强烈的毒性和致命性。
19. 丁二酸盐:C4H6O4,无色固体,常用于制造塑料和染料。
20. 丙二醇:C3H8O2,无色液体,是一种常见的溶剂和增塑剂。
有机化学基础

代,每从 CH4 分子中取代 1 mol H 原子,就消耗1 mol Cl2
分子。
(2)烯烃、炔烃的加成反应
(3)氧化反应
①燃烧
名称
现象
化学方程式
甲烷
淡蓝色火焰
CH4+2O2—点—燃→
CO2+2H2O
乙烯 火焰明亮并产生黑烟
C2H4+3O2—点—燃→
指点迷津 同分异构体概念的理解 (1)分子结构式的写法与分子真实结构的差别。如
和
是同种物质,而不是同分异构体。
(2)同分异构体的分子式、相对分子质量、最简式都相同, 但相对分子质量相同的化合物不一定是同分异构体,如 C2H6 与 HCHO;最简式相同的化合物也不一定是同分异构体,如 C2H2 与 C6H6。
(1)列表比较
异同点
芳香烃 苯的同系物 芳香族化合物
含有的 只含碳和氢 只含碳和氢元
含碳和氢元素
元素
元素
素
共同点
结构
都含有苯环
特点
除碳和氢元素
含有的 只含碳和氢 只含碳和氢元外还含有其他来自不同点 元素元素
素
元素
通式
无通式 CnH2n-6 (n≥6)
无通式
(2)用集合表示其关系
2.苯与溴单质要发生取代反应,必须用液溴,并且有合适
有机化学基础 第 2 讲 烃和卤代烃
基础盘点
一、烷烃、烯烃和炔烃 1.代表物的组成和结构
2.概念及通式 (1)烷烃是分子中碳原子之间以单键结合成链状,碳原子剩 余的价键全部跟氢原子结合的烃,其通式为 CnH2n+2(n≥1) ; (2)烯烃是分子里含有一个 碳碳双 键的不饱和链烃,分 子通式为 CnH2n(n≥2) ; (3)炔烃是分子里含有一个 碳碳三 键的不饱和链烃,分子 通式为 CnH2n-2(n≥2) 。
有机化学试题库及答案

有机化学试题库及答案一、选择题(每题2分,共20分)1. 下列化合物中,哪一个是醇?A. CH3COOHB. CH3CH2OHC. CH3CH2COOHD. CH3CH2CH3答案:B2. 以下哪个反应是酯化反应?A. 醇与酸的氧化反应B. 醇与酸的还原反应C. 醇与酸的脱水反应D. 醇与酸的加成反应答案:C3. 以下化合物中,哪一个是芳香烃?A. CH4B. C6H6C. C4H10D. C3H8答案:B4. 以下哪种反应是取代反应?A. 醇的脱水反应C. 醇的酯化反应D. 醇的氢化反应答案:C5. 以下化合物中,哪一个是醛?A. CH3CHOB. CH3COCH3C. CH3CH2OHD. CH3COOH答案:A6. 以下哪种反应是消除反应?A. 醇的脱水反应B. 醇的氧化反应C. 醇的酯化反应D. 醇的氢化反应答案:A7. 以下化合物中,哪一个是酮?A. CH3COCH3B. CH3CH2OHC. CH3CH2COCH3D. CH3COCH2CH3答案:A8. 以下哪种反应是加成反应?B. 醇的氧化反应C. 醇的酯化反应D. 醇的氢化反应答案:D9. 以下化合物中,哪一个是羧酸?A. CH3COOHB. CH3CH2OHC. CH3CH2COOHD. CH3CH2CH3答案:A10. 以下哪种反应是氧化反应?A. 醇的脱水反应B. 醇的氧化反应C. 醇的酯化反应D. 醇的氢化反应答案:B二、填空题(每空1分,共20分)1. 有机化学中,碳原子的价电子数是________。
答案:42. 醇类化合物的官能团是________。
答案:-OH3. 芳香烃的典型代表是________。
答案:苯4. 酯化反应的产物是________和水。
答案:酯5. 取代反应是指有机化合物分子中的原子或原子团被其他原子或原子团所________。
答案:替换6. 消除反应是指有机化合物分子中的两个相邻原子或原子团被________。
有机化学课后答案

有机化学课后答案集团标准化工作小组 #Q8QGGQT-GX8G08Q8-GNQGJ8-MHHGN#第一章 绪论扼要归纳典型的以离子键形成的化合物与以共价键形成的化合物的物理性质。
答案:1.2CH 4 及CCl 4各1mol 混在一起,与CHCl 3及CH 3Cl 各1mol 的混合物是否相同为什么答案: NaCl 与KBr 各1mol 与NaBr 及KCl 各1mol 溶于水中所得溶液相同。
因为两者溶液中均为Na + , K + , Br -,Cl -离子各1mol 。
由于CH 4 与CCl 4及CHCl 3与CH 3Cl 在水中是以分子状态存在,所以是两组不同的混合物。
碳原子核外及氢原子核外各有几个电子它们是怎样分布的画出它们的轨道形状。
当四个氢原子与一个碳原子结合成甲烷(CH 4)时,碳原子核外有几个电子是用来与氢成键的画出它们的轨道形状及甲烷分子的形状。
答案:写出下列化合物的Lewis 电子式。
a. C 2H 2b. CH 3Clc. NH 3d. H 2Se. HNO 3f. HCHOg. H 3PO 4h. C 2H 6i. C 2H 2j. H 2SO 4答案:下列各化合物哪个有偶极矩画出其方向。
a. I 2b. CH 2Cl 23 e. CH 3OH f. CH 3OCH 3 答案: 1.6 根据S 与O 的电负性差别,H 2O 与H 2S 相比,哪个有较强的偶极-偶极作用力或氢键 答案:电负性 O > S , H 2O 与H 2S 相比,H 2O 有较强的偶极作用及氢键。
第二章 饱和脂肪烃2.2 用系统命名法(如果可能的话,同时用普通命名法)命名下列化合物,并指出(c)和(d) 中各碳原子的级数。
a.CH 3(CH 2)3CH(CH 2)3CH 3C(CH 3)22CH(CH 3)2 b.C H C H C H H C HH C H H C H H H c.CH 322CH 3)2CH 23d.CH 3CH 2CH CH 2CH 3CH CH 2CH 2CH 3CH 3CH 3e.C CH 3H 3C 3H f.(CH 3)4Cg.CH 3CHCH 2CH 3C 2H 5h.(CH 3)2CHCH 2CH 2CH(C 2H 5)21。
有机化学概论

2s2 2px1 2py1 2pz为价轨道,其中的电子为价电子。
杂化轨道能量 处于2s和2p轨 道能量之间
C在形成化学键时,2s轨道与三个2p轨道杂化形成四个 能级相等、形状相同的sp3杂化轨道,每个轨道中一个电子。
sp3杂化轨道形状
spsp轨道可以自身和相互间形成cc键形成饱和的不饱和的碳链或spsp也都能与其它原子轨道形成cxcocn不等性杂化spsp杂化同一组杂化轨道中的s和p的成分相同轨道的夹角也相等称为等性在形成某种分子如环丙烷时2s与三个2p轨道杂化得到的一组杂化轨道每个轨道中的s和p的成分不是相等的轨道的能级夹角也不完全相等这一组轨道称为不等性杂化轨道
1.2 有机化合物的结构特征
一、 共价键的形成 二、 共价键的基本属性 三、 共振论 四、 有机化合物构造式的表示法 五、 键的极性在链上的传递——诱导效应
1.2 有机化合物的结构特征
一、共价键的形成:
1、价键法
• ⑴ 基本思路:在形成化学键时,原子的能级相近的价轨 道进行 “杂化”,形成新的价轨道,价电子的排布也随 之改变,利用杂化轨道与其它原子形成共价键。 轨道的 “杂化”、“成键”等过程是同时完成的。
常见共价键的键能(单位:kJ/mol, 25oC, 气相)
⑵ 键能的用途: 可用键能数据估计化学反应的焓变
例1.估算甲烷氯化生成二氯甲烷的反应焓: CH4+2Cl2——>CH2Cl2+2HCl
生成新键放热:2个C—Cl 2×339=678 kJ/mol 2个H—Cl 2×432=864 kJ/mol
C—I > C—Br> C—Cl> C—F; C=C的极化度比C-C的大; 外电场越强(带电荷多)键的极化度越大。 成键电子和原子核都在运动中,也能使非极性键 在瞬间产生极性。
有机化学名词详解

有机化学名词详解有机化学概念解析有机化合物碳氢化合物及其派生而得的化合物。
比如:ch4、ch3ch3、ch3ch2oh同分异构体分子式相同而结构相异因而其性质也各异的化合物。
例如:乙醇(ch3ch2oh)和甲醚(ch3och3)共价键的均裂及自由基反应两个原子之间的共用电子对光滑对立,两个原子各留存一个电子。
共价键的这种脱落方式称作键的歧化。
键歧化产生了具备未成对电子的原子或原子团叫作自由基(游离基)。
自由基性质非常开朗,可以稳步引发一系列反应(链反应)。
存有自由基参予的反应叫作自由基反应。
比如:aba均裂快快+broor2roro+hbrroh快+brbr+ch2chch3hbr快brch2chch3brch2chch3+brch2ch2ch3+br共价键的异裂及离子型反应共价键脱落时,两个原子之间的共用电子对全然迁移至其中的一个原子上。
共价键的该脱落方式称作键的异裂。
由共价键异裂产生离子而展开的反应叫作离子型反应。
比如:aba+b-r3cbr异裂慢r3c++br-1r3c+oh2+快+-hr3coh2+r3coh亲电试剂在反应过程中,如果试剂从有机化合物中与它反应的那个原子获得电子对并与之共用形成化学键,这种试剂称做亲电试剂。
比如:h+、so3、bf3、alcl3、+no2等均为亲电试剂。
亲核试剂在反应过程中,如果试剂把电子对给予有机化合物与它反应的那个原子并与之共有形成化学键,这种试剂称做亲核试剂。
比如:-oh、-nh2、-cn、h2o、nh3等所含孤对电子的分子和负离子都就是和亲核试剂。
官能团官能团是指分子中比较活泼、容易发生某些特征反应的原子(如卤素原子)、原子团或某些特征的化学键结构单元等。
cc比如:-cl、-oh、-cooh、桥环的特定编号原则等从某一桥头碳已经开始,沿最久的桥编成至另一个桥头碳,随后稳步编成较长的桥至初始桥头碳,最后编成最短的桥。
ch2chch2ch2ch3ch2ch2ch3ch3例如:ch2ch双环〔3.2.1〕辛烷2-甲基双环〔2.2.1〕-2-庚烯7,7-二甲基双环〔4.1.0螺环的特定编号原则螺环的编号先从小环上与螺原子相邻的碳原子开始,沿小环经螺原子编到另一大环。
有机化学知识点归纳(二)

(2)质量一定的有机物燃烧
规律一:从C+O2=CO2、6H2+3O2=6H2O可知等质量的碳、氢燃烧,氢耗氧量是碳的3倍。
可将 → ,从而判断%m(H)或%m(C)。
推知:质量相同的烃( ),m/n越大,则生成的CO2越少,生成的H2O越多,耗氧量越多。
规律二:质量相同的下列两种有机物 与 完全燃烧生成CO2物质的量相同;质量相同的下列两种有机物 与 ,燃烧生成H2O物质的量相同。
C) 化学性质:
①葡萄糖类似醛类,能发生银镜反应、费林反应等;
②具有多元醇的化学性质。
(2)二糖
A) 代表物:蔗糖、麦芽糖(C12H22O11)
B) 结构特点:蔗糖含有一个葡萄糖单元和一个果糖单元,没有醛基;
麦芽糖含有两个葡萄糖单元,有醛基。
C) 化学性质:①蔗糖没有还原性,麦芽糖有还原性。②水解反应
有机化学知识点归纳(二)
一、有机物的结构与性质
1、官能团的定义:决定有机化合物主要化学性质的原子、原子团或化学键。
2、常见的各类有机物的官能团,结构特点及主要化学性质
(1)烷烃
A) 官能团:无 ; 通式:CnH2n+2; 代表物:CH4
B) 结构特点:键角为109°28′,空间正四面体分子。烷烃分子中的每个C原子的四个价键也都如此。
规律三:等质量的具有相同最简式的有机物完全燃烧时,耗氧量相同,生成的CO2和H2O的量也相同。或者说,最简式相同的有机物无论以何种比例混合,只要总质量相同,耗氧量及生成的CO2和H2O的量均相同。
(3)由烃燃烧前后气体的体积差推断烃的组成
当温度在100℃以上时,气态烃完全燃烧的化学方程式为:
有机化学常用反应方程式汇总

光照 光照 光照 光照 高温 CaO △ 催化剂 加热、加压催化剂 △ 催化剂有机化学方程式汇总1. CH 4 + Cl 2 CH 3Cl + HCl2. CH 3Cl + Cl 2 CH 2Cl 2 + HCl3. CH 2Cl + Cl 2 CHCl 3 + HCl4. CHCl 3 + Cl 2 CCl 4+ HCl5. CH 4 C +2H 26. C 16H 34 C 8H 18 + C 8H 167. CH 3COONa + NaOH CH 4↑+ Na 2CO 38. CH 2 = CH 2 + Br 2 CH 2Br —CH 2Br9. CH 2 = CH 22OH10. CH 2 = CH 23—CH 2Br 11. CH 2 = CH 2CH 3 12. nCH 2 = CH 2 ] n13. nCH 22-CH=CH-CH 2] n14. 2CH 23CHO15. CH ≡CH + Br 2 CHBr = CHBr16. CHBr = CHBr+ Br 2 CHBr 2-CHBr 217. CH ≡CH + HCl H 2C = CHCl18. nCH 2 = CH [ CH 2-CH ] nCl Cl19. CH ≡CH + H 2O CH 3CHO20. CaC 2 + 2H 2O CH ≡CH ↑+ Ca(OH)2+ Br 222. + HO 2 +H 2O 23. + HO 3H+H 2O催化剂△浓硫酸170℃浓硫酸140℃催化剂△24.+ 3H2-NO22O26. 3CH≡C H27. CH3CH2Br + H228. CH3CH229. CH3CH22O30. 2CH3CH2OH+2Na 2CH3CH2ONa + H2↑31. 2CH3CH2OH+O2 2CH3CHO + 2H2O32. CH3CH2OH CH2 = CH2↑+ H2O33.C2H5OH+C2H5OH C2H5OC2H5+H2O34. 2O35. 2O -+H3O+2337+3HBr38. CH339. 2CH340. CH34+2Ag↓+3NH3+H2O 41CH32O↓+2H2O42. 2CH3COOH+2Na 2CH3COONa+H2↑43.2CH3COOH+Na2CO32CH3COONa+H2O+CO2↑44. CH3COOH+NaHCO3 CH3COONa+H2O+CO2↑45. CH3COOH + NaOH CH3COONa + H2O浓硫酸△催化剂催化剂催化剂催化剂催化剂△催化剂加热、加压+ 浓硫酸△+ 2H2OO OC —CO OCH2-CH246. 2CH3COOH + Cu(OH)2 (CH3COO)2Cu + 2H2O47.CH3COOH+CH3CH2OH CH3COOCH2CH3 +H2O48. CH3COOCH2CH3+NaOH CH3COONa+CH3CH2OH49. nOHCH2CH2COO H→[ OCH2CH2C ] n +H2O50. C6H12O6 (s) + 6O2 (g)6CO2 (g) + 6H2O (l)51. C6H12O62CH3CH2OH + 2CO252. C12H22O11+H2O C6H12O6+ C6H12O6蔗糖葡萄糖果糖53. C12H22O11 + H2O2C6H12O6麦芽唐葡萄糖54. (C6H10O5)n + nH2O n C6H12O6淀粉葡萄糖55. (C6H10O5)n + nH2O n C6H12O6纤维素葡萄糖56.C17H33COO-CH2C17H35COO-CH2C17H33COO-CH +3H2 C17H35COO-CHC17H33COO-CH2C17H35COO-CH257. C17H35COO-CH2CH2-OHC17H35COO-CH +3NaOH3C17H35COONa+ CH-OHC17H35COO-CH2CH2-OH58. CH2OH COOHCH2OH COOH1.HClClCHClCH+−→−+324光HClClCHClClCH+−→−+2223光2.3.4.5.6.7.8.222Br CH CH CH CH +=-= 9.10.11.12.13.14.15.16.17. OH NH Ag CHO CHOH HOCH 2342)(2)(+O H NH Ag COONH CHOH HOCH 2344232)(++↓+−→−∆18.19.20.21.高中有机化学知识点总结1.需水浴加热的反应有:(1)、银镜反应(2)、乙酸乙酯的水解(3)苯的硝化(4)糖的水解(5)、酚醛树脂的制取(6)固体溶解度的测定凡是在不高于100℃的条件下反应,均可用水浴加热,其优点:温度变化平稳,不会大起大落,有利于反应的进行。
有机化学第五版习题答案

《有机化学》(第五版,李景宁主编)习题答案 第一章3、指出下列各化合物所含官能团的名称。
(1) CH 3CH=CHCH 3 答:碳碳双键 (2) CH 3CH 2Cl 答:卤素(氯) (3) CH 3CHCH 3OH 答:羟基(4) CH 3CH 2 C=O 答:羰基 (醛基)H(5)CH 3CCH 3O答:羰基 (酮基)(6) CH 3CH 2COOH 答:羧基 (7)NH 2答:氨基(8) CH 3-C ≡C-CH 3 答:碳碳叁键4、根据电负性数据,用和标明下列键或分子中带部分正电荷和负电荷的原子。
答:6、下列各化合物哪个有偶极矩?画出其方向(1)Br 2 (2) CH 2Cl 2 (3)HI (4) CHCl 3 (5)CH 3OH (6)CH 3OCH 3 答:以上化合物中(2)、(3)、(4)、(5)、(6)均有偶极矩(2)H 2C Cl (3)HI (4) HCCl 3 (5)H3COH(6)H 3COCH 37、一种化合物,在燃烧分析中发现含有84%的碳[Ar (C )=12.0]和16的氢[Ar (H )=1.0],这个化合物的分子式可能是(1)CH 4O (2)C 6H 14O 2 (3)C 7H 16 (4)C 6H 10 (5)C 14H 22答:根据分析结果,化合物中没有氧元素,因而不可能是化合物(1)和(2); 在化合物(3)、(4)、(5)中根据碳、氢的比例计算(计算略)可判断这个化合物的分子式可能是(3)。
第二章习题解答1、用系统命名法命名下列化合物 (1)2,5-二甲基-3-乙基己烷 (3)3,4,4,6-四甲基辛烷 (5)3,3,6,7-四甲基癸烷(6)4-甲基-3,3-二乙基-5-异丙基辛烷2、写出下列化合物的构造式和键线式,并用系统命名法命名之。
(3)仅含有伯氢和仲氢的C 5H 12答:符合条件的构造式为CH 3CH 2CH 2CH 2CH 3;键线式为; 命名:戊烷。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
F-C反应
-H
弱 -X 间位定位基 (GII) 中 强
a.
基准
弱钝化
-CN, -SO3H,
O
+
中钝化 强钝化
O R
不能进行
-NR3, -NO2, -CX3
F-C反应a
的亲电能力较弱。
亲电试剂的亲电能力不同,影响反应能否发生。R和
定位规律涉及的影响因素
诱导效应 电子效应 共轭效应
空间效应
定位基电子效应的理论解释:I效应与C效应共同作用的结果。
+
N(CH3)3
or
对位
H E N(CH3)3
Hale Waihona Puke EHE N(CH3)3
H E
or
H E
间位
三甲胺基的定位效应解释(3)
N(CH3)3 H N(CH3)3 H N(CH3)3 H E E E
不稳定
N(CH3)3
N(CH3)3
N(CH3)3
H
E
H
E
不稳定
H
E
N(CH3)3
N(CH3)3
N(CH3)3
H
H
4.5 苯环上亲电取代反应定位规律
第三章作业 P66
(四)(3)
(E)-2-甲基-1-氟-1-氯-1-丁烯
注意:较优基团后列出,P96
第三章作业 P67
(八)(2)(3)(4)
Br
+
δ Br CH2 C H3 δ C C H3
+
+
C H3
C C H3
CH2
H 2O
第三章作业 P67
(八)(2)(3)(4)
小结
一、定位规律 »1、邻、对位定位基(识记常见定位基的定位能力大小顺序) »2、间位定位基(识记常见定位基的定位能力大小顺序) 二、定位规律的解释 1、邻、对位定位基(甲苯、苯酚、氯苯) 2、间位定位基(硝基苯) 三、二取代苯的定位规律 »1、定位规律一致 »2、定位规律不一致 四、空间效应 五、定位规律在有机合成中的应用实例
卤代反应
硝化反应
磺化反应
+
R
发烟 H2SO4 X , AlCl3
R
烷基化反应 Friedel-Crafts 反应
R
O R C X , AlCl3 O C
酰基化反应
(CH2O)3+HCl, ZnCl2 CH2Cl
氯甲基化反应
+浓HONO2
浓H2SO4 50-60 C
o
NO2 +H2O
CH3
+ 浓 HONO2
—— +I增加苯环上所有碳原子的电子密度(与苯相比较),‐I效 应降低电子密度。 ——共轭和超共轭效应沿苯环的共轭链只能传递到定位基的邻位 和对位,不能传递到间位碳原子上:+C、-C效应使邻、对位电子密 度增加或降低较多,而+C、‐C效应使间位电子密度增加或降低较 少。 例:﹣CH3,﹣OH和﹣NO2。 ﹣CH3:+I和+C; ﹣OH:‐I和+C;
二取代苯的定位规律
在二取代苯中引入第三个取代基时,新引入的
取代基进入苯环上的位置将由原来的两个定位基 共同决定。 1、当两个定位基的定位效应一致时:它们的作用可 互相加强,第三个基团进入它们共同确定的位置。 2、当两个定位基的定位效应不一致时: »属于同类,第三个基团进入的位置,通常较强 定位基决定。 »属于不同类,第三个基团进入的位置,通常第 一类定位基决定。
-I
<
+C
羟基是活化基团,可以活化邻、间、对位, 尤其活化邻、对位。
羟基的定位效应解释(2)
OH H E or OH H E
邻位
OH OH or
OH
E
+
对位
H E OH
H OH
E
H E
or
H E
间位
羟基的定位效应解释(3)
氯原子的定位效应解释(1)
Cl
Cl
O
Cl O O
-I
>
+C
卤原子是钝化基团,可以钝化邻、间、对位, 但是由于+C补偿,邻、对位活性降低较少。
H
E
E
E
硝基的定位效应解释(1)
O N O
O N
O O O
O
NO2 NO2 0.70 0.705 0.79 0.72
硝基是钝化基团,可以钝化邻、间、对位,由 于-C,邻、对位活性降低较多。
-I
-C
硝基的定位效应解释(2)
NO2 H E or NO2 H E
邻位
NO2 NO2
+
NO2
or
E
对位
H E NO2
中等活化
•间位定位基的特点:
①与苯环相连的原子带有正电荷、或双键、或叁
键。
②这些基团能使苯环钝化、亲电取代比苯难。 强钝化 -N+R3,-NO2,-CF3 ,-CCl3
中等钝化 -COR,-CHO,-COOH,-COOR烷氧羰基, -CONH2氨基甲酰基,-SO3H,-CN,
芳香亲电取代反应速率和定位的决定因素 邻对位定位基 (GI) 强 中 弱 -OӨ, -NR2, -NHR, -NH2, -OH -NHCOR, -OR, -OCOR -R, -Ar 反应速率 强活化 中活化 弱活化 能够进行 备注
C H3
HNO3 H2SO 4
C H3 NO2 > 99% NO2
NH2
NO2
OH
NO2
NO2 CH3
CN
多取代苯的定位规律
1.活化基团的作用超过钝化基团;
2.取代基的作用具有加和性;
3.第三取代基一般不进入1,3-取代苯的2位。
4.5.4 定位规律的应用
CH(CH3)2 例1 Cl 在合成之前,先要考虑几个问题: (1)要考虑定位规律和空间效应。 SO 3H (2)要考虑引入三个基团的先后顺序。 (3)要考虑反应的难易,产率的高低。一般是先引入供电子基和大 基团。
20 %
定位规律
当苯环上已有一个取代基,再进行亲电取代反 应时,第二取代基的取代位置由苯环上原取代基所 决定,而与第二取代基的性质无关,这一效应称之 取代基的定位效应(orientation effect)。苯环 上原有的取代基称为定位基。
一取代苯的两类定位基
邻对位定位基
—O¯ ; —N(CH3)2; —NH2; —OH; —OCH3; —NHCOCH3; —OCOCH3; —R; —Cl; —Br; —I; —C6H5 —N+(CH3)3; —NO2; —CN; —SO3H; —CHO; —COCH3; —COOH; —COOCH3; —CONH2; —NH3+;
-萘乙酸:植物生长激素
4.6.2.2 萘的二环取代 (自学)
4.6.2.3 加成反应(自学)
4.6.2.4 氧化反应
CrO3-HOAc 25 C
O
0
O
1,4-萘醌
V2O5, 空气 385~390 C
0
O
O
O
邻苯二甲酸酐
增塑剂:邻苯二甲酸酯类
4.7 其他稠环芳烃
(β ) 6 (α ) 8 (β ) 7 (β ) 6 5 (α ) 10 (γ ) 蒽 4 (α ) (γ ) 9 (α ) 1 2 (β ) 3 (β ) (β ) 3 (β ) 2 1 (α ) 10 (γ ) 菲 (α ) (α ) 5 4 7 (β ) 8 (α ) 9 (γ )
间位定位基
•邻、对位定位基的特点:
①与苯直接相连的原子不含有双键和叁键,除烃
基外,通常带有未共用电子对。
②邻、对位取代基都能使苯环活化(卤素除外) 使取代反应易进行。
-NH2、 -NR2, -OH, -OR 强烈活化
-NHCOR酰胺基, -OCOR酰氧基
-CH3(-R), -Ar -X(Cl,Br,I) 弱活化 弱钝化
E H
E H
......
卤化
Cl2 FeCl3
Cl HCl 70%
硝化
HNO3 H2SO4 25℃~50℃
NO2
70% α -硝基萘
磺化
-萘磺酸
-萘磺酸
与氯乙酸的反应
低温时,主要生成α-萘磺酸; 高温时,则主要生成β-萘磺酸。
CH2COOH FeCl3-KBr + ClCH2COOH 200-218oC
H NO2
E
H E
or
H E
间位
硝基的定位效应解释(3)
NO2 orth o电荷集中
E H
NO2
E H
NO2
E H
l e ss stable paraE NO2
NO2
NO2
NO2
H NO2
E H l e ss stable E H
E NO2
H
m e ta-
E H
E H 间位取代中间体较稳定
空间效应
CH(CH3)2 CH3CH AlCl3 CH2
Cl2 FeCl3 H2SO 4 100度
CH(CH3)2 Cl CH(CH3)2
由于空间效应 产率不高。 CH(CH3)2
Cl2 FeCl3 SO 3H
Cl SO 3H
4.5.4 定位规律的应用
如何由苯合成下列化合物?
NO2
NO2
Br
COCH3
4.5.4 定位规律的应用
空间效应对苯环上第一类定位基定位的影响:不 利于邻位取代,使对位取代增多。
» 试剂不同,苯环上取代基大小不同。 » 反应物相同,亲电试剂体积大小不同。 » 反应物的取代基和试剂的体积均较大。
