5-氟尿嘧啶诱导人大肠癌多药耐药细胞株及细胞凋亡的实验研究
5-氟尿嘧啶及其衍生物抗肿瘤作用的研究进展

5-氟尿嘧啶及其衍生物抗肿瘤作用的研究进展晁艳红;杨广建;齐丽娟;潘静;杨春洁;孙永琨【摘要】5-氟尿嘧啶(5-FU)作为一种细胞周期特异性抗代谢药物,因其抗瘤谱广,有效率高,被广泛应用于各类实体瘤的治疗.随着现代肿瘤学的不断发展,替加氟、卡莫氟、尿嘧啶替加氟(UFT)、卡培他滨、替吉奥、TAS-102等一系列新型5-FU衍生物被逐渐研发出来,并继续在消化系统肿瘤、肺癌、乳腺癌等多种肿瘤治疗中发挥重要的抗肿瘤作用.目前关于5-FU及其衍生物抗肿瘤作用的研究进展尚无全面、详尽的总结,本文对此进行概括与综述,以提高临床肿瘤科医师对经典抗代谢类肿瘤药物的认识.【期刊名称】《癌症进展》【年(卷),期】2019(017)001【总页数】4页(P9-12)【关键词】5-氟尿嘧啶;衍生物;代谢;抗肿瘤【作者】晁艳红;杨广建;齐丽娟;潘静;杨春洁;孙永琨【作者单位】首都医科大学密云教学医院肿瘤内科,北京 101500;国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院内科,北京100021;北京市朝阳区三环肿瘤医院肿瘤科,北京 100021;河南大学附属郑州颐和医院肿瘤科,郑州 450000;赤峰市医院肿瘤内科,内蒙古赤峰 024000;国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院内科,北京100021【正文语种】中文【中图分类】R730.53氟尿嘧啶合成至今已有60余年历史,抗瘤谱广,目前仍是包括消化系统肿瘤在内的多种恶性肿瘤的基础性治疗药物。
5-氟尿嘧啶(5-fluorouracil,5-FU)为细胞周期特异性药物,作用于细胞S期,其作用有时间依赖性,持续静脉滴注可提高疗效,联合亚叶酸钙有协同作用。
5-FU一直是治疗大肠癌的主要药物,其单药有效率为20%左右。
20世纪70年代以来,以5-FU为核心进行了多方面研究,以期提高疗效,延长生存期。
1 5-氟尿嘧啶的抗肿瘤作用机制及临床应用1957年,Heidelberger等[1]首次设计并发现将尿嘧啶的第5位氢原子以大小相近的氟原子取代后所得到的氟化物不仅体积与原化合物相似,而且形成的C—F键非常稳定,在代谢过程中不易分解,能在分子水平上干扰正常代谢。
5-FU相关的药物疗效及毒性预测分子

高药物的敏感性.
用免疫印记的方法检测了20个大肠癌患者的dUTP核苷酸 水解酶的表达 发现其中核dUTPase阳性的8个患者(核内阳性表达>10%), 没有一个人对5-FU敏感;而另外12个dUTPase阴性的患者
却对5-FU敏感(P = 0.005).
不同患者对同一药物反应不同 根据肿瘤自身药物敏感性为指导开展个体
化的药物治疗
个体化的化疗
恶性肿瘤的分子学分类 药物敏感性相关基因
药物基因组学 (pharmacogenomics)、 药物遗传学 (pharmacogenetics)
2005年广东省自然科学基金重点项目
:
“实现肿瘤化疗个体化的研究 ” 林桐榆
2004年广州市科技计划项目
“二氢嘧啶脱氢酶基因的单核苷酸多态性与
5-Fu的个体化治疗” 姜文奇
5-FU作为消化道肿瘤最常用的化疗药物之
一,其疗效与毒性相关基因的研究备受瞩目。
与5-FU相关基因的基础研究早已广泛开展,
其具体机制也有较明确的认识
5-FU的代谢特点
相关药物效应分子 毒性预测分子
Horiguchi等:119例乳腺癌术后患者(87例术后接受5-FU为 主的化疗)的DPD表达与预后的关系:DPD阳性患者的无病生 存期少于阴性患者,两者有显著性差异(P<0.05)。还证明了淋 巴结的转移与DPD的表达都可以作为无病生存期的独立预后指 标。相似的结果在肠癌患者的研究中也有报道
1. 直肠癌:TS表达水平可以作为复发和远处转移的独立预测指标.
2. 但有研究发现在胰腺癌患者中,TS高表达却预示着生存期越长,具体 机制尚不清楚.
氟尿嘧啶及其衍生物的临床应用原理
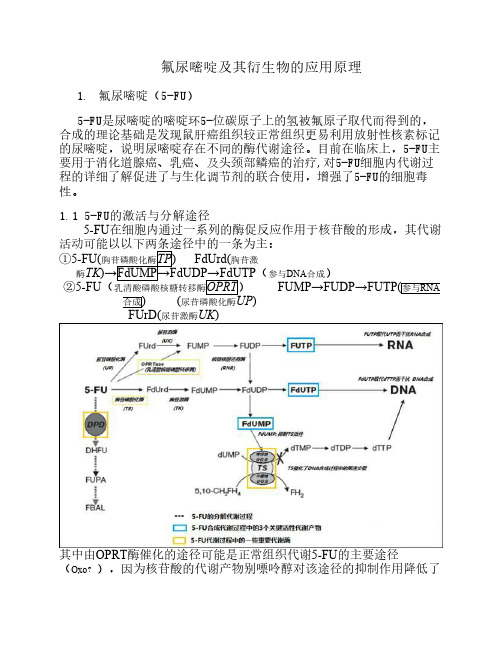
氟尿嘧啶及其衍生物的应用原理1. 氟尿嘧啶(5-FU)5-FU是尿嘧啶的嘧啶环5-位碳原子上的氢被氟原子取代而得到的,合成的理论基础是发现鼠肝癌组织较正常组织更易利用放射性核素标记的尿嘧啶,说明尿嘧啶存在不同的酶代谢途径。
目前在临床上,5-FU主要用于消化道腺癌、乳癌、及头颈部鳞癌的治疗,对5-FU细胞内代谢过程的详细了解促进了与生化调节剂的联合使用,增强了5-FU的细胞毒性。
1.1 5-FU的激活与分解途径5-FU在细胞内通过一系列的酶促反应作用于核苷酸的形成,其代谢活动可能以以下两条途径中的一条为主:①5-FU(胸苷磷酸化酶TP) FdUrd(胸苷激酶TK)→FdUMP→FdUDP→FdUTP(参与DNA合成)②5-FU(乳清酸磷酸核糖转移酶OPRT) FUMP→FUDP→FUTP(参与RNA合成) (尿苷磷酸化酶UP)FUrD(尿苷激酶UK)其中由OPRT酶催化的途径可能是正常组织代谢5-FU的主要途径(Oxo?),因为核苷酸的代谢产物别嘌呤醇对该途径的抑制作用降低了5-FU对骨髓和胃肠道粘膜的毒性反应。
而且发现在一些种类的癌细胞中,代谢5-FU主要通过TP和UP的作用。
不过虽然某一类癌细胞中某一代谢途径占优势,但两条途径通常都会被利用。
5-FU的分解途径如下:5-FU(二氢吡啶脱氢酶DPD) DHFU(二氢嘧啶酶) FUPA FBAL(二氢氟尿嘧啶) (α氟脲基-丙酸) (氟-β丙氨酸)DPD催化5-FU还原成二氢氟尿嘧啶的反应是5-FU分解代谢的初始限速反应,5-乙炔基尿嘧啶是DPD的灭活剂,同时口服时5-FU的生物利用度接近100% DPD的活性影响 5- FU的抗肿瘤活性,但是,大剂量的DPD的缺失与5-FU用药后的严重毒性反应相关。
1.2 5-FU的作用机制1.2.1 对胸苷酸合成酶(TS)的抑制作用FdUMP与胸苷酸合成酶(TS)紧密结合阻止dTMP的合成,dTMP是生成dTTP的关键底物,而dTTP是DNA的合成和修复的必需物质。
5fu方案

5FU方案引言5-氟尿嘧啶(5-fluorouracil,5-FU)是一种抗癌药物,被广泛用于治疗多种恶性肿瘤,如结直肠癌、胃癌和乳腺癌等。
5-FU方案是一种使用5-FU作为核心药物的化疗方案,通常与其他化疗药物联合应用。
本文将详细介绍5FU方案的组成、作用机制、适应症、药物给药方式和常见副作用等。
1. 5FU方案的组成5FU方案通常是由5-FU及其他辅助药物组成的复合方案。
常见的5FU方案包括FOLFOX方案、FOLFIRI方案、FLOX方案等。
以下是各方案的具体组成:•FOLFOX方案:5-FU、氧铂(oxaliplatin)和白蛋白紫松(leucovorin)•FOLFIRI方案:5-FU、伊立替康(irinotecan)和白蛋白紫松•FLOX方案:5-FU、氧铂和长春新碱(vincristine)这些方案的具体组成可能会因病情而有所不同,需根据患者的具体情况和医生的建议进行选择。
2. 5FU方案的作用机制5-FU作为一种抗癌药物,其作用机制主要与DNA和RNA的合成有关。
5-FU经过转化后可进入细胞内,在酶的作用下转化为5-脱氧尿嘧啶核苷酸(FdUMP),FdUMP可与脱氧尿苷酸合成酶(thymidylate synthase)结合,抑制脱氧尿苷酸的合成。
这样一来,细胞内的DNA合成受到抑制,从而阻断肿瘤细胞的生长和增殖。
此外,5-FU还可通过抑制脱氧核糖核酸环化酶(ribonucleotide reductase)的活性,阻断RNA合成,增加细胞毒性。
另外,5-FU还可通过干扰血管生成、调节细胞凋亡等途径发挥抗肿瘤作用。
3. 5FU方案的适应症5FU方案适用于多种恶性肿瘤的治疗,主要包括以下疾病:•结直肠癌:结直肠癌是5FU方案最常使用的适应症之一。
5FU方案可用于手术前的辅助化疗,或用于晚期结直肠癌的姑息治疗。
•胃癌:5FU方案可用于手术前的辅助化疗,或用于晚期胃癌的姑息治疗。
•乳腺癌:5FU方案可用于乳腺癌的化疗,通常与其他化疗药物联合应用。
5fu方案

5fu方案5-FU方案引言5-FU方案是一种常用于治疗癌症的化学治疗药物方案之一。
5-FU,即5-氟尿嘧啶(5-Fluorouracil),是一种氟代嘧啶类抗癌药物。
在过去的几十年里,5-FU方案已经被广泛应用于多种癌症的治疗中,如结直肠癌、胃癌和乳腺癌等。
本文将重点介绍5-FU方案的药理学、使用方法和副作用等信息。
5-FU方案的药理学5-FU通过抑制嘌呤和嘧啶的合成,阻断了DNA链的合成,从而抑制了癌细胞的增殖。
此外,5-FU还可以抑制胞嘧啶脱氨酶的活性,从而增加细胞内的脱氨酶水平,导致细胞毒性加强。
总的来说,5-FU方案通过多种机制来抑制癌细胞的生长和分裂。
5-FU方案的使用方法5-FU方案一般通过静脉注射给药。
其具体的剂量和给药频率会根据患者的具体情况和癌症的类型来确定。
通常情况下,5-FU方案会作为其他抗癌药物方案的一部分使用,以增强治疗效果。
在治疗过程中,医生会根据患者的反应和耐受性来进行调整剂量。
通常情况下,5-FU方案需要连续几周或几个月的治疗才能达到最佳效果。
5-FU方案的副作用5-FU方案的使用可能会引起一系列副作用。
常见的副作用包括恶心、呕吐、腹泻、口腔溃疡、疲劳和脱发等。
这些副作用通常是暂时的,随着治疗的进展,会逐渐减轻或消失。
然而,一些罕见但严重的副作用,如心脏毒性和骨髓抑制等,也可能发生。
因此,在使用5-FU方案治疗癌症时,医生需要密切监测患者的身体情况,以及根据副作用的发生情况来调整治疗方案。
5-FU方案的注意事项在使用5-FU方案治疗癌症时,有一些注意事项需要遵守。
首先,患者需要按照医生的指导准确地服用药物。
如果漏服了药物,应尽快联系医生进行咨询。
其次,患者需要定期进行血液检查和身体检查,以及向医生报告任何副作用的变化。
此外,患者应该避免接触其他病人的体液,以减少感染的风险。
最后,患者在治疗期间需要注意自己的饮食和生活习惯,保持健康的生活方式。
结论5-FU方案是一种常用的化学治疗药物方案,广泛应用于各种癌症的治疗中。
中药抗肝癌作用机制的研究进展

910 pmol/L苦参碱和227 Imaol/L盐酸川芎嗪),结
传统中药参与肝癌的综合治疗对改善患者症状
性肿瘤细胞,而是诱导其分化为正常或接近正常的
细胞。郭霞等口1以人肝癌BEL.7402细胞为研究对
象,探讨黄芩苷对细胞分化的影响,结果显示,经 黄芩苷作用后该细胞趋于成熟分化。与对照组相比,
涉及凋亡基因的大量表达,核转录因子(NF)一心表
达下调,端粒酶活性抑制及Caspase途径的激活。 1.4抑制肿瘤血管生成 肿瘤新生血管生成与肿瘤的生长及其转移密切 相关。肝癌是典型的富血管性恶性肿瘤,阻断肿瘤 血供有望成为肝癌治疗的突破1:3[14】。樊讯等n列观 察麝黄消瘤方对肝癌H2:模型小鼠肝癌细胞侵袭和
黄芩苷组的丫_谷氨酰转移酶()'-GT)比活力、胎盘
型碱性磷酸酶(PALP)活性及甲胎蛋白(AFP)分泌 量明显较低,碱性磷酸酶(ALP)比活力、白蛋白分 泌及细胞内环磷腺苷(cAMP)含量明显较高。同时, 研究还显示,随着黄芩苷浓度的增加和作用时间的 延长,BEL.7402细胞G。/G。期比例逐步增高,S期 细胞减少。这些生化指标的变化均提示黄芩苷能诱 导肝癌细胞分化,且与细胞周期调节密切相关。王
肝癌细胞的凋亡,且效果明显,如吡霜(三氧化二
砷,As20,)能够显著抑制人肝癌细胞株HepG2的 增生,并诱导其凋亡。As:O,诱导的肝癌细胞凋亡
通过Caspase一3途径实现,伴随着Caspase.3和聚腺
间和剂量依赖性。郭昱等H1应用MTT比色法观察
美洲大蠊提取物逆转BEL-7402/5-Fu多药耐药性的作用及机制研究

美洲大蠊提取物逆转BEL-7402/5-Fu多药耐药性的作用及机制研究王瑶;李婷;乔婷婷;刘俊勇;沈琦;彭芳【摘要】目的探讨美洲大蠊提取物CⅡ-3和脱脂膏逆转BEL-7402/5-Fu细胞多药耐药性的作用及可能的作用机制。
方法通过测定BEL-7402/5-Fu细胞生长曲线和细胞凋亡率,以及P-gp的摄取情况,探索美洲大蠊提取物体外逆转BEL-7402/5-Fu的作用。
结果CⅡ-3和脱脂膏对BEL7402/5-Fu 的抑制率、逆转倍数及细胞凋亡率随浓度增加逐渐增大,且差异无统计学意义,说明CⅡ-3与脱脂膏对耐药细胞的逆转效果及诱导凋亡作用相当。
CⅡ-3和脱脂膏能减弱P-gp的外排功能,且脱脂膏较CⅡ-3作用强,细胞内药物蓄积量较多。
结论美洲大蠊提取物CⅡ-3和脱脂膏能够有效逆转人肝癌BEL-7402/5-Fu 细胞的多药耐药性,其逆转作用机制主要通过诱导耐药细胞凋亡和抑制 P-gp蛋白的表达。
【期刊名称】《药学研究》【年(卷),期】2017(036)006【总页数】4页(P315-318)【关键词】美洲大蠊逆转肝癌多药耐药性【作者】王瑶;李婷;乔婷婷;刘俊勇;沈琦;彭芳【作者单位】[1]大理大学药学与化学学院,云南大理671000 [2]上海交通大学药学院,上海200240;;[1]大理大学药学与化学学院,云南大理671000 [2]上海交通大学药学院,上海200240;;[1]大理大学药学与化学学院,云南大理671000 [2]上海交通大学药学院,上海200240;;[1]大理大学药学与化学学院,云南大理671000 [2]上海交通大学药学院,上海200240;;[1]大理大学药学与化学学院,云南大理671000 [2]上海交通大学药学院,上海200240;;[1]大理大学药学与化学学院,云南大理671000 [2]上海交通大学药学院,上海200240【正文语种】中文【中图分类】R963肝癌是全球最常见的恶性肿瘤,我国肝脏恶性肿瘤的发病率和致死率占全球一半以上[1-2],多药耐药性(multi-drug resistance,MDR)的出现,降低了化疗药物的疗效。
5-氟尿嘧啶-1-基乙酸与5-氟尿嘧啶抗肿瘤作用的比较的开题报告

5-氟尿嘧啶-1-基乙酸与5-氟尿嘧啶抗肿瘤作用的比较的开题报告一、研究背景:5-氟尿嘧啶(5-FU)是一种广泛使用的化疗药物,可用于治疗多种肿瘤,如胃癌、结肠癌、乳腺癌等。
5-FU被认为是一种锶促进剂,可诱导细胞死亡,从而抑制肿瘤细胞增殖。
然而,5-FU的毒副作用较大,易导致胃肠道反应和骨髓抑制等,限制了其临床应用。
因此,寻找新的5-FU衍生物,以提高其治疗效果和减少毒副作用,具有重要的临床意义。
二、研究目的:本研究旨在比较5-氟尿嘧啶-1-基乙酸和5-氟尿嘧啶对肿瘤的抗增殖作用,探讨两种药物的治疗效果和毒副作用,为临床治疗提供参考。
三、研究方法:1. 细胞培养和处理:选取人结肠癌细胞株HCT116,在RPMI 1640培养基中培养至60%-70%的密度,分别用5-氟尿嘧啶-1-基乙酸和5-氟尿嘧啶处理细胞,浓度分别为5 μg/mL、10 μg/mL、20 μg/mL、40 μg/mL和80 μg/mL。
2. 细胞增殖检测:采用MTT法检测细胞增殖率,统计5-氟尿嘧啶-1-基乙酸和5-氟尿嘧啶处理后的IC50值。
3. 细胞凋亡检测:采用Annexin V-FITC/PI两色荧光法检测细胞凋亡率。
4. 毒副作用检测:采用ELISA方法检测细胞培养液中白细胞介素-6(IL-6)和C反应蛋白(CRP)的含量,分析两种药物的毒副作用。
四、预期结果:通过MTT法和细胞凋亡实验,比较5-氟尿嘧啶-1-基乙酸和5-氟尿嘧啶对HCT116细胞的抗增殖效果和诱导细胞凋亡的能力。
同时,通过检测IL-6和CRP等指标,评估两种药物的毒副作用。
预计5-氟尿嘧啶-1-基乙酸对肿瘤的抑制作用较5-氟尿嘧啶更有效,且毒副作用会更少。
五、意义和贡献:本研究将探讨5-氟尿嘧啶-1-基乙酸作为新型化疗药物的潜力,为临床治疗提供新的方法和药物选择。
同时,比较两种药物的毒副作用,有助于促进化疗剂的研发和优化,提高患者的治疗效果和生活质量。
细胞迁移实验(细胞划痕法)

抗肿瘤药物5-氟尿嘧啶对肿瘤细胞迁移的影响(细胞划痕法)实验导读瘤组织的增殖失控、瘤细胞的分化异常、瘤细胞具有侵袭和转移的能力是恶性肿瘤最基本的生物学特征,而侵袭和转移又是恶性肿瘤威胁患者健康乃至生命的主要原因。
因此研究肿瘤侵袭和转移的规律及其发生机制,对恶性肿瘤的防治有重要意义。
肿瘤转移是指恶性肿瘤细胞从原发部位侵入淋巴管、血管或体腔,至靶组织或靶器官,长出与原发瘤不相连续而组织学类型相同的肿瘤。
前者称为原发瘤,后者称为转移瘤或继发瘤。
图1 肿瘤转移示意图根据肿瘤异质性理论,大多数恶性肿瘤最初虽属单克隆起源,但它在不断增殖演进至临床明显的肿瘤时,由于瘤细胞遗传性状的不稳定性(来自基因突变或缺失等)而不断地变异,造成该肿瘤内瘤细胞亚群表型的多样性,诸如瘤细胞的侵袭性、生长速率、转移能力,核型乃至对激素的反应性和抗肿瘤药物的敏感性等,这些瘤细胞亚群具有被此不同的特性即所谓异质性。
异质性与肿瘤转移直接有关的就是癌细胞的转移潜能,癌细胞的转移潜能有高低之分,具有高转移潜能的筋细胞易发生转移。
肿瘤细胞的运动性,来源于细胞运动“接触抑制”的概念。
通过体外培养正常和恶性结缔组织细胞,发现正常纤维母细胞在移动过程中引起的皱栖脑膜与其他细胞的表面接触时,往往产生细胞膜活动的抑制和移动中细胞的缩短,然后停止。
当纤维母细胞生长过程中在培养皿上融合形成一单层时,细胞运动即显著受到抑制。
间变的肉瘤细胞则缺乏接触抑制,瘤细胞的运动不会被正常纤维母细胞所抑制。
针对肿瘤转移这一复杂的过程,人们研制了各种抗转移药物,如血小板凝集抑制剂、血管生成抑制因子、内皮稳定因子、干扰素-α以及其他化学药物。
细胞划痕法是测定了肿瘤细胞的运动特性的方法之一。
其借鉴体外细胞致伤愈合实验模型,在体外培养的单层细胞上,划痕致伤,然后加入药物观察其抑制肿瘤细胞迁移的能力。
下图即为划痕实验的示意图,图中可见,在细胞层上出现一道空痕(A),当加入药物后,由于药物的作用使细胞迁移受到抑制(B),而未加入药物的细胞保持了原有的迁移能力,在一段时间后通过迁移将划痕掩盖(C)。
载5-氟尿嘧啶细胞囊泡对结直肠癌细胞株HCT116_的杀伤作用

胞内功能,包括自噬㊁线粒体功能障碍和细胞凋亡[11]㊂Xu 等[5]发现上调Sirt1/FoxO1信号轴可以缓解DM 大鼠肾损伤㊂本研究结果显示,与NR 组相比,HG 组p -Sirt1/Sirt1㊁p -FoxO1/FoxO1蛋白水平显著降低,而CT 使p -Sirt1/Sirt1㊁p -FoxO1/FoxO1蛋白水平显著上调,暗示CT 可以通过激活Sirt1/FoxO1信号轴激活细胞自噬以及细胞凋亡,进而缓解高糖诱导的GEC 炎性损伤以及氧化应激损伤㊂本研究用Sirt1/FoxO1信号轴抑制剂和CT 共同处理GEC ,结果发现SIRT1-IN -1逆转了CT 对GEC 的有利作用㊂综上所述,CT 可以通过上调Sirt1/FoxO1信号轴激活自噬,减轻高糖诱导的炎性损伤㊁氧化应激损伤㊂本文不足是研究机制较浅,我们将在下步实验深入研究㊂ʌ参考文献ɔ[1]㊀Orr P ,Shank BC ,Hickson S ,et al.Clinical management ofglomerular diseases [J ].Nurs Clin North Am ,2018,53(4):551-567.[2]㊀Daehn IS ,Duffield JS.The glomerular filtration barrier :astructural target for novel kidney therapies [J ].Nat RevDrug Discov ,2021,20(10):770-788.[3]㊀Sun L ,Sun C ,Zhou S ,Zhang L ,et al.Tamsulosin attenuateshigh glucose -induced injury in glomerular endothelial cells[J ].Bioengineered ,2021,12(1):5184-5194.[4]㊀Song M ,Chen L ,Zhang L ,et al.Cryptotanshinone enhanceswound healing in type 2diabetes with modulatory effects on inflammation ,angiogenesis and extracellular matrix remodel-ling [J ].Pharm Biol ,2020,58(1):845-853.[5]㊀Xu J ,Liu LQ ,Xu LL ,et al.Metformin alleviates renal injuryin diabetic rats by inducing Sirt1/FoxO1autophagic signalaxis [J ].Clin Exp Pharmacol Physiol ,2020,47(4):599-608.[6]㊀Shan MY ,Dai Y ,Ren XD ,et al.Berberine mitigates nonalco-holic hepatic steatosis by downregulating SIRT1-FoxO1-SREBP2pathway for cholesterol synthesis [J ].Integr Med ,2021,19(6):545-554.[7]㊀Lo SH ,Hsu CT ,Niu HS ,et al.Cryptotanshinone inhibitsSTAT3signaling to alleviate cardiac fibrosis in type 1-like diabetic rats [J ].Phytother Res ,2017,31(4):638-646.[8]㊀Mukohara S ,Mifune Y ,Inui A ,et al.In vitro and in vivotenocyte -protective effectiveness of dehydroepiandrosteroneagainst high glucose -induced oxidative stress [J ].BMCMusculoskelet Disord ,2021,22(1):519-529.[9]㊀Tang PM ,Nikolic -Paterson DJ ,Lan HY.Macrophages :ver-satile players in renal inflammation and fibrosis [J ].Nat Rev Nephrol ,2019,15(3):144-158.[10]㊀Koch EAT ,Nakhoul R ,Nakhoul F ,et al.Autophagy in dia-betic nephropathy :a review [J ].Int Urol Nephrol ,2020,52(9):1705-1712.[11]㊀He W ,Zhang A ,Qi ,et al.FoxO1,a potential therapeutictarget ,regulates autophagic flux oxidative stress mitochon-drial dysfunction and apoptosis in human cholangiocarcino-ma QBC939cells [J ].Cell Physiol Biochem ,2018,45(4):1506-1514.ʌ文章编号ɔ1006-6233(2023)06-0893-07载5-氟尿嘧啶细胞囊泡对结直肠癌细胞株HCT116的杀伤作用孙建海,㊀晏㊀菲,㊀魏武杰,㊀邓㊀洁,㊀李㊀黎,㊀刘㊀莉,㊀马燕凌(江汉大学附属湖北省第三人民医院肿瘤科,㊀湖北㊀武汉㊀430000)ʌ摘㊀要ɔ目的:探讨载5-氟尿嘧啶细胞囊泡对结直肠癌细胞株HCT116的杀伤作用㊂方法:设HCT116组㊁细胞囊泡组(EVs 混悬液5mL ㊁106个/mL )㊁5-氟尿嘧啶组(5-氟尿嘧啶5mL ㊁30μg /mL )㊁5-氟尿嘧啶载药囊泡组(EVs 混悬液5mL ㊁106个/mL +5-氟尿嘧啶5mL ㊁30μg /mL ),以上各组细胞每孔设6个平行样,培养72h ㊂培养结束后,测定细胞增殖侵袭㊁凋亡水平,RT -PCR 法及蛋白印迹法测定各组细胞miR -128㊁PIK3水平㊂结果:细胞囊泡组OD 值㊁存活率㊁单克隆形成数目㊁穿膜数㊁迁移距离㊁凋亡率㊁miR -128水平㊁PI3K mRNA 和蛋白水平与HCT116组比较无统计学差异(P >0.05);5-氟尿嘧啶组㊁5-氟尿嘧啶载药囊泡组OD 值㊁存活率㊁单克隆形成数目㊁穿膜数㊁迁移距离㊁PI3KmRNA 和蛋白水平明显低于HCT116组㊁细胞囊泡组(P <0.05),凋亡率㊁miR -128水平明显高于HCT116组㊁细胞囊泡组(P <0.05);5-氟尿嘧啶载药囊泡组OD 值㊁存活率㊁单克隆形成数目㊁穿膜数㊁迁移距离㊁PI3K mRNA 和蛋白水平明显低于5-氟尿嘧啶组,凋亡率㊁miR -128水平明显高于5-氟尿嘧啶组(P <0.05)㊂结论:细胞外㊃398㊃ʌ基金项目ɔ湖北省卫健委2019年科研项目,(编号:WJ2019F184)ʌ通讯作者ɔ马燕凌囊泡装载5-氟尿嘧啶能明显抑制结直肠癌细胞株HCT116增殖㊁侵袭水平,增强其凋亡水平,其机制可能与细胞外囊泡装载5-氟尿嘧啶能促进结直肠癌细胞株HCT116高表达miR-128,低表达PI3K有关㊂ʌ关键词ɔ㊀载5-氟尿嘧啶细胞囊泡;㊀结直肠癌;㊀细胞增殖ʌ文献标识码ɔ㊀A㊀㊀㊀㊀㊀ʌdoiɔ10.3969/j.issn.1006-6233.2023.06.03Killing Effect of5-Fluorouracil Cell Vesicles onColorectal Cancer Cell Line HCT116SUN Jianhai,YAN Fei,WEI Wujie,et al(Hubei Third People's Hospital Affiliated to Jianghan University,Hubei Wuhan430000,China)ʌAbstractɔObjective:To explore the killing effect of5-fluorouracil cell vesicles on colorectal cancer cell line HCT116.Methods:The HCT116group,cell vesicles group(EVs suspension5mL,106cells/mL), 5-fluorouracil group(5-fluorouracil5mL,30μg/mL),and5-fluorouracil drug-loaded vesicles group(EVs suspension5mL,106cells/mL+5-fluorouracil5mL,30μg/mL)were set up,and6parallel samples of each well of the above groups were incubated for72h.After incubation,the levels of cell proliferation,invasion and apoptosis were determined,and the levels of miR-128and PIK3were determined by RT-PCR and western blotting.Results:The OD value,survival rate,number of monoclonal formation,number of membrane pene-tration,migration distance,apoptosis rate,miR-128level,PI3K mRNA and protein levels in cell vesicles group were not significantly different from those in HCT116group(P>0.05).OD value,survival rate,num-ber of monoclonal formation,number of membrane penetration,migration distance,PI3KmRNA and protein levels in5-fluorouracil group and5-fluorouracil drug-loaded vesicles group were significantly lower than those in HCT116group and cell vesicles group(P<0.05),and the apoptosis rate and the level of miR-128were significantly higher than those in HCT116group and cell vesicle group(P<0.05).OD value,survival rate, number of monoclonal formation,number of membrane penetration,migration distance,PI3K mRNA and pro-tein levels in5-fluorouracil drug-loaded vesicles group were significantly lower than those in5-fluorouracil group,and the apoptosis rate and miR-128level were significantly higher than those in5-fluorouracil group (P<0.05).Conclusion:Extracellular vesicles loaded with5-fluorouracil can significantly inhibit the prolif-eration and invasion level of colorectal cancer cell line HCT116,and enhance its apoptosis level,which may be related to the mechanism that extracellular vesicles loaded with5-fluorouracil can promote the high expres-sion of miR-128and low expression of PI3K in colorectal cancer cell line HCT116.ʌKey wordsɔ㊀5-fluorouracil;㊀Colorectal cancer;㊀Proliferation of cells㊀㊀结直肠癌(CRC)可导致正常结肠黏膜恶化为浸润性肠黏膜[1],遗传和环境因素等许多风险因素都会导致CRC的发生[2]㊂手术是早期CRC病例的金标准治疗方法,但绝大多数CRC患者术后生存率较低㊂细胞外囊泡(EV)是一种球形脂质双层,EV可以将蛋白质㊁糖蛋白㊁脂质㊁核酸和细胞因子从母体细胞转移到受体细胞,以促进受体细胞的表型变化,并在细胞间通讯中发挥重要作用㊂EV可以携带母体细胞成分以影响各种生物过程,包括:DNA转移㊁细胞代谢物输出㊁细胞间通讯等㊂细胞外囊泡由于其可修饰性㊁有效的装载能力和天然的肿瘤靶向特性而被广泛用作抗肿瘤药物的递送工具[3,4]㊂研究发现,5-氟尿嘧啶与结直肠癌患者来源的EV有机结合就形成了载5-氟尿嘧啶细胞囊泡,其具有高效靶向性㊁特异性高以及副作用小等特点㊂微小RNA(miRNA)是19-24个核苷酸的小型非编码RNA,已被确定为多种癌症类型的潜在标志物,包括CRC[5]㊂大量的miRNA与CRC的发展或总体存活率低有关㊂例如,在转移性CRC患者中,miR-30d-5p血浆水平有所提高㊂基于miRNA的微阵列显示miR-128是CRC细胞中最显著上调的miRNA之一,miR-128过表达有助于促进细胞迁移和侵袭[6]㊂本研究拟探讨载5-氟尿嘧啶细胞囊泡对结直肠癌细胞株HCT116的杀伤作用,为结直肠癌的治疗提供依据㊂1㊀材料与方法1.1㊀试剂及仪器:DMEM-F12(Sigma-Aldrich Chemi-㊃498㊃cal Company),FBS(System Biosciences),1ˑ抗生素和抗真菌剂(Life technologies),10%胎牛血清(FBS;Hy-clone;GE Healthcare Life Sciences),Dulbecco改良Ea-gle培养基(DMEM)完全培养基(Sigma),链霉素㊁青霉素(Gibco;Thermo Fisher Scientific),CCK-8溶液(Ye-asen),FITC-膜联蛋白㊁碘化丙锭(PI)(BioLegend), Transwell室(BD Biosciences)㊁Matrigel(Corning),TR-Izol试剂盒(Invitrogen),miScript逆转录试剂盒(Qia-gen),SYBR Premix EX Taq(TaKaRa Otsu Shiga),逆转录试剂盒(Promega),IQTM SYBR Green Supermix试剂盒(Bio-Rad),Radio Immunoprecipitation Assay裂解缓冲液㊁二辛可宁酸蛋白质测定试剂盒(Thermo Fisher),一抗PIK3兔多克隆抗体㊁GAPDH兔铵多克隆抗体(Abcam,Cambridge),辣根过氧化物酶标记的山羊抗兔IgG(Abcam Cambridge)㊂SpectraMax M5酶标仪(Molecular Devices),流式细胞仪(BD Biosciences), Cell QuestPro软件(BD Biosciences),Applied Biosys-tems7500系统(Applied Biosystems)㊂1.2㊀细胞外囊泡分离:结直肠癌细胞株HCT116在DMEM-F12中生长,含有10%EV消耗的FBS和1ˑ抗生素和抗真菌剂培养48h后,通过不同的离心方法将EV从培养基中分离出来㊂将收集的培养基以300g离心10min,然后以2000g离心25min㊂通过0.22μm过滤器收集上清液㊂使用获得的培养基在100000g和4ħ下离心60min来制造EV㊂然后弃去上清液㊂在相同条件下,将培养基超速离心并用磷酸盐缓冲盐水(PBS)重悬用于后续分析㊂提取的EV由日立JEM-2100透射电子显微镜(日本电子有限公司)鉴定㊂1.3㊀细胞培养及分组:结直肠癌细胞株HCT116购自Be Na Culture Collection㊂细胞系均在含有10%胎牛血清的Dulbecco改良Eagle培养基(DMEM)完全培养基中培养,添加100U/mL链霉素和100U/mL青霉素㊂所有细胞系均置于37ħ㊁5%CO2恒温培养箱中培养备用㊂HCT116组㊁细胞囊泡组㊁5-氟尿嘧啶组㊁5-氟尿嘧啶载药囊泡组培养方法HCT116组的培养方法如前所述;细胞囊泡组加入EV混悬液5mL(106个/mL);5 -氟尿嘧啶组加入5-氟尿嘧啶5mL(30μg/mL);5-氟尿嘧啶载药囊泡组加入载药囊泡混悬液5mL,载药囊泡混悬液的制备方法如下:取5-氟尿嘧啶30μg,溶于1mL EVs混悬液中,在37ħ恒温培养箱中孵育1h, 9168r/min离心10min,经0.22μm过滤器过滤; 30900r/min离心70min,将沉淀溶于PBS,即得载药囊泡混悬液㊂各组设6个平行样,培养72h㊂1.4㊀HCT116细胞活力及单克隆形成数目检测:将细胞接种到96孔板中,每孔1ˑ103个细胞,在5%CO2, 37ħ环境下孵育72h,将10μL CCK-8溶液加入每个孔中㊂在37ħ下孵育1.5h后,使用SpectraMax M5检测450nm处的光密度值㊂细胞存活率=(实验组OD-空白组OD)/(HCT116组OD-空白组OD)㊂将各组结直肠癌细胞株HCT116用0.25%胰蛋白酶消化成单细胞,以4ˑ105细胞/孔的密度接种到6孔培养板中, 24h后,将50个细胞接种于6孔组织培养板中,继续培养2周,然后将细胞用结晶紫-福尔马林溶液染色10min并计数㊂1.5㊀HCT116细胞凋亡测定:使用FITC-膜联蛋白V 和碘化丙锭(PI)通过流式细胞术分析细胞凋亡㊂将2mL细胞(5ˑ104个细胞/mL)接种到6孔板中,48h 后,用PBS洗涤细胞两次,消化并重悬于100μL结合缓冲液中㊂细胞密度调整为0.5ˑ106个/mL细胞,使用5μL Annexin V/FITC在室温下黑暗染色细胞10min,加入100μL结合缓冲液,将细胞在室温下在黑暗中用5μL PI染色5min㊂用流式细胞术分析细胞凋亡率,用Cell Quest Pro软件计算凋亡细胞百分比㊂1.6㊀HCT116细胞侵袭㊁迁移测定:通过Transwell小室评估细胞的侵袭能力㊂Transwell室底部膜的孔径为8μm,底室充满600μL含有10%FBS的DMEM营养液,顶室的大小为200μL,接种5ˑ105个细胞,在37ħ㊁5%CO2的培养箱中培养24h,将Transwell小室取出并固定在由甲醇和冰醋酸(3:1)组成的液体中30min,用PBS洗涤腔室,用0.5%结晶紫染色并最后固定,在显微镜下随机取5个视野观察并计数染色细胞数㊂迁移水平测定,将约5ˑ104个细胞加入涂有500ng/mL Ma-trigel的24孔Transwell上室㊂下室充满10%FBS补充的DMEM培养基,将细胞在37ħ㊁5%CO2的培养箱中培养㊂24h后,取出Transwell插入物,使用无菌镊子移除插入物以产生均匀的500μm无细胞间隙,用4%多聚甲醛固定30min,在显微镜下计算迁移距离㊂1.7㊀HCT116细胞miR-128㊁PIK3mRNA水平测定: TRIzol试剂盒提取总RNA㊂为了量化miR-128的表达,采用miScript逆转录试剂盒(Qiagen)合成互补DNA,并使用SYBRPremixEXTaq以U6作为内标进行qRT-PCR参考miR-128㊂为了量化PIK3mRNA的表达,使用逆转录试剂盒(Promega)生成cDNA,并应用IQTM SYBR Green Supermix试剂盒以GAPDH作为内源对照进行扩增㊂结果用2-ΔΔCt值进行量化和归一化㊂qRT-PCR检测均在Applied Biosystems7500系统上进行㊂1.8㊀结直肠癌细胞株HCT116PIK3蛋白表达水平测㊃598㊃定:不同处理组的细胞转染72h后,用Radio Immuno-precipitation Assay裂解缓冲液在冰上裂解10min,二辛可宁酸蛋白质测定法定量蛋白质,将蛋白质在100V 电压下加载到十二烷基硫酸钠-聚丙烯酰胺凝胶电泳中,转移到聚偏二氟乙烯膜上,用5%BSA/TBST封闭60min,将膜与一抗PIK3兔多克隆抗体和GAPDH兔铵多克隆抗体在4ħ下孵育过夜,在室温下用1ˑTBST 溶液洗涤每次5min,重复3次㊂室温下,将膜与辣根过氧化物酶标记的山羊抗兔IgG孵育1h,并用TBST 洗涤3次㊂每20min应用电化学发光检测发光反应,并拍摄蛋白质印记以供观察㊂1.9㊀统计学分析:SPSS24.0软件进行统计分析,定量数据以均值ʃ标准差表示,多组均数比较采用单因素方差分析,两组间比较采用LSD-t检验,P<0.05表示差异有统计学意义㊂2㊀结㊀果2.1㊀各组结直肠癌细胞株HCT116OD值㊁存活率比较:细胞囊泡组OD值㊁存活率与HCT116组比较无统计学差异(P>0.05);5-氟尿嘧啶组㊁5-氟尿嘧啶载药囊泡组OD值㊁存活率明显低于HCT116组㊁细胞囊泡组(P<0.05),5-氟尿嘧啶载药囊泡组OD值㊁存活率明显低于5-氟尿嘧啶组(P<0.05)㊂见表1㊂表1㊀各组结直肠癌细胞株HCT116OD值存活率比较组别复孔数OD值存活率(%) HCT116组60.80ʃ0.0773.52ʃ5.73细胞囊泡组60.81ʃ0.0872.85ʃ5.37 5-氟尿嘧啶组60.54ʃ0.05b52.10ʃ3.27b 5-氟尿嘧啶载药囊泡组60.24ʃ0.05bc30.12ʃ4.04bc F19.65821.365 P0.0000.000㊀㊀注:b与HCT116组相比P<0.05;c与5-氟尿嘧啶组相比P<0.052.2㊀各组结直肠癌细胞株HCT116单克隆形成数目比较:细胞囊泡组单克隆形成数目与HCT116组比较无统计学差异(P>0.05);5-氟尿嘧啶组㊁5-氟尿嘧啶载药囊泡组单克隆形成数目明显低于HCT116组㊁细胞囊泡组(P<0.05),5-氟尿嘧啶载药囊泡组单克隆形成数目明显低于5-氟尿嘧啶组(P<0.05)㊂见表2㊁图1㊂表2㊀各组结直肠癌细胞株HCT116克隆形成数目比较组别复孔数单克隆形成数目HCT116组6647.77ʃ99.47细胞囊泡组6652.59ʃ95.35 5-氟尿嘧啶组6453.54ʃ55.87b 5-氟尿嘧啶载药囊泡组6124.29ʃ22.47bc F25.297 P0.000㊀㊀注:b与HCT116组相比P<0.05;c与5-氟尿嘧啶组相比P<0.05图1㊀各组结直肠癌细胞株HCT116克隆形成数目比较(结晶紫染色,ˑ400)(A:HCT116组B:细胞囊泡组C:5-氟尿嘧啶组C:5-氟尿嘧啶载药囊泡组)2.3㊀各组结直肠癌细胞株HCT116凋亡率比较:细胞囊泡组凋亡率与HCT116组比较无统计学意义(P>0.05);5-氟尿嘧啶组㊁5-氟尿嘧啶载药囊泡组凋亡率明显高于HCT116组㊁细胞囊泡组(P<0.05),5-氟尿嘧啶载药囊泡组凋亡率明显高于5-氟尿嘧啶组(P<0.05)㊂见表3㊁图2㊂表3㊀各组结直肠癌细胞株HCT116凋亡率比较组别复孔数凋亡率(%) HCT116组6 2.06ʃ0.32细胞囊泡组6 2.02ʃ0.33 5-氟尿嘧啶组6 3.04ʃ0.52b 5-氟尿嘧啶载药囊泡组614.75ʃ2.14bc F15.632 P0.000㊀㊀注:b与HCT116组相比P<0.05;c与5-氟尿嘧啶组相比㊃698㊃P<0.05图2㊀各组结直肠癌细胞株HCT116凋亡率比较流式细胞图(A:HCT116组B:细胞囊泡组C:5-氟尿嘧啶组C:5-氟尿嘧啶载药囊泡组)2.4㊀各组结直肠癌细胞株HCT116侵袭能力比较:细胞囊泡组穿膜数与HCT116组比较无统计学差异(P> 0.05);5-氟尿嘧啶组㊁5-氟尿嘧啶载药囊泡组穿膜数明显低于HCT116组㊁细胞囊泡组(P<0.05),5-氟尿嘧啶载药囊泡组穿膜数明显低于5-氟尿嘧啶组(P< 0.05)㊂见表4㊁图3㊂表4㊀各组结直肠癌细胞株HCT116穿膜数比较组别复孔数穿膜数(个) HCT116组62654.69ʃ484.30细胞囊泡组62701.74ʃ411.88 5-氟尿嘧啶组61247.02ʃ205.59b 5-氟尿嘧啶载药囊泡组6423.63ʃ85.89bc F29.667 P0.000㊀㊀注:b与HCT116组相比P<0.05;c与5-氟尿嘧啶组相比P<0.05图3㊀各组结直肠癌细胞株HCT116穿膜数数目比较(结晶紫染色,ˑ400)(A:HCT116组B:细胞囊泡组C:5-氟尿嘧啶组C:5-氟尿嘧啶载药囊泡组)2.5㊀各组结直肠癌细胞株HCT116迁移能力比较:细胞囊泡组迁移距离与HCT116组比较无统计学差异(P >0.05);5-氟尿嘧啶组㊁5-氟尿嘧啶载药囊泡组迁移距离明显低于HCT116组㊁细胞囊泡组(P<0.05),5-氟尿嘧啶载药囊泡组迁移距离明显低于5-氟尿嘧啶组(P<0.05)㊂见表5㊁图4㊂表5㊀各组结直肠癌细胞株HCT116迁移距离比较组别复孔数迁移距离(μm) HCT116组628.92ʃ5.02细胞囊泡组629.02ʃ5.03 5-氟尿嘧啶组615.80ʃ2.00b 5-氟尿嘧啶载药囊泡组6 6.41ʃ1.32bc F36.257 P0.000㊀㊀注:b与HCT116组相比P<0.05;c与5-氟尿嘧啶组相比P<0.05图4㊀各组结直肠癌细胞株HCT116迁移距离比较(ˑ400) (A:HCT116组B:细胞囊泡组C:5-氟尿嘧啶组C:5-氟尿嘧啶载药囊泡组)2.6㊀各组结直肠癌细胞株HCT116miR-128㊁PI3K mRNA和蛋白水平比较:细胞囊泡组miR-128水平与HCT116组比较无统计学差异(P>0.05);5-氟尿嘧啶组㊁5-氟尿嘧啶载药囊泡组miR-128高于HCT116组㊁细胞囊泡组(P<0.05),5-氟尿嘧啶载药囊泡组miR-128高于5-氟尿嘧啶组(P<0.05)㊂细胞囊泡组PI3K mRNA和蛋白与HCT116组比较无统计学差异(P>0.05);5-氟尿嘧啶组㊁5-氟尿嘧啶载药囊泡组PI3K mRNA和蛋白低于HCT116组㊁细胞囊泡组(P< 0.05),5-氟尿嘧啶载药囊泡组PI3KmRNA和蛋白低㊃798㊃于5-氟尿嘧啶组(P<0.05)㊂见表6㊂表6㊀各组结直肠癌细胞株HCT116miR -128PI3K mRNA 和蛋白表达水平比较组别复孔数miR -128PI3KmRNA PI3K 蛋白(/GAPDH )HCT116组6 1.17ʃ0.23 3.85ʃ0.65 3.95ʃ0.79细胞囊泡组6 1.15ʃ0.26 3.90ʃ0.63 3.89ʃ0.785-氟尿嘧啶组6 3.68ʃ0.57b 2.54ʃ0.44b 2.34ʃ0.47b 5-氟尿嘧啶载药囊泡组65.42ʃ0.98bc1.63ʃ0.28bc1.44ʃ0.21bcF 29.85732.25818.578P0.0000.0000.000㊀㊀注:b 与HCT116组相比P<0.05;c 与5-氟尿嘧啶组相比P<0.053㊀讨㊀论EV 作为一种纳米级的膜结构,主要负责携带各种内容物,通过质膜融合㊁内吞㊁与细胞表面受体结合等机制广泛参与肿瘤的生物学过程㊂EV 作为肿瘤侵袭转移的分子基础之一,对肺癌的早期诊断和靶向治疗具有重要意义㊂研究发现,来源于高转移肺癌细胞和晚期肺癌患者血清的EV 诱导波形蛋白表达,诱导HBECs 上皮-间质转化,诱导非转移癌细胞的迁移㊁侵袭和增殖[7];与来自早期非小细胞肺癌(NSCLC )细胞的EV 相比,来自转移性SCLC 细胞的EV 对肿瘤细胞迁移和侵袭的影响更大㊂特别是在缺氧条件下,转移性小细胞肺癌细胞EV 中与肿瘤细胞迁移和侵袭密切相关的转化生长因子-β和白细胞介素-10含量增加[8,9]㊂EV 作为细胞间信息交换的重要物质,通过自分泌或远距离传播的方式将相关信号分子传递给靶细胞,从而产生一系列生物学效应㊂因此,EV 靶向肿瘤治疗方法可能具有广阔的前景㊂已经确定了EV 中常见的三个蛋白质家族,分别是热休克蛋白70(HSP70)㊁S -腺苷同型半胱氨酸酶和甘油醛3-磷酸脱氢酶㊂在这项研究中,我们对EV 进行了蛋白质组学分析,发现了所有三种蛋白质,进一步证实了EV 的纯化㊂同时,我们在EV 中发现了MAP30㊁MAP30可以增加细胞内Ca 2+离子浓度,从而通过细胞凋亡触发ROS 介导的癌细胞凋亡㊂本研究发现5-氟尿嘧啶载药囊泡处理后细胞凋亡的产生,这可能是由EV 中的MAP30蛋白介导的㊂氟尿嘧啶可诱导线粒体ROS ,导致癌细胞增殖㊁侵袭能力下降,ROS 的产生增强了5-氟尿嘧啶对癌细胞的抗肿瘤作用㊂而抗氧化剂降低了5-氟尿嘧啶在结肠癌中的凋亡作用㊂本研究发现载5-氟尿嘧啶细胞囊泡能明显抑制结直肠癌细胞株HCT116增殖㊁侵袭水平,增强其凋亡水平㊂PI3K 蛋白家族是由调节亚基p85和催化亚基p110组成的二聚体,广泛参与调控细胞增殖㊁分化㊁凋亡和迁移等表型㊂有报道[10,11]称PI3K 信号的异常激活参与5-氟尿嘧啶耐药的发生发展,而EV 通过激活细胞凋亡信号通路和负向调节PI3K /Akt 信号通路,抑制5-氟尿嘧啶耐药NSCLC 细胞增殖并诱导细胞凋亡,延缓5-氟尿嘧啶耐药NSCLC 细胞的增殖和凋亡㊂此外,炎症是肿瘤进展的重要组成部分㊂化疗增强炎症可能导致治疗失败和转移㊂PI3K 是先天免疫系统的重要组成部分之一,在癌症中起着重要作用㊂许多因素可以激活PI3K ,包括K +流出㊁细胞内钙㊁内质网(ER )应激和ROS [12]㊂之前的研究结果表明,5-氟尿嘧啶治疗增加了口腔癌(OSCC )中PI3K 的表达,从而介导了5-氟尿嘧啶耐药耐药性,而5-氟尿嘧啶耐药可以促进OSCC 中的肿瘤生长和转移㊂Fer 样家族成员4(Ferrostatin -4)是PI3K 的下游调控因子,其在肺癌细胞系A549和95D 中的过表达抑制集落形成㊁细胞增殖和迁移,导致细胞中PI3K /Akt 表达降低,同时使用小分子抑制剂激活PI3K /Akt 信号磷酸酶和张力蛋白同系物逆转了Ferrostatin -4对细胞增殖和转移的抑制作用㊂同样,miR -128表达在肺癌组织或细胞中下调,miR -128的敲低通过激活PI3K /Akt 通路促进A549细胞活力㊁集落形成和侵袭,加速肿瘤转移和复发㊂本研究结果与上述研究结果一致,发现细胞外囊泡装载5-氟尿嘧啶能促进结直肠癌细胞株HCT116高表达miR -128,低表达PI3K ㊂本研究未探讨细胞外囊泡装载5-氟尿嘧啶对直肠癌细胞株HCT116Ferrostatin -4表达的影响,这将在后续研究中进行㊂㊃898㊃综上所述,细胞外囊泡装载5-氟尿嘧啶能明显抑制结直肠癌细胞株HCT116增殖㊁侵袭水平,增强其凋亡水平,其机制可能与细胞外囊泡装载5-氟尿嘧啶能促进结直肠癌细胞株HCT116高表达miR -128,低表达PI3K 有关㊂ʌ参考文献ɔ[1]㊀Xi Y ,Xu P.Global colorectal cancer burden in 2020and pro-jections to 2040[J ].Transl Oncol ,2021,14(10):101174.[2]㊀Biller LH ,Schrag D.Diagnosis and treatment of metastaticcolorectal cancer :a review [J ].JAMA ,2021,325(7):669-685.[3]㊀Herrmann IK ,Wood MJA ,Fuhrmann G.Extracellular vesiclesas a next -generation drug delivery platform [J ].Nat Nano-technol ,2021,16(7):748-759.[4]㊀Verweij F J ,Balaj L ,Boulanger CM ,et al.The power of ima-ging to understand extracellular vesicle biology in vivo [J ].Nat Methods ,2021,18(9):1013-1026.[5]㊀Guo Y ,Guo Y ,Chen C ,et al.Circ3823contributes to growth ,metastasis and angiogenesis of colorectal cancer :involvementof miR -30c -5p /TCF7axis [J ].Mol Cancer ,2021,20(1):93.[6]㊀He F ,Song Z ,Chen H ,et al.Long noncoding RNA PVT1-214promotes proliferation and invasion of colorectal cancerby stabilizing Lin28and interacting with miR -128[J ].On-cogene ,2019,38(2):164-179.[7]㊀Wang H ,Wang X ,Zhang H ,et al.The HSF1/miR -135b -5paxis induces protective autophagy to promote oxaliplatin re-sistance through the MUL1/ULK1pathway in colorectal cancer [J ].Oncogene ,2021,40(28):4695-4708.[8]㊀Zhang W ,Wang Z ,Cai G ,et al.Circ _DOCK1regulatesUSP11through miR -132-3p to control colorectal cancerprogression [J ].World Surg Oncol ,2021,19(1):67.[9]㊀Zhang X ,Li T ,Han Y N ,et al.miR -125b promotes colorec-tal cancer migration and invasion by dual -targeting CFTR and CGN [J ].Cancers ,2021,13(22):5710.[10]㊀Zheng J ,Yang T ,Gao S ,et al.miR -148a -3p silences theCANX /MHC -I pathway and impairs CD8+T cell -mediated immune attack in colorectal cancer [J ].FASEB ,2021,35(8):e21776.[11]㊀Zhou L ,Li J ,Tang Y ,et al.Exosomal LncRNA LINC00659transferred from cancer -associated fibroblasts promotescolorectal cancer cell progression via miR -342-3p /ANXA2axis [J ].Transl Med ,2021,19(1):8.[12]㊀Bai L ,Gao Z ,Jiang A ,et al.Circular noncoding RNA circ_0007334sequestrates miR -577to derepress KLF12and ac-celerate colorectal cancer progression [J ].Anticancer Drugs ,2022,33(1):409-422.ʌ文章编号ɔ1006-6233(2023)06-0899-08CircRNA YAP1对股骨头微血管内皮细胞血管生成的作用研究日夏提㊃帕尔哈提,㊀翟㊀生,㊀吕㊀青(新疆医科大学第五附属医院骨科中心,㊀新疆㊀乌鲁木齐㊀830000)ʌ摘㊀要ɔ目的:探讨环状RNA (circRNA )YAP1对激素性股骨头坏死(SONFH )大鼠股骨头微血管内皮细胞(MVECs )血管生成的作用与机制㊂方法:成年雄性SD 大鼠接受甲基强的松龙(MPS ,20mg ㊃kg -1㊃d -1肌肉注射3周,以诱导SONFH 模型(n =30只)㊂Ctrl 组(n =30只)注射等量生理盐水㊂用mi-cro -CT 扫描和HE 染色评估是否造模成功㊂分离大鼠的股骨头MVECs ㊂并用CD31蛋白作为标志物用免疫荧光化学法(IF )鉴定股骨头MVECs ㊂将MVECs 分为过表达circRNA YAP1组(pcDNA -YAP1组)㊁阴性对照组(pcDNA -NC 组)㊁以及pcDNA -YAP1联合Wnt1/β-catenin 通路拮抗剂dickkopf -1处理组(pcDNA -YAP1+dickkopf -1组)㊂用qPCR 检测circRNA YAP1表达,Western blot 法分别检测Wnt1㊁β-catenin ㊁VEGF -A 和vimentin 的表达㊂用CCK -8实验检测各组细胞的增殖活性㊂Transwell 小室检测细胞的迁移率㊂管形成实验检测细胞的血管生成能力㊂结果:HE 染色结果显示Ctrl 组表现为健康状态,无骨坏死,SONFH 组大鼠均重度股骨头坏死,股骨头恶化㊂micro -CT 扫描的结果显示Ctrl 组表现骨小梁致密规则,骨小梁数量和形态均正常,SONFH 组伴空骨陷窝,骨小梁减少,骨小梁缩短㊂与Ctrl 组(1.00ʃ0.08;1.00ʃ0.12;1.00ʃ0.15)比较,SONFH 组股骨组织中circRNA YAP1(0.27ʃ0.04)㊁Wnt1(0.49ʃ0.03)㊁β-catenin (0.33ʃ0.03)表达量均显著减少(t =12.158,P =0.009;t =10.596,P =0.012;t =10.080,P =0.014)㊂另外,成功分离Ctrl 组和SONFH 组的股骨头MVECs ㊂与Ctrl 组(1.00ʃ0.㊃998㊃ʌ基金项目ɔ新疆维吾尔自治区自然科学基金项目,(编号:2021D01C426)ʌ通讯作者ɔ吕㊀青。
氟尿嘧啶 (Fluorouracil) 抗癌药物

氟尿嘧啶 (Fluorouracil) 抗癌药物氟尿嘧啶(Fluorouracil)抗癌药物氟尿嘧啶(Fluorouracil),也被称为5-氟尿嘧啶(5-Fluorouracil, 5-FU),是一种广泛应用于肿瘤治疗的抗癌药物。
它属于嘧啶类似物,通过抑制肿瘤细胞的DNA和RNA合成,从而抑制癌细胞的生长和分裂。
以下将从药理学、临床应用和副作用等方面介绍氟尿嘧啶的特性。
一、药理学特性氟尿嘧啶是一种嘌呤类抗癌药物,在体内可以转变为活性代谢产物-氟脱氨尿嘧啶(5-fluorodeoxyuridine, FdUMP)。
FdUMP能够与三磷酸脱氨尿苷(dUMP)结合,形成FdUMP-dUMP复合物,阻止胸腺嘧啶酸合成酶(thymidylate synthase)的活性。
进而,该药物通过抑制嘧啶合成,阻碍DNA合成及修复,从而使癌细胞无法正常生长和分裂。
二、临床应用氟尿嘧啶作为治疗广泛的抗癌药物,被应用于多种癌症的治疗,包括胃癌、结直肠癌、乳腺癌、头颈部肿瘤等。
它可以通过多种途径给药,如口服、静脉注射、局部注射等,具体给药途径和方案需根据具体情况而定。
在胃癌和结直肠癌的治疗中,氟尿嘧啶通常与其他化疗药物联合使用,如亚叶酸、顺铂等。
这种联合治疗方案能够提高功效并降低耐药性的风险。
对于乳腺癌的治疗,氟尿嘧啶也可以与其他药物,如环磷酰胺等进行联合应用,实现更好的治疗效果。
三、副作用尽管氟尿嘧啶对癌症治疗有益,但它也伴随着一些副作用。
其中最常见的包括骨髓抑制、消化道反应和手足综合症等。
骨髓抑制是氟尿嘧啶最常见的副作用之一。
该药物会抑制骨髓中造血细胞的生成,导致血小板、红细胞和白细胞的数量减少。
这可能导致贫血、易出血和感染等并发症。
因此,在使用氟尿嘧啶期间,需要密切监测患者的血常规指标,并采取相应的措施进行支持治疗。
消化道反应是另一个常见的副作用,患者可能会出现恶心、呕吐、腹泻等消化道不适。
在治疗期间,患者通常需要采取饮食调节、药物辅助治疗等措施来缓解这些反应。
氟尿嘧啶及其衍生物的临床应用原理
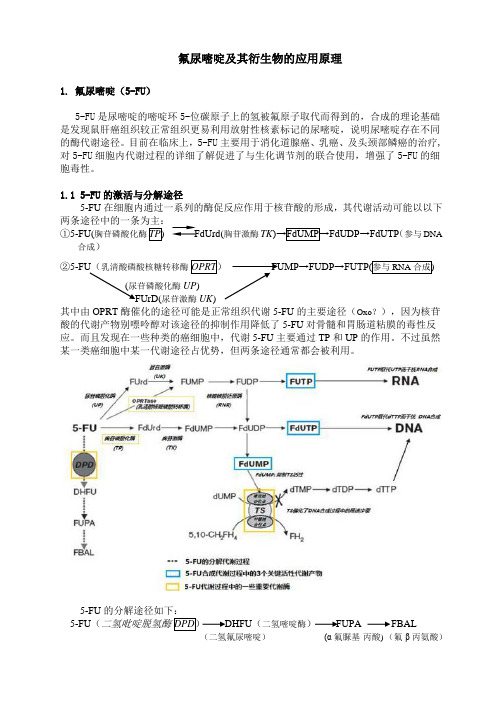
氟尿嘧啶及其衍生物的应用原理1.氟尿嘧啶(5-FU)5-FU是尿嘧啶的嘧啶环5-位碳原子上的氢被氟原子取代而得到的,合成的理论基础是发现鼠肝癌组织较正常组织更易利用放射性核素标记的尿嘧啶,说明尿嘧啶存在不同的酶代谢途径。
目前在临床上,5-FU主要用于消化道腺癌、乳癌、及头颈部鳞癌的治疗,对5-FU细胞内代谢过程的详细了解促进了与生化调节剂的联合使用,增强了5-FU的细胞毒性。
1.1 5-FU的激活与分解途径5-FU在细胞内通过一系列的酶促反应作用于核苷酸的形成,其代谢活动可能以以下①5-FU(胸苷磷酸化酶TP) FdUrd(胸苷激酶TK)→FdUMP→FdUDP→FdUTP(参与DNA合成)②5-FU(乳清酸磷酸核糖转移酶OPRT)FUMP→FUDP→FUTP(参与RNA合成)(尿苷磷酸化酶UP)尿苷激酶UK)其中由OPRT酶催化的途径可能是正常组织代谢5-FU的主要途径(Oxo?),因为核苷酸的代谢产物别嘌呤醇对该途径的抑制作用降低了5-FU对骨髓和胃肠道粘膜的毒性反应。
而且发现在一些种类的癌细胞中,代谢5-FU主要通过TP和UP的作用。
不过虽然某一类癌细胞中某一代谢途径占优势,但两条途径通常都会被利用。
5-FU5-FU(二氢吡啶脱氢酶DPD)DHFU(二氢嘧啶酶)FUPA FBAL(二氢氟尿嘧啶)(α氟脲基-丙酸) (氟-β丙氨酸)DPD催化5-FU还原成二氢氟尿嘧啶的反应是5-FU分解代谢的初始限速反应,5-乙炔基尿嘧啶是DPD的灭活剂,同时口服时5-FU的生物利用度接近100% DPD的活性影响5- FU的抗肿瘤活性,但是,大剂量的DPD的缺失与5-FU用药后的严重毒性反应相关。
1.2 5-FU的作用机制1.2.1 对胸苷酸合成酶(TS)的抑制作用FdUMP与胸苷酸合成酶(TS)紧密结合阻止dTMP的合成,dTMP是生成dTTP的关键底物,而dTTP是DNA的合成和修复的必需物质。
功能性TS是由两个相同亚基组成的二聚体,每个亚基上有一个核酸结合位点和两个特殊的叶酸盐合成位点。
高效液相色谱法测定分析原料药氟胞嘧啶中有关物质的方法验证

高效液相色谱法测定分析原料药氟胞嘧啶中有关物质的方法验证袁拥军,张伟男(精华制药集团南通有限公司,江苏南通226407)摘 要:建立测定氟胞嘧啶原料药中有关物质的质量控制方法,采用高效液相色谱法测定5-氟胞嘧啶原料药中的有关物质,并对此方法的专属性、精密度、准确度、线性范围、耐用性等进行了验证。
在0.02~0.12 μg/mL范围内,线性关系良好,相关系数r大于0.999,方法检出限为0.007 0 μg/mL,定量限为0.02 μg/ m L,平均回收率在97.76% ~ 97.87%,重复性RSD为0.02%,耐用性检测结果在规定的限度内。
该质量控制方法能有效测定出氟胞嘧啶原料药中有关物质的量。
关键词:方法验证;有关物质;高效液相色谱法中图分类号:TQ 460.7 文献标识码:A 文章编号:2095-817X(2021)01-0013-0065-氟胞嘧啶(5-Flμcylosine)(简称5-FC),化学名为4-氨基-5-氟-2(1H)-嘧啶酮,对隐球菌属和念珠菌属等具有较高抗菌活性,对着色真菌、少数曲霉菌属有一定抗菌活性,其抗菌作用在临床上得到广泛应用,其药用机制是替代尿嘧啶进入DNA分子中,阻断核酸合成,也是抗癌原料药卡培他滨、氟西他滨关键中间体[1]。
5-氟胞嘧啶的杂质控制方法在中国药典中已有摘录,但应对国外市场,必须符合欧洲以及美国药典的要求。
为此,本实验室为更好地控制产品质量,在中国药典的基础上,结合欧洲及美国药典的要求,对测试方法进行了专题研究和一定程度的优化。
1 探讨与分析1.1检测方法的选择美国药典采用薄层色谱法(TLC)检测5-氟胞嘧啶的有关物质,中国药典和欧洲药典都采用高效液相色谱法(High Performance Liquid Chromatography \ HPLC)检测5-氟胞嘧啶的有关物质。
高效液相色谱法用作定量分析时,较薄层色谱法更为准确,且精确度和灵敏度高。
二氢嘧啶脱氢酶在大肠癌的表达及其与5-氟尿嘧啶化疗敏感性的研究

平与 5 一 氟尿 嘧啶( 5 . F U) 化疗敏感性的相关性 , 从 中分析药物 代谢相关 酶的表达 情况 , 为临床 开展耐药 指标 筛查 , 指导 大 肠癌个体化疗 提供理论依据 。
[ 2 ] 杨佳 , 杨波 , 黄燕 , 等.Байду номын сангаас多发性骨髓瘤形 态学分型与临床 特点 及 预后 分析 . 中国药物与临床杂志 , 2 0 1 2 , 1 2 ( 3 ) : 3 1 3 . 3 1 5 .
我们 将进 一步对 禹州漏芦含药 血清诱导 骨髓瘤 细胞凋亡 的
( 收稿 日期 : 2 0 1 2 — 1 2 . 2 8 )
但 禹州漏 芦是否是通过阻断聚集体通路实现抗 骨髓 瘤作用? 对其 他骨髓瘤细胞株及耐药细胞株是否具有抑 制增 长作用 ?
机制进行实验研究 。
参 考 文 献
[ 1 ] 韦中玲 , 汪兴洪. N F — K B 在 多发性 骨髓瘤 的研究进展 . 医学研 究
杂志 , 2 0 0 7, 3 6 ( 1 1 ) : 9 8 — 1 0 1 .
n m) 。
1 . I 临床资料 收集 2 0 1 0年 9月至 2 0 1 2年 3月忻州 市人 民医院住 院 手术切 除的大肠 癌 5 6例 ,所有患 者术前均未 接受过化 、 放 疗 。男性 3 6例 , 女性 2 0例 , 年龄 3 0 ~ 8 1 岁, 中位年龄 5 7岁 ; 管状腺 癌 3 6 例( 高 分化 1 6例 , 中分化 1 2例 , 低分 化 8例 ) , 乳头 状腺癌 8例 , 黏 液腺癌 1 2例 ; 低 级别 3 6例 , 高级别 2 0
氟尿嘧啶的功能主治是什么意思

氟尿嘧啶的功能主治是什么意思1. 什么是氟尿嘧啶氟尿嘧啶(5-fluorouracil,简称5-FU)是一种抗肿瘤药物,属于嘧啶类化学物质。
它以化疗药物的形式广泛应用于治疗多种恶性肿瘤,包括结直肠癌、乳腺癌、胃癌等。
2. 氟尿嘧啶的功能氟尿嘧啶的主要功能是通过抑制DNA和RNA的合成,干扰癌细胞的生长和繁殖。
它具有以下主要的功能效应:a. 抑制癌细胞生长氟尿嘧啶可以干扰癌细胞的DNA和RNA的合成,阻止癌细胞的正常生长。
它通过与嘧啶核苷酸的合成途径中的关键酶结合,阻塞嘧啶代谢的正常过程。
b. 诱导癌细胞凋亡氟尿嘧啶还可以诱导癌细胞凋亡,即促使癌细胞主动死亡。
它作用于癌细胞的DNA和RNA,引起DNA和RNA的损伤,从而触发癌细胞的凋亡程序。
c. 抑制肿瘤血管生成氟尿嘧啶还具有抑制肿瘤血管生成的功效。
肿瘤血管生成是指肿瘤细胞通过新生血管的形成获取充足的营养和氧气。
氟尿嘧啶可以通过作用于血管内皮细胞,抑制肿瘤血管的形成,从而限制肿瘤的营养供应。
d. 增强免疫系统功能氟尿嘧啶还可以增强免疫系统的功能,提高机体抵抗疾病的能力。
它可以促进机体产生免疫相关的细胞和抗体,增强机体的免疫应答能力,有助于清除异常细胞和微生物。
3. 氟尿嘧啶在临床中的主治氟尿嘧啶作为一种重要的抗癌药物,在临床上被广泛应用于多种恶性肿瘤的治疗。
以下是氟尿嘧啶在不同肿瘤中的主要应用:a. 结直肠癌氟尿嘧啶是结直肠癌的标准化疗方案的主要组成部分。
它常与其他药物联合使用,如白蛋白紫杉醇、奥沙利铂等,用于治疗早期和晚期结直肠癌。
b. 乳腺癌氟尿嘧啶也可以用于乳腺癌的治疗。
它可单独使用或与其他化疗药物联合使用,如环磷酰胺、柠檬酸环磷酰胺等,用于治疗乳腺癌的不同阶段和亚型。
c. 胃癌氟尿嘧啶是胃癌的常用化疗药物之一。
它可以与顺铂、多柔比星等药物联合使用,用于治疗晚期胃癌和转移性胃癌。
d. 其他恶性肿瘤氟尿嘧啶还可用于治疗其他恶性肿瘤,如食管癌、头颈部肿瘤、胰腺癌等。
鼠源乳腺癌多药耐药细胞株的建立及耐药机制的初步研究

鼠源乳腺癌多药耐药细胞株的建立及耐药机制的初步研究邓印根;张志杰;卢敏莹;贾小婷;彭聪;贺智敏【期刊名称】《中国医药导报》【年(卷),期】2016(013)011【摘要】目的构建鼠源性乳腺癌5-氟尿嘧啶(5-Fu)耐药细胞株,为研究乳腺癌耐药与体内免疫微环境的关系提供细胞模型.方法通过体外以浓度递增的方法诱导小鼠乳腺癌4T1细胞对5-Fu产生耐药,MTS法确定其耐药性,平板克隆检测其增殖活性,实时定量和半定量PCR检测其中5-Fu代谢相关酶TS、MTHFR、TK、OPRT、DPD及药泵蛋白MDR1、MRP1的表达,通过流式细胞术检测其周期及CD44+CD24-干细胞亚群的比例.结果耐药细胞4T1/5-Fu与4T1细胞相比,4T1/5-Fu细胞对5-Fu、吉西他滨和顺铂耐药的耐药指数(RI)明显升高;5-Fu合成代谢相关酶TK、OPRT表达明显降低(P<0.05),代谢抑制性相关酶TS、MTHFR 明显升高(P<0.05),药泵蛋白MDR1、MRP1表达明显升高(P<0.05);流式细胞术结果显示,CD44表达明显升高,肿瘤干细胞群增多.结论成功构建小鼠乳腺癌多药耐药细胞株,耐药发生可能与5-Fu代谢酶类、药泵蛋白表达以及干细胞比例改变相关.【总页数】6页(P9-13,17)【作者】邓印根;张志杰;卢敏莹;贾小婷;彭聪;贺智敏【作者单位】广州医科大学附属肿瘤医院肿瘤研究所广州市恶性肿瘤治疗转化医学重点实验室,广东广州 510095;广州医科大学附属肿瘤医院肿瘤研究所广州市恶性肿瘤治疗转化医学重点实验室,广东广州 510095;广州医科大学附属肿瘤医院肿瘤研究所广州市恶性肿瘤治疗转化医学重点实验室,广东广州 510095;广州医科大学附属肿瘤医院肿瘤研究所广州市恶性肿瘤治疗转化医学重点实验室,广东广州510095;广州医科大学附属肿瘤医院肿瘤研究所广州市恶性肿瘤治疗转化医学重点实验室,广东广州 510095;广州医科大学附属肿瘤医院肿瘤研究所广州市恶性肿瘤治疗转化医学重点实验室,广东广州 510095【正文语种】中文【中图分类】R329.24【相关文献】1.胃癌多药耐药细胞株BGC823/5-FU的建立及其耐药机制的研究 [J], 杨皎娃;牛建花;曾季平;刘永;贾继辉;陈春燕2.结肠癌TRAIL耐药细胞株的建立及其耐药机制的初步研究 [J], 陈琳琳;朱玉萍;宋章法;黄学锋;毛伟芳3.乳腺癌依西美坦耐药细胞株的建立及耐药机制的初步研究 [J], 胡丽霞;袁媛;杜瀛瀛;潘跃银4.乳腺癌帕博西尼耐药细胞株的建立及耐药机制研究 [J], 唐瑶;杨建;郭正成;郝峰;宁金鹰;康金森5.人乳腺癌多药耐药细胞株的建立及其特性的研究 [J], 袁海平;刘全海因版权原因,仅展示原文概要,查看原文内容请购买。
5-氟尿嘧啶在pH敏感型分子筛控释载体中的缓释行为

5-氟尿嘧啶在pH敏感型分子筛控释载体中的缓释行为吴都督;陈稚;龙烁杭;施志海;吴锐彬【摘要】以肠溶性的羟丙基甲基纤维素邻苯二甲酸酯(HPMCP)作为包覆材料,制备了HPMCP包覆的SBA-15介孔分子筛药物控释载体(HPMCP/SBA-15),并考察了抗癌药物5-氟尿嘧啶(5-Fu)负载于控释载体后,在不同pH释放环境中的释放行为.结果表明,在模拟胃液中(pH=1.2),HPMCP能明显地延缓5-Fu的释放速度;药物释放4h后,其释放率仅为15%.而在模拟肠液中(pH=7.5) HPMCP迅速溶解,对5-Fu释放速度的影响甚微;药物释放4h后,释放率可达到80%.与此同时,包覆膜的干燥温度影响5-Fu的释放行为,干燥温度越高,药物在模拟胃液中的释放速度越慢.%A pH-sensitive mesoporous molecular sieve as drug release carrier was synthesized by coating SBA-15 tablet with hydroxypropyl methylcellulose phthalate (HMPCP) so as to improve the cancer targeting ability and selectivity of antineoplastic agent 5-fluorouracil (5-Fu). Into the drug release carrier (HPMCP/SBA-15) was loaded 5-Fu by adsorption in the mixed solution of water and methanol (volume ratio 1:1). The releasing behavior of loaded 5-Fu in two kinds of release fluids with different pH environment, simulated intestinal fluid (SIF, pH = 7. 4) and simulated gastric fluid (SGF, pH = 1.2), was examined. Results indicate that in SGF the coating carrier can effectively delay the release rate of 5-Fu, with release rate being only 15% after 4 h of drug release. However, in SIF it has no obvious effect on the drug delivery rate, possibly due to the dissolution of HPMCP in SIF; and in this case the release rate reaches 80% after 4 h of drug release. Moreover, the release behavior of 5-Fu is also dependent onthe temperature for drying HPMCP, and higher drying temperature corresponds to better drug release performance of loaded 5-Fu in SGF.【期刊名称】《化学研究》【年(卷),期】2012(023)001【总页数】6页(P24-28,34)【关键词】5-氟尿嘧啶;羟丙基甲基纤维素;邻苯二甲酸酯;pH敏感型介孔分子筛;药物缓释行为【作者】吴都督;陈稚;龙烁杭;施志海;吴锐彬【作者单位】广东医学院药学院,广东东莞523808;广东医学院分析中心,广东东莞523808;广东医学院药学院,广东东莞523808;广东医学院药学院,广东东莞523808;广东医学院药学院,广东东莞523808【正文语种】中文【中图分类】O629.95-氟尿嘧啶(5-Fu)是常用的治疗癌症(如肠癌)的药物[1].但在传统口服给药方式中,药物分子在到达肠道以前大部分被胃吸收或者被胃中的酶所破坏,这样不仅降低了药物到达肠道后的有效浓度,而且5-Fu的毒副反应容易对胃、肝等正常器官造成伤害[2].因此开发一些新型的肠道靶向药物控释系统具有重要的实用价值和广阔的应用潜力.最近,纳米技术的发展激发了广大研究者使用新开发的纳米材料作为医药载体的兴趣.而硅基介孔分子筛因具有分布均匀且连续可调的纳米孔径、高比表面积、大孔容、表面可官能团化和良好的生物相容性等优点,已成为一种很有应用潜力的新型药物载体[3].2001年,VALLET-REGÍ首次报道了介孔分子筛的药物输送性能,将硅基介孔分子筛的应用拓展到药物制剂领域[4].随后,相继有几个研究小组分别报道了以介孔分子筛作药物载体的安全性和生物相容性等方面的研究成果,并对调控药物释放速度的影响因素,如介孔孔径、分子筛表面官能团、药物释放环境等进行了探索性的研究,这些研究结果表明在以硅基介孔分子筛为载体的药物体系中,药物分子能够以分子级别分布在介孔孔道中,从而可更加精确地调控药物释放速度,实现对药物的定时定量释放[5-7].与此同时,人体环境是一个很复杂的生理环境,比如整个相连通的消化系统中,胃液的pH是1.2左右,十二指肠中的pH是5.4左右,而小肠部位的pH又是7.4左右,所以复杂的人体环境为介孔分子筛这种新型载体的发展也提出了复杂的要求,“靶向释放”这种更高级的药物释放模式被人们提了出来.鉴于胃和肠道各自环境中pH的差异,设计一种pH控制的药物释放载体应用于药物控释应该是一个切合实际的研究方向.如果设计出的pH控制药物释放系统,不仅能够很明显地延缓药物(如5-Fu)在胃液中的释放速度,而且又不限制药物在其他器官(如肠道)中的释放,那么所得到的应该是一个好的pH敏感的药物释放系统.该控释系统不仅可阻止毒副反应对胃、肝等器官的损害,还可提高药效,因而在癌症(如肠癌)治疗中应具有良好的应用前景.然而,到目前为止,基于介孔分子筛这种新型载体的pH敏感药物控释研究却只有很少的报道.YANG等人利用羧基官能团化SBA-15表面的-COOH和聚电解质PDDA之间的静电相互作用,开发了一种pH敏感药物释放载体.该系统在碱性条件下,利用聚合物将药物束缚在介孔孔道内,使之不能很快释放出来.而在酸性条件下,聚合物与分子筛表面的作用力消失,药物则能够快速的被释放.遗憾的是,该控释系统对酸过于敏感,应用价值不大[8].羟丙基甲基纤维素邻苯二甲酸酯(HPMCP)是一种良好的pH敏感包覆材料,自从1971年上市以来,常作为纤维素的衍生物用于包衣,并在药学行业中广泛应用[9].它具有非常好的成膜能力,所以在制备过程中无须任何其他处理,就能与负载药物的载体紧密结合.操作过程非常简单,而且对制备过程无特别要求,因此是一种理想的介孔分子筛的包覆材料.因此,作者以pH敏感的HPMCP作为包覆材料,通过提拉的方法,制备HPMCP包覆的SBA-15介孔分子筛药物控释载体(HPMCP/SBA-15),同时利用5-Fu与分子筛的表面硅羟基的耦合将5-Fu负载于载体中,并考察其在模拟胃液(SGF)和模拟肠液(SIF)中的药物控释行为,以验证HPMCP/SBA-15载体的pH敏感性能.5-氟尿嘧啶,分析纯,Sigma公司;羟丙基甲基纤维素邻苯二甲酸酯,分析纯,广州市鼎泰树脂有限公司;P123(H(CH2CH2O)20(CH2CH2CH2O)70(CH2CH2O)20H),分析纯,Aldrich公司;正硅酸乙酯(TEOS),分析纯,天津市化学试剂一厂;磷酸二氢钾,磷酸氢二钾,分析纯,天津科密欧化学试剂公司;无水乙醇,盐酸,分析纯,广东番禺化学试剂厂.在磁力搅拌下,将4.0g表面活性剂P123加入到80mL 2.0mol·L-1的HCl溶液中,温度恒定在40℃,搅拌至P123完全溶解后,加入5.0mL的TEOS.反应混合物在40℃下恒温搅拌24h后转移至100 mL的晶化釜中,于100℃下晶化36h.所得产物过滤后,用去离子水和无水乙醇反复冲洗直至滤液的pH为7.0左右,然后样品在80℃下干燥,最后将样品在索氏抽提器中用无水乙醇萃取48h,80℃下烘干即得纯硅基介孔SBA-15.分别取1.0g SBA-15粉末和1.5g 5-氟尿嘧啶,加入到250mL的去离子水和甲醇的等体积混合溶剂中.室温搅拌12h后过滤,所得固体在80℃烘箱中干燥.取2.0mL滤液稀释到25.0mL,用WFZ-26A型紫外可见分光光谱仪(天津拓普仪器有限公司)测定溶液中的5-氟尿嘧啶的浓度,按公式(1)确定载药量.取0.20g负载了药物的SBA-15粉末,在5.0MPa的轴向压力下制得13mm×3mm的药片.然后将2.0g的HPMCP加入到总体积为50mL的甲醇和去离子水的混合溶剂中(甲醇和水的体积比为1∶1),搅拌至HPMCP全部溶解.接着以提拉的方式在SBA-15药片上包覆HPMCP聚合物,提拉的速度控制在20 cm/min.每个药片的HPMCP包覆过程重复3次.将包覆有HPMCP聚合物膜的药片置于烘箱中干燥30 min,然后20℃下真空干燥12h备用.在100r/min的搅速下,将以上所得药片分别在模拟胃液(pH=1.2,HCl水溶液)和模拟肠液(pH=7.4,磷酸氢二钾和磷酸二氢钾的缓冲溶液)中研究药物的缓释行为,实验温度控制在37℃.用WFZ-26A型紫外可见分光光谱仪测定溶液中释放出来的5-氟尿嘧啶的浓度,并按公式(2)确定药物释放率.药物释放率=(释放过程中游离的药物质量/负载的药物质量)×100% (2)透射电镜(TEM)测试在日立H 600透射电镜仪上进行,具体操作为:首先把少量样品放入称量瓶内,乙醇作分散剂,超声振荡20min后,用洁净的滴管取一滴于铜网上,干燥后进行观察,操作电压为200kV.红外光谱在FTS175C-UMA500型傅立叶红外光谱仪(美国Bio-Rad公司)上测得,扫描累加128次.采用KBr压片法进行测定.X射线衍射(XRD)测试于日本理学(Rigaku)D/max-γA型X射线衍射仪上进行,使用Cu Kα辐射(λ=0.154 2nm),金属Ni滤波,石墨单色器,电压40kV,电流30mA,闪烁记数器记录强度.N2吸附-脱附和孔分布在美国Tristar 3000自动物理吸附仪上进行.样品在80℃和1.33×10-4Pa下脱气12h后,在-196℃下进行测定,并由Brunauer-Emmett-Teller(BET)方程计算样品的比表面积,用Barrett-Joyner-Halenda(BJH)方法和N2吸附-脱附曲线中的脱附分支计算材料的孔分布. SBA-15介孔分子筛的透射电镜图如图1所示.由图1可见,所合成的SBA-15长度约为10~20μm,并具有很好的直径均一的棒状结构.表1列出了SBA-15介孔分子筛吸附5-Fu前后的主要红外特征吸收峰.由表1可见,纯SBA-15介孔分子筛在3 465cm-1、1 644cm-1、1 090cm-1、971.6cm-1和 802.5cm-1出现特征吸收峰.其中,3 465cm-1属于分子筛表面吸附的水的O-H伸缩振动,1 644cm-1属于吸附的水的O-H弯曲振动,1 090 cm-1属于Si-O的不对称伸缩振动,971.6cm-1和802.5cm-1属于SiO-H 的弯曲振动[10].当SBA-15介孔分子筛吸附5-Fu后,其表面除了依然有上述硅骨架的特征峰外,还在1 730cm-1、882.6cm-1和753.3 cm-1出现了新的特征峰.其中,1 730cm-1属于5-Fu的CO伸缩振动,882.6cm-1属于-CFCH-中C-H的面外弯曲振动,753.3cm-1属于-CFCH-中C-H的面外变形振动[11].这些属于5-Fu的特征峰的出现,意味着5-Fu已成功地负载到介孔SBA-15的表面.图2是负载5-Fu前后的SBA-15介孔分子筛的XRD图.由图可见,SBA-15在负载5-Fu前后均在2θ=1.0°左右存在一个六方晶系d100衍射主峰,与文献报道一致[12].该衍射峰是典型的SBA-15介孔材料的特征峰,表明样品长程有序的六方孔道结构已经形成.另外,SBA-15在负载5-Fu后,其XRD图基本不变,仅峰强度略有降低,这表明5-Fu在SBA-15上负载并不会改变分子筛的有序结构,但是会使其介孔结构的有序性降低.图3是羧基官能团化SBA-15吸附5-Fu前后的N2吸附脱附和孔分布图.如图3所示,两样品在吸附5-Fu前后吸附脱附等温线都呈现了典型的Ⅳ型曲线并保留着完整的H1滞后环,这说明所合成的SBA-15具有有序的介孔结构.同时,发现当分子筛在吸附药物后,其比表面积由543.7m2/g降至509.5m2/g,孔容由1.023cm3/g降至0.962cm3/g,孔径由5.9nm降为5.6nm.分子筛吸附药物后,其比表面积、孔径和孔容的降低,再次证实了5-Fu分子被成功地负载到介孔SBA-15的孔道内.另外,根据UV-Vis所测得的浓度,计算出5-Fu在SBA-15介孔分子筛上的药物负载量为10.3%.采用体外模拟释放实验来评价药物载体对5-Fu的缓释行为.图4是SBA-15载药粒和HPMCP/SBA-15载药粒在模拟胃液(a)和模拟肠液(b)中的缓释行为.从图4(a)中可以看到,没有包覆HPMCP的SBA-15载药粒在模拟胃液中释放5-Fu的速度很快,2h后药物基本释放完全.而有HPMCP包覆的SBA-15载药粒在模拟胃液中释放5-Fu的速度较慢(见图4(a)),2h之前药物的释放不超过10%,而到达4h时,被释放出来的5-Fu也仅有15%,即使24h后,药物的释放也仅达到50%,这表示HPMCP/SBA-15可以很好地延缓5-Fu在模拟胃液中的释放速度.由于食物在胃中的停留时间一般为4h,因此我们认为HPMCP/SBA-15可以很好的在胃环境中保护吸附于介孔孔道中的药物分子.另外,我们发现,在模拟肠液中,药物缓释过程基本不受所包覆的HPMCP膜层的影响,包覆前后的药物缓释曲线变化不大,5-Fu在模拟肠液中均可快速释放,这一点,恰恰可以满足5-Fu对于肠道疾病治疗(如肠癌)的需要.因为该药物缓释系统,不仅可以明显延缓5-Fu在胃液中的释放速度,而且又不影响5-Fu在肠液中的释放,可减少胃液对药物的影响,因而是一种理想的pH敏感载体.另外,HPMCP(pKa值约为4.5~5.5)是一种生物兼容和pH敏感的聚合物,其表面存在一个pH控制的疏水作用和静电斥力之间的敏感平衡.在模拟胃液中,HPMCP会因为表面羧基被质子化,疏水作用占主导地位,从而包覆在SBA-15药片上不溶解,使药物难以释放.因此,膜的厚度对载体的缓释效果有着重要的影响,而干燥温度无疑是影响膜厚度的一个重要因素[10].因此,我们考察了膜的干燥温度对药物释放行为的影响.从图5(a)可见,提高干燥温度对药物在模拟胃液中的释放速度减缓效果非常明显,样品干燥温度越高,5-Fu的释放速度越慢,这说明提高干燥温度可以使HPMCP的膜层变得更加致密,使药物的缓释效果增强.而在模拟肠液中,我们发现提高制样时的干燥温度对5-Fu的释放速度基本没有影响,5-Fu在短时间内均可快速释放(见图5(b)),这主要是因为HPMCP在模拟肠液中,其表面的静电斥力起主导作用,可使其快速溶解的缘故[13].结论:通过简单的提拉方法,将HPMCP聚合物膜成功包覆于负载有5-Fu的SBA-15药片的表面,制备了pH敏感型药物缓释材料HPMCP/SBA-15,并且考察了其在模拟胃液和模拟肠液中的缓释行为.研究发现,在包覆HPMCP后,载体HPMCP/SBA-15能够有效地减缓抗癌药物5-Fu在模拟胃液中的释放速度.同时,又不影响药物在模拟肠液中的释放速度,是一种较好的pH敏感型药物缓释材料.而且,膜的干燥温度越高,载体的缓释性能越强.HPMCP/SBA-15良好的pH敏感性能,有望使其实现对肿瘤组织的主动靶向和控制释药.【相关文献】[1]陈志和,黄灵珍.奥沙利铂联合5-氟尿嘧啶、亚叶酸钙治疗晚期大肠癌的临床观察 [J].医学理论与实践,2011,24(5):543-544.[2]季风存,程若川,康俊升.5-氟尿嘧啶诱导直肠癌HR8348细胞凋亡作用的研究 [J].中国普外基础与临床杂志,2003,10(6):564-567.[3]ANGELOS S,JOHANSSON E,STODDART J F,et al.Mesostructured silica supports for functional materials and molecular machines[J].Adv Funct Mater,2007,17(14):2261-2271.[4]VALLET-REGI M,RAMILA A,DEL REAL R P,et al.A new property of MCM-41:Drug delivery system[J].Chem Mater,2001,13(2):308-311.[5]RADU D R,LAI Cheng Yu,JEFTINIJA K,et al.A polyamidoamine dendrimer-capped mesoporous silica nanospherebased gene transfection reagent[J].J Am Chem Soc,2004,126(41):13216-13217.[6]SONG S W,HIDAJAT K,KAWI S.Functionalized SBA-15materials as carriers for controlled drug delivery:influence of surface properties on matrix-druginteractions[J].Langmuir,2005,21(21):9568-9575.[7]HORCAJADA P,RAMILA A,GERARD F.Influence of superficial organic modification of MCM-41matrices on drug delivery rate[J].Solid State Sci,2006,8(10):1243-1249. [8]YANG Qing,WANG Shi Chao,FAN Pei Wei,et al.pH-responsive carrier system based on carboxylic acid modified mesoporous silica and polyelectrolyte for drug delivery[J].Chem Mater,2005,17(24):5999-6003.[9]张宪康,沈健平.肠溶性药用辅料HPMCP的合成研究[J].中国医药工业杂志,1993,24(3):104-107.[10]徐武军,高强,徐耀,等.基于HPMCP包覆介孔SBA-15的pH敏感药物缓释系统[J].化学学报,2008,66(14):1658-1662.[11]梁丽芸,郭俊,谭必恩.5-氟尿嘧啶明胶微球的制备、表征及释药性能 [J].广东化工,2009,36(5):117-119.[12]ZHAO Dong Yuan,FENG Jiang Lin,HUO Qi Sheng,et al.Triblock copolymer syntheses of mesoporous silica with heriodic 50to 300angstrom pores[J].Science,1998,279:548-552.[13]QIU Yong,PARK K.Environment-sensitive hydrogels for drug delivery[J].Adv Drug Deliver Rev,2001,53(3):321-339.。
中药半枝莲对5-氟尿嘧啶抗肝癌增强作用的实验研究的开题报告

中药半枝莲对5-氟尿嘧啶抗肝癌增强作用的实验研究的开
题报告
题目:中药半枝莲对5-氟尿嘧啶抗肝癌增强作用的实验研究
摘要:近年来,5-氟尿嘧啶(5-FU)是常用的肝癌化疗药物之一。
但是5-FU常
常存在耐药性和中毒性的问题。
因此,我们需要寻找新的药物或方法来增强5-FU的抗肝癌作用。
半枝莲是一种传统的中药,用于治疗各种疾病,包括肝癌。
这项研究旨在
探讨半枝莲是否能增强5-FU的抗肝癌作用。
研究方法:使用肝癌细胞株HepG2进行实验。
将HepG2细胞分为四组:对照组、5-FU组、半枝莲组和5-FU+半枝莲组。
分别测定细胞的增殖率、凋亡率、细胞周期分布以及基因表达。
预期结果:预计半枝莲组和5-FU+半枝莲组会增强5-FU对HepG2的作用,包括减少细胞增殖率、增加细胞凋亡率、改变细胞周期分布以及调节相关的基因表达。
这
些结果将有望证明半枝莲可能作为一种潜在的增强化疗药物的候选,并有助于开发更
有效的肝癌治疗方法。
结论:本研究将为研究半枝莲的药理作用和有效性提供新思路,并有望开展更深入的研究以帮助发现更具潜力的药物组合治疗方案,提高肝癌治疗的成功率,改善患
者血清生化指标和生存质量。
五氟尿嘧啶的功能主治

五氟尿嘧啶的功能主治一、简介五氟尿嘧啶是一种广泛应用于医学领域的化学物质,它具有多种功能和主治作用。
本文将介绍五氟尿嘧啶的各项功能和主要用途。
二、功能以下是五氟尿嘧啶的主要功能:•抗癌作用:五氟尿嘧啶被广泛用于化疗治疗癌症,尤其是结直肠癌和胃癌等消化系统肿瘤。
它能够通过阻断DNA的合成和抑制肿瘤细胞的增殖,起到抗癌的效果。
•抗炎作用:五氟尿嘧啶对于某些炎症疾病如风湿性关节炎和克罗恩病等有一定的治疗作用。
它能够抑制炎症反应和减少炎症部位的疼痛和肿胀。
•免疫调节作用:五氟尿嘧啶可以调节免疫系统的功能,增强机体的免疫力。
它能够增加淋巴细胞的活性,促进免疫细胞的增殖和分化,对于某些免疫相关疾病如自身免疫性疾病具有一定的治疗效果。
•抗菌作用:五氟尿嘧啶对某些细菌有抑制和杀灭作用,特别是对于导致感染性腹泻的细菌有较好的效果。
它能够阻断细菌的DNA和RNA的合成,使细菌无法繁殖和生存。
•抗病毒作用:五氟尿嘧啶可用于抗病毒药物的制备,对于某些病毒如禽流感病毒和乙肝病毒等有抑制和杀灭作用。
它可以干扰病毒蛋白的合成和阻断病毒核酸的复制,从而抑制病毒的增殖。
三、主治五氟尿嘧啶具有多种主治作用,主要包括以下方面:•消化系统肿瘤:五氟尿嘧啶在化疗中被广泛用于消化系统肿瘤的治疗,如结直肠癌和胃癌等。
它能够抑制肿瘤细胞的增殖和扩散,减少肿瘤的体积,并提高患者的生存率。
•炎症性疾病:五氟尿嘧啶对于某些炎症性疾病如风湿性关节炎和克罗恩病等有治疗效果。
它能够减轻炎症反应和缓解患者的症状,提高生活质量。
•免疫相关疾病:由于五氟尿嘧啶具有免疫调节作用,因此可以用于治疗某些免疫相关性疾病,如风湿性关节炎和系统性红斑狼疮等。
它能够调节免疫系统的功能,减少免疫反应的异常,缓解患者的症状。
•感染性疾病:五氟尿嘧啶对于某些细菌和病毒引起的感染性疾病有较好的治疗效果。
它能够抑制细菌和病毒的生长和繁殖,减少感染的范围和严重程度,缩短感染的持续时间。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
大肠癌化疗过程中多药耐药( %&’()*+,&- ,./)/(012., ) 345 是临床化疗成功的主要障碍,研究其耐药机制, 对克服其 345 及逆转剂的研究具有重要临床意义 6 $ 7 。 我们应用大剂量 8 9 氟尿嘧啶 : 8*;< = 冲击疗法诱导 >?@? 细胞,历时 # 个月,已成功建立了 >?@? A 8*;< 耐药细胞株,并进行系列研究,本实验应用原位 4BC 末端转移酶标记法分别对 >?@? A 8*;< 和 >?@? 细胞 8*;< 诱导细胞凋亡进行了研究,试图探讨 345 机 制。 ! 材料与方法 $D $ 细胞株及细胞培养 人大肠癌 >?@? 细胞株引 自第一军医大学病理教研室, 耐药细胞株 >?@? A 8*;< 应用大剂量 8*;< 冲击疗法,历时 # 个月建成。 >?@? 细胞株置 EFG 、饱和湿度、8H I?! 的孵箱中无菌培
实用医学杂志 !""# 年第 !! 卷第 $" 期
$$"%
记脱氧尿苷三磷酸 . /-01 2 反应混合液 *" !&, 3%4 湿 ( 盒内孵育 $ 5, 滴加 <=1 辣根过氧 167 漂洗 * 89: ; 3, 化物酶 ) 标记的抗 ,>0? 抗体, 3%4 湿盒内保温 $ 5, 终止显色, 苏木精复染脱水, 封 @AB 暗处显色 * 89:, 片, 镜下观察、 摄影。阳性细胞为胞浆呈棕黄色, 不着 色为阴性。同时用 167 代替 @AB 末端转移酶, 作为阴 性对照。 $C 3C D 细胞凋亡指数 ( EFGFHGI9I 9:/JKL B>) 每个时 间点选 * 个阳性着色最明显视野( , 计数 *"" 个 ; D"") 细胞中阳性百分率。 $C 3C * @AB 凝胶电泳 M D N 分别收集不同浓度 *+,作用 &’(’ 和 &’(’ ) *+,- 细胞, 167 漂洗 * 89: ; 3, 加入细胞裂解液 "C * 8&( F< OC " , P@0B $" 88GQ ) &, , , 蛋白酶 0R9I+<?Q $" 88GQ ) & 7@7 "C *S T "C $* :U ) 酚 ) 氯仿抽提, 离心取上清液, 加 8&)3%4 反应 !D 5, 入 $ ) $" 体积的 AEBV "C "$ 8GQ ) &, 再加入 ! 倍体积无 水乙醇, 混匀, 离心弃上清, 沉淀在空气 3%4 水浴 ! 5, 中干燥, 加入 =ABEIJ $"" !U ) 8&, 重 0P 液重悬 @AB, ( 新提取 @AB,@AB 沉淀溶解于 !" !Q 0P 液 F< OC ") 中, 紫外灯下观察、 拍照。 $C *S 琼脂糖凝胶电泳 ! 5, $C D 统计方法 取 3 次实验均值,两样本率比较应 用 "! 检验。 " 结果 !C $ 细胞存活率 应用 W00 法测定相同时间内 ( DO ) 5 不同浓度的 *+,- 对 &’(’ 及 &’(’ ) *+,- 细胞存 分别用 *+,- !!、 活率的影响, 见图 $ 。 $$"、 !!" !U ) 8& 作用 DO 5, &’(’ 细胞存活率分别下降为 #OC !$S 、 而 &’(’ ) *+,- 细胞存活率分别下 !"C 3!S 、 $DC 3#S , 降为 XDC "*S 、 两株细胞存活率比 3"C X3S 、 $*C !"S , 较差异有显著性( ! Y "C "$ 2 。
$$"#
实用医学杂志 !""# 年第 !! 卷第 $" 及细胞凋亡的实验研究
姚学清 林 锋 卿三华 黄祥成 钟世镇
摘 要 目的: 研究 8 9 氟尿嘧啶 ( 诱导 >?@? 细胞凋亡, 探讨人大肠癌多药耐药机制。方法: 用噻唑蓝 8*;<) ( 法、 光镜及电镜、 分别对耐药细胞株 >?@? A 8*;< 细胞及敏感 3LL) 4BC 凝胶电泳和原位 4BC 末端转移酶标记法, 光镜 细胞株 >?@? 细胞进行 8*;< 诱导细胞凋亡的实验研究。结果: >?@? A 8*;< 细胞存活率明显高于 >?@? 细胞, 和电镜观察凋亡形态学改变, 凋亡细胞 4BC 凝胶电泳可以出现梯形 ( 凋亡带, ’0++.,) >?@? 细胞原位 4BC 末端转移 ( ( 酶标记阳性率高于 >?@? A 8*;<。结论: 有明显的时间和剂量效应。 在相 $) 8*;< 诱导人大肠癌 >?@? 细胞凋亡, !) ( 细胞凋亡对研究大肠癌 >?@? 前者凋亡受到抑制。 同条件下, 耐药细胞株 >?@? A 8*;< 与敏感细胞株 >?@? 相比, E) 细胞多药耐药机制, 克服化疗产生的多药耐药及逆转多药耐药具有重要的临床价值。 关键词 结直肠肿瘤 氟尿嘧啶 抗药性, 肿瘤 细胞凋亡 "#$%&’(&’()*+%#+,-’*.- )/&/0&1+1 +, 2’%0+#-(’3 (.1+10),*. 4’2), *&%&(.*0)% *),*.( *.%% %+,.1 !"# $%&’()*+" , -./ 0&*+, 1./2 34*’5%4, 67"/2 $)4*+’85&*+, 96#/2 35)’:5&*; " <&=4>?@&*? AB 24C?>A)*?&C?)*4D 3%>+&>E, 2%4*+FA*+ G>AH)*8)4D G&A=D&I C 6AC=)?4D, 2%4*+:5A% JKLLML, N5)*4 【 5610()*0】 768.*0+9. LW /(&+X 8*Y’W&,W&,02)’ : 8*;< = *)1+&2.+ 0ZWZ(W/)/ WY >?@? 2.’’/ 01+ .[Z’W,. (\. %.2\01)/% WY %&’()*+,&- ,./)/(012. )1 \&%01 2W’W,.2(0’ 2012.,D :.04&-1 3LL 0//0X] WZ()20’ %)2,W/2WZX] .’.2(,W1 %)2,W/2WZX] 4BC 0-0,W/. -.’ .’.2(,WZ\W,./)/] 01+ )1 /)(& 4BC 1)2^ .1+*’0_.’)1- ‘.,. &/.+ (W +.(.2( (\. 0ZWZ(W/)/ )1 (\. +,&- ,./)/(01( >?@? A 8*;< 01+ /.1/)()a. >?@? 2.’’/D ;.1’%01 L\. /&,a)a0’ ,0(. WY >?@? A 8*;< 2.’’/ ‘0/ /)-1)Y)201(’X \)-\., (\01 (\0( WY >?@? 2.’’/D L\. %W,Z\W’W-)20’ 2\01-./ WY 0ZWZ(W()2 2.’’ )1 _W(\ 2.’’ ’)1./ ‘.,. W_/.,a.+ &/)1- _W(\ WZ()20’ 01+ .’.2(,W1 %)2,W/2WZXD C ’0++.,*’)^. 0ZWZ(W()2 _01+ ‘0/ /\W‘1 _X 0-0,W/. -.’ .’.2(,WZ\W,./)/D L\. ZW/)()a. ,0(. WY )1 /)(& 4BC 1)2^ : $ = 8*;< )1+&2./ (\. 0ZWZ(W/)/ WY .1+*’0_.’)1- )1 >?@? 2.’’/ ‘0/ \)-\., (\01 (\0( )1 >?@? A 8*;< 2.’’/D <&,*%’1+&,1 \&%01 2W’W,.2(0’ 2012., >?@? 2.’’/ )1 0 2\0,02(.,)/()2 +W/.* 01+ ()%.*+.Z.1+01( %011.,D : ! = L\. 0ZWZ(W/)/ )1 (\. +,&- ,./)/(01( >?@? A 8*;< 2.’’/ ‘0/ %&2\ ’.// (\01 (\0( )1 /.1/)()a. >?@? 2.’’/ &1+., (\. /0%. 2W1+)()W1D : E = CZWZ(W/)/ %0X Z’0X 01 )%ZW,(01( ,W’. )1 /(&+X)1- (\. %.2\01)/% WY %&’()*+,&- ,./)/(012. )1 \&%01 2W’W,.2(0’ 2012., >?@? 2.’’/ 01+ Z,.a.1()1- (\. +.a.’WZ%.1( WY %&’()*+,&- ,./)/(012. )1+&2.+ _X 2\.%W(\.,0ZX 0/ ‘.’’ 0/ .’)%)10()1- (\)/ %&’()*+,&- ,./)/(012.D 【 =.> ?&(-1】 IW’W,.2(0’ 1.WZ’0/%/ ;’&W,W&,02)’ 4,&- ,./)/(012.] 1.WZ’0/% CZWZ(W/)/
