超氧阴离子产生速率测定
抗氧化酶(SOD、POD、CAT)活性测定方法

抗氧化酶(SOD、POD、CAT)活性测定方法一、超氧化物歧化酶(SOD)活性测定(氮蓝四唑光化还原法)1、试剂的配制(1)L磷酸缓冲液(PBS,:A母液:L磷酸氢二钠溶液: 取Na2HPO4·12H2O(分子量)71.7g;B母液:L磷酸二氢钠溶液:取NaH2PO4·2H2O(分子量)31.2g。
分别用蒸馏水定容到1000ml。
L PBS()的配制:分别取A母液(Na2HPO4) ,B母液(NaH2PO4) ,用蒸馏水定容至1000ml。
参考文献:李合生主编:植物生理生化实验原理和技术.高等教育出版社,2000:267~268。
(2)甲硫氨酸溶液:取 Met用磷酸缓冲液()定容至1000ml。
(3)30μM EDTA-Na2溶液:取用磷酸缓冲液定容至100ml。
(4)60μM核黄素溶液:取核黄素用磷酸缓冲液定容至100ml,避光保存。
(5)氮蓝四唑(NBT)溶液:取 NBT用PBS定容至100ml,避光保存。
酶液制备:取(可视情况调整)样品(新鲜叶片或根系)洗净后置于预冷的研钵中,加入 50mmol/L预冷的磷酸缓冲液()在冰浴上研磨成匀浆,转入离心管中在4℃、12000g下离心20min,上清液即为酶液。
2、酶活性测定(1)反应混合液配制(以60个样为准):分别取Met溶液162ml,EDTA-Na2溶液,磷酸缓冲液,NBT溶液6ml,核黄素溶液6ml,混合后摇匀;(2)分别取3ml反应混合液和30μl酶液于试管中(3)将试管置于光照培养箱中在4000 lux光照下反应20min;同时做两支对照管,其中1支试管取3ml反应混合液加入30μl PBS(不加酶液)照光后测定作为最大光还原管,另1支只加缓冲液置于暗中测定时用于调零。
(4)以不照光的对照管(只有缓冲液并置于暗处)调零后,避光测OD560(出现颜色即可测定)。
(5)酶活性计算:SOD活性单位以抑制NBT光化还原50%所需酶量(测的样品值要在最大管的一半左右才合适,否则要调整酶量)为1个酶活单位(u)。
抗氧化酶(SOD、POD、CAT)活性测定方法

抗氧化酶(SOD、POD、CAT)活性测定方法一、超氧化物歧化酶(SOD)活性测定(氮蓝四唑光化还原法)1、试剂的配制(1)0.05mol/L磷酸缓冲液(PBS,pH7.8):A母液:0.2mol/L磷酸氢二钠溶液: 取Na2HPO4·12H2O(分子量358.14)71.7g;B母液:0.2mol/L磷酸二氢钠溶液:取NaH2PO4·2H2O(分子量156.01)31.2g。
分别用蒸馏水定容到1000ml。
0.05mol/L PBS(pH7.8)的配制:分别取A母液(Na2HPO4) 228.75ml,B母液(NaH2PO4) 21.25ml,用蒸馏水定容至1000ml。
参考文献:李合生主编:植物生理生化实验原理和技术.高等教育出版社,2000:267~268。
(2)14.5mM甲硫氨酸溶液:取2.1637g Met用磷酸缓冲液(pH7.8)定容至1000ml。
(3)30μM EDTA-Na2溶液:取0.001gEDTA-Na2用磷酸缓冲液定容至100ml。
(4)60μM核黄素溶液:取0.0023g核黄素用磷酸缓冲液定容至100ml,避光保存。
(5)2.25mM 氮蓝四唑(NBT)溶液:取0.1840g NBT用PBS定容至100ml,避光保存。
酶液制备:取0.2g(可视情况调整)样品(新鲜叶片或根系)洗净后置于预冷的研钵中,加入1.6ml 50mmol/L预冷的磷酸缓冲液(pH7.8)在冰浴上研磨成匀浆,转入离心管中在4℃、12000g下离心20min,上清液即为酶液。
2、酶活性测定(1)反应混合液配制(以60个样为准):分别取Met溶液162ml,EDTA-Na2溶液0.6ml,磷酸缓冲液5.4ml,NBT溶液6ml,核黄素溶液6ml,混合后摇匀;(2)分别取3ml反应混合液和30μl酶液于试管中(3)将试管置于光照培养箱中在4000 lux光照下反应20min;同时做两支对照管,其中1支试管取3ml反应混合液加入30μl PBS(不加酶液)照光后测定作为最大光还原管,另1支只加缓冲液置于暗中测定时用于调零。
巯基乙胺修饰电极法测定植物体内超氧阴离子自由基

巯基乙胺修饰电极法测定植物体内超氧阴离子自由基王燕*陈蓁蓁(山东师范大学化学化工与材料科学学院,济南250014)摘 要 盐酸羟胺与超氧阴离子自由基反应生成NO -2,通过检测NO -2的生成量,可间接测定超氧阴离子自由基。
基于上述原理,建立了一种用巯基乙胺自组装修饰金电极测定生物体系中超氧阴离子自由基的新方法。
实验结果表明,在p H 4.8的HA c -N a A c 缓冲溶液中,修饰电极对NO -2的氧化具有良好的电催化作用,差分脉冲溶出伏安法测定其氧化峰电流与NO -2的浓度在5.0@10-8~1.0@10-4m o l/L 范围内呈线性关系,其线性回归方程为i pa (L A )=3.726C (L mo l/L)+0.0257,相关系数为0.9983;检出限为1.0@10-8m ol/L 。
该法用于玉米幼苗和叶片中超氧阴离子自由基产生速率的测定,结果令人满意。
关键词 超氧阴离子自由基,化学修饰电极,巯基乙胺,差分脉冲溶出伏安法2008-04-02收稿;2008-05-28接受本文系山东省自然科学基金(No .Y2006B28)资助项目*E-m ai:l f agong @sdu .edu .cn1 引 言在生物体的氧化代谢过程中会产生大量的活性氧自由基,它们具有很强的氧化能力,可以损伤生物膜的结构及功能,引起核酸及蛋白质变性,从而对细胞及组织产生十分有害的生物学效应。
其中超氧阴离子自由基(O 2#-)是生物体中第一个生成的氧自由基,它既能与体内的活性物质直接作用,又能经过一系列反应转化生成H 2O 2、羟自由基(#OH )、单线态氧(1O 2)等其它的氧自由基,具有更大的危害性,可引起各类疾病[1]。
因此,生物体系中超氧阴离子自由基的检测,对于研究自由基的生物学作用及其清除机理具有重要意义。
目前超氧阴离子自由基的检测方法有电子自旋共振法、荧光法、光度法、电化学法和化学发光法等[2~7]。
一定强度的UVC辐射对玉米幼苗活性氧成分及抗氧化系统的影响

一定强度的UVC辐射对玉米幼苗活性氧成分及抗氧化系统的影响卜婷;刘灵霞;杨建霞;鲜盼盼【摘要】Through a certain intensity UVC irradiation,we detected the change of some reactive oxygen species and antioxidant enzyme activity in corn leaves,then explored the possible mechanism for the corn seeding response to UVC irradiation. Corn seeding was continuously exposed to UVC for 5 days (5hrs/d),O2- generation rate,H2 O2 content,SOD activity,CAT activity and POD activity were measured as follows:when the corn seeding was irradiated by UVC alone,O2- generation rate promoted significantly(P﹤0. 01),SOD activity,H2O2 content and POD activity all reduced significantly(P﹤0 . 01 ),CAT activity had no obvious change;when the corn seeding was exposed to daylight and UVC simultaneously,O2- generation rate kept promoting(P ﹤0. 01),SOD activity kept reducing(P ﹤0.01),H2O2content and POD activity suggested promotion(P﹤0. 01),CAT activity reduced signifi-cantly( P﹤0 . 01 ). The results indicated that the damage in corn seedlings caused by UVC irradiation mainly comes fromO2-,mixed light can aggravate the damage. The mixed light can inducedH2 O2 con-tent promotion which would be removed by CAT. The mixed light radiation is not an effective measure to reduce the negative effect in corn seeding caused by UVC.%通过一定强度UVC照射,对玉米幼苗叶片内几种活性氧成分及几种抗氧化酶的活性变化进行检测,以探究玉米幼苗对UVC照射进行应答的可能机理。
抗氧化酶SODPODCAT活性测定方法

抗氧化酶(SOD、POD、CAT)活性测定方法一、超氧化物歧化酶(SOD)活性测定(氮蓝四唑光化还原法)1、试剂的配制(1)0.05mol/L磷酸缓冲液(PBS,pH7.8):A母液:0.2mol/L磷酸氢二钠溶液: 取Na2HPO4·12H2O(分子量358.14)71.7g;B母液:0.2mol/L磷酸二氢钠溶液:取NaH2PO4·2H2O(分子量156.01)31.2g。
分别用蒸馏水定容到1000ml。
0.05mol/L PBS(pH7.8)的配制:分别取A母液(Na2HPO4) 228.75ml,B母液(NaH2PO4) 21.25ml,用蒸馏水定容至1000ml。
参考文献:李合生主编:植物生理生化实验原理和技术.高等教育出版社,2000:267~268。
(2)14.5mM甲硫氨酸溶液:取2.1637g Met用磷酸缓冲液(pH7.8)定容至1000ml。
(3)30μM EDTA-Na2溶液:取0.001gEDTA-Na2用磷酸缓冲液定容至100ml。
(4)60μM核黄素溶液:取0.0023g核黄素用磷酸缓冲液定容至100ml,避光保存。
(5)2.25mM 氮蓝四唑(NBT)溶液:取0.1840g NBT用PBS定容至100ml,避光保存。
酶液制备:取0.2g(可视情况调整)样品(新鲜叶片或根系)洗净后置于预冷的研钵中,加入1.6ml 50mmol/L预冷的磷酸缓冲液(pH7.8)在冰浴上研磨成匀浆,转入离心管中在4℃、12000g下离心20min,上清液即为酶液。
2、酶活性测定(1)反应混合液配制(以60个样为准):分别取Met溶液162ml,EDTA-Na2溶液0.6ml,磷酸缓冲液5.4ml,NBT溶液6ml,核黄素溶液6ml,混合后摇匀;(2)分别取3ml反应混合液和30μl酶液于试管中(3)将试管置于光照培养箱中在4000 lux光照下反应20min;同时做两支对照管,其中1支试管取3ml反应混合液加入30μl PBS(不加酶液)照光后测定作为最大光还原管,另1支只加缓冲液置于暗中测定时用于调零。
超氧阴离子含量测定
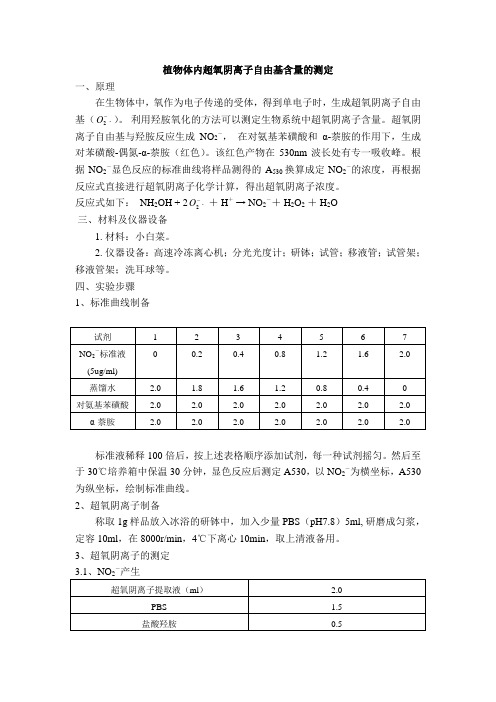
植物体内超氧阴离子自由基含量的测定一、原理在生物体中,氧作为电子传递的受体,得到单电子时,生成超氧阴离子自由基(⋅-2O )。
利用羟胺氧化的方法可以测定生物系统中超氧阴离子含量。
超氧阴离子自由基与羟胺反应生成NO 2-, 在对氨基苯磺酸和α-萘胺的作用下,生成对苯磺酸-偶氮-α-萘胺(红色)。
该红色产物在530nm 波长处有专一吸收峰。
根据NO 2-显色反应的标准曲线将样品测得的A 530换算成定NO 2-的浓度,再根据反应式直接进行超氧阴离子化学计算,得出超氧阴离子浓度。
反应式如下: NH 2OH + 2⋅-2O + H + → NO 2-+ H 2O 2 + H 2O 三、材料及仪器设备1. 材料:小白菜。
2. 仪器设备:高速冷冻离心机;分光光度计;研钵;试管;移液管;试管架;移液管架;洗耳球等。
四、实验步骤 1、标准曲线制备标准液稀释100倍后,按上述表格顺序添加试剂,每一种试剂摇匀。
然后至于30℃培养箱中保温30分钟,显色反应后测定A530,以 NO 2-为横坐标,A530为纵坐标,绘制标准曲线。
2、超氧阴离子制备称取1g 样品放入冰浴的研钵中,加入少量PBS (pH7.8)5ml, 研磨成匀浆,定容10ml ,在8000r/min ,4℃下离心10min ,取上清液备用。
3、超氧阴离子的测定 -25℃保温20min-上述反应液(ml) 2.0对氨基苯磺酸(ml) 2.0α-萘胺(ml) 2.030℃恒温箱中保温30min4、含量计算从标准曲线中计算出测定液对应NO2-的浓度,并换算成超氧阴离子的浓度(X),再算出超氧阴离子的含量。
超氧阴离子的含量(μg-1FW)=2X·V t·n/g·FW·V sV t为样品提取液总体积;n为稀释倍数;V s为显色时取样品体积;X为从标准曲线上计算出的浓度。
五、实验结果5.1 标准曲线y = 19.025xR2 = 0.973145.2 样品测定样品A530=0.046NO2-的浓度=0.046/19.025=0.0024ug/ml超氧阴离子的含量(μg·g-1FW)=2X·V t·n/g·FW·V s=2*0.0024*10*6/(1*2)=0.144 六、注意事项如果样品中含有大量叶绿素将干扰测定,可在样品液与羟胺温浴后,加入等体积乙醚提取叶绿素。
植物组织超氧阴离子自由基含量测定
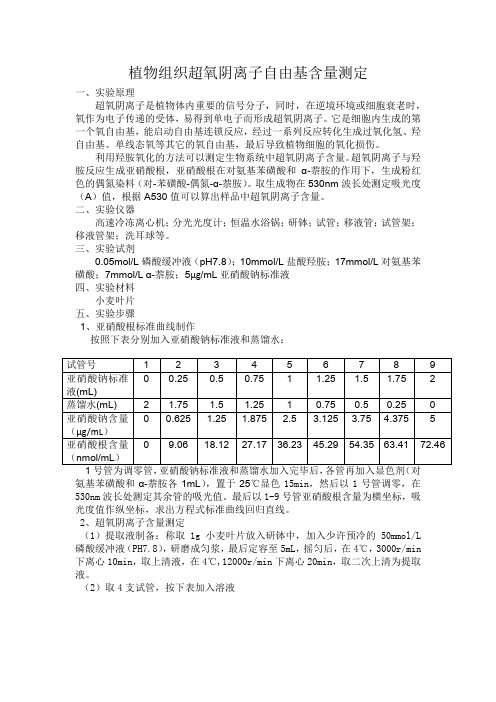
植物组织超氧阴离子自由基含量测定一、实验原理超氧阴离子是植物体内重要的信号分子,同时,在逆境环境或细胞衰老时,氧作为电子传递的受体,易得到单电子而形成超氧阴离子。
它是细胞内生成的第一个氧自由基,能启动自由基连锁反应,经过一系列反应转化生成过氧化氢、羟自由基、单线态氧等其它的氧自由基,最后导致植物细胞的氧化损伤。
利用羟胺氧化的方法可以测定生物系统中超氧阴离子含量。
超氧阴离子与羟胺反应生成亚硝酸根,亚硝酸根在对氨基苯磺酸和α-萘胺的作用下,生成粉红色的偶氮染料(对-苯磺酸-偶氮-α-萘胺)。
取生成物在530nm波长处测定吸光度(A)值,根据A530值可以算出样品中超氧阴离子含量。
二、实验仪器高速冷冻离心机;分光光度计;恒温水浴锅;研钵;试管;移液管;试管架;移液管架;洗耳球等。
三、实验试剂0.05mol/L磷酸缓冲液(pH7.8);10mmol/L盐酸羟胺;17mmol/L对氨基苯磺酸;7mmol/L α-萘胺;5µg/mL亚硝酸钠标准液四、实验材料小麦叶片五、实验步骤1、亚硝酸根标准曲线制作按照下表分别加入亚硝酸钠标准液和蒸馏水:氨基苯磺酸和α-萘胺各1mL),置于25℃显色15min,然后以1号管调零,在530nm波长处测定其余管的吸光值。
最后以1-9号管亚硝酸根含量为横坐标,吸光度值作纵坐标,求出方程式标准曲线回归直线。
2、超氧阴离子含量测定(1)提取液制备:称取1g小麦叶片放入研钵中,加入少许预冷的50mmol/L 磷酸缓冲液(PH7.8),研磨成匀浆,最后定容至5mL,摇匀后,在4℃,3000r/min 下离心10min,取上清液,在4℃,12000r/min下离心20min,取二次上清为提取液。
(2)取4支试管,按下表加入溶液各1mL混匀,置于25℃下显色15min,最后以1号管调零,在530nm波长处测定其余管吸光值。
六、实验结果及计算求平均值得A530为0.073。
通过标准曲线回归方程求得亚硝酸根含量为2.36nmol/mL ,反应体系中提取液为1mL,故反应体系中中亚硝酸根含量为2.36nmol。
抗氧化酶活性等测定方法

叶绿体的提取一、试剂配置1、PBS提取液:每L水依次加入MES(195.2×0.05=9.76g)、山梨糖醇(0.33×182.2=60.126g)、NaCl (0.010×58.5=0.585g)、MgCl(0.002×95=0.19g)、EDTA(292.25×0.002=0.5845g)、KH2PO4(200×0.0005=0.1g);使用时加入ASA-Na(198.1×0.002=0.3962g);2、悬浮液:将PBS提取液中的MES换为238.3×0.05=11.915g的HEPES(238.3×0.05=11.915g);3、80%Percol:80ml原液+20ml水;40%Percol:40ml原液+60ml水;实际配制:PBS提取液2000ml(3个处理*2个品种*3个重复*20ml*3次=1080ml),悬浮液100ml(3个处理*2个品种*3个重复*1ml*3次=54ml);80%Percol 200ml; 40%Percol 200ml.(3个处理*2个品种*3个重复*3ml*3次=162ml)二、提取步骤1、10g鲜样加20ml提取PBS(50mM MES PH6.1,含0.33M山梨糖醇,10mM NaCl,2mM MgCl2,2mM EDTA,0.5 mMKH2PO4,2mM ASA-Na,ASA-Na使用前现配现加)2、快速研磨,使叶片碎成绿豆粒大小,4层纱布过滤,去除残渣(注意过滤时不可用力挤压,以免叶绿体膜破碎)3、滤液2000g 3min,小心倒出上清液,将离心管放入离心机后,使离心机的加速很快上升到预定值(水平转头,加速度调到9),约经30s后很快使其下降停止,整个离心持续大约2-3min左右完成;4、沉淀用1ml提取液漂洗表面悬浮物;5、用1ml悬浮液(50mM HEPES pH 7.6,含0.33 mM山梨糖醇,10mM NaCl,2mM MgCl2,2mM EDTA,0.5 mMKH2PO4,2mM ASA-Na,ASA-Na使用前现配现加)将沉淀悬浮,在分散叶绿体时宜用毛笔轻轻刷,或者用手握住离心管在冰块之间搅动,使叶绿体由于震动分散开来,不要用棉球吸滤,以防被膜压破。
抗氧化酶活性等测定方法

叶绿体的提取一、试剂配置1、PBS提取液:每L水依次加入MES(195.2×0.05=9.76g)、山梨糖醇(0.33×182.2=60.126g)、NaCl (0.010×58.5=0.585g)、MgCl(0.002×95=0.19g)、EDTA(292.25×0.002=0.5845g)、KH2PO4(200×0.0005=0.1g);使用时加入ASA-Na(198.1×0.002=0.3962g);2、悬浮液:将PBS提取液中的MES换为238.3×0.05=11.915g的HEPES(238.3×0.05=11.915g);3、80%Percol:80ml原液+20ml水;40%Percol:40ml原液+60ml水;实际配制:PBS提取液2000ml(3个处理*2个品种*3个重复*20ml*3次=1080ml),悬浮液100ml(3个处理*2个品种*3个重复*1ml*3次=54ml);80%Percol 200ml; 40%Percol 200ml.(3个处理*2个品种*3个重复*3ml*3次=162ml)二、提取步骤1、10g鲜样加20ml提取PBS(50mM MES PH6.1,含0.33M山梨糖醇,10mM NaCl,2mM MgCl2,2mM EDTA,0.5 mMKH2PO4,2mM ASA-Na,ASA-Na使用前现配现加)2、快速研磨,使叶片碎成绿豆粒大小,4层纱布过滤,去除残渣(注意过滤时不可用力挤压,以免叶绿体膜破碎)3、滤液2000g 3min,小心倒出上清液,将离心管放入离心机后,使离心机的加速很快上升到预定值(水平转头,加速度调到9),约经30s后很快使其下降停止,整个离心持续大约2-3min左右完成;4、沉淀用1ml提取液漂洗表面悬浮物;5、用1ml悬浮液(50mM HEPES pH 7.6,含0.33 mM山梨糖醇,10mM NaCl,2mM MgCl2,2mM EDTA,0.5 mMKH2PO4,2mM ASA-Na,ASA-Na使用前现配现加)将沉淀悬浮,在分散叶绿体时宜用毛笔轻轻刷,或者用手握住离心管在冰块之间搅动,使叶绿体由于震动分散开来,不要用棉球吸滤,以防被膜压破。
抗氧化酶活性等测定方法

叶绿体的提取一、试剂配置1、PBS提取液:每L水依次加入MES(195.2×0.05=9.76g)、山梨糖醇(0.33×182.2=60.126g)、NaCl(0.010×58.5=0.585g)、MgCl(0.002×95=0.19g)、EDTA(292.25×0.002=0.5845g)、KH2PO4(200×0.0005=0.1g);使用时加入ASA-Na(198.1×0.002=0.3962g);2、悬浮液:将PBS提取液中的MES换为238.3×0.05=11.915g的HEPES(238.3×0.05=11.915g);3、80%Percol:80ml原液+20ml水;40%Percol:40ml原液+60ml水;实际配制:PBS提取液2000ml(3个处理*2个品种*3个重复*20ml*3次=1080ml),悬浮液100ml(3个处理*2个品种*3个重复*1ml*3次=54ml);80%Percol 200ml; 40%Percol 200ml.(3个处理*2个品种*3个重复*3ml*3次=162ml)二、提取步骤1、10g鲜样加20ml提取PBS(50mM MES PH6.1,含0.33M山梨糖醇,10mM NaCl,2mM MgCl2,2mM EDTA,0.5 mMKH2PO4,2mM ASA-Na,ASA-Na使用前现配现加)2、快速研磨,使叶片碎成绿豆粒大小,4层纱布过滤,去除残渣(注意过滤时不可用力挤压,以免叶绿体膜破碎)3、滤液2000g 3min,小心倒出上清液,将离心管放入离心机后,使离心机的加速很快上升到预定值(水平转头,加速度调到9),约经30s后很快使其下降停止,整个离心持续大约2-3min左右完成;4、沉淀用1ml提取液漂洗表面悬浮物;5、用1ml悬浮液(50mM HEPES pH 7.6,含0.33 mM山梨糖醇,10mM NaCl,2mM MgCl2,2mM EDTA,0.5 mMKH2PO4,2mM ASA-Na,ASA-Na使用前现配现加)将沉淀悬浮,在分散叶绿体时宜用毛笔轻轻刷,或者用手握住离心管在冰块之间搅动,使叶绿体由于震动分散开来,不要用棉球吸滤,以防被膜压破。
211060483_不同预冷温度对甜樱桃果实保鲜效果的影响

包装工程第44卷第7期·104·PACKAGING ENGINEERING2023年4月不同预冷温度对甜樱桃果实保鲜效果的影响彭丽,高姗,熊思国,蒋旭,姜爱丽,陈晨(1.大连民族大学 a.生命科学学院 b.生物技术与资源利用教育部重点实验室,辽宁大连116600;2.SGS–CSTC通标标准技术服务有限公司(大连),辽宁大连116600)摘要:目的探究不同预冷温度对采后甜樱桃果实生理品质的影响,找出最适宜的预冷温度,进而推动甜樱桃产业化发展。
方法本实验分别将采后甜樱桃分别预冷至15、12、9、6、3、0 ℃后回温至室温,以不进行预冷处理为对照组,比较6种处理方式果实预冷和回温过程中的温度变化,并分别测定回温前后果实的色差、呼吸强度及乙烯释放量、硬度、可溶性固形物(TSS)、风味、感官评价,总酚、类黄酮、花色苷、维生素C(Vc)、可溶性蛋白、丙二醛(MDA)含量以及超氧阴离子产生速率(O2−)。
结果不同预冷温度均可较好地保持果实外观及风味,能够降低甜樱桃果实呼吸强度与乙烯释放量,抑制果实TSS、MDA含量和O2−产生速率的上升,延缓甜樱桃果实硬度的下降,从而保持甜樱桃果实的外观品质,且有利于维持甜樱桃果实中的Vc、可溶性蛋白和花色苷含量,以0 ℃预冷效果最佳,感官评分最高。
结论预冷能够有效维持甜樱桃果实采后的品质,达到增加甜樱桃果实经济价值的作用。
关键词:甜樱桃;预冷温度;营养物质;抗氧化能力中图分类号:TB485.2 文献标识码:A 文章编号:1001-3563(2023)07-0104-11DOI:10.19554/ki.1001-3563.2023.07.012Effects of Different Precooling Temperature on the Preservation of Sweet Cherry PENG Li, GAO Shan, XIONG Si-guo, JIANG Xu, JIANG Ai-li, CHEN Chen(1. a. College of Life Science b. Key Laboratory of Biotechnology and Resource Utilization of the Ministry ofEducation, Dalian Minzu University, Liaoning Dalian 116600, China; 2. SGS-CSTC General StandardTechnical Service Co., LTD., (Dalian), Liaoning Dalian 116600, China)ABSTRACT: The work aims to study the effect of different precooling temperature on the physiological quality of post-harvest sweet cherry and find out the most appropriate precooling temperature, so as to promote the industrial develop-ment of sweet cherry. In this experiment, the postharvest sweet cherries were precooled to 15, 12, 9, 6, 3 and 0 ℃ and then rewarmed to room temperature. With the sweet cherries not precooled as the control group, the temperature changes of sweet cherries treated by six methods during the process of precooling and rewarming were compared. The color differ-ence, respiratory intensity, ethylene release, hardness, soluble solids (TSS), flavor, sensory evaluation, contents of total phenols, flavonoids, anthocyanins, vitamin C (Vc), soluble protein, Malondialdehyde (MDA) and superoxide anion pro-duction rate (O2−) of the cherries were measured before and after rewarming. Different precooling temperature could bet-ter maintain the appearance and flavor of cherry, reduce the respiratory intensity and ethylene release, inhibit the increase of TSS, MDA content and O2− production rate and delay the decrease of hardness, so as to maintain the appearance quality of sweet cherry and make for keeping the content of Vc, soluble protein and anthocyanin in sweet cherry. When the pre-收稿日期:2022–09–29基金项目:大连市科技创新基金(2020JJ27SN109);大连民族大学2022年研究生创新立项项目(0103–202201)作者简介:彭丽(1998—),女,硕士生,主攻采后生物学与技术。
超氧阴离子产生速率

超氧阴离子产生速率
超氧阴离子产生速率是指在化学反应或生物过程中产生超氧阴离子的速率。
超氧阴离子是一种高度活性的自由基,可以与许多生物分子反应,导致细胞损伤和疾病。
因此,超氧阴离子产生速率的研究对于生物医学和环境科学非常重要。
超氧阴离子产生的主要途径包括光合作用、线粒体呼吸链、酸化过程、免疫系统等。
超氧阴离子的产生速率受到多种因素的影响,如温度、pH值、氧气浓度、金属离子等。
此外,许多天然产物和化合物也可以影响超氧阴离子的产生速率,如抗氧化剂、靶向药物等。
目前,研究人员正在开展大量的研究,探索超氧阴离子产生速率的影响因素和调控机制。
通过深入研究超氧阴离子产生速率,我们可以更好地理解生物体内的氧化应激反应,并为疾病的治疗和预防提供更有效的策略。
- 1 -。
超氧阴离子产生速率测定

超氧阴离子产生速率测定羟氨氧化法(王爱国,罗广华.植物的超氧物自由基与羟胺的反应[J].植物生理学通讯,1990,(6):55-57)一、原理植物组织器官的衰老总是伴着细胞内膜结构的破坏,表现为细胞内的电解质大量渗漏出来。
很多研究结果表明,细胞衰老过程中膜的破坏是由细胞中(特别是线粒体和叶绿体)产生的自由基(如O2·ˉ、OH·、O2等)使膜脂中的不饱和脂肪酸发生过氧化作用而造成的。
膜脂过氧化作用中产生的自由基,它不仅能连续诱发膜脂过氧化作用,而且还可以使蛋白质脱H+而产生蛋白质自由基,使蛋白质分子发生链式聚合,从而使细胞膜变性,最终导致细胞损伤、衰老和死亡。
二、材料、仪器设备与试剂(一) 材料植物叶片、花瓣等器官(二) 仪器设备低温高速离心机、微量加样器(1mL、20uL) 、精密电子天平、分光光度计、试管、研钵、剪刀、镊子、烧杯、试管架(三) 试剂(1) 0.05 mol ·L-1磷酸缓冲液PH=7.8(0.66304g 的NaH2PO4.2H2O 和16.3849g 的Na2HPO4.12H2O 定溶1000mL ,校正PH)(2) 10m mol L·-1盐酸羟胺(NH2OH·HCl,69.49,溶于水)0.3475g定溶到500mL ,(冷)(3) 17m mol L·-1对氨基苯磺酸(C 6H 7NO 3S 173.19 1.4721g) 或者(C6H7NO3S·H2O191.21 1.6253g)定溶到500mL ,(冷,磁)-1(4) 7m mol L·-1α-萘胺,0.5012g 定溶到500mL ,(乙醇溶解,定溶,溶解完全)三、试验步骤(1) 制做亚硝酸根标准曲线2mL 系列浓度的NaNO 2(5,4,3,2,1,0.5 μg/L) 加入4mL 对氨基苯磺酸和4mLa -萘胺于25℃保温20min ,然后测定OD530以[NO2-]和测得的OD530 值互为函数作图,制的亚硝酸根标准曲线(2) 取0.2g 植物材料,加入 1.0mL 0.05 mol L-·1磷酸缓冲液(PH7.8)于冰浴研磨(3) 研磨物以12000r/min 离心15min ,取上清液0.5mL 加入0.5mL 磷酸缓冲液和1mL 10mmol·L-1盐酸羟胺,25℃静置1h(4) 加入1mL17m mol ·L -1对氨基苯磺酸和1mL7m mo·l L -1α-萘胺,25℃静置20min ,测其530 处OD 值四、计算根据测得的OD 值,查标准曲线将花瓣中氧自由基含量的OD 值转换成[NO 2-],依据羟胺与O2-的反应式:--+NH2OH+2O 2-+H +→ NO2-+H 2O2+H 2O 从[NO2-]对[O2-]进行化学计算,将[NO 2-]乘以 2 得到[O 2-]。
植物组织超氧阴离子自由基含量测定

植物组织超氧阴离子自由基含量测定一、实验原理超氧阴离子是植物体内重要的信号分子,同时,在逆境环境或细胞衰老时,氧作为电子传递的受体,易得到单电子而形成超氧阴离子。
它是细胞内生成的第一个氧自由基,能启动自由基连锁反应,经过一系列反应转化生成过氧化氢、羟自由基、单线态氧等其它的氧自由基,最后导致植物细胞的氧化损伤。
利用羟胺氧化的方法可以测定生物系统中超氧阴离子含量。
超氧阴离子与羟胺反应生成亚硝酸根,亚硝酸根在对氨基苯磺酸和α-萘胺的作用下,生成粉红色的偶氮染料(对-苯磺酸-偶氮-α-萘胺)。
取生成物在530nm波长处测定吸光度(A)值,根据A530值可以算出样品中超氧阴离子含量。
二、实验仪器高速冷冻离心机;分光光度计;恒温水浴锅;研钵;试管;移液管;试管架;移液管架;洗耳球等。
三、实验试剂0.05mol/L磷酸缓冲液(pH7.8);10mmol/L盐酸羟胺;17mmol/L对氨基苯磺酸;7mmol/L α-萘胺;5µg/mL亚硝酸钠标准液四、实验材料小麦叶片五、实验步骤1、亚硝酸根标准曲线制作按照下表分别加入亚硝酸钠标准液和蒸馏水:氨基苯磺酸和α-萘胺各1mL),置于25℃显色15min,然后以1号管调零,在530nm波长处测定其余管的吸光值。
最后以1-9号管亚硝酸根含量为横坐标,吸光度值作纵坐标,求出方程式标准曲线回归直线。
2、超氧阴离子含量测定(1)提取液制备:称取1g小麦叶片放入研钵中,加入少许预冷的50mmol/L 磷酸缓冲液(PH7.8),研磨成匀浆,最后定容至5mL,摇匀后,在4℃,3000r/min 下离心10min,取上清液,在4℃,12000r/min下离心20min,取二次上清为提取液。
(2)取4支试管,按下表加入溶液各1mL混匀,置于25℃下显色15min,最后以1号管调零,在530nm波长处测定其余管吸光值。
六、实验结果及计算求平均值得A530为0.073。
通过标准曲线回归方程求得亚硝酸根含量为2.36nmol/mL ,反应体系中提取液为1mL,故反应体系中中亚硝酸根含量为2.36nmol。
抗氧化酶活性等测定方法

一、试剂配置 1、PBS 提取液:每 L 水依次加入 MES(195、2x0. 05=9、76g)、山梨糖醇(0、33x182. 2=60、126g). NaCl(0、010x58、5=0. 585g)、MgCI(0、002x95=0、19g)、EDTA(292. 25x0. 002=0. 5845g). KH2PO4(200x0. 0005=0. Ig);使用时加入 ASA-Na(!98. 1x0. 002=0. 3962g);2、悬浮液:将 PBS 提取液中得 MES 换为 238、3x0、05=11、915g 得 HEPES(238、3x0、05=1 k 915g);3、80%PercoI;80ml 原液+20ml 水:40%Percol:40ml 原液+60ml 水;实际配制:PBS 提取液20001111(3个处理*2个品种*3个靈复*20m!*3次=1080ml ).悬浮液1001111(3个处理*2个品种*3个重复次=54n 】l );80%Percol 200ml; 40%Percol 200nik (3 个处理*2 个品种*3 个重复*3ml*3 次=162ml)二、提取步骤 1、lOg 鮮样加 20ml 提取 PBS(50mM MES PH6、1,含O 、33M 山梨糖醇JOmM NaCL2mM MgCkfmM EDTA.O 、5 mMKH2POj ・2mM ASA ・Na ・ASA ・Na 使用前现配现加) 2、快速研曆,使叶片碎成绿豆粒大小4层纱布过滤,去除残渣(注意过滤时不可用力挤压,以免叶绿体膜破碎) 3、滤液2000g 3min •小心倒出上淸液,将离心管放入离心机后,使离心机得加速很快上升到预崔值(水平转头.加速度调到9),约经30s 后很快使加下降停止,整个离心持续大约2・3min 左右完成;4、沉淀用1ml 提取液漂洗表面悬浮物;5、用 1ml 悬浮液(50mMHEPES pH7. 6•含0. 33 mM 山梨糖醇」0NaCl ・2mM MgCb2mM EDTA.O 、5 niMKH2PO4-2mM ASA-Na.ASA-Na 使用前现配现加)将沉淀悬浮,在分散叶绿体时宜用毛笔轻轻刷,或者用手 握住离心管在冰块之间搅动,便叶绿体由于震动分散开来,不要用棉球吸滤,以防被膜压破。
抗氧化酶SOD、POD、CAT活性测定方法

抗氧化酶(SOD、POD、CAT)活性测定方法一、超氧化物歧化酶(SOD)活性测定(氮蓝四唑光化复原法)1、试剂的配制1)0.05mol/L磷酸缓冲液(PBS,pH7.8):母液:0.2mol/L磷酸氢二钠溶液:取Na2HPO4·12H2O(分子量358.14)71.7g;母液:0.2mol/L磷酸二氢钠溶液:取NaH2PO4·2H2O(分子量156.01)31.2g。
分别用蒸馏水定容到1000ml。
0.05mol/LPBS(pH7.8)的配制:分别取A母液(Na2HPO4)228.75ml,B母液(NaH2PO4)21.25ml,用蒸馏水定容至1000ml。
参照文件:李合生主编:植物生理生化实验原理和技术.高等教育第一版社,2000:267~268。
2)14.5mM甲硫氨酸溶液:取2.1637gMet用磷酸缓冲液(pH7.8)定容至1000ml。
(3)30μMEDTA-Na2溶液:取0.001gEDTA-Na2用磷酸缓冲液定容至100ml。
(4)60μM核黄素溶液:取0.0023g核黄素用磷酸缓冲液定容至100ml,避光保留。
5)2.25mM氮蓝四唑(NBT)溶液:取0.1840gNBT用PBS定容至100ml,避光保留。
酶液制备:取0.2g(可视状况调整)样品(新鲜叶片或根系)洗净后置于预冷的研钵中,加入1.6ml50mmol/L 预冷的磷酸缓冲液(pH7.8)在冰浴上研磨成匀浆,转入离心管中在4℃、12000g下离心20min,上清液即为酶液。
2、酶活性测定1)反响混淆液配制(以60个样为准):分别取Met溶液162ml,EDTA-Na2溶液0.6ml,磷酸缓冲液5.4ml,NBT溶液6ml,核黄素溶液6ml,混淆后摇匀;(2)分别取3ml反响混淆液和30μl酶液于试管中光照下反响(3)将试管置于光照培育箱中在4000lux20min;同时做两支比较管,此中后测定作为最大光复原管,1支试管取3ml反响混淆液加入30μlPBS(不加酶液)照光另1支只加缓冲液置于暗中测准时用于调零。
植物体超氧阴离子自由基不同检测方法的比较

理条件下水溶液中寿命极其短暂的 O2 的定性和定量问题
·-
[9 ]
. EPR 自旋捕捉技术要求的实验条件比较
[10 ]
严格, 而且需要 EPR 这样昂贵的实验仪器, 一般研究者很难具备, 限制了其推广和普及. 王爱国等 研 ·- - - O2 与羟胺反应生成 NO2 , NO2 在对究报道, 氨基苯磺酸和 α萘胺作用下生成粉红色的偶氮染料, 该
活性氧自由基( ROS ) ,顺磁共振波谱仪 ( EPR ) ,羟胺氧化法,二氢乙锭 ( DHE ) 荧光探针,原位
ROS 主要产 协同作用, 形成一个复杂的反应网络. 在叶片等含有叶绿素的组织和细胞中 , 在光照条件下, ROS 生于叶绿体和过氧化物酶体, 而在根部等不含叶绿素的组织和细胞中以及黑暗条件下的绿色组织 , 主要来源于线粒体
响应水平. 关键词 显色.
·- 植物体内的活性氧 ( reactive oxygen species,ROS ) 通常存在超氧阴离子自由基 ( O2 ) 、 过氧化氢 1 ( H2 O2 ) 、 羟基自由基 ( OH· ) 、 单线态氧 ( O2 ) 、 氢过氧基 ( HOO· ) 、 脂质自由基 ( R· ) 、 脂氧自由基 ·- ( RO·) 和脂质过氧自由基( ROO·) 等类型. 其中, O2 、 H2 O2 、 OH· 和1 O2 等活性氧可以相互转化, 通过
·- 1 [ NO2- ] , · min -· mg - 1 Pr 表示. 再计算出 O2 的含量, 结果以 nmol
1. 5
应用特异 水稻根尖组织 O2 的荧光检测参照 Yamamoto 等方法 进行, 略加改进. 剪取染毒后的水稻根尖
( 1 cm) , · L - 1 DHE ( 10 mmol·L - 1 TrisHCl,pH 7. 5 配制 ) , 37 ℃ 避光染色 30 min. 用 立即浸入 5 μmol -1 10 mmol · L TrisHCl( pH 7. 5) 避光洗涤 15 min × 2 次, 切取 0. 5 cm 根尖, 排列于载玻片上, 在荧光显微镜 · L - 1 CdCl2 处理组的 下(490 nm 激发光和 520 nm 发射光) 拍摄图片. 为检测该探针的特异性, 取 100 μmol · L - 1 SOD 酶溶液中于室温下孵育 30 min, 根尖, 置于 35 mg 清洗后转移至 DHE 染液, 后续步骤同上. ·- 1. 6 应用 NBT 原位显色法捕获叶片组织 O2 Puertas 等方法 叶片组织 O2 的原位显色分析参照 Romero即浸入 O
花壳辣椒病菌侵染对色素及活性氧水平的影响

花壳辣椒病菌侵染对色素及活性氧水平的影响郑文宇;丁筑红;刘海;邓程;肖治柔【摘要】为探讨花壳辣椒病菌对采后辣椒色素及组织活性氧水平的影响,采用新鲜红辣椒(Capsicum annuum L.)接种“花壳”病菌株,跟踪辣椒色素变化并动态分析辣椒组织活性氧超氧阴离子(O2-)的产生速率、过氧化氢(H2 O2)、羟自由基(·OH)含量的变化.结果表明:花壳辣椒病菌组辣椒色泽发生明显褪变,辣椒O2-的产生速率和羟自由基的含量变化总体呈先下降后显著上升的趋势,出现单个低峰值;H2O2的含量变化总体呈先下降后上升,到达峰值后又有下降的趋势,其中,F101(lrpex lacteus)和F121(Cladosporium cladosporioides)病菌对辣椒组织活性氧的影响较其他病菌显著(P<0.05).而对照组辣椒色素未发生褪变,活性氧水平总体变化微小,非花壳辣椒病菌组辣椒色素褪变以及组织活性氧水平变化程度低于花壳辣椒病菌组.该病菌侵染导致辣椒色素褪变,同时辣椒组织活性氧水平发生明显变化,不同花壳辣椒病菌对活性氧水平的影响存在差异.%In order to explore the effect of pathogens causing discoloration in red pepper postharvest on capsicum pigment and the level of reactive oxygen species,the change of pigment in red pepper was kept track of and the production rate of superoxide anion radical(O2-),the content of hydrogen peroxide(H2O2) and hydroxyl radical(· OH) were determined using dynamic analysis via the experiment that the red pepper was infected by pathogens causing discoloration.The results showed that the surfaces of the red pepper inoculated by all the pathogens causing discoloration faded to obvious yellow.The amount ofO2-and · OH totally decreased and then increased and it had a single low peak in the red pepper fruits,at the same time the amount of H2O2decreased first and then increased and when it arrived at the peak,it had a tendency to go down.Among those,F101 (cteus) and F121(C.cladosporioides)had a stronger influence significantly on defensive enzyme system of red pepper fruits compared with others(P < 0.05).While pepper pigment in the control group did not fade and there were small changes in the level of reactive oxygen species,and chili pigment fading and the change of ROS levels by non-stain-causing-discoloration group was lower than that caused by stains causing group.The pathogens causing discoloration caused the fading of the red pepper,at the same time,the levels of ROS change significantly.And there were differences for changing of ROS levels by different pathogens causing discoloration.【期刊名称】《西南农业学报》【年(卷),期】2013(026)003【总页数】6页(P1044-1049)【关键词】花壳辣椒;病菌侵染;辣椒色素;活性氧【作者】郑文宇;丁筑红;刘海;邓程;肖治柔【作者单位】贵州大学生命科学学院贵州省农畜产品贮藏与加工重点实验室,贵州贵阳550025;贵州大学生命科学学院贵州省农畜产品贮藏与加工重点实验室,贵州贵阳550025;贵州大学生命科学学院贵州省农畜产品贮藏与加工重点实验室,贵州贵阳550025;贵州大学生命科学学院贵州省农畜产品贮藏与加工重点实验室,贵州贵阳550025;贵州大学生命科学学院贵州省农畜产品贮藏与加工重点实验室,贵州贵阳550025【正文语种】中文【中图分类】S641.3辣椒(Capsicum annuum L.)作为茄科传统蔬菜作物,年产量和总产值巨大,居全国各类蔬菜首位。
采后涂膜处理对山竹果壳细胞代谢物和果肉品质的影响

采后涂膜处理对山竹果壳细胞代谢物和果肉品质的影响于立梅;刘朝霞;吴杰【摘要】以山竹果为材料,研究了采后涂膜处理常温贮藏(1%壳聚糖和1%海藻酸钠)对山竹果壳细胞代谢物及果肉品质的影响.结果表明:采后涂膜处理常温贮藏中山竹果壳中超氧阴离子、膜脂过氧化产物丙二醛(M DA)、过氧化氢的含量随着贮藏时间呈上升趋势,贮藏15d时,常温、1%壳聚糖、1%海藻酸钠涂膜处理的丙二醛含量比初期分别增加了94.4%、67.0%和38.9%.果壳代谢物可溶性糖和总酚含量均先上升后下降,2种涂膜处理均能有效延缓果壳细胞代谢物的增加.其中1%壳聚糖涂膜处理能够显著延缓果肉Vc和总糖含量的下降,减慢营养物质的消耗,抑制果实的腐烂.%The effect of different postharvest treatments on mangosteenfruit at room temperature (1 % sodium alg-inate and 1 % chitosan coating) on cell metabolites and lignification substrate of mangosteen shell was studied.The results show that superoxide anion, malondialdehyde ( MDA ) and hydrogen peroxide content of mangosteen shell increased during storage.At the 15 days of storage, malondialdehyde content increased by 94.4% , 67.0% and 38.9% after the treatment of 1 % sodium alginate and 1 % chitosan coating treatment.Soluble sugar and total phenolic content were first increased and then dropped.The coating treatment can significantly reduce the cell metabolites of mangosteen shell.It also reduced Vc andtotal sugar content, slow down nutrient consumption and inhibit the decay of fruit.【期刊名称】《食品与发酵工业》【年(卷),期】2013(039)002【总页数】5页(P213-217)【关键词】山竹果;采后处理;细胞代谢物;果肉品质【作者】于立梅;刘朝霞;吴杰【作者单位】吉林中粮生化科技有限公司,吉林长春,130118【正文语种】中文山竹(Garcinia mangostana L),又称倒捻子、凤果或莽吉柿,为藤黄科藤黄属的一种间杂交的异源多倍体果树,原产于印度尼西亚和马来西亚,是一种典型的热带水果,主要分布于泰国、越南、马来西亚、印度尼西亚、菲律宾等东南亚国家。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
超氧阴离子产生速率测定
羟氨氧化法
(王爱国,罗广华.植物的超氧物自由基与羟胺的反应[J].植物生理学通讯,1990,(6):55-57) 一、原理
植物组织器官的衰老总是伴着细胞内膜结构的破坏,表现为细胞内的电解质大量渗漏出来。
很多研究结果表明,细胞衰老过程中膜的破坏是由细胞中(特别是线粒体和叶绿体)产生的自由基(如O2·¯、OH·、O2等)使膜脂中的不饱和脂肪酸发生过氧化作用而造成的。
膜脂过氧化作用中产生的自由基,它不仅能连续诱发膜脂过氧化作用,而且还可以使蛋白质脱H+而产生蛋白质自由基,使蛋白质分子发生链式聚合,从而使细胞膜变性,最终导致细胞损伤、衰老和死亡。
二、材料、仪器设备与试剂
(一)材料
植物叶片、花瓣等器官
(二)仪器设备
低温高速离心机、微量加样器(1mL、20uL)、精密电子天平、分光光度计、试管、
研钵、剪刀、镊子、烧杯、试管架
(三)试剂
(1)0.05 mol·L-1磷酸缓冲液PH=7.8(0.66304g的NaH2PO4.2H2O和16.3849g的
Na2HPO4.12H2O定溶1000mL,校正PH)
(2)10m mol·L-1盐酸羟胺(NH2OH·HCl,69.49,溶于水)0.3475g定溶到500mL,(冷)
(3)17m mol·L-1对氨基苯磺酸(C6H7NO3S 173.19 1.4721g) 或者(C6H7NO3S·H2O 191.21 1.6253g)定溶到500mL,(冷,磁)
(4)7m mol·L-1α-萘胺,0.5012g定溶到500mL,(乙醇溶解,定溶,溶解完全)
三、试验步骤
(1)制做亚硝酸根标准曲线
2mL系列浓度的NaNO2(5,4,3,2,1,0.5μg/L)加入4mL对氨基苯磺酸和4mLa-萘胺于25℃保温20min,然后测定OD530以[NO2-]和测得的OD530值互为函数作图,制的亚硝酸根标准曲线
(2)取0.2g植物材料,加入1.0mL 0.05 mol·L-1磷酸缓冲液(PH7.8)于冰浴研磨
(3)研磨物以12000r/min离心15min,取上清液0.5mL加入0.5mL磷酸缓冲液和1mL 10m
mol·L-1盐酸羟胺,25℃静置1h
(4)加入1mL17m mol·L-1对氨基苯磺酸和1mL7m mol·L-1α-萘胺,25℃静置20min,测其
530处OD值
四、计算
根据测得的OD值,查标准曲线将花瓣中氧自由基含量的OD值转换成[NO2-],依据羟胺与O2-的反应式:
NH2OH+2O2-+H+→NO2-+H2O2+H2O
从[NO2-]对[O2-]进行化学计算,将[NO2-]乘以2得到[O2-]。
五、注意:
加样的顺序不能颠倒,25℃是它的反应温度。
