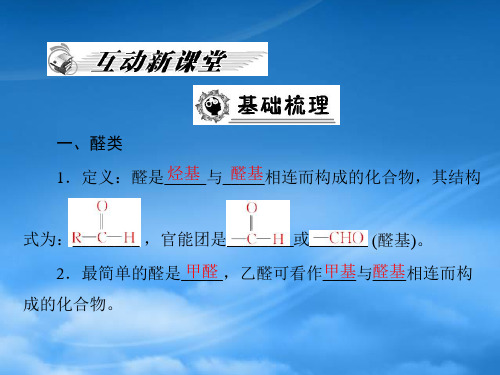
醛课件
合集下载
3-2《醛》课件(人教版化学选修5)

碳原子价 态改变
HC
乙醛的氧化反应: H
HO
CH
极性键
H C CH
O
H
⑴乙醛的氧化反应
①燃烧
在点燃的条件下,乙醛能在空气或氧气中燃
烧。乙醛完全燃烧的化学方程式为: 2CH3CHO+5O2 点燃 4CO2+4H2O
②催化氧化 2CH3CHO+O2 催化剂 2CH3COOH
催化氧 H O
化机理
H C CH
⒉乙醛的分子结构:
分子式: C2H4O
HO
结构式:
HC CH
结构简式: CH3CHO H
官能团: -CHO 不能写成-COH
图3-12 乙醛分子的比例模型
图3-11 乙醛的核磁共振氢谱
通过乙醛的核磁共振氢谱,你能获取什么信 息?请你指出两个吸收峰的归属。
醛基上的氢
甲基上的氢
吸收峰较强的为甲基上的氢原子,较弱的为 醛基上的氢原子,二者面积比约为3:1
由苯二氯甲烷水解制得。它用途广泛,可用于生产苯甲
醇、苯胺、苯甲酮和杀虫剂等产品,也是苯甲醛系香料
最基本的原料,是某些合成医药产品、塑料添加剂的最
基本原料。由于苯甲醛具有独特的甜味、芳香味和杏仁
气味,因此它也是合成香精香料的一种重要中间体,苯
甲醛也是合成诸如玫瑰香和茉莉香等香料的第一步,这
些香料广泛用于各种香皂和香水中。
根据乙醛的结构——预测乙醛的性质
H HC
O 不饱和
CH
H
烯烃和醛都有不饱和双键,能发生加成反应, 这是两者的共性。但是,C=O双键和C=C双键结构 不同,产生的加成反应也不一样。因此,能跟烯 烃起加成反应的试剂(如溴),一般不跟醛发生 加成反应。
醛课件(高二化学)

高中化学课件
2.下列物质不属于醛类的是( )
【解析】 醛是由烃基和醛基相连而构成的化合物,B中的 CH3—O不是烃基,故B不属于醛类。
【答案】 B
高中化学课件
【答案】 B
高中化学课件
4.若有A、B、C三种烃的衍生物,相互转化关系如下:
1,2-二溴乙烷―溴―水→气体D浓―17H―02S→℃O4A
高中化学课件
【解析】 由信息C跟石灰石反应可放出CO2知C中有羧 基,再根据A、B、C三者的相互转化关系,推断B中含醛基,A 中含羟基,根据A转化成D所需的反应条件推知D为烯烃,D与 溴水发生加成反应生成1,2-二溴乙烷,故D为乙烯,A为乙醇,B 为乙醛,C为乙酸。四者中只有醛能被弱氧化剂氧化,故醛的还 原性最强。
高中化学课件
第3步 例证——典例印证,思维深化 今有以下几种化合物:
高中化学课件
(1)请写出丙中含氧官能团的名称:________。 (2)请判别上述哪些化合物互为同分异构体:________。 (3)请分别写出鉴别甲、乙、丙化合物的方法(指明所选试剂 及主要现象即可)。 ①鉴别甲的方法:________。 ②鉴别乙的方法:_____________。 ③鉴别丙的方法:___________。
【提示】 耗氧量相等。乙醛(C2H4O)的分子式可以看作 C2H2·H2O,只有C2H2耗氧。
高中化学课件
二、乙醛的化学性质
1.氧化反应
(1)银镜反应
实 验 操 作
实 验 现 象
向(a)中滴加氨水,现象 为: 试管内壁出现一层
先出现白色沉淀后变澄清 ,水浴加热一段时间后, 光亮的银镜
高中化学课件
高中化学课件
高中化学课件
2.乙醛能使溴水或酸性KMnO4溶液褪色吗?为什么? 【提示】 能。因为醛基有较强的还原性,能被 Ag(NH3)2OH溶液或新制Cu(OH)2悬浊液等弱氧化剂氧化。而溴 水或酸性KMnO4溶液的氧化能力比Ag(NH3)2OH溶液、新制 Cu(OH)2悬浊液强得多,故溴水或KMnO4酸性溶液也能氧化乙 醛,而自身被还原,从而使溶液褪色。
2.下列物质不属于醛类的是( )
【解析】 醛是由烃基和醛基相连而构成的化合物,B中的 CH3—O不是烃基,故B不属于醛类。
【答案】 B
高中化学课件
【答案】 B
高中化学课件
4.若有A、B、C三种烃的衍生物,相互转化关系如下:
1,2-二溴乙烷―溴―水→气体D浓―17H―02S→℃O4A
高中化学课件
【解析】 由信息C跟石灰石反应可放出CO2知C中有羧 基,再根据A、B、C三者的相互转化关系,推断B中含醛基,A 中含羟基,根据A转化成D所需的反应条件推知D为烯烃,D与 溴水发生加成反应生成1,2-二溴乙烷,故D为乙烯,A为乙醇,B 为乙醛,C为乙酸。四者中只有醛能被弱氧化剂氧化,故醛的还 原性最强。
高中化学课件
第3步 例证——典例印证,思维深化 今有以下几种化合物:
高中化学课件
(1)请写出丙中含氧官能团的名称:________。 (2)请判别上述哪些化合物互为同分异构体:________。 (3)请分别写出鉴别甲、乙、丙化合物的方法(指明所选试剂 及主要现象即可)。 ①鉴别甲的方法:________。 ②鉴别乙的方法:_____________。 ③鉴别丙的方法:___________。
【提示】 耗氧量相等。乙醛(C2H4O)的分子式可以看作 C2H2·H2O,只有C2H2耗氧。
高中化学课件
二、乙醛的化学性质
1.氧化反应
(1)银镜反应
实 验 操 作
实 验 现 象
向(a)中滴加氨水,现象 为: 试管内壁出现一层
先出现白色沉淀后变澄清 ,水浴加热一段时间后, 光亮的银镜
高中化学课件
高中化学课件
高中化学课件
2.乙醛能使溴水或酸性KMnO4溶液褪色吗?为什么? 【提示】 能。因为醛基有较强的还原性,能被 Ag(NH3)2OH溶液或新制Cu(OH)2悬浊液等弱氧化剂氧化。而溴 水或酸性KMnO4溶液的氧化能力比Ag(NH3)2OH溶液、新制 Cu(OH)2悬浊液强得多,故溴水或KMnO4酸性溶液也能氧化乙 醛,而自身被还原,从而使溶液褪色。
高中化学-醛-课件

思考题部分
在此添加您的文本17字
思考题1:醛的结构与性质的关系
在此添加您的文本16字
深入思考醛的结构与性质的关系是解决此题的关键。
在此添加您的文本16字
学生需要思考醛的结构特点与其性质之间的关系,理解结 构决定性质的原理,以便能够更好地掌握醛的化学性质和 制备方法。
在此添加您的文本16字
思考题2:醛与其他有机物的区别与联系
03
避免使用含甲醛的物品
尽量避免使用含甲醛的装修材 料、家具等,选择符合国家标 准的绿色环保建材。
04
加强个人防护
在装修或从事与甲醛相关的工 作时,应佩戴防毒面具或口罩 ,保护呼吸系统不受侵害。
06
习题与思考
习题部分
习题1:醛的化学性质
掌握醛的化学性质是解题的关键。
醛是一类重要的有机化合物,具有多种化学性质,如还原性、加成反应等。学生需 要掌握这些性质,以便能够正确解答与醛相关的习题。
04
醛的应用
在工业上的应用
01
醛在工业上被广泛应用,主要用 于制造香料、塑料、染料、医药 等。
02
例如,苯甲醛是制造香豆素的重 要原料,而乙醛则是制造醋酸、 丁二醇等的重要中间体。
在生活中的应用
醛在日常生活中也随处可见,许多香 料、香精、化妆品和清洁剂中都含有 醛类化合物。
例如,香豆素是香料和香精的主要成 分之一,而乙醛则是许多化妆品和清 洁剂的重要成分。
醛基可与亲核试剂发生加成反应 。
常见的亲核试剂包括氢氰酸、醇 、氨等。
在加成过程中,亲核试剂进攻醛 基的碳原子,形成新的碳-碳键
。
α-H的反应
醛基中的α-H具有酸性,可被碱中和 生成醇。
高中化学第三章第二节醛课件新人教选修5.ppt
2.有饱和一元醛发生银镜反应时,生成 21.6 g 银,再将等
质量的该醛完全燃烧,生成 CO2 为 13.44 L(标准状况),则该醛 是( D )。
A.丙醛
B.丁醛
C.3-甲基丁醛
D.己醛
醛基的检验 【例 3】已知柠檬醛的结构简式如下:
(1)检验柠檬醛中的醛基的方法是____________________ ____________________________。
答案:C
醛的有关计算
【例 2】(双选)1 mol 下列物质与足量的银氨溶液反应,可
还原出 4 mol Ag 的是( BC )。
A.丙醛
B.乙二醛 C.甲醛
D.乙醛
【解析】根据银镜反应规律,1 mol 醛基可还原出 2 mol Ag,
则 1 mol 可还原出 4 mol Ag 的物质中应含有两个醛基,故 B 选
④与新制 Cu(OH)2 反应 实验现象:有__砖__红__色__沉__淀__生__成__;其化学方程式为_C_H__3C__H_O__ _+_2_C__u(_O_H__)2____C_H_3_C_O__O_H_+__C_u_2_O_↓_+__2_H_2O__。该反应也可用来 检验醛基。
醛的定义、结构和分类 1.醛的结构 醛的通式为 R—CHO,—CHO 为醛基,注意醛基中 H、O 的顺序不能颠倒。 2.饱和一元脂肪醛的通式:CnH2n+1CHO 或 CnH2nO。
____________________________ 。 (2)氧化反应
①燃烧的化学方程式为_2_C_H_3_C_H__O_+__5_O__2 _ __点 _ _燃_ ___4_C__O_2_+_
___4_H_2_O___ 。
②催化氧化的化学方程式为___2_C_H_3_C_H__O_+__O__2___________ _2_C_H_3_C_O__O_H___ 。
醛课件1

8/6/2014
乙醛实验
8/6/2014
滴加氨水后 有白色沉淀产生 . ,
8/6/2014
继续滴加氨水, 沉淀消失,溶液变澄清。
银氨溶液Ag(NH3)2OH(氢氧 化二氨合银)一种弱氧化剂。
8/6/2014
水浴加热后在试管底部看 见一层光亮的银。
8/6/2014
银镜反应 ——检验醛基的一种方法
8/6/2014
加成反应
反应类型: 还原反应
8/6/2014
8/6/2014
习题
写出有机物的银镜反应方程式,和与 新制氢氧化铜的反应方程式。
8/6/2014
8/6/2014
乙醛和氧气的反应
8/6/2014
+H2
AgOH+2NH3· H2O = Ag(NH3)2OH+2H2O
O 催化剂 ‖ 2 CH3 –C –H +O2 △
→
O ‖ 2CH3– C –OH
CH3CH2 – OH
8/6/2014
现象
滴加硫酸铜溶液后溶液变蓝, 有沉淀产生。
加热后,有红色的沉淀。(Cu2O)
8/6/2014
口诀:112,113
氧化反应
8/6/2014
乙醛用途
乙醛是有机合成 的重要材料,主要 用于制取乙酸,乙 醇,乙酸乙酯等。
8/6/2014
课堂小节 • 化学性质: 氧化反应
8/6/2014
化学化工学院
8/6/2014
C2H4O的核磁共振氢谱图
两组吸收峰,则有两 种等效氢。峰面积比 为1:3,则两种等效 氢的个数比为1:3 从核磁共振氢谱图,你能获取什么 信息?并推出这种化合物。
CH3CHO8/6/2014 Nhomakorabea乙醛
高二化学选修醛课件

05
醛的危害与防护
醛对人体的危害
刺激和腐蚀
高浓度的甲醛和其他醛类物质 会对皮肤和眼睛产生刺激和腐 蚀作用,导致红肿、疼痛等症
状。
免疫系统影响
长期接触低浓度的醛,可能会 影响人体的免疫系统,使人体 容易感染疾病。
神经系统损伤
长期接触高浓度的甲醛,还可 能对神经系统造成损伤,出现 头痛、头晕、记忆力减退等症 状。
结构和功能。
醛还具有抗菌、抗炎、抗氧化的 生物活性,可用于药物开发和治
疗某些疾病。
在食品工业中的应用
醛在食品工业中主要用于食品添加剂和香料的合成,如香草醛和乙基香草醛等。
醛可以用于食品保鲜和防腐,如甲醛可以用于果蔬保鲜,山梨酸可以用于食品防腐 。
醛还可以作为食品加工助剂,如丙二醇、甘油等,用于改善食品加工性能和口感。
高二化学选修醛课件
目录பைடு நூலகம்
• 醛的简介 • 醛的化学性质 • 醛的制备方法 • 醛的应用 • 醛的危害与防护
01
醛的简介
醛的定义
醛的定义
醛是含有醛基的有机化合物,通 常简写为RCHO,其中R代表烃基 。
醛的命名
根据烃基名称和醛基的位次来命 名醛,例如乙醛、丙醛等。
醛的分类
脂肪醛
脂肪醛是指烃基链上连接的醛基,如 乙醛、丙醛等。
佩戴防护用品
在接触可能含有甲醛的物品或环境时 ,可以佩戴手套、口罩等防护用品, 减少甲醛对人体的危害。
THANKS
感谢观看
等都可能释放出甲醛。
其他来源
化妆品、清洁剂、杀虫剂等也 可能含有甲醛或其他醛类物质
。
醛的防护措施
加强通风换气
经常开窗通风换气,保持室内空气流 通,可以有效降低室内甲醛浓度。
醛课件精选全文

根据加成反应的概念写出CH3CHO 和H2 加成反应的方程式。
CH3CHO+H2 Ni CH3CH2OH 这个反应属于氧化反应还是还原反应?为什么?
还原反应 因为在有机化学反应里,通常还可以从加 氢或去氢来分析氧化还原反应,即加氢就 是还原反应去氢就是氧化反应。
(2)氧化反应
a. 催化乙氧醛化可以被还原为乙醇, 能否被氧化?
溶剂和化工原料。
丙酮不能被银氨溶液、新制的氢氧化 铜等弱氧化剂氧化,但可催化加氢生成醇。
酮
羰基的两端连有两个烃基的化合物 饱和的一元酮为CnH2nO(n≥3)
O R1—C—R2
主要化学性质 1、加成反应:
=
O R1—C—R2
OH
+ H2
Ni △
| R1—CH—R2
2、难被氧化(燃烧除外):难被银氨溶液或新制氢氧化铜氧化
现象:有红色(Cu2O)沉淀生成
△
2Cu(OH)2+CH3CHO Cu2O↓+CH3COOH+H2O
注意:氢氧化铜溶液一定要新制 碱一定要过量
应用: 检验醛基的存在
医学上检验病人是否患糖尿病
学
写出甲醛发生银镜反应,以及与新制的
与
氢氧化铜反应的化学方程式
问
O
HCHO+ 4 [Ag(NH3)2]OH 加热
A、乙醛 C、丁醛
B、丙醛 D、2-甲基丙醛
【知识拓展】 一、乙醛的制法
1、乙炔水化法:CH≡CH + H2O
催化剂
△
CH3CHO
2、乙烯氧化:2CH2=CH2 + O2
催化剂 △
2CH3CHO
3、乙醇氧化:2CH3CH2OH + O2
CH3CHO+H2 Ni CH3CH2OH 这个反应属于氧化反应还是还原反应?为什么?
还原反应 因为在有机化学反应里,通常还可以从加 氢或去氢来分析氧化还原反应,即加氢就 是还原反应去氢就是氧化反应。
(2)氧化反应
a. 催化乙氧醛化可以被还原为乙醇, 能否被氧化?
溶剂和化工原料。
丙酮不能被银氨溶液、新制的氢氧化 铜等弱氧化剂氧化,但可催化加氢生成醇。
酮
羰基的两端连有两个烃基的化合物 饱和的一元酮为CnH2nO(n≥3)
O R1—C—R2
主要化学性质 1、加成反应:
=
O R1—C—R2
OH
+ H2
Ni △
| R1—CH—R2
2、难被氧化(燃烧除外):难被银氨溶液或新制氢氧化铜氧化
现象:有红色(Cu2O)沉淀生成
△
2Cu(OH)2+CH3CHO Cu2O↓+CH3COOH+H2O
注意:氢氧化铜溶液一定要新制 碱一定要过量
应用: 检验醛基的存在
医学上检验病人是否患糖尿病
学
写出甲醛发生银镜反应,以及与新制的
与
氢氧化铜反应的化学方程式
问
O
HCHO+ 4 [Ag(NH3)2]OH 加热
A、乙醛 C、丁醛
B、丙醛 D、2-甲基丙醛
【知识拓展】 一、乙醛的制法
1、乙炔水化法:CH≡CH + H2O
催化剂
△
CH3CHO
2、乙烯氧化:2CH2=CH2 + O2
催化剂 △
2CH3CHO
3、乙醇氧化:2CH3CH2OH + O2
3.3 醛、酮 课件(共27张PPT) 人教版(2019)选择性必修三

O H-C-H
O H-C-O-H
O H-C-O-CH3
甲醛简介
甲醛又称蚁醛,是无色、有刺激性气味的气体,有毒,易溶于 水。 甲醛用途非常广泛,是重要的有机合成原料;35%-40%的甲 醛水溶液叫福尔马林,具有杀菌、防腐性能。 在烃的含氧衍生物中,甲醛是唯一常温呈气态的物质。 甲醛毒性较高, 是主要的室内污染物,已被确定为致癌和致 畸形物质,是公认的变态反应源,也是潜在的强致突变物之一。
化学性质 氧化反应
HO
HO
2H-C-C-H
+ O2
催化剂
△
2H-C-C-O-H
H
H
乙醇
乙醛 乙酸 氧化(脱氢)
氧化(加氧)
还原(加氢)
化学性质 氧化反应
2ml 10% NaOH
2% CuSO4 4~6滴振荡
0.5 ml 乙醛
加热 煮沸
实验现象 蓝色絮状沉淀
砖红色沉淀
反应原理 Cu2++2OH-= Cu(OH)2↓ CH3CHO + 2Cu(OH)2 +NaOH △ CH3COONa + Cu2O↓+ 2H2O
有弱氧化性 Ag+表现氧化性
➢ CH3CHO + 2Ag(NH3)2OH △ CH3COONH4 +3NH3+ 2Ag↓+ H2O
乙酸与NH3·H2O 反应得到
无↑,因NH3 极易溶于水
1mol-CHO~2 molAg(NH3)2OH~ 2 mol Ag
【思考】1 mol甲醛最多可以还原得到多少 Ag? 甲酸能发生银镜反应吗? 甲酸甲酯能发生银镜反应吗?
【思考】将甲醛、乙醛混合发生上述反应,产物有多少种? 需断裂醛基的π键和α-C上的碳氢键,但甲醛无α-C。
醛(教学课件)(共32张PPT)高二化学(人教版2019选择性必修3)

02 乙醛的化学性质
【思考与讨论】 凡是能发生银镜反应的有机物都是醛? 1:醛类物质; 2:甲酸以及甲酸盐; 3:甲酸酯,如甲酸乙酯; 4:葡萄糖、麦芽糖等含醛基的物质。
02 乙醛的化学性质
2.氧化反应 (2)与新制氢氧化铜反应 实验装置:
实验条件:(1)新制氢氧化铜溶液;(2)碱要过量;(3)水浴加热 实验现象:(a)中溶液出现蓝色絮状沉淀;(c)溶液有砖红色沉淀(Cu2O)产生 实验过程分析: CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
δ- δ+ δ-
+ H ─ CN
δ+
催化剂 △
2-羟基丙腈
延长碳链
当极性分子与醛基发生加成反应时,带正电荷的原子或原子团
连接在氧原子上,带负电荷的原子或原子团接在碳原子上。
请类比上述反应写出乙醛与氨的衍生物(NH3)、醇(CH3OH)等发生的反应?
02 乙醛的化学性质
1.加成反应
O δR CH
δ+
通过乙醇的催化氧化可以得到乙醛,那么乙醛能否被还原为乙醇呢?
1.加成反应---与H2加成
醛基催化加氢一定生成端醇
+
H─H
催化剂 △
CH3CH2 ─ OH
醛基与氢气的加成反应,同时也属于还原反应。
请你尝试写出甲醛与氢气的加成反应吗?
+ H─H
催化剂 △
CH3 ─ OH
02 乙醛的化学性质
1.加成反应---与HCN加成
简写为:R—CHO
2.官能团: -CHO 或 OHC-
-COH
3.饱和一元醛的通式为:CnH2nO (n≥1 )或CnH2n+1CHO
4.结构:
醛基上的C原子为sp2杂化,醛基上以碳 原子为中心的4个原子在同一个平面内。
化学课件《醛》优秀ppt5 人教课标版

87.当一切毫无希望时,我看着切石工人在他的石头上,敲击了上百次,而不见任何裂痕出现。但在第一百零一次时,石头被劈成两半。我体会到,并非那一击,而是前面的敲打使它裂开。――[贾柯·瑞斯] 88.每个意念都是一场祈祷。――[詹姆士·雷德非]
89.虚荣心很难说是一种恶行,然而一切恶行都围绕虚荣心而生,都不过是满足虚荣心的手段。――[柏格森] 90.习惯正一天天地把我们的生命变成某种定型的化石,我们的心灵正在失去自由,成为平静而没有激情的时间之流的奴隶。――[托尔斯泰]
HH
HH
H
C—C—H
+
1
2
O2
催化剂
H—C— C
+ H2O
HO H
HO
乙醛
一、醛:
从结构上看,由烃基(或氢原子) 跟醛基相连而成的化合物叫醛。
二、醛的分类:
饱和醛、不饱和醛
醛 脂肪醛
芳香醛
一元醛 二元醛
多元醛
CnH2n+1CHO 或CnH2nO
三、醛的同分异构现象
除本身的碳架异构外,醛与酮、烯醇、 环醇互为同分异构体
91.要及时把握梦想,因为梦想一死,生命就如一只羽翼受创的小鸟,无法飞翔。――[兰斯顿·休斯] 92.生活的艺术较像角力的艺术,而较不像跳舞的艺术;最重要的是:站稳脚步,为无法预见的攻击做准备。――[玛科斯·奥雷利阿斯] 93.在安详静谧的大自然里,确实还有些使人烦恼.怀疑.感到压迫的事。请你看看蔚蓝的天空和闪烁的星星吧!你的心将会平静下来。[约翰·纳森·爱德瓦兹]
还原剂
氧化剂
2、氧化反应
4>与新制的Cu(OH)2反应
【实验3-6】
步骤:
配Cu(OH)2悬浊液 (CuSO4+ NaOH)
89.虚荣心很难说是一种恶行,然而一切恶行都围绕虚荣心而生,都不过是满足虚荣心的手段。――[柏格森] 90.习惯正一天天地把我们的生命变成某种定型的化石,我们的心灵正在失去自由,成为平静而没有激情的时间之流的奴隶。――[托尔斯泰]
HH
HH
H
C—C—H
+
1
2
O2
催化剂
H—C— C
+ H2O
HO H
HO
乙醛
一、醛:
从结构上看,由烃基(或氢原子) 跟醛基相连而成的化合物叫醛。
二、醛的分类:
饱和醛、不饱和醛
醛 脂肪醛
芳香醛
一元醛 二元醛
多元醛
CnH2n+1CHO 或CnH2nO
三、醛的同分异构现象
除本身的碳架异构外,醛与酮、烯醇、 环醇互为同分异构体
91.要及时把握梦想,因为梦想一死,生命就如一只羽翼受创的小鸟,无法飞翔。――[兰斯顿·休斯] 92.生活的艺术较像角力的艺术,而较不像跳舞的艺术;最重要的是:站稳脚步,为无法预见的攻击做准备。――[玛科斯·奥雷利阿斯] 93.在安详静谧的大自然里,确实还有些使人烦恼.怀疑.感到压迫的事。请你看看蔚蓝的天空和闪烁的星星吧!你的心将会平静下来。[约翰·纳森·爱德瓦兹]
还原剂
氧化剂
2、氧化反应
4>与新制的Cu(OH)2反应
【实验3-6】
步骤:
配Cu(OH)2悬浊液 (CuSO4+ NaOH)
醛 高中化学课件 高考化学课件 有机化学课件

(红色)
3.化学性质
(1)氧化反应 ①银镜反应—与银氨溶液的反应 ②与新制Cu(OH)2的反应 △ CH3CHO + 2Cu(OH)2 + NaOH CH3COONa + Cu2O + 3H2O
(红色)
说明:a.乙醛被氧化 b.此反应常用来检验醛基
思考:
1、1mol乙二醛(OHC-CHO)与新制氢 氧化铜悬浊液反应可生成多少Cu2O?
醛
一、醛
1.定义:由烃基和醛基相连而构成的化合 物,简写为RCHO
一、醛
1.定义:由烃基和醛基相连而构成的化合 物,简写为RCHO O 2.官能团:醛基( C H ,简写 CHO)
3. 醛的分类:
R
3. 醛的分类:
R
醛
3. 醛的分类:
R
脂肪醛 芳香醛
醛
3. 醛的分类: 饱和醛、不饱和醛 脂肪醛
2、1mol甲醛与新制氢氧化铜悬浊液反应 可生成多少Cu2O?
思考:
1、1mol乙二醛(OHC-CHO)与新制氢 氧化铜悬浊液反应可生成多少Cu2O?
2、1mol甲醛与新制氢氧化铜悬浊液反应 可生成多少Cu2O?
均生成2molCu2O
3.化学性质
(1)氧化反应 ①银镜反应—与银氨溶液的反应 ②与新制Cu(OH)2的反应 ③催化氧化
3.化学性质
(1)氧化反应 ①银镜反应—与银氨溶液的反应 ②与新制Cu(OH)2的反应 ③催化氧化 催化剂 2CH3CHO + O2 2CH3COOH △
3.化学性质
(1)氧化反应 ①银镜反应—与银氨溶液的反应 ②与新制Cu(OH)2的反应 ③催化氧化 催化剂 2CH3CHO + O2 2CH3COOH △ ④被KMnO4、K2Cr2O4等强氧化剂氧化
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CH3CHO+2Ag(NH3)2OH →CH3COONH4+2Ag↓+3NH3+H2O
△
由于生成的银附着在试管壁上形成银镜,所以叫银镜反应
注意点:
(1)试管内壁必须洁净;
(2)必须水浴; (3)加热时不可振荡和摇动试管; (4)须用新配制的银氨溶液; (5)乙醛用量不可太多; (6)实验后,银镜用HNO3浸泡,再用水洗
现象:有红色(Cu2O)沉淀生成
2Cu(OH)2+CH3CHO
△
Cu2O↓+CH3COOH+H2O
注意:氢氧化铜溶液一定要新制
碱一定要过量 应用: 检验醛基的存在
医学上检验病人是否患糖尿病
学 与 问
写出甲醛发生银镜反应,以及与新制的 氢氧化铜反应的化学方程式
O
HCHO+ 4 [Ag(NH3)2]OH
这个反应属于氧化反应还是还原反应?为什么? 还原反应 因为在有机化学反应里,通常还可以从加
氢或去氢来分析氧化还原反应,即加氢就 是还原反应去氢就是氧化反应。
(2)氧化反应
乙醛可以被还原为乙醇, a. 催化氧化 能否被氧化?
催化剂
2CH3CHO+O2 △ 2CH3COOH
氧化 乙醇 还原 乙醛
氧化
乙酸
银镜反应有什么应用,
有什么工业价值? 应用: 检验醛基的存在, 工业上用来制瓶胆和镜子
(2)与新制的氢氧化铜反应
a、配制新制的Cu(OH)2悬浊液:在试管里加入 2ml10%NaOH溶液,滴入2%CuSO4溶液4~6滴, 振荡。
Cu2++2OH-= Cu(OH)2
b、乙醛的氧化:在上述蓝色浊液中加入 0.5ml乙醛溶液,加热至沸腾。
A、乙醛 C、丁醛 B、丙醛 D、2-甲基丙醛
【知识拓展】
一、乙醛的制法
催化剂 1、乙炔水化法:CH≡CH + H2O CH3CHO △ 催化剂 2、乙烯氧化:2CH2=CH2 + O2 2CH3CHO △ 3、乙醇氧化:2CH3CH2OH + O2 二、醛的命名及同分异构 催化剂 △ 2CH3CHO + 2H2O
1、醛类的命名:选主链时要选含有醛基的最长碳链;编号时 要从醛基上的碳原子开始;名称中不必对醛基定位,因醛基必 然在其主链的边端。 2、醛类的同分异构,包括碳链异构,醛基的位置异构,以及 异类异构(醛与碳的酮、烯醇为同分异构)。
O
科学视野
丙酮
CH3-C-CH3
酮:羰基碳原子与两个烃基相连的化合物。 >C=O称羰基,是酮的官能团,丙酮 是最简单的酮。在常温下,丙酮是无色透 明的液体,易挥发,具有令人愉快的气味, 能与水、乙醇等混溶,是一种重要的有机 溶剂和化工原料。 丙酮不能被银氨溶液、新制的氢氧化 铜等弱氧化剂氧化,但可催化加氢生成醇。
【思考】乙醛能否使溴水或酸性KMnO4溶液褪色?
能 c、与氧气反应 燃烧
点燃 2CH3CHO+5O2 4CO2+4H2O
在一定温度和催化剂条件下:
O
2CH3 —C — H + O2
催化剂
O
△
2CH3 —C — OH
学与问
(3)结合乙醛的结构,说明 乙醛的氧化反应和还原反应 有什么特点?
H O H C C H H
乙醛能发生氧化反应是由于醛基上的H原子 受C=O的影响,活性增强,能被氧化剂所氧化; 能发生还原反应是由于醛基上的C=O与C=C类似, 可以与H2发生加成反应。
氧化 氧化 总结:CH3CH2OH CH3CHO CH3COOH 还原
CnH2n+2O
CnH2n O
CnH2nO2
醛类应该具备哪些重要的化学性质? 小结:醛类化学性质 (1) 和H2加成被还原成醇 (2)氧化反应 a.燃烧 b.催化氧化成羧酸 c.被弱氧化剂氧化 Ⅰ 银镜反应
烃的含氧衍生物
醇类发生催化氧化的条件是什么?
1.Ag或Cu作催化剂并加热。 2.羟基所连的碳原子上有氢原子。
根据醇类催化氧化反应的原理,完成下列方 程式:
2CH3CH2OH+O2 OH 2CH3CHCH3+O2 △
Cu
2CH3CHO+2H2O O 2CH3CCH3+2H2O
△
Cu
12.3 醛
乙醛分子比例模型
2、氧化反应
(1)银镜反应 a、配制银氨溶液 :取一洁净试管,加入 1ml2%的AgNO3溶液,再逐滴滴入2%的稀氨 水,至生成的沉淀恰好溶解。 Ag++NH3· 2O→AgOH +NH4+ H AgOH+2 NH3· 2O=[Ag(NH3)2]++OH-+2H2O H b、水浴加热生成银镜 :在配好的上述银 氨溶液中滴入三滴乙醛溶液,然后把试管放 在热水浴中静置。
加热
H C H
4Ag ↓+CO2↑+8NH3+3H2O
思考:1mol甲醛最多可以还原得到多少molAg?
HCHO+4Cu(OH)2
加热
2Cu2O↓+CO2↑+5H2O
小结:甲醛
1、结构 2、性质 : 不同点:
O
H C H 与乙醛相似
1、常温下甲醛为无色有刺激性气 味的气体
2、甲醛中有2个活泼氢可被氧化
酮
羰基的两端连有两个烃基的化合物 饱和的一元酮为CnH2nO(n≥3) 主要化学性质 1、加成反应: O + H2 Ni △ OH | R1—CH—R2 =
O R—C—R2 1
R1—C—R2
2、难被氧化(燃烧除外):难被银氨溶液或新制氢氧化铜氧化
有蓝色絮状沉淀生成;有红色沉淀生成。
醛
D
分子式:C3H6O; 结构简式:CH3CH2CHO
结构简式
CHO
或
C H
友情 提示
醛基的写法,不要写成
COH
思考:分析醛基的结构,推测其在化学反 应中的断裂方式判断醛基有哪些性质?
O
碳氧键
氧化性
醛基中碳氧双 键发生加成反 应,被H2还原 为醇
C
碳 氢 键
H
还原性
醛基中碳氢键 较活泼,能被 氧化成相应羧 酸
三、乙醛的化学性质
1、加成反应
根据加成反应的概念写出CH3CHO 和H2 加成反应的方程式。 CH3CHO+H2 Ni CH3CH2OH
O
R C H
Ⅱ
ห้องสมุดไป่ตู้与新制的氢氧化铜反应
d.使酸性KMnO4溶液和溴水褪色
巩固练习
1、用化学方法鉴别下列各组物质 (1)用新制氢氧化铜溶液 (1)溴乙烷 、乙醇 、乙醛 重铬酸甲酸性溶液 (2)苯、甲苯、乙醇、1-己烯、甲醛、苯酚 (2)用溴水、用新制氢氧化铜溶液、酸性高锰酸钾溶液 2、一定量的某饱和一元醛发生银镜反应,析出银 21.6g,等量的此醛完全燃烧时生成CO2 0.89L, 则此醛是( CD )
乙醛分子棍棒模型
3
一、醛基和醛
:: : 1、醛基
结构式 结构简式 O —C — H —CHO 电子式
O: · C:H
不能写成 —COH
2、醛的定义:
分子里由烃基跟醛基相连而构成的化合物。
饱和一元醛的通式: CnH2n+1CHO 或CnH2nO
3、常见的醛: 甲醛:HCHO是最简单的醛,为无色、有刺激性气味
的气体,它的水溶液(又称福尔马林)具有杀 菌、防腐性能。
乙醛:乙醛是一种没有颜色,有刺激性气味的液体,密度比水
小,沸点20.8℃,易挥发易燃烧,易溶于水及乙醇、乙 醚、氯仿等有机溶剂。
肉桂醛
CH2=CH—CHO
苯甲醛
CHO
二、乙醛的分子结构
分子式 结构式 C2H4O H O H C C H H CH3CHO O 官能团 醛基:
△
由于生成的银附着在试管壁上形成银镜,所以叫银镜反应
注意点:
(1)试管内壁必须洁净;
(2)必须水浴; (3)加热时不可振荡和摇动试管; (4)须用新配制的银氨溶液; (5)乙醛用量不可太多; (6)实验后,银镜用HNO3浸泡,再用水洗
现象:有红色(Cu2O)沉淀生成
2Cu(OH)2+CH3CHO
△
Cu2O↓+CH3COOH+H2O
注意:氢氧化铜溶液一定要新制
碱一定要过量 应用: 检验醛基的存在
医学上检验病人是否患糖尿病
学 与 问
写出甲醛发生银镜反应,以及与新制的 氢氧化铜反应的化学方程式
O
HCHO+ 4 [Ag(NH3)2]OH
这个反应属于氧化反应还是还原反应?为什么? 还原反应 因为在有机化学反应里,通常还可以从加
氢或去氢来分析氧化还原反应,即加氢就 是还原反应去氢就是氧化反应。
(2)氧化反应
乙醛可以被还原为乙醇, a. 催化氧化 能否被氧化?
催化剂
2CH3CHO+O2 △ 2CH3COOH
氧化 乙醇 还原 乙醛
氧化
乙酸
银镜反应有什么应用,
有什么工业价值? 应用: 检验醛基的存在, 工业上用来制瓶胆和镜子
(2)与新制的氢氧化铜反应
a、配制新制的Cu(OH)2悬浊液:在试管里加入 2ml10%NaOH溶液,滴入2%CuSO4溶液4~6滴, 振荡。
Cu2++2OH-= Cu(OH)2
b、乙醛的氧化:在上述蓝色浊液中加入 0.5ml乙醛溶液,加热至沸腾。
A、乙醛 C、丁醛 B、丙醛 D、2-甲基丙醛
【知识拓展】
一、乙醛的制法
催化剂 1、乙炔水化法:CH≡CH + H2O CH3CHO △ 催化剂 2、乙烯氧化:2CH2=CH2 + O2 2CH3CHO △ 3、乙醇氧化:2CH3CH2OH + O2 二、醛的命名及同分异构 催化剂 △ 2CH3CHO + 2H2O
1、醛类的命名:选主链时要选含有醛基的最长碳链;编号时 要从醛基上的碳原子开始;名称中不必对醛基定位,因醛基必 然在其主链的边端。 2、醛类的同分异构,包括碳链异构,醛基的位置异构,以及 异类异构(醛与碳的酮、烯醇为同分异构)。
O
科学视野
丙酮
CH3-C-CH3
酮:羰基碳原子与两个烃基相连的化合物。 >C=O称羰基,是酮的官能团,丙酮 是最简单的酮。在常温下,丙酮是无色透 明的液体,易挥发,具有令人愉快的气味, 能与水、乙醇等混溶,是一种重要的有机 溶剂和化工原料。 丙酮不能被银氨溶液、新制的氢氧化 铜等弱氧化剂氧化,但可催化加氢生成醇。
【思考】乙醛能否使溴水或酸性KMnO4溶液褪色?
能 c、与氧气反应 燃烧
点燃 2CH3CHO+5O2 4CO2+4H2O
在一定温度和催化剂条件下:
O
2CH3 —C — H + O2
催化剂
O
△
2CH3 —C — OH
学与问
(3)结合乙醛的结构,说明 乙醛的氧化反应和还原反应 有什么特点?
H O H C C H H
乙醛能发生氧化反应是由于醛基上的H原子 受C=O的影响,活性增强,能被氧化剂所氧化; 能发生还原反应是由于醛基上的C=O与C=C类似, 可以与H2发生加成反应。
氧化 氧化 总结:CH3CH2OH CH3CHO CH3COOH 还原
CnH2n+2O
CnH2n O
CnH2nO2
醛类应该具备哪些重要的化学性质? 小结:醛类化学性质 (1) 和H2加成被还原成醇 (2)氧化反应 a.燃烧 b.催化氧化成羧酸 c.被弱氧化剂氧化 Ⅰ 银镜反应
烃的含氧衍生物
醇类发生催化氧化的条件是什么?
1.Ag或Cu作催化剂并加热。 2.羟基所连的碳原子上有氢原子。
根据醇类催化氧化反应的原理,完成下列方 程式:
2CH3CH2OH+O2 OH 2CH3CHCH3+O2 △
Cu
2CH3CHO+2H2O O 2CH3CCH3+2H2O
△
Cu
12.3 醛
乙醛分子比例模型
2、氧化反应
(1)银镜反应 a、配制银氨溶液 :取一洁净试管,加入 1ml2%的AgNO3溶液,再逐滴滴入2%的稀氨 水,至生成的沉淀恰好溶解。 Ag++NH3· 2O→AgOH +NH4+ H AgOH+2 NH3· 2O=[Ag(NH3)2]++OH-+2H2O H b、水浴加热生成银镜 :在配好的上述银 氨溶液中滴入三滴乙醛溶液,然后把试管放 在热水浴中静置。
加热
H C H
4Ag ↓+CO2↑+8NH3+3H2O
思考:1mol甲醛最多可以还原得到多少molAg?
HCHO+4Cu(OH)2
加热
2Cu2O↓+CO2↑+5H2O
小结:甲醛
1、结构 2、性质 : 不同点:
O
H C H 与乙醛相似
1、常温下甲醛为无色有刺激性气 味的气体
2、甲醛中有2个活泼氢可被氧化
酮
羰基的两端连有两个烃基的化合物 饱和的一元酮为CnH2nO(n≥3) 主要化学性质 1、加成反应: O + H2 Ni △ OH | R1—CH—R2 =
O R—C—R2 1
R1—C—R2
2、难被氧化(燃烧除外):难被银氨溶液或新制氢氧化铜氧化
有蓝色絮状沉淀生成;有红色沉淀生成。
醛
D
分子式:C3H6O; 结构简式:CH3CH2CHO
结构简式
CHO
或
C H
友情 提示
醛基的写法,不要写成
COH
思考:分析醛基的结构,推测其在化学反 应中的断裂方式判断醛基有哪些性质?
O
碳氧键
氧化性
醛基中碳氧双 键发生加成反 应,被H2还原 为醇
C
碳 氢 键
H
还原性
醛基中碳氢键 较活泼,能被 氧化成相应羧 酸
三、乙醛的化学性质
1、加成反应
根据加成反应的概念写出CH3CHO 和H2 加成反应的方程式。 CH3CHO+H2 Ni CH3CH2OH
O
R C H
Ⅱ
ห้องสมุดไป่ตู้与新制的氢氧化铜反应
d.使酸性KMnO4溶液和溴水褪色
巩固练习
1、用化学方法鉴别下列各组物质 (1)用新制氢氧化铜溶液 (1)溴乙烷 、乙醇 、乙醛 重铬酸甲酸性溶液 (2)苯、甲苯、乙醇、1-己烯、甲醛、苯酚 (2)用溴水、用新制氢氧化铜溶液、酸性高锰酸钾溶液 2、一定量的某饱和一元醛发生银镜反应,析出银 21.6g,等量的此醛完全燃烧时生成CO2 0.89L, 则此醛是( CD )
乙醛分子棍棒模型
3
一、醛基和醛
:: : 1、醛基
结构式 结构简式 O —C — H —CHO 电子式
O: · C:H
不能写成 —COH
2、醛的定义:
分子里由烃基跟醛基相连而构成的化合物。
饱和一元醛的通式: CnH2n+1CHO 或CnH2nO
3、常见的醛: 甲醛:HCHO是最简单的醛,为无色、有刺激性气味
的气体,它的水溶液(又称福尔马林)具有杀 菌、防腐性能。
乙醛:乙醛是一种没有颜色,有刺激性气味的液体,密度比水
小,沸点20.8℃,易挥发易燃烧,易溶于水及乙醇、乙 醚、氯仿等有机溶剂。
肉桂醛
CH2=CH—CHO
苯甲醛
CHO
二、乙醛的分子结构
分子式 结构式 C2H4O H O H C C H H CH3CHO O 官能团 醛基:
