奥赛无机元素化学习题_第十七章__铜_锌_分_族教案资料
化学竞赛基础知识之铜、锌副族

6、Cu2+的氧化性、 Cu2+和Cu+的互相转化
1、氢氧化铜和氧化铜 CuSO4+2NaOH = Cu(OH)2 ↓ +Na2SO4 Cu(OH)2
353~363K
CuO +H2O
(1) 氧化铜
a. 热稳定性:在高温时明显分解
1237K
2CuO
Cu2O +1/2O2↑
b.加热可被H2、CO、NH3还原 3CuO + 2NH3 = 3Cu +3H2O + N2↑
Ag + HI = AgI↓+ 1/2H2 ↑
Au + 4HCl + HNO3 = H[AuCl4] + NO ↑+ 2H2O
3、与配体反应:
2Cu + 8CN- + 2H2O = 2Cu(CN)43- + 20H- + H2
2Cu + 8NH3+ O2 + 2H2O = 2Cu(NH3)42+ + 4OH-
作消毒剂和腐蚀剂。大量AgNO3用于制造照相
底片上的卤化银,是重要的化学试剂。
3.卤化物
(1)CuX : CuF 颜色 红 溶解度
2Cu2++2X-+SO2+2H2O
CuCl 白
CuBr CuI 白 白 减小
△
CuX ↓+4H++SO42浓HCl
+H2O
Cu2++2Cl-+Cu
△
2CuCl
2H[CuCl2]
(2)氢氧化铜(浅蓝色) a.微显两性(以碱性为主),可溶于浓强碱
化学奥赛无机元素化学习题--氧-族-元-素(含答案)教学内容

化学奥赛无机元素化学习题--氧-族-元-素(含答案)【高中化学奥林匹克竞赛辅导】无机元素化学习题第十三章氧族元素1. 写出臭氧与下列物质发生反应的化学方程式:(1) 在酸性溶液中I-到I2。
(2) S到硫酸(在水存在下)(3) [Fe(CN)6]4-到[Fe(CN)6]3- (在碱性介质中)2. O + 2e −→ O2-的过程是一个吸热过程,但为什么许多化合物中存在O2-离子?3. 试解释:O2、O3和H2O2中O-O键长分别为1.21、1.28和1.48,为什么会有这种增加趋势?4. 试用分子轨道理论说明:许多过氧化物有颜色。
5. 用乙基蒽醌法生产H2O2有什么好处?6. 从标准电极电位看φөH2O2/H2O(+1.776V)>φөMnO4-/Mn2+(+1.491V)>φөCl2/Cl-(+1.358V)但为什么H2O2遇KMnO4和Cl2时都起还原剂的作用?写出相应的离子方程式。
7. 完成下列各反应,写出化学方程式并注明反应条件(可写离子方程式):(1) FeS2→ SO2→ K2SO4→ K2S2O8→ H2O2(2) SO2→ NaHSO3→ Na2S2O3→ Na2S4O6↓S ← Na2SO3 → SO2↓SO42-S2O42-8. 写出硫(S)与H2、C、Fe、O2、Cl2和HNO3反应的化学方程式。
9. 写出H2S与Fe3+、MnO4-、Br2和Cr2O72-反应的离子方程式(在酸性条件下)10. 写出硫作为氧化剂的三个化学方程式,又作为还原剂的三个化学方程式。
11. 用化学方程式表示以下各反应(1) 过氧化氢在酸性介质中与高锰酸钾溶液的反应(2) CaS5与盐酸反应(3) SO2(OH)Cl与水反应(4) PCl5和SO2反应(5) 二氯氧化硫(VI)慢慢地加入硫氢化钾(KHS)的水溶液内(6) 硫代硫酸钠溶液与碘反应(7) 亚硫酸钠溶液与碘的反应(8) 以过量的硫代硫酸盐处理酸化的碘酸钾溶液12. 在自然界中发现的硫是以硫化物(如Cu2S)和硫酸盐(如CaSO4·2H2O)存在,但不存在亚硫酸盐,试解释其原因?13. SF6非常稳定,不易与其他试剂反应,也不易分解,故能作为高压电机的绝缘气体。
知识总结——铜族元素和锌族元素
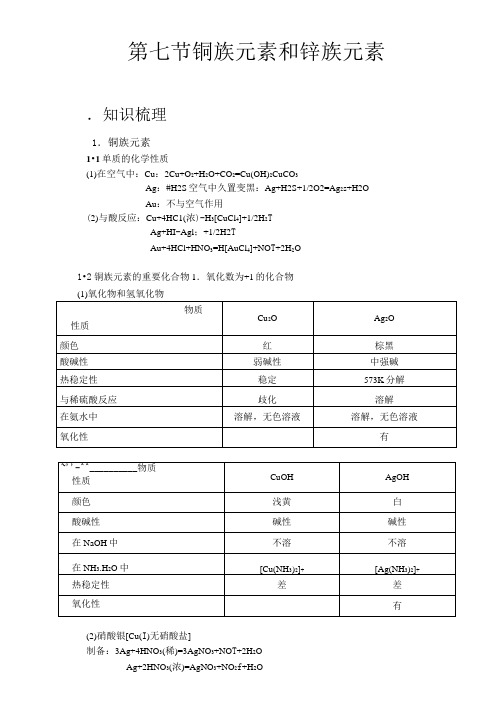
第七节铜族元素和锌族元素.知识梳理1.铜族元素1•1单质的化学性质(1)在空气中:Cu:2Cu+O2+H2O+CO2=Cu(OH)2CuCO3Ag:#H2S空气中久置变黑:Ag+H2S+1/2O2=Ag2s+H2OAu:不与空气作用(2)与酸反应:Cu+4HC1(浓)-H3[CuCl4]+1/2H2TAg+HI-Agl;+1/2H2TAu+4HCl+HNO3=H[AuCl4]+NO T+2H2O1•2铜族元素的重要化合物1.氧化数为+1的化合物(2)硝酸银[Cu(I)无硝酸盐]制备:3Ag+4HNO3(稀)=3AgNO3+NO T+2H2OAg+2HNO3(浓)=AgNO3+NO2f+H2O遇蛋白质生成黑色蛋白银,对有机组织有破坏作用,使用时勿使皮肤接触,在医药上用作消毒剂和腐蚀剂。
大量AgNO3用于制造照相底片上的卤化银,是重要的化学试剂。
(3)卤化物:①CuX2Cu2++2X-+SO2+2H2O-CuX;+4H++SO42-Cu2++2Cl-+Cu-2CuCl-2H[CuCl2]2Cu2++4I-=2CuI;+I2;CuX主要性质:在潮湿含氧环境下稳定性差:4CuCl+O2+4H2O=3CuOCuCl2^3H2O+2HCl8CuCl+O2=2Cu2O+4Cu2++8Cl-在相应卤化物中形成较稳定的卤配离子:CuX+X-=^CuX2-(无色)有一定氧化性:4CuI+Hg=Cu2[HgI4]+2Cu白暗红此反应用于检验实验室空气中的汞含量。
②AgX性质:见光分解:AgBr-Ag+Br因此AgBr用作感光材料。
(4)硫化物:Cu2S,Ag2S:黑色;难溶于水;溶于热浓硝酸3Cu2s+16HNO3(浓)一6Cu(NO3)2+3s;+4NO f+8H2O3Ag2s+8HNO3(浓)一6Ag(NO3)2+3S;+2NO f+4H2O2.氧化数为+2的化合物(1)氢氧化铜和氧化铜CuSO4+2NaOH=Cu(OH)2J+Na2SO4Cu(OH)2O①氧化铜热稳定性:在高温时明显分解2CuO1237K>Cu2O+1/2O2加热可被H2、CO、NH3还原3CuO+2NH3=3Cu+3H2O+N2②氢氧化铜(浅蓝色)微显两性(以碱性为主),可溶于浓强碱:Cu(OH)2+2OH-[Cu(OH)4]2-溶于氨水Cu(OH)2+4NH3^^[Cu(NH3)4](OH)2(2)氯化铜CuCl2无水CuCl2为共价化合物,结构为链状,其中Cu采取dsp2杂化方式。
无机化学试题库及答案

无机化学试题库及答案一、选择题(每题2分,共20分)1. 以下哪种元素的原子序数为11?A. 钠B. 镁C. 铝D. 钾答案:A2. 氢氧化钠的化学式是:A. NaOHB. NaClC. H2OD. Na2O答案:A3. 以下化合物中,哪一个是酸性氧化物?A. CO2B. Na2OC. CaOD. H2O答案:A4. 以下哪种元素属于卤素?A. 氧B. 氮C. 氟D. 碳答案:C5. 以下化合物中,哪一个是共价化合物?A. NaClB. H2OC. NaOHD. MgO答案:B6. 以下哪种金属的密度大于水?A. 钠B. 钾C. 铝D. 铜答案:C7. 以下哪种化合物是离子化合物?A. CO2B. H2OC. NaClD. CH4答案:C8. 以下哪种元素的原子序数为26?A. 铁B. 钴C. 镍D. 锌答案:A9. 以下哪种化合物是碱性氧化物?A. CO2B. Na2OC. CaOD. H2O答案:B10. 以下哪种元素的原子序数为30?A. 锌B. 镓C. 锗D. 砷答案:C二、填空题(每题2分,共20分)1. 元素周期表中,第____周期的元素数量最多。
答案:六2. 元素周期表中,第____族的元素都是金属元素。
答案:三3. 化合物H2SO4的俗名是____。
答案:硫酸4. 化合物NaCl的俗名是____。
答案:食盐5. 元素周期表中,第____族的元素都是非金属元素。
答案:七6. 化合物NH3的俗名是____。
答案:氨7. 元素周期表中,第____周期的元素数量最少。
答案:一8. 化合物H2O的俗名是____。
答案:水9. 元素周期表中,第____族的元素都是稀有气体。
答案:零10. 化合物CO2的俗名是____。
答案:二氧化碳三、简答题(每题10分,共40分)1. 请简述什么是离子键,并举例说明。
答案:离子键是由正负离子之间的静电吸引力形成的化学键。
例如,NaCl中的钠离子(Na+)和氯离子(Cl-)之间就是通过离子键结合在一起的。
奥林匹克化学竞赛初赛试题

奥林匹克化学竞赛初赛试题一、物质结构与性质相关题目1. 题目:- 已知某元素X的原子序数为29,写出其基态原子的电子排布式,并指出其在元素周期表中的位置。
- 解析:- 原子序数为29的元素是铜(Cu)。
根据构造原理,其基态原子的电子排布式为1s²2s²2p⁶3s²3p⁶3d¹⁰4s¹。
- 铜位于元素周期表的第四周期第ⅠB族。
因为其价电子层为3d¹⁰4s¹,最外层电子数为1,且处于第ⅠB族,周期数等于电子层数,其有4个电子层,所以是第四周期。
2. 题目:- 解释NH₃分子的空间构型是三角锥形,而BF₃分子的空间构型是平面三角形。
- 解析:- 在NH₃分子中,氮原子的价层电子对数为4,其中有3个成键电子对和1个孤电子对。
根据价层电子对互斥理论(VSEPR),由于孤电子对的存在,对成键电子对有排斥作用,使得NH₃分子的空间构型为三角锥形。
- 在BF₃分子中,硼原子的价层电子对数为3,且这3个电子对均为成键电子对。
根据VSEPR理论,这3个成键电子对相互排斥,且排斥力最小的空间分布是平面三角形,所以BF₃分子的空间构型是平面三角形。
二、化学反应原理相关题目1. 题目:- 对于反应2NO₂(g)⇌N₂O₄(g),在一定温度下达到平衡,若增大压强,平衡将如何移动?并解释原因。
- 解析:- 对于反应2NO₂(g)⇌N₂O₄(g),增大压强,平衡将向正反应方向移动。
- 根据勒夏特列原理,当改变影响平衡的一个条件(如压强)时,平衡将向着能够减弱这种改变的方向移动。
该反应的正反应方向是气体分子数减小的方向(2个NO₂分子反应生成1个N₂O₄分子),增大压强时,体系倾向于减少压强的增加,所以平衡向气体分子数减少的方向,即正反应方向移动。
2. 题目:- 已知某反应的反应热ΔH=- 100kJ/mol,活化能Ea = 50kJ/mol,求逆反应的活化能。
奥赛无机元素化学习题_第十七章__铜_锌_分_族

【高中化学奥林匹克竞赛辅导】无机元素化学练习第十七章铜锌分族1. 完成并配平下列各反应方程式:(1) Cu + NaCN + H2O −→(4) AuCl3 + H2O2 + KOH −→(2) Ag2S +HNO3(浓) −→(5) CuS+HNO3(稀) −→(3) Ag(S2O3)23- + H2S −→(6) Cu + I-+ H+−→2. 为什么Cu2+(aq)比Cu+(aq)稳定?而固态时Cu(I)比Cu(II)稳定?3. 往硫酸铜溶液中加入Na2CO3溶液能否得到碳酸铜沉淀?为什么?写出相应的反应方程式。
4. 试说明:AuCl在水中能自动分解成为Au和AuCl3,而Au3+和I-作用则得到AuI。
5. 为把银线上的灰暗色Ag2S除去,可以把这灰暗色的银线放入盛有热的Na2CO3溶液的铝器皿中。
试解释这是为什么?(已知EөAg2S/Ag = -0.70V,EөAg+/Ag = 0.80V)6. CuSO4水溶液加入I-或CN-时,会得到Cu(I)化合物的沉淀,但是Cu2SO4一遇水就会变成CuSO4和Cu,这是为什么?7. 为什么在水中CuF2存在而CuF不存在;CuI存在而CuI2不存在。
8. 解释下列各现象:(1) CuCl2的稀溶液是兰色,加入浓HCl后呈绿色。
(2) CuCl不溶于水和稀HCl中,但溶于浓HCl中。
(3) 把KCN加入Cu2+离子溶液中,溶液的兰色显著减少,再向此溶液中通入H2S气体,不产生CuS沉淀。
(4) AgCl的盐酸中的溶解度一开始减少,然后随着盐酸浓度的增加而增加。
(5) 氯化银在氨溶液中溶解,但碘化银不溶于氨溶液。
9. 将CuCl2⋅2H2O加热,能否制得无水CuCl2?10. 不用H2S或硫化物,如何分离Ag+、Cu2+、Ba2+、Al3+离子?11. 化合物A溶于水,加入NaOH后得兰色沉淀B。
B溶于盐酸,也溶于氨水,生成兰色溶液C。
C与稀NaOH无明显反应。
化学奥赛无机元素化学习题--氮-族-元-素(含答案)

【高中化学奥林匹克竞赛辅导】 无机元素化学习题第十三章 氮 族 元 素1。
试写出硝酸或硝酸盐被还原为六种不同产物的化学方程式。
2。
写出下列各种硝酸盐的热分解化学方程式:(1) NaNO 3 (2) NH 4NO 3 (3) LiNO 3 (4) Cu (NO 3)2 (5) AgNO 3 3. 试写出下列各物质的热分解方程式:(1) NH 4Cl (2) NH 4NO 2 (3) (NH 4)2Cr 2O 7 (4) (NH 4)2SO 4 (5) (NH 4)2CO 3 (6) NH 4ClO 4 (7) NH 4NO 3 (8) NH 4HCO 34。
指出下列各分子或离子中氮的氧化数:N 2,NH 4+,NaNO 3,N 2H 4,NH 2OH ,NO 2,N 2O 4,NH 4NO 3,N 2O,NCl 3,Li 3N ,HN 35. 为什么硝酸能用于从Na 2CO 3制备CO 2而不能用于从Na 2SO 3制备SO 2?写出相应的反应方程式。
6. 什么叫同素异形体?磷有几种主要的同素异形体?它们的性质主要区别表现在哪些方面?7. 计算下列各分子中磷的氧化数:PH 3,H 3PO 2,H 3PO 3,H 3PO 4,H 4P 2O 7,PH 4I,P 4,PCl 3 8。
写出NaH 2PO 4、NaNH 4HPO 4和NH 4MgPO 4的热分解方程式.9. 试从HO -P -OH 的缩水过程表明焦磷酸,偏磷酸,链状三磷酸,环状三偏磷酸的结构式。
10. 已知H 3PO 2是一元酸,你能推断出此酸的结构式吗?11. 为什么NCl 3不稳定,易爆炸,而PCl 3则不然?写出它们与水反应的化学方程式。
12。
估计下列各酸的p K 1值:H 2CrO 4,HBrO 4,HClO,H 5IO 6,HNO 3 13。
试写出下列各物质的反应方程式 (1) Mg + N 2 −→ (2) NH 3 + CuO −→(3) HNO 3 光或热−→−− (4) PCl 3 + H 2O −→(5) NaBiO 3 + MnCl 2 + HCl −→ (6) AsH 3 + AgNO 3 + H 2O −→ (7) As 2S 3 + HNO 3(浓) −→ (8) H 3AsO 4 + KI+ HCl −→14。
无机化学教案(在办公室打印格式正常

无机化学教案第一章:绪论1.1 课程介绍了解无机化学的定义、范围和重要性。
理解无机化学与其他相关学科的关系。
1.2 无机化学的发展历程了解无机化学的历史发展,著名科学家及其主要贡献。
了解我国无机化学的发展概况。
1.3 无机化学的研究方法熟悉无机化学的研究方法,包括实验、理论计算等。
了解现代无机化学的研究动态和趋势。
第二章:元素周期律与元素周期表2.1 原子结构与元素周期律掌握原子的电子排布与元素周期律的关系。
理解主族元素、过渡元素和镧系元素的特点。
2.2 元素周期表的结构与特点熟悉元素周期表的结构,包括周期、族等。
了解元素周期表的命名规则。
2.3 元素的主要性质与周期表的关系掌握元素的主要性质,如原子半径、电负性等。
理解元素性质的周期性变化与周期表的关系。
第三章:化学键与分子结构3.1 化学键的类型熟悉离子键、共价键、金属键和氢键等化学键的特点。
理解化学键的形成与断裂。
3.2 分子的结构与性质掌握分子的轨道理论,如杂化轨道理论等。
了解分子几何形状与化学键的关系。
3.3 晶体结构与性质熟悉晶体的基本类型,如离子晶体、共价晶体等。
理解晶体结构与物理性质的关系。
第四章:化学反应原理4.1 化学反应的基本概念掌握化学反应的定义、类型和特点。
理解化学平衡的概念及其影响因素。
4.2 化学反应的速率与机制熟悉化学反应速率的定律,如一级反应、二级反应等。
了解化学反应速率的影响因素。
4.3 化学平衡与反应方向掌握化学平衡的原理,如勒夏特列原理等。
理解化学平衡的移动与反应条件的关系。
第五章:溶液与离子平衡5.1 溶液的基本概念掌握溶液的定义、分类和特点。
理解溶液的浓度表示方法,如摩尔浓度、质量浓度等。
5.2 离子平衡与离子反应熟悉离子平衡的原理,如酸碱平衡、氧化还原平衡等。
了解离子反应的类型和特点。
5.3 溶度积与溶解度掌握溶度积的概念及其应用。
理解溶解度与溶度积的关系。
第六章:氧化还原反应6.1 氧化还原反应的基本概念理解氧化还原反应的定义、特征和重要性。
2015年高中化学竞赛辅导无机化学17.1铜分族知识点素材
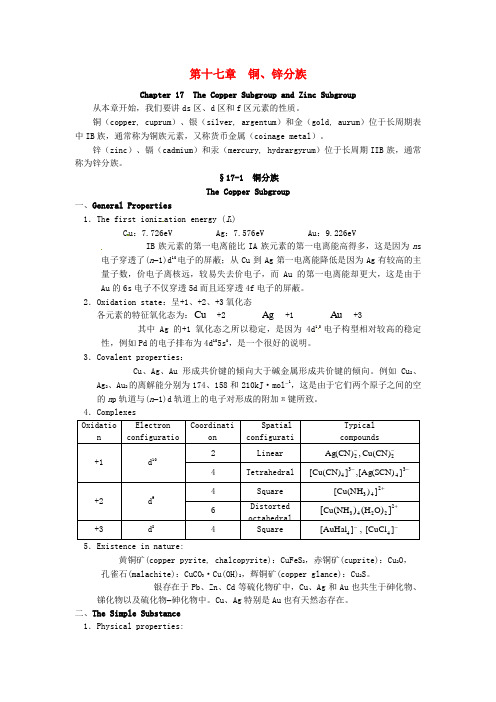
第十七章铜、锌分族Chapter 17 The Copper Subgroup and Zinc Subgroup 从本章开始,我们要讲ds区、d区和f区元素的性质。
铜(copper, cuprum)、银(silver, argentum)和金(gold, aurum)位于长周期表中IB族,通常称为铜族元素,又称货币金属(coinage metal)。
锌(zinc)、镉(cadmium)和汞(mercury, hydrargyrum)位于长周期IIB族,通常称为锌分族。
§17-1 铜分族The Copper Subgroup一、General Properties1.The first ioniz ation energy (I1)C u:7.726eV Ag:7.576eV Au:9.226eVIB族元素的第一电离能比IA族元素的第一电离能高得多,这是因为n s 电子穿透了(n-1)d10电子的屏蔽;从Cu到Ag第一电离能降低是因为Ag有较高的主量子数,价电子离核远,较易失去价电子,而Au的第一电离能却更大,这是由于Au的6s电子不仅穿透5d而且还穿透4f电子的屏蔽。
2.Oxidation state:呈+1、+2、+3氧化态各元素的特征氧化态为:Cu+2 Ag+1 Au+3其中Ag的+1氧化态之所以稳定,是因为4d10电子构型相对较高的稳定性,例如Pd的电子排布为4d105s0,是一个很好的说明。
3.Covalent properties:Cu、Ag、Au形成共价键的倾向大于碱金属形成共价键的倾向。
例如Cu2、Ag2、Au2的离解能分别为174、158和210kJ·mol-1,这是由于它们两个原子之间的空的n p轨道与(n-1)d轨道上的电子对形成的附加π键所致。
4.Complexes5.Existence in nature:黄铜矿(copper pyrite, chalcopyrite):CuFeS2,赤铜矿(cuprite):Cu2O,孔雀石(malachite):CuCO3·Cu(OH)2,辉铜矿(copper glance):Cu2S。
无机化学 第17章铜族和锌族元素

O2
2
不可用铜器盛氨水
7
[Cu(NH3 ) 4 ] (蓝)
4Au O2 8CN 2H 2 O 4[Au(CN)2 ] 4OH
17.3
铜族元素的主要化合物
1 . 氧化物及氢氧化物
加热Cu(OH)2、Cu2(OH)2CO3、Cu(NO3)2都可 以得到CuO:
Cu(OH)2 CuCO3 2CuO H2O CO2 Cu(OH)2 CuO H2O
H 2SO 4 Ag 2S(s, 黑)
21
Ag+的鉴定:
HCl AgCl Ag
NH 3
Ag(NH )
3 2
Br AgBr(s)
S2 O 3 3
-
HNO 3
Ag 2S(s) S Ag(CN)
2-
2
CN AgI(s) I Ag(S O ) 3 2 3 2 I AgI(趋势较小) 2
导热率(Hg=1)
51.3
57.2
39.2
3
熔沸点较低(相对于其他过渡金属): ①原子半径较大、结构不够紧密 ②次外层充满,电子不参与成键,价电 子较少 良好导电导热性和良好的延展性 1gAu可拉3.4km金丝,金也可被压成 0.0001mm厚的金箔 Cu、Ag、Au和许多金属形成合金 Cu-Zn 黄铜 Cu-Sn-Zn 青铜 60-40 80 -15 -5 Cu —— Ni —— Zn 白铜 50~70 - 13~15 - 13~25 4
Au 4HCl(浓) HNO3 (浓) H[AuCl4 ] NO(g) 2H 2 O
6
与沉淀剂、配合剂的作用
4Ag 2H2S O2 2Ag2S 2H2O
化学奥赛无机元素化学习题氧族元素(含答案)

【高中化学奥林匹克竞赛辅导】无机元素化学习题第十三章氧族元素1. 写出臭氧与下列物质发生反应的化学方程式:(1)在酸性溶液中I-到I2。
(2)S到硫酸(在水存在下)(3)[Fe(CN)6]4-到[Fe(CN)6]3- (在碱性介质中)2. O + 2e −→ O2-的过程是一个吸热过程,但为什么许多化合物中存在O2-离子?3. 试解释:O2、O3和H2O2中O-O键长分别为1.21、1.28和1.48,为什么会有这种增加趋势?4. 试用分子轨道理论说明:许多过氧化物有颜色。
5. 用乙基蒽醌法生产H2O2有什么好处?6. 从标准电极电位看φөH2O2/H2O(+1.776V)>φөMnO4-/Mn2+(+1.491V)>φөCl2/Cl-(+1.358V)但为什么H2O2遇KMnO4和Cl2时都起还原剂的作用?写出相应的离子方程式。
7. 完成下列各反应,写出化学方程式并注明反应条件(可写离子方程式):(1) FeS2→ SO2→ K2SO4→ K2S2O8→ H2O2(2) SO2→ NaHSO3→ Na2S2O3→ Na2S4O6↓S ← Na2SO3→ SO2↓SO42-S2O42-8. 写出硫(S)与H2、C、Fe、O2、Cl2和HNO3反应的化学方程式。
9. 写出H2S与Fe3+、MnO4-、Br2和Cr2O72-反应的离子方程式(在酸性条件下)10. 写出硫作为氧化剂的三个化学方程式,又作为还原剂的三个化学方程式。
11. 用化学方程式表示以下各反应(1)过氧化氢在酸性介质中与高锰酸钾溶液的反应(2)CaS5与盐酸反应(3)SO2(OH)Cl与水反应(4)PCl5和SO2反应(5)二氯氧化硫(VI)慢慢地加入硫氢化钾(KHS)的水溶液内(6)硫代硫酸钠溶液与碘反应(7)亚硫酸钠溶液与碘的反应(8)以过量的硫代硫酸盐处理酸化的碘酸钾溶液12. 在自然界中发现的硫是以硫化物(如Cu 2S)和硫酸盐(如CaSO 4·2H 2O)存在,但不存在亚硫酸盐,试解释其原因?13. SF 6非常稳定,不易与其他试剂反应,也不易分解,故能作为高压电机的绝缘气体。
2020高中化学竞赛实验讲义设计-无机实验-ds区元素(铜、银、锌、镉、汞)

ds区元素(铜、银、锌、镉、汞)一、实验目的与要求:1.了解铜、银、锌、镉、汞氧化物或氢氧化物的酸碱性,硫化物的溶解性。
2. 掌握Cu(Ⅰ)、Cu(Ⅱ)重要化合物的性质及相互转化条件。
3. 熟悉铜、银、锌、镉、汞的配位能力,以及Hg22+和Hg2+的转化。
二、教学重点与难点:了解铜、银、锌、镉、汞氧化物或氢氧化物的酸碱性,硫化物的溶解性,熟悉铜、银、锌、镉、汞的配位能力,以及Hg22+和Hg2+的转化;掌握Cu(Ⅰ)、Cu(Ⅱ)重要化合物的性质及相互转化条件,三、教学方法与手段:讲授法;演示法四、教学课时: 4课时五、课的类型:实验课一、铜、银、锌、镉、汞氧化物或氢氧化物的生成和性质1、铜、锌、镉氧化物的生成和性质向三支试管分别盛有0.5ml 0.2mol.L-1CuSO4、ZnSO4、CdSO4溶液的试管中滴加新配制的2mol.L-1NaOH溶液,观察溶液颜色及状态。
将沉淀分成两份, 一份加硫酸另一份加NaOH溶液,观察现象。
Cu2++2OH-===Cu(OH)2↓ (蓝色沉淀)两性偏碱,所以需强碱使之生成配离子。
蓝色沉淀,溶解于酸,微溶于过量的碱,得到深蓝色溶液[Cu(OH)4]2-。
Cu(OH)2Zn2++2OH-=== Zn(OH)2↓ (白色沉淀)白色沉淀, 溶解于酸和过量的碱,典型的两性化物。
Cd 2++2OH-===Cd(OH)2↓白色沉淀,溶于酸, 不溶于碱。
Cd(OH)2 + NaOH (6M)= 不反应(Cd(OH)碱性)2. 银、汞氧化物的生成和性质(1)、氧化银的生成和性质取0.5ml 0.1mol.L-1AgNO3溶液,滴加新配制的2mol.L-1的NaOH溶液,观察沉淀的颜色和状态。
洗涤并离心,将沉淀分成两份,一份加入HNO3,另一份加入氨水,观察现象。
Ag++OH-===AgOH↓白色沉淀2AgOH===Ag2O+H2O 黑色沉淀Ag2O+2HNO3===2AgNO3+H2OAg2O+2NH3.H2O==2[Ag(NH3)2]++2OH-+H2O氢氧化银不稳定,很容易被氧化成黑色的Ag2O,此黑色沉淀溶于硝酸得到银离子,加入氨水得到银氨络合溶液。
奥赛化学试题及答案

奥赛化学试题及答案一、选择题(每题5分,共50分)1. 下列元素中,属于金属元素的是:A. 碳B. 氮C. 铁D. 硫答案:C2. 根据元素周期表,元素的原子序数与其原子核外电子数的关系是:A. 原子序数等于核外电子数B. 原子序数等于核内质子数C. 原子序数等于核内中子数D. 原子序数等于核外电子数和核内质子数之和答案:B3. 化学反应中,能量变化通常表现为:A. 光能B. 热能C. 电能D. 机械能答案:B4. 以下化合物中,属于共价化合物的是:A. NaClB. CaOC. H2OD. MgO答案:C5. 根据酸碱理论,下列物质中属于酸的是:A. NaOHB. HClC. KOHD. NH3答案:B6. 金属活动性顺序表中,排在氢前面的金属能够:A. 与酸反应生成氢气B. 与碱反应生成氢气C. 与水反应生成氢气D. 不能与水或酸反应答案:A7. 氧化还原反应中,氧化剂和还原剂的关系是:A. 氧化剂被氧化B. 还原剂被还原C. 氧化剂被还原D. 还原剂被氧化答案:C8. 以下物质中,属于电解质的是:A. 酒精B. 蔗糖C. 硫酸D. 植物油答案:C9. 根据化学平衡原理,当一个化学反应达到平衡状态时,其特点是:A. 反应物和生成物的浓度不再改变B. 反应速率为零C. 反应物和生成物的浓度不断变化D. 反应速率与逆反应速率相等答案:A10. 以下物质中,属于非极性分子的是:A. CO2B. H2OC. NH3D. CH4答案:D二、填空题(每空3分,共30分)1. 元素周期表中,第ⅢA族的元素具有_______个价电子。
答案:32. 摩尔质量的单位是_______。
答案:g/mol3. 根据勒夏特列原理,当一个处于平衡状态的化学反应受到外部条件变化时,系统会自发地调整以_______。
答案:抵消这种变化4. 酸雨的pH值通常_______7。
答案:小于5. 根据化学键理论,离子键是由_______力形成的。
武汉大学版无机化学课后习题答案(第三版)第17章d区元素

D区元素〔1〕1.钛的主要矿物是什么?简述从钛铁矿制取钛白得反响原理。
解:钛的主要矿物有钛铁矿FeTiO2反响原理:FeTiO3 + 2H2SO4 = TiOSO4 + FeSO4 + 2H2OTiOSO4 + 2H2O =TiO2•H2O↓ + H2SO4TiO2•H2O = TiO2 + H2O2.解释TiCl3和[Ti(O2)OH(H2O)4]+ 有色得原因。
解:TiCl3显色是因为产生了电核跃迁,[Ti(O2)OH(H2O)4]+有色是因为O22-离子变形性较强,d—d跃迁所引起。
3.完成并配平以下反响方程式。
(1)Ti + HF →(2)TiO2 + H2SO4→(3)TiCl4 + H2O →(4)FeTiO3 + H2SO4→(5)TiO2 + BaCO3→(6)TiO2 + C + Cl2→解:(1) Ti + 5HF = H2TiF6 + 2H2↑(2)TiO2 + H2SO4 = TiOSO4 + H2O(3)TiCl4 + 2H2O = TiO2 + 4HCl(4)FeTiO3 + 2H2SO4 = TiOSO4 + FeSO4 + 2H2O(5)TiO2+ BaCO3 = BaTiO3 + CO2↑(6)TiO2 + 2C + 2Cl2 = TiCl4+ 2CO↑4.完成以下反响(1)TiI4在真空中强热;(2)FeTiO3和碳得混合物在氯气中加热;(3)向含有TiCl-2得水溶液参加过量得氨;6(4) 向VCl 3的水溶液参加过量的氨;(5) 将VCl 2的固体加到HgCl 2水溶液中。
解:(1) TiI 4 = Ti + 2I 2(2) 2FeTiO 3 + 6C + 5Cl 2 = 2FeCl 3 + 2TiCl 4 + 6CO(3) TiCl 62- + NH 3 = [Ti(NH 3)6]4+ + 6Cl -(4) VCl 3 + Na 2SO 3 =(5) VCl 2 + HgCl 2=5. 根据以下实验写出有关的反响方程式:将一瓶TiCl 4翻开瓶塞时立即冒白烟。
元素无机化学第六章铜锌分族元素教案

了解铜锌分族元素在 日常生活、工业生产 等领域的应用。
教学内容与目标
01
02
03
04
教学内容
铜锌分族元素的原子结构、物 理性质、化学性质、重要化合
物及其反应等。
知识目标
掌握铜锌分族元素的基本性质 和重要化合物,理解其反应机
理。
能力目标
能够运用所学知识解决实际问 题,具备实验设计和数据分析
能力。
情感目标
05 铜锌分族元素的重要反应 及机理
氧化还原反应及机理
01
02
03
铜的氧化反应
铜可被氧化为+1或+2价 的铜离子,如铜与硝酸反 应生成硝酸铜、一氧化氮 和பைடு நூலகம்。
锌的氧化反应
锌易被氧化为+2价的锌离 子,如锌与稀硫酸反应生 成硫酸锌和氢气。
铜锌原电池反应
铜和锌可组成原电池,其 中锌为负极,铜为正极, 电解质溶液中的氢离子在 正极得到电子生成氢气。
元素无机化学第六章铜锌分族元素 教案
contents
目录
• 引言 • 铜锌分族元素概述 • 铜锌分族元素的单质及其化合物 • 铜锌分族元素的结构与性质关系 • 铜锌分族元素的重要反应及机理 • 铜锌分族元素的应用与前景
01 引言
目的和背景
掌握铜锌分族元素的 基本性质、化合物及 其反应。
培养学生的实验技能 和科学探究能力。
铜锌分族元素的性质与特点
01
物理性质
铜锌分族元素多为有色金属,具有良好的延展性和导电性。例如,铜和
银是著名的导电材料,而金则因其稀有性和稳定性被用作贵金属。
02 03
化学性质
这些元素具有多种氧化态,并能形成多种化合物。例如,铜可以形成 +1和+2价的化合物,而锌则可以形成+2价的化合物。此外,它们还能 与其他元素形成合金,改变材料的性质。
无机化学教案
无机化学教案说明一、课程教学的基本要求本课程的教学环节包括课堂讲授,学生自学,讨论课、实验、习题、答疑和期中、期末考试。
通过本课程的学习使学生掌握物质结构、元素周期律、化学热力学、化学平衡(酸碱平衡、沉淀溶解平衡、?氧化还原平衡,配合离解平衡)和化学反应速率等基本概念和基本理论知识;理解和掌握重要元素及其化合物的结构、性质、反应规律和用途,训练和培养学生科学思维能力和分析问题解决问题的能力,指导学生掌握正确的学习方法和初步的科学研究方法,帮助学生树立辨证唯物主义观点,为后继课程的学习打下坚实的基础。
二、教学方法、手段主要运用启发式教学方法,注重在教学中实践“以学生为主体,以教师为主导”的素质教育指导思想,充分运用多媒体教学、网络教学等多元化、全方位的教学手段,努力提高教学质量。
三、考核方式本课程分两学期讲授,第一学期讲授化学基础理论,第二学期讲授元素化学,每学期考核一次,考核成绩由平时成绩20%+期末考试(闭卷)成绩80%组成。
四、学时分配(共计144学时)五、目录绪论 (4)第1章原子结构和元素周期律 (4)第2章分子结构 (9)第3章晶体结构 (13)第4章化学热力学基础 (23)第5章化学平衡 (30)第6章化学动力学基础 (32)第7章水溶液 (36)第8章酸碱平衡 (41)第9章沉淀平衡 (51)第10章电化学基础 (56)第11章配合物与配位平衡 (66)第12章氢和稀有气体 (73)第13章卤素 (74)第14章氧族元素 (80)第15章氮磷砷 (87)第16章碳硅硼 (97)第17章非金属元素小结 (103)第18章金属通论 (104)第19章S区金属 (105)第20章P区金属 (109)第21章ds区金属 (114)第22章d区金属(一) (121)课程的主要内容绪论学时1[教学基本要求]介绍本课程的学习内容、目的、任务和方法。
[重点与难点]介绍本课程的学习内容[教学内容]一、化学研究对象化学是研究物质组成、结构、性质和变化的科学;无机化学研究的对象、发展和前景,化学研究内容包括对化学物质的(1)分类(2)合成(3)反应(4)分离(5)表征(6)设计(7)性质(8)结构(9)应用。
《无机化学》第十七章d区元素之课后习题参考答案

第十七章d 区元素(二)课后习题参考答案3解:(1)查表得E θ(Cu 2+/Cu)=0.3394V ,K θf [Cu(NH 3)42+)=2.30×1012以Cu(NH 3)42+/Cu 电对做正极, Cu 2+/Cu 做负极组成原电池,总反应Cu(NH 3)42+ == Cu 2+ + 4NH 3∴ E θ(Cu(NH 3)42+/Cu)=-0.0265V(2)铜溶解后,溶液中的Cu(NH 3)42+的浓度为0.010(mol/L), 则氨水的浓度为 1.0-4×0.010=0.96(mol/L).对于半反应: Cu(NH 3)42+ + 2e == Cu + 4NH 3 由奈斯特方程得在0.96mol/L 氨水中: 对于半反应: O 2 + 2H 2O + 4e === 4OH -∵ E(O 2/OH -)> E(Cu(NH 3)42+/Cu)∴ Cu 可以溶于氨水中, 且O 2可以氧化Cu.5解:(1) 反应: Cu(OH)2 + 2OH - == Cu(OH)42-设NaOH 的初始浓度为x(mol/L) x=7.96(mol/L)7解:反应: 2[Cu(CN)4]3- + H 2S == Cu 2S + 2HCN + 6CN -因平衡常数非常小,说明反应向右进行趋势很弱,即不能生成Cu 2S 沉淀.8解:A :CuO ;B :CuSO 4;C :Cu 2(OH)2SO 4;D :[Cu(NH 3)4]2+;E :CuS 。
CuO + H 2SO 4 == CuSO 4 + H 2O CuSO 4+2NH 3·H 2O==Cu 2(OH)2SO 4+(NH 4)2SO 4 Cu 2(OH)2SO 4+6NH 3+2NH 4+==2[Cu(NH 3)4]2++SO 42-+2H 2O[Cu(NH 3)4]2++H 2S==CuS+2NH 3+2NH 4+ 3CuS+8HNO 3==3Cu(NO 3)2+3S+2NO+4H 2O 10解:加入Cr 2O 72-有Ag 2CrO 4的砖红色沉淀析出.加Cl -后砖红色沉淀转为白色的AgCl 沉淀.再加过量的S 2O 32-,沉淀溶解为无色溶液,因形成配离子Ag(S 2O 3)23-. 相关反应:4Ag ++ Cr 2O 72-+H 2O== Ag 2CrO 4+2H + Ag 2CrO 4 + 2Cl - == 2AgCl + CrO 42-AgCl + 2S 2O 32- == Ag(S 2O 3)23- + Cl -11解:已知电对: Au + + e == Au (1)[AuCl 2]- + e == Au + 2Cl - (2) 36.121030.21lg ])([1lg 0592.0]3394.0))(([20592.0lg 12243243-=⨯==-⨯==++NH Cu K NH Cu E zE K f MF θθθθ)(53.0)102.4(100/21.0325.101lg 40592.04009.0)(/lg 40592.0)/()/(434222V OH c P P OH O E OH O E O =⨯⨯+=+=----θθ)(0836.0)96.0(010.0lg 20592.00265.0)(])([lg 20592.0)/)(()/)((443243243243V NH c NH Cu c Cu NH Cu E Cu NH Cu E -=+-=+=+++θ)/(0042.096.0108.1)()(53L mol NH c K OH c b =⨯⨯=⋅=--θ])([)()()()(])([)(])([24242224224-+--+---⋅=⋅⋅⋅==OH Cu K K Cu c OH c OH c Cu c OH Cu c OH c OH Cu c K f sp θθθ162078.2241054.7102.210])([⨯=⨯==---θθθsp f K K OH Cu K 78.2210)20.0(1.0-=-=x K θ2048282301982223421222223422262223462108.1105.2)108.5()1003.2(101.7109.8)()]([)])(([)()()()(])([)()()()()()(])([)()(-------++--++---⨯=⨯⨯⨯⨯⨯⨯⨯=⋅⋅⋅=⋅⋅⋅⋅⋅⋅⋅⋅=⋅⋅=S Cu K HCN K CN Cu K K K Sc H c Cu c S H c CN Cu c S c H c Cu c CN c HCN c S H c CN Cu c CN c HCN c K sp a f a a θθθθθθ以电对(1)为正极,(2)为负极组成原电池,总反应为: Au + + 2Cl - == [AuCl 2]-182.10592.0)61.168.1(1)(lg lg 2=-⨯==-AuCl K K f θθ K θf (AuCl 2-)=15.22 元素电势图: Au 3+ Au + 1.68 Au└────1.50───┘E θ(Au 3+/Au +)=1.41(V) 同理以Au 3+/Au +为正极,AuCl 4-/AuCl 2-为负极组成原电池,其总反应为:Au 3+ + AuCl 2- + 2Cl- == Au + + AuCl 4-)()()()()()()()()()()()()(24423242234----+--+--+-+=⋅⋅⋅⋅=⋅⋅⋅=A u C lK A u C l K Cl c AuCl c Au c Cl c AuCl c Au c Cl c AuCl c Au c AuCl c Au c K f f θθθ 22.160592.0)93.041.1(2lg =-⨯=θKK θ=1.645×1016 K θf (AuCl 4-)= K θ×K θf (AuCl 2-)=1.645×1016×15.22=2.50×101713解:A :Ag +;B :Ag 2O ;C :AgCl ;D :Ag(NH 3)2+;E :AgBr ;F :Ag(S 2O 3)23-;G :AgI ;H :Ag(CN)2-;I :Ag 2S 。
铜、锌及其化合物

铜、锌及其化合物一、教学目的1、了解铜、锌的氢氧化物的生成和酸碱性;2、了解铜、锌的氨配合物的生成;3、了解铜(Ⅱ)的氧化性;4、掌握Cu2+的鉴定方法。
二、实验提要铜、锌是第四周期的ds区元素,它们的价电子构型分别为3d104s1、3d104s2 。
铜的氧化值通常为+2,但也有+1;而锌的氧化值则为+2。
Cu2+、Zn2+与碱作用分别生成Cu(OH)2(浅蓝色↓)和Zn(OH)2 (白色↓)。
Cu(OH)2 两性偏碱,在浓NaOH溶液中形成亮蓝色[Cu(OH)4]- 配离子;而Zn(OH)2 具有两性,在NaOH溶液中形成无色[Zn(OH)4]- 配离子。
铜、锌的盐与氨水作用时,先生成沉淀(注意:生成的是不同类型的沉淀物!),后溶解而生成氨配合物,例如:2Cu2+ + SO42- + 2NH3·H2O (适量) == Cu2(OH)2SO4↓(蓝色)+ 2NH4+Cu2(OH)2SO4 (s)+8NH3·H2O(过量)=2[Cu(NH3)4]2+(深蓝色)+SO42-+2OH-+8H2OZn2+ + 2NH3·H2O (适量) == Zn(OH)2↓+ 2NH4+Zn(OH)2 (s) + 4NH3·H2O (过量) == [Zn(NH3)4]2+(无色)+ 4H2OCu2+ 具有氧化性,与I- 反应时,不是生成CuI2,而是生成白色的CuI↓:2Cu2+ + 4I-== 2CuI↓+ I2将CuCl2溶液与铜屑混合,加入浓HCl,加热,可得泥黄色配离子[CuCl2]- 的溶液,将这种溶液稀释可得到白色的CuCl沉淀:Cu2+ + Cu + 4Cl- == 2[CuCl2]-[CuCl2]-CuCl↓+ Cl-Cu2+ 能与K4[Fe (CN)6]溶液反应生成红棕色Cu2[Fe (CN)6]沉淀:2Cu2+ + [Fe (CN)6]4- == Cu2[Fe (CN)6]↓这个反应用来鉴定Cu2+ 。
第十七章 d区元素(二)

HNO3
A Cl(s, g )
I-
A I(s,黄 g )
− + 4
A + +H →A g Cl gCl(s) +H+ A +2NH3 →A gCl g(NH ) +Cl
+ 3 2 + − + 3 2 − + 3 2
A g(NH ) +2H +Cl →A gCl(s) +2NH A g(NH ) +I →A gI(s) +2NH3
浅蓝 深蓝
Cu
2+
P2 O (适量)
Cu2 P2 O7 (s)
浅蓝
P2 O (过量)
47
Cu(P2 O )
蓝
6− 7 2
Cu + 4Cl (浓 →Cu (黄 ) Cl )
24
2+
−
(β =10 ) 4
-4.6
2+ 6
H2O
Cu(H2O)
CuSO4 ⋅ 5H2O 也是配合物 [Cu(H2O)4 ]SO4 ⋅ H2O
3.化学性质 •与O2作用
2Cu + O2 →2Cu 黑 O( )
∆ 2Cu + O2 + H2O+ CO2 → ∆
碱式碳酸铜
Cu2 (OH 2 CO3 (绿 ) )
Au Ag不与O2发生反应, 当有沉淀剂或配合剂存在时,可反应。
M= Cu, A A g, u 4M+O2 + 2H2O+8CN− →4[M (CN)2]− + 4OH− 4Cu +O2 + 2H2O+8NH3 →4[Cu(NH3)2]+(无 ) + 4OH− 色
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
奥赛无机元素化学习题_第十七章__铜_锌_分_族【高中化学奥林匹克竞赛辅导】无机元素化学练习第十七章铜锌分族1. 完成并配平下列各反应方程式:(1) Cu + NaCN + H2O −→ (4) AuCl3 + H2O2 + KOH −→(2) Ag2S +HNO3(浓) −→ (5) CuS+HNO3(稀) −→(3) Ag(S2O3)23- + H2S −→ (6) Cu + I- + H+−→2. 为什么Cu2+(aq)比Cu+(aq)稳定?而固态时Cu(I)比Cu(II)稳定?3. 往硫酸铜溶液中加入Na2CO3溶液能否得到碳酸铜沉淀?为什么?写出相应的反应方程式。
4. 试说明:AuCl在水中能自动分解成为Au和AuCl3,而Au3+和I-作用则得到AuI。
5. 为把银线上的灰暗色Ag2S除去,可以把这灰暗色的银线放入盛有热的Na2CO3溶液的铝器皿中。
试解释这是为什么?(已知EөAg2S/Ag = -0.70V,EөAg+/Ag = 0.80V)6. CuSO4水溶液加入I-或CN-时,会得到Cu(I)化合物的沉淀,但是Cu2SO4一遇水就会变成CuSO4和Cu,这是为什么?7. 为什么在水中CuF2存在而CuF不存在;CuI存在而CuI2不存在。
8. 解释下列各现象:(1) CuCl2的稀溶液是兰色,加入浓HCl后呈绿色。
(2) CuCl不溶于水和稀HCl中,但溶于浓HCl中。
(3) 把KCN加入Cu2+离子溶液中,溶液的兰色显著减少,再向此溶液中通入H2S气体,不产生CuS沉淀。
(4) AgCl的盐酸中的溶解度一开始减少,然后随着盐酸浓度的增加而增加。
(5) 氯化银在氨溶液中溶解,但碘化银不溶于氨溶液。
9. 将CuCl2⋅2H2O加热,能否制得无水CuCl2?10. 不用H2S或硫化物,如何分离Ag+、Cu2+、Ba2+、Al3+离子?11. 化合物A溶于水,加入NaOH后得兰色沉淀B。
B溶于盐酸,也溶于氨水,生成兰色溶液C。
C与稀NaOH无明显反应。
通入H2S时,有黑色沉淀D生成。
D难溶于盐酸,可溶于硝酸,得一兰绿色溶液。
在另一份A溶液中加入AgNO3溶液,有白色沉淀E生成,E与溶液分离后加入氨水,可溶解为溶液F,F用HNO3酸化又产生沉淀E。
判断A→F 各为何物?写出相应的化学方程式。
12. 根据SHAB原则说明:(1) AgCl能溶于氨水,而AgBr微溶,AgI则不溶。
(2) Ag2O易溶于稀硝酸,而Ag2S则不溶。
13. 正1价的金化合物在水溶液中发生歧化反应,生成Au+3和Au:3Au+ = 2Au + Au3+,试计算此反应在25℃时的平衡常数。
已知:Au+ + e −→ Au φө = +1.68VAu3+ + 2e −→ Au+φө = +1.29V14. 把1.00g铜矿溶解后,Cu2+(aq)与过量的KI反应,放出的碘需要11.2cm3、0.1000mol⋅dm-3 Na2S2O3来滴定。
问此矿含Cu的重量百分比是多少?15. 已知Cu2S与CuS的混合物1.000g,用50.00cm3、1.5000mol⋅dm-3Ce4+离子在酸性溶液中处理,生成SO2、Cu2+与Ce3+。
当SO2气体被赶出后,过量的铈(IV)离子用17.50cm3、1.000mol⋅dm-3Fe2+溶液处理。
写出上述各反应的化学方程式。
并求原来混合物中Cu2S的百分数?16. 为了测定在298K时的溶解度,进行了如下的实验:重5.092gCuSO4饱和溶液用水稀释到100cm3,取10cm3该溶液用过量的KI溶液处理,得到的碘能氧化14.0cm3、9.126kg⋅m-3的Na2S2O3-5H2O的硫代硫酸钠溶液。
根据这些实验结果,计算CuSO4在298K时的溶解度。
17. 判断下列各字母所代表的物质:化合物A是一种黑色固体。
它不溶于水、稀醋酸与氢氧化钠溶液,而易溶于盐酸中,生成一种绿色的溶液B。
如溶液B与铜丝一起煮沸,即逐渐变黑,成为溶液C。
若用大量的水稀释溶液C,生成了白色沉淀D。
D可溶于氨溶液中,生成无色溶液E。
E若暴露于空气,则迅速变兰,生成溶液F。
往溶液F中加入KCN 时,兰色消失,生成溶液G。
往G溶液中加入锌粉,则生成红棕色的沉淀H,H不溶于稀的酸和碱,可溶于热硝酸中,生成兰色的溶液I。
往溶液I中慢慢加入NaOH溶液,生成兰色沉淀J。
如将J过滤,取出沉淀物后,加强热,又生成原来的化合物A。
用化学方程式表示上述每一种变化。
18. 完成并配平下列反应式(1) HgCl2 + SnCl2 (过量) −→ (4) HgCl2 + NH3−→(2) HgS + 王水−→ (5) ZnCl2 + NaOH (过量) −→(3) Hg2(NO3)2 + KI −→ (6) HgCl2 (过量) + SnCl2−→19. 试解释下列现象:(1) ZnS能溶于盐酸和硫酸,但不溶于HAc;CuS不溶于盐酸和硫酸,而溶于硝酸。
(2) H2S通入ZnSO4溶液中,ZnS的沉淀很不完全,但是如在ZnSO4溶液中先加若干NaAc,再通H2S气体,ZnS的沉淀就几乎完全了。
20. 将铜溶于乙酸乙酯的N2O4溶液中,可制得无水硝酸铜,写出这一变化的化学反应方程式。
21. Hg2+与I-可形成两种络离子:[HgI4]2-和[HgI3]-试预言此两种络离子的结构式。
22. 草酸汞(II)不溶于水,但加入含有大量氯离子的溶液后即溶解。
何故?23. 分别用什么办法可使下列平衡向左移动?(1) 2Cu+ = Cu2+ + Cu(2) Hg2+ = Hg2+ + Hg24. 为什么焊接铁皮时,常用浓的ZnCl2溶液处理铁皮表面?25. Zn的熔点比周期表中它前面的所有过渡元素的熔点都低,试说明为什么?26. 要使Ag2S和HgS溶解,各采用何种试剂?写出反应方程式。
27. 写出氯化汞(II)和氯化亚汞(I)的分子式及它们空间构型,并指出分子中各原子由什么轨道参加成键的。
28. 下列各种沉淀物,试选用配合剂分别将它们溶解,并写出化学反应式:(1) Cu(OH)2 (2) AgBr (3) Zn(OH)2 (4) HgI229. 我们知道在所有金属硫化物中,HgS的溶解度最小,其K sp = 3⨯10-62,但Bi2S3的K sp竟为1⨯10-96。
如何解释从表面上看存在的矛盾?30. 鉴别:(1) 用三种方法区别镁盐和锌盐。
(2) 用二种不同的方法区别锌盐和镉盐。
(3) 用一种方法区别锌盐和铝盐。
31. 试设计一个用H2S或硫化物,能使下述各组离子分离的方案:(1) Hg22+、Al3+、Cu2+ (2) Ag+、Cd2+、Hg2+、Zn2+32. 白色晶体A溶于水得无色溶液。
将溶液分成两份,一份加BaCl2溶液,有白色沉淀B生成,B不溶于酸及碱;A的另一份溶液加入Na2CO3溶液,有白色沉淀C生成,C溶于过量的NaOH溶液,也溶于稀盐酸中,并放出气体,剩下溶液D。
D中加入(NH4)2S,有白色沉淀E 生成,E溶于稀盐酸放出H2S。
指出A→E各为何物?写出各步反应方程式。
33. 一固体样品可能含CuSO4、K2Cr2O7、ZnO、CaCl2、KCl、Na3PO4样品,用水处理后,得一白色剩余物。
过滤后,滤液呈无色。
在滤液中加入AgNO3溶液,得白色沉淀,此白色沉淀溶于氨水。
问上述物质哪些存在?哪些不存在?哪些可能存在?说明相应的理由,写出有关的反应方程式。
34. 在pH = 7的0.1mol⋅dm-3[Cd(CN)4]2-的缓冲溶液中,通入足量的H2S,能否产生CdS沉淀?35. 三个电解池分别含有硫酸锌、硝酸银、硫酸铜溶液。
将它们串联起来,通以稳定的1.5A电流。
直到1.45g银在第二个电解池阴极上析出为止。
问通电时间为多少?在另外两个电解池的阴极上,分别析出了多少克铜和锌?36. 在盐酸溶液中,25cm3、0.032mol⋅dm-3的K2Cr2O7与1g汞完全作用,所产生汞的化合物是一价还是二价?37. 试解释:对于反应 1/2O2(g) + Hg(l) = HgO(s),当温度升高到约400℃时,其自由能变化(∆G)从负值变成了正值。
38. 若要在一铁表面镀铜锌合金,设镀液中[CN-]=1mol⋅dm-3, Cu(I)总浓度T Cu+=1mol⋅dm-3,求算镀液中Zn(II)总浓度T Zn2+为多少物质的量浓度时,铜与锌可同时析出。
(已知φөCu+/Cu = 0.522V,φөZn2+/Zn = -0.763V,K f,Cu(CN)43- = 2.0⨯1030,K f,Zn(CN)42- = 5⨯1016,并假定Cu(I)、Zn(II)的配合物全部为[Cu(CN)4]3-、[Zn(CN)4]2-)39. 中国古代出土文物青铜器编钟的表面布满铜锈。
分析表明铜锈中有CuCl、Cu2O和Cu2(OH)3Cl。
模拟实验指出,在空气中和含Cl-离子的水溶液的共同作用下,生锈过程中首先生成CuCl,然后经两种可能途径生成Cu2(OH)3Cl:有关物种的标准摩尔生成吉布斯自由能如下:物种∆f G mө (kJ⋅mol-1)Cu2O(s)CuO(s)CuCl(s)Cu2(OH)3Cl(s) Cl-(aq)OH-(aq)H2O(l) -146 -130 -120 -1338 -131 -157 -237回答下列问题:(1) 写出反应(a)、(b)、(c)的配平的化学方程式。
(2) 计算反应(a)和(b)的标准摩尔吉布斯自由能变化∆r G mө (298K)(3) 判断在标准状态下,反应(a)、(b)、(c)的反应方向。
40. 次磷酸H3PO2是一种强还原剂,将它加入CuSO4水溶液,加热到40~50℃,析出一种红棕色的难溶物A。
经鉴定:反应后的溶液是磷酸和硫酸的混合物;X-射线衍射证实A是一种六方晶体,结构类似于纤维锌矿(ZnS),组成稳定,A的主要化学性质为:温度超过60℃,分解成金属铜和一种气体;在氯气中着火;与盐酸反应放出气体。
(1) 试写出A的分子式,(2) 并完成A的生成反应方程式和与氯气、盐酸反应的化学方程式。
41. 假定分子式为C5H5AgNH3的化合物被分离出来了,环戊二烯基是如何与金属结合的?42. 高碘酸根(IO65-)离子与Ag3+或Cu3+离子生成稳定的配离子。
画出此配离子最可能的结构。
磁化率测量能否说明此结构?试说明理由。
43. 化学式为CsAuCl3晶体是反磁性物质,不存在金属键。
(1) 此晶体中有Au(II)吗?(2) 提出此晶体的结构式。
44. 当Hg(II)与二甲亚砜(dimethylsulfoxide),(CH3)2SO,形成配合物时,Hg(II)是与(CH3)2SO中的氧原子还是硫原子配位?试解释你的结论。
