2014级综合化学课表2017年9-12月
化学化工学院课程表

B201
7
8
近代史纲要
B201
9
10
职业生涯
规划
(3-12周)
英语6级
15501班
英语6级
15501班
形势与政策
5月12日和
5月19日两次
A116
A0305
A0305
B106
化学化工学院课程表
年级:2015级 专业:材化2015–16学年第2学期
星期
课程、
教室
节次
一
二
三
四
五
1
2
大学物理1
英语3级
7
8
合成技术与方法
化学信息学
15501班
英语6级
15501班
形势与政策
5月12日和
5月19日两次
A116
A0305
A0305
B106
化学化工学院课程表
年级:2015级 专业:应化2015–16学年第2学期
星期
课程、
教室
节次
一
二
三
四
五
1
2
大学物理1
英语3级
计算机基础
高数A2
B501(15215班)
B412
英语2级
计算机网络基础
B308
B507(14133班)
绿色化学
高分子化学
英语
A201
B306
3
4
物化1
体育4
物化1
B202(14210班)
B501(14131班)B504(14132班)
B507(14133班)
B306
A208
英语
5
2015-2016第二学期课程表
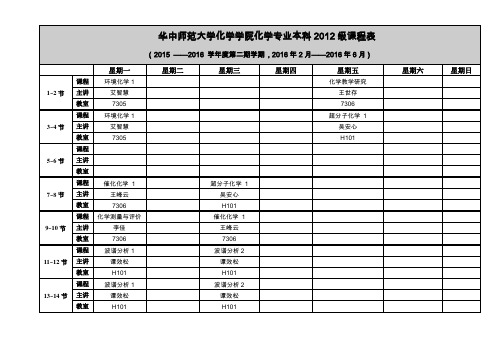
高等无机化学
主讲
李东风
教室
H237
3~4节
课程
理论与化学计算
统计物理
理论与化学计算
固体物理
主讲
万坚
(合班)
高等无机化学
(合班)
教室
H237
单H237双
5~6节
课程
主讲
教室
7~8节
课程
综合化学实验4
固体物理
综合化学实验4
统计物理
创新化学实验4-2
主讲
化工实验
(合班)
化工实验
(合班)
导师组
教室
SYS
主讲
有机实验2
王峰云
有机实验2
张礼知、贾法龙
教室
SYS
H101
SYS
H201 H101
3~4节
课程
物化实验1
有机化学2 45
345
主讲
有机实验2
彭浩、佘能芳
有机实验2
4、5双
王、王、熊
教室
SYS
7306 7308
SYS
H201 7308
8213 7304 7308
5~6节
SYS
SYS
9~10节
课程
综合化学实验4
化工基础4
综合化学实验4
创新化学实验4-2
主讲
化工实验
吴正舜
化工实验
导师组
教室
SYS
7211
SYS
SYS
11~12节
课程
主讲
教室
13~14节
课程
主讲
教室
华中师范大学化学学院化学专业本科2014级课程表
(2015——2016学年度第二期学期,2016年2月——2016年6月)
2014年全国高考新课标2卷理综试题(含答案)

2014年普通高等学校招生全国统一考试(新课标Ⅱ卷)理科综合能力测试化学部分7.下列过程没有发生化学反应的是()A.用活性炭去除冰箱中的异味B.用热碱水清除炊具上残留的油污C.用浸泡过高锰酸钾溶液的硅藻土保鲜水果D.用含硅胶、铁粉的透气小袋与食品一起密封包装8.四联苯的一氯代物有()A.3种B.4种C.5种D.6种9.下列反应中,反应后固体物质增重的是( )A.氢气通过灼热的CuO粉末B.二氧化碳通过Na2O2粉末C.铝与Fe2O3发生铝热反应D.将锌粒投入Cu(NO3)2溶液10.下列图示实验正确的是( )A.除去粗盐溶液中的不溶物B.碳酸氢钠受热分解C.除去CO气体中的CO2气体D.乙酸乙酯制备演示实验11.一定温度下,下列溶液的离子浓度关系式正确的是( )A.pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5mol•L-1B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1C.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH—)+c(HC2O4-)D.pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③12.2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系,下列叙述错误的是( )A.a为电池的正极B.电池充电反应为LiMn2O4=Li1-x Mn2O x+xLiC.放电时,a极锂的化合价发生变化D.放电时,溶液中Li+从b向a迁移13.室温下,将1mol的CuSO4•5H2O(s)溶于水会使溶液温度降低,热效应为△H1,将1mol 的CuSO4(s)溶于水会使溶液温度升高,热效应为△H2,CuSO4•5H2O受热分解的化学方程式为:CuSO4•5H2O(s)错误!CuSO4(s)+5H2O(l),热效应为△H3。
则下列判断正确的是()A.△H2〉△H3 B.△H1<△H3 C.△H1+△H3=△H2 D.△H1+△H2>△H3 26.(13分)在容积为1。
2014年全国统一高考化学试卷(新课标ⅱ)(含解析版)

2014年全国统一高考化学试卷(新课标Ⅱ)一、选择题:本题共7小题,每小题6分,在每小题给出的四个选项中,只有一项是符合题目要求的.1.(6分)下列过程没有发生化学反应的是()A.用活性炭去除冰箱中的异味B.用热碱水清除炊具上残留的油污C.用浸泡过高锰酸钾溶液的硅藻土保鲜水果D.用含硅胶、铁粉的透气小袋与食品一起密封包装2.(6分)四联苯的一氯代物有()A.3种B.4种C.5种D.6种3.(6分)下列反应中,反应后固体物质增重的是()A.氢气通过灼热的CuO粉末B.二氧化碳通过Na2O2粉末C.铝与Fe2O3发生铝热反应D.将锌粒投入Cu(NO3)2溶液4.(6分)下列图示实验正确的是()A.除去粗盐溶液中不溶物B.碳酸氢钠受热分解C.除去CO气体中的CO2气体D.乙酸乙酯的制备演示实验5.(6分)一定温度下,下列溶液的离子浓度关系式正确的是()A.pH=5的H2S溶液中,c(H+)=c(HS﹣)=1×10﹣5mol•L﹣1B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1C.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH﹣)+c(HC2O4﹣)D.pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③6.(6分)2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系,下列叙述错误的是()A.a为电池的正极B.电池充电反应为LiMn2O4═Li1﹣x Mn2O4+xLiC.放电时,a极锂的化合价发生变化D.放电时,溶液中Li+从b向a迁移7.(6分)室温下将1mol的CuSO4•5H2O(s)溶于水会使溶液温度降低,热效应为△H1,将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为△H2;CuSO4•5H2O受热分解的化学方程式为:CuSO4•5H2O(s)═CuSO4(s)+5H2O (l),热效应为△H3.则下列判断正确的是()A.△H2>△H3B.△H1>△H3C.△H1=△H2+△H3D.△H1+△H2>△H3二、非选择题:包括必考题和选考题两部分,第22题~第32题为必考题,每个试题考生都必须作答,第33题~第40题为选考题,考生根据要求作答8.(13分)在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)⇌2NO2(g),随温度的升高,混合气体的颜色变深。
普通高中化学新旧课程标准对比

普通高中化学新旧课程标准对比2014年12月,教育部全面启动对2004年开始施行的各学科普通高中课程标准的修订工作。
本次修订以贯彻落实党的十八大提出的“立德树人”根本任务为指针,深入总结21世纪以来我国普通高中课程改革的宝贵经验,充分借鉴国际课程改革的优秀成果,努力将我国普通高中课程标准修订成既具有国际先进水平又符合我国实际情况的纲领性教学文件,构建具有中国特色的普通高中课程体系。
课程标准是学生学习和教师教学的重要指导性文件。
2017年9月入学的新高一学生将面临新课程改革,使用新教材和新课程标准。
现把新课程标准与2004版旧课程标准进行对比,找出差异,制定策略,以便更好地完成新情境下的教学任务。
一、新旧化学课程标准内容对比新课程标准增加了“学业质量标准”部分,该标准帮助我们明确人才培养要求。
学科教学要以核心素养为统领,将具体教学目标进行水平划分,形成基于核心素养的学业质量标准。
该标准不仅要在引导教师把握人才培养要求、把握教学的深度和广度、提高教学设计和实施水平中发挥作用,而且要在帮助学生学习、进行过程性学业评价、指导学业水平考试和高考命题中发挥作用。
二、新旧教材课程结构对比新课程标准对于课程结构的调整,坚持基础性和选择性的统一,在强调共同基础的同时,强化课程的多样性和选择性。
在课程结构上适当压缩必修课程的内容和课时,提高选修课程所占的比例;在课程内容安排上精选必修内容,以强化共同基础。
同时,尽可能呈现不同类别和水平,为学生选择课程提供可能,满足学生多样化发展的需求。
修订后的课程标准,明确了必修、选修内容与普通高中学业水平考试、高校考试招生的对应关系。
基本思路是:必修指向学业水平考试的合格性考试;选修I指向学业水平考试等级性考试和高考;选修II由学生自主选择,学而不考或学而备考,可在高校自主招生中体现。
这样的结构安排,既坚持了普通高中教育基础性和选择性的统一,也较好地实现了教与考对接协调,方便教,方便学,方便考。
2014 新课标I理综卷-化学评卷、真题、答案及05备考建议

2014 新课标I理综卷-化学评卷、真题、答案及05备考建议编者按:总体来说,今年新课标I理综卷-化学难度略低于去年,无论是题型还是考察的知识点,都沿袭了近几年高考题稳中求变的特点。
试题覆盖面比较广,更加注重化学学科特点与基本研究方法。
整体分析:考点新颖,贴近生活试题基本遵循“稳中求变、立足基础、突出能力、锐意求新”的命题指导思想,全卷设计合理、梯度适中,覆盖面广。
对知识点的考查与平时复习的切入点有所不同,比如第9题将催化剂与反应机理联系考查;知识迁移念能力要求比较高,比如第11题溶解度曲线考查沉淀溶解平衡和溶度积常数的计算;今年试题依旧贯彻以往高考题的命题趋势,紧密联系生活中的化学元素,如第8题的烧碱去污、肥料使用,印刷电路板的腐蚀原理等,体现了化学命题源于生活而高于生活的理念。
本套试题没有出现偏、难、怪的试题,能够公平公正地考查学生的综合能力和素质,体现了新课程理念。
试题特点试题源于教材,以考查高中基础知识为主线,在基础查能力。
这套试题所涉及的知识内容几乎覆盖了高中化学所学知识的全部重要内容,如9题和28题考查化学反应速率和化学平衡,7题、26题和38题考查有机物的制备及性质,27题考查了氧化还原反应及电解原理。
这些类型的题目在我们的课堂中都给学生反复的讲过练过,基本功扎实的学生不难获得较好的分数。
而且试题更注重知识综合方面的考查,部分题目初看都比较朴实、平和,都是考生熟悉的题干,但深入解题后又会发现与过去已做过的题目不同,易掉入出题人的陷阱。
试卷具体特点解析如下:(1)突出主干知识,考点分布全面试题考查了几乎高中化学所有主干知识,全面考查了学生“双基”,体现了化学教学的基本要求,对重点内容重点考查,符合考纲说明。
(2)注重化学思想化学思想决定着化学基础知识教学的水平,培养化学能力,优化思维素养和化学基本技能的培养、能力的发展有十分重要的意义。
也是考纲考查的重点。
本试题考查了化学应用于生活思想,理论与实验相结合思想。
2014届最新全国新课标理综试卷(化学部分)

2014届赣县中学高二0班周练(化学)7.化学与生产、生活、社会密切相关。
下列有关说法中,错误的是A .服用铬含量超标的药用胶囊会对人体健康造成危害B .血液透析是利用了胶体的性质C .在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质D .厨房中燃气泄漏,立即打开抽油烟机排气8.4种短周期元素W 、X 、Y 、Z 的原子序数依次增大,其原子的最外层电子数之和为19,W 和X 元素原子内质子数之比为1:2,X 2+和Z -离子的电子数之差为8,下列说法不正确的是A .与W 相邻的同主族元素可制成重要的半导体材料B .X 单质不可能置换出W 单质C .元素原子半径从大到小的顺序是X 、Y 、ZD .W 、Y 、Z 元素最高价氧化物对应的水化物中酸性最强的是HZO 49.已知某有机物C 6H 12O 2能发生水解反应生成A 和B ,B 能氧化成C 。
若A 、C 都能发生银镜反应,则C 6H 12O 2符合条件的结构简式有(不考虑立体异构)A .3种B .4种C .5种D .6种10.某种药物合成中间体的结构简式为:OH 3COOOHOHOHOHCOOH,有关该物质的说法不正确...的是 A .属于芳香族化合物 B .能发生消去反应和酯化反应C .能分别与金属Na 、NaHCO 3溶液反应D .1 mol 该有机物与足量NaOH 溶液反应,消耗5 mol NaOH11. 实验室中某些气体的制取、除杂及收集装置如图所示。
仅用此装置和表中提供的物质完成相关实验,最合理的是选项 a 中物质 b 中物质 c 中物质d 中收集的气体A 浓氨水 CaO 浓H 2SO 4 NH 3B 浓硫酸 Na 2SO 3 浓H 2SO 4 SO 2C 饱和食盐水 电石 CuSO 4溶液 CH ≡CHD 浓盐酸 MnO 2 饱和NaCl 溶液 Cl 212.某化学研究性学习小组对电解质溶液作如下的归纳总结(均在常温下),其中正确的是① pH =1的强酸溶液,加水稀释后,溶液中各离子浓度都会降低②1L 0.50 mol ·L -1NH 4Cl 溶液与2L 0.25 mol ·L -1NH 4Cl 溶液含NH 4+物质的量完全相等 ③ pH 相等的四种溶液:a .CH 3COONa b .C 6H 5ONa c .NaHCO 3 d .NaOH ,则四种溶液的溶质的物质的量浓度由小到大顺序为:d ﹤b ﹤c ﹤a④ pH=8.3的NaHCO 3溶液:c (Na +)>c (HCO 3-)>c (CO 32-)>c (H 2CO 3)⑤ pH =2的一元酸和pH =12的二元强碱等体积混合:c (OH -) ≤ c (H +)⑥ pH =4、浓度均为0.1 mol ·L -1的CH 3COOH 、CH 3COONa 混合溶液中:c (CH 3COO -)+c (OH -)>c (CH 3COOH)+c (H +)A .①②④B .①③⑤C .③⑤⑥D .②④⑥13.气体的自动化检测中常常应用原电池原理的传感器。
2014年新课标全国II卷 理科综合化学部分

7. 列过程没 发生化学反 的是
A.用活性炭去除冰箱中的异味 B.用热碱水清除炊 残留的 垢
C.用 泡过高锰酸钾溶液的硅藻土保鲜水果 D.用含硅胶 铁粉的 气小袋 食品一起密封包装 8.四联苯 A.3 种 B.4 种 C .5 种 的一氯代物 D.6 种
所示,已知失重曲线 的 a 点
品
品起始质 — a点固体质 品起始质
×100% 的残留固体,若 a 点固体组 表
_
PbOx 或 mPbO2·nPbO,列式计算 x 值和 m:n 值_
28. 15 分
3
某小组以 CoCl2·6H2O NH4Cl H2O2 浓 水 原料,在活性炭催化 ,合 了橙黄 色晶体 X, 确定 组 ,进 如 实验 的测定 滴加入足 精确 全 w g X,加入适 水溶解,加入如 所示的 颈瓶中,然后
列改进和优化 水综合利用工艺的设想和做法可 的是 用混凝法获 淡水 优化提 产品的品种 提高部分产品的质 改进钾 溴 从弄 水 等的提 工艺 收,碱 收溴的
填序号
T
列式计算温度 T 时反 的 衡常数 K 2 (3)温度 T 时反 达 衡后,将反 容器的容 少一半 衡向 填“ 反 ”或“逆反
” 方向移动,判断理 是 27. 15 分 铅及 化合物可用于蓄电 耐酸设备及 X 射线 材料等 回答 列问 _周期
1 铅是碳的同 元素, 比碳多 4 个电子层, 铅在元素周期表的 置 第_ 第_ _ ,PbO2 的酸性比 CO2 的酸性 2 PbO2 填 强 弱
CuSO4(s) +5H2O( l ),
A.∆H2>∆H3 C.∆H1+∆H3=∆H2 26. 13 分 在容
【化学】2014年普通高等学校招生全国统一考试(新课标Ⅱ卷)理科综合(化学部分)答案解析

2014年普通高等学校招生全国统一考试(新课标Ⅱ卷)理科综合能力测试化学部分7.下列过程没有发生化学反应的是A.用活性炭去除冰箱中的异味B.用热碱水清除炊具上残留的油污C.用浸泡过高锰酸钾溶液的硅藻土保存水果D.用含硅胶、铁粉的透气小袋与食品一起密封包装8.四联苯的一氯代物有A.3种B.4种C.5种D.6种9.下列反应中,反应后固体物质增重的是A.氢气通过灼热的CuO粉末B.二氧化碳通过Na2O2粉末C.铝与Fe2O3发生铝热反应D.将锌粒投入Cu(NO3)2溶液【答案】B【解析】试题分析:A 、氢气通过灼热的CuO 粉末发生的反应为CuO+H 2=====△Cu+H 2O ,固体由CuO 变为Cu ,反应10.下列图示实验正确的是11.一定温度下,下列溶液的离子浓度关系式正确的是A.pH=5的H2S溶液中,c(H+)= c(HS-)=1×10—5 mol·L—1B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1C.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+ c(H+)= c(OH-)+c( HC2O4-)D.pH相同的①CH3COO Na②NaHCO3③NaClO三种溶液的c(Na+):①>②>③【答案】D【解析】试题分析:A、HS溶液中,存在H2S H+ + HS-、HS-H+ + S2-、H2O H++ OH-,根据上考点:考查电解质溶液中离子浓度大小关系,涉及弱电解质的电离、盐类的水解及三个守恒式的应用。
12.2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系。
下列叙述错误的是A .a 为电池的正极B .电池充电反应为LiMn 2O 4 Li 1-x Mn 2O 4+xLiC .放电时,a 极锂的化合价发生变化D .放电时,溶液中Li +从b 向a 迁移13.室温下,将1mol 的CuSO 4·5H 2O(s)溶于水会使溶液温度降低,热效应为△H 1,将1mol 的CuSO 4(s)溶于水会使溶液温度升高,热效应为△H 2;CuSO 4·5H 2O 受热分解的化学方程式为:CuSO 4·5H 2O(s) =====△CuSO 4(s)+5H 2O(l), 热效应为△H 3。
2014高考全国新课标1卷理综化学试题(word清晰版)试题及答案

卷试题及答案1高考真题理科综合全国新课标1402分,在每小题给出的四个选项中,只有一项是符合题目6小题,每小题13一、选择题:本题共要求的。
) ( 下列化合物中同分异构体数目最少的是 7. 乙酸乙酯 D. 戊烯 C. 戊醇 B. 戊烷 A. 化学与社会、生活密切相关。
对下列现象或事实的解释正确的是 8. − 分解的机理为: OH的溶液中,I ,在含少量98 kJ 放出热量 O1 mol H 已知分解9. 2222 − −慢O + IOH + IOH222 −−快+ IO + OH + IOOH 2222 ) ( 下列有关该反应的说法正确的是− −反应的速率与 A. 也是该反应的催化剂IO B. 的浓度有关I 1 −H)=υ(mol·98 kJ 反应活化能等于C. ) O) =υ(OOHυ( D. 2222−2X均是短周期元素,Z 、Y、X、10. W 和X 的最低价离子分别为Z 、X处于同一周期,Y 、−−+ ( 离子具有相同的电子层结构。
下列说法正确的是Z 和Y,Z) Z >Y>X单质沸点: B. Z >Y>X原子最外层电子数:A. −+−2X原子序数: D. Z>Y>X离子半径: C. Z >Y>3 )溶解度随温度变化曲线如图所示,下列说法错误的是AgBr O.溴酸银(11 .溴酸银的溶解是放热过程A .温度升高时澳酸银溶解速度加快B4− 60 C. l0×6 约等于K时溴酸银的℃sp .若硝酸钾中含有少量溴酸银,可用重D 结晶方法提纯.下列有关仪器使用方法或实验操作正确的是12.洗净的锥形瓶和容量瓶可以放进烘箱中烘干A .酸式滴定管装标准溶液前,必须先用该溶液润洗B .酸碱滴定实验中,用待滴定溶液润洗锥形瓶以减小实验误差C .用容量瓶配溶液时,若加水超过刻度线,立即用滴管吸出多余液体D ) ( 利用右图所示装置进行下列实验,能得出相应实验结论的是 13.分) 129 (一)必考题(共 ) 分(13 、26 乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。
2014年化学课程标准试题

密单位姓名密 封 线 内 不 得 答 题化学课程标准理论测试题姓名一、填空题(每空1分,共50分)1、化学是在原子、分子水平上研究物质的组成、结构、 的一门基础自然科学,其特征是研究物质和 。
2、 是一种重要而有效的学习方式,在义务教育化学课程内容中单独设立主题,明确地提出发展 能力所包含的内容及要求。
3、科学探究是重要实践活动,它涉及 、 、制定计划、进行实验、收集证据、解释与结论、反思与评价、表达与交流等要素。
4、 是进行科学探究的重要方式,学生具备基本的化学实验技能是学习化学和进行探究活动的基础和保证。
5、从宏观到微观、从 ,体现了化学学科发展的趋势。
对物质组成的微观研究和定量研究使化学逐步成为在实验和理论两个方面都获得迅速发展的一门自然科学。
6、物质的化学变化这一主题包括化学变化的特征、 、化学反应中的能量变化以及质量守恒定律和化学反应的表示方法等内容。
7、教师的“教”是为学生的“学”服务的,要转变学生的学习方式,教师必须转变 。
8、义务教育阶段的化学学业评价,包括 和 ,都应严格根据本标准来确定评价的目标、测评的范围和方式,以确保学习目标、教学要求和学业评价之间的一致性。
9、 能考查学生掌握知识的情况,操作方便,是最常用的学业评价方法。
10、 要求学生在真实或模拟的情景中运用所学知识分析、解决某个实际问题,以评价学生在活动过程中的表现与活动成果。
11、教材内容的组织应体现 和 的具体运用。
12、目前,在课程编制中课程目标的取向方式有: 取向,取向,演进过程取向。
13、制定课程目标体系时一般从三个方面进行:即根据社会需要确定课程目标,根据学生需要确定课程目标,从课程内容(或其载体)的逻辑和系统性需要确定课程目标。
14、《标准(2011年版)》确定的课程目标不但突出了基础性、发展性、综合性、时代性和针对性,而且注意了基础性与发展性的统 一, 的统一,时代性和继承性的统一。
15、“以 为基础”是化学学科的基本特征。
中国石油大学(北京)2014年化学综合(含无机化学、分析

硕士《化学综合》(含无机化学、分析化学、有机化学和结构化学)考试大纲考试科目名称:化学综合 考试科目代码:663 适用专业:化学一、考试要求:闭卷考试,书写规范、工整,所有答案均写在答题纸上,否则无效。
二、考试内容:(一)无机化学(占总分比例30%) (1)原理部分 1、化学热力学基础了解体系、环境、相、状态、状态函数、过程、途径、热、功、热力学能、焓、熵和自由能等热力学基本概念,能计算化学反应的r m H θ∆、r m S θ∆和r m G θ∆以及用r m G ∆和r m G θ∆判断反应进行的方向。
2、化学反应速率和化学乎衡了解质量作用定律和阿仑尼乌斯公式以及反应级数的概念。
能用活化能和活化分子的概念说明浓度、温度、催化剂对反应速率的影响。
并能利用r m G θ∆计算K θ。
由K θ能计算出平衡组成。
3、溶液中的离子平衡了解酸碱质子理论的基本概念。
掌握电离平衡、盐类水解、缓冲溶液等有关计算。
利用溶度积规则判断沉淀的生成与溶解并进行有关计算。
计算配体过量时配位平衡的组成。
4、氧化还原反应与电化学能熟练运用离子-电子法配平氧化还原反应方程式。
了解原电池的组成和表示方法。
了解电极反应、电池反应和电动势的计算。
掌握电极电势和元素电势图的应用。
熟练运用能斯特方程进行有关计算。
5、物质结构了解原子能级、波粒二象性、原于轨道(波函数)和电子云等概念。
了解四个量子数的物理意义和取值,并熟悉四个量子数对核外电子运动状态的描述。
了解前五周期元素在周期表中的位置。
掌握原子核外电子排布的一般规律和主族元素、过渡元素原子的结构特征。
能够从原子的电子层结构了解元素的性质。
了解原子半径、电离能;电子亲合能和电负性等概念以及各自的周期性变化。
熟悉杂化轨道类型(sp ,sp 2,sp 3,dsp 2,d 2sp 3,sp 3d 2 )与分子构型的关系。
了解分子轨道的概念及第二周期元素同核双原子分子的能级图。
了解四种基本类型晶体和混合型晶体的结构特征及物理特性。
2014年新课标高考全国I理综化学(含答案)

7.以下化合物中,同分异构体数目最少的是〔 〕 A .戊烷 B .戊醇 C .戊烯 D .乙酸乙酯 8.化学与社会、生活密切相关。
对以下现象或事实的解释正确的选项是〔 〕选项 现象或事实解释A 用热的烧碱溶液洗去油污 Na 2CO 3可直接与油污反应B 漂白粉在空气中久置变质漂白粉中的CaCl 2与空气中的CO 2反应生成CaCO 3 C 施肥时,草木灰(有效成分为K 2CO 3)不能与NH 4Cl 混合使用K 2CO 3与NH 4Cl 反应生成氨气会降低肥效 DFeCl 3溶液可用于铜质印刷线路板制作FeCl 3能从含有Cu 2+的溶液中置换出铜9.已知分解1 mol H 2O 2放出热量98 kJ 。
在含少量I -的溶液中,H 2O 2分解的机理为:H 2O 2+I -→H 2O+IO -(慢) H 2O 2+IO -→ H 2O+O 2 + I -(快) 以下有关该反应的说法正确的选项是〔 〕A .反应速率与I -浓度有关 B .IO -也是该反应的催化剂 C .反应活化能等于98 kJ/mol D .υ(H 2O 2)=υ(H 2O)=υ(O 2)10.X 、Y 、Z 均为短周期元素,X 、Y 处于同一周期,X 、Z 的最低价离子分别为X 2-和Z -,Y +和Z -具有相同的电子层结构。
以下说法正确的选项是〔 〕A .原子最外层电子数:X >Y >ZB .单质沸点:X >Y >ZC .离子半径:X 2->Y +>Z-D .原子序数:X >Y >Z11.溴酸银(AgBrO 3)溶解度随温度变化曲线如下图,以下说法错误的选项是〔 〕A .溴酸银的溶解是放热过程B .温度升高时溴酸银的溶解速度加快C .60℃时溴酸银的Ksp 约等于6×10-4D .假设硝酸银中含有少量溴酸银,可用重结晶方法提纯 12.以下有关仪器使用方法或实验操作正确的选项是〔 〕A .洗净的锥形瓶和容量瓶可以放进烘箱中烘干B .酸式滴定管装标准溶液前,必须用溶液润洗C .酸碱滴定实验中,用待滴定溶液润洗锥形瓶以减小实验误差2016~2017高三年级 2014年高考理综化学全国I 卷班级 学号化学老师为你加油!高考必胜!历年高考回忆 今年胸有成竹D.用容量瓶配标准溶液时,假设加水超过刻度线,立即用滴管吸出多余的液体13.利用右图所示装置进行以下实验,能得出相应实验结论的是〔〕选项①②③实验结论A 稀硫酸Na2S AgNO3与AgCl的浊液K sp(AgCl)>K sp(Ag2S)B 浓硫酸蔗糖溴水浓硫酸具有脱水性、氧化性C 稀盐酸Na2SO3Ba(NO3)2SO2与可溶性钡盐均可生成白色沉淀D 浓硝酸Na2CO3Na2SiO3溶液酸性:硝酸>碳酸>硅酸26.〔13分〕乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。
2014年高考新课标全国2卷理科综合化学精编精校收藏版

2014年高考新课标全国2卷理科综合化学精编精校收藏版DC. △H1+△H3=△H2D. △H1+△H2>△H326.(13分)在容积为 1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)2NO2(g),随温度升高,混合气体的颜色变深。
回答下列问题:(1)反应的△H 0(填“大于”或“小于”);100℃时,体系中各物质浓度随时间变化如上图所示。
在0~60s时段,反应速率υ(N2O4)为mol•L-1•s-1;反应的平衡常数K1为。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020mol•L-1•s-1的平均速率降低,经10s后又达到平衡。
①T 100℃(填“大于”或“小于”),判断理由是。
②列式计算温度T时反应的平衡常数K2。
(3)温度T时反应达平衡后,将反应容器的容积减少一半。
平衡向(填“正反应”或“逆反应”)方向移动,判断理由是。
27.(15分)铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等,回答下列问题:(1)铅是碳的同族元素,比碳多4个电子层。
铅在元素周期表的位置为第周期、第族;PbO2的酸性比CO2的酸性(填“强”或“弱”)。
(2)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为。
(3)PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为;PbO2也可以通过石墨为电极,Pb(NO 3)2和Cu(NO 3)2的混合溶液为电解液电解制取。
阳极发生的电极反应式为 ,阴极上观察到的现象是 ;若电解液中不加入Cu(NO 3)2,阴极发生的电极反应式为 ,这样做的主要缺点是 。
(4)PbO 2在加热过程发生分解的失重曲线如下图所示,已知失重曲线上的a 点为样品失重4.0%(即-×100%a 样品起始质量点固体质量样品起始质量)的残留固体,若a 点固体组成表示为PbO χ或mPbO 2•nPbO ,列式计算χ值和m:n 值 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
下午
H4-2
H4-1
H4-4
H4-3
上午
H4-3
H4-4
H4-1
H4-2
下午
H4-4
H4-3
H4-2
H4-1
10-11周星期五H5
上午
H5-1
H5-2
H5-3
H5-4
下午
H5-2
H5-1
H5-4
H5-3
上午
H5-3
H5-4
H5-1
H5-2
下午
H5-4
H5-3
H5-2
H5-1
12-13周星期五H6
2014级综合化学实大验循环表
周次/星期
1生化
2仪分
3高分子
4有机
5综合
6化学信息学
2
星期五
化学全年级综合实验星期五讲座
3,4周
星期五
H1
H2
H3
H4
H5
H6
6,7周
星期五
H2
H3
H4
H5
H6
H1
8,9周
星期五
H3
H4
H5
H6
H1
H2
10,11周
星期五
H4
H5
H6
H1
H2
H3
12,13周
星期五
H5
H6
2014级综合化学实验课表(2017年9-12月)
周/
星期
组名
实验名称
学时
人数
教师
实验室
预备
2 /五
1.综合实验讲座
143
杨正银
张
世
平
三
到
十
六
周
星
期
五
全
天
(9:00
-5:00)
有机
2.槐花米中芦叮的提取、分离及纸层析,芦叮水解制备槲皮素及UV分析
8
143
许主国
1023
3. 2.7-羟基-4-甲基香豆素的合成
H1
H2
H3
H4
14,15周
星期五
H6
H1
H2
H3
H4
H5
实验室
1011
1015/1006
1014/1042
1019
1023
1029
பைடு நூலகம்1033
仪分实验小循环表
实验室门牌号
1015
TG-DTA
1014
液相色谱
1006
电分析
1042
原子吸收
3-4周星期五
H2
上午
H2-1
H2-2
H2-3
H2-4
下午
H2-2
H2-1
H2-4
H2-3
上午
H2-3
H2-4
H2-1
H2-2
下午
H2-4
H2-3
H2-2
H2-1
6-7周星期五
H3
上午
H3-1
H3-2
H3-3
H3-4
下午
H3-2
H3-1
H3-4
H3-3
上午
H3-3
H3-4
H3-1
H3-2
下午
H3-4
H3-3
H3-2
H3-1
8-9周星期五
H4
上午
H4-1
H4-2
H4-3
上午
H6-1
H6-2
H6-3
H6-4
下午
H6-2
H6-1
H6-4
H6-3
上午
H6-3
H6-4
H6-1
H6-2
下午
H6-4
H6-3
H6-2
H6-1
14-15周星期五H1
上午
H1-1
H1-2
H1-3
H1-4
下午
H1-2
H1-1
H1-4
H1-3
上午
H1-3
H1-4
H1-1
H1-2
下午
H1-4
H1-3
H1-2
8
143
刘兴妤
1019
10乙酸乙烯酯的溶液聚合
8
143
王宝燕
1019
仪分
11.TG-DTA分析乙二胺钴配合物
7
143
黄勇
1015
茶叶中咖啡因
及无机微量元
素的测定
12液相色谱
7
143
刘晓燕
1014
13电分析
7
143
杜永令
1006
14原子吸收光谱
7
143
周雷
1042
化信
息学
15 Chemwin
8
97
张晓昀
H1-1
1033
16 SCI检索
8
46
姚小军
1033
总学时
108
说明:化学1,2、3和基地1,2班分成H1、H2、H3、H4、H5,H6六组大循环做完综合化学实验。各组在仪分实验再分成H1-i,H2-i,H3-i,H4-i,H5-i和H6-i(i=1.2.3.4)共24个小组小循环做完仪分实验。18周前将成绩报实验主讲杨正银。
8
143
靳军
1023
综合
4.乙二胺合钴配合物的合成及对映体拆分
8
143
习聘贤
1029
5.配合物的合成及分光化学序测定
8
143
邬金才
1029
6.配合物的旋光和磁性分析
8
143
杨正银
1022
生化
7溶菌酶的分离纯化
8
143
房建国
1011
8动物肝脏DNA的提取与检测
8
143
李天荣
1011
高分子
9苯乙烯的悬浮聚合
