饱和甘汞电极的电解液
Ce3+Ce4+氧化还原反应的循环伏安测试实验

Ce 3+/Ce 4+氧化还原反应的循环伏安测试实验铈(Ce )是我国较丰富的稀土资源之一。
Ce 在溶液中以Ce 3+、Ce 4+ 等不同价态的离子存在。
Ce 3+/Ce 4+构成氧化还原对,其标准还原电位较高(E= 1.715 V )。
从热力学的角度出发,铈的可溶盐的溶液可以作为高能氧化还原电池的正极材料。
有两个因素限制了铈在这方面的开发应用:(1)Ce 在水溶液中的溶解度较低;(2)与其相匹配的负极电解液的确定。
对此,近来在国外已取得了一些突破。
用甲基磺酸(MSA )配制铈的电解液已获得较为满意的溶解度。
此外,用Zn ,Cr 2+,V 2+,Ti 3+ 作负极材料也显示可行。
从我国的资源利用及技术可行性出发,尽快开展以铈为正极材料的研究开发具有重要的意义。
循环伏安法是一种经典的电化学研究方法, 其工作原理涉及电化学领域多方面的较为成熟的理论。
这种测试对设备没有特殊要求,且实验操作简便。
.测试结果可以提供有关反应机理和反应动力学的丰富的信息。
在本实验中,学生将在教师的指导下,运用循环伏安等方法研究Ce 3+/Ce 4+在电极上的氧化还原反应机理和动力学。
通过实验工作,学生有机会运用电化学的基本理论知识,处理实际问题,并能亲身领略化学电源的前沿科研课题。
一、实验目的与要求在第一部分实验中,学生运用循环伏安方法对快速、可逆反应:--+ N )(([ ↔e ])C III Fe ])[Fe(II)(CN 36-46进行测定,并作数据处理。
初步掌握循环伏安方法的运用,从实验结果获取有关反应行为的信息, 巩固有关电极反应可逆性、反应速率、反应动力学等电化学基本概念。
在第二部分实验中,学生运用循环伏安方法研究Ce 3+/Ce 4+在电极上反应的动力学和机理;组装并测试电池的性能。
初步掌握氧化还原电池的基本概念及结构,电池基本性能的测试方法。
了解氧化还原概念与结构,以及国内外在这方面的最新进展。
要求:① 学生复习电化学,循环伏安法的基本原理;② 上网或通过其他途径,查阅有关稀土铈的物理化学性质,资源及应用现状;③ 了解氧化还原电池的基本原理、基本结构以及研究开发的最新进展。
电极的极化和极化曲线_极化曲线

文章编号:100123849(2008)0720029206 电极的极化和极化曲线( )①——极化曲线覃奇贤, 刘淑兰(天津大学化工学院,天津 300072)Polar ization of Electrode and Polar ization Curve ( )(the end )——Polar ization CurveQ I N Q i 2x ian ,L I U Shu 2lan3 电极电位的测量311 液体接界电位1)定义 两种组成不同、浓度不同或者组成及浓度均不相同的电解液相接触时,在界面上产生的电位差,叫做液体接界电位,以E j 表示。
2)产生原因 当两种组成不同、浓度不同或者组成及浓度均不相同的电解液相接触时,由于两相中相同离子或不同离子存在浓度梯度,必然发生扩散,达稳态时,在两相界面间形成了双电层,双电层所具有的电位差就是液体接界电位。
3)液体接界电位的消除 液体接界电位是不可逆成分,原电池中存在液体接界电位,使原电池电动势的数值丧失热力学意义。
因此在电极电位的测量中必须设法消除或者是将其减到最小。
最常用的方法是采用盐桥,将液体接界电位减到最小。
盐桥实际上是将两种不同溶液隔开的中间溶液,该溶液的浓度很高(一般采用饱和溶液),而且所含正离子与负离子的迁移数比较接近,最常用的是饱和KC l 溶液。
当饱和的KC l 溶液与两种不同溶液相接触时,接界处的电位差主要是由KC l 的扩散产生的,在两个相界面形成的液体接界电位比原来的数值小得多,而且符号相反,因此总的数值将更小。
值得注意的是,盐桥中的溶液不应与原电池中的电解液发生反应,例如待测溶液为A gNO 3溶液,则不能选用KC l 盐桥。
通常用做盐桥的电解质还有KNO 3和N H 4NO 3。
312 电极电位的标度在电极电位的定义中规定,以标准氢电极为负极,待测电极为正极组成原电池,测得该原电池的电动势,叫做待测电极的电极电位,如手册中[1]给出的标准电极电位就是氢标电极电位。
电化学体系三电极介绍

•电化学体系三电极介绍所有电化学体系至少含有浸在电解质溶液中或紧密附于电解质上的两个电极,而且在许多情况下有必要采用隔膜将两电极分隔开。
我们将分别介绍电极、隔膜、电解质溶液及电解池的设计与安装。
电极(electrode)是与电解质溶液或电解质接触的电子导体或半导体,为多相体系。
电化学体系借助于电极实现电能的输入或输出,电极是实施电极反应的场所。
一般电化学体系分为二电极体系和三电极体系,用的较多的是三电极体系。
相应的三个电极为工作电极、参比电极和辅助电极。
工作电极: 又称研究电极,是指所研究的反应在该电极上发生。
一般来讲,对工作电极的基本要求是:工作电极可以是固体,也可以是液体,各式各样的能导电的固体材料均能用作电极。
(1) 所研究的电化学反应不会因电极自身所发生的反应而受到影响,并且能够在较大的电位区域中进行测定; (2) 电极必须不与溶剂或电解液组分发生反应; (3) 电极面积不宜太大,电极表面最好应是均一平滑的,且能够通过简单的方法进行表面净化等等。
工作电极的选择:通常根据研究的性质来预先确定电极材料,但最普通的“惰性”固体电极材料是玻碳(铂、金、银、铅和导电玻璃)等。
采用固体电极时,为了保证实验的重现性,必须注意建立合适的电极预处理步骤,以保证氧化还原、表面形貌和不存在吸附杂质的可重现状态。
在液体电极中,汞和汞齐是最常用的工作电极,它们都是液体,都有可重现的均相表面,制备和保持清洁都较容易,同时电极上高的氢析出超电势提高了在负电位下的工作窗口记被广泛用于电化学分析中。
辅助电极:又称对电极,辅助电极和工作电极组成回路,使工作电极上电流畅通,以保证所研究的反应在工作电极上发生,但必须无任何方式限制电池观测的响应。
由于工作电极发生氧化或还原反应时,辅助电极上可以安排为气体的析出反应或工作电极反应的逆反应,以使电解液组分不变,即辅助电极的性能一般不显著影响研究电极上的反应。
但减少辅助电极上的反应对工作电极干扰的最好办法可能是用烧结玻璃、多孔陶瓷或离子交换膜等来隔离两电极区的溶液。
极化曲线的测定
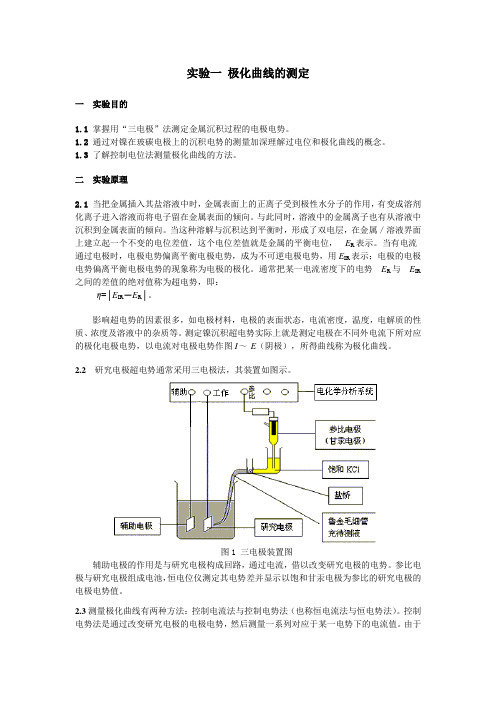
实验一极化曲线的测定一实验目的1.1掌握用“三电极”法测定金属沉积过程的电极电势。
1.2 通过对镍在玻碳电极上的沉积电势的测量加深理解过电位和极化曲线的概念。
1.3 了解控制电位法测量极化曲线的方法。
二实验原理2.1当把金属插入其盐溶液中时,金属表面上的正离子受到极性水分子的作用,有变成溶剂化离子进入溶液而将电子留在金属表面的倾向。
与此同时,溶液中的金属离子也有从溶液中沉积到金属表面的倾向。
当这种溶解与沉积达到平衡时,形成了双电层,在金属/溶液界面上建立起一个不变的电位差值,这个电位差值就是金属的平衡电位,E R表示。
当有电流通过电极时,电极电势偏离平衡电极电势,成为不可逆电极电势,用E IR表示;电极的电极电势偏离平衡电极电势的现象称为电极的极化。
通常把某一电流密度下的电势E R与E IR 之间的差值的绝对值称为超电势,即:η=│E IR-E R│。
影响超电势的因素很多,如电极材料,电极的表面状态,电流密度,温度,电解质的性质、浓度及溶液中的杂质等。
测定镍沉积超电势实际上就是测定电极在不同外电流下所对应的极化电极电势,以电流对电极电势作图I~E(阴极),所得曲线称为极化曲线。
2.2研究电极超电势通常采用三电极法,其装置如图示。
图1 三电极装置图辅助电极的作用是与研究电极构成回路,通过电流,借以改变研究电极的电势。
参比电极与研究电极组成电池,恒电位仪测定其电势差并显示以饱和甘汞电极为参比的研究电极的电极电势值。
2.3测量极化曲线有两种方法:控制电流法与控制电势法(也称恒电流法与恒电势法)。
控制电势法是通过改变研究电极的电极电势,然后测量一系列对应于某一电势下的电流值。
由于电极表面状态在未建立稳定状态前,电流会随时间改变,故一般测出的曲线为“暂态”极化曲线。
本实验采用控制电势法测量极化曲线:控制电极电势以较慢的速度连续改变,并测量对应该电势下的瞬时电流值,以瞬时电流对电极电势作图得极化曲线。
图2 阴极极化曲线三仪器与试剂LK98A微机电化学分析系统一台;甘汞电极一枝;铂电极一枝;玻碳电极一枝;100ml 烧杯3个,500ml烧杯1个;瓦特型镀镍液50ml;稀硝酸50ml;乙醇50ml;蒸馏水500ml。
孝义煤电化学脱硫研究__电解体系的研究

第25卷第2期燃 料 化 学 学 报V o l125 N o12 1997年4 月JOU RNAL O F FU EL CH E M ISTR Y AND T ECHNOLO GY A p r1 1997孝义煤电化学脱硫研究Ξ1电解体系的研究刘旭光 李 静 巩志坚 王志忠(太原工业大学,太原030024)摘 要 对孝义煤在不同电解体系中的脱硫率进行了考察。
对不同电解气氛和不同助剂的影响进行了研究。
发现N aOH和H2SO4均是较好的脱硫体系,C l对电解脱硫有明显的促进作用,但对煤质的破坏程度很大。
对煤的电解脱硫规律的研究表明,碱性体系中的电解反应为包括脱硫反应的综合反应,对煤为一级,表观活化能为41188kJ mo l。
关键词 煤,电解,脱硫煤的电化学脱硫技术既能克服物理法、化学法、生物法等[1]脱硫方法中的缺点,又能达到较好的脱硫效果,正在引起煤化学专家们的兴趣。
这一技术是借助于煤在电解槽中发生的氧化或还原反应,将黄铁矿硫和有机硫转化为水溶性硫化物而达到脱硫的目的。
Sternberg等[2,3]曾经于六十年代对煤的电解还原脱硫进行过研究,认为只有在多数芳环加氢之后才可能脱硫。
七十年代以后,L alvan i等对煤的氧化脱硫等进行了大量研究[4~10],并取得了很好的效果。
本文即是在此基础上,探讨适合山西煤电解脱硫的适宜体系和适宜条件。
1 实 验111 原料和试剂 实验所用两种煤样分别取自孝义东风煤矿(D F coal)和王家湾煤矿(W J coal)。
其元素分析、热值和硫分布分别见表1和表2。
表1 煤样的元素分析和热值T able1 U lti m ate analysis and calo rific value of coal samp lesSamp leContent %C H NTo tal sulfurQkJ kgD F coal W J coal 77168781754111514611111131314401923160032010 实验所用化学试剂均为分析纯,水为蒸馏水。
电化学测量技术实验报告

实验报告课程名称:电化学测试技术实验地点:材料楼417同实验者:管先统SQ10067034010朱佳佳SQ10067034007吴佳迪SQ10068052038杨小艳SQ10068052028实验一铁氤化钾的循环伏安测试一、实验目的1.学习固体电极表面的处理方法;2.掌握循环伏安仪的使用技术;3.了解扫描速率和浓度对循环伏安图的影响。
二、实验原理铁氤化钾离子[Fe (CN) 6广亚铁氧化钾离子[Fe (CN) 6厂氧化还原电对的标准电极电位为[Fe (CN) 6]3- + e= [Fe (CN) 6广(I)°= 0. 36V电极电位与电极表面活度的Nernst方程式为RT/Fln(C Ox/CRed) 在一定扫描速率下,从起始电位(-0. 2V)正向扫描到转折电位(+0.8V)期间,溶液中[Fe (CN)胪被氧化生成[Fe (CN) 6]3',产生氧化电流;当负向扫描从转折电位(+0. 6V)变到原起始电位(-0. 2V)期间,在指示电极表面生成的[Fe (CN) 6产被还原生成[Fe(CN)J",产生还原电流。
为了使液相传质过程只受扩散控制,应在加入电解质和溶液处于静止下进行电解。
在0. 1MN&C1溶液中[Fe (CN) 的电子转移速率大,为可逆体系(1MN&C1溶液中,25°C时,标准反应速率常数为5. 2 X 10': cm2s_1; ) o三、仪器和试剂电化学分析系统;钳盘电极:釦柱电极,饱和甘汞电极:电解池:容量瓶。
0. 50mol ・ L_1 K3[Fe (CN) J; 0. oOmol ・ I? K;[Fe (CN) 6] ; 1 mol ・ I? NaCl四、实验步骤1.指示电极的预处理钳电极用A1O 粉末(粒径0. 05Mm)将电极表面抛光,然后用蒸镭水清洗。
2. 支持电解质的循环伏安图在电解池中放入0. 1 mol ・I? NaCl 溶液,插入电极,以新处理的钮电极为 指示电极,钳丝电极为辅助电极,饱和甘汞电极为参比电极,进行循环伏安仪设 定;起始电位为-0. 2V :终止电位为+0.6V 。
溶液中--Ag_AgCl高温参比电极的制备_张清

文章编号:1009-671X(2005)06-0062-02Ag/AgCl 高温参比电极的制备张 清1,李 萍2,白真权3(1.河南科技大学材料科学与工程学院,河南洛阳471003;2.洛阳工业高等专科学校建筑工程系,河南洛阳471003;3.中国石油天然气集团公司石油管材研究所,陕西西安710065)摘 要:在对美国Cortest 公司设计的A g/A gCl 参比电极进行改进的基础上,采用电解法制备了一种内置式Ag /AgCl 参比电极,对其进行了性能测试,并用其对油管钢N 80的高温高压腐蚀行为多次进行了测试研究.结果表明,该参比电极具有重现性好、可逆性好、响应时间短、内阻小等优良性能,且在高温高压条件下工作性能稳定,测试曲线理想,可用于高温高压电化学研究.关键词:Ag/AgCl 参比电极;电解;制备中图分类号:T G145 文献标识码:A收稿日期:2004-12-28.项目资助:中国石油天然气集团公司石油管材研究所基金资助项目(23-524);河南科技大学科研基金资助项目(200101).作者简介:张 清(1974-),男,硕士研究生,主要研究方向:油田腐蚀与防护.Preparation of an elevated temperature Ag/AgCl reference electrodeZHANG Qing 1,LI Ping 2,BAI Zhen_quan 3(1.School of M ater ials Science and Engineer ing ,Henan U niversity of Science and T echnology ,Luoyang 471003,China; 2.Depar t -ment of Architectur e Eng ineering,Luoyang College of T echnology ,Luoy ang 471003,China; 3.T ubular G oo ds Research Center,China N ational Petro leum Corporation,Xi an 710065,China)Abstract:On the basis of the improvement of Ag/AgCl reference electrode of Cortest Company in America,the internal Ag/Ag Cl reference electrodes w ere prepared by means of electrolyzing.T heir features w ere tested and the corrosion behavior of tubular steel N80under hig h temperature and high pressure w ere studied w ith them.T he results show that it has such outstanding features as good reproducibility and reversibility ,short response time and sm all resistance.The new electrodes worked stably and ideal test curves were obtained under high tem -perature and high pressure,and c ould be used in electrochemic al research under high temperature and high pre ssure.Keywords:Ag/AgCl reference electrode;electrolyzing;preparation 为了研究油气钻采设备及石油化工设备在高温高压下的电化学腐蚀机理,模拟油气田高温高压环境下的电化学测试工作愈来愈引起腐蚀科技工作者的重视.高温高压下的电化学测试,一个主要的问题是高温参比电极的制备,目前国内尚未较好地解决这个问题.甘汞电极在室温下使用最广泛,但在温度高于60 时性能不稳定;氢电极在理论上已得到充分研究,但其应用受到很多限制,使用起来很不方便;Ag /AgCl 电极具有制备简单、稳定性好、没有滞后、使用方便等优点,是高温高压电化学研究最理想的参比电极[1].中国石油天然气集团公司石油管材研究所引进了美国Cortest 公司设计的内置式Ag/Ag Cl 参比电极,它由一个很长的聚四氟乙烯管作为盐桥,通过一个不等温的电解液桥与高温区域连通,由于电解液桥温度梯度的存在,所测电位包含了一个由热扩散引起的成分,从而导致在高温高压釜中进行模拟测试时,所得的测试结果稳定性差.假如这一成分不随时间改变,而是一常数,那么就如M ckie [2]和Danie-lson [3]所述,所测电位很容易转化为氢标电位.本文对这一参比电极系统进行改进,成功地制备了Ag/AgCl 高温参比电极,为建立稳定完善的高温高压电化学测试系统奠定了基础.1 A g/AgCl 参比电极的制备1.1 活性元件的制备Ag/AgCl 电极的制备一般有3种方法:直接氯化法、电解氯化法和热分解氯化法.采用电解法制取第32卷第6期 应 用 科 技 V ol.32, .62005年6月 AppliedScience and Technology Jun.2005的Ag/Ag Cl电极对光的敏感性小,不易分解,常用来制备作为内置式参比电极的Ag/Ag Cl电极.本文采用电解法在银表面制备氯化银薄膜,步骤如下:1)对纯度为99.99%的银丝进行表面预处理,包括除去表面硫化物、除油、活化和清洗等;2)以铂电极作为辅助电极与电源负极连接,处理好的银丝与电源正极连接;3)把银丝与铂电极置于25 下1N HCl溶液中,通4mA直流电3h,氯化过程中需不断摇动银丝;4)电解氯化结束后,检验氯化效果是否合格:银丝表面应为灰色致密的AgCl膜层,均匀而无明显的斑点;在0.1N KCl溶液中与饱和甘汞电极的电位差至少应为35mV,否则应重新氯化;5)按以上方法制备3个Ag/AgCl电极,并将所有电极连接在一起,室温下置于0.1N KCl溶液中;6)浸渍24~48h后,使用高阻抗的PZ286型数字电压表测量任意一对电极之间的电位差,应小于1mV;如果差值太大,将两者短路后再置于0 1N KCl溶液中,24~48h后再测其差值,如果仍大于1m V,需磨去氯化膜,重新氯化.1.2 电极内室的填充Ag/Ag Cl参比电极内室设计为双连接形式,两端均有塞子,一端为聚四氟乙烯塞子,另一端为氧化锆陶瓷隔膜,从一端到另一端依次为聚四氟乙烯塞子、饱和KCl溶液、尼龙绳、氧化锆陶瓷隔膜、饱和KCl溶液、氧化锆陶瓷隔膜,Ag/AgCl电极与聚四氟乙烯塞子连接在一起.该结构可有效地避免活性元件Ag/Ag Cl受到污染.填充电极内室时,应首先移去两端的塞子,利用长针管小心填充内室,排除气泡后,将两端的塞子塞回,确保与聚四氟乙烯管紧密接触.电极内室的填充应注意以下3点:1)电解液必须经过除氧处理,因为在酸性溶液中Ag/AgCl电极对痕量的氧是非常敏感的;2)电解液为饱和KCl溶液,可有效地避免低浓度KCl溶液容易出现的不稳定现象;3)AgCl在饱和KCl溶液中的溶解度很大,是在1N KCl溶液中的65倍,因此需在电极内室的KCl 溶液中预先加入少量AgCl粉末,使其达到饱和,避免电极氯化层的溶解,从而保证其性能.2 Ag/AgCl参比电极的性能制得的Ag/Ag Cl电极是否可以作为参比电极,除了测量该电极与饱和甘汞电极之间的电位差外,还应测试该电极的其他一些性能,如重现性、可逆性、响应时间等,从而对参比电极进行综合评价.经测试,室温下该电极与饱和甘汞电极之间的电位差为44mV,多次测量基本一致,说明该电极的稳定性与重现性好;施加+10m V电压进行循环微极化时,正反向曲线几乎完全重合,而且线性度非常好,说明该电极具有很好的可逆性;在室温下插入0.1N KCl溶液中,5s后即可达到稳定,从0.1N KCl溶液中转到1N KCl溶液或饱和KCl溶液中,达到稳定的时间也不超过10s,说明该电极的响应时间极短;该电极内阻不到1000 ,内阻相当小.用该电极在高温高压釜中对油管钢N80的高温高压腐蚀行为多次进行极化曲线和交流阻抗测试,结果表明,该电极在高温高压条件下工作性能稳定,测试曲线理想,可用于高温高压电化学研究[4~6].3 结 论1)在对美国Cortest公司设计的Ag/Ag Cl参比电极进行改进的基础上,选用高纯度银丝,经过严格处理,采用电解法成功制得Ag/AgCl电极.2)性能测试结果表明,制得的Ag/AgCl高温参比电极具有重现性好、可逆性好、响应时间短、内阻小等优良性能.3)用制得的Ag/Ag Cl高温参比电极对油管钢N80的高温高压腐蚀行为多次进行了测试,结果表明,该参比电极在高温高压条件下工作性能稳定,测试曲线理想,可用于高温高压电化学研究.参考文献:[1]金兆法,刘华堂,周锦义.Ag/AgCl高温参比电极的试制[J].中国腐蚀与防护学报,1981,1(2):53-56.[2]M CIK E A S.Hig h temperature high pr essure electr o-chemistry in aqueous solutions[M].Houston:NA CE, 1979.[3]DA NI EL SO N M J.Application of linear polarization tech-nique to the measur ement of corrosion rates in simulated geother mal brines[R].Battelle M emorial Institute,U.S.Department of Energ y,1980.[4]周计明.油管钢在含CO2/H2S高温高压水介质中的腐蚀行为及防护技术的作用[D].西安:西北工业大学, 2002.[5]任呈强.N80油管钢在含CO2/H2S高温高压两相介质中的电化学行为及缓蚀机理研究[D].西安:西北工业大学,2003.[6]张 清.CO2/H2S共存条件下的油管钢腐蚀规律研究[D].洛阳:河南科技大学,2004.[责任编辑:李玲珠]63第6期 张 清,等:Ag/AgCl高温参比电极的制备。
氧化锌的XRD和TG—DTA分析

depositiontime,electrolyteconcentra—
tionandsolutiontemperatureonthecompositionandstructureofthefilms.
20
(a)Ⅺ图
Zn(OH),而XRD未检测出的原因是,它是无定型的或超出
了XRD的检测限.
表1列出了ZnO的3个主峰在不同温度下的粒径(由
图6不同电解液温度下所得产物的XRDandTGA图
t=15min,Currentdensity=10mA/cmI[Zn(NO3)2]=0.1M
谢乐公式算出).可见,由45℃升到65℃时,这三个晶面的
窄,晶粒越大,结晶度越高.根据谢乐方程D=0.9A//3cos0计
算晶粒大小.D是晶粒的粒径,A是x射线的波长,0是布拉
格角,口是半高宽.算出了(100)晶面在三种电流密度a,b,C
下的粒径分别为13.7nm,14.4rim,17.1rim.由此可知晶粒
是随电流密度的增大而增大的.这是因为电流密度增加,电
AnalysisaboutZincOxideWithXRDandTG——DTA
ZHANGYongqiang,LIYong
(DepartmentofChemistry,HenanInstituteofEducation,Zhengzhou450046,China)
Abstract:ZnOthinfilmwaspreparedoncathodebyusinggalvanostaticelctrodepositiontechnique.Discussedthe
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
饱和甘汞电极的电解液
饱和甘汞电极的电解液是一种应用广泛的电解质溶液,其在电化学领域中有着重要的作用。
本文将对饱和甘汞电极的电解液进行详细介绍。
一、什么是饱和甘汞电极的电解液
饱和甘汞电极的电解液是由氯化铵和氯化汞混合而成的溶液,是一种强电解质。
该电解液在常温下呈现为无色透明的液体,能够在电化学反应中扮演重要的角色,被广泛应用于化学分析、电池、电解等领域。
1. 饱和甘汞电极的电解液具有强电解性和高离子导电性,能够快速地传递电子和离子,从而在电化学反应中发挥重要作用。
2. 该电解液的氯离子浓度较高,容易与水分子结合形成氯化氢气体,因此在使用过程中需要注意安全。
3. 该电解液在高温和阳光下易发生爆炸,因此在储存和使用过程中需要注意安全。
4. 该电解液的pH值较低,对金属具有一定的腐蚀性,需要注意使用时的保护措施。
三、饱和甘汞电极的电解液的应用
1. 电化学分析:饱和甘汞电极的电解液可以作为电化学分析中的参比电极,用于测定电极电位和电化学反应的动力学参数。
2. 电化学合成:该电解液可以作为电化学合成中的电解质,用于电沉积、电还原等反应。
3. 电池:该电解液可以作为电池中的电解液,用于制造铅酸电池、锌碱电池等。
4. 电解:该电解液可以作为电解中的电解质,用于铝电解、氯碱电解等反应。
四、饱和甘汞电极的电解液的注意事项
1. 在使用过程中需要注意安全,避免直接接触和吸入电解液。
2. 在储存过程中需要放置在阴凉、干燥的地方,避免受潮和受热。
3. 在使用过程中需要注意保护措施,避免对金属产生腐蚀。
4. 在废弃电解液时需要进行专门处理,避免对环境造成污染。
饱和甘汞电极的电解液是一种重要的电解质溶液,在电化学领域中具有广泛的应用。
使用时需要注意安全和保护措施,避免对人体和环境造成伤害和污染。
