化学平衡常数及分配系
77 实验七十七 化学平衡常数及分配系数的测定

77实验七十七化学平衡常数及分配系数的测定摘要碘化钾与单质碘反应生成三碘化钾的平衡常数测定是一个经典的物理化学实验。
该实验的测定过程是一个纯化学滴定实验,装置简单,易于操作。
但在长期教学实践中,我们发现学生的一些操作易产生误差。
本文结合我们的教学经验探讨一下相关问题及改进方法,同时对实验的绿色化提出一些建议。
关键词化学平衡常数分配系数实验教学绿色化学实验化学平衡常数及分配系数测定实验是一个经典的物理化学实验,测定I2在CCl4和H2O中的分配系数k以及反应I2+KI=KI3的平衡常数KC。
本实验涉及到的操作为标准的硫代硫酸钠溶液标定单质碘。
通过该实验可以帮助学生更好地理解分配系数的物理意义和化学平衡常数的测定方法。
该实验设计思路清晰,易于操作,但是由于学生操作不当,会使实验结果误差很大;同时该实验内容未能及时更新,与当前绿色化学理念相左,因此结合我们长期的教学与管理实践经验,对该实验中存在的一些问题进行讨论,并对这些问题提出一些改进建议。
一、实验方法设计思路在恒温、恒压下I2和KI在水溶液中建立如下平衡:为了测定平衡常数,应在不扰动平衡状态的条件下,测定平衡组成。
当上述反应达到平衡时,用Na2S2O3标准溶液来滴定溶液中I2的浓度,随着I2的消耗,平衡向左移动,使KI3持续分解,最终只能测得溶液中I2和KI3的总量。
由于KI和KI3均不溶于CCl4,只有I2既可溶于CCl4也可溶于H2O,当温度和压力一定时,上述化学平衡及I2在CCl4层和H2O 层中的分配平衡同时建立。
为了测定上述体系I2的平衡浓度,本实验首先设计一个实验,即体系中没有KI存在,只有I2在CCl4及H2O中的分配平衡,测定I2在CCl4和H2O中平衡浓度,利用下式求出实验温度下I2在两液相中的分配系数k。
由于分配系数只是温度的函数,当温度不变时,分配系数为常数。
利用已测出的分配系数,来计算分配平衡和化学平衡都存在的体系中水层I2的平衡浓度,然后可求出KI3和KI的平衡浓度。
【精品】实验七十七化学平衡常数及分配系数的测定

【精品】实验七十七化学平衡常数及分配系数的测定实验目的:1. 测定化学平衡常数Kc 2. 测定分配系数Kd
实验原理:该实验利用固定体系的特点:在恒定的温度和压力下,浓度的发生可以被
描述为一个恒定的化学平衡常数Kc。
此外,如果物质之间由不同相中互相分配,则可以定义出分配系数Kd。
实验材料:1. 无水氯化钠溶液 2. 0.1M HCl溶液 3. 0.3M NaCl溶液
实验步骤:
(1)准备实验用液体:将50ml的无水氯化钠溶于50ml的蒸馏水后配制成0.1M的氯
化钠溶液,并分别配制出0.1M的HCl溶液、0.3M的NaCl溶液。
(2)进行反应:58ml的HCl溶液加入到50ml的NaCl溶液中,搅拌均匀,放置20分钟。
(3)测量溶液中的浓度:用分光光度计测量混合液中的浓度,记录。
(4)算出Kc:根据浓度得出Kc,即Kc=([HCl]^2-[NaCl]^2)/([NaCl]*[Cl-]^2) 。
(6)数据分析:计算得出的Kc和Kd的绝对值,并比较和理论值的差距,得出实验
结论。
实验结论:本次实验采用定容、定温及固定压力的场景,得出了搅拌前后溶液中浓度
的变化,从而算出Kc和Kd的绝对值,并与理论值比较,结果达到了理想的误差步骤,实
验完成了预期的任务。
化学平衡常数及分配系数的测定【复习准备】
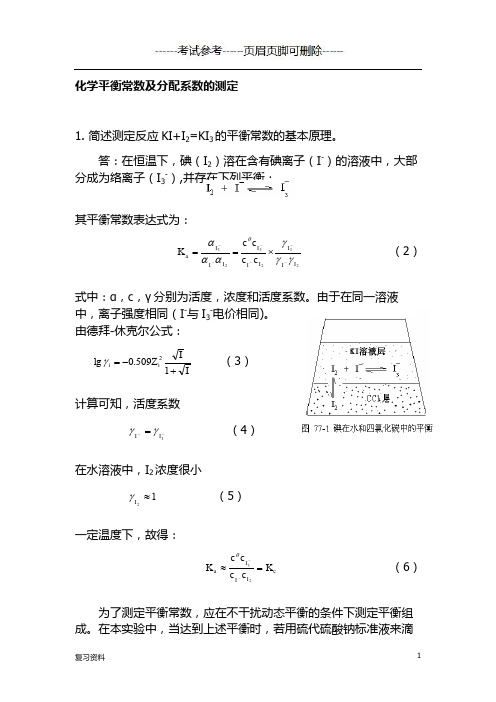
化学平衡常数及分配系数的测定1. 简述测定反应KI+I 2=KI 3的平衡常数的基本原理。
答:在恒温下,碘(I 2)溶在含有碘离子(I -)的溶液中,大部分成为络离子(I 3-),并存在下列平衡:其平衡常数表达式为:232323II II I I II Ia c c c c K γγγαααθ------⨯==(2)式中:α,c ,γ分别为活度,浓度和活度系数。
由于在同一溶液中,离子强度相同(I -与I 3-电价相同)。
由德拜-休克尔公式:II Z i i +-=1509.0lg 2γ (3)计算可知,活度系数--=3I I γγ (4)在水溶液中,I 2浓度很小12≈I γ (5)一定温度下,故得:c I I I a K c c c c K =≈--23θ (6)为了测定平衡常数,应在不干扰动态平衡的条件下测定平衡组成。
在本实验中,当达到上述平衡时,若用硫代硫酸钠标准液来滴定溶液中的I 2浓度,则会随着I 2的消耗,平衡将向左端移动,使I 3-继续分解,因而最终只能测得溶液中I 2和I 3-的总量。
为了解决这个问题,可在上述溶液中加入四氯化碳(CCl 4),然后充分震荡 (I -和I 3-不溶于CCl 4),当温度一定时,上述化学平衡及I 2在四氯化碳层和水层的分配平衡同时建立,如图1所示。
首先测出I 2在H 2O 及CCl 4层中的分配系数K d ,待平衡后再测出I 2在CCl 4中的浓度,根据分配系数,可算出I 2在KI 水溶液中的浓度。
再取上层水溶液分析,得到I 2和I 3-的总量。
()平衡水层水层=,,3232---+I I I I c c c c(7)由于在溶液中I -总量不变,固有:平衡平衡初始=,,,3----I I I c c c (9)因此,将平衡后各物质的浓度代入式(7)就可求出此温度下的平衡常数K c 。
2. 在KI+I 2=KI 3反应平衡常数测定实验中,所用的碘量瓶和锥形瓶哪些需要干燥?哪些不需要干燥?为什么?答:配置2号液的碘量瓶需要干燥,配置1号液的碘量瓶和锥形瓶不需要干燥。
实验七十七 化学平衡常数及分配系数的测定

实验七十七 化学平衡常数及分配系数的测定一、实验目的(1)了解分配定律的应用范围;(2)掌握从分配系数求平衡常数的方法; (3)通过平衡常数计算I 3- 的解离焓。
二、实验原理在一定温度下如果一个物质A 溶解在两种互不相溶的液体溶剂中达到平衡,且A 物质在这两种溶剂中都无缔合作用,则物质A 在这两种溶剂中的活度之比为常数,这就是分配定律。
若浓度较稀,则活度之比近似等于浓度比。
用数学式(1)表示:βαAA d c c K = (1) 式中:c A α为A 物质在溶剂α中的浓度;c A β为A 物质在溶剂β中的浓度;K d 为与温度有关的常数,称为分配系数。
式(1)只能用于理想溶液或稀溶液中,同时,溶质在两种溶剂中分子形态相同,即不发生缔合、离解、络合等现象。
在恒温下,碘(I 2)溶在含有碘离子(I -)的溶液中,大部分成为络离子(I 3-),并存在下列平衡:其平衡常数表达式为:232323II II I I II Ia c c c c K γγγαααθ------⨯==(2)式中:α,c ,γ分别为活度,浓度和活度系数。
由于在同一溶液中,离子强度相同(I -与I 3-电价相同)。
由德拜-休克尔公式:II Z i i +-=1509.0lg 2γ (3)计算可知,活度系数--=3I I γγ (4)在水溶液中,I 2浓度很小12≈I γ (5)一定温度下,故得:c I I I a K c c c c K =≈--23θ (6)为了测定平衡常数,应在不干扰动态平衡的条件下测定平衡组成。
在本实验中,当达到上述平衡时,若用硫代硫酸钠标准液来滴定溶液中的I 2浓度,则会随着I 2的消耗,平衡将向左端移动,使I 3-继续分解,因而最终只能测得溶液中I 2和I 3-的总量。
为了解决这个问题,可在上述溶液中加入四氯化碳(CCl 4),然后充分震荡 (I -和I 3-不溶于CCl 4),当温度一定时,上述化学平衡及I 2在四氯化碳层和水层的分配平衡同时建立,如图1所示。
8 问题 实验七十七 化学平衡常数及分配系数的测定

实验七十七化学平衡常数及分配系数的测定预习提问1、在实验中,所用的碘量瓶和锥形瓶哪些需要干燥?哪些不需要干燥?为什么?答:1、用标准Na2S2O3滴定时所用的锥心瓶,装碘的饱和水溶液的碘量瓶不需要干燥,因为其对碘的物质的量没有影响,不会引起偏差;2、装KI溶液的碘量瓶需要干燥,若有水会影响碘离子的浓度。
2、在实验中,配制1、2号溶液的目的何在?答:1号液是为了求出该温度下碘在水和四氯化碳中的分配系数;2号液是在水中建立碘的化学平衡以及碘在水和四氯化碳中的分配平衡,先通过滴定测出碘在四氯化碳中的浓度,用分配定律求出水层中的碘浓度,再依次算出I 3-和碘离子的浓度,从而求出其化学平衡常数。
3、在实验中,为什么应严格控制恒温?如何控制?答:因为平衡常数和分配系数均与温度有关,所以应严格控制温度。
将配置好的溶液放入恒温水浴槽中。
4、在实验中,需要直接测得哪些实验数据?如何测得?答:恒温水浴温度,常温以及升温后①号液中水层和CCl4层中碘的浓度,②号液中水层和CCl4层中碘的浓度。
用数值式贝克曼温度计测定水温;用硫代硫酸钠标准溶液来滴定溶液中碘的浓度。
5、在实验中,滴定CCl4层样品时,为什么要先加KI 水溶液? 答:加入KI 水溶液是为了加快四氯化碳中的碘完全提出到水层中,加快了滴定速率,有利于硫代硫酸钠滴定的顺利进行。
6、在实验中,如何求得反应达平衡时I 2 、I -、I 3-的浓度? 答:首先根据①号液测出I 2在H 2O 及CCl 4层中的分配系数K d ,然后在根据②号液待平衡后再测出I 2在CCl 4中的浓度,根据分配系数,可算出I 2在KI 水溶液中的浓度。
再取上层水溶液分析,得到I 2和I 3-的总量。
()平衡水层水层=,,3232---+I I I I c c c c由于在溶液中I -总量不变,固有:平衡平衡初始=,,,3----I I I c c c这样就可求得反应达平衡时I 2 、I -、I 3-的浓度。
化学平衡的计算式及其应用

化学平衡的计算式及其应用在化学反应中,化学平衡是指反应物与生成物的浓度达到一个稳定的状态,此时反应速率相等,化学反应不再发生变化。
化学平衡是化学反应中非常重要的概念,它在化学反应的控制和制备化学物品中起着重要作用。
在本文中,我们将讨论化学平衡计算式及其应用。
一、计算式1. 平衡常数平衡常数Kc是化学平衡的关键参数,它是反应物浓度及反应产物浓度的乘积比例的定量表达式。
对于反应A + B = C + D,平衡常数表达式为:Kc = [C][D]/[A][B]。
当反应物和生成物浓度达到平衡时,Kc的值保持不变。
2. 反应商反应商Qc是未达到平衡时的反应物浓度与反应产物浓度的比例,它可用于确定反应是否向某个方向推进。
反应商与平衡常数之间的比较可以告诉我们反应向哪个方向演进。
当Qc小于Kc时,反应会向产物方向移动,而当Qc大于Kc时,反应会向反应物方向移动,直到达到平衡。
二、应用1. 氨与氧当氨和氧进行反应时,会生成一氧化氮和水:4 NH3(g) +5 O2(g) = 4 NO(g) +6 H2O(g)反应的平衡常数可以用以下方程式表示:Kc = [NO]^4[H2O]^6/[NH3]^4[O2]^5如果我们将NH3和O2混合在一起并点燃,它们就会燃烧成尘土,NO和水。
如果我们想判断反应是否到达平衡,可以使用反应商。
假设我们在反应物中的浓度是0.3 M NH3和0.4 M O2,而产物中的浓度是0.1 M NO和0.2 M H2O。
我们可以计算反应商:Qc = [NO]^1[H2O]^2/[NH3]^4[O2]^5 = 0.1 × 0.2^2/(0.3^4 × 0.4^5) = 1.71 × 10^-11接下来,我们可以将Qc与Kc进行比较。
如果Qc小于Kc,这意味着反应物的浓度过高,反应会继续向产物方向推进。
如果Qc大于Kc,则意味着产物过多,反应会向反应物方向移动。
在这种情况下,Qc大于Kc,因此反应将向反应物方向移动,以达到平衡。
化学平衡常数

化学平衡常数化学平衡常数是描述化学反应在平衡态时物质浓度之间的定量关系的指标。
它在化学反应研究中起到了至关重要的作用。
本文将探讨化学平衡常数的定义、计算和应用。
一、化学平衡常数的定义化学平衡常数(Keq)指的是在给定温度下,化学反应在平衡状态时各物质的浓度之间的比值的稳定数值。
对于一般的化学反应:A +B ⇌C + D其平衡常数可以用如下形式表示:Keq = [C][D] / [A][B]其中,[A]、[B]、[C]和[D]分别表示反应中各物质的浓度。
二、化学平衡常数的计算化学平衡常数的计算需要根据反应式和已知条件,利用化学方程式中的系数以及各物质的浓度进行推导。
一般情况下,平衡常数的计算需要满足以下条件:1. 列写化学方程式:根据反应过程写出化学方程式,并标明各物质的物质量或浓度。
2. 写出反应式和平衡常数表达式:根据化学方程式,写出反应的反应式,并根据反应物和生成物的物质量或浓度写出平衡常数的表达式。
3. 列出各物质的初始浓度和平衡浓度:根据已知条件或实验数据,确定反应物和生成物的初始浓度,以及在平衡状态下的浓度。
4. 代入数值计算:将已知的浓度代入平衡常数表达式中,并计算得出化学平衡常数的数值。
三、化学平衡常数的应用化学平衡常数在化学反应研究和实际应用中有广泛的应用,主要包括以下几个方面:1. 判断反应方向:根据化学平衡常数的数值大小,可以判断反应是向产物的方向进行还是向反应物的方向进行。
当Keq大于1时,反应向产物的方向进行;当Keq小于1时,反应向反应物的方向进行;当Keq等于1时,反应物和产物的浓度相等,反应处于平衡态。
2. 预测反应结果:根据已知的反应物浓度和平衡常数的数值,可以预测化学反应达到平衡时产物和反应物的浓度。
3. 优化反应条件:通过调控反应物浓度和温度等条件,可以改变平衡常数的数值,从而实现对反应方向和产物浓度的调控。
4. 指导工业生产:对于工业生产中的化学反应,通过研究和掌握平衡常数的性质和数值,可以指导工业生产过程中的反应条件优化,提高产品收率和质量。
化学反应中的平衡常数和平衡原理

化学反应中的平衡常数和平衡原理化学反应在发生时,通常会在一定条件下达到平衡态。
在平衡态中,反应物的浓度和生成物的浓度保持恒定,称为平衡常数。
平衡常数的大小直接反映了反应的偏向性和平衡位置。
本文将探讨化学反应中的平衡常数和平衡原理,了解其在化学反应中的重要性。
一、平衡常数的概念和表示方法平衡常数是研究化学反应平衡性的重要参数,用K表示。
对于一般的化学反应:aA + bB ⇌ cC + dD平衡常数K的表达式可以表示为:K = [C]ᶜ[D]ᵈ / [A]ᵃ[B]ᵇ其中,[C]、[D]、[A]和[B]分别表示在平衡态各物质的浓度或压强。
a、b、c和d表示化学反应方程式中各物质的系数。
平衡常数可以反映反应的偏向性和平衡位置。
二、平衡常数的相关特性1. 平衡常数的大小平衡常数大小与反应的倾向性有关。
当平衡常数K大于1时,反应趋向生成物的方向,反应偏向产物;当K小于1时,反应倾向于反应物的方向,反应偏向反应物;当K接近于1时,反应物质和生成物质的浓度或压力基本相当。
2. 平衡常数的影响因素平衡常数受温度、压力和浓度等因素的影响。
温度变化会改变平衡常数的数值,反应在不同温度下的平衡常数不同。
对于气体反应来说,在等压条件下,压力的改变会影响平衡常数。
当压力增加时,反应会趋向于生成物浓度较小的方向。
浓度的变化也会影响平衡常数。
根据Le Chatelier原理,当浓度增加时,平衡常数会减小,反应偏向生成较少分子数的物质。
3. 平衡常数与反应速率平衡常数与反应速率没有直接的关系。
即使一个反应的平衡常数很大,也不能得出该反应速率很快的结论。
三、平衡原理及其应用平衡原理是指在化学反应过程中,当外界条件发生变化时,平衡系统会以某种方式调整自身以保持平衡。
1. Le Chatelier原理Le Chatelier原理指出,当系统处于平衡态时,当外界打扰因素作用于该系统时,平衡系统会通过调整其本身来抵消外界因素的影响,以达到新的平衡。
实验三化学平衡常数及分配系数的测定

实验三化学平衡常数及分配系数的测定实验目的:1. 通过测定酸碱指示剂在酸碱介质中颜色的变化,掌握平衡常数计算的方法。
2. 通过测定二苯醇在水和正丁醇中的分配系数,掌握物质在不同相中的分布规律。
实验原理:1. 化学平衡常数Kc在化学平衡条件下,反应物和生成物的浓度之比不再发生变化,称为化学平衡。
在一定温度下,平衡时反应物和生成物的浓度之比称为反应的平衡常数Kc。
其公式为:Kc=[C]c[D]d/[A]a[B]b2. 分配系数Kd物质在两相中分别的浓度之比称为分配系数Kd。
用水和正丁醇分别浸泡二苯醇,二苯醇在两相中的浓度之比即为分配系数Kd。
其公式为:Kd=C2-o/C2-w实验操作及步骤:1. 每个小组取三个试管,分别装入0.10mol/L的醋酸钠溶液、0.10mol/L的苯甲酸钠溶液和水。
2. 用蓝色酸碱指示剂滴定醋酸钠溶液和苯甲酸钠溶液,记录每滴指示剂后溶液颜色的变化。
重新取一组,用红色酸碱指示剂滴定醋酸钠溶液和苯甲酸钠溶液,记录每滴指示剂后溶液颜色的变化。
3. 再取两个试管,分别装入1mL二苯醇和1mL水,1mL二苯醇和1mL正丁醇,振荡均匀,并静置10min。
4. 用分光光度计测定试管中的吸光度,计算出二苯醇在水相和正丁醇相中的吸光度比值。
5. 根据测量值,计算出在二苯醇、水、正丁醇体系中二苯醇的分配系数Kd。
结果与分析:1. 酸碱指示剂颜色变化观察表指示剂醋酸钠水苯甲酸钠蓝色无明显变化蓝色碱性-中性红色无明显变化红色酸性-中性2. 二苯醇在水和正丁醇中的分配系数的计算取二苯醇、水、正丁醇中二苯醇的吸光度值分别为A、B、C,则二苯醇在水和正丁醇中的分配系数Kd=C/A。
化学平衡常数及分配系数的测定.doc

化学平衡常数及分配系数的测定.化学平衡常数及分配系数的测定1. 简述测定反应KI+I2=KI3的平衡常数的基本原理。
答:在恒温下,碘(I2)溶在含有碘离子(I-答:在恒温下,碘(I2)溶在含有碘离子(I:其平衡常数表达式为:(2)式中:α,c,γ分别为活度,浓度和活度系数。
由于在同一溶液中,离子强度相同(I- (2)式中:α,c,γ分别为活度,浓度和活度系数。
由于在同一溶液中,离子强度相同(I:(3)计算可知,活度系数(4)在水溶液中,I2浓度很小(5)一定温度下,故得:(6)为了测定平衡常数,应在不干扰动态平衡的条件下测定平衡组成。
在本实验中,当达到上述平衡时,若用硫代硫酸钠标准液来滴定溶液中的I2浓度,则会随着I2的消耗,平衡将向左端移动,使I3- (6)为了测定平衡常数,应在不干扰动态平衡的条件下测定平衡组成。
在本实验中,当达到上述平衡时,若用硫代硫酸钠标准液来滴定溶液中的I2浓度,则会随着I2的消耗,平衡将向左端移动,使I3:(9)因此,将平衡后各物质的浓度代入式(7)就可求出此温度下的平衡常数Kc。
2. 在KI+I2=KI3反应平衡常数测定实验中,所用的碘量瓶和锥形瓶哪些需要干燥?哪些不需要干燥?为什么?答:配置2号液的碘量瓶需要干燥,配置1号液的碘量瓶和锥形瓶不需要干燥。
因为2号液是用来测定平衡浓度的,平衡时I-配置2号液的碘量瓶需要干燥,配置1号液的碘量瓶和锥形瓶不需要干燥。
因为2号液是用来测定平衡浓度的,平衡时I:配置1号液是用来测I2在H2O及CCl4层中的分配系数Kd,配置2号液是用来测定反应KI+I2=KI3达平衡时各物质的平衡浓度的。
4. 在KI+I2=KI3反应平衡常数测定实验中,滴定CCl4层样品时,为什么要先加KI水溶液?答:硫代硫酸钠标准液与溶液中I2的反应是在水层中进行,滴定CCl4层样品的I2时,先加KI水溶液是为了加快CCl4层中的I2借助于反应KI+I2=KI3提取到水层中,有利于Na2S2O3滴定的顺利进行。
平衡常数计算方法

平衡常数计算方法平衡常数是指化学反应达到平衡时,反应物与生成物的浓度的比值的稳定值。
平衡常数是一种反应系统的性质,反映了反应的进行程度以及反应物和生成物在平衡时的浓度。
平衡常数的计算方法有多种,下面将介绍几种常见的计算方法。
1.反应物浓度法平衡常数可通过反应物和生成物的浓度来计算。
设反应物A和B生成物C和D,反应的化学方程式为:A+B⇌C+D假设在平衡时,A,B,C,D的浓度分别为[A],[B],[C],[D],则平衡常数K为:K=([C]*[D])/([A]*[B])这种方法适用于已知反应物和生成物浓度的实验数据,并且反应为单一反应的情况。
2.摩尔浓度法摩尔浓度法是一种以物质的摩尔数为计量单位的平衡常数计算方法。
在已知化学方程式的条件下,可通过已知物质的摩尔数及平衡时的摩尔浓度来计算平衡常数。
例如,对于反应物A和B生成物C和D,化学方程式为:aA+bB⇌cC+dD假设在平衡时,A的摩尔数为n(A),B的摩尔数为n(B),C的摩尔数为n(C),D的摩尔数为n(D),则平衡常数K为:K=([C]^c*[D]^d)/([A]^a*[B]^b)这种方法适用于已知物质的摩尔数及平衡时的摩尔浓度的情况。
3.压力法对于气态反应,可以使用压力来计算平衡常数。
根据气体压力与摩尔数的关系可知,气体的分压与其摩尔浓度成正比。
例如,对于反应物A和B生成物C和D,化学方程式为:aA+bB⇌cC+dD假设在平衡时,A的分压为P(A),B的分压为P(B),C的分压为P(C),D的分压为P(D),则平衡常数K为:K=(P(C)^c*P(D)^d)/(P(A)^a*P(B)^b)这种方法适用于气态反应的情况。
需要注意的是,以上方法都是在反应达到平衡时计算平衡常数的方法。
平衡常数的数值与温度有关,温度的变化会使平衡常数发生变化。
因此,在计算平衡常数时需要注意选择适当的温度。
总结起来,平衡常数的计算方法有反应物浓度法、摩尔浓度法和压力法等。
化学平衡常数及其应用

化学平衡常数及其应用化学平衡是化学反应进行到一定程度后,化学反应物和生成物浓度不再变化的状态。
在逐渐接近平衡状态的过程中,反应物和生成物的浓度会不断发生变化,这些变化通常可以通过化学平衡常数来描述。
化学平衡常数是一种表示平衡状态下反应物和生成物浓度比例的物理量。
1. 化学平衡常数的定义化学平衡常数通常用Kc或Kp表示,具体定义如下:对于一个化学反应aA + bB ⇌ cC + dD平衡常数Kc的定义为:Kc = [C]^c[D]^d/[A]^a[B]^b其中,[X]表示X的浓度,a、b、c、d分别为反应方程式中物质X的系数。
在平衡状态下,反应物和生成物的浓度比例是固定不变的,Kc的值也是固定不变的。
除了Kc外,化学平衡常数还可以使用Kp来表示,对于一个气相反应,Kp表示气相分压的乘积之比。
Kc和Kp之间的关系可以通过下式推导得到:Kp = Kc(RT)^(Δn)其中,R是气体常数,T是反应温度,Δn为气体反应的摩尔数变化量,即生成物气体的摩尔数减去反应物气体的摩尔数。
通常情况下,Δn的值在计算Kp的时候需要特别考虑。
2. 化学平衡常数的计算化学平衡常数的计算可以通过测量反应物和生成物浓度的比例来进行。
需要注意的是,由于平衡状态下反应物和生成物的浓度比例是固定的,因此需要等反应达到平衡状态后再进行测量。
例如,对于下面的化学反应N2(g) + 3H2(g) ⇌ 2NH3(g)可以通过测量反应物和生成物的浓度比例来计算Kc值。
假设达到平衡状态后,反应物N2、H2的浓度分别为0.1mol/L、0.3mol/L,生成物NH3的浓度为0.15mol/L,那么Kc的值为:Kc = [(0.15mol/L)^2]/(0.1mol/L)(0.3mol/L)^3= 1.875mol/L3. 化学平衡常数的应用化学平衡常数在化学反应和化学平衡的研究中具有广泛的应用。
下面将介绍其中的一些应用:(1)判断反应物和生成物浓度比例化学平衡常数可以用来判断反应物和生成物浓度比例。
物理化学实验思考题及参考答案 (2)

基础化学实验Ⅳ (物理化学实验) 2011年11制作 目 录 第一部分:思考题 (3)实验七十 恒温水浴组装及性能测试 (3)实验七十一 燃烧热得测定 (3)实验七十二 差热分析 (4)实验七十三 凝固点降低法测定摩尔质量 (4)实验七十四 纯液体饱与蒸气压得测量 (5)实验七十五 双液系得气—液平衡相图 (6)实验七十六 三组分液—液体系得平衡相图 (7)实验七十七 化学平衡常数及分配系数得测定 (8)实验七十八 溶液电导得测定——测HAc 得电离平衡常数 (8)实验七十九 原电池电动势得测定及其应用 (9)实验八十 线性电位扫描法测定镍在硫酸溶液中得钝化行为 (9)实验八十一 旋光法测定蔗糖转化反应得速率常数 (10)实验八十二 电导法测定乙酸乙酯皂化反应得速率常数 (11)实验八十三 最大泡压法测定溶液得表面张力 (11)实验八十四 固体在溶液中得吸附 (12)实验八十五 粘度法测定水溶性高聚物相对分子质量 ................................................................... 13 实验八十六 Fe (OH )3溶胶得制备及其ξ电势得测定 . (14)实验八十七 电导法测定水溶性表面活性剂得临界胶束浓度 (15)第二部分:参考答案 (16)实验七十 恒温水浴组装及性能测试 ........................................................................................... 16 思考题及参考答案实验七十一燃烧热得测定 (17)实验七十二差热分析 (23)实验七十三凝固点降低法测定摩尔质量 (25)实验七十四纯液体饱与蒸气压得测量 (28)实验七十五双液系得气-液平衡相图 (31)实验七十六三组分液—液体系得平衡相图 (34)实验七十七化学平衡常数及分配系数得测定 (37)实验七十八溶液电导得测定——测HAc得电离平衡常数 (40)实验七十九原电池电动势得测定及其应用 (42)实验八十线性电位扫描法测定镍在硫酸溶液中得钝化行为 (45)实验八十一旋光法测定蔗糖转化反应得速率常数 (48)实验八十三最大泡压法测定溶液得表面张力 (53)实验八十四固体在溶液中得吸附 (59)实验八十五粘度法测定水溶性高聚物相对分子质量 (61)实验八十六Fe(OH)3溶胶得制备及其ξ电势得测定 (66)实验八十七电导法测定水溶性表面活性剂得临界胶束浓度 (69)第一部分:思考题实验七十恒温水浴组装及性能测试1、简要回答恒温水浴恒温原理就是什么?主要由哪些部件组成?它们得作用各就是什么?2、简述恒温槽得构造及工作原理。
化学方程式的平衡常数与反应条件

化学方程式的平衡常数与反应条件化学反应中的平衡常数是用于描述反应物与生成物之间的相对浓度关系的一个重要指标。
它能够提供关于反应进行方向、速率和平衡位置的信息,从而帮助我们理解和控制化学反应过程。
在本文中,我们将探讨化学方程式的平衡常数与反应条件之间的关系,以及如何通过调整反应条件来影响反应的平衡。
一、化学方程式的平衡常数化学反应的平衡常数K是在特定温度下,反应物与生成物的浓度之比的稳定值。
对于一般的化学方程式:aA + bB ↔ cC + dD平衡常数可以用下面的公式来表示:K = ([C]^c * [D]^d) / ([A]^a * [B]^b)其中,[A]、[B]、[C]和[D]分别表示反应物A、B和生成物C、D的浓度,a、b、c和d分别表示它们在方程式中的系数。
二、影响化学方程式平衡的因素平衡常数K与反应条件之间存在着密切的关系,而反应条件的变化可以引起平衡常数K的改变。
以下是一些常见的影响平衡常数的因素:1. 温度:温度对化学反应平衡的影响是最为明显的因素之一。
根据Le Chatelier原理,增加温度将使平衡点偏向于吸热反应(即反应物生成物的生成方向),而降低温度则偏向于放热反应。
平衡常数K随着温度的增加或减少而改变。
2. 压力(或浓度):对于涉及气体的反应,压力的改变会对平衡常数K产生影响。
根据Le Chatelier原理,增加压力(或浓度)会导致平衡点偏向于生成物的方向,而减小压力则偏向于反应物的方向。
3. 催化剂:催化剂是能够加速化学反应速率但在反应结束后能够恢复原状的物质。
催化剂对平衡常数K的影响主要体现在反应速率方面,而不会改变平衡位置。
三、调整反应条件以改变平衡通过调整反应条件,我们可以改变平衡常数K,从而影响反应的平衡位置。
以下是几种常见的操作方法:1. 改变温度:增加反应温度会使平衡点偏向于吸热反应,而降低温度则偏向于放热反应。
这可以通过加热或冷却反应体系来实现。
2. 改变压力(或浓度):对于气体反应,增加压力(或浓度)会使平衡点偏向于生成物的方向,而减小压力则偏向于反应物的方向。
无机化学反应的平衡常数计算

无机化学反应的平衡常数计算无机化学反应的平衡常数是描述化学反应平衡状态的重要参数,它可以反映出反应物与生成物在平衡状态下的相对浓度或活性。
平衡常数的计算对于理解化学反应的平衡性质、预测反应的方向和速率等具有重要意义。
本文将介绍无机化学反应平衡常数的计算方法以及相关的应用。
一、平衡常数的定义与表达式平衡常数(K)是指在特定温度下,化学反应达到平衡时,反应物与生成物浓度之比的稳定值。
对于一般的无机化学反应:aA + bB ⇌ cC + dD其平衡常数表达式为:K = [C]^c[D]^d / [A]^a[B]^b其中,[A]、[B]、[C]、[D]分别表示反应物A、B和生成物C、D的浓度。
二、平衡常数的计算方法1. 实验测定法实验测定法是通过实验测定反应物与生成物的浓度或活性来确定平衡常数。
一种常用的实验方法是利用溶液的吸收光谱或电化学方法测定反应物与生成物的浓度变化。
通过测定不同浓度下反应物与生成物的吸光度或电位,可以得到平衡常数的数值。
2. 配平法配平法是一种常用的计算平衡常数的方法,它通过平衡反应物与生成物的物质量或物质的摩尔数来计算平衡常数。
首先,根据反应物与生成物的化学式,编写平衡反应方程;然后,根据反应物与生成物的物质量或物质的摩尔数,进行配平反应方程;最后,根据配平后的反应方程,计算平衡常数。
三、平衡常数的应用平衡常数的计算对于理解化学反应的平衡性质、预测反应的方向和速率等具有重要意义。
以下是平衡常数的一些应用:1. 预测反应方向根据平衡常数的数值大小,可以预测反应的方向。
当平衡常数大于1时,生成物的浓度较高,反应向右进行;当平衡常数小于1时,反应物的浓度较高,反应向左进行。
平衡常数接近于1时,反应物与生成物的浓度相近,反应接近平衡。
2. 预测反应速率平衡常数还可以用于预测反应的速率。
根据速率方程和平衡常数的关系,可以推导出反应速率与反应物和生成物浓度之间的关系。
平衡常数较大的反应速率较快,平衡常数较小的反应速率较慢。
化学反应的平衡常数与浓度变化规律

化学反应的平衡常数与浓度变化规律化学反应是物质转化的过程,其中平衡常数是反应系统达到平衡时反应物浓度与生成物浓度之比的一个关键参数。
平衡常数的大小与反应的方向性和反应浓度的变化有着密切的联系。
本文将就化学反应的平衡常数与浓度变化规律展开讨论。
一、平衡常数的定义和表示化学反应的平衡常数,通常用K表示,定义为反应物浓度的乘积与生成物浓度的乘积的比值,即K = [C]c[D]d/[A]a[B]b。
其中,A、B为反应物,C、D为生成物,a、b、c、d分别为反应物和生成物的摩尔系数。
二、平衡常数与反应方向性的关系平衡常数的大小决定了反应的方向性。
当K大于1时,反应偏向生成物的方向,说明生成物浓度高于反应物浓度;当K小于1时,反应偏向反应物的方向,说明反应物浓度高于生成物浓度;当K等于1时,反应物和生成物的浓度相等,反应处于平衡状态。
三、浓度变化对平衡常数的影响1.浓度的增加或减少当反应物的浓度增加或生成物的浓度减少时,平衡常数将向反应物的方向移动,以减小反应物的浓度或增加生成物的浓度,以达到新的平衡状态。
反之,当反应物的浓度减少或生成物的浓度增加时,平衡常数将向生成物的方向移动。
2.浓度的倍数变化根据平衡常数表达式,当反应物和生成物的浓度分别增加或减少一倍时,平衡常数将发生对应的倍数变化。
例如,当反应物的浓度和生成物的浓度都增加一倍时,平衡常数将变为原来的平方倍(K' = K^2);当反应物的浓度减少一半,生成物的浓度增加一倍时,平衡常数将变为原来的一半(K' = K/2)。
3.浓度的改变对平衡常数的影响改变平衡系统中某一物质的浓度,将对其他物质浓度产生影响,从而改变平衡常数。
根据Le Chatelier原理,当平衡系统中的浓度发生改变时,系统将倾向于通过反应方向的移动来抵消浓度的变化,以达到新的平衡状态。
四、浓度变化对平衡位置的影响改变反应物和生成物的浓度将导致平衡位置的移动。
当反应物浓度增加或生成物浓度减少时,平衡位置将向生成物的方向移动;当反应物浓度减少或生成物浓度增加时,平衡位置将向反应物的方向移动。
化学反应的平衡常数与平衡浓度的计算

化学反应的平衡常数与平衡浓度的计算化学反应中的平衡常数是用来描述反应物和生成物在达到平衡时的浓度之间的关系。
通过平衡常数,我们可以了解反应的进行方向和程度。
本文将介绍化学反应的平衡常数的计算方法,以及如何根据平衡常数计算平衡浓度。
1. 平衡常数的定义平衡常数(K)是指在特定温度下,反应物浓度和生成物浓度的乘积与反应物浓度的乘积之比。
根据化学方程式的系数,平衡常数可以用不同的形式表示。
例如,对于一般的化学方程式:aA + bB ⇌ cC + dD平衡常数可以用以下形式表示:Kc = [C]^c[D]^d / [A]^a[B]^bKp = (PC)^c(PD)^d / (PA)^a(PB)^b其中,[ ]表示物质的浓度,P表示分压,a、b、c、d分别表示化学方程式中物质的系数。
2. 平衡浓度的计算平衡浓度指的是反应物和生成物在达到平衡时的实际浓度。
根据平衡常数的定义,我们可以通过已知条件计算出平衡浓度。
首先,根据平衡常数的表达式,我们可以得知平衡浓度与平衡常数之间的关系,即:Kc = [C]^c[D]^d / [A]^a[B]^b假设反应物A的浓度为x,B的浓度为y,生成物C的浓度为z,D 的浓度为w。
根据方程式中的系数,我们可以得到反应物和生成物之间的浓度关系:[C] = c*z[D] = d*w[A] = a*x[B] = b*y将以上关系代入平衡常数的表达式中,我们可以得到:Kc = (c*z)*(d*w) / (a*x)*(b*y)通过已知条件中的浓度值,我们可以计算得到平衡常数Kc的值。
3. 平衡常数与反应方向的关系根据平衡常数的大小,我们可以了解反应的进行方向和程度。
如果平衡常数Kc大于1,则生成物的浓度较高,反应趋向于生成物方向进行。
反之,如果Kc小于1,则反应物的浓度较高,反应趋向于反应物方向进行。
如果Kc等于1,则反应物与生成物的浓度相等,反应处于平衡状态。
根据平衡常数的大小,我们可以预测反应的进行方向,并可以通过改变反应条件来控制反应方向。
化学反应的平衡常数的压力变化规律及其实际应用

化学反应的平衡常数的压力变化规律及其实际应用化学反应的平衡常数是描述反应物浓度和产物浓度之间关系的物理量,通常用K表示。
在一定温度下,反应达到平衡时,反应物和产物的浓度达到一定的比例关系,并可以通过平衡常数来描述。
1. 平衡常数与压力变化规律对于气相反应,可以用分压来表示反应物和产物的浓度,此时平衡常数也常用压力来表示,即Kp。
根据平衡常数与浓度之间的关系,可以推导出平衡常数与压力之间的变化规律。
首先,考虑一个简单的气相反应A(g) + B(g) ⇌ C(g) + D(g),在一定温度下达到平衡。
设初始时刻A、B、C、D的分压分别为P₀A、P₀B、P₀C、P₀D,达到平衡时,各组分的分压为Pₐ、Pₐ、Pₐ、Pₐ。
根据平衡常数定义,有Kp = (Pₐ × Pₐ) / (Pₐ × Pₐ)。
根据气体分压与物质摩尔数之间的关系,有Pₐ = nₐ × RT / V,其中nₐ为A的摩尔数,R为气体常量,T为温度,V为体积。
将上述分压表达式代入平衡常数公式中,得到Kp = ((nₐ × RT / V)*(nₐ × RT / V)) / ((nₐ × RT / V)*(nₐ × R T / V))。
化简上式,可得Kp = (nₐ × nₐ) / (nₐ × nₐ) = (nₐ / nₐ) × (nₐ / nₐ),即Kp = (nₐ / nₐ)²。
由此可见,平衡常数Kp与反应物和产物的物质的摩尔比例有关,而与体积和温度无关。
2. 平衡常数的实际应用平衡常数在化学反应中有着重要的实际应用,常用于分析反应的方向和速率。
首先,平衡常数可以用于预测反应的方向。
根据平衡常数的大小,可以了解反应物和产物在平衡时的浓度关系。
如果Kp > 1,表示产物浓度较大,反应向产物方向偏移;如果Kp < 1,表示反应物浓度较大,反应向反应物方向偏移。
化学平衡常数及分配系

石化与能源工程学院实验报告实验名称:化学平衡常数及分配系数的测定班级:________ __________________________ 学生姓名:________ __________________学号:_______ ______________________实验日期: ___ __________________________化学平衡常数及分配系数的测定一、实验目的:(1)测定反应I2+KI=KI3的平衡常数及碘在CCl4和水中的分配系数。
(2)掌握常温恒温技术的控制方法。
二、实验原理:在恒温、恒压下I2和KI在水溶液中建立如下平衡:I2+KI=KI3(1)为了测定平衡常数,应在不扰动平衡状态的条件下,测定平衡组成。
当上述反应达到平衡时,若用Na2S2O3标准溶液来滴定溶液中I2的浓度,则随着I2的消耗,平衡将向左移动,使KI3继续分解,最终只能测得溶液中I2和KI3的总量。
为了测定I2的单独浓度,可在上述溶液中加入CCl4,然后充分摇匀(KI和KI3均不溶于CCl4),当温度和压力一定时,上述化学平衡及I2在CCl4层和H2O层中的分配平衡同时建立,测得四氯化碳层中I2的浓度,即可根据分配系数求得水层中I2的浓度。
当两个平衡同时建立时,设水层中KI3和I2的总浓度为b(可通过Na2S2O3标准溶液滴定测得)KI的初始浓度为c(由配置溶液可算出),四氯化碳层I2的浓度为a’(用Na2S2O3标准溶液滴定测得)I2在水层和四氯化碳层的分配系数为k,通过实验测得k值和四氯化碳层中I2的浓度a’后,可求出水层中I2浓度a’,k=a’/a,a=a’/k。
这样平衡中水层中I2的浓度为a,KI3的浓度为(b-a),KI的厨师浓度减去KI3的浓度(b-a),即c-(b-a), (因为形成一个KI3,就消耗一个KI),所以反应式(1)的平衡常数:三、仪器和试剂:仪器:250ml碘量瓶3个;50ml移液管3支;10ml移液管2支;250ml三角锥瓶4个;碱式滴定管2支;10ml量筒1个,25ml量筒1个;5ml量杯2个;50ml 小烧杯1个。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
石化与能源工程学院
实验报告
实验名称:化学平衡常数及分配系数的测定
班级:________A13化工__________________________ 学生姓名:__________刘文斌________________________ 学号:_________19_________________________
实验日期: ___2014.12.3____________________________
化学平衡常数及分配系数的测定
一、实验目的:(1)测定反应I
+KI=KI3的平衡常数及碘在CCl4和水中的
2
分配系数。
(2)掌握常温恒温技术的控制方法。
二、实验原理:在恒温、恒压下I
和KI在水溶液中建立如下平衡:
2
I2+KI=KI3(1)
为了测定平衡常数,应在不扰动平衡状态的条件下,测定平衡组成。
当上述反应达到平衡时,若用Na2S2O3标准溶液来滴定溶液中I2的浓度,则随着I2的消耗,平衡将向左移动,使KI3继续分解,最终只能测得溶液中I2和KI3的总量。
为了测定I2的单独浓度,可在上述溶液中加入CCl4,然后充分摇匀(KI和KI3均不溶于CCl4),当温度和压力一定时,上述化学平衡及I2在CCl4层和H2O层中的分配平衡同时建立,测得四氯化碳层中I2的浓度,即可根据分配系数求得水层中I2的浓度。
当两个平衡同时建立时,设水层中KI3和I2的总浓度为b(可通过Na2S2O3标准溶液滴定测得)KI的初始浓度为c(由配置溶液可算出),四氯化碳层I2的浓度为a’(用Na2S2O3标准溶液滴定测得)I2在水层和四氯化碳层的分配系数为k,通过实验测得k值和四氯化碳层中I2的浓度a’后,可求出水层中I2浓度a’,k=a’/a,a=a’/k。
这样平衡中水层中I2的浓度为a,KI3的浓度为(b-a),KI的厨师浓度减去KI3的浓度(b-a),即c-(b-a), (因为形成一个KI3,就消耗一个KI),所以反应式(1)的平衡常数:
三、仪器和试剂:
仪器:250ml碘量瓶3个;50ml移液管3支;10ml移液管2支;250ml三角锥瓶4个;碱式滴定管2支;10ml量筒1个,25ml量筒1个;5ml量杯2个;50ml 小烧杯1个。
试剂:Na2S2O3标准溶液(0.01mol/L);KI标准溶液(0.1);四氯化碳;I2的CCl4溶液饱和溶液;碘;1%淀粉溶液。
四、实验步骤:
1、按表列数据,将样品溶液配于碘量瓶中。
2、将配好的溶液置于30℃的恒温槽内,恒温1.5小时。
恒温期间,每隔10分钟振荡一次,如要取出槽外振荡,每次不要超过半分钟,以免温度改变,影响结果。
最后一次振荡后,待两液层充分分离后,按表列数据吸取样品进行分析。
3、析水层时,用Na2S2O3滴至淡黄色,再加2ml淀粉溶液作指示剂,然后仔细滴至蓝色刚好消失。
4、吸取CCl4层样品溶液,(为了不让水层样品溶液进入移液管,用吸耳球边向移液管吹气通过水层而插入CCl4层),放入盛有10ml蒸馏水的三角锥瓶中。
加入少许固体KI,以保证CCl4层中的I2完全提取到水层中,然后加入2ml淀粉溶液。
细心地滴至水层蓝色消失,CCl4层不再呈紫红色。
滴定后和未用完的CCl4层溶液皆应倾入回收瓶。
五、数据记录与处理
实验温度_17.3_____ 大气压___101kap_____
223
数K。
K=四氯化碳层中的浓度/水层中的浓度
由2号,3号实验的四氯化碳层a′和k求出水层a,再由水层中消耗的Na2S2O3溶液量求出b,将a,b,c代入(2)式中求Kc值。
六、思考题
1. 配制第1号,2号,3号溶液进行实验的目的何在?根据你的实验结果判断反应是否已达平衡。
I号用来测定分配系数K;由2,3号中,aa,/K,b由水层Na2S2O3消耗量可求,即可求得Kc
2.测定四氯化碳层中I2的浓度时应注意些什么?
由于I2在CCl4层中不易进行H2O层,须充分摇动且不能过早加入淀粉指示剂,终点必须以CCl4层不再有浅蓝色为准。
