同位素同素异形体同系物同分异构体和同种物质的比较
同系物同位素同素异形体同分异构体的举例

同系物同位素同素异形体同分异构体的举例同系物、同位素、同素异形体、同分异构体是化学中常用的概念,用来描述化学物质在分子结构上的差异。
下面将以具体实例为例,细致解释这四个概念的含义和应用。
同系物是指具有相同或相近分子式的化合物。
它们在分子构造上有着相似但不完全相同的特点。
例如,酚类化合物对苯酚、间酚和邻酚,它们的分子式都是C6H6O,但它们的分子结构和性质有所不同。
另一个例子是醇类化合物,如乙醇、异丙醇等都是同系物。
同位素是指原子核中质子数相同、中子数不同的同位素体系。
例如,氢气的同位素有氘(氢的同位素,质子数为1,中子数为1)和氚(质子数为1,中子数为2)。
同一元素的不同同位素有时会导致其物理和化学性质的差异。
同素异形体是指由同一组原子组成,但分子结构不同的同素体。
常见的例子是热带硬脂酸的两种异构体。
正硬脂酸和癸二酸,化学式都是C17H34O2,但它们的分子结构和物理性质有所不同。
另一个例子是异构烯烃,如顺式-丁烯和反式-丁烯都是C4H8的同素异形体。
同分异构体是指分子式相同,但结构略有不同的化合物。
例如,异丁烷和2-甲基丁烷,它们的分子式都是C4H10,但它们的分子结构不同。
另一个例子是异构酮,如丙酮和乙酸酯,它们的分子式都是C3H6O,但它们在分子结构上有所不同。
这四个概念在化学中有着广泛的应用。
首先,通过研究同系物,可以了解不同化合物之间的相似性和差异性,为合成新的化合物提供参考。
其次,同位素的使用在放射性同位素示踪、核能利用和碳定年等方面具有重要意义。
同素异形体和同分异构体的研究可以深入了解化学反应机制,对有机合成和药物设计有着重要的指导作用。
总结起来,同系物、同位素、同素异形体和同分异构体是用来描述化学物质在分子构造上的差异的重要概念。
通过研究和区分这些概念,我们能够更好地理解化学物质的性质和行为,从而为新化合物的合成和应用提供指导。
同位素、同素异形体、同系物、同分异构体和同种物质的比较

1同位素是针对原子来说的,指质子数相同而中子数不同的原子,如D和H2同分异构体是指分子式相同而结构不同的化合物,如丁烷和异丁烷3同系物是指有机物中差一个CH2的物质,如烷4同素异形体是指单质,如O2,O3。
红磷白磷同位素是具有相同原子序数的同一化学元素的两种或多种原子之一,在元素周期表上占有同一位置,化学行为几乎相同,但原子质量或质量数不同,从而其质谱行为、放射性转变和物理性质(例如在气态下的扩散本领)有所差异。
同位素的表示是在该元素符号的左上角注明质量数,例如碳14,一般用14C而不用C14。
自然界中许多元素都有同位素。
同位素有的是天然存在的,有的是人工制造的,有的有放射性,有的没有放射性。
同一元素的同位素虽然质量数不同,但他们的化学性质基本相同(如:化学反应和离子的形成),物理性质有差异[主要表现在质量上(如:熔点和沸点)]。
自然界中,各种同位素的原子个数百分比一定。
同位素是指具有相同核电荷但不同原子质量的原子(核素)称为同位素。
在19世纪末先发现了放射性同位素,随后又发现了天然存在的稳定同位素,并测定了同位素的丰度。
大多数天然元素都存在几种稳定的同位素。
同种元素的各种同位素质量不同,但化学性质几乎相同。
同素异形体,是相同元素组成,不同形态的单质。
如碳元素就有金钢石、石墨、无定形碳等同素异形体。
同素异形体由于结构不同,彼此间物理性质有差异;但由于是同种元素形成的单质,所以化学性质相似。
同分异构体:化学上,同分异构体是一种有相同化学式,有同样的化学键而有不同的原子排列的化合物。
简单地说,化合物具有相同分子式,但具有不同结构的现象,叫做同分异构现象;具有相同分子式而结构不同的化合物互为同分异构体。
很多同分异构体有相似的性质。
同系物定义同系物定义同系物定义同系物定义化学上,我们把结构相似,组成上相差1个或者若干个某种原子团的化合物互称为同系物。
多用于有机化合物。
旧定义(在比较旧的化学书上可能存在这个概念)化学上,我们把结构、化学性质、通式相似,组成上相差1个或者若干个CH2原子团(系差)具有相同官能团的化合物统称为同系物。
同位素同分异构体的比较 (2)

同位素,同素异形体,同系物,同分异构体的异同一、定义同位素:质子数相同,中子数不同的原子(核素)同素异形体:由同一种元素组成的不同单质同系物:结构相似,分子组成相差一个或若干个CH2基团的物质同分异构体:分子式相同,结构不同的化合物二、不同点1、同位素的对象是原子,在元素周期表上占有同一位置,化学性质基本相同,但原子质量或质量数不同,从而其质谱行为、放射性转变和物理性质(例如在气态下的扩散本领)有所差异。
2、同素异形体的对象是单质,同素异形体的组成元素相同,结构不同,物理性质差异较大,化学性质有相似性,但也有差异。
如金刚石和石墨的导电性、硬度均不同,虽都能与氧气反应生成CO2,由于反应的热效应不同,二者的稳定性不同(石墨比金刚石能量低,石墨比金刚石稳定)。
同素异形体的形成方式有三种:(1)组成分子的原子数目不同,例如: O2和O3。
(2)晶格中原子的排列方式不同,例如:金刚石和石墨。
(3)晶格中分子排列的方式不同,例如:正交硫和单斜硫(高中不要求此种)。
注意:同素异形体指的是由同种元素形成的结构不同的单质,如H2和D2的结构相同,不属于同素异形体。
3、同系物的对象是有机化合物,属于同系物的有机物必须结构相似,在有机物的分类中,属于同一类物质,通式相同,化学性质相似,差异是分子式不同,相对分子质量不同,在组成上相差一个或若干个CH2原子团,相对分子质量相差14的整数倍,如分子中含碳原子数不同的烷烃之间就属于同系物。
(1)结构相似指的是组成元素相同,官能团的类别、官能团的数目及连接方式均相同。
结构相似不一定是完全相同,如CH3CH2CH3和(CH3)4C,前者无支链,后者有支链,但二者仍为同系物。
(2)通式相同,但通式相同不一定是同系物。
例如:乙醇与乙醚它们的通式都是CnH2n+2O,但他们官能团类别不同,不是同系物。
又如:乙烯与环丁烷,它们的通式都是CnH2n,但不是同系物。
(3) 在分子组成上必须相差一个或若干个CH2原子团。
高中化学 同位素 同素异形体 同系物 同分异构体和同种物质的比较概念辨析 新人教版
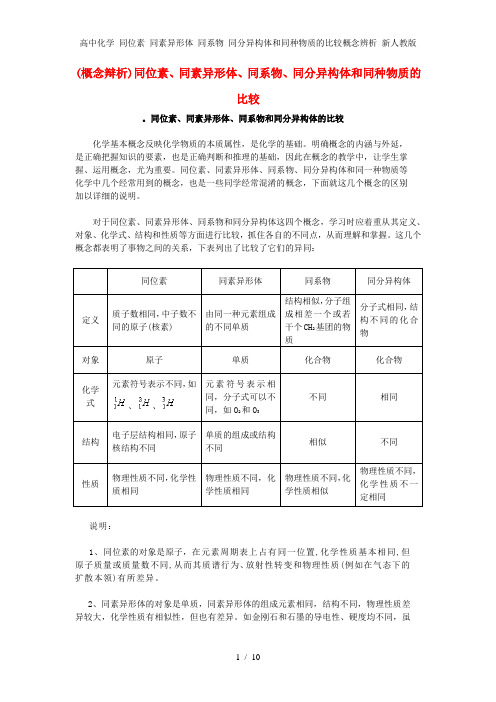
(概念辩析)同位素、同素异形体、同系物、同分异构体和同种物质的比较。
同位素、同素异形体、同系物和同分异构体的比较化学基本概念反映化学物质的本质属性,是化学的基础。
明确概念的内涵与外延,是正确把握知识的要素,也是正确判断和推理的基础,因此在概念的教学中,让学生掌握、运用概念,尤为重要。
同位素、同素异形体、同系物、同分异构体和同一种物质等化学中几个经常用到的概念,也是一些同学经常混淆的概念,下面就这几个概念的区别加以详细的说明。
对于同位素、同素异形体、同系物和同分异构体这四个概念,学习时应着重从其定义、对象、化学式、结构和性质等方面进行比较,抓住各自的不同点,从而理解和掌握。
这几个概念都表明了事物之间的关系,下表列出了比较了它们的异同:同位素同素异形体同系物同分异构体定义质子数相同,中子数不同的原子(核素)由同一种元素组成的不同单质结构相似,分子组成相差一个或若干个CH2基团的物质分子式相同,结构不同的化合物对象原子单质化合物化合物化学式元素符号表示不同,如、、元素符号表示相同,分子式可以不同,如O2和O3不同相同结构电子层结构相同,原子核结构不同单质的组成或结构不同相似不同性质物理性质不同,化学性质相同物理性质不同,化学性质相同物理性质不同,化学性质相似物理性质不同,化学性质不一定相同说明:1、同位素的对象是原子,在元素周期表上占有同一位置,化学性质基本相同,但原子质量或质量数不同,从而其质谱行为、放射性转变和物理性质(例如在气态下的扩散本领)有所差异。
2、同素异形体的对象是单质,同素异形体的组成元素相同,结构不同,物理性质差异较大,化学性质有相似性,但也有差异。
如金刚石和石墨的导电性、硬度均不同,虽都能与氧气反应生成CO2,由于反应的热效应不同,二者的稳定性不同(石墨比金刚石能量低,石墨比金刚石稳定)。
同素异形体的形成方式有三种:(1)组成分子的原子数目不同,例如: O2和O3。
(2)晶格中原子的排列方式不同,例如:金刚石和石墨。
烷 烃

烷烃【要点分析】一、烷烃链状的饱和烃称为烷烃。
链状是指碳原子间没有闭合成环;饱和是指碳链中碳原子间均以单键相结合,碳的其它的价键均被氢原子所饱和。
其通式为:C n H2n+2(n≥1)。
所以,对于烷烃只要知道碳原子个数或H原子个数,即可求出其分子式和相对分子质量。
如果碳原子间均以单键结合,而且闭合成环,则称为环烷烃。
例如:其通式为:C n H2n(n≥3)。
二、同系物1.定义:结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物。
注意:必须同时满足“结构、组成”两个条件的要求。
同系物必然具有相同的通式,但具有相同通式的不一定是同系物。
2.烃基:烃分子失去一个或几个氢原子后所剩余的部分,一般用“R—”表示。
烷烃失去一个氢原子后所剩余的原子团叫烷基,常见的有—CH3叫甲基,—C2H5叫乙基等。
烷基的通式为—C n H2n+1。
要注意“基”与“根”的区别,“烃基”是呈电中性的,不带电荷;而“根”是带电荷的。
3.烷烃的性质:(1)物理性质随着分子里碳原子数的递增,它们在常温下的状态由气态、液态到固态:C1~C4为气态,C5~C16为液态,C17以上为固态;它们的沸点和液态时的密度也都逐渐升高和增大。
其原因是烷烃为分子晶体,随着碳原子数增多,相对分子质量逐渐增大,分子间作用力增大,因而熔沸点逐渐升高。
当相对分子质量相同时,烷烃支链越多,熔沸点越低。
注意分析随着碳原子数增加,烷烃分子的含碳量和含氢量的递变规律:含碳量逐渐增大,含氢量逐渐减小。
(2)化学性质烷烃的化学性质与其代表物甲烷的相似。
一般比较稳定,在通常情况下跟酸、碱和酸性高锰酸钾等氧化剂都不起反应,也不跟其它物质化合。
但在特定条件下也能发生下列反应:①在光照条件下均可与氯气发生取代反应;②氧化反应:均可点燃;③分解反应(裂解反应)。
烷烃燃烧的通式为:C n H2n+2+O2 nCO2+(n+1)H2O三、同分异构现象1.概念:化合物具有相同的分子式,但具有不同结构的现象,叫做同分异构现象。
同分异构体,同位素,同系物,同素异形体的定义

同分异构体,同位素,同系物,同素异形体的定义In the field of chemistry, there are several terms thatrefer to different forms or variations of the same chemical element. These terms include: isotopes, allotropes, isomers, and isobars. While they may sound similar, each of these terms carries a specific meaning in the context of chemistry.在化学领域中,有几个词汇用于指代同一种化学元素的不同形式或变异。
这些术语包括:同位素、同素异构体、同分异构体和同质庄稼。
尽管它们听起来很相似,但每个术语在化学的上下文中都有着特定的含义。
Let's start with isotopes. Isotopes are atoms of the same element that have different numbers of neutrons in their nuclei. This means that while isotopes have the same number of protons and electrons, they differ in their atomic mass. For example, carbon-12 and carbon-14 are both isotopes of carbon, as they have the same number of protons (6) but different numbers of neutrons (6 and 8 respectively).让我们先从同位素开始。
同位素同素异形体同系物同分异构体和同种物质的比较概念辨析
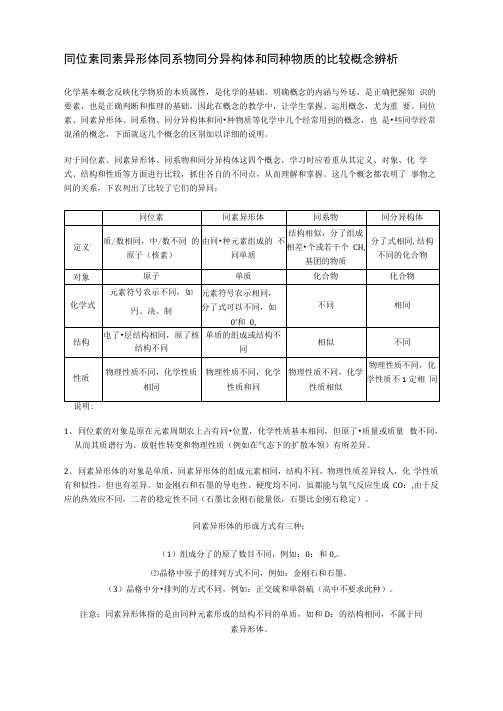
同位素同素异形体同系物同分异构体和同种物质的比较概念辨析化学基本概念反映化学物质的本质属性,是化学的基础。
明确槪念的内涵与外延,是正确把握知识的要素,也是正确判断和推理的基础,因此在槪念的教学中,让学生掌握、运用槪念,尤为重要。
同位素、同素异形体、同系物、同分异构体和同•种物质等化学中几个经常用到的槪念,也是•些同学经常混淆的概念,下面就这几个概念的区别加以详细的说明。
对于同位素、同素异形体、同系物和同分异构体这四个槪念,学习时应着重从其定义、对象、化学式、结构和性质等方面进行比较,抓住各自的不同点,从而理解和掌握。
这几个概念都农明了事物之间的关系,下农列出了比较了它们的异同:1、同位素的对象是原在元素周期农上占有同•位置,化学性质基本相同,但原了•质量或质量数不同,从而其质谱行为、放射性转变和物理性质(例如在气态下的扩散本领)有所差异。
2、同素异形体的对象是单质,同素异形体的组成元素相同,结构不同,物理性质差异较人,化学性质有和似性,但也有差异。
如金刚石和石墨的导电性、硬度均不同,虽都能与氧气反应生成CO:,由于反应的热效应不同,二者的稳定性不同(石墨比金刚石能量低,石墨比金刚石稳定)。
同素异形体的形成方式有三种:(1)组成分了的原了数目不同,例如:0:和0,。
⑵晶格中原子的排列方式不同,例如:金刚石和石墨。
(3)晶格中分•排列的方式不同,例如:正交硫和单斜硫(高中不要求此种)。
注意:同素异形体指的是由同种元素形成的结构不同的单质,如和D:的结构相同,不属于同素异形体。
3、同系物的对象是有机化合物,属于同系物的有机物必须结构相似,在有机物的分类中,属于同•类物质,通式相同,化学性质相似,差异是分子式不同,相对分子质量不同,在组成上相差•个或若干个CH,原了•团,相对分J'•质量相差14的整数倍,如分了中含碳原了数不同的烷桂之间就属于同系物。
(D结构相似指的是组成元素相同,官能团的类别、官能团的数目及连接方式均相同。
同位素-同素异形体-同系物-同分异构体的异同

张浩祥对于同位素、同素异形体、同系物和同分异构体这四个概念,学习时应着重从其定义、对象、化学式、结构和性质等方面进行比较,抓住各自的不同点,从而理解和掌握。
这几个概念都表明了事物之间的关系,下表列出了比较了它们的异同:同位素:质子数相同,中子数不同的原子(核素)对象原子同素异形体:由同一种元素组成的不同单质。
对象单质同系物; 结构相似,分子组成相差一个或若干个CH2基团的物质对象化合物同分异构体: 分子式相同,结构不同的化合物对象化合物说明:1、同位素的对象是原子,在元素周期表上占有同一位置,化学性质基本相同,但原子质量或质量数不同,从而其质谱行为、放射性转变和物理性质(例如在气态下的扩散本领)有所差异。
2、同素异形体的对象是单质,同素异形体的组成元素相同,结构不同,物理性质差异较大,化学性质有相似性,但也有差异。
如金刚石和石墨的导电性、硬度均不同,虽都能与氧气反应生成CO2,由于反应的热效应不同,二者的稳定性不同(石墨比金刚石能量低,石墨比金刚石稳定)。
同素异形体的形成方式有三种:(1)组成分子的原子数目不同,例如:O2和O3 。
(2)晶格中原子的排列方式不同,例如:金刚石和石墨。
(3)晶格中分子排列的方式不同,例如:正交硫和单斜硫(高中不要求此种)。
注意:同素异形体指的是由同种元素形成的结构不同的单质,如H2和D2的结构相同,不属于同素异形体。
3、同系物的对象是有机化合物,属于同系物的有机物必须结构相似,在有机物的分类中,属于同一类物质,通式相同,化学性质相似,差异是分子式不同,相对分子质量不同,在组成上相差一个或若干个CH2原子团,相对分子质量相差14的整数倍,如分子中含碳原子数不同的烷烃之间就属于同系物。
(1)结构相似指的是组成元素相同,官能团的类别、官能团的数目及连接方式均相同。
结构相似不一定是完全相同,如CH3CH2CH3和(CH3)4C,前者无支链,后者有支链,但二者仍为同系物。
(2)通式相同,但通式相同不一定是同系物。
同系物 同分异构体 同位素 同素异形体的区别

1、同系物:结构相似,分子组成相差一个或若干个CH2原子的物质CH4和CH2H6
2、同分异构体:化合物具有相同的分子式,但具有不同结构(这个需要结构式)
*一个是物质不同*一个是结构不同
A同系物就是结构相似,分子式相差一个或多个CH2 的物质,在有机物中存在,如烷烃
B同分异构体就是化学式一致,但是结构式排布不一致的两种物质
C同位素就是在一种元素中存在着质子相同,中子数不同的数种核素(上面的“水和重水”的说法是不对的),如氢元素中的氕、氘、氚
D同素异型体就是构成的元素相同,但由于原子排列不同,形成不同性质的物质,如O2 和O3。
同系物同位素同素异形体同分异构体的举例

同系物同位素同素异形体同分异构体的举例一、引言在化学领域中,同系物、同位素、同素异形体以及同分异构体都是常见的概念。
它们代表了不同的化学性质和结构特征。
本文将对这些概念进行详细解释,并给出相关的例子,以便更好地理解它们之间的区别和联系。
二、同系物同系物是指具有相似化学性质和结构特征的一组化合物。
它们通常具有相似的分子式和相近的分子量,但其结构可能存在差异。
下面是几个例子:1.甲醛(HCHO)和乙醛(CH3CHO):它们都是醛类化合物,具有类似的化学性质,但其分子结构不同。
2.硫酸(H2SO4)和亚硫酸(H2SO3):它们都是含硫酸基团的无机化合物,但亚硫酸比硫酸少一个氧原子。
三、同位素同位素是指具有相同原子序数(即相同的元素)但质量数不同的原子。
同位素具有相似的化学性质,但其物理性质可能存在差异。
以下是一些例子:1.氢的同位素:氢有三种主要的同位素,分别是氢-1(1H)、氘(2H)和氚(3H)。
它们在化学反应中表现出类似的性质,但在物理性质上有所不同。
2.碳的同位素:碳有两种稳定的同位素,分别是碳-12(12C)和碳-13(13C)。
它们在化学反应中表现出类似的性质,但由于质量数不同,在物理性质上也存在差异。
四、同素异形体同素异形体是指具有相同元素组成但结构或空间构型不同的化合物。
它们通常具有不同的物理和化学性质。
以下是几个例子:1.顺式和反式异戊二烯酸二甲酯–顺式异戊二烯酸二甲酯(CH3OC(O)C(CH3)=CHC(O)OCH3):两个甲基基团位于双键相对位置。
–反式异戊二烯酸二甲酯(CH3OC(O)C(CH3)=CHC(O)OCH3):两个甲基基团位于双键同侧位置。
2.光学异构体–D-葡萄糖和L-葡萄糖:它们是以不对称碳原子为中心的异构体,可以通过手性合成得到。
两者具有相同的分子式和结构,但旋光性质不同。
五、同分异构体同分异构体是指具有相同分子式但结构不同的化合物。
它们具有不同的物理和化学性质。
同系物和同分异构体同素异形体 同位素

同系物和同分异构体同素异形体同位素
1.同素异形体:同一种元素形成的多种单质互为同素异形体。
例如金刚石和石墨是碳的同素异形体。
2.同位素:同位素同属于某一化学元素,针对原子来说的,其原子具有相同数目的电子,原子核也具有相同数目的质子,但却有不同数目的中子。
例如氕、氘和氚。
3.同分异构体是有机物的分子式相同但是分子结构不同。
4.同系物:结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物。
如:甲烷、乙烷、丙烷互称为同系物,它们都属于烷烃。
正确理解几个有机概念

正确理解几个有机概念化学基本概念反映化学事实的本质属性,是学习的基础。
明确概念的内涵与外延,是正确思维的要素,也是判断和推理的基础,因此在概念的学习中,让学生掌握、运用概念,尤为重要。
同系物、同分异构体、同一物质、同素异形体、同位素有机化学中几个经常用到的概念,也是同学们经常混淆的概念。
下面就对这几个概念的区别加以详细的论述。
一、同系物:分子式不同,结构相似,在分子组成上相差若干个—CH2—原子团的化合物互称同系物1、思考讨论:下列物质互为同系物的是①CH3CH3与CH3CH(CH3)2②CH3CH2OH与CH3CH(OH)CH3③C2H4与C3H6④CH4O与C2H6O⑤CH2O2与C2H4O2⑥CH3OH与HOCH2 CH2OH⑦C2H4与CH2=CH—CH=CH22、对同系物的理解要注意以下几点:①必须是符合同一通式同一类物质,化学式一定不同,而且符合同一通式的并不一定就是同系物。
②结构相似,是结构特点相似,并不是完全相同。
如异丁烷与正戊烷,前者有支链,后者没有。
③结构相似,但性质有时相差较大,甲苯与苯。
④官能团一定要相同,并且官能团数目也要相同。
二、同分异构体:分子式相同,结构不同的化合物互为同分异构体1、对“分子式相同”的理解:①分子量相同的有机物一定有相同的分子式吗?不一定,如甲酸和乙醇(式量46)、乙酸和丙醇(式量60)、丙酸和丁醇(式量74)、壬烷(C9H20)和萘(C10H8)(式量128)等。
②组成元素相同且最简式也相同的有机物一定有相同的分子式吗?不一定,如环丙烷和乙烯、乙炔和苯、甲醛和乙酸和葡萄糖等。
③分子量相同、元素百分含量相同(或最简式相同)的有机物一定有相同的分子式吗?一定。
2、对“结构不同”的理解:这里的结构是指空间构型不同,要注意结构简式书写的等效性。
3、对“化合物”的理解:①有机化合物之间可以互为同分异构体;有机化合物和无机化合物之间可以互为同分异构体,如NH4CNO和CO(NH2)2,前者为无机化合物,后者为有机化合物;无机化合物之间也可以互为同分异构体。
同位素、同素异形体、同系物、同分异构体和同种物质的比较
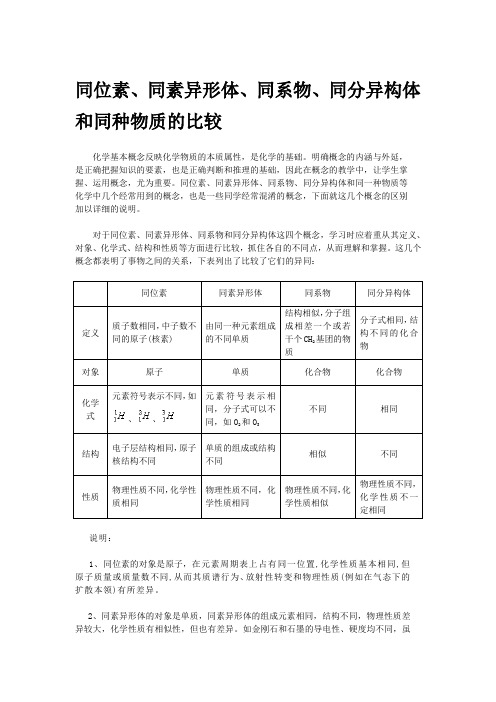
同位素、同素异形体、同系物、同分异构体和同种物质的比较化学基本概念反映化学物质的本质属性,是化学的基础。
明确概念的内涵与外延,是正确把握知识的要素,也是正确判断和推理的基础,因此在概念的教学中,让学生掌握、运用概念,尤为重要。
同位素、同素异形体、同系物、同分异构体和同一种物质等化学中几个经常用到的概念,也是一些同学经常混淆的概念,下面就这几个概念的区别加以详细的说明。
对于同位素、同素异形体、同系物和同分异构体这四个概念,学习时应着重从其定义、对象、化学式、结构和性质等方面进行比较,抓住各自的不同点,从而理解和掌握。
这几个概念都表明了事物之间的关系,下表列出了比较了它们的异同:同位素同素异形体同系物同分异构体定义质子数相同,中子数不同的原子(核素)由同一种元素组成的不同单质结构相似,分子组成相差一个或若干个CH2基团的物质分子式相同,结构不同的化合物对象原子单质化合物化合物化学式元素符号表示不同,如、、元素符号表示相同,分子式可以不同,如O2和O3不同相同结构电子层结构相同,原子核结构不同单质的组成或结构不同相似不同性质物理性质不同,化学性质相同物理性质不同,化学性质相同物理性质不同,化学性质相似物理性质不同,化学性质不一定相同说明:1、同位素的对象是原子,在元素周期表上占有同一位置,化学性质基本相同,但原子质量或质量数不同,从而其质谱行为、放射性转变和物理性质(例如在气态下的扩散本领)有所差异。
2、同素异形体的对象是单质,同素异形体的组成元素相同,结构不同,物理性质差异较大,化学性质有相似性,但也有差异。
如金刚石和石墨的导电性、硬度均不同,虽都能与氧气反应生成CO2,由于反应的热效应不同,二者的稳定性不同(石墨比金刚石能量低,石墨比金刚石稳定)。
同素异形体的形成方式有三种:(1)组成分子的原子数目不同,例如: O2和O3。
(2)晶格中原子的排列方式不同,例如:金刚石和石墨。
(3)晶格中分子排列的方式不同,例如:正交硫和单斜硫(高中不要求此种)。
同位素、同素异形体、同系物、同分异构体

同位素、同素异形体、同系物、同分异构体同位素、同素异形体、同系物、同分异构体这四个概念都带有一个同字。
分别对应同一元素的不同原子、同一元素形成的不同单质、组成结构和性质相似的有机物、分子组成相同但结构不同的物质。
对于同一种物质本文没有列入讨论。
同位素是指质子数相同而中子数不同的同一种元素的不同原子互称为同位素。
把具有一定数目的质子和一定数目的中子的一种原子叫做核素。
同位指核素的质子数相同,在周期表中占有相同的位置。
同位素中又有放射性同位素,化学书籍所列相对原子质量多数含有小数就是大都存在同位素的缘故。
相对于同位素,还有人提出同量素概念,是指质子数和中子数都不同但质量数相同的核素。
高考要求是理解同位素概念,看懂并会写核素表示式,计算元素相对原子质量。
由于这个知识点题目相对容易,仅在第一年课标卷即2007年第9题出现,难度系数0.89,所以以后再也没有出现。
同素异形体在初中九年级教材叙述为由同种元素形成的不同单质。
大体可分为三类:物质中原子的排列不同,按照高中讲解是连接方式不同,如金刚石和石墨;分子中的原子个数不同,氧气和臭氧;连接方式和分子中原子个数都不同,如红磷和白磷。
中学阶段理解同素异形体存在于第ⅣA碳、ⅤA磷、ⅥA氧的理由。
这样才有助于记忆且同时理解其性质。
硅元素原子核外电子有3层,半径大,原子之间另一种键合时彼此键合能力弱,这既是含硅化合物远不及碳的原因,也是其同素异形体不易存在的理由。
同理由于氮原子之间可以以氮氮三键结合成为稳定的氮气分子,因此也是极难成为其他形式的单质。
至于氧的同素异形体可以与碳相类比,当然高考题中曾经以信息介绍硫的同素异形体S8,笔者意见作为特例记忆合适。
至于卤族,由于其最外层7个电子,以共用一对电子成为稳定结构,当然不必形成其他形式结合的同素异形体,还有Ⅰ、Ⅱ为金属元素,可认为没有其他形式的单质,ⅢA族的铝也是金属。
这样理解记忆即可。
同素异形体物理性质和化学性质均有不同,其中物理性质差别较为明显,如熔、沸点和气味明显不同;化学性质也有不同,如石墨较金刚石稳定,臭氧比氧气氧化性强,白磷在空气中可以自燃。
“五同”的辨析与判断

“五同”的辨析与判断“五同”是指同位素、同素异形体、同系物、同分异构体、同种物质,下面从若干方面对这五个概念进行分析、比较,以加深对五个概念的认识与理解,掌握判断的方法和技巧。
一.“五同”的概念1.同位素:质子数相同质量数(或中子数)不同的原子互称同位素。
2.同素异形体:同种元素形成多种不同单质的现象叫做同素异形现象,同种元素形成的不同单质互为同素异形体。
3.同系物:结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物。
4.同分异构体:化合物具有相同的分子式,但具有不同的结构式的现象,叫做同分异构现象。
具有同分异构现象的化合物互称为同分异构体。
5.同种物质:组成和结构都相同的物质。
二.“五同”之间的比较相同的内容不同的内容使用范围同位素质子数相同、化学性质相同、在周期表中的位置相同中子数不同、质量数不同、物理性质不同原子同素异形体元素同种组成不同或结构不同无机物的单质同系物结构相似、化学性质相似、分子式通式相同分子式不同、物理性质不同有机物同分异构体分子式相同结构不同、物理性质不同、不同类时化学性质不同多为有机物同种物质组成、结构、性质都相同结构式的形状及物质的聚集状态可能不同无机物或有机物三.“五同”的分类与判断1.同位素多数元素都存在同位素,如1 1H 2 1H 3 1H , 12 6C 13 6C 14 6C , 少数元素不存在同位素,如钠、氟等元素不存在同位素。
同位素要求质子数相同且中子数不同。
如果质子数中子数都相同,则为同种原子。
同位素适用于原子之间,不适用于分子、离子等微粒。
例1.下列各组微粒中互为同位素的一组的是()A. D与2 1HB. 质量数均为40的两原子C. 3 1H 与1 1H+D. 16O、17O、18O答案:D解析:A项中D与2 1H 为同种原子;B项中质量数相同可以是同种原子,也可以是不同元素的不同原子,如40 19K 和40 20Ca 质量数均为40 ;C项中原子与离子不能互为同位素;D项为氧元素的三种不同原子,质子数相同,均为8,中子数不同,分别为8、9、10,互为同位素。
同分异构体同素异形体同位素同系物

同分异构体同素异形体同位素同系物
随着科学技术的不断进步,同分异构体同素异形体同位素同系物已经成为高等
教育领域探索的一个热门话题。
首先,同分异构体同素异形体同位素同系物是一种复合物,它可以通过向化学
缔结记相邻分子层间同分异构体中的分子结构和素异形体中的位素安排来识别。
它们具有极其重要的认识意义,因为它们可以帮助我们更加深入地理解物质的研究、认知缔结甚至分子组成的构成细节。
其次,高等教育中的相关学科也在努力探索这个话题。
在生物学和物理学中,
借助同位素技术,可以迅速地分析出蛋白质、微囊藻等有机分子的结构。
在化学领域,借助四维晶格技术,可以深刻地研究大分子在温度调节和分子过滤作用下的仪器特性。
这些先进的技术有助于加深我们对物质的深入认识,进而影响着我们的日常生活。
最后,针对该课题,各所高校均在加强研究,以构建具有国际知名度的大型科
研机构。
许多大学正在通过实验课程以及大量支持有关研究的资金,来增强教师和学生的参与度,以便他们能够实现有效识别同分异构体同素异形体同位素同系物的方法,从而为建立科学体系提供保证。
从以上这些内容可以看出,同分异构体同素异形体同位素同系物是一个充满挑
战的课题,因此应当给予高校相应的重视,充分发挥高等教育领域的科技研究能力,以更快、更准确地理解和分析相关物质构成和它们之间的关联关系。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
同位素、同素异形体、同系物、同分异构体和同种物质的比较
化学基本概念反映化学物质的本质属性,是化学的基础。
明确概念的内涵与外延,
是正确把握知识的要素,也是正确判断和推理的基础,因此在概念的教学中,让学生掌握、运用概念,尤为重要。
同位素、同素异形体、同系物、同分异构体和同一种物质等
化学中几个经常用到的概念,也是一些同学经常混淆的概念,下面就这几个概念的区别
加以详细的说明。
对于同位素、同素异形体、同系物和同分异构体这四个概念,学习时应着重从其定义、对象、化学式、结构和性质等方面进行比较,抓住各自的不同点,从而理解和掌握。
这几个概念都表明了事物之间的关系,下表列出了比较了它们的异同:
同位素同素异形体同系物同分异构体
定义质子数相同,中子数不
同的原子(核素)
由同一种元素组成
的不同单质
结构相似,分子组
成相差一个或若
干个CH2基团的物
质
分子式相同,结
构不同的化合
物
对象原子单质化合物化合物
化学式元素符号表示不同,如
、、
元素符号表示相
同,分子式可以不
同,如O2和O3
不同相同
结构电子层结构相同,原子
核结构不同
单质的组成或结构
不同
相似不同
性质物理性质不同,化学性
质相同
物理性质不同,化
学性质相同
物理性质不同,化
学性质相似
物理性质不同,
化学性质不一
定相同
说明:
1、同位素的对象是原子,在元素周期表上占有同一位置,化学性质基本相同,但原子质量或质量数不同,从而其质谱行为、放射性转变和物理性质(例如在气态下的扩散本领)有所差异。
2、同素异形体的对象是单质,同素异形体的组成元素相同,结构不同,物理性质差异较大,化学性质有相似性,但也有差异。
如金刚石和石墨的导电性、硬度均不同,虽
都能与氧气反应生成CO2,由于反应的热效应不同,二者的稳定性不同(石墨比金刚石能
量低,石墨比金刚石稳定)。
同素异形体的形成方式有三种:
(1)组成分子的原子数目不同,例如: O2和O3。
(2)晶格中原子的排列方式不同,例如:金刚石和石墨。
(3)晶格中分子排列的方式不同,例如:正交硫和单斜硫(高中不要求此种)。
注意:同素异形体指的是由同种元素形成的结构不同的单质,如H2和D2的结构相同,不属于同素异形体。
3、同系物的对象是有机化合物,属于同系物的有机物必须结构相似,在有机物的分类中,属于同一类物质,通式相同,化学性质相似,差异是分子式不同,相对分子质量不同,在组成上相差一个或若干个CH2原子团,相对分子质量相差14的整数倍,如分子中含碳原子数不同的烷烃之间就属于同系物。
(1)结构相似指的是组成元素相同,官能团的类别、官能团的数目及连接方式均相同。
结构相似不一定是完全相同,如CH3CH2CH3和(CH3)4C,前者无支链,后者有支链,但二者仍为同系物。
(2)通式相同,但通式相同不一定是同系物。
例如:乙醇与乙醚它们的通式都是C n H2n+2O,但他们官能团类别不同,不是同系物。
又如:乙烯与环丁烷,它们的通式都是C n H2n,但不是同系物。
(3) 在分子组成上必须相差一个或若干个CH2原子团。
但分子组成上相差一个或若干个CH2原子团的物质却不一定是同系物,如CH3CH2Br和CH3CH2CH2Cl都是卤代烃,且组成相差一个CH2原子团,但二者不是同系物。
(4)同系物具有相似的化学性质,物理性质有一定的递变规律,如随碳原子个数的增多,同系物的熔、沸点逐渐升高;如果碳原子个数相同,则有支链的熔、沸点低,且支链越对称,熔、沸点越低。
如沸点:正戊烷>异戊烷>新戊烷。
同系物的密度一般随着碳原子个数的增多而增大。
4、同分异构体的对象是化合物,属于同分异构体的物质必须化学式相同,结构不同,因而性质不同。
具有“五同一异”,即同分子式、同最简式、同元素、同相对原子式量、同质量分数、结构不同。
属于同分异构体的物质可以是有机物,如正丁烷和异丁烷;可以是有机物和无机物,如氰酸铵和尿素;也可以是无机物,如[Pu(H2O)4]Cl3和[Pu(H2O)2Cl2]·2H2O·Cl。
在有机物中,很多物质都存在同分异构体,中学阶段涉及的同分异构体常见的有以下几类:
(1)碳链异构:指碳原子之间连接成不同的链状或环状结构而造成的异构。
如C5H12有三种同分异构体,即正戊烷、异戊烷和新戊烷。
(2)位置异构(官能团位置异构):指官能团或取代基在在碳链上的位置不同而造成的异构。
如1—丁烯与2—丁烯、1—丙醇与2—丙醇、邻二甲苯与间二甲苯及对二甲苯。
(3)类别异构(又称官能团异构):指官能团不同而造成的异构,如1—丁炔与1,3—丁二烯、丙烯与环丙烷、乙醇与甲醚、丙醛与丙酮、乙酸与甲酸甲酯、葡萄糖与果糖、蔗糖与麦芽糖等。
(4)其他异构方式:如顺反异构、对映异构(也叫做镜像异构或手性异构)等,在中学阶段的信息题中屡有涉及。
各类有机物类别异构体情况:
⑴ C n H2n+2:只能是烷烃,而且只有碳链异构。
如CH3(CH2)3CH3、CH3CH(CH3)CH2CH3、C(CH3)4
⑵ C n H2n:单烯烃、环烷烃。
如CH2=CHCH2CH3、CH3CH=CHCH3、CH2=C(CH3)2、、
⑶ C n H2n-2:炔烃、二烯烃、环烯烃。
如:CH≡CCH2CH3、CH3C≡CCH3、CH2=CHCH=CH2、
⑷C n H2n-6:芳香烃(苯及其同系物)。
如:、、
⑸ C n H2n+2O:饱和脂肪醇、醚。
如:CH3CH2CH2OH、CH3CH(OH)CH3、CH3OCH2CH3
⑹C n H2n O:醛、酮、环醚、环醇、烯基醇。
如:CH3CH2CHO、CH3COCH3、
CH2=CHCH2OH、
、、
⑺ C n H2n O2:羧酸、酯、羟醛、羟基酮。
如:CH3CH2COOH、CH3COOCH3、HCOOCH2CH3、
HOCH2CH2CHO、CH3CH(OH)CHO、CH3COCH2OH
⑻ C n H2n+1NO2:硝基烷、氨基酸。
如:CH3CH2NO2、H2NCH2COOH
⑼ C n(H2O)m:糖类。
如: C6H12O6:CH2OH(CHOH)4CHO、CH2OH(CHOH)3COCH2OH
C12H22O11:蔗糖、麦芽糖。
