第五章 基团保护和去保护
有机化学基础知识点有机合成中的保护基与去保护

有机化学基础知识点有机合成中的保护基与去保护有机合成是有机化学的一个重要分支,它通过一系列的化学反应将简单的有机物转化为目标化合物,是现代有机化学的基础和核心。
在有机合成中,保护基(Protecting Group)和去保护(Deprotection)是经常用到的策略。
保护基是一种暂时性的官能团,它可以在某个特定的反应条件下保护某些功能团,以避免其在反应过程中发生意外的反应或损失。
而去保护则是将保护基从目标分子中除去,使其恢复原有的官能团。
有机合成中常用的保护基包括醚、酯、酸、酮、酰胺等。
它们的选择要考虑到以下几个因素:保护基的选择应易于引入和去除,同时要有足够的稳定性,以确保在反应条件下不发生早期去保护或其他副反应。
此外,还需考虑到保护基的引入和去除条件是否与目标分子的其他功能团相容,避免对其他反应步骤产生干扰。
醚和酯是常用的保护基,它们在酸性条件下稳定,在碱性条件下则容易去除。
当需要保护醇或羟基时,可以选择使用醚保护基,如醚化反应,将目标分子中的醇转化为相应的醚化物。
待其他反应完成后,通过酸催化或氧化还原等条件,将醚保护基去除。
而当需要保护羧酸时,可以选择使用酯保护基,如酯化反应,将目标分子中的羧酸转化为酯化物。
在需要的时候,通过碱的催化作用,将酯保护基去除。
酸和酮也是常见的保护基,它们在碱性条件下稳定,在酸性条件下易于去除。
当需要保护胺基时,可以选择使用酸保护基,如酸化反应,将目标分子中的胺基转化为相应的酸化物。
待其他反应完成后,通过碱的催化作用,将酸保护基去除。
而当需要保护羰基时,可以选择使用酮保护基,如酮化反应,将目标分子中的羰基转化为相应的酮化物。
在需要的时候,通过酸的催化作用,将酮保护基去除。
此外,酰胺也是常用的保护基。
它在碱性条件下稳定,在酸性条件下易于去除。
当需要保护胺基时,可以选择使用酰胺保护基,如酰胺化反应,将目标分子中的胺基转化为相应的酰胺化物。
待其他反应完成后,通过酸的催化作用,将酰胺保护基去除。
基团的保护与反应性转换

3
① BzCl/Py ②H2[Pd-C]
O OH adenin OH 94%
O OH OH OBz OH 89%
O
OCH2Ph adenin
HO
PhCH2O adenin =
NH2 N N N N 6-氨基嘌呤 (腺嘌呤)
苄基醚在碱性条件下通常是稳定的,就是对氧化剂(如过碘酸、四乙酸铅)、LiAlH4 与弱酸也是稳定的。在中性溶液中室温下它们能很快被催化氢解,常用钯催化氢解 或者与金属钠在液氨(或醇)中脱保护。该方法广泛用于糖及核苷酸中醇羟基的保护。
O R R'
HO(CH2)2OH(as Solvent) I2(5mol%), r. t. 16h
O R
O R'
19examplex 30%~90%
O R R'
O R
O R'
I2(10mol%), acetane r. t. 5~45min, or reflux 5min
O R R'
9 examplex 93%~99%
1 基团的保护和去保护
1. 该基团应该是在温和条件下引入;
2. 在化合物中其它基团发生转化所需要的条件下是稳定的;
3. 在温和条件下易于除去。
1 基团的保护和去保护
1.1 羟基的保护
1.醇羟基的保护
注:Tceoc为三氯乙氧羰基,Tbeoc 为三溴乙氧羰基,Bn为苄基,ThP为四氢吡喃基,Py为吡啶
2 ) 14 CH 3
CH 2 OH CH-OH CH 2 OH
O
① CH 3 (CH 2 ) 14 COCl, Py
PhCHO/H
有机合成课件保护基团

要点二
详细描述
在有机合成中,酮是一种常见的反应物和产物,但它的羰 基容易受到氧化和还原等反应的影响。为了保护酮的羰基 ,可以使用各种保护基团,如甲氧羰基、乙氧羰基、丙氧 羰基等。这些保护基团可以与酮形成稳定的化学键,从而 避免酮参与不必要的反应。
THANKS
谢谢
详细描述
在有机合成中,羧酸是一种常见的反应物和产物,但它的羧基容易受到脱羧和氧化等反应的影响。为了保护羧酸 ,可以使用各种保护基团,如甲酯、乙酯、丙酯等。这些保护基团可以与羧酸形成稳定的化学键,从而避免羧酸 参与不必要的反应。
醛基保护基团的应用实例
总结词
醛基保护基团能够保护醛免受氧化和还原等反应的影响。
保护。
硅氧基
如三甲基硅氧基,常用 于醇的保护,易于脱去
。
磷酸酯基
如磷酸三乙酯、磷酸三 丁酯等,适用于醇的保
护,并可耐强酸。
氨基保护基团
乙酰基
常用于伯胺的保护。
苯磺酰基
适用于仲胺和叔胺的保护,可 在酸性条件下脱去。
甲磺酰基
适用于仲胺的保护,可在酸性 条件下脱去。
丙酮肟基
适用于伯胺的保护,可在酸性 条件下脱去。
羧基保护基团
甲酯基
常用于羧酸的保护,可在碱性条件下脱去。
苯甲酯基
适用于不活泼羧酸的保护,可在碱性条件下 脱去。
乙酯基
适用于羧酸的保护,可在碱性条件下脱去。
氨基甲酸酯基
适用于羧酸的保护,可在酸性或碱性条件下 脱去。
醛基保护基团
烯丙基
常用于醛的保护。
苯甲酰基
适用于醛的保护,可在酸性条件下脱 去。
乙酰基
亲核加成反应
在形成氮-保护基团时,通常发 生亲核加成反应,即试剂进攻有 机物中的硝基、磺酸酯等基团,
有机合成-5官能团的保护

CH2OH CHOCO(CH2)14CH3 CH2OH OCH3 HO HO O O OH OCH3 89% TsOH O O 少量 HCl 蒸镏
CH2OH CHOH CH2OOC(CH2)14CH3
1) mCPBA, 99% 2) (CH3)2CuLi, 乙醚, 94% HO O O
2、形成碳酸环酯
HOH2C
O
O O P OLi OLi OH
HO
二、羰基的保护
CH3OH, H+ R2C O 2 mol/L, H2SO4 O HN H C2H5 O p-TsOH, PhH HOCH2CH2OH 85% O O HS(CH2)3SH, BF3(C2H5)2O R2C O CH3I, H2O, CH3OH R2C S S HN H C2H5 O 1) LiAlH4, THF 2) NaOH aq 3) 1 mol/L HCl O HN H C2H5 R2C OCH3 OCH3
AcO
OAc O Ar, reflux Ph condition
O
H H OAc taxinine (1)
O
AcO
OAc +
AcO
OAc
AcO +
OAc
O H
H OAc
OH HO
N H
H OAc 29-a
OH
N HO
H
H OAc
OH
taxinineA (29)
29-b
Table 2: Selective Hydrolysis of Cinnamoyl Group at C-5 of taxinine (1) yields (%) entry Reagents (equiv) conditions 29 NH2OH. HCl (12) NaOAc (12) H2O 1,4-dioxane NH2OH. HCl (15) NaOAc (15) MeOH 1,4-dioxane NH2OH. HCl (15) NaOAc (10) H2O 1,4-dioxane NH2OH. HCl (10) NaOAc (15) H2O 1,4-dioxane NH2OH. HCl (5) NaOAc (10) EtOH, H2O 1,4-dioxane 70-75 oC, 64 h 29-a 29-b 1
《有机化学》有机合成方法研究进展

有机合成方法研究进展一、前言1.有机合成是有机化学中最富活力的领域有机合成是表现有机化学家非凡创造力的舞台。
有机合成是化学科学对人类文明作出重大贡献的领域。
资料:* 1900-2000年的100年中,化学合成和分离了2285万种化合物(包括天然产物、药物、染料、高分子化合物等)。
其中大部分都是有机合成的产物。
* 许多天然存在的有机化合物,包括复杂的天然产物,都可以用有机合成方法制得。
有机合成是有机化学中永不枯竭的研究资源:* 生命科学: 生物大分子,生物活性分子,生化分析试剂等* 医药学: 药物,药理、病理分析试剂等* 农业: 农药、农用化学品等* 石油: 石油化工产品等* 材料科学: 高分子化合物,功能材料等* 食品: 食品添加剂等* 日用化工: 染料,涂料,化装品等有机合成是推动有机化学发展的永恒动力:人类文明发展对新结构、新功能、新用途的有机化合物永恒的需求。
有机化学家在解决有机合成问题过程中,全面发展了有机化学:化学结构理论,反应理论,合成方法,分离纯化方法,结构鉴定方法等。
具有重要功能的复杂有机分子,如生物大分子、天然有机化合物、药物、染料、材料、特殊有机试剂、精细有机化学产品以及其它功能有机化合物的合成需要;结构与功能关系研究需要等是有机合成方法研究的基本动力。
例如:* 手性纯氨基酸的合成--------->不对称合成法* 多肽合成--------->固相合成法* 大规模药效筛选--------->组合化学法* 特殊结构化合物合成、零污染合成--------->生物有机合成法(酶法和基因工程法)2. 有机合成发展历史(1)1828年Wohler用典型的无机物合成了尿素。
开始了近代有机化学以及有机合成的历史。
(2)1917年,Robinson合成了托品酮。
开创了系统的有机结构理论、合成方法、反应机制和结构鉴定等的研究。
并第一次开设了有机合成课程。
(3)20世纪50年代NMR技术开始应用于有机化合物结构测定。
第五保护基团剖析

t-BuMe2SiCl, (C2H5)3N ROH
n-Bu4N F
ROSi
8
9
10
硅醚保护基的除去:
酸水解稳定性:
TMS(1)<TES(64) < TBDMS (20,000) < TIPS (700,000) < TBDPS (5,000,000)
碱水解稳定性:
TMS(1)<TES(10-100) < TBDMS=TBDPS (20,000) < TIPS (100,000)
6
5.1.2 生成硅醚保护基
常用硅醚保护基:Me3Si (TMS), Et3Si (TES), tBuMe2Si
(TBDMS或TBS), iPr3Si (TIPS), tBuPh2Si (TBDPS)
7
形成三甲基硅醚
(CH3)3SiCl, (C2H5)3N ROH
HF
ROSi(CH3)3
形成叔丁基二甲基硅醚
NHBoc HO
COOMe
Bo c
H
N
N
HN
O
NH O
Boc2O
DMAP, Et3N 83%
Boc N O
O
N Boc
24
常用脱保护剂:三氟乙酸/CH2Cl2、HF/H2O
25
2、苄氧羰基(Cbz或Z) • 常用保护试剂:苄氧甲酰氯(CbzCl) • 常用脱保护剂:催化氢解、锂氨还原
26
27
3、 9-芴甲氧基羰基(Fmoc):常用于多肽合成 常用保护试剂:Fmoc-Cl(9-fluorenylmethoxycarbonyl-Cl) 常用脱保护剂:NH3, Et2NH(DEA), 哌啶(六氢吡啶) HN R1
有机化学中的官能团保护与去保护

有机化学中的官能团保护与去保护官能团保护是有机化学中的一项重要技术。
官能团保护可以在合成反应中起到保护和控制官能团反应的作用,使其不受到其他反应条件的干扰。
而去保护则是将保护官能团去除,使官能团恢复原来的活性。
本文将重点讨论有机化学中的官能团保护与去保护的相关内容。
一、官能团保护1. 保护官能团的目的在有机合成中,有时候需要保护某些官能团,以免其受到其他反应条件的干扰。
官能团保护的目的有以下几个方面:(1) 避免副反应:有机合成中常常伴随着多步反应,有些副反应会发生在特定的官能团上,通过保护这些官能团可以有效地避免不必要的副反应。
(2) 控制反应速率:有机反应中,一些官能团可能会加速或减缓反应的进行,通过保护官能团,可以控制反应速率,以便更好地控制合成过程。
(3) 保护活性官能团:有机合成中的一些活性官能团,如羟基、胺基等,容易受到空气、湿气等环境因素的影响,通过保护这些官能团,可以保持其活性。
2. 常见的官能团保护方法官能团保护有多种方法,下面介绍几种常见的官能团保护方法:(1) 酯保护:通过酯化反应将酸敏感官能团(如羟基)保护成酯,常用的保护剂有甲基、乙基等醇酚和对甲苯磺酸等。
(2) 醚保护:通过醚化反应将醇敏感官能团(如胺基)保护成醚,常用的保护剂有甲基、乙基等醇酚和氯甲基、溴甲基等卤代烷。
(3) 硅保护:通过硅化反应将官能团保护成硅醚,常用的保护剂有三甲基氯硅烷、三甲基乙氧基硅烷等。
二、官能团去保护官能团去保护是官能团保护的反向操作,它将保护官能团还原为原来的活性官能团。
官能团去保护可通过以下几种方式实现:1. 氢化还原:对于酯保护,可以使用氢气和催化剂进行还原反应,还原成羟基。
对于醚保护,可以使用硼酸或三氟乙酸等酸性条件还原为胺基。
2. 碱性水解:对于酯保护,可以使用氢氧化钠或氢氧化钾等碱性条件进行水解反应,水解为羟基。
对于醚保护,可以使用氢氧化钠或氢氧化钾等碱性条件还原为胺基。
3. 酸性水解:对于碳酸酯或脲保护,可以使用酸性条件进行水解反应,恢复原来的官能团。
《保护基团》课件

本课件将为您介绍保护基团的概念及其在化学和生物领域中的重要性和应用。 让我们一起探索这个令人着迷的主题。
保护基团
在本节中,我们将介绍保护基团的定义和其在化学和生物领域中的应用。保 护基团是实现有机合成和生物学研究中成功的关键因素。
保护基团的方法
有机合成中的保护基团
了解有机合成中保护基团的定义和常见的保护基团,以及它们引入和去除的方法。
- Chen, T.; Wu, S.; Li, H. Applications of protecting groups in organic synthesis. Journal of Organic Chemistry, 2018.
- Zhang, L.; Wang, J.; Zhao, S. The role of protective groups in biomedical research. Nature Reviews Drug Discovery, 2019.
结论
通过本课件,我们了解了保护基团在化学和生物领域中的重要性和应用前景。 同时,我们还探讨了今后的研究方向以推动该领域的发展。Fra bibliotek参考文献
- Adams, J.; Dolfi, A.; Hartman, C.; McCoy, M. D.; Smaltz, J. Design and implementation of protected areas. Journal of Environmental Conservation, 2020.
生物学中的保护基团
探索生物大分子中的保护基团的功能和去除方法,以及它们在生物学研究中的重要性。
保护基团在化学及生物领域中的应用
化学合成中的应用
现代有机合成中的保护基

第 三 章
有 机 合 成 中 的 保 护 基
21
特 殊 的, 它 的 除 去 是 用 肼 在 甲 醇 或 乙 醇 中 进 行, 不 是 一 个 严 格 的 水 解 反 应。 它 的 机 理 大 致 是 肼 对 酰 胺 的 加 成 - 消 除, 最 后 的 净 结 果 是 置 换 出 游 离 的 氨 基。
第 三 章
有 机 合 成 中 的 保 护 基
20
围 绕 这 些 要 求 人 们 在 经 过 了 几 十 年 的 努 力 之 后, 今 天 仍 不 时 有 对 新 的 保 护 基 团 的 研 究 工 作 报 道, 为 有 机 合 成 提 供 更 加 巧 妙 的 手 段1, 2。 相 信 今 后 对 这 一 领 域 的 研 究 还 会 有 更 大 的 发 展。
3.2
保护基团的互不相干性原则
对 于 一 个 结 构 复 杂 的 分 子 的 合 成, 合 成 设 计 者 必 须 考 虑 许 多 问 题, 如 片 断 的 合 成、 片 断 的 连 接、 立 体 化 学、 官 能 团 的 相 互 转 换, 还 有 就 是 保 护 基 问 题。 合 成 中, 上 保 护 基 的 问 题 往 往 是 容 易 解 决 的, 而 去 保 护 基 步 骤 常 是 整 个 合 成 的 压 轴 戏, 许 多 的 合 成 工 作 因 此 而 失 败。 当 合 成 过 程 中 存 在 多 种 保 护 基 的 选 择 性 脱 除 时, 预 先 作 一 周 密 的 考 虑 是 必 需 的, 最 理 想 的 情 形 就 是 我 们 认 为 的 保 护 基 团 能 符 合 互 不 相 干 性 原 则, 即 其 中 一 个 保 护 基 的 脱 除 不 影 响 另 外 的 保 护 基。 虽 然 实 际 的 情 况 很 少 百 分 之 百 符 合, 但 这 种 观 念 在 考 虑 问 题 时 是 十 分 重 要 的。 下 面, 我 们 分 十 二 种 情 况 加 以 讨 论。
官能团保护及去保护
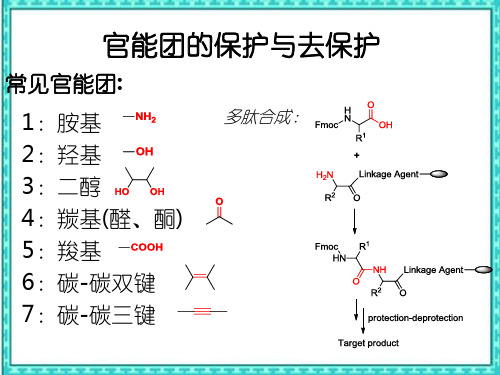
常见官能团:
1:胺基 2:羟基 3:二醇 4:羰基(醛、酮) 5:羧基 6:碳-碳双键 7:碳-碳三键
多肽合成:
官能团保护及去保护
选择保护基的原则:
(1) 保护基的供应来源(容易得到、价格便宜); (2) 保护基不能引入其它可参与目标反应的官能团; (3) 保护基的引入对化合物的结构论证不致增加过量的
官能团保护及去保护
硅醚保护基
三甲基硅醚 (TMSOR叔)丁基二甲基硅醚 (TBDMS-OR or TBS-OR) 叔丁基二苯基硅醚 (TBDPS-OR )
苄醚保护基 烷氧基甲基醚或烷氧基取代甲基醚 2.4 酰化成酯保护
官能团保护及去保护
笏甲氧羰基(Fmoc)的引入与去除 笏甲氧羰基的特点: √ 对酸极其稳定,在它的存在下,Boc和苄基可去保护;
√ 较易由简单的胺不通过水解去保护,被保护的胺以游离 碱释出;
√ 一般而言,Fmoc对氢化稳定,但某些情况下,它可用 H2/Pd-C在AcOH和MeOH中脱去。Fmoc保护基可与酸
和K2CO3、DIPEA、NaH、Et3N 和n-BuLi在有机溶剂
(如DMF、二氯甲烷和乙腈等)中反应来引入,或 C6H4CHO/ NaBH4、NaBH3CN或NaBH(OAc)3还原胺 化。
官能团保护及去保护
实例:
官能团保护及去保护
去保1)护常方用法催:化氢解脱去,如H2/Pd-C、H2/PdCl2、 Pd/HCOOH或Pd-C/HCOOH、Pd-C/HCOONH4、或 Pd-C/环已烯作氢源转移氢化;注:在用催化氢化(H2, Pd/C)脱苄时, 胺对钯催化剂的慢性毒化使得反应较慢通 常较慢,甚至反应不彻底.一般加酸或Boc2O促进Bn的离 去。
有机合成中的重要保护基团和去保护方法

有机合成中的重要保护基团和去保护方法在有机合成中,保护基团扮演着至关重要的角色。
它们可以保护反应中的特定功能团,以防止其与其他试剂发生不必要的反应。
保护基团的引入和去除成为了有机合成中的两个关键步骤。
在本文中,我们将探讨一些有机合成中的重要保护基团,以及去除它们的方法。
1. 醇保护基团醇保护基团是有机合成中最常用的保护基团之一。
它可以通过与醇反应生成醚来引入。
常用的醇保护基团包括醇酯、醚和醇醚。
在选取保护基团时,需要考虑其稳定性和去保护的条件。
去除醇保护基团的方法有很多种。
常用的方法包括酸处理和还原。
酸处理通常使用强酸,如硫酸、盐酸或三氟甲磺酸。
还原方法则是使用还原试剂,如铝醇盐或氢化钠。
2. 酰基保护基团酰基保护基团是保护羧酸的常用基团。
它可以通过与酸反应生成酯来引入。
常用的酰基保护基团包括乙酰基、苄酰基和丙酰基。
选择合适的酰基保护基团需要考虑其稳定性和易于去除的条件。
去除酰基保护基团的方法主要有碱处理和酸处理。
碱处理通常使用碱性试剂,如碳酸氢钠或氢氧化钠。
酸处理则使用酸性试剂,如盐酸或三氟甲磺酸。
3. 氨基保护基团氨基保护基团常用于保护胺官能团。
常用的氨基保护基团包括铺地基(Boc)、苄基、三甲基硅基(TMS)和甲酰基。
选择保护基团需要考虑其稳定性和去除的条件。
去除氨基保护基团的方法有多种。
常用的方法包括酸处理和碱处理。
酸处理通常使用强酸,如三氟甲磺酸或盐酸。
碱处理通常使用氢氧化钠或氢氧化铯。
4. 硅基保护基团硅基保护基团常用于保护醇和酚官能团。
常用的硅基保护基团包括二甲基氧硅基(TBS)、二异丙基氧硅基(TIPS)和三甲基硅基(TMS)。
选择硅基保护基团需要考虑其稳定性和去除的条件。
去除硅基保护基团的方法主要是酸处理。
常用的酸处理试剂包括氢氟酸、三氟甲磺酸和硼氟酸。
总结起来,有机合成中的保护基团起着至关重要的作用。
正确选择保护基团可以有效地保护特定的功能团,而去除保护基团则是合成目标化合物的关键步骤。
有机化学中的保护基团和去保护反应

有机化学中的保护基团和去保护反应保护基团在有机化学中具有重要的作用,它们可以保护特定的官能团,防止其被其他反应所干扰。
同时,去保护反应则能够将保护基团去除,使被保护的官能团重新恢复活性。
本文将探讨有机化学中的保护基团和去保护反应,并介绍一些常见的实例。
一、保护基团的种类及其应用1. 硅醚保护基团硅醚保护基团由于其稳定性和易去除性而在有机化学中得到广泛应用。
硅醚保护基团可以保护醇、酚等羟基化合物。
典型的硅醚保护基团有三甲基硅基(TMS)、甲基三乙基硅基(SEM)、四甲基硅基(TBS)等。
去除硅醚保护基团常用的方法是用强酸或碱溶液处理。
2. 酯保护基团酯保护基团可以保护羧酸和酮等官能团。
合成中常使用的酯保护基团有甲酯、乙酯等。
酯保护基团可以通过酸催化或碱催化条件下的酯水解反应去除。
3. 酰基保护基团酰基保护基团可以保护胺基化合物中的氨基,常用的酰基保护基团有苯甲酰基(Boc)、三甲基乙酰基(TFA)、甲氧羰基(Fmoc)等。
去除酰基保护基团需要使用相应的去保护试剂,如氢氟酸、三氟乙酸等。
二、去保护反应的应用1.硅醚的去保护硅醚保护基团可以通过酸或碱处理去除。
常用的去保护试剂是氟化银(AgF)和氟化铵(NH4F),它们可以有效去除硅醚保护基团,还原羟基的反应活性。
2. 酯的去保护酯保护基团可以通过酸催化的水解或酸催化的醇ysis反应去除。
常用的去保护试剂是浓氢氧化钠(NaOH)、甲醇、乙醇等。
在合适的条件下,酯保护基团可以选择性地去除,而不影响其他官能团。
3. 酰基的去保护酰基保护基团可以通过使用酸或碱去保护试剂去除。
例如,苯甲酰基(Boc)保护基团可以使用三氟乙酸或氢氟酸处理去除。
甲氧羰基(Fmoc)保护基团可以通过用碱处理去除。
这些去保护反应一般是在温和的条件下进行。
三、实例展示1. 硅醚保护例如,对于芳香醇类化合物,可以使用TMS作为保护基团,合成过程中保护羟基,避免其在反应中被氧化或其他官能团干扰。
大学有机合成实验中的保护基与去保护实验

大学有机合成实验中的保护基与去保护实验在有机合成领域中,保护基和去保护实验是非常重要的技术手段。
保护基是指在有机化合物中引入的一种特殊基团,用于保护某些活泼的官能团,以防止其在反应过程中发生不必要的副反应。
而去保护实验则是指将保护基从有机化合物中去除的过程,以使目标分子恢复其原有的活性。
本文将以大学有机合成实验中的保护基与去保护实验为主题,探讨其原理、方法和应用。
一、保护基的原理和方法1.1 保护基的原理保护基的引入是为了保护某些活泼的官能团,在反应过程中避免其发生副反应。
常见的保护基包括醚基、酯基、酰基等。
保护基通过形成稳定的化学键与活泼官能团结合,使其不易与其他试剂发生反应。
1.2 保护基的引入方法保护基的引入方法多种多样,常见的方法包括酯化反应、醚化反应、酰化反应等。
以酯化反应为例,可以通过将醇与酸反应得到酯化产物,从而引入酯基保护基。
二、去保护实验的原理和方法2.1 去保护实验的原理去保护实验是将保护基从有机化合物中去除的过程。
去保护实验的原理主要是通过适当的反应条件,使保护基与官能团之间的化学键断裂,从而恢复目标分子的原有活性。
2.2 去保护实验的方法去保护实验的方法也多种多样,常见的方法包括酸性水解、碱性水解、氢化还原等。
以酸性水解为例,可以通过在酸性条件下处理有机化合物,使保护基与官能团之间的酯键断裂,从而去除酯基保护基。
三、保护基与去保护实验的应用保护基和去保护实验在有机合成中有着广泛的应用。
它们可以用于保护活泼的官能团,使其在反应过程中不发生不必要的副反应,从而提高目标产物的收率和纯度。
同时,保护基还可以用于调控反应速率和选择性,实现复杂有机合成的目标。
在药物合成中,保护基和去保护实验被广泛应用于合成复杂的天然产物和药物分子。
通过引入保护基,可以保护药物分子中的特定官能团,以避免在合成过程中发生不可逆的副反应。
而通过去保护实验,可以恢复药物分子的原有活性,使其具备生物活性。
此外,保护基和去保护实验还在有机合成中扮演着重要的角色。
有关官能团的保护

有机合成中的基团保护、导向基(高考必备)(一)基团保护在有机合成中,些不希望起反应的官能团,在反应试剂或反应条件的影响下而产生副反应,这样就不能达到预计的合成目标,因此,必须采取对这些基团进行保护,完成合成后再除去保护基,使其复原。
对保护措施一定要符合下列要求:①只对要保护的基团发生反应,而对其他基团不反应;②反应较容易进行,精制容易;③保护基易脱除,在除去保护基时,不影响其他基团。
下面只简略介绍要保护的基团的方法。
1、羟基的保护在进行氧化反应或某些在碱性条件进行的反应,往往要对羟基进行保护。
如防止羟基受碱的影响,可用成醚反应。
防止羟基氧化可用酯化反应。
2、对氨基的保护氨基是个很活泼的基团,在进行氧化、烷基化、磺化、硝化、卤化等反应时往往要对氨基进行保护。
(1)乙酰化(2)对NR 2可以加H + 质子化形成季铵盐,– NH 2也可加H + 成 – NH3而保护。
3、对羰基的保护羰基,特别是醛基,在进行氧化反应或遇碱时,往往要进行保护。
对羰基的保护一般采用缩醛或缩酮反应。
4、对羧基的保护羧基在高温或遇碱性试剂时,有时也需要保护,对羧基的保护最常用的是酯化反应。
– OH –OR– NH 2 CH 3COCl或酸酐–NH 2-C -CH 3O–COOH + R –OH – COORH +–CHO + 2ROH – CH(OR)2H +-O -C -RO– OH5、对不饱和碳碳键的保护碳碳重键易被氧化,对它们的保护主要要加成使之达到饱和。
(二)导向基在有机合成中,往往要“借”某个基团的作用使其达到预定的目的,预定目的达到后,再把借来的基团去掉,恢复本来面貌,这个“借”用基团 我们叫“导向基”。
当然这样的基团,要符合易“借”和易去掉的原则,如由苯合成1,3,5 – 三溴苯,在苯的亲电取代反应中,溴是邻、对位取代基,而1,3,5 – 三溴苯互居间位,显然不是由溴的定位效应能引起的。
但如苯上有一个强的邻、对位定位基存在,它的定位效应比溴的定位效应强,使溴进入它的邻、对位,这样溴就会呈间位,而苯环上原来并无此类基团,显然要在合成时首先引入,完成任务后,再把它去掉,恰好氨基能完成这样的任务,因为它是一个强的邻、对位定位基,它可如下引入:– H → – NO 2 → – NH 2 ,同时氨基也容易去掉:– NH 2 → – N 2 → – H 因此,它的合成路线是:根据导向基团的目的不同,可分为下列几种情况: 1、致活导向假如要合成 可以用 但这种方法产率低,因为丙酮两个甲基活性一样,会有副反应发生:但在丙酮的一个甲基上导入一个致活基团,使两个甲基上的氢的活性有显著差别,这可用一个乙酯基(–COOC 2H 5)导入丙酮的一个甲基上,则这个甲基的氢OC 6H 5O+ C 6H 5BrOC 6H 5OC 6H 5C 6H 5Br碱C 6H 5Br碱O C 6H 5C 6H 5O有较大的活性,使这个碳成为苄基溴进攻的部位,因此,利用乙酰乙酸乙酯而不用丙酮,完成任务后,把乙酯基水解成羧基,利用β– 酮酸易于脱羧的特性将导向基去掉,于是得出合成路线为:2、致钝导向活化可以导向,有时致钝也能导向,如合成氨基是很强的邻、对位定位基,进行取代反应时容易生成多元取代物:如只在苯胺环上的氨基的对位引入一个溴,必须将氨基的活性降低,这可通过乙酰化反应来达到,同时乙酰氨基是一个邻、对位定位基,而此情况下对位产物是主要产物:3、利用封闭特定位置来导向例如合成 ,用苯胺为起始原料,用混酸硝化,一方面苯胺易被硝酸氧化,另一方面,苯胺与硫酸还会生成硫酸盐,而 是一个间位定位基,硝化时得到,所以苯胺硝化时,要把苯胺乙酰化后,再硝化。
第五章保护基团

锂化合物的全部反应。反应完毕,l,3-二噻环己烷化合物可在
高汞离子存在下用酸水解,变为羰基化合物。
43
例3 合成
44
例4 合成
45
例5 合成
46
5.5 羧基常用的保护
形成羧酸酯的形式被保护,
常用甲酯、乙酯、叔丁酯或苄酯。
叔丁酯用酸除去,苄酯用氢解法除去。 还可用酰胺和酰肼来保护羧基 。
甲酯和乙酯可以用羧酸直接与甲醇或乙醇发生酯化反应制得,又 可以被碱水解。 叔丁酯可由羧酸先变为酰氯,再与叔丁醇作用,或者通过羧酸与 异丁烯直接作用而得。它不能氢解,在通常条件下也不被氨解及 碱催化水解 。 苯甲酯可由羧酸与苯甲基卤在碱性条件下反应而得。它除了可在 强酸性或碱性条件下水解,还可以被氢解 。
2-叔丁氧羰基氧亚胺基苯乙腈
N O O N
23
O
NH2 COOH
Boc 2O NaOH, t -BuOH, H 2 O 78%
NH2.HCl HO COOMe
Boc2 O Et3 N 95% HO
NHB
C
H N Boc 2O HN O DMAP, Et N
24
B
N Boc
N
常用脱保护剂:三氟乙酸/CH2Cl2、HF/H2O
25
2、苄氧羰基(Cbz或Z) • 常用保护试剂:苄氧甲酰氯(CbzCl) • 常用脱保护剂:催化氢解、锂氨还原
26
27
3、 9-芴甲氧基羰基(Fmoc):常用于多肽合成 常用保护试剂:Fmoc-Cl(9-fluorenylmethoxycarbonyl-Cl) 常用脱保护剂:NH3, Et2NH(DEA), 哌啶(六氢吡啶) ,吗啡啉
11
5.1.3 生成烷基醚保护基
第五篇基团保护

ROH
NaOH,Me2SO4
Me3SiI ,CHCl3
ROCH3
一、羟基的保护基团
脱去甲基保护基,回复到醇类,通常使用 Lewis酸,如BBr3及Me3SiI,也就是引用硬软酸碱 原理(hard-soft acid and base principle),使氧原 子与硼或硅原子结合(较硬的共轭酸),而以溴离 子或碘离子(较软的共轭碱)将甲基(较软的共轭 酸)除去。
Ketal (acetal) Dithioketal Oxothioketal
Cyanohydrin 羟腈 Aminonitrile
Dioxolane 二氧戊环 Oxazolidine 咪唑烷
Imidazolidine Thiazolidine 噻唑烷 Dithiolane 二硫戊烷
Dithiane 二噻烷
(iii)1N HCl
Et
O
R2C=O
HOCH2CH2OH,H+ H3O+
O CH2 R2C
O CH2
三、羰基的保护
CO2CH3 HOCH2CH2OH
TsOH
O
benzene (86%)
CH2OH O
CH2OCOCH3 O
CO2CH3 O O LiAlH4 (67%) CH2OH O O
CH3COCl
BnO
O
Me N
O
O
HO OH
三、羰基的保护
保护羰基的方法可分为二种:
一是形成缩酮或其对等物
R CO
R'
RX
C R' Y
醛基是最容易形成缩醛或对等物的羰基,而苯环上 的酮基则是反应性最低的羰基。
一般说来,反应性是:
醛基 > 链状羰基(环已酮)> 环戊酮 > α,β-不饱 和酮 > 苯基酮。
有机合成中的基团保护

有机合成中的基团保护在有机合成中,某些不希望起反应的官能团,在反应试剂或反应条件的影响下而产生副反应,这样就不能达到预计的合成目标,因此,必须采取措施保护某些官能团,待完成反应后再除去保护基,使其复原。
1、保护措施必须符合如下要求①只对要保护的基团发生反应,而对其它基团不反应;②反应较易进行,精制容易;③保护基易脱除,在除去保护基时,不影响其它基团。
2、常见的基团保护措施①羟基的保护在进行氧化或某些在碱性条件下进行的反应,往往要对羟基进行保护。
a.防止羟基受碱的影响,可用成醚反应。
b.防止羟基氧化可用酯化反应。
②对羧基的保护羧基在高温或碱性条件下,有时也需要保护。
对羧基的保护最常用的是酯化反应。
③对不饱和碳碳键的保护碳碳双键易被氧化,对它们的保护主要用加成反应使之达到饱和。
;④对羰基的保护(以信息题出现)羰基,特别是醛基,在进行氧化反应或遇碱时,往往要进行保护。
对羰基的保护一般采用生成缩醛或缩酮的反应。
(缩醛或缩酮)(缩酮)生成的缩醛或缩酮水解又变成原来的醛或酮。
3、题例解析例1、已知下列信息:①烯键在一定条件下氧化可生成二元醇:②醛能发生如下反应生成缩醛:缩醛比较稳定,与稀碱和氧化剂均难起反应,但在稀酸中温热,会水解为原来的醛。
现有如下合成路线:试回答下列问题:(1)写出A、B的结构简式:________、________。
(2)写出反应Ⅲ的化学方程式:________。
解析:由题给信息知,欲使CH2=CH—CHO变为CH2OH—CHOH—CHO,需将C=C双键氧化,而—CHO对氧化剂敏感,故应先进行保护,待C=C双键氧化完毕,再将醛基还原出来,故合成路线为:答案:(1)A:CH2=CH=CH(OC2H5)2 B:CH2OH—CHOH—CH(OC2H5)(2)CH2OH—CHOH—CH(OC2H5) CH2OH—CHOH—CHO+2C2H5OH例2、已知胺(R—NH2)具有下列性质:−R—NHCOCH3+CH3COOH(Ⅰ)R—NH2+(CH3CO)2O−→−R—NH2+CH3COOH(Ⅱ)R—NHCOCH3+H2O−→硝基苯胺是重要的化工原料,其合成路线如下:(1)a、c、e分别为________。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2.与被保护分子能有效的结合 保护基与被保护分子形成的结构,必须能经受住随后所 要发生的主要反应条件的作用,而不致于被破坏。 例如, 为了使醛基在碱性条件或氧化条件下不发生变化 ,就要选择醇将它制成缩醛保护起来。因为缩醛是一种双醚 键结构,对碱或氧化剂很稳定。但在酸性条件下却经不住“ 考验”,必然发生水解而复原。此即去掉保护基的办法。 3.在保持分子的其他部分结构不损坏的条件下易除去 假如保护基引入不易,除去困难,或者虽容易引入,而 去掉时会损坏分子的其他部分结构,这样的保护基反而会导 致合成的失败。至少是会影响合成路线的简捷性。这样的基 团也不便作为保护基。 二、保护基的实例应用 例1 设计5-甲基-5-羟基-2-已酮的合成路线
1)分析 TM俗名敏克静,是一种抗过敏药,用于寻麻 疹、神经性皮炎等的治疗。
从结构上看,以哌嗪为母体,两端有两个活性中心— —仲二胺。但是,两端所引入的取代基不同,应分别作处 理,故拆开如下:
前已介绍,可用铵盐形式保护。
(2) 合成 首先合成原料。 a) 间-甲基苄基氯的制备:
b)α-(对-氯苯基)苄基溴的制备:
(4)变成氨基甲酸酯 a) 试剂合成:
b) 实施保护:
作用:对酸、碱、氧化剂均稳定。 去除:
二、醇类——羟基的保护 1. 特性 醇易氧化,易烷化成醚,酰化成酯,仲醇和叔醇还容易脱水。 2.保护法 常用有三种方法: (1)成醚 保护:
作用:对格氏试剂、还原剂LiAIH4、氧化剂CrO3均稳定。 去除:
b. 催化 是指对整个反应的活化。现在较好的催化剂是N , N ' - 二 环 己 基 碳 化 二 亚 胺 ( N , N ' -DiCycIohexyIcarbodiimide)简称DCC。 (a)制备:
DCC是一种优良的偶联剂,在其催化下,肽键合成时 羧基可以不活化。
(b)催化机理:假设氨基酸中保护了氨基及羧基以外 的部分用R表示,环己基用R'表示。则DCC的催化机理可 能按如下进行:
第五章 官能团的保护
把不必参加反应,而又有可能参加反应,甚至是优先 反应的官能团,暂时的隐蔽起来,从而使必要的合成反应 顺利地进行。这种暂时的隐蔽官能团的作法,称为官能团 的保护。为了保护其他官能团而引入的官能团,称“保护 基”(Protective groups)。
第一节 对保护基的要求 一、对保护基的具体要求
肽的合成:设氨基酸除NH2 以外用R’’表示
而
(2)合成 ① 保护氨基采用Cbz保护法
② 保护羧基:用苄酯保护法
③ 合成:
习题 一、完成下列转变:
二、试设计下列化合物的合成线路:
保护:
作用:对格氏试剂、LiAIH4、CrO3、酸、碱均稳定。 去除:、
(2)转变成混合型缩醛 试剂制备:
保护:
作用:对RMgX、LiAIH4、CrO3及碱稳定。 去除:
生成酯 作用:对酸、CrO3稳定
四、酸类—羧基的保护。 1.特性
羟酸有多种反应,与碱(有机、无机)成盐;脂肪族β羰基酸、a,β-二元羧酸、芳酸等受热脱羧;各种羟基酸有 多种反应,如生成不同的酯等;对各种羟基物亦生成酯
2.保护法 一般转变为酯
(1)转变为甲酯或乙酯 其作用脱羧、成盐等反应稳定。
保护:去Biblioteka :注意:(1)甲酯的制备和水解,均比乙酯容易;(2) 甲酯为固体相应的乙酯为液体,处理时应当采取不同的措 施;(3)通过采取原酸酯-C(OR)3进行保护可降低官能 团的活性。
保护 去除:
五.醛、酮中C=O的保护
1.保护法 保护的方法很多,常用制成缩醛、酮的办法。
2.共性 对多种试剂都能反应,甚至仅有碱存在时自身就能
反应。 (1)制成二甲或二乙基缩醛或缩酮
保护:
作用: a)对还原剂Na+NH3,Na+HOR,H2/[催化剂],NaBH4, LiAIH4都稳定。 b)在中性或碱性条件下,对于除O3以外几乎所有的氧化剂 都稳定。 c)对亲核试剂:RMgX,NaH,EtOK,NH2,H2N-NH2, SO2CI2—吡啶等都稳定。但对酸不稳定,即为去除保护基的理 论依据。 (2)对于酮的保护 尤其宜用乙二醇。
第二节 几类重要官能团的保护法 -、胺类――氨基的保护 1.特性
容易氧化、酰化和烃基化。 2.保护法
常用的有四种: (1)成盐保护法 此法简单而有效
保护:
作用:对氧化剂KMnO4,Na2Cr2O7等稳定。 去除:
(2)变成苄胺或取代的苄胺或三苯甲基胺 a) 变成苄胺
保护:
作用:对酸、碱、格氏试剂均稳定。 去除:氢解:
(1)分析 从骨架看,官能团是一分子醇酮,而醇又可 看成同碳连有相同烃(甲)基的叔醇;C=O基处,可视为甲 基酮。根据优先拆开的部位的经验—官能团处,链分支处等, 此TM可作如下拆开:
这种拆开是对的。但是,按原路线返回进行合成,却是 行不通的。这是因为酮基比酯基更活泼,当乙酰丙酸乙酯与 MeMgI发生反应时,优先发生在酮类羰基上:所以,要想按 拆开的路子返回合成,在格氏反应发生之前,应先将酮羰基 保护起来。
(2)变成混合型缩醛——特殊反应 保护:
作用:对碱、格氏试剂、LiAIH4、金属氢化物、CrO3等 均稳定。 优点:去除保护基条件温和——无机酸水溶液、室温即 可水解。
(3)变成酯(略)
三、酚类——对羟基的保护 1. 特性
其特性与醇相似,但比醇更易被氧化。 2. 保护法
其保护法常用三种: (1)成醚:
b) 变成三苯甲基衍生物 保护: 作用:对碱、格氏试剂稳定。 去除:去除条件亦温和,但成本高。
(3)变成酰胺、磺酰胺或酰亚胺 a) 生成酰胺:
作用:对氧化剂、烃基化剂均稳定。 去除:
b)生成磺酰胺:
作用:防止叔胺的生成。 去除:
c) 生成酰亚胺(特别适用于伯胺)
作用:对酸稳定。适用于酸性中无需胺的反应。 去除:
(2) 合成 前面酯的合成步骤省略
三、如何寻找保护基 1.官能团的相似性及其递变规律 例如:-NH2,-OH,-SH等基,保护法相似,并具 有如下递变规律:
用于保护它们中某一类基因的方法,也常用于其他两类 2.保护基与被保护基是相辅相成的,可互相换用
例如:醇或胺与醛或酮,可借缩合反应,相互保护。
① 氨基的保护与解除:方法很多,最重要的有两种: a苄氧羰基[Carbobenzoxy(简称Cbz)]保护法
(a)保护基(苄氧甲酰氯)的制备: (b)保护:
(c)去除保护基:由于酰胺比酯更难水解,可用催化剂 氢解使苄-氧键断裂后,再加热使不稳定的氨基甲酸分解 (脱羧)放出CO2而去除。
而
b.叔丁氧羰基保护法[t-Butoxycarbony(简称Boc)] (a)保护:
(b)解除:酸水解
(c)解除:
③ 活化与催化 a. 活化 是对参与反应的官能团的活化。目的:(a)是
反应在较低的温度(常温)下进行;(b)保持立体旋光性 不变。有时活化氨基,但更重要的常常是活化羧基。
方法:氨基酸与PCI3或PCl5作用,制成酰氯。
(注:在两个氨基酸反应时,若此—氨基酸的羧基被活化, 则另-氨基酸的羧基可不予保护而能安全地进行定向反应
保护:
作用:比开链的缩醛酮更稳定。 去除:
第三节 合成实例
例1 设计顺—5—庚烯—2—酮的合成路线。
TM的骨架双键是顺式双键结构,因此,可以看成是由 叁键催化加氢而得的。
合成
例2 设计由哌嗪合成敏克静——1-[对-氯-(a-苯基) 苄基]-4-(间-甲基)苄基哌嗪二盐酸盐的合成路线。
c) 母体官能团的保护与全合成:
例3 多肽的合成
肽键的实质就是酰胺键 键,称为“肽键”。
, 肽分子中的酰胺
设计二肽苏氨酰-丙氨酸(简称苏-丙肽)的合成路线。 (1)分析 肽的拆开很容易,根据定义切断的位置——肽 键是很明显的。
但是,反过来进行合成却很麻烦。因为,若将两种氨基酸 随便放在一起,将得到四种产物:苏-丙肽,丙-苏肽,苏-苏肽 和丙-丙肽。所要之产物,只占其中约1/4。若要实现定向合成 苏-丙肽,就必得将苏氨酸的氨基和丙氨酸的羧基,分别“保护 起来”。为了提高产率,又需要将苏氨酸的羧基和丙氨酸的氨 基分别予以“活化”。
