人教版高中化学选修五第三章 烃的含所衍生物第三节 第2课 时 酯
人教版高中化学选修5-3.3《酯》名师教学设计

第三章烃的含氧衍生物第三节羧酸酯第二课时酯教材分析1.教材的知识结构:本节是人教版高中《有机化学基础》第三章第三节《羧酸酯》,从知识结构上看,包含了两部分内容即羧酸和酯,乙酸是羧酸类物质的代表物,酯是羧酸与醇的衍生物。
本节分两课时完成,其中第一课时按教材的编排体系,包含乙酸概述、乙酸的分子结构特点、乙酸的性质研究、乙酸的用途。
第二课时包含酯的结构、性质、存在。
2.教材的地位和作用:从教材整体上看,乙酸乙酯既是很重要的烃的含氧衍生物,又是酯类物质的代表物,它和我们的生活生产实际密切相关,从知识内涵和乙酸乙酯的分子结构特点上看,乙酸乙酯既是乙酸和乙醇的酯化反应知识的巩固、延续和发展,又是学好酯(油脂)类化合物的基础。
3.教学重点:酯的结构和性质是本课的教学重点,特别是酯的水解反应的特点和过程分析探究酯水解实验的观察和有关问题及数据分析、推理又是性质教学中的重点。
4.教材的处理:为了使教学具有更强的逻辑性,突出教学重点内容,充分说明物质的性质决定物质的结构,对教材的内容在教学程序上进行了调整:(1)将酯的定义放在乙酸乙酯的结构之后再讲授,这样有利于学生对结构决定性质这一化学基本学习方法的理解(2)为了突出酯的水解反应的过程分析和加深对酯水解的条件理解和对化学探究实验中固定变量法的应用,添加乙酸乙酯的水解实验,让学生感受酯在不同条件下的水解程度,理解实验条件的控制对实验过程及实验数据的影响,达到了“知其然,知其所以然”的教学效果。
5.教学目标:知识与技能:(1)使学生掌握酯的分子结构特点,主要物理性质、用途。
(2)根据乙酸乙酯的组成和结构特点,认识酯的水解反应。
过程与方法:根据教学任务和学生特征,为了最大限度地调动学生参与课堂教学过程,使其真正成为课堂的主人,成为发现问题和解决问题的高手,本课时主要采用研究探索式教学。
通过实验设计、动手实验,培养学生的观察能力,加强基本操作训练,培养分析、综合的思维能力和求实、创新、合作的优良品质。
高中化学第三章烃的含氧衍生物3.3.2酯课件新人教版选修5

CH3COOH+C2H5OH。 CH3COONa+C2H5OH。
一
二
请思考在乙酸乙酯的水解反应中,酸作催化剂和碱作催化剂有什 么不同? 提示:无机酸、碱都是乙酸乙酯水解反应的催化剂。在无机酸催 化下,乙酸乙酯的水解反应仍为可逆反应。 CH3COOC2H5+H2O CH3COOH+C2H5OH 当用碱作乙酸乙酯水解反应的催化剂时,碱与水解生成的乙酸发 生中和反应,抑制了酯化反应,可使水解反应趋于完全。 CH3COOC2H5+NaOH CH3COONa+C2H5OH 故在酯的水解反应中,酸只作催化剂,碱既作催化剂又作反应物。
知识点1
知识点2
解析:该物质的苯环上直接连有羧基,因此具有酸性,且酸性强于 碳酸 (酚羟基结构也能与 CO2 3 反应生成HCO3 ), 故能与纯碱溶液反应, 选项A正确;该物质中含有酯基,因此可以水解,且水解产物只有一 种(在酸性条件下水解生成3,4,5-三羟基苯甲酸),因此选项B正确;能 与NaOH反应的有苯环支链的酚羟基、酯基、羧基,其中酯基水解 后生成1 mol羧基和1 mol酚羟基,所以1 mol该有机物最多能与8 mol NaOH反应,故C选项不正确;酚羟基的邻位和对位上的氢原子 易被溴取代,故该有机物能与溴水发生取代反应,选项D正确。 答案:C
知识点1
知识点2
知识点2 酯化反应和酯的水解在有机推断中的应用 【例题2】 乙酸苯甲酯具有提升花香和果香香味的作用,故常用 于化妆品工业和食品工业中,乙酸苯甲酯的合成方案为:
A D(
B(C7H7Cl) )
C
(1)写出A、C的结构简式。 (2)写出C与CH3COOH反应生成D的化学方程式。
知识点1
一
高中化学 第三章 烃的含氧衍生物 第三节 第二课时 酯课件高中选修5化学课件

(1)酯水解反应的断键原理
。
(2)酯的酸性或碱性水解反应 ①在酸性条件下,酯的水解是 可逆
反应。
乙酸乙酯在稀 H2SO4 存在下水解反应的化学方程式为 CH3COOC2H5+H2O
CH3COOH+C2H5OH。
12/11/2021
第十七页,共三十五页。
②在碱性条件下,酯水解生成
羧酸(suō suān)
C34H50O2+H2O-C27H46O=C7H6O2。
12/11/2021
第二十七页,共三十五页。
3.某有机物X能发生水解反应,水解产物为Y和Z。同温同压下,相同质量的Y和Z的蒸气
(zhēnɡ qì)所占体积相同,化合物X可能是(
)
A
A.乙酸丙酯
B.甲酸甲酯
C.乙酸甲酯
D.乙酸乙酯
解析:题给信息看,X为酯,水解后产生醇和羧酸。同温同压下,相同质量的Y和Z的蒸气 所占体积相同,说明所得(suǒ dé)的醇和羧酸的相对分子质量相同。含n个碳原子的饱和 一元羧酸的相对分子质量与含(n+1)个碳原子的饱和一元醇的相对分子质量相同。对 照各选项,正确选项为A。
6 种,分别是
、
、
、
、
12/11/2021
、
。
第十二页,共三十五页。
2.化学式为C5H10O2的羧酸A可由醇B氧化(yǎnghuà)得到,A和B可生成酯C(相对分子质量为
172),符合此条件的酯有(
)
D
A.1种
B.2种
C.3种
D.4种
解析:羧酸A可由醇B氧化得到,则醇B的结构简式为R—CH2OH。因C的相对分 子(fēnzǐ)质量为172,故化学式为C10H20O2,即醇分子中有5个碳原子,为C4H9— CH2OH,而—C4H9有四种同分异构体,故酯C可能有四种结构。
人教化学选修5第3章《烃的含氧衍生物》归纳提升
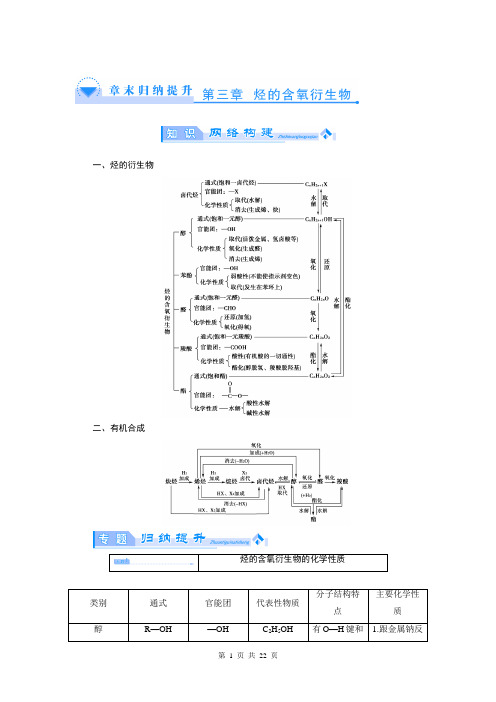
一、烃的衍生物二、有机合成(2013·长安一中高二期末)2011年西安世园会期间对大量盆栽鲜花施用了诱抗素剂,以保持鲜花盛开。
诱抗素的分子结构如图,下列关于该分子说法正确的是( )A .含有碳碳双键、羧基、酯基三种官能团B .1 mol 该物质在催化剂加热条件下最多可与4 mol H 2发生加成反应C .1 mol 该有机物与足量的溴水反应能消耗4 mol Br 2D .该分子中所有碳原子可能位于同一平面上【解析】 该分子含有碳碳双键、羧基和羰基三种官能团,A 项错误;1 mol 该有机物最多消耗3 mol Br 2,C 项错误;分子内部有饱和碳原子,D 项不正确;分子中三个碳碳双键和羰基能够与H2发生加成反应,—COOH中的碳氧双键不能与H2反应,B项正确。
【答案】 B醇、由于与—OH相连的基团不同,—OH受相连基团的影响也不同,这些羟基上的氢原子活性也就不同,表现在性质上也就有较大差异。
如下表:2332 ROH。
(2012·上海高考)过量的下列溶液与水杨酸(COOHOH)反应能得到化学式为C7H5O3Na的是()A.NaHCO3溶液B.Na2CO3溶液C.NaOH溶液D.NaCl溶液【解析】由于酸性:COOH>H2CO3>OH,可知水杨酸与NaHCO3溶液反应时只是—COOH作用转化为—COONa,产物的分子式为C7H5O3Na,A项正确;水杨酸与Na2CO3溶液反应时—COOH、—OH均反应,生成产物的分子式为C7H4O3Na2,B项错误;水杨酸与NaOH溶液反应时—COOH、—OH均反应,生成产物的分子式为C7H4O3Na2,C项错误;与NaCl溶液不反应,D项错误。
【答案】 A现有4种液态有机物A、B、C、D,分子式均为C3H6O2,请根据下表所给出的实验结果,判断这4种物质为何物质(写出结构简式)。
A________;B________;C________;D________。
人教版高中化学选修五课件第三章第三节.pptx

(1)酸性
RCOOH
RCOO-+H+
羧酸都是较弱的酸,但不同的羧酸酸性也不相 同.
(2)酯化反应 C—O
—OH
O—H H 如乙酸与乙醇的反应: C_H_3_C_O_O_H_+__C_2_H_5O_H____浓_H△_2S_O4___C_H_3_C_O_O_C_2_H_5_+_H_2_O_.
二、乙酸的组成和结构及物理性质 1.组成和结构
要点突破讲练互动
羟基的活性比较
探究导引1 化合物跟足量的哪种物质的溶液 反应可得到钠盐C7H5O3Na? 提示:NaHCO3.
要点归纳 醇、酚、羧酸的结构中均有—OH,由于这些 —OH所连的基团不同,—OH受相连基团的 影响就不同.故羟基上的氢原子的活性也就 不同,表现在性质上也相差较大,其比较如 下:
即时应用 1.已知酸性大小:羧酸>碳酸>酚.下列含溴化 合物中的溴原子,在适当条件下都能被羟基 取代(均可称为水解反应),所得产物能与 NaHCO3溶液反应的是( )
解析:选C.A水解成醇,没有酸性.B、D水解 成酚,酸性比H2CO3弱不能和NaHCO3反应.C 水 解 得 羧 酸 , 酸 性 大 于 H2CO3, 能 和 NaHCO3 反应.
【解析】 本题所给条件很少,所以应充分 领会题意,使用好有限的条件.由酯的分子式 可知为不饱和酯,又不能使溴的CCl4溶液褪 色可知为芳香酯.醇B氧化后可得酸C,说明 B、C分子中的碳原子数相等.酯A中有14个C 原子,则B和C中各有7个C原子,
从而可判断B是苯甲醇,C是苯甲酸,A是苯甲 酸苯甲酯.苯甲醇有三种同分异构体,即三种 甲基苯酚,它们都能与NaOH反应.本题的创 新之处是题中隐含了B和C的碳原子个数相 等.
新知初探自学导引
酯 人教版选修5 第三章第三节第二课时

4.酯的通式 酯的通式
• 饱和一元羧酸和饱和一元醇生成的酯 • (1)一般通式: 一般通式: • (2)结构通式: 结构通式:
• (3)组成通式: CnH2nO2 组成通式:
资料卡片
自然界中的有机酯
含有: 含有:丁酸乙酯
含有: 含有:戊酸戊酯
含有:乙酸异戊酯 含有:
酯的结构、性质及用途 酯的结构、
第三章
烃的含氧衍生物 羧酸 酯
第三节
(第二课时 第二课时) 第二课时
沁阳一中 岳爱国
【学习目标】
• • • • • 会设计实验探究乙酸乙酯在不同条件下 的水解速率。 【学习重点】 酯水解的原理 【学习难点】 酯水解反应的基本规律
二、酯
被 1、定义: 羧酸分子羧基中的━OH被 定义: 羧酸分子羧基中的━ 取代后的产物。 ━OR′取代后的产物。 取代后的产物 2、简式: RCOOR′ 简式: 思考: 思考: 1、是否只有醇与羧酸才能发生酯化反应? 、是否只有醇与羧酸才能发生酯化反应? 2、乙醇与氢溴酸加热能否生成酯?讨论无 、乙醇与氢溴酸加热能否生成酯? 机酸生成酯的条件是什么? 机酸生成酯的条件是什么?
试管编号 1 2 向试管内加6 向试管内加6 滴乙酸乙酯再 稀硫酸(1 加稀硫酸(1︰ mL; 5)0.5 mL;蒸 馏水5 mL。 馏水5 mL。振 荡均匀 3 向试管内加6 向试管内加6滴 乙酸乙酯, 乙酸乙酯,再 30% 加30%的NaOH 溶液0. 溶液0. 5 mL, 蒸馏水5mL 5mL振荡 蒸馏水5mL振荡 均匀 实验步骤1 实验步骤1 向试管内加 6滴乙酸乙 酯,再加 mL蒸馏 5.5 mL蒸馏 水。振荡均 匀
实验步骤2 将三支试管同时放入70 80℃的水浴里加热约 70~ 实验步骤2 将三支试管同时放入70~80℃的水浴里加热约 5 min,闻各试管里乙酸乙酯的气味 min, 酯的水解反应在酸性条件好,还是碱性条件好?(碱性) ?(碱性 (1)酯的水解反应在酸性条件好,还是碱性条件好?(碱性)
选修5第三章烃的含氧衍生物_第三节第二课时 酯

稀H2SO4
△ NaOH △
CH3COOH + C2H5OH
CH3COOH + C2H5OH
无机酸 △ 无机碱
酯水解的规律: 酯 + 水 酯 + 碱
酸 + 醇 盐 + 醇
△
酯在无机酸、碱催化下,均能发生水解反应, 其中在酸性条件下水解是可逆的,在碱性条 件下水解是不可逆的。
酯的化学性质
酯可以水解生成相应的酸和醇。
无机酸
RCOOR′+NaOH → RCOONa + R′OH
【小结】:
1、酯在酸(或碱)存在的条件下, 水解生 成酸和醇。 2、酯的水解和酸与醇的酯化反应是可 逆的。 3、在有碱存在时, 酯的水解趋近于完全。 (用化学平衡知识解释)
பைடு நூலகம்
酯化反应与酯水解反应的比较
酯
反应关系
化
水
解
催化剂
催化剂的 其他作用 加热方式
RCOOR′
CnH2nO2
与饱和一元羧酸互为同分异构体
酯的命名——“某酸某酯”
【练一练】说出下列化合物的名称: • (1)CH3COOCH2CH3 • (2)HCOOCH2CH3 • (3)CH3CH2O—NO2 硝酸乙酯 • (4)CH3CH2—NO2
【思考】 乙醇与氢溴酸加热能否生成酯?讨论无机
4、现有分子式为C3H6O2的四种有机物A、B、
NaOH溶液 银氨溶液 新制Cu(OH)2 A B C D 中和反应 —— 水解反应 水解反应 —— 有银镜 有银镜 —— 溶解 产生红色沉淀 产生红色沉淀 —— 金属钠 产生氢气 产生氢气 —— ——
C、D,且分子内均含有甲基,把它们分别进 行下列实验以鉴别之,其实验记录如下:
人教版高中化学选修5第3章《烃的含氧衍生物》word教案2

点高得多,即在不太低的温度下就凝聚为冰一样的晶体,故纯乙酸又称冰醋酸。
【板书】2.分子结成和结构分子式 结构式 结构简式C 2H 4O 2 CH 3COOH官能团:C OOH 或 —COOH (羧基)【板书】3.化学性质【分析】盐酸、硫酸等无机酸呈酸性,是因为其中的氢能够电离,乙酸有明显的酸性,在电离溶液里能部分地电离,CH 3COOHCH 3COO -+H +。
因此,乙酸具有酸的通性。
【板书】(1)乙酸的酸性性质化学方程式与酸碱指示剂反应 乙酸能使紫色石蕊试液变红 与爽朗金属反应Zn+2CH 3COOH→(CH 3COO 2)Zn+H 2↑ 与碱反应 CH 3COOH+NaOH→CH 3COONa+H 2O 与碱性氧化物反应CuO+2CH 3COOH→(CH 3COO)2Cu+H 2O 与某些盐反应 CaCO 3+2CH 3COOH→(CH 3COO)2Ca+H 2O+CO 2↑酸性由强到弱顺序:HCl>H 2SO 3>CH 3COOH>H 2CO 3>【过渡】乙酸除具有酸的通性外,还能够发生酯化反应 【板书】2.酯化反应师:在高一的时候差不多对乙酸的酯化反应进行了学习,并做了酯化反应的实验,大伙儿回忆一下此实验需要的试剂、反应原理、装置以HHOC H C O H芳香酸 : 苯甲酸(由苯环和羧基构成)(2)按分子里的羧基的数目分一元羧酸:CH 3CH 2COOH 、C 6H 5 COOH羧酸 二元羧酸HOOC —COOH (乙二酸) HOOC(CH 2)4COOH (己二酸) 多元羧酸 C 6H 2(COOH)4饱和一元脂肪酸:组成C n H 2n O 2 (n≥1)或者C n H 2n+1COOH(n≥0) 例:写出C 4H 8O 2羧酸的结构简式CH 3CH 2CH 2COOH ,C 5H 10O 2的羧酸的同分异构体有 种(4种,因为丁基有四种)【板书】3.化学性质羧酸的官能团差不多上—COOH ,因而必具有相似的性质:酸的通性和酯化反应。
人教版选修5化学高二年级第三章 烃的含氧衍生物第三节 羧酸 酯第二课时酯教案2

人教版选修5第三章烃的含氧衍生物第三节羧酸酯第二课时酯教案2【教学目标】1.酯的组成和结构特点2.酯的化学性质【教学过程】一、酯1.结构简式通式:RCOOR′分子式通式:Cn H2nO2与同碳原子羧酸同分异构体。
酯类难溶于水,易溶于乙酸和乙醚等有机溶剂,密度一般比水小。
低级酯是具有芳香气味的液体。
2. 酯类化合物的存在:酯类化合物的存在:水果、饮料、糖类、糕点等。
二、酯的化学性质1.怎样设计酯水解的实验?(2)酯在酸性、碱性、中性哪种条件易水解呢?根据(1)、(2)两个问题,讨论酯水解实验的设计方案。
对学生的设计方案进行评价,并指导学生按以下方案进行实验。
指导(1)温度不能过高;(2)闻气味的顺序。
分组实验酯的水解酯+水酸+醇CH3COO—CH2CH3+H2O CH3COOH+CH3CH2OHRCOOCH2R +H2O RCOOH + RCH2OHH2O在有酸或碱存在的条件下,酯能发生水解反应,生成相应的酸和醇。
在酸存在的条件下酯的水解是可逆反应,而在碱存在下酯的水解趋于完全,是不可逆反应。
2.闻气味的顺序及现象:Ⅳ中几乎无气味、Ⅲ中稍有气味、Ⅱ中仍有气味、Ⅰ中仍有气味。
推理出Ⅰ、Ⅱ中乙酸乙酯没有反应;Ⅲ、Ⅳ中乙酸乙酯发生了反应。
3.思考与交流(1)酯的水解反应在酸性条件好,还是碱性条件好?(碱性)碱性条件好,碱作催化剂,它与生成的酸反应减少生成物的量,使可逆反应向右进行的程度大。
(2)酯化反应H2SO4和NaOH哪种作催化剂好?(浓H2SO4)H2SO4作催化剂好,浓H2SO4不仅起催化剂作用,还兼起脱水剂作用,使可逆反应向右进行。
(3)酯为什么在中性条件下难水解,而在酸、碱性条件下易水解?有机分子间的反应进行较慢,许多有机反应需加热和催化剂条件,与无机离子间反应瞬间即可完成有区别。
三、酯的醇解R1-COO-R2+ R3—OH R-COO-R3+ R2—OH酯的醇解又称酯交换反应,在有机合成中有重要用途。
高中化学选修五《有机化学基础》《酯》【创新教案】

第三章烃的含氧衍生物第三节羧酸酯第二课时酯教材分析1.教材的知识结构:本节是人教版高中《有机化学基础》第三章第三节《羧酸酯》,从知识结构上看,包含了两部分内容即羧酸和酯,乙酸是羧酸类物质的代表物,酯是羧酸与醇的衍生物。
本节分两课时完成,其中第一课时按教材的编排体系,包含乙酸概述、乙酸的分子结构特点、乙酸的性质研究、乙酸的用途。
第二课时包含酯的结构、性质、存在。
2.教材的地位和作用:从教材整体上看,乙酸乙酯既是很重要的烃的含氧衍生物,又是酯类物质的代表物,它和我们的生活生产实际密切相关,从知识内涵和乙酸乙酯的分子结构特点上看,乙酸乙酯既是乙酸和乙醇的酯化反应知识的巩固、延续和发展,又是学好酯(油脂)类化合物的基础。
3.教学重点:酯的结构和性质是本课的教学重点,特别是酯的水解反应的特点和过程分析探究酯水解实验的观察和有关问题及数据分析、推理又是性质教学中的重点。
4.教材的处理:为了使教学具有更强的逻辑性,突出教学重点内容,充分说明物质的性质决定物质的结构,对教材的内容在教学程序上进行了调整:(1)将酯的定义放在乙酸乙酯的结构之后再讲授,这样有利于学生对结构决定性质这一化学基本学习方法的理解(2)为了突出酯的水解反应的过程分析和加深对酯水解的条件理解和对化学探究实验中固定变量法的应用,添加乙酸乙酯的水解实验,让学生感受酯在不同条件下的水解程度,理解实验条件的控制对实验过程及实验数据的影响,达到了“知其然,知其所以然”的教学效果。
5.教学目标:知识与技能:(1)使学生掌握酯的分子结构特点,主要物理性质、用途。
(2)根据乙酸乙酯的组成和结构特点,认识酯的水解反应。
过程与方法:根据教学任务和学生特征,为了最大限度地调动学生参与课堂教学过程,使其真正成为课堂的主人,成为发现问题和解决问题的高手,本课时主要采用研究探索式教学。
通过实验设计、动手实验,培养学生的观察能力,加强基本操作训练,培养分析、综合的思维能力和求实、创新、合作的优良品质。
高中化学选修5课件第三章 第三节 第2课时 酯

答案:B
方法指津 有机物与氢氧化钠反应消耗氢氧化钠量的判断 能与氢氧化钠反应的官能团:卤素原子、与苯环直接相连 的羟基(酚羟基)、羧基、酯基和肽键(-CONH-)等。 各官能团消耗氢氧化钠的量的规律:
(1)每 1 mol 酚羟基、羧基、肽键均消耗 1 mol NaOH。
(2) -X( 卤素) 连在烃基上时,每 1 mol -X 消耗 1 mol
△
5.乙酸乙酯在 KOH 溶液中水解,得到的产物是( ①乙酸钾;②甲醇;③乙醇;④乙酸。 A.①② C.①③ B.②③ D.②④
C
)。
一、酯的结构与性质 1.酯的结构 酯的结构简式为 RCOOR′,官能团为酯基(-COO-)。其 中 R 和 R′可以相同,也可以不同,但 R 可以为 H,而 R′不 能为 H。饱和一元酯的通式为 CnH2nO2(n≥2),与相同碳原子数 的饱和一元羧酸互为同分异构体。 2.酯的化学性质 酯的水解为酯化反应的逆反应,水解时酯基中 C—O 键断裂, 碳原子与—OH 或—OR 等结合形成羧酸或新的酯,氧原子与氢 原子结合生成醇(或酚)。酯的水解分为酸性水解和碱性水解。
下列说法正确的是( 生加成反应
)。
A.该有机物 1 mol 能与 3 mol H2 在镍作催化剂条件下发 B.该有机物 1 mol 能与 1 mol H2 在镍作催化剂条件下发
生加成反应
C.该有机物能与 NaHCO3 反应放出 CO2 D.该有机物在一定条件下能发生银镜反应
点拨:1 mol 苯环加氢需消耗 3 mol H2,但酯基上的羰基不 能与 H2 发生加成反应,含有-COOH 才能与 NaHCO3 反应放 出CO2,酚羟基与 NaHCO3 不反应。 答案:A
A.5 mol B.4 mol C.3 mol
最新人教版高中化学选修五第三章烃的含氧衍生物 第三节 羧酸 酯

第三节羧酸酯学习目标核心素养1.了解羧酸的分类。
2.了解乙酸的结构特点,理解乙酸的主要化学性质。
3.了解乙酸乙酯的结构特点,理解乙酸乙酯的主要化学性质。
1.能够写出羧酸、酯的官能团,简单代表物的结构简式和名称。
(宏观辨识与微观探析)2.能够描述和分析乙酸、乙酸乙酯的重要反应,能书写相应的反应式。
(变化观念与平衡思想)3.基于乙酸、乙酸乙酯的性质,认识酯化反应和酯的水解反应的反应机理,建立认知模型,并能运用模型分析和推断其他含有羧基、酯基的有机化合物的化学性质。
(证据推理与模型认知)一、羧酸1.羧酸的组成和结构:2.分类:(1)按照与羧基相连的烃基的结构分类:(2)按照分子中羧基的数目分类:【教材二次开发】教材中提到“羧酸可以分为脂肪酸和芳香酸”,硬脂酸(C17H35COOH)和乙酸是否为同系物?油酸(C17H33COOH)和乙酸是否为同系物? 提示:硬脂酸和乙酸为同系物,油酸和乙酸不为同系物。
二、乙酸1.分子结构:分子式:C2H4O2;结构式:;结构简式:或CH3COOH;比例模型:;核磁共振氢谱:2个峰,峰面积比为3∶1。
2.物理性质:颜色状态气味溶解性熔点无色液体有刺激性气味易溶于水和乙醇温度低于16.6 ℃凝结成冰状晶体,又称冰醋酸3.化学性质:(1)弱酸性。
乙酸是一种常见的有机酸,比碳酸酸性强,但仍属弱酸,电离方程式为CH3COOH CH3COO-+H+,属于一元弱酸,具有酸的通性。
(2)酯化反应。
①乙酸与乙醇的酯化反应方程式:CH3COOH+CH3CH2OH CH3COOC2H5+H2O。
②酯化反应原理:【判一判】判断下列说法是否正确。
①食醋就是乙酸。
(×)提示:食醋是乙酸的水溶液。
②在水溶液中CH3COOH中的—CH3可以电离出H+。
(×)提示:应为—COOH电离出H+。
③1 mol C2H5OH和1 mol CH3COOH在浓硫酸作用下加热可以完全反应生成1 mol CH3COOC2H5。
高中化学-第三章第三节第二课时 酯
酸加羟基醇加氢
酯化反应与酯水解反应的比较
酯化
水解
反应系
催化剂 催化剂的 其他作用 加热方式
CH3COOH+C2H5OH
浓硫酸
吸水,提高CH3COOH 与C2H5OH的转化率
酒精灯火焰加热
CH3COOC2H5+H2O
稀H2SO4或NaOH
NaOH中和酯水解生成的 CH3COOH,提高酯的水
解率
水浴加热
CH3COOCH3 CH3COOCH2CH3
乙酸甲酯 乙酸乙酯
CH3CH2COOCH2CH3 丙酸乙酯
写出下列酯的结构简式:
丁酸甲酯 苯甲酸甲酯 苯甲酸苯甲酯
【重点】 饱和一元羧酸、酯, 通式为CnH2nO2
酯与饱和一元羧酸互为同分异构体
判断下列哪些互为同分异构体? A.醋酸、甲酸甲酯 B.丙酸、甲酸乙酯、乙酸甲酯 C. 2-甲基丙酸、丁酸、甲酸丙酯、甲酸异
某酯在酸性条件下水解得到相对分子质量相等的两
种有机产物,该酯可能是( BC )
A.甲酸甲酯 B.乙酸异丙酯 C.甲酸乙酯 D.乙酸甲酯
O RC-OR’+ H-OH
稀硫酸
O RC—OH+H—OR’
RCOOR′+NaOH → RCOONa + R′OH
小结:
1、酯在酸存在的条件下, 水解生成酸和醇。 2、酯在碱存在的条件下, 水解生成羧酸盐和醇。
注意:酯类水解需要水浴加热(70℃~80℃)
丙酯、乙酸乙酯、丙酸甲酯
3、物理性质
分子量小通常为液体的酯是具有芳香气味、难溶 于水、比水轻的液体,易溶于有机溶剂。
4.乙酸乙酯的分子结构
化学式:C4H8O2
吸
化学选修5第二章第三节 酯(完全原创)

C2H5-O-NO2+H2O 硝酸乙酯
注意:硝酸酯与硝基化合物的区别。
C2H5-O-NO2 硝酸乙酯(属于酯类) C2H5-NO2 硝基乙烷(硝基化合物,不属于酯类) 问题:下列物质属于哪一类有机物?
酯类。磷酸三乙酯。
(2)羧酸与醇的酯化反应 ①一元羧酸与一元醇之间的酯化反应。 ②一元羧酸与多元醇之间的酯化反应,如:
结论:酯在碱性条件下水解程度最大,水解几乎趋于完 全。酯在酸性条件下水解程度较小,具有可逆性。
乙酸乙酯在酸性、碱性条件下的水解方程式:
=
O CH3C-O-C2H5 + H2O
=
O 稀H2SO4 CH3C-OH + C2H5OH
△
=
O CH3C-O-C2H5 + NaOH △
=
O CH3C-ONa + C2H5OH
小结
1.酯的水解化学方程式的书写规律:
H+
R1COOR2+ H2O △ R1COOH + R2OH
R1COOR2+ NaOH
△ R1COONa + R2OH
羧酸钠 醇
2.能与NaOH水溶液反应的有机物:①卤代烃(水 解)、②酚(中和)、③羧酸(中和)、④酯(水解)。
CH3COO
COOCH3
1. 1mol有机物
(2)酯:插入法或移C法。4种。
5.酯的生成与制取:
(1)无机含氧酸+羧酸→酯
常见的无机含氧酸结构式:
O
O
O
H-O-C-O-H (碳酸H2CO3)
H-O-N=O
H-O-S-O-H
O (硝酸HNO3) (硫酸H2SO4)
【整合】人教版选修5化学高二年级第三章烃的含氧衍生物第三节羧酸酯第二课时酯教案3.doc

人教版选修5第三章绘的含氧衍生物第三节竣酸酯第二课时酯教案3【教学目标】根据酯的组成和结构的特点,认识酯的水解反应。
【教学过程】同学们根据上一节的学习,请写出乙酸与乙醇酯化的反应方程式?注意观察乙酸乙酯的结构一、酯1. 乙酸的酯化反应是一个可逆反应,因此酯类的重要化学性质之一就是可以发生水解反应。
酯的水解酯+水无机酸或喊酸+醇SRCOOCH2R +H20 无机:或喊 RCOOH + RCH2OHH2O2. 【科学探究】乙酸乙酯在中性、酸性、碱性溶液中以及不用温度下的水解速率P62实验探究,对比思考,迁移提高情景创设:用计算机课件展示乙酸乙酯的分子结构模型。
实验探究方案1:学生分组开展探究实验,探究乙酸乙酯的水解反应规律对比思考、讨论提高:(1)对比乙酸和乙酸乙酯的物理性质差异,为什么会有这些差异?竣基一COOH为亲水基,乙酯基一COOC2H5为疏水基,所以乙酸易溶于水,乙酸乙酯微溶于水、密度比水小(2)乙酸乙酯在酸性、碱性条件下的水解有什么不同,为什么?乙酸乙酯在酸性条件下的水解反应为可逆反应、水解速率较慢;而在碱性条件下水解反应为不可逆反应,水解速率较快。
因为在碱性条件下水解生成的竣酸与碱发生中和反应,使酯水解的化学平衡向正反应方向移动实验探究方案2:(供参考)乙酸乙酯在『、OH催化下,均能发生水解反应,其中在酸性条件下的水解是可逆的,在碱性条件下水解是不可逆的。
选取3支大小相同的试管(可选用细一些的试管,便于观察),在试管壁上用透明胶带贴上毫米刻度纸(实验室没有准备)。
分别向其屮加入5 mL 0.1 mol・|/出$04、5 mL蒸镭水和5 mL 0.1 mol ・L'1 NaOH溶液,再用滴管分别加入1 mL乙酸乙酯(约20滴)。
将3支试管放在同一烧杯中水浴加热,并记录下反应温度(一般控制在70 °C左右)。
数据记录:每隔1 min记录一次酯层的高度,以此确定水解反应的速率,至酸溶液催化的试管中酯层消失时结束。
【整合】人教版选修5化学高二年级第三章烃的含氧衍生物第三节羧酸酯第二课时酯教案1.doc

人教版选修5第三章绘的含氧衍生物第三节竣酸酯第二课时酯教案1【教学目标】1•知道酯的定义、物理性质及饱和一元酯通式2.掌握酯水解反应的机理,并了解酯化反应和酯的水解是一对可逆反应3.能根据酯的命名,写出相应的酯的结构简式4.知道常见的几种酯知识回顾酸的通性【教学过程】一、酯1.酯是竣酸分子竣基屮的-0H被-0附取代后的产物,简写为RCOOR',其屮R和R'可以担同, 也可以丕同。
2.竣酸酯的官能团:-COOR3.酯的性质:酯一般难溶于水,主要性质是易发生建反应,其条件是在酸性或碱性条件下, 有关方程式为:催化剂、(1)酸性条件:RCOOR' +出()、、RCOOI【+R' 01〕(2)碱性条件:RCOOR' +NsOH二RCOO0+R' 0H4.【议一议】(1)对比乙酸和乙酸乙酯的物理性质差异,为什么会有这些差异?竣基一COOH为亲水基,乙酯基一C00Q也为疏水基,所以乙酸易溶于水,乙酸乙酯微溶于水、密度比水小(2)乙酸乙酯在酸性、碱性条件下的水解有什么不同,为什么?乙酸乙酯在酸性条件下的水解反应为可逆反应、水解速率较慢;而在碱性条件下水解反应为不可逆反应,水解速率较快。
因为在碱性条件下水解生成的竣酸与碱发生中和反应,使酯水解的化学平衡向正反应方向移动二、酚、醇、竣酸中轻基的区别三、酯化反应与酯的水解反应的比较涯催化剂浓硫酸稀硫酸或NaOH溶液催化剂的其他作用吸水、提高CHaCOOH和C2H5OH的转化率NaOH中和酯水解牛成的竣酸、提高酯的水解率加热方式酒精灯火焰加热热水浴加热反应类型酯化反应、取代反应水解反应、取代反应四、课堂小结:酯的水解和酯化反应都属于収代反应,在酸性条件下二者是可逆的;酯在碱性条件下可以彻底水解得到竣酸钠和相应的醇(酚)。
如何除去鱼腥味烧鱼吋为了除去鱼腥味,可加入黄酒、醋、生姜、葱。
鱼腥味是由三甲胺(CHJ^N产生的,黄酒中的乙醇溶解三甲胺,加热过程中三甲胺和酒精一起被蒸发,达到去腥的目的。
高中化学第三章烃的含氧衍生物32酯课件选修5高中选修5化学课件

12/11/2021
第四页,共三十五页。
3. 酯的命名:酯类化合物是根据生成酯的酸和醇的名称来命 名的,例如:
12/11/2021
第五页,共三十五页。
4. 酯的同分异构现象:酯的同分异构现象,一般要比其他的 烃的含氧衍生物的同分异构现象更复杂,除酯类产生同分异构体 外,酯与羧酸等物质之间也能产生同分异构体。
解析:由题意可知,该羧酸酯分子含有 2 个酯基,因此有 2 个水分子参加反应,即 C18H26O5+2H2O―→羧酸+2C2H6O,由原 子守恒可知羧酸的分子式为 C14H18O5。
12/11/2021
第十四页,共三十五页。
4.下列说法正确的是( B ) A.酯类均无还原性,不会与新制 Cu(OH)2 悬浊液发生氧化 还原反应 B.油脂为高级脂肪酸的甘油酯,属于酯类 C.从溴水中提取 Br2 可用植物油作萃取剂 D.乙酸乙酯和乙酸互为同分异构体
A.A 分子中含有醛基 B.A 分子中含有氧元素 C.A 分子中含有甲基 D.A 分子中含有一个碳原子
解析:由酯 B 能发生银镜反应可知,A 为甲醛,所以 C 项错 误。甲酸甲酯中含有—CHO ,能发生银镜反应。
12/1NaOH 溶液中会出现分层现象,然后用
第三章
烃的含氧衍生物
12/11/2021
第一页,共三十五页。
第三节 羧酸(suō suān) 酯
课时作业2——酯
12/11/2021
第二页,共三十五页。
课基前础预训习练
12/11/2021
第三页,共三十五页。
一、酯 1. 酯的一般通式: RCOOR′。饱和一元羧酸和饱和一元醇形 成的酯的分子式为 CnH2nO2(n≥2) ,所以这种酯与碳原子数相同 的饱和一元羧酸互为同分异构体。 2. 酯的通性 物理性质:酯 不 溶于水,易溶于 有机溶剂 ,密度比 水 小 ,低级酯有果香味。这种特殊的性质往往被用来鉴别酯 类物质。
2018-2019学年高中化学 第三章 烃的含氧衍生物 3.3.2 酯课件 新人教版选修5

8.有关下图所示化合物的说法不正确的是( )
A.既可以与 Br2 的 CCl4 溶液发生加成反应,又可以在光 照下与 Br2 发生取代反应
B.1 mol 该化合物最多可以与 3 mol NaOH 反应 C.既可以催化加氢,又可以使酸性 KMnO4 溶液褪色 D.既可以与 FeCl3 溶液发生显色反应,又可以与 NaHCO3 溶液反应放出 CO2 气体
9.乙酸苯甲酯对花香和果香的香韵具有提升作用,故常用 于化妆品工业和食品工业。乙酸苯甲酯可以用下面的设计方案 合成。
ACl―2,① ―光→照B稀―― ②碱→液CCH3COO―H、―③→浓硫酸、△
(1)写出 A、C 的结构简式:A________、C________。
(2)D 有很多的同分异构体,含有酯基的一取代苯结构的同
2.下列对有机物
的叙述中错误的是( ) A.常温下,与 NaHCO3 溶液反应放出 CO2 气体 B.能发生碱性水解,1 mol 该有机物完全反应需要消耗 8 mol NaOH C.与稀硫酸共热时,生成两种有机物 D.该有机物的分子式为 C14H10O9
课前预习
一、 1. RCOOR′ CnH2nO2(n≥2) 2. 不 有机溶剂 小 3. 甲酸甲酯 苯甲酸乙酯 乙二酸二乙酯 二乙酸乙二酯 硝酸乙 酯
2.C 该有机物中含有羧基(—COOH),可与 NaHCO3 溶 液反应放出 CO2,所以 A 项正确。该有机物中含 5 个酚羟基、 1 个羧基和 1 个酯基,在碱性条件下水解后又生成 1 个酚羟基 和 1 个羧基,故 1 mol 该有机物可中和 8 mol NaOH,所以 B 项正确。与稀硫酸共热时,该有机物水解,生成的是同一种物
7.已知酸性强弱顺序是苯甲酸>碳酸>苯酚,将
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
4mol
6mol
Br HO
HO
O
O
依据有机物的结构简式确定1 mol 该有机物消耗NaOH的物 质的量时,要特别注意官能团的连接方式,因不同的连接方式可 消耗不同量的NaOH,否则容易造成判断错误.
(1)只有1个—OH连在苯环上时,1 mol 该有机物消耗1 mol NaOH, 而(2)——OXH连连在在烃烃基基上上时时,不1 与moNla该O有H发机生物反消应耗.1 mol NaOH; 而—X
31.没有过不去的坎,只要你还活着。 53.一个人幸运的前提,是他有能力改变自己。 17.不怕万人阻挡,只怕自己投降。 18.命是弱者的借口,运是强者的谦词。 79.越努力,越幸运。 11.向你的美好的希冀和追求撒开网吧,九百九十九次落空了,还有一千次呢…… 3、笑着面临,不去抱怨。悠然,随心,随性,随缘。肯定终身改动的,只在百年后,那一朵花开的时分。 55.讨厌自己明明不甘平凡却又不好好努力。 31.愚蠢的人总是为昨天悔恨,为明天祈祷,可惜的是少了今天的努力。 76.失败时郁郁寡欢,这是懦夫的表现。 80.死鱼随波逐流,活鱼逆流而上。 11.要别人相信自己,不是靠信誓旦旦,而是靠行动。 37.要成功,先发疯,头脑简单向前冲。
水解反应 取代反应
举一反三
写出下列水解反应
稀H2SO4
C2H5OOC-COOC2H5
+2H2O
2 C2H5OH
+ HOOC-COOH
+2 NaOH + 2NaOH
COONa
Na
+ H2O
OH
O
ONa
CH3—C—ONa +
H2O
2.写出阿司匹林在酸性条件和碱性条件下水解的方程式。
【当堂训练】
1.对有机物
四、酯的化学性质
酯化反应
浓硫酸
CH3COOH+C2H5OH
CH3COOC2H5+H2O
①吸水;②蒸出乙酸乙酯;③增加乙醇浓度。
什么条件下上述可逆反应利于向左进行?
= =
即: O
CH3C-O-C2H5 +H—OH
O CH3C-OH + C2H5OH
探究乙酸乙酯在不同酸碱性条件下的水解
实验步骤: 1.向三只试管中各加入2mL乙酸乙酯 2.向试管1中加入4mL蒸馏水,试管2中加入4mL稀硫酸, 试管3mL中加入4氢氧化钠溶液,震荡试管 3.将三只试管同时放入盛有热水的烧杯中加热,观察现象
+
18
H2O
O
18
R—C—OH
+
18RBiblioteka —OH酯类水解:酯和水作用生成相应的酸和醇
酯水解反应的条件
酸性
反应条件 水解程度
稀H2SO4 水浴加热 不彻底 可逆
碱性 NaOH溶液 水浴加热
彻底 不可逆
反应产物
乙酸、乙醇 乙酸钠、乙醇
反应方程式
反应类型 水解通式
水解反应、取代反应 水解反应、取代反应
酯化反应与酯水解反应的比较
实验现象及结论
2mL乙酸乙酯 和4mL蒸馏水
2mL乙酸乙酯 和4mL稀硫酸
结论:酯在中性条件下几乎不水解, 酸性条件下水解不彻底,可逆 碱性条件下水解彻底,不可逆
2mL乙酸乙酯和 4mL氢氧化钠
酯的水解历程
18 浓 硫 酸
18
CH3COOH+C2H5OH
CH3CO OC2H5+H2O
O
R—C—18O—R'
连在苯环上时,1 mol 该有机物能消耗2 mol NaOH.
(3)
(普通酯基)氧连在烃基上时,1 mol 该有机物消
耗1 mol NaOH,而酯基氧连在苯环上(酚酯基)
时
【课后思考】
87.炫耀什么,缺少什么;掩饰什么,自卑什么。所谓正常人,只是自我防御比较好的人。真正的心理健康,是不设防而又不受害。 41.过去的已经一去不复返了,再怎么悔恨也是无济于事。未来的还是可望而不可及,再怎么忧虑也是会空悲伤的。今天心今日事和现在人, 却是实实在在的,也是感觉美好的。
C
的叙述不正确的是 A.常温下能与Na2CO3反应放出CO2 B.在碱性条件下水解,1mol该有机物完全反应消耗8mol NaOH C.与稀H2SO4共热生成两种有机物 D.该物质的化学式为C H O
3、1mol该物质最多消耗Br2多少m2omlo?l
最多消耗H2多少mol?最多消耗NaOH多少mol?
反应关系
催化剂 催化剂的 其他作用 加热方式 反应类型
酯化
水解
酯化 CH3COOH+C2H5OH 水解 CH3COOC2H5+H2O
浓硫酸
稀H2SO4或NaOH
吸水,提高CH3COOH NaOH中和酯水解生成的 与C2H5OH的转化率 CH3COOH,提高酯的水解率
酒精灯火焰加热
热水浴加热
酯化反应 取代反应
化学 ·选修5《有机化学基础》
酯
戊酸戊酯
丁酸乙酯
乙酸异戊酯
一、酯的结构特点及通式 定义: 酯是羧酸分子羧基中的-OH被-OR′取代后的产物
官能团:
或 RCOOR′
通式: CnH2nO2(n≥2)
二、酯的命名
甲酸甲酯
苯甲酸乙酯
乙二酸二乙酯
三、酯的物理性质
1、低级酯是具有芳香气味的液体。 2、密度比水小。 3、难溶于水,易溶于乙醇和乙醚等有机溶剂。
