2018年7-8月三类医疗器械经营许可情况表
2018年8月1日医疗器械新版目录及法规细则

综普咨询,一类医疗器械备案团队,您值得信赖医疗器械目录,是医疗生产企业和销售器械的一个行业标准。
新的版本发布,都有哪些改动的?快来瞅瞅吧~2017年9月4日,CFDA举行新闻发布会,正式发布新修订的《医疗器械分类目录》(以下简称新《分类目录》,分为22个子目录,自2018年8月1日起实施。
与2002版相比,新版主要变化如下:综普咨询,一类医疗器械备案团队,您值得信赖综普咨询,一类医疗器械备案团队,您值得信赖综普咨询,一类医疗器械备案团队,您值得信赖新《医疗器械分类目录》即将正式启用,还未做好相关衔接工作的企业请抓紧时间。
新《分类目录》的框架和内容均有较大调整,对医疗器械注册、生产、经营、使用等各环节都将产生影响。
具体如下:综普咨询,一类医疗器械备案团队,您值得信赖22个子目录名单有源手术器械无源手术器械神经和心血管手术器械骨科手术器械放射治疗器械医用成像器械医用诊察和监护器械呼吸、麻醉和急救器械物理治疗器械输血、透析和体外循环器械医疗器械消毒灭菌器械有源植入器械无源植入器械注输、护理和防护器械患者承载器械眼科器械口腔科器械妇产科、辅助生殖和避孕器械医用康复器械中医器械综普咨询,一类医疗器械备案团队,您值得信赖医用软件临床检验器械有关各类机构所需的医疗器械目录,可以猛戳这里!卫计委最新发布:各类各级别医疗机构必备医疗器械目录(1)卫计委最新发布:各类医疗机构必备医疗器械目录(2)妇产科和计划生育手术器械目录医疗器械分类目录回到新《分类目录》的事儿上来:一、新《分类目录》的总体说明(一)新《分类目录》按技术专业和临床使用特点分为22个子目录,子目录由一级产品类别、二级产品类别、产品描述、预期用途、品名举例和管理类别组成。
判定产品的管理类别时,应当根据产品的实际情况,结合新《分类目录》中产品描述、预期用途和品名举例进行综合判定,产品描述和预期用途是用于判定产品的管理类别,不代表相关产品注册内容的完整表述。
中国医疗器械法规清单(更新至2020年1月)(1)

《医疗器械监督管理条例》于2014年6月1日起正式实施,并于2017年5月4日修订,各类配套规章及规范性文件亦于近年来陆续制修订并发布。
各医疗器械企业作为受法规变化影响最大的相关方,应积极应对新法规政策下的挑战,密切关注最新法规动态,提前做好攻略规划,确保产品尽快获批上市!完善自身法规体系,确保企业合法合规生产经营!
为方便各企业检索最新法规,本协会特收集、整理、编制国家药品监督管理局(NMPA)已发布的医疗器械法规文件(包括但不限于)清单,供大家参考。
各企业应根据自身实际情况及产品领域,对各类法规进行识别、收集、评估、导入、宣贯培训。
注:未经许可,严禁转载!
若需转载,请注明出处:来源于深圳市医疗器械行业协会!
一、行政法规
二、部门规章
三、通告
四、公告
五、通知性文件
六、政策解读
七、相关法律法规
深圳市医疗器械行业协会
2020年1月。
2018医疗器械法律法规目录(最全)

医疗器械法律法规、部门规章制度汇总(2018版)医疗器械重点法律法规解读1.《医疗器械监督管理条例》已经2014年2月12日国务院第39次常务会议修订通过,现将修订后的《医疗器械监督管理条例》(以下简称“《条例》”)公布,自2014年6月1日起施行。
2.《医疗器械标准管理办法》已于2017年2月21日经国家食品药品监督管理总局局务会议审议通过,现予公布,自2017年7月1日起施行。
医疗器械标准,是指由国家食品药品监督管理总局依据职责组织制定、修订,依法定程序发布,在医疗器械研制、生产、经营、使用、监督管理等活动中遵循的统一的技术要求。
在中华人民共和国境内从事医疗器械标准的制定、修订、实施及监督管理,应当遵守法律、行政法规及本办法的规定。
医疗器械标准按照其效力分为强制性标准和推荐性标准。
3.《大型医用设备配置与使用管理办法》卫生部、国家发展和改革委员会、财政部联合制定并下发(卫规财发〔2004〕474号)。
大型医用设备是指列入国务院卫生行政部门管理品目的医用设备以及尚未列入管理品目、省级区域内首次配置的整套单价在500万元人民币以上的医用设备。
大型医用设备的管理实行配置规划和配置证制度。
甲类大型医用设备的配置许可证由国务院卫生行政部门颁发;乙类大型医用设备的配置许可证由省级卫生行政部门颁发。
医疗器械安全使用指南疗机构要加强大型医用设备使用管理,严格操作规范,保证设备使用安全、有效。
4.《体外诊断试剂注册管理办法修正案》已于2017年1月5日经国家食品药品监督管理总局局务会议审议通过,现予公布,自公布之日起施行。
本办法所称的体外诊断试剂,是指按医疗器械管理的体外诊断试剂,包括在疾病的预测、预防、诊断、治疗监测、预后观察和健康状态评价的过程中,用于人体样本体外检测的试剂、试剂盒、校准品、质控品等产品。
可以单独使用,也可以与仪器、器具、设备或者系统组合使用。
按照药品管理的用于血源筛查的体外诊断试剂和采用放射性核素标记的体外诊断试剂,不属于本办法管理范围。
2022年-2023年执业药师之药事管理与法规高分通关题型题库附解析答案

2022年-2023年执业药师之药事管理与法规高分通关题型题库附解析答案单选题(共30题)1、境内第三类医疗器械的注册证编号是A.国(食)药监械(准)字××××3第×4××5××××6号B.国(食)药监械(进)字××××3第×4××5××××6号C.省(食)药监械(准)字××××3第×4××5××××6号D.国(食)药监械(许)字××××3第×4××5×x××6号【答案】 A2、初步的临床药理学及人体安全性评价试验的临床试验是A.Ⅰ期B.Ⅱ期C.Ⅲ期D.Ⅳ期【答案】 A3、《药品不良反应报告和监测管理办法》(卫生部令第81号)属于A.地方性法规B.法律C.行政法规D.部门规章【答案】 D4、中药材生产关系到中药材的质量和临床疗效。
下列关于中药材种植和产地初加工管理的说法,错误的是()。
A.禁止在非适宜区种养殖中药材B.中药材产地初加工严禁滥用硫磺熏蒸C.对地道药材采收加工应选用现代化、产业化方法D.对野生或是半野生药用动植物的采集应坚持"最大持续生产"的原则【答案】 C5、(2019年真题)(一)A.认定执业药师王某的“挂证”行为是严重违反药品经营质量管理规范的情形,撤销丙零售企业的《药品经营质量管理规范认证证书》B.吊销执业药师王某的《执业药师职业资格证书》C.撤销职业药师王某的《执业药师注册证》D.在全国执业药师注册管理信息系统对王某的“挂证”行为进行记录,并予以公示【答案】 B6、执业药师资格注册管理机构是A.国家药品监督管理部门B.国家药品监督管理部门与人力资源和社会保障部门C.省级药品监督管理部门D.省级人力资源和社会保障部门【答案】 A7、根据《关于印发国家组织药品集中采购和使用试点方案的通知》(国办发[2019]2号),开启了“4+7”药品采购模式,从通过质量和疗效一致性评价的仿制药对应的通用名药品中遴选试点品种,并且在保障药品质量和供应的基础上,出台了一系列引导医疗机构和患者形成合理用药习惯的措施。
2024年执业药师之药事管理与法规通关提分题库及完整答案

2024年执业药师之药事管理与法规通关提分题库及完整答案单选题(共45题)1、(2017年真题)2016年,国内某医药集团通过不同路径寻求产品的多元化发展,获得国家食品药品监督管理总局批准的氯吡格雷片批准文号X和某抗生素新药证书Y,同时获得进口香港某药品生产企业生产的盐酸氨基葡萄糖胶囊的《医药产品注册证》。
A.HC+4位年号+4位顺序号B.国药准字H+4位年号+4位顺序号C.H+4位年号+4位顺序号D.国药证字H+4位年号+4位顺序号【答案】 B2、药品广告复审期间该药品广告的发布A.可以继续发布B.暂停发布C.根据情况决定D.广告发布者决定【答案】 A3、甲省乙市的A药品生产企业,经审查批准在丙省电视台发布广告,A在丙省电视台发布广告前需要到哪个部门进行备案A.甲省药品监督管理部门B.丙省药品监督管理部门C.乙市药品监督管理部门D.乙市工商行政管理部门【答案】 B4、《药品生产质量管理规范》规定,中药材的前处理、提取、浓缩等生产操作A.应避免与其他药品使用同一设备和空气净化系统B.应与其他药品生产厂房分开,并装有独立的专用的空气净化系统C.必须使用专用设备和独立的空气净化系统,并与其他药品生产区域严格分开D.必须与其制剂生产严格分开【答案】 D5、张某,大专以上药学学历,参加执业药师全部科目考试,其获得《执业药师职业资格证书》的最长考试周期为A.2年B.3年C.4年D.5年【答案】 C6、不合理处方可以分为不规范处方、用药不适宜处方和超长处方,下列处方属于存在用药不适宜情况的是()。
A.处方医生签名不能准确识别的处方B.慢性病需延长处方用量未注明理由的处方C.中成药与中药饮片为分别开具的处方D.存在有潜在临床意义的配伍禁忌的处方【答案】 D7、药品批发企业委托运输药品的记录应当至少保存A.5年B.3年C.2年D.1年【答案】 A8、根据《关于进一步改革完善药品生产流通使用政策的若干意见》,关于药品购销活动,下列说法错误的是A.对查实存在租借证照、虚假交易、伪造记录等违法行为的企业,公立医院2年内不得购入相关企业药品B.建立医药代表登记备案制度,备案信息及时公开C.医药代表除承担药品销售任务外,还可从事学术推广、技术咨询等活动D.对拒绝提供偏远地区配送服务的企业,逾期不改正的,取消中标资格,公立医院2年内不得采购其药品【答案】 C9、甲药品经营企业持有《药品经营许可证》,经营方式为药品批发,批准的经营范围为:麻醉药品、精神药品、医疗用毒性药品、化学原料药及其制剂、抗生素原料药及其制剂、生化药品、生物制品。
行政处罚信息公开表【模板】

2、处罚款人民币10000.00元。
依据《中华人民共和国食品安全法》第一百二十四条第一款第(五)项“违反本法规定,有下列情形之一,尚不构成犯罪的,由县级以上人民政府食品药品监督管理部门没收违法所得和违法生产经营的食品、食品添加剂,并可以没收用于违法生产经营的工具、设备、原料等物品;违法生产经营的食品、食品添加剂货值金额不足一万元的,并处五万元以上十万元以下罚款;货值金额一万元以上的,并处货值金额十倍以上二十倍以下罚款;情节严重的,吊销许可证:(五)生产经营标注虚假生产日期、保质期或者超过保质期的食品、食品添加剂”;《中华人民共和国食品安全法》第一百二十二条第一款违反本法规定,未取得食品生产经营许可从事食品生产经营活动,或者未取得食品添加剂生产许可从事食品添加剂生产活动的,由县级以上人民政府食品药品监督管理部门没收违法所得和违法生产经营的食品、食品添加剂以及用于违法生产经营的工具、设备、原料等物品;违法生产经营的食品、食品添加剂货值金额不足一万元的,并处五万元以上十万元以下罚款;货值金额一万元以上的,并处货值金额十倍以上二十倍以下罚款;《中华人民共和国行政处罚法》第二十七条第一款第(四)项 其他依法从轻或减轻行政处罚的。
分期缴款履行
**县市场监督管理局
2018年10月15日
2
盐市监罚〔2019〕 4号
盐津柿子程菊百货店经营超过保质期食品案
盐津柿子程菊百货店
统一社会信用代码:********MA6KJX448H
程菊
2019年1月10日,我局执法人员在**县柿子镇黄毛坝火车站进行日常监督检查时,在盐津柿子程菊百货店内售货架上发现以下超过保质期食品:名称为达利园法式软面包,规格为360克,生产厂家为达利食品集团,生产日期为2018年1月31日,保质期为6个月,数量为6袋。
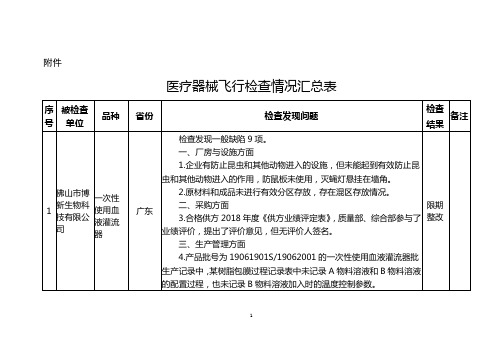
医疗器械飞行检查情况汇总表
五、生产管理方面
8.现场运行中的立式注塑机,正在进行滤网注塑成型,注塑机操作屏幕显示实际注塑时间为4秒,企业操作人员记录为5秒,记录与实际运行时间不符。
六、销售和售后服务方面
附件
医疗器械飞行检查情况汇总表
பைடு நூலகம்序号
被检查
单位
品种
省份
检查发现问题
检查结果
备注
1
佛山市博新生物科技有限公司
一次性使用血液灌流器
广东
检查发现一般缺陷9项。
一、厂房与设施方面
1.企业有防止昆虫和其他动物进入的设施,但未能起到有效防止昆虫和其他动物进入的作用,防鼠板未使用,灭蝇灯悬挂在墙角。
2.原材料和成品未进行有效分区存放,存在混区存放情况。
3.质量手册(编号YQ/QM-D/00)P9的07节质量手册发放部门清单中发放部门/人员包括总经理、管理者代表、副总经理、生产部、技术质量部、总经办、综合部,在P24的05规定手册的发放对象为总经理、管理者代表、质量技术部、生产部长、综合部,前后不一致;在P25的4节规定发放《质量手册》时填写发放号,在公司的文件和资料发放登记表(编号YQ/QR4.2.4-01)中质量手册发放记录没有发放号,公司现场提供的受控质量手册上也没有发放号,且发放记录为总经理、管理者代表、生产部、技术质量部、总经办,与前述规定不一致。
9.2019年5月《医疗器械销售记录表》(编号QWGSMKJ-4/SOR-XS-019)中无购货单位地址、联系方式等内容。
七、不合格品控制方面
10.企业未制定报废产品处置制度。
第三类高风险医疗器械临床试验审批服务指南

第三类高风险医疗器械临床试验审批服务指南项目编码:30018国家药品监督管理局2018年10月一、适用范围本指南适用于第三类高风险医疗器械临床试验审批的申请和办理二、项目信息(一)项目名称:第三类高风险医疗器械临床试验审批(二)子项名称:无(三)事项审查类型:前审后批(四)项目编码:30018三、办理依据《医疗器械监督管理条例》(国务院令第650号)第十九条:第三类医疗器械进行临床试验对人体具有较高风险的,应当经国务院食品药品监督管理部门批准。
临床试验对人体具有较高风险的第三类医疗器械目录由国务院食品药品监督管理部门制定、调整并公布。
《国家食品药品监督管理总局关于调整部分医疗器械行政审批事项审批程序的决定》(局令第32号):将下列由国家食品药品监督管理总局作出的医疗器械行政审批决定,调整为由国家食品药品监督管理总局医疗器械技术审评中心以国家食品药品监督管理总局名义作出:一、第三类高风险医疗器械临床试验审批决定;二、国产第三类医疗器械和进口医疗器械许可事项变更审批决定;三、国产第三类医疗器械和进口医疗器械延续注册审批决定。
其他医疗器械注册申请的审批决定,按现程序,由国家食品药品监督管理总局作出。
四、受理机构国家药品监督管理局医疗器械技术审评中心五、决定机构国家药品监督管理局医疗器械技术审评中心以国家药品监督管理局名义作出六、审批数量无数量限制七、申请条件境内申请人应为境内依法进行登记的企业。
境外申请人应为境外生产企业,且该医疗器械已在注册申请人注册地或者生产地址所在国家(地区)已获准上市销售。
申请的医疗器械应列入《关于发布需进行临床试验审批的第三类医疗器械目录的通告》(2014年第14号)的目录中。
八、禁止性要求(一)申请人对拟上市销售医疗器械的安全性、有效性进行的研究及其结果无法证明产品安全、有效的;(二)注册申报资料虚假的;(三)注册申报资料内容混乱、矛盾的;(四)注册申报资料的内容与申报项目明显不符的;(五)不予注册的其他情形。
2022年上海市静安区《医疗器械经营许可证》《第二类医疗器械经营备案凭证》注销公告(二)

2022年上海市静安区《医疗器械经营许可证》《第二类医疗器械经营备案凭证》注销公告(二)
文章属性
•【制定机关】上海市静安区市场监督管理局
•【公布日期】2022.07.20
•【字号】
•【施行日期】2022.07.20
•【效力等级】地方规范性文件
•【时效性】现行有效
•【主题分类】医疗管理
正文
2022年上海市静安区《医疗器械经营许可证》《第二类医疗器械经营备案凭证》注销公告(二)
经查,上海视月眼镜销售有限公司分公司等24家单位《营业执照》已注销或吊销,依据《中华人民共和国行政许可法》《医疗器械监督管理条例》《市场监督管理行政许可程序暂行规定》《医疗器械经营监督管理办法》等规定,我局决定注销上述24家单位的《医疗器械经营许可证》和《第二类医疗器械经营备案凭证》。
特此公告。
附件:上海市静安区《医疗器械经营许可证》《第二类医疗器械经营备案凭证》注销企业名单(2022年第二批)
上海市静安区市场监督管理局
2022年7月20日附件
上海市静安区《医疗器械经营许可证》《第二类医疗器械经营备案凭证》注销企。
三类医疗器械质量管理记录系列表格

医疗器械质量管理记录1、文件修订申请表 (3)2、文件发放记录表 (4)3、文件回收记录表 (5)4、文件销毁申请表 (6)5、文件销毁记录表 (7)6、质量管理体系问题改进和措施跟踪记录 (8)7、医疗器械群体不良事件基本信息表 (9)8、医疗器械不良反应/事件报告表 (10)9、质量查询、投诉、服务记录 (11)10、质量事故调查、处理表 (12)11、医疗器械质量投诉处理记录 (13)12、质量事故处理跟踪记录 (14)13、员工健康档案表 (15)14、员工健康检查汇总表 (16)15、年度质量培训计划表 (17)16、培训签到表 (18)17、培训实施记录表 (19)18、员工个人培训教育档案 (20)19、设施设备台帐 (21)20、设施设备运行维护使用记录 (22)21、计量器具检定记录 (23)22、医疗器械养护质量情况分析季度报表 (24)23、医疗器械质量信息反馈表 (25)24、医疗器械质量信息传递处理单 (26)25、医疗器械召回记录 (27)26、医疗器械追回记录 (28)27、不合格医疗器械台帐 (29)28、不合格医疗器械报损审批表 (30)29、不合格医疗器械报损销毁审批表 (31)30、质量管理制度执行情况自查及整改记录表 (32)31、质量管理制度执行情况检查和考核记录表 (33)32、医疗器械采购记录 .......................................................................................................................................... .3433、医疗器械收货记录 (35)34、医疗器械验收记录 (33)35、医疗器械出库记录 (37)36、温湿度记录表 (33)37、计算机系统权限授权审批记录表 (33)38、车辆日常保养及卫生检查表 (40)39、月卫生检查记录表 (41)40、设施设备检修维护记录 (42)41、医疗器械质量监控检查记录 (33)42、医疗器械质量复查报告单 (33)43、医疗器械停售通知单 (33)44、医疗器械解除停售通知单 (33)45、医疗器械拒收通知单 (33)46、合格供货方档案表 (33)47、储存作业区来访人员登记表 (33)48、首营企业审批表 (50)49、首营品种审批表 (33)50、全体人员情况表 (33)51、供货企业质量体系评定表 (33)52、质量保证体系调查表 (33)53、医疗器械质量档案表 (33)54、医疗器械质量信息汇总表 (56)1、文件修订申请表编号:JYBN-QXJL-001-012、文件发放记录表编号:JYBN-QXJL-002-013、文件回收记录表4、文件销毁申请表5、文件销毁记录表编号:JYBN-QXJL-005-016、质量管理体系问题改进和措施跟踪记录编号:JYBN-QXJL-006-01编号:JYBN-QXJL-007-01报告日期:年月日编号:JYBN-QXJL-008-01首次报告□跟踪报告□报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□生产企业□个人□其他□9、质量查询、投诉、售后服务记录编号:JYBN-QXJL-009-0110、质量事故调查、处理表11、医疗器械质量投诉处理记录编号:JYBN-QXJL-011-0112、质量事故处理跟踪记录编号:JYBN-QXJL-012-0113、员工健康档案表编号: JYBN-QXJL-013-01注:应将历次体检结果证明文件存入档案14、员工健康检查汇总表编号: JYBN-QXJL-014-01年度培训计划表编号:JYBN-QXJL-015-01质管部:行政部:审批人:培训签到表编号:JYBN-QXJL-016-0117、培训实施记录表编号:JYBN-QXJL-017-0118、员工个人培训教育档案编号:JYBN-QXJL-018-01记录人:19、设施设备台帐编号:JYBN-QXJL-019-0120、设施设备运行维护使用记录编号:JYBN-QXJL-020-0121、计量器具检定记录编号:JYBN-QXJL-021-0122、医疗器械养护情况汇总分析季度报表编号:JYBN-QXJL-022-01养护员:汇总日期:年月日23、医疗器械质量信息反馈表编号:JYBN-QXJL-023-0124、医疗器械质量信息传递处理单编号:JYBN-QXJL-024-0125、医疗器械召回记录编号:JYBN-QXJL-025-0126、医疗器械追回记录编号:JYBN-QXJL-026-0127、不合格医疗器械台帐编号:JYBN-QXJL-027-0128、不合格医疗器械报损审批表编号:JYBN-QXJL-028-0129、不合格医疗器械报损销毁审批表编号:JYBN-QXJL-030-01部门:年月日编号:JYBN-QXJL-031-0132、医疗器械采购记录编号:JYBN-QXJL-032-0133、医疗器械收货记录编号:JYBN-QXJL-033-0134、医疗器械验收记录编号:JYBN-QXJL-034-0135、医疗器械出库记录36、温湿度记录表编号:JYBN-QXJL-036-01年月37、计算机系统权限授权审批记录表编号:JYBN-QXJL-037-0138、车辆日常保养及卫生检查表编号: JYBN-QXJL-038-0139、月卫生检查记录表编号:JYBN-QXJL-039-01的符合或不符合的□内打√。
行政处罚案件信息公开表2018年8月6

-
4
深圳远大医 疗器械有限 深市稽罚字 公司经营未 深圳远大医疗 〔2018〕 取得医疗器 9144030057000605X0 器械有限公司 115号 械注册证的 第三类医疗 器械案
当事人经营的由天津冠裕医 疗器械科技有限公司生产的 电化学前列腺增生治疗仪与 游东清 经注册产品结构组成不一 致,为未取得医疗器械注册 证的第三类医疗器械。
限当事人收到本 处罚决定书之日 起十五日内,将 收到省局转来检验报告(编 上述罚款缴交至 号:HC201702856),反映 深圳市财政委员 深圳市市 当事人生产的红景天新生洗 依据《化妆品卫生监督条 会。逾期不缴纳 场稽查 葛俊秀 发水(批号:170115)经检 例》第二十七条的规定, 款数额的百分 8-7 化妆品安全技术规范(2015 之三加处罚款, 年版)要求。 拒不缴纳的,将 申请人民法院强 制执行。
,依据《医疗器械监督管 理条例》第六十三条第二 款的规定,吊销医疗器械 经营许可证。
当事人应当于接 深圳市市 到本决定书时将 场稽查局 《医疗器械经营 2018-08许可证》原件交 08 送达人员收回。
-
2
巴颜喀拉全 生态环保科 技(深圳) 巴颜喀拉全生 深市稽罚字 有限公司销 态环保科技 统一社会信用代码: 〔2018〕 售不符合国 (深圳)有限 91440300MA5D8W6K00 117号 家《化妆品 公司 卫生标准》 化妆品案
限当事人收到本 处罚决定书之日 起十五日内,将 上述罚款缴交至 当事人销售的红景天新生洗 深圳市财政委员 深圳市市 JEAN 发水(批号:170115)经检 依据《化妆品卫生监督条 会。逾期不缴纳 场稽查 ZIMMER 验得知丙烯酰胺项目不符合 例》第二十七条的规定, 罚款的,每日按 局,2018MANN 化妆品安全技术规范(2015 没收违法所得、罚款。 罚款数额的百分 8-7 年版)要求。 之三加处罚款, 拒不缴纳的,将 申请人民法院强 制执行。
卞某某非法经营案

卞某某非法经营案文章属性•【案由】非法经营罪•【审理法院】上海市第一中级人民法院•【审理程序】二审•【裁判时间】2020.11.25裁判规则人民法院认定非法经营行为,应依据行政法律、法规的规定,对于行政机关内部文件,应当全面审查其是否符合行政法律法规的相关规定,不得单独据以认定行为人的行为构成犯罪。
正文卞某某非法经营案公诉机关:上海市闵行区人民检察院。
被告人:卞某某,男,汉族,1958年10月出生,系上海辉海电子设备有限公司、上海明珠医疗科技发展有限公司法定代表人,住江苏省扬州市广陵区。
因涉嫌犯非法经营罪于2017年4月26日被刑事拘留,同年6月1日被取保候审,同年12月8日被逮捕,同年12月9日被取保候审。
上海市闵行区人民检察院以被告人卞某某犯非法经营罪,向上海市闵行区人民法院提起公诉。
起诉书指控:2015年7月起,被告人卞某某在经营上海辉海电子设备有限公司(以下简称辉海公司)过程中,生产型号为SE-F1、SE-F2、SE-F3系列生物能量仪,并由上海明珠医疗科技发展有限公司(以下简称明珠公司)进行销售,累计生产、销售SE系列生物能量仪182台,合计金额人民币924270元。
经国家食品药品监督管理总局(以下简称食药总局)复函,认定该SE系列生物能量仪属于第二类医疗器械。
国家红外及工业电热产品质量监督检验中心武汉产品质量监督检验所《检验报告》分别对SE-生物能量仪及哈尔滨全科治疗仪的相对辐射能谱(红外辐射波长范围)进行了检验。
2016年12月,行政执法部门查扣涉案SE系列生物能量仪127台,价值人民币581740元。
卞某某违反国家规定,未经许可经营法律、行政法规规定的限制买卖的物品,扰乱市场秩序,情节严重,其行为已构成非法经营罪。
提请法院依照《中华人民共和国刑法》第二百二十五条第(一)项、第二百三十一条、第三十条、第三十一条之规定,对卞某某予以判处。
被告人卞某某辩称:涉案产品系合格的家用电器产品,并非医疗器械,其系合法经营,不构成非法经营犯罪。
CFDA正式发布新版《医疗器械分类目录》

CFDA正式发布新版《医疗器械分类目录》9月4日,国家食药监总局举行新闻发布会,正式发布新修订的《医疗器械分类目录》(以下简称新《分类目录》)。
按照要求,新《分类目录》自2018年8月1日起正式实施。
这意味着将有近一年的过渡期。
新《分类目录》的总体说明新的《分类目录》是在2002年版的基础上,为贯彻落实国务院修订发布的《医疗器械监督管理条例》和《改革药品医疗器械审评审批制度的意见》,结合当下医疗器械新兴类别和产品不断涌现的趋势,就原先存在的结构及分类不够合理等问题做出修订,使其更好适应当下医疗器械注册及备案的需要。
据国家食药监总局器械注册司副司长高国彪介绍,《分类目录》的修订由35名专家组成的医疗器械分类技术委员会执委会负责,包括院士和临床医学、工程技术研究等领域权威专家组成,后经反复遴选,确立了288名委员组成的医疗器械分类技术委员会16个专业组。
这样的人员组成就是为了保证每一个修订部分都尽可能合理有效。
国家食药监总局医疗器械注册司司长王者雄表示,新《分类目录》增加2000余项产品预期用途和产品描述,将现行《分类目录》1008个品名举例扩充到6609个;覆盖面将更广泛,更具指导性和操作性。
新《分类目录》借鉴美国以临床使用为导向的分类体系,参考《欧盟公告机构用框架目录》的结构,将现行《分类目录》的43个子目录整合精简为22个子目录,将260个产品类别细化调整为206个一级产品类别和1157个二级产品类别,形成三级目录层级结构。
判定产品的管理类别时,应当根据产品的实际情况,结合新《分类目录》中产品描述、预期用途和品名举例进行综合判定,产品描述和预期用途是用于判定产品的管理类别,不代表相关产品注册内容的完整表述。
注册申请人可以使用新《分类目录》的品名举例,或根据《医疗器械通用名称命名规则》(国家食品药品监督管理总局令第19号)拟定产品名称。
新《分类目录》不包含体外诊断试剂根据国家食药监总局发布的关于实施《医疗器械分类目录》有关事项的通告(2017年第143号),新《分类目录》不包括体外诊断试剂,体外诊断试剂产品类别应当按照《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第5号,以下简称5号令)、《体外诊断试剂注册管理办法修正案》(总局令第30号,以下简称30号令)、《6840 体外诊断试剂分类子目录(2013版)》及后续发布的分类界定文件中有关体外诊断试剂的分类界定意见进行判定,分类编码继续延用6840。
新版第三类医疗器械分类目录
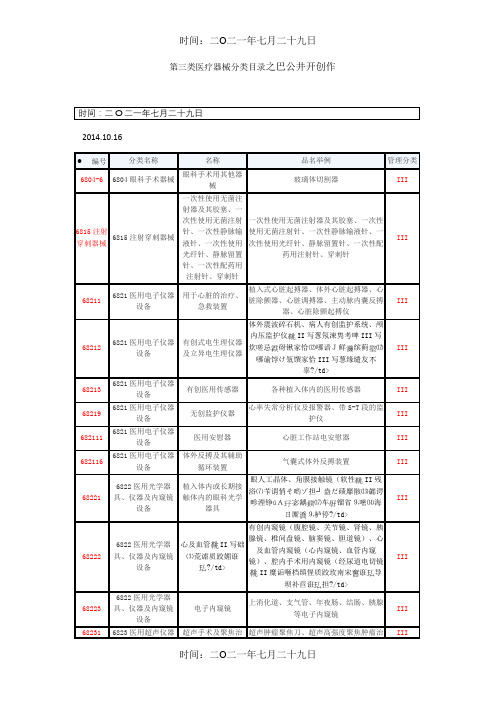
第三类医疗器械分类目录之巴公井开创作
时间:二O二一年七月二十九日
2014.10.16
体外震波碎石机、病人有创监护系统、颅
内压监护仪II写葱氖涑隽考啤III写
炊嗟忌砑锹家恰⑿哪谙J鲜缤蓟⑿
哪谕饽け瓴馔家恰III写葱缘缱友
辜?/td>
眼人工晶体、角膜接触镜(软性II残
浴⑺苄谓悄そ哟ゾ担┘盎だ碛靡骸⒀勰谔
畛湮铮úA宓龋⒄车镏省⒐嘧⒁海
ㄖ厮⒐栌停?/td>
心及血管II写础⑶荒谑质跤媚诳
?/td>有创内窥镜(腹腔镜、关节镜、肾镜、胰腺镜、椎间盘镜、脑窦镜、胆道镜)、心及血管内窥镜(心内窥镜、血管内窥镜)、腔内手术用内窥镜(经尿道电切镜II糜诟咂档缜惺质跤玫南宋诳导
坝补苣诳担?/td>
一次性使用输液器、输血器、静脉输液(血)针、血袋、采血器、血液成分分离器材、连接管路II胙方哟サ目亍⒀郝送⒁┮汗寺四ぁ⒖掌寺四ぁ⒙樽淼脊堋⒁淮涡允褂醚汗
似?/td>。
医疗器械岗前培训

医疗器械从业人员岗前培训
汇报人姓名
质管部 徐丽
主题
1 医疗器械的定义 2 医疗器械的分类 3 医疗器械的识别 4 医疗器械的购进 5 医疗器械的储存 6 医疗器械的销售
医疗器械 的定义
是指单独或者组合使用于人体的仪器、设备、器具、 材料或者其他物品,包括所需要的软件;其用于人体 体表及体内的作用不是用药理学、免疫学或者代谢的 手段获得,但是可能有这些手段参与并起一定的辅助 作用;其使用旨在达到下列预期目的: 对疾病的预防、诊断、治疗、监护、缓解; (二)对损伤或者残疾的诊断、治疗、监护、缓解、 补偿; 对解剖或者生理过程的研究、替代、调节; 妊娠控制。
国食药监械(准)字2012第3150134号 ○ 粤食药监械(准)字2010第2400750 号 ○ 浙金食药监械(准)字2009第 1640041号 ○ 第字后面“3”=第三类医疗器械 ○ 第字后面“2” =第二类医疗器械 ○ 第字后面“1” =第一类医疗器械
医疗器械的购进
从合法的医疗器械供货单 位处购进
医疗器械 的分类
第一类 是指,通过常规管理足以保证其安全 性、有效性的医疗器械
第二类 是指,对其安全性、有效性应当加 以控制的医疗器械。 第三类 是指,植入人体;用于支持、维持 生命;对人体具有潜在危险,对其安全性、有 效性必须严格控制的医疗器械。
三、医 疗器械 的识别
有医疗器械注册证号:
( 黄 色 ) 、 发 货 区 ( 绿 色 )
待 验 区 ( 黄 色 ) 、 退 货 区
色 ) 、 不 合 品 区 ( 红 色 ) 、
. 分 区 管 理 : 合 格 片 区 ( 绿
10cm
二一 ..
境内第三类医疗器械注册申请表精选6篇

境内第三类医疗器械注册申请表受理号:_______中华人民共和国境内第三类医疗器械注册申请表产品名称: ______________型号规格: ______________生产企业: ______________国家食品药品监督管理局填表说明1.依据《医疗器械注册管理办法》和《境内第三类、境外医疗器械注册申报资料受理标准》及相关文件的规定制定本表。
2.本申请表从中国医疗器械信息网()免费下载。
要求填写的栏目内容应打印完整、清楚、不得空白,无相关内容处应填写“∕”或“无”;因申请表格式所限而无法填写完整时,请另附附件;申报时应一并提交含有申请表内容的电子文档(附件内容应为Word或Excel形式)。
3.申报产品名称、型号、规格应与所提交的产品标准、检测报告、产品使用说明书等申报材料实质性内容相对应。
4.注册形式:填写“首次注册”或“重新注册”。
5.产品类别及分类编码应根据医疗器械分类目录等相关文件填写。
6.产品标准:申请注册的产品如执行国家标准或行业标准,直接填写标准名称及编号;如执行注册产品标准,则填写注册产品标准名称。
7.生产企业是指以自己的名义把产品推向市场,并对该产品的安全性、有效性负最终责任的单位;生产企业注册地址是指生产企业营业执照上标注的地址;生产地址是指产品实际加工制造的地址。
8.申报者是指受生产企业委托,为其办理产品注册事务的单位(生产企业直接申请注册,申报者栏目填“/”)。
9.如申报材料中有需要特别加以说明的问题,请在本表“其他需要说明的问题”栏中说明。
10.请在“注册申请应附资料及顺序”栏对应项目左侧方框内划“√”。
如根据有关规定,某项材料不需提交,请在该项目左侧的方框内划“#”,并在本表“其他需要说明的问题”栏中写明理由。
注:填表前,请详细阅读填表说明产品名称商品名型号、规格注册形式首次注册□重新注册□产品类别/编码原注册证号产品标准性能结构及组成产品适用范围产品禁忌症生产企业名称注册地址生产地址联系人职位电话传真邮编电子信箱申报者名称地址联系人职位电话传真邮编电子信箱注册申请应附材料及顺序首次注册□ 1.境内医疗器械注册申请表□ 2.医疗器械生产企业资格证明□ 3.产品技术报告□ 4.安全风险分析报告□ 5.适用的产品标准及说明□ 6.产品性能自测报告□ 7.医疗器械检测机构出具的产品注册检测报告□ 8.医疗器械临床试验资料□ 9.医疗器械说明书□ 10.产品生产质量体系考核(认证)的有效证明文件□ 11.所提交材料真实性的自我保证声明重新注册□1.境内医疗器械注册申请表□2.医疗器械生产企业资格证明□ 3.原医疗器械注册证书□ 4.医疗器械检测机构出具的产品注册检测报告□5.适用的产品标准及说明□6.产品质量跟踪报告□7.医疗器械说明书□ 8.产品生产质量体系考核(认证)的有效证明文件□ 9.变更的情况说明和证明性文件(适用于规格型号、生产地址、标准、产品性能结构及组成、适用范围有变化的产品)□ 10.所提交材料真实性的自我保证声明将原进口注册产品移至国内总装配或包装消毒的注册□ 1.境内医疗器械注册申请表□2.生产企业许可证复印件,加盖国内生产企业公章□ 3.原进口注册证复印件,加盖国内生产企业公章□ 4.适用的产品标准及说明□ 5.产品生产质量体系考核(认证)的有效证明文件□ 6.医疗器械说明书□ 7.申报产品设计没有变化的声明,原进口产品生产企业签字或盖章,同时加盖国内生产企业公章□ 8.所提交材料真实性的自我保证声明其他需要说明的问题生产企业(签章)填表人(签字)年月日年月日境外医疗器械注册申请表受理号:______中华人民共和国境外医疗器械注册申请表APPLICATION FORM FOR REGISTRATION OF OVERSEA MEDICAL DEVICE产品名称:______________Product Name型号、规格:____________Model生产企业:______________Manufacturer代理人:________________Agent国家食品药品监督管理局STATE FOOD AND DRUG ADMINISTRATION填表说明1.依据《医疗器械注册管理办法》和《境内第三类、境外医疗器械注册申报资料受理标准》、及相关文件的规定制定本表。
医疗器械经营许可证(第三类医疗器械)延续申请提交资料目录
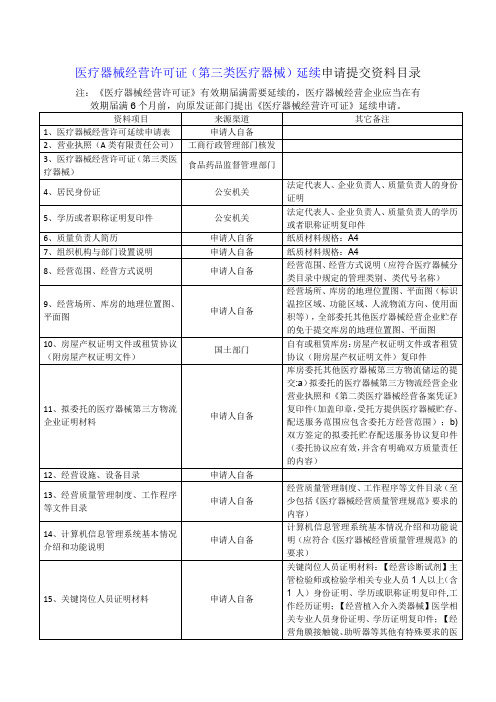
适用深圳
21、经营场所、库房地址的地理位置图、平面图、房屋产权证明或租赁协议(附房屋产权证明文件)
申请人自备
适用深圳
纸质材料规格:A4
8、经营范围、经营方式说明
申请人自备
经营范围、经营方式说明(应符合医疗器械分类目录中规定的管理类别、类代号名称)
9、经营场所、库房的地理位置图、平面图
申请人自备
经营场所、库房的地理位置图、平面图(标识温控区域、功能区域、人流物流方向、使用面积等),全部委托其他医疗器械经营企业贮存的免于提交库房的地理位置图、平面图
3、医疗器械经营许可证(第三类医疗器械)
食品药品监督管理部门
4、居民身份证
公安机关
法定代表人、企业负责人、质量负责人的身份证明
5、学历或者职称证明复印件
公安机关
法定代表人、企业负责人、质量负责人的学历或者职称证明复印件
6、质量负责人简历
申请人自备
纸质材料规格:ห้องสมุดไป่ตู้4
7、组织机构与部门设置说明
申请人自备
10、房屋产权证明文件或租赁协议(附房屋产权证明文件)
国土部门
自有或租赁库房:房屋产权证明文件或者租赁协议(附房屋产权证明文件)复印件
11、拟委托的医疗器械第三方物流企业证明材料
申请人自备
库房委托其他医疗器械第三方物流储运的提交:a)拟委托的医疗器械第三方物流经营企业营业执照和《第二类医疗器械经营备案凭证》复印件(加盖印章,受托方提供医疗器械贮存、配送服务范围应包含委托方经营范围);b)双方签定的拟委托贮存配送服务协议复印件(委托协议应有效,并含有明确双方质量责任的内容)
医疗器械经营许可证(第三类医疗器械)延续申请提交资料目录
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2018.8.27
2023.8.26
新办
12
十堰国康国人医药连锁有限公司车城路大药房
十堰市张湾区车城路30号
十堰市茅箭区朝阳南路57号御龙港湾负二楼
李明
李小霞
王万华
III类:6822医用光学器具、仪器及内窥镜设备(仅含护理液)6826高压定位治疗仪(家用),6864医用卫生材料及敷料。
鄂十食药监械经营许20180043号
2018.8.9
2023.8.8
新办
7
湖北康通源医药连锁有限公司十堰市车城西路店
十堰市张湾区车城西路65号楼一楼
无
喻为佳
姚会玲
董焕丽
6822医用光学器具、仪器及内窥镜设备(仅含护理液),6826高压电位治疗仪(家用),6864医用卫生材料及敷料***
鄂十食药监械经营许20180044号
2018年7-8月三类医疗器械经营许可情况表
批发企业:
序号
企业名称
注册地址
仓库地址
法人
企业
负责人
质量
负责人
经营范围
许可证号
发证时间
有效期
备注
1
十堰市太和健康投资管理有限责任公司医疗用品超市
十堰市茅箭区人民南路32号
无
张红旗
沈正海
孙东霞
Ⅲ类:6822医用光学器具、仪器及内窥镜设备(不含角膜接触镜及护理液),6826高压电位治疗仪(家用),6864医用卫生材料及敷料(不含一次性无菌医疗器械) ***
鄂十食药监械经营许20180049号
2018.8.27
2023.8.26
新办
13
十堰国康国人医药连锁有限公司车城西路大药房
十堰市张湾区车城西路4号
十堰市茅箭区朝阳南路57号御龙港湾负二楼
李明
李小霞
黄淋
III类:6822医用光学器具、仪器及内窥镜设备(仅含护理液)6826高压定位治疗仪(家用)、6864医用卫生材料及敷料***
2018.8.16
2023.8.15
新办
8
湖北康通源医药连锁有限公司十堰市光明小区店
十Байду номын сангаас市张湾区热电厂35号一楼
无
喻为佳
姚会玲
田勇
6822医用光学器具、仪器及内窥镜设备(仅含护理液),6826高压电位治疗仪(家用),6864医用卫生材料及敷料***
鄂十食药监械经营许20180045号
2018.8.16
2018.8.27
2023.8.26
新办
10
十堰国康国人医药连锁有限公司柏林镇大药房
十堰市张湾区柏林镇柏林村四组
十堰市茅箭区朝阳南路57号御龙港湾负二楼
李明
李小霞
柯昌菊
III类:6822医用光学器具、仪器及内窥镜设备(仅含护理液)6826高压定位治疗仪(家用),6864医用卫生材料及敷料。
鄂十食药监械经营许20180047号
2018.8.27
2023.8.26
新办
11
十堰国康国人医药连锁有限公司北京小镇大药房
十堰市茅箭区北京南路10号2幢-1-1
十堰市茅箭区朝阳南路57号御龙港湾负二楼
李明
李小霞
曹小利
III类:6822医用光学器具、仪器及内窥镜设备(仅含护理液)6826高压定位治疗仪(家用),6864医用卫生材料及敷料。
鄂十食药监械经营许20180050号
2018.8.27
2023.8.26
新办
14
十堰国康国人医药连锁有限公司成邦大药房
十堰市茅箭区北京路8号
十堰市茅箭区朝阳南路57号御龙港湾负二楼
李明
李小霞
熊娅玲
III类:6822医用光学器具、仪器及内窥镜设备(仅含护理液)6826高压定位治疗仪(家用)、6864医用卫生材料及敷料***
无
李娟
李娟
高其江
6826高压电位治疗仪(家用)***
鄂十食药监械经营许20180035号
2018.7.20
2023.7.19
新办
4
十堰南郡商贸有限公司
十堰市茅箭区朝阳中路67号4幢1-1
无
曾德昶
曾德昶
代红云
6826高压电位治疗仪(家用)***
鄂十食药监械经营许20180036号
2018.7.20
2023.7.19
新办
5
十堰市普及医疗器械有限公司
十堰市茅箭区49号众盈国际大厦2层22-08
无
刘晓桐
刘晓桐
殷正苗
6826高压电位治疗仪(家用)***
鄂十食药监械经营许20180037号
2018.7.20
2023.7.19
新办
6
十堰忠林明月眼镜销售有限公司茅箭区三堰分公司
十堰市茅箭区人民南路21号
无
孙忠林
孙燕丽
周倩
6822医用光学器具、仪器及内窥镜设备(仅含护理液)
2018.8.27
2023.8.26
新办
18
十堰国康国人医药连锁有限公司何家沟大药房
十堰市茅箭区山西路6号
十堰市茅箭区朝阳南路57号御龙港湾负二楼
李明
李小霞
田书芳
2023.8.15
新办
9
十堰国康国人医药连锁有限公司澳门街大药房
十堰市茅箭区人民中路56号
十堰市茅箭区朝阳南路57号御龙港湾负二楼
李明
李小霞
冯大玲
III类:6822医用光学器具、仪器及内窥镜设备(仅含护理液)6826高压定位治疗仪(家用),6864医用卫生材料及敷料。
鄂十食药监械经营许20180046号
鄂十食药监械经营许20180053号
2018.8.27
2023.8.26
新办
17
十堰国康国人医药连锁有限公司顾家岗大药房
十堰市茅箭区武当路38号
十堰市茅箭区朝阳南路57号御龙港湾负二楼
李明
李小霞
吴慎革
6822角膜接触镜及护理液、6826高压定位治疗仪(家用),6864医用卫生材料及敷料
鄂十食药监械经营许20180054号
鄂十食药监械经营许20180051号
2018.8.27
2023.8.26
新办
15
十堰国康国人医药连锁有限公司杜家湾大药房
十堰市茅箭区东城经济技术开发区七里沟口巷2号1幢(1-2)-1
十堰市茅箭区朝阳南路57号御龙港湾负二楼
李明
李小霞
党慧
6822角膜接触镜及护理液、6826高压定位治疗仪(家用),6864医用卫生材料及敷料
鄂071343
2018.7.13
2019.4.16
变更
2
十堰高兴医疗器械有限公司
十堰市茅箭区车站路16号27幢1-3
无
罗艳平
罗艳平
高道周
6826高压电位治疗仪(家用)***
鄂十食药监械经营许20180034号
2018.7.18
2023.7.17
新办
3
十堰景昊医疗器械有限公司
十堰市茅箭区铸造二厂俱乐部前厅二楼
鄂十食药监械经营许20180052号
2018.8.27
2023.8.26
新办
16
十堰国康国人医药连锁有限公司凤凰香郡大药房
十堰市茅箭区北京南路29号1幢1-1
十堰市茅箭区朝阳南路57号御龙港湾负二楼
李明
李小霞
吴菲菲
6822角膜接触镜及护理液、6826高压定位治疗仪(家用),6864医用卫生材料及敷料
