4.4 化学方程式 课时3
科粤版九年级化学教案设计:4.4化学方程式
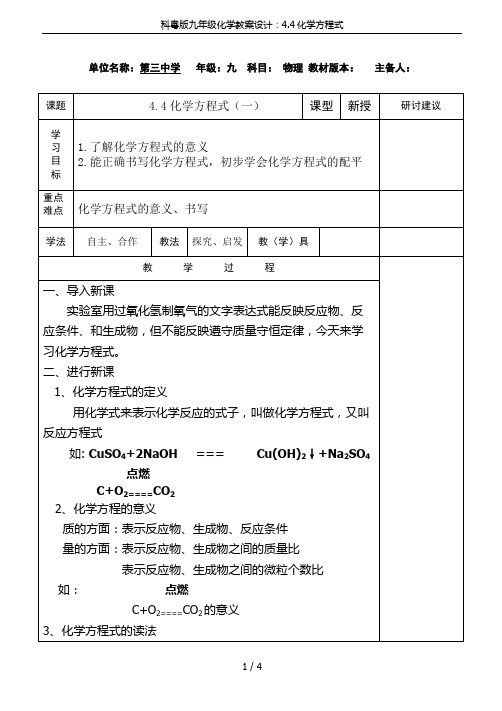
1、化学方程式的定义
用化学式来表示化学反应的式子,叫做化学方程式,又叫反应方程式
如:Байду номын сангаасuSO4+2NaOH===Cu(OH)2↓+Na2SO4
点燃
C+O2====CO2
2、化学方程的意义
质的方面:表示反应物、生成物、反应条件
量的方面:表示反应物、生成物之间的质量比
表示反应物、生成物之间的微粒个数比
(1)氯酸钾与二氧化锰混合共热
(2)铁丝在氧气中燃烧
(3)镁与稀硫酸反应
(4)水通直流电分解成氢气和氧气;
(5)硫酸铜溶液和氢氧化钠溶液反应生成氢氧化铜和硫酸钠;
四、小结本节内容
课题
4.4化学方程式(一)
课型
新授
研讨建议
学
习
目
标
1.了解化学方程式的意义
2.能正确书写化学方程式,初步学会化学方程式的配平
重点
难点
化学方程式的意义、书写
学法
自主、合作
教法
探究、启发
教(学)具
教学过程
一、导入新课
实验室用过氧化氢制氧气的文字表达式能反映反应物、反应条件、和生成物,但不能反映遵守质量守恒定律,今天来学习化学方程式。
4、练习读化学方程式
5、化学方程式的书写
(1)书写原则:一是科学实验的事实为依据
二是以质量守恒定律为依据
(2)书写步骤:
一写出反应物、反应条件和生成物
二配平,使反应前后各元素的原子个数相等,划等号
三标明生成物的状态
四检查
6、练习化学方程的书写
三、当堂练习
完成下列反应的化学方程式,并写出化学反应的基本类型:
最新科粤版九年级上册化学精品课件-4.4 化学方程式

时(反应物无不溶性固体),在固体物质的化学式右边标
注2“019/↓8/2”9 。
12
怎样书写化学方程式
化学方程式的配平方法
化学方程式书写完之后为使式子两边的每一种元素的原 子的总数相等,就需要配平,即在式子两边的化学式前 面配上适当的化学计量数。
2019/8/29
13
怎样书写化学方程式
化学方程式的配平方法
找出关键元素(是O)。反应前后该 (氧)原子个数的最小公倍数是10, 最小公倍数除以化学式中该原子的个
数,把得到的数字写到化学式前面。 在O2前面配上计量数5,在P2O5前面 配上计量数2,再配平其他原子。前 后磷原子个数的最小公倍数是4,在P 前面配上计量数4 。
15
怎样书写化学方程式
化学方程式的配平方法
(这是正确解题的关键) (4)进行准确、熟练的数学运算(这是解题正确的保证)。 (250)19要/8/2有9 完整的解题步骤和规范的书写格式。19
怎样根据化学方程式进行计算
3.根据化学方程式进行计算的步骤 (1)设未知量; (2)写出化学方程式; (3)找相关量,即列出跟计算相关的量; (4)列比例式;
4P + 5O2
2019/8/29
2P2O5
9
怎样书写化学方程式
书写化学方程式的步骤
3.标: 标明化学反应发生的条件,生成物的状态。
点燃
4P + 5O2
2P2O5
2019/8/29
10
怎样书写化学方程式
书写化学方程式的步骤
化学方程式的书写可归纳为:(以加热氯酸钾为例)
左反右生一横线
KClO3 KCl+ O2
(3)奇数配偶法
人教版九年级化学教案设计:4.4化学式与化合价(第3课时)教学设计

题目:《化学式与化合价》教学设计 单位: 姓名: 学科:化 学
1/5
人教版九年级化学教案设计:4.4 化学式与化合价(第 3 课时)教学设计
第四单元自然界中的水 课题 4 化学式与化合价(第三课时教学设计)
课题名称: 化学式与化合价(第三课时)
学的工具,掌握好化学用语是学好化学的前提,该课时内容承接本教材第四章第二节组成物质的化学元
素,学生们已经学习了元素符号的书写,化合物化学式的书写这部分内容的学习又为后面,化学方程式
的书写做铺垫,可见学好这一课题的内容的重要性,它是化学用语内容的重要组成部分,在化学用语的
学习中起到承上启下的作用,要正确用化学方程式表示物质发生化学反应过程,必须在较好地掌握化学
式书写的基础上,用化学式来表示参加反应的各物质,以及各物质之间量的关系。
一、知识与技能:
教学目标
1、 熟记常见元素及原子团的化合价; 2、 能利用化学式推求化合价,能用化合价推求物质的化学式正确的表示常见物质的组成; 二、过程与方法:
通过化合价的学习,使学生初步学会运用观察、比较等处理信息的方法;
三、情感、态度与价值观:
静听,思 考,回答
阅读,思 考,归纳 整理,回 答
培养学生 观察、比 较、归纳 处理信息 的能力
探究 二: 化合 价的 表示 方法 与离 子符 号的 书写 区别
1、复习旧知:写出下列离子符号 钠离子、镁离子、氧离子、铝离子、
2、简介化合价表示方法:书写在元素符号的正上方,符号在前,数字在后
3、归纳小结:离子符号和化合价的比较
课堂 达标 训练
2.氮气 N2 中氮的化合价是 (
【精选】科学版九年级上册化学第四章第四课时《化学方程式》重要知识点总结

【精选】科学版九年级上册化学第四章第四课时《化学方程式》重要知识点总结第四章 生命之源——水4.4 化学方程式第1课时 化学方程式一、化学方程式的概念及其意义1.概念:用化学式表示化学反应的式子。
2.意义:(1)质的意义:表明了反应物、生成物和反应条件。
(2)量的意义:(宏观)各物质的质量关系。
质量比关系等于化学方程式中各物质的相对分子质量与化学计量数乘积的比。
(3)微观意义:物质间反应时的微粒个数比。
以2H 2+O 2=====点燃2H 2O 为例, ①表示氢气与氧气在点燃条件下生成水;②表示氢气、氧气与水的质量比为4 ∶32 ∶36;③表示氢分子、氧分子与水分子的个数比为2 ∶1 ∶2。
二、化学方程式的书写1.书写原则:以科学实验的事实为根据,写出反应物和生成物的化学式;以质量守恒定律为依据,等号两边各种原子的种类和数目必须相同。
2.书写步骤:一写二配三条件,四要瞄准放暗箭。
(1)写:在短线的左右两边分别写出反应物和生成物的化学式。
(2)配:在有关化学式前配上适当的化学计量数,使反应前后各元素的原子个数相等,将短线改为“===”。
(3)注:注明反应条件。
(4)标:标注生成物状态。
“↑”:如果反应物中没有气体,而生成物中有气体,那么应该在生成气体的化学式后面标“↑”。
“↓”:在初中阶段,只有在溶液中发生反应时生成沉淀,才需在生成沉淀的化学式后标“↓”。
(5)查:一查反映客观事实的化学式是否正确,二查化学方程式是否配平,三查生成物状态是否标注、标注是否恰当,四查反应条件是否标明且是否正确。
一、常用的简单配平方法:最小公倍数法找反应前后个数最多的原子,根据其个数的最小公倍数,确定相关化学式的化学计量数。
再由已有的化学计量数,配平其他元素的原子,使化学反应中的反应物与生成物的元素种类和原子个数都相等,从而确定其他化学式的化学计量数。
例如:加热分解氯酸钾与二氧化锰混合物制氧气。
二、万能配平法:设“1”法设“1”法的基本步骤:。
人教版九年级化学教案设计:4.4化学式

课题4 化学式与化合价【教材分析】本课题包括化学式、化合价和有关相对原子质量的计算三部分内容,它们是学习化学的重要工具,因此是“双基”的重要部分。
能够较好的掌握它们,对于今后的化学学习有很大的帮助。
教材首先介绍了化学式的概念,指出由于纯净物有固定的组成,因此每种物质只有一个化学式。
同时还指出物质的组成是通过实验测定的,化学式的书写必须依据实验结果,但是在初中化学进行化学书写练习时,主要应用化合价来推倒。
【学情分析】对于122班学习成绩较好的同学,自觉性,理解能力都没问题,这部分学生上课认真听讲,课后做练习问题不大。
对于中间层次的学生最主要的问题是:上课期间有时会打瞌睡、开小差、讲话等。
需要老师上课期间经常关注,经常提醒。
课后练习要有人监督完成。
而对于靠后的同学基础很差、心思不在学习上。
学不懂,从而导致不想学,不愿意学。
这部分同学要提起他的学习兴趣,能学多少学多少。
【学习目标】1.知道化学式的定义。
2.能说出化学式的含义。
【重难点】化学式的意义。
【教学过程】元素可以用元素符号来表示,那么由元素组成的各种单质和化合物怎样来表示呢?举例:氢。
氮、氧、等元素的元素符号。
前面学过的水、二氧化碳、氧气等的化学符号——这就是化学式,要学会化学式的书写方法,理解其涵义。
(板书)一、什么是化学式:1、定义:用元素符号表示物质组成的式子叫做化学式。
【思考】①.任何物质都有化学式吗?纯净物有固定的组成才有化学式,混合物没有固定的组成也就没有化学式。
②.同种物质可以有不同的化学式吗?一种物质只能用一个化学式来表示③.化学式可以任意书写吗?化学式的书写必须依据实验的结果或化合价来推求。
2、意义(以H2O为例)①表示一种物质:水②表示该物质的元素组成:水是由氢、氧两种元素组成。
③表示物质的一个分子:一个水分子④表示物质的分子构成:每个水分子是由两个氢原子和一个氧原子构成【小结】1.元素符号之前加了数字以后不再表示某元素,不再有宏观的意义,只表示原子的个数。
2021年九年级化学上册 4.4 化学式与化合价教案 新人教版(III)

直接用元素符号表示②非
金属气体:双原子构成的分
子,如氢气H
2
、氧气O
2
等。
用元素符号再加小数字
(2)化合物(先研究两种
元素组成的化合物)
a. 氧化物:如Fe
3
O
4
、CO
2、
P
2
O
5
,“氧在后”
b.金属与非金属元素组成
的化合物:如NaCl、ZnS
“金前,非后”
注意:1.化学式中原子个
数为1时,“1”不标出。
2.化学式中右下方的小数
字一般为最简整数比。
⑶三种以上元素形成的化
合物:一般都带有原子团,
将原子团当一个原子看待。
尝试书写氢气、氧化钙、
氯化铜、硫化钠、铁、
氢氧化钙的化学式
尝试归纳化学式的书写
方法
让学生在不
断尝试和纠
错中学会书
写化学式
启发学生三
种元素以上
的写法
)27555 6BA3 殣29957 7505 甅!940057 9C79 鱹7v €.37378 9202 鈂24961 6181 憁23259 5ADB 嫛。
科粤版九年级上册 《4.4化学方程式》教案

《4.4化学方程式》教案教学目标第一课时:化学方程式及其写法1.了解化学方程式的意义。
2.能正确书写化学方程式,初步学会化学方程式的配平方法。
第二课时:根据化学方程式的计算1.了解化学方程式计算的意义。
2.初步掌握化学方程式的简单计算。
3.掌握化学方程式计算的规范格式和解题方法。
教学重点:正确书写化学方程式; 有关化学方程式的计算。
教学难点书写和配平化学方程式;化学方程式计算的解题思路和规范格式。
教学过程(第一课时)复习:用质量守恒定律说明下列叙述是否正确?(1)化学反应前后,各物质的质量保持不变。
(2) 13克碳与32克氧气充分反应后,只能生成44克二氧化碳,这一过程不符合质量守恒定律。
(3)发生化学变化时,原子的种类及个数都保持不变。
(4)参加反应各物质的总体积,等于各生成物的总体积。
问题引入:我们学习了质量守恒定律,那么,在化学上有没有一种式子,既能表示反应物和生成物是什么,又能反映出该化学变化遵循质量守恒定律呢?回答是肯定的,这就是我们本节课要学习的种化学用语一化学方程式。
阅读:课文板书:一、什么是化学方程式1定叉:用化学式表示字应的式子、叫做化学方程式。
如:碳燃烧的化学方程式为:C+O2=CO22.参加反应的物质(指反应过程酒耗的量).叫做反应物:化学反应后生成的物质叫做主成物。
问题讨论:化学方程式表示了什么?它与文字表达式有什么不同?讲解并板书:3.化学方程式的意义:a.质的方面:表明各反应物和生成物的种类(用化学式表明“是什么”的问题)b.量的方面:表明各反应物和生成物的质量比并符合质量守恒定律。
(用化学计量数即“系数”与式量的乘积表明“各多少”的问题)问题讨论:(1)P+02-P2O5,这个式子是化学方程式吗?它符合质量守恒定律吗?(2)2H2+02-2H2O表明:是___气和___气进行反应、产生燃贷现象,生成物是___。
又表明在这个反应中氢气、氧气及水的质量多少有一定的比例,总是按氢气:氧气:水=___的比例进行反应的。
九年级制学校九年级化学上册4.4+化学式和化合价教案3+新人教版

化学式和化合价教学目标知识技能1、了解相对分子质量的涵义,并能利用相对原子质量和相对分子质量计算物质的组成。
2、能看懂某些商品标签或说明书上标示物质成分和含量。
过程方法通过学习化学式及其相关运算,培养学生的分析能力和解决问题的能力。
情感态度价值观培养学生严谨的科学态度。
使学生养成良好的学习习惯。
教学重点化合价与化学式。
教学难点化学式的相关计算。
教学内容及教师活动学生活动设计意图【巩固复习】1、由两种元素组成的化合物的名称一般从______到______ 读作______,例如:NaCl读作______,KCl读作______;有时还要化学式中各元素的____________ ,例如:CO2读作______ ,Fe3O4读作______ 。
2、单质化学式的书写:____________、____________和____________的化学式用元素符号直接表示,对于____________ ,除元素符号外,还在元素符号右下角写上表示分子中所含____________。
如:O2、N2、H2、Cl2、O3等。
3、化合物化学式的书写:(1)当某组成元素的原子个数比是1时,1可省略,(2)氧化物化学式的书写,一般把氧元素符号写在_______方,另一种元素符号写在____________方。
如:H2O、Fe4O3。
(3)由金属元素和非金属元素组成组成的化合物,书写化学式时,一般把____________符号写在左方,____________ 符号写在右方。
如:NaCl。
4、应用化合价怎样推求实际存在的化合物的化学式?如:磷为+5价,氧为-2价_______ ,碳为+4价,氧为-2价_______ ,铝为+3价,氯为-1价_______ 2、利用化学式怎样求某元素的化合价?求出下列加短线元素的化合价Mn2O7 AlCl3 CO2 H2SO4 K2MnO4 Zn【课堂探究】一、学生自学P84-——P85有关相对分子质量的计算,完成下列问题:1.、什么叫相对分子质量? CO2 H2SO4 K2MnO4_____ (2)CO______(3)HNO______ (4)KClO______ 2、计算上述物质中各元素的质量比:(2)____________(3)____________(4)_________________________(得或失)氧化铜氧化铁氯化钾硫酸铝氢氧化亚铁氯化银教学反思。
2020_2021学年人教版化学九年级上册4.4化学式与化合价第三课时教案

有关相对分子质量的计算教学目标1、了解相对分子质量的涵义,并能利用相对原子质量和相对分子质量进行各项相关计算;2、通过讨论交流、活动探究,培养学生利用所学的知识解决实际问题的能力和基本计算能力;3、通过突破元素质量比这个难点,让学生进一步认识宏观和微观之间的联系,逐步形成化学学科素养。
教学重难点重点:有关相对分子质量的计算。
难点:物质中各元素质量比、某元素质量分数的计算,宏观与微观之间的联系。
教学过程:引入:同学们,水是生命之源,本单元我们围绕水展开了学习。
老师带来了一瓶矿泉水,它是纯净物还是混合物?主要成分是什么?是的,除了水之外的物质我们在标签上能看到。
PPT展示:矿泉水标签,我们可看到一些元素的质量,由此我们得知它们的含量,通过今天的学习,我们能很快算出含量来。
提问:水的化学式是?它的意义是?回答:板书:H2O 水这种物质水由氢元素和氧元素组成1个水分子1个水分子由2个氢原子和1个氧原子构成提问:我们可根据水分子的构成得出它的原子个数比过渡:如果我们和科学家一样用高倍扫描隧道显微镜能看到这瓶水中有什么呢?分子有质量吗?提问:是的,因为原子有质量,展示:一个氢原子的质量,一个氧原子的质量,那么一个水分子的质量怎么计算?回答:思考:大家发现分子的真实质量如同原子质量,很小,表达、使用起来不方便,那么我们可以用什么来表示呢?活动1:求H2O的相对分子质量学生思考、交流,得出方法、步骤归纳、小结练习:计算下列物质的相对分子质量或相对分子质量总和:(1)O2(2)CO2(3)Ca(OH)2(4)硝酸铵(NH4NO3)(5)3H2O 学生各自做完后组内互相批改,得出正确答案,如果有错误,说出计算时需注意什么。
提问:根据计算,同学们觉得O2和CO2谁的质量更大?小结:板书:1个水分子相对分子质量1个水分子由2个氢原子和1个氧原子构成过渡:水是由氢元素和氧元素组成的,元素是有质量的。
在前面的学习中我们知道,地壳中含量最多的元素是氧元素,这个“含量”指的就是质量分数,即氧元素的质量与地壳总质量的比值。
初中化学教学设计4:4.4 化学式与化合价

第四节 化学式与化合价(第三课时)化合物中的原子个数如:Fe 2O 3中,铁原子与氧原子个数比就是2:3,碳酸钙CaCO 3中钙、碳、氧原子个数比为1:1:3但注意某些物质的化学式中,同种元素并不写在一起的,这时要注意原子个数如:NH 4NO 3中,氮、氢、氧原子个数比应该为2:4:3Cu 2(OH)2CO 3中,铜、碳、氢、氧原子个数比为2:1:2:5(3)计算化合物中各元素质量之比在化合物中,各元素质量之比就是各元素的原子个数与它的相对原子质量积之间的比值 如:氯酸钾(KClO 3)中,m (K ):m (Cl ):m (O )=39:35.5:16×3=78:71:96 硝酸铵(NH 4NO 3)中,m (N ):m (H ):m (O )=14×2:1×4:16×3=7::1:12(4)计算化合物中某一元素的质量分数元素的质量分数(ω)=总质量该元素的质量×100%=相对分子质量原子个数该元素的相对原子质量 ×100%如:计算MgSO 4中氧元素的质量分数ω(O)=)()(44MgSO Mr O Ar ×100%=1643224164⨯⨯++×100%=53.3% (5)计算一定质量的物质中某元素的质量某元素的质量=物质的质量×该元素在物质中的质量分数如:求60gMgSO 4中含有氧的质量m (O )=m (MgSO 4)×ω(O)=60g ×53.3%=32g(6)有关化合物中元素的质量分数的计算如:例1 硝酸铵样品中含有杂质10%(杂质中不含氮元素),求样品中氮元素的质量分数 首先,先求出纯净的硝酸铵中,氮的质量分数为:尿素中氮元素的质量分数ω(N)=)()(234NO NH Mr N Ar ×100%=80142⨯×100%=35% 设不纯的硝酸铵中氮元素的质量分数为x ,则有如下关系:故:x%90=,x =31.5% 例2 某不纯的尿素[CO(NH 2)2]中氮元素的质量分数为42.4%,求这种尿素中杂质(不含氮元素)的质量分数。
初中化学九年级4.4化学方程式(3)化学方程式的计算导学案

4.4化学方程式(3)化学方程式的计算学习目标:1、知道根据化学方程式进行计算的步骤和书写格式2、能根据化学方程式进行有关计算3、认识定量研究对化学发展的意义学习重点:计算的步骤和书写格式学习难点:计算能力的提高一、知识回顾:1、质量守恒定律的内容2、化学方程式与质量守恒定律的关系分析化学方程式的意义3、化学方程式有两层含义——质的含义和量的含义,你能过说出下列方程式的这两层含义吗? C + O2点燃CO2质的含义:量的含义:二、阅读课本117-118页阅读之后,你能说出利用化学方程式进行计算的步骤吗?请写出来。
三、计算:试一试A.计算相对分子质量,看谁算得又快又准(H-1 O-16K-39Cl-35.5Mn-55Ca-40)(1)过氧化氢(H2O2):(2)氯酸钾(KClO3):(3)高锰酸钾(KMnO4):(4)碳酸钙(CaCO3):B.写出下列反应的化学方程式:(1)电解水:(2)实验室用氯酸钾制氧气:(3)磷在空气中燃烧:四、初出茅庐,小试身手12、氢气在氯气中燃烧生成氯化氢,燃烧100 g氢气需要氯气多少克?五、、利用化学方程式的简单计算1)设未知量2)写出反应的化学方程式并配平3)找相关量,写出相关物质的相对分子的质量和已知量、未知量4)列出比例式,5)求未知量6)回答问题分析以上几个例题,根据化学方程式的计算,可以由反应物计算出生成物,还有哪些类型呢有效训练:Cu-64 O-16 H-1在实验室中用氢气还原氧化铜来制取铜。
若制取3.2克铜,至少需要氧化铜多少克?(提示:CuO+H2 △Cu+H2O)。
2020_2021学年人教版化学九年级上册 4.4 化学式与化合价 第三课时教案

《有关相对分子质量的计算》教学设计一、教学目标:1、知道相对分子质量的概念,能根据化学式计算物质的相对分子质量,计算化合物中各元素的质量比以及某元素的质量分数。
2、能进行化合物质量、元素质量、元素质量分数的相互换算。
二、内容与学情分析:人教版初中化学教材第四单元《物质构成的奥秘》,课题4《化学式与化合价》第三部分,“有关相对分子质量的计算”涵盖了五种基本的计算,即:(1)求物质的相对分子质量;(2)求物质中各元素的质量比;(3)求物质中某元素的质量分数;(4)已知物质的质量求元素的质量;(5)已知元素的质量求物质的质量。
这些内容是初中学生应掌握的基本计算,也是教学中的重点,这些计算必须建立在对化学式涵义的透彻理解基础之上,而且远离学生的生活实际,因此也是教学中的难点。
在教学中主要采用以下三个策略:一是课前创设情境,提出问题,营造轻松的课堂气氛。
在引入课题时,列举学生身边的实例。
且让这个实例贯穿本课题学习的始终,让学生感受到有关相对分子质量的计算不是虚无缥缈的,而是实实在在的,是有用的,从而激发学生的求知欲,让学生感受到化学就在身边,起到学以致用的作用。
二是用一道小学数学题作为类比和迁移。
就数学角度来看计算,本课题是比较简单的,但相对分子质量的概念对于学生都是陌生的,运用类比和迁移,等于给学生一个台阶,也降低了学习的心理难度。
三是采用“讲练结合”的学习方式。
每讲完一种计算类型,立刻让学生练习,力求精讲多练,讲在练之前,练在关键处。
练习都是例题的类型题,使学生能跟着例题进行模仿做题,以达到分散难点,限制难点个数的作用。
三、使能任务分析四、教学环节活动一、说出下列物质组成元素种类和各元素原子个数 1.H 2O 2.SO 2 3.Ca(OH)2 4.NH 4NO 3活动二、求计算相对分子质量引导:原子的质量很小,所以在化学中使用相对原子质量。
那么在化学中怎样表示分子的质量呢? 思考:原子-相对原子质量分子-相对分子质量,理解相对分子质量的涵义 引入举例:一只烧鸭,鸭身重500g ,鸭腿重150g 。
九年级化学教案第四单元《4.4化合价与化学式(第三课时)》人教版
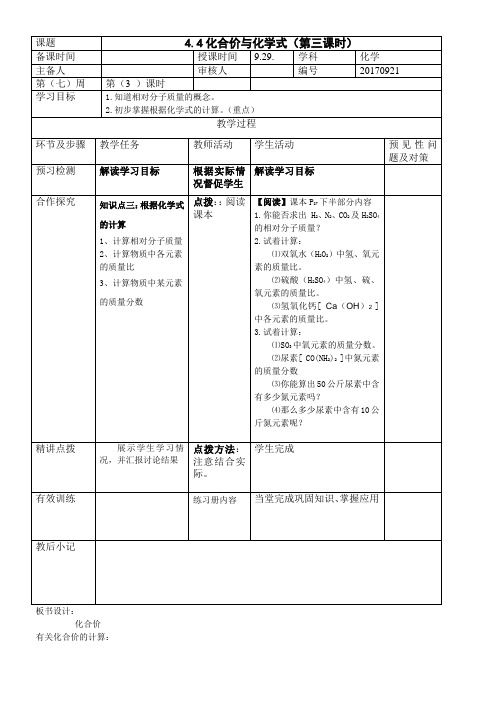
化合价有关化合价的计算:1.已知葡萄糖的化学式为:C6H12O6(1)葡萄糖的相对分子质量是(2)碳、氢、氧的质量比是(3)碳元素的质量分数是2.家居装修时,装饰材料会释放出一种叫甲醛(CH2O)的有害气体,下列关于甲醛的说法不正确的是()A.甲醛是由碳氢氧三种元素组成的。
B.甲醛中碳氢氧三种元素的质量比是 1:2:1C.甲醛的相对分子质量是30 D.甲醛是一种有毒的化合物3.相同分子数的下列气体质量最大的是() A.O2 B.H2 C.Cl2 D.N24.吸烟危害健康,其原因是吸烟时会吸入多种有害气体,其中有一种是氧化物,在它的组成中氧元素与另种元素的质量比是4:3,它是下列气体中的() A.CO2 B.CO C.SO2 D.NO5.相同质量的CO和CO2中,碳元素的质量比是()A.1:1 B.14:11 C.7:11 D.11:76.我国部分地区突发“非典”,严重危害人体健康。
为防治“非典”,对公共场所进行消毒时常用过氧乙酸消毒液,过氧乙酸的分子结构如下图所示:其中代表碳原子,代表氢原子,代表氧原子,(1)过氧乙酸的化学式是相对分子质量是。
(2)过氧乙酸中碳氢氧三种元素的原子个数比是,碳氢氧三种元素的质量比是。
(3)过氧乙酸中氧元素的质量分数是。
7.药用阿司匹林的元素组成是:含碳60%,含氧35.5%,其余为氢,已知它的相对分子质量是180,若阿司匹林的化学式用C X H Y O Z表示,则X,Y,Z的数值各是多少?【中考直通车】8.已知NH4NO3和KH2PO4固体混合物中氮元素的质量分数为28%,则混合物中KH2PO4的质量分数为()A.20% B.25% C.85% D.80%9.建立一个适当的模型来反映和代替客观现象,可以更简单明了地表示事物。
(1)甲图是人体中元素质量分数模型,则A代表的一种元素是。
(2)小明模仿甲图构建了NH4NO3中各元素质量分数的模型(如乙图),则乙图中表示氮元素的是。
粤教初中化学九上《4.4 化学方程式》PPT课件 (3)

已知量和未知量 .....…...关
(4) 列比例式,求解 …...….…..比 ………………….….算
(5) 简明地写出答案 ….…...答
化学方程式
这是小虎同学书写的化学方程式,正确吗?
S + H2O
写出下列反应的化学方程式。
1.木炭在氧气中燃烧 2.硫在氧气中燃烧 3.镁条在空气中燃烧 4.铁在氧气中燃烧 5.红磷在空气中燃烧 6.氢气在氧气中燃烧 7.双氧水和二氧化锰混合制氧气 8.氯酸钾和二氧化锰混合加热制氧气 9.加热高锰酸钾 10.电解水
试试看,你能配平下列化学方程式吗?
2.微观读法:每4个磷原子和5个氧气分子在点燃条件下 生成2个五氧化二磷分子
3.质量读法:每124份质量的磷和160份质量的氧气在点 燃条件下生成284份质量的五氧化二磷
刚才我们说过磷燃烧的化学方程式的读法,那么同 学们读一下镁在氧气中燃烧化学方程式的读法。
点燃
2Mg + O2==== 2MgO
24×2 16×2
△
2KMnO4 K2MnO4 + MnO2 + O2
课堂练习三
配平下列化学方程式:
(1) C + CO2 2 高温 CO
(2)4 Al +3 O2 2 点燃 Al2O3
(3)2 CuO + C
高温
2
Cu + CO2
(4) C2H2 + O2 点燃
H2O +
CO2 2
2 点燃
2
(5) H2S + O2
2×(24+16)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
解:设氯酸钾的质量为X,
118页 抄笔记
2KClO3 2KCl+3O2 96 245 X 9.6g 245 X = 9.6g 96
MnO2
X=24.5g
答:要分解氯酸钾的质量是24.5g。
118页抄笔记
总结:根据化学方程式计算的要领和关键
三个要领: 1、步骤要完整
2、格式要规范
3、得数要准确 三个关键: 1、准确书写化学方程式
解
X=800kg
答:完全燃烧100Kg液氢需液氧800Kg
答
步骤要完整,格式要规范!!
1、在化学反应中,反应物与生成 物之间的质量比成 正比 关系。
2、计算依据:各物质之间的质量比 (等于各物质的相对分子质量与化学计量数 的乘积之比)
例2、用加热氯酸钾与少量二化锰的方法,要制取9.6g氧气,求分 解氯酸钾的质量是多少?
(第一列标) 反应中各物质之 间的质量关系= 各物质的相对分 子质量与化学计 量数的乘积
第二列标: 已知量、 未知量
你会计算吗?
“天宫一号”用长征 系列火箭发射升空探月, 至少携带100kg的液氢, 假如你是火箭推进器的 设计师,你会计算在火 箭助燃仓中填充多少千 克的液氧来满足这些液 氢的完全燃烧?
、
重点---中考必考、最后压轴计算题型!!
根据化学方程式计算质量的一般步骤---参考 118页例题,归纳总结: 1.解、设未知量为x,求什么设什么,不带单位 2、写出相应正确的化学方程式配平 3、在相关物质化学式的正下方, 第一列、计算标出相关物质的相对分子质量 乘以分子个数(即配平的化学计量数), 第二列,标出已知量、未知量(即实际质量) 4、列比例式 5、求未知量 6、简单答题
2、化学方程式要配平
3、准确计算物质相对分子质量
4、计算结果如果不能整除,至少保留一位小 数点。
周末作业
• 1、课本119页: 1 ---7、上交
“天宫一号” 升 空
解:设完全燃烧100Kg液氢需液氧的质量为X, 设
第一列标) 反应中各物质之 间的质量关系= 各物质的相对分 子质量与化学计 量数的乘积
2H2 + O2
4 100Kg 32 X
点燃
2H2O
4 =100Kg 32 X
第二列标: 已知量、 未知量 (即实际 质量)
写 算 标
列正比例式
