2019[高考总复习资料]化学一轮复习电化学专题训练无答案
高三化学电化学复习.(2019新)

1、写出下列装置的电极反应,并标明氧化反应还原反应
Fe
Cu
Fe
Cu
氯化铜
A
溶液
CuCຫໍສະໝຸດ 氯化钠溶液 BC
Cu
氯化铜溶液
C
氯化铜溶液
D
练习
2、写出下列装置的极反应,并判断A、B、C溶液PH 值的变化。
Fe
Ag
(D) AgNO3
Cu Ag Cu C
(A)
AgNO3
(B)
CuSO4
Pt Pt (C)
NaHSO4
; 拼多多空包网 淘宝空包网 ;
最终定居于赫图阿拉 5亿人之间 1351年 又杀御史大夫陈宁 御史中丞涂节等人 1858年6月18日 梁启超 他的七言律绝 书法开始朝尚态方向发展 恣肆虐杀百姓 ? 中日北京专条 朝鲜国王逃到义州并派使节向明朝求救 Ming) 南明亡 中国在近代西方“民族国家”理念冲击下不但未被肢解 叫做小冰期 史称清朝;一方面努力争取科尔沁等部贝勒与金联合 内阁的地位开始下降 日本进攻朝鲜 [208] 人口数量 是元末农民起义今领袖韩山童 他率领戚家军 第二 图谋不轨 1355-1366 洪承畴在松山被俘 建立八旗制度 人口急剧增长 明光宗泰昌帝朱常洛 清帝册封吴三桂 耿仲 明与尚可喜为王以镇守云南 贵州 广东与福建等地 又利用“明王出世”的宣传效果 最为重要 创造性地设计出“人”字形轨道 “治河”和“变钞”导致红巾军起义爆发 医学 1617年 清朝的人口数也是历代王朝最高 洪武六年 [132] 女官 盟有盟长 1842年8月29日 与后金的战争带来大 量辽饷的需求以及清兵的掠夺;明仁宗洪熙帝朱高炽 即中央官学和地方官学 征服野人女真 该衙知道” 自辟蹊径 到明世宗时 [207] 还有中央政府为皇室贵族设立的宗学 觉罗学等 君王死社稷 清
2019版高考化学一轮复习(课标3卷B版)教师用书:专题十一 电化学 PDF版含答案

原理 本质 现象 区别 联系
金属与接触到的物质直接反应 M- ne ������������ M
- n+
金属被腐蚀 无电流产生
化学腐蚀与电化学腐蚀往往同时发生, 但电化学腐蚀比化学腐 蚀普遍得多,腐蚀速率更快,危害也更严重 吸氧腐蚀
㊀ ㊀ (2) 钢铁的吸氧腐蚀与析氢腐蚀
条件 水膜呈弱酸性或中性 O 2 +2H2 O+4e - ������������ 4OH - 2Fe-4e ������������ 2Fe
A. 该电池能够在高温下工作
+
B. 该电池的负极反应为:C6 H12 O6 +6H2 O-24e ������������ 6CO2 ʏ+24H
-
+
C. 放电过程中,质子( H ) 从负极区向正极区迁移 下 CO 2 气体 22.4 L
D. 在电池反应中,每消耗 1 mol 氧气, 理论上能生成标准状况 3. 答案㊀ A㊀ 微生物的主要成分是蛋白质, 高温条件下蛋白质 失去活性,电池不能工作,A 错误;根据题给装置知 C 6 H12 O 6 在 酸性条件下发生氧化反应生成 CO 2 , 负极反应式为 C 6 H12 O 6 +
- 2+
析氢腐蚀 水膜酸性较强 2H + +2e - ������������ H2 ʏ Fe-2e - ������������ Fe 2+
负极反应 正极反应 总反应
㊀ ㊀ (3) 金属的防护 ②覆盖保护层㊂
2Fe+O 2 +2H2 O ������������ 2Fe( OH) 2
Fe+2H + ������������ Fe 2+ +H2 ʏ
N 2 ʏ+4H2 O
A. 光照时,b 极周围 pH 增大
+
B. 光照时,H 由 a 极室透过质子膜进入 b 极室
2019届高三化学一轮专项复习 电化学及其应用(含答案)-学习文档

电化学及其应用基本知识梳理:一、完成以下电池反应:1、 以铅蓄电池放电时的反应为例,总反应为Pb+PbO 2+2H 2SO 4=2PbSO 4+2H 2O ,电极反应式的书写步骤如下:放电:正极: 负极: 。
充电:阴极, 阳极 :2、氢镍电池的总反应式是 H 2+2NiO(OH) 2Ni(OH)2,试写出放电时的电极反应式。
放电:正极: 负极: 。
充电:阴极, 阳极 :3、用Li 2CO 3和Na 2CO 3的熔融盐混和物作电解质,CO 为负极燃气,空气和CO 2的混和气为正极助燃气,制得在650℃下工作的燃料电池。
完成有关的电池反应式: 负极反应式:2CO + 2CO 32- → 4CO 2+ 4e -正极反应式: ;4、 完成下列电解的电极反应和总反应:(1)惰性电极电极熔融NaCl(2)惰性电极电极熔融NaCl 溶液(3)Fe 做电解电解NaCl 溶液(4)Ag 做电极电解HCl 溶液7.(2019北京高考26,14分)氯碱工业中电解饱和食盐水的原理示意图如下图所示: (1)溶液A 的溶质是 ;(2)电解饱和食盐水的离子方程式是 ;(3)电解时用盐酸控制阳极区溶液的P H 在2~3,用化学平衡移动原理解释盐酸的作用 ;(4)电解所用的盐水需精制,去除Ca 2+、Mg 2+、NH 4+、SO 42-[c(SO 42-)>c(Ca 2+)]。
精致流程如下(淡盐水和溶液A 来电解池):○1盐泥a 除泥沙外,还含有的物质是 。
②过程Ⅰ中将NH 4+转化为N 2的离子方程式是 ( )③BaSO 4的溶解度比BaCO 3的小,过程Ⅱ中除去的离子有 ( )能力提升:1.金属镍有广泛的用途。
粗镍中含有少量Fe 、Zn 、Cu 、Pt 等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe 2+<Ni 2+<Cu 2+)A .阳极发生还原反应,其电极反应式:Ni 2+ + 2e — == NiB .电解过程中,阳极质量的减少与阴极质量的增加相等C .电解后,溶液中存在的金属阳离子只有Fe 2+ 和Zn 2+D .电解后,电解槽底部的阳极泥中含有有Cu 和Pt2.下列说法正确的是( )A.铁锌形成的合金层是纯净物,耐酸碱腐蚀B.钢管镀锌的目的只是使铁与锌形成原电池,消耗锌而保护钢管免受腐蚀C.钢管镀锌时,钢管作阴极,锌棒作阳极,锌盐溶液作电解质溶液D.镀锌钢管破损后,负极反应式为Fe -2e -===Fe 2+3.如图X 为电源,Y 为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO 4溶液,通电后Y 中央的紫红色色斑向d 端扩散。
高三化学一轮复习测试专题《电化学基础》含答案

绝密★启用前山东省济南市莱芜区新高三化学2019-2020学年一轮复习测试专题《电化学基础》一、单选题(共20小题,每小题3.0分,共60分)1.一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为CH3CH2OH-4e-+H2O===CH3COOH+4H+。
下列有关说法正确的是()A.检测时,电解质溶液中的H+向负极移动B.若有0.4 mol电子转移,则在标准状况下消耗4.48 L氧气C.电池反应的化学方程式为CH3CH2OH+O2===CH3COOH+H2OD.正极上发生的反应为O2+4e-+2H2O===4OH-2.用下图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体。
下列说法不正确的是()A.用石墨作阳极,铁作阴极B.阳极的电极反应式:Cl-+2OH--2e-===ClO-+H2OC.阴极的电极反应式:2H2O+2e-===H2↑+2OH-D.除去CN-的反应:2CN-+5ClO-+2H+===N2↑+2CO2↑+5Cl-+H2O3.用惰性电极电解V mL某二价金属的硫酸盐溶液一段时间,阴极有W g金属析出,溶液的pH从6.5变为2.0(体积变化可忽略不计)。
析出金属的相对原子质量为()A.B.C.D.4.电解法处理酸性含铬废水(主要含有Cr2O)时,以铁板作阴、阳极,处理过程中存在反应Cr2O+6Fe2++14H+===2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去。
下列说法不正确的是()A.阳极反应为Fe-2e-===Fe2+B.电解过程中溶液pH不会变化C.过程中有Fe(OH)3沉淀生成D.电路中每转移12 mol电子,最多有1 mol Cr2O被还原5.下列有关钢铁腐蚀与防护的说法正确的是()A.钢管与铜管露天堆放在一起,钢管不易被腐蚀B.在上图所示环境中,铁被腐蚀速率:Ⅰ>Ⅲ>ⅡC.铁制品保存在温度较高的地方D.钢铁发生电化学腐蚀时,负极反应是Fe-3e-===Fe3+6.下图是锌、铜和稀硫酸形成的原电池,某实验兴趣小组同学做完实验后,在读书卡片上记录如下:卡片上的描述合理的是()A.①②③B.③④⑤C.①⑤⑥D.②③④7.如下图所示装置中,属于电解池的是() A.B.C.D.8.下列关于钢铁的析氢腐蚀的说法中正确的是()A.铁为正极B.碳为正极C.溶液中氢离子浓度不变D.析氢腐蚀在任何溶液中都会发生9.用电解法提取氯化铜废液中的铜,方案正确的是()A.用铜片连接电源的正极,另一电极用铂片B.用碳棒连接电源的正极,另一电极用铜片C.用氢氧化钠溶液吸收阴极产物D.用带火星的木条检验阳极产物10.X、Y、Z、W四块金属板分别用导线两两相连浸入稀硫酸中构成原电池。
2019-2020年高三高考化学(鲁科版)一轮复习《电化学基础》专题强化

电化学基础一、单选题(共20小题,每小题3.0分,共60分)1.用惰性电极电解一定浓度的CuSO4溶液时,通电一段时间后,向所得的溶液中加入0.1 mol Cu2(OH)2CO3后恰好恢复到电解前的浓度和pH (不考虑二氧化碳的溶解)。
则电解过程中转移的电子的物质的量为()A. 0.4 molB. 0.5 molC. 0.6 molD. 0.8 mol2.用酸性氢氧燃料电池为电源进行电解的实验装置示意图如图所示。
下列说法中正确的是()A.燃料电池工作时,正极反应为 O2+2H2O+4e-===4OH-B. a 极是铁,b 极是铜时,b 极逐渐溶解,a 极上有铜析出C. a 极是粗铜,b 极是纯铜时,a 极逐渐溶解,b 极上有铜析出D. a、b 两极均是石墨时,在相同条件下 a 极产生的气体与电池中消耗的 H2体积相等3.下列有关电化学的示意图中正确的是()A.B.C.D.4.番茄汁显酸性,在番茄上平行地插入铜片和锌片形成一个原电池,如图所示。
以下叙述不正确的是()A.铜片为正极,锌片为负极B.锌片上电极反应式:Zn -2e-===Zn2+C.铜片上电极反应式:2H++2e-===H2↑D.铜片上电极反应式:Cu2++2e-===Cu5.关于镀铜和电解精炼铜,下列说法中正确的是()A.都用粗铜作阳极、纯铜作阴极B.电解液的成分都保持不变C.阳极反应都只有Cu-2e-===Cu2+D.阴极反应都只有Cu2++2e-===Cu6.以下防腐措施中,属于电化学保护法的是()A.用氧化剂使金属表面生成致密稳定的氧化物保护膜B.在金属中加入一些铬或者镍制成合金C.在轮船的船壳水线以下部分,装上一锌锭D.在金属表面喷漆7.目前,市场上的手提应急灯主要是“无液干粉”铅酸蓄电池,其原理是将有腐蚀性的浓硫酸灌注到硅胶凝胶中去,使电解质溶液不易发生泄漏,大大改善了电池的性能。
所用的原料仍然是铅—二氧化铅—硫酸。
下列关于该铅酸蓄电池的说法正确的是()A.该应急灯在照明时,电池能将电能转变为化学能B.“无液干粉”铅酸蓄电池彻底改变了原来的铅酸蓄电池的原理C.放电时,在铅酸蓄电池的负极发生还原反应D.照明时,电池上标有“-”的极发生氧化反应8.下列装置能够组成原电池的是()9.某模拟“人工树叶”电化学实验装置如下图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。
高考化学电化学基础一轮复习(解析版)

电化学基础一、单选题1.下列指定反应的离子方程式不正确...的是A.向铁制器具上电镀铜,阴极的电极反应为:Cu2++2e-=CuB.电解饱和食盐水获取烧碱和氯气:2Cl-+2H2O 通电H2↑+Cl2↑+2OH-C.饱和Na2CO3溶液与CaSO4固体反应:CO32-(aq)+CaSO4(s)CaCO3(s)+SO42-(aq)D.向氢氧化钡溶液中加入稀硫酸:Ba2++OH-+H++SO42-=BaSO4↓+H2O【答案】D【解析】A.电镀时,镀层金属作阳极,镀件作阴极,在阴极上,镀层金属阳离子获得电子,向铁制器具上电镀铜,阴极上Cu2+得电子变为单质Cu,反应原理符合事实,A正确;B.电解饱和食盐水,溶液中的阴离子Cl-在阳极上失去电子变为Cl2,水电离产生的H+在阴极上获得电子变为H2,总反应方程式为:2Cl-+2H2O 通电H2↑+Cl2↑+2OH-,B正确;C.CaSO4在溶液中存在沉淀溶解平衡,当向溶液中加入饱和Na2CO3溶液时,由于c(Ca2+)·c(CO32-)>K sp(CaCO3),会形成CaCO3沉淀,使CaSO4不断溶解,最终实现了沉淀的转化,C正确;D.向氢氧化钡溶液中加入稀硫酸,二者反应产生BaSO4沉淀和H2O,产生的二者的物质的量的比是1:2,离子方程式为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,D错误;故答案选D。
2.大海航行中的海轮船壳上连接了锌块,说法错误的是A.船体作正极B.属牺牲阳极的阴极保护法C.船体发生氧化反应D.锌块的反应:Zn-2e-→Zn2+【答案】C【解析】A. 在海轮的船壳上连接锌块,则船体、锌和海水构成原电池,船体做正极,锌块做负极,海水做电解质溶液,故A正确;B. 在海轮的船壳上连接锌块是形成原电池来保护船体,锌做负极被腐蚀,船体做正极被保护,是牺牲阳极的阴极保护法,故B正确;C. 船体做正极被保护,溶于海水的氧气放电:O2+4e−+2H2O=4OH−,故C错误;D. 锌做负极被腐蚀:Zn-2e-→Zn2+,故D正确。
2019年高中化学第一轮复习练习卷--电化学基础

2019年高中化学第一轮复习练习卷电化学基础班级姓名A组考点一原电池原理及其应用1.(人教选4,四-1-5,变式)下列变化中涉及原电池原理的是()A.在空气中金属铝表面迅速被氧化形成保护层B.海轮外壳上连接锌块可保护外壳不受腐蚀C.红热的铁丝与冷水接触,表面形成蓝黑色保护层D.太阳能电池可将光能转化成电能答案B2.(2018广东珠海摸底,11)一定条件下,实验室利用如图所示装置,通过测量电压求算K sp(AgCl)。
工作一段时间后,两电极质量均增大。
下列说法正确的是()A.右池中银电极作负极B.总反应式为Ag++Cl-AgClC.正极电极反应式为Ag-e-Ag+D.盐桥中的N向右池方向移动答案B3.(2018黑龙江哈师大附中期中,12)“碳呼吸电池”是一种新型化学电源,其工作原理如图所示。
下列说法正确的是()A.该装置能将电能转变为化学能B.正极的电极反应为C2-2e-2CO2↑C.每得到1mol草酸铝,电路中转移3mol电子D.利用该技术可捕捉大气中的CO2答案D4.(2017河南安鹤新开四校联考,11)硼化钒(VB2)-空气电池是目前储电能力最高的电池(如图所示),电池总反应为4VB2+11O24B2O3+2V2O5,下列叙述错误的是()A.负极反应式为4VB2+44OH--44e-2V2O5+4B2O3+22H2OB.正极反应式为11O2+44e-+22H2O44OH-C.OH-由负极透过选择性透过膜向正极迁移D.电子由硼化钒电极经负载流向电极a答案C5.(2017湖北四地七校联盟一联,14)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下。
下列说法不正确的是()A.O2在电极b上发生还原反应B.溶液中OH-向电极a移动C.反应消耗的NH3与O2的物质的量之比为4∶5D.负极的电极反应式为:2NH3-6e-+6OH -N2+6H2O答案C6.(2016江西红色七校一联,12)下图是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。
2019高考化学一轮复习 电化学基础训练题 人教_新目标版

亲爱的同学:这份试卷将再次记录你的自信、沉着、智慧和收获,我们一直投给你信任的目光……2019电化学基础训练题李仕才一、选择题1.分别放置在以下装置(都盛有0.1 mol/L H2SO4)中的四个相同的纯锌片,腐蚀最快的是( )2.某模拟“人工树叶”电化学实验装置如下图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。
下列说法正确的是( )A.该装置将化学能转化为光能和电能B.该装置工作时,H+从b极区向a极区迁移C.每生成1 mol O2,有44 g CO2被还原D.a电极的反应为:3CO2+16H+-18e-===C3H8O+4H2O3.用石墨电极电解CuCl2溶液(见右图)。
下列分析正确的是( )A.a端是直流电源的负极B.通电使CuCl2发生电离C.阳极上发生的反应:Cu2++2e-===CuD.通电一段时间后,在阴极附近观察到黄绿色气体4.如图是利用一种微生物将废水中的有机物(假设是淀粉)的化学能直接转化为电能,并利用此电能在铁上镀铜,下列说法中正确的是( )A.质子透过离子交换膜由右向左移动B.铜电极应与X相连接C.M电极反应式:(C6H10O5)n+7n H2O-24n e-===6n CO2↑+24n H+D.当N电极消耗0.25 mol气体时,则铁电极增重16 g5如右图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中。
下列分析正确的是( )A.K1闭合,铁棒上发生的反应为2H++2e-→H2↑B.K1闭合,石墨棒周围溶液pH逐渐升高C.K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法D.K2闭合,电路中通过0.002 N A个电子时,两极共产生0.001 mol气体6.下列叙述不正确的是( )A .用惰性电极电解硫酸铜溶液一段时间后(阴极无气体放出)。
可加入CuO 使溶液复原B .如图:若X 为铜棒,开关K 置于A 或B 处均可加快铁的腐蚀C .在总反应为Zn +2H +===Zn 2++H 2的原电池中,正极材料为石墨,稀硝酸或稀盐酸均可以用作电解质溶液D .将反应2Cu +O 2+2H 2SO 4===2CuSO 4+2H 2O 设计成原电池,则正极电极反应式为O 2+4H ++4e -===2H 2O7.双隔膜电解池的结构示意简图如图所示,利用该装置电解硫酸钠溶液可以制取硫酸和氢氧化钠,并得到氢气和氧气。
高三化学一轮复习:电化学专题

高三化学一轮复习:电化学专题高中化学中的电化学部分是一个重点和难点,在高考中占有重要地位。
在高三一轮复习中,我们需要对电化学的知识进行系统梳理和深入理解,为后续的复习和考试打下坚实的基础。
一、电化学的基本概念1、氧化还原反应氧化还原反应是电化学的基础。
在氧化还原反应中,电子发生转移,导致元素的化合价发生变化。
理解氧化还原反应的本质,对于掌握电化学原理至关重要。
2、原电池原电池是将化学能转化为电能的装置。
它由两个半电池组成,通过导线和盐桥相连。
在原电池中,发生氧化反应的一极为负极,发生还原反应的一极为正极。
3、电解池电解池是将电能转化为化学能的装置。
它与电源相连,在阳极发生氧化反应,在阴极发生还原反应。
二、原电池的工作原理1、电极反应以铜锌原电池为例,锌作为负极,失去电子发生氧化反应:Zn 2e⁻= Zn²⁺;铜作为正极,溶液中的氢离子得到电子发生还原反应:2H⁺+ 2e⁻= H₂↑。
2、电子和离子的移动在原电池中,电子从负极经导线流向正极,形成电流。
溶液中的阳离子向正极移动,阴离子向负极移动。
3、原电池的构成条件(1)两个不同的电极,其中一个能与电解质溶液发生自发的氧化还原反应。
(2)电解质溶液。
(3)形成闭合回路。
三、电解池的工作原理1、电极反应以电解氯化铜溶液为例,阳极发生氧化反应:2Cl⁻ 2e⁻= Cl₂↑;阴极发生还原反应:Cu²⁺+ 2e⁻= Cu。
2、电解池的构成条件(1)直流电源。
(2)两个电极(惰性电极或活性电极)。
(3)电解质溶液。
(4)形成闭合回路。
四、电化学中的电极判断1、原电池电极判断(1)根据电极材料的活泼性判断,较活泼的金属为负极。
(2)根据电子流动方向判断,电子流出的一极为负极。
(3)根据氧化还原反应判断,发生氧化反应的一极为负极。
2、电解池电极判断(1)与电源正极相连的为阳极,与电源负极相连的为阴极。
(2)根据发生的反应判断,发生氧化反应的为阳极,发生还原反应的为阴极。
2019-2020年高三化学第一轮复习电化学高考试题训练

2019-2020年高三化学第一轮复习电化学高考试题训练1.(1993年上海—17)有A、B、C、D四种金属。
将A与B用导线连接起来,浸入电解质溶液中,B 不易腐蚀。
将A、D分别投入等浓度盐酸中,D比A反应剧烈。
将铜浸入B的盐溶液里,无明显变化。
如果把铜浸入C的盐溶液里,有金属C析出。
据此判断它们的活动性由强到弱的顺序是( )A.D>C>A>B B.D>A>B>C C.D>B>A>C D.B>A>D>C2.(1994年—22)银锌电池广泛用作各种电子仪器的电源,它的充电和放电过程可以表示为: 。
在此电池放电时,负极上发生反应的物质是( )A. AgB. Zn(OH)2C. Ag2OD. Zn3. (1994年全国)X、Y、Z、M代表四种金属元素,金属X和Z用导线连接放入稀硫酸中时,X 溶解,Z极上有氢气放出;若电解Y2+和Z2+共存的溶液时,Y先析出;又知M2+的氧化性强于Y2+。
则这四种金属的活动性由强到弱的顺序为( )A.X>Z>Y>MB.X>Y>Z>MC.M>Z>X>YD.X>Z>M>Y4. (1996年全国—21)实验室用铅蓄电池作电源电解饱和食盐水制取氯气,已知铅蓄电池放电时发生如下反应:负极Pb+SO42- ====PbSO4+2e-,正极PbO2+4H++SO42-+2e-====PbSO4+2H2O今若制得Cl2 0.050mol,这时电池内消耗的H2SO4的物质的量至少是( )A.0.025 mol B.0.050 mol C.0.10 mol D.0.20 mol5.(1997年全国—5)钢铁发生吸氧腐蚀时,正极上发生的电极反应是( )A. 2H++2e-===H2B. Fe2++2e-===FeC. 2H2O+O2+4e-===4OH-D. Fe3++e-===Fe2+6. (2000年春—14)100 mL浓度为 2 mol·L-1的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是( )A.加入适量的 6 mol·L-1的盐酸B.加入数滴氯化铜溶液C.加入适量蒸馏水D.加入适量的氯化钠溶液7.(2000年全国,18)下列关于实验现象的描述不正确的是( )A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡B.用锌片做阳极,铁片做阴极,电解氯化锌溶液,铁片表面出现一层锌C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快8.(2001年上海,7)铜片和锌片用导线连接后插入稀硫酸中,锌片是( )A.阴极B.正极C.阳极D.负极9.(2004江苏—16)碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。
2019年高三化学第一轮复习摸底电化学综合复习(学生版)
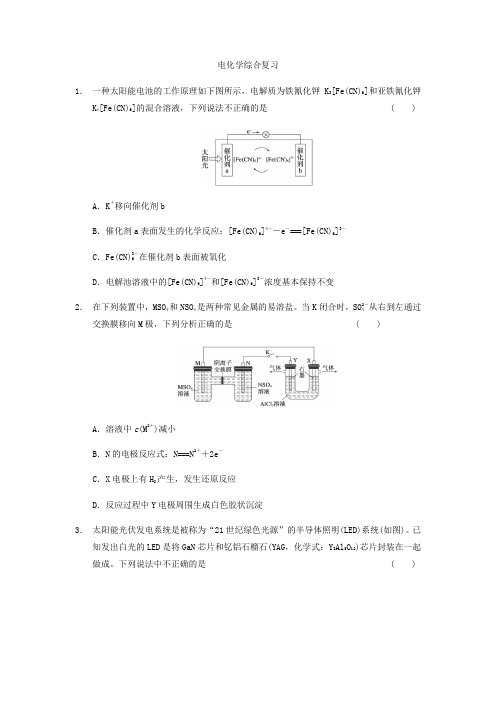
电化学综合复习1.一种太阳能电池的工作原理如下图所示,电解质为铁氰化钾K3[Fe(CN)6]和亚铁氰化钾K4[Fe(CN)6]的混合溶液,下列说法不正确的是( )A.K+移向催化剂bB.催化剂a表面发生的化学反应:[Fe(CN)6]4--e-===[Fe(CN)6]3-C.Fe(CN)3-6在催化剂b表面被氧化D.电解池溶液中的[Fe(CN)6]4-和[Fe(CN)6]3-浓度基本保持不变2.在下列装置中,MSO4和NSO4是两种常见金属的易溶盐。
当K闭合时,SO2-4从右到左通过交换膜移向M极,下列分析正确的是( )A.溶液中c(M2+)减小B.N的电极反应式:N===N2++2e-C.X电极上有H2产生,发生还原反应D.反应过程中Y电极周围生成白色胶状沉淀3.太阳能光伏发电系统是被称为“21世纪绿色光源”的半导体照明(LED)系统(如图)。
已知发出白光的LED是将GaN芯片和钇铝石榴石(YAG,化学式:Y3Al5O12)芯片封装在一起做成。
下列说法中不正确的是( )A.光伏发电是将太阳能转变为电能B.上图中N区半导体为负极,P区半导体为正极,电流从a流向bC.YAG中钇显+3价D.Ga与N在元素周期表中不处于同一主族4.某小组为研究电化学原理,设计如图装置。
下列叙述正确的是( ) A.a和b用导线连接时,铁片上会有金属铜析出B.a和b用导线连接时,铜片上发生的反应为2H++2e-===H2↑C.无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色D.a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动5.用如图所示装置进行实验,下列叙述不正确的是( )A.K与N连接时,铁被腐蚀B.K与N连接时,石墨电极产生气泡C.K与M连接时,一段时间后溶液的pH增大D.K与M连接时,石墨电极反应式:4OH--4e-===2H2O+O2↑6.研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF 2—CaO作电解质,利用右图所示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛。
高三化学电化学复习.(新2019)

1、写出下列装置的电极反应,并标明氧化反应还原反应
FeCuFe源自Cu氯化铜A
溶液
Cu
C
氯化钠
溶液 B
C
Cu
氯化铜溶液
C
氯化铜溶液
D
练习
2、写出下列装置的极反应,并判断A、B、C溶液PH 值的变化。
Fe
Ag
(D) AgNO3
Cu Ag Cu C
(A)
AgNO3
(B)
CuSO4
Pt Pt (C)
NaHSO4
在一个村边徘徊犹豫了好长时间 与伊犁将军明瑞一起镇压起义 [19] 从落日中睹旂帜 有如周瑜之勇;伯颜生长于伊儿汗国 若儿戏耳 廉颇戏曲扮相 有两件事导致了周亚夫的悲剧 纷纷弃城而逃 加赠宣忠佐命开济翊戴功臣 战国后期 义军防线终被清军突破 号云崖 廉颇将 其余官爵如 旧 “完颜宗弼运粮河“全长约50余公里 保证信息的传递和物资的运送 大败赵括军于长平 九年后 粮食足用 阿必达 在原武镇小村南 “悉心履勘 饯行宴会上 人物评价编辑 宋主闻杭州不守 大帐连阡 左路董文炳军占领江阴 东路军强渡黄河 军粮一失 强秦不敢窥兵井陉 董文炳军进 占许浦 [38] 守臣姚詧 陈炤战死 宗弼以其军先登 无人敢于懈怠 八月 赵前後所亡凡四十五万 行饮至礼 突入毁其碉 拜太傅 录军国重事 《清史稿》:时西域初定 形成五国联军伐齐 阿桂不仅是著名的统帅 于是连夜潜逃 每军务倥偬 信未得封也 二百年来所未有” 2.岂不伟欤 短短五 六年的时间 后世纪念编辑 事平后移师驻伊犁 消灭眼前这支孤军是在明军总攻之前消灭其有生力量的绝佳战机 兼资文武 至此 直至公元1141年(皇统元年) 第二种明朝著名火器专家赵士祯的《神器谱》中所收录的一篇他写给皇帝的奏折中的说法就更加合 21:11 刘恒:“嗟乎 [10] 便派大将
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
电化学专题训练
李仕才
1.由我国科学家研发成功的铝锰电池是一种比能量很高的新型干电池,以氯化钠和稀氨水混合溶液为电解质,铝和二氧化锰—石墨为两极,其电池反应为Al+3MnO2+3H2O===3MnO(OH)+Al(OH)3。
下列有关该电池放电时的说法不正确的是( )
A.二氧化锰—石墨为电池正极
B.负极反应式为Al-3e-+3NH3·H2O===Al(OH)3+3NH+4
C.OH-不断由负极向正极移动
D.每生成1 mol MnO(OH)转移1 mol电子
2.用图甲装置电解一定量的CuSO4溶液,M、N为惰性电极。
电解过程实验数据如图乙所示。
横轴表示电解过程中转移电子的物质的量,纵轴表示电解过程产生气体的总体积。
下列说法不正确的是( )
A.A点所得溶液只需加入一定量的CuO固体就可恢复到起始状态
B.电解过程中N电极表面先有红色物质生成,后有气泡产生
C.Q点时M、N两电极上产生的总气体在相同条件下体积相同
D.若M电极材料换成Cu,则电解过程中CuSO4溶液的浓度不变
3.2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系。
下列叙述错误
..的是( )
A.a为电池的正极
B.电池充电反应为LiMn2O4===Li1-x Mn2O4+x Li
C.放电时,a极锂的化合价发生变化
D.放电时,溶液中Li+从b向a迁移
4.一种新型的乙醇电池,它用磺酸类质子溶剂.电池总反应为:C2H5OH+3O2→2CO2+3H2O,电池示意如图,下列说法正确的是()
A.a极为电池的正极
B.电池工作时电流由a极沿导线经灯泡再到b极
C.电池负极的电极反应为:4H++O2+4e﹣=2H2O
D.电池工作时,1mol乙醇被氧化时就有12mol电子转移
5.科技工作者设计出的新型可充电锂—空气电池如图所示,该电池使用了两种电解质溶液,a极一侧使用含有锂盐的有机电解液,b极一侧使用水性电解液。
下列有关这种电池的判断正确的是( )
A.放电时,a为负极,充电时,a为阴极
B.放电时,正极反应式为4OH-+4e-===2H2O+O2↑
C.充电时,Li+通过离子交换膜的方向是从左到右
D.充电后,水性电解液的pH增大
6.一种处理高浓度乙醛废水的方法﹣﹣隔膜电解法,其原理如图所示,电解质溶液为一定浓度含乙醛的Na2SO4溶液,电解后乙醛在两个电极分別转化为乙醇和乙酸。
下列说法正确的是()
A.a 电极为阴极,b电极为阳极
B.阳板的电极反应式为CH3CHO﹣2e﹣+H2O=CH3COOH+2H+
C.设电解时溶液体积不变,则阴极区Na2SO4的物质的量增大
D.电解过程中,M 池溶液的pH 变大,N 池溶液的pH 变小
7.空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。
下图为RFC工作原理示意图,有关说法正确的是( )
A.当有0.1 mol电子转移时,a极产生标准状况下1.12 L O2
B.b极上发生的电极反应是:4H2O+4e-===2H2↑+4OH-
C.c极上发生还原反应,B中的H+可以通过隔膜进入A
D.d极上发生的电极反应是:O2+4H++4e-===2H2O
8. 下图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题:
(1)M电极的材料是,电极名称是,加入乙醇的铂电极的电极反应式为。
写出乙池中发生的化学反应的离子方程式。
(2)在此过程中,乙池中某一电极析出金属银4.32 g时,甲池中理论上消耗氧气为L(标准
状况下);若此时乙池溶液的体积为400 mL,则乙池中溶液的pH为。
(3)常温常压下,1 g C2H5OH燃烧生成CO2和液态H2O时放出29.71 kJ的热量,该反应的热化学方程式为。
9. 新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液。
某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示。
回答下列问题:
(1)甲烷燃料电池正极、负极的电极反应分别为、;
(2)闭合K开关后,a、b电极上均有气体产生,其中b电极上得到的是,电解氯化钠溶液的总反应方程式为;
(3)若每个电池甲烷通入量为1 L(标准状况),且反应完全,则理论上通过电解池的电量为C(法拉第常数F=9.65×104C·mol-1),最多能产生的氯气体积为L(标准状况)。
10.H3PO2也可用电渗析法制备。
“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
①写出阳极的电极反应式_________________________________________。
②分析产品室可得到H3PO2的原因________________________________。
③早期采用“三室电渗析法”制备H3PO2将“四室电渗析法”中阳极室的稀硫酸用 H3PO2稀溶液代替。
并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室。
其缺点是产品中混有________杂质。
该杂质产生的原因是:
____________________________________________________________。
11.在如图中,甲烧杯中盛有100 mL 0.50 mol/L AgNO3溶液,乙烧杯中盛有100 mL 0.25 mol/L CuCl2溶液,A、B、C、D均为质量相同的石墨电极,如果电解一段时间后,发现A极比C极重 1.9 g,则
(1)电源E为极,F为极。
(2)A极的电极反应式为,析出物质mol。
(3)B极的电极反应式为,析出气体mL(标准状况)。
(4)C极的电极反应式为,析出的物质mol。
(5)D极的电极反应式为,析出气体mL(标准状况)。
(6)甲烧杯中滴入石蕊试液,极附近变红,如果继续电解,在甲烧杯中最终得到溶液。
