北京医疗器械检测资格认可范围及限制要求
北京医疗器械验收标准

北京医疗器械验收标准医疗器械的验收是医疗机构日常工作中非常重要的一环,它直接关系到患者的健康和生命安全。
为了规范医疗器械的验收工作,北京市制定了一系列的医疗器械验收标准,以确保医疗器械的质量和安全性。
本文将详细介绍北京医疗器械验收标准的相关内容,希望能够对医疗机构的工作人员有所帮助。
首先,北京医疗器械验收标准要求医疗机构在进行器械验收前,必须对器械的相关证件进行审查。
这包括器械的生产许可证、注册证、产品合格证等。
只有在相关证件齐全并且合法有效的情况下,医疗机构才能够进行器械的验收工作。
其次,医疗器械的验收需要进行外观检查。
外观检查主要是针对器械的包装完好性、标识清晰度、表面光洁度等方面进行检查,以确保器械在运输和储存过程中没有受到损坏或污染。
接着,医疗器械的验收还需要进行性能检测。
性能检测是指对器械的功能和性能进行测试,以确保其符合相关的技术标准和性能要求。
例如,医用电子血压计需要进行测量精度和稳定性的测试,医用手术刀需要进行切割效果和安全性的测试等。
此外,北京医疗器械验收标准还要求医疗机构对器械的贮存条件进行检查。
医疗器械通常需要在特定的温度、湿度和光照条件下进行贮存,以确保其质量和安全性。
医疗机构在验收器械时,需要对其贮存条件进行检查,并及时采取相应的措施,以防止器械在贮存过程中受到损坏或变质。
最后,医疗器械的验收还需要进行验收记录和报告的编制。
验收记录和报告是对器械验收过程和结果的书面记录,它包括了验收的时间、地点、验收人员、验收结果等内容。
医疗机构需要对每一次器械的验收进行记录和报告,以便日后的跟踪和追溯。
总之,北京医疗器械验收标准对医疗机构进行了严格的规范,要求医疗机构在进行器械验收时,必须严格按照标准的要求进行。
只有这样,才能够保证医疗器械的质量和安全性,为患者的健康和生命安全提供保障。
希望各医疗机构能够严格遵守相关标准,提高器械验收的质量和效率。
根据医疗器械监督管理条例及医疗器械检测机构资格认可办法

根据医疗器械监督管理条例及医疗器械检测机构资格认可办法医疗器械监督管理条例是我国医疗器械监管的基本法律,对医疗器械的生产、销售、使用、检测等环节做出了详细规定。
医疗器械检测机构资格认可办法则是对医疗器械检测机构进行资格认定的具体规定。
本文将从医疗器械监督管理条例和医疗器械检测机构资格认可办法两方面展开论述,以期加深对医疗器械监管的理解和认识。
其次,医疗器械监督管理条例还对医疗器械的检测进行了规范。
根据条例,医疗器械的检测必须由具备相应资质的检测机构进行。
医疗器械检测机构必须获得国家药品监督管理局认可,具备相应设备和技术能力,并对检测结果负责。
医疗器械检测机构还需要建立严格的质量管理体系,确保检测的准确性和可靠性。
同时,医疗器械检测机构资格认可办法对医疗器械检测机构的资格认定进行了具体规定。
根据办法,医疗器械检测机构的资格认定分为初次认定和继续认定两个阶段。
初次认定需要提交相关申请材料,并接受资格认定的评审。
评审根据医疗器械检测机构的设备、技术能力、质量管理体系等方面进行评判。
对于初次认定合格的机构,将颁发医疗器械检测机构资格认定证书。
继续认定则需要定期进行,评价标准和程序与初次认定类似。
综上所述,医疗器械监督管理条例和医疗器械检测机构资格认可办法共同构成了我国医疗器械监管的法律体系。
通过这些法规,我们可以确保医疗器械的生产、销售和使用环节遵循规范,保障医疗器械的质量和安全。
医疗器械检测机构资格认可办法则为医疗器械检测机构提供了明确的认证流程和评价标准,加强了对检测机构的管理和监督。
这些法规和制度的实施,有助于促进医疗器械行业的健康发展,保障公众的健康和安全。
北京市医疗器械质量监督检验中心承检范围
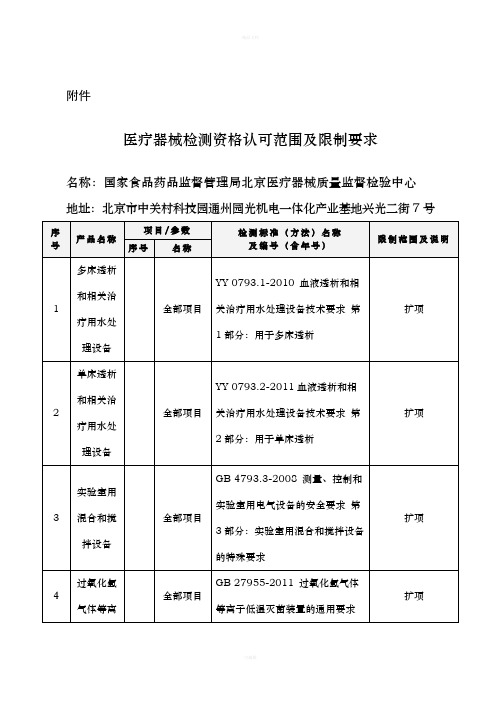
31
液体膨腔泵
全部项目
YY/T 0864-2011 医用内窥镜 内窥镜功能供给装置 液体膨宫泵
扩项
32
直肠、乙状结肠活体取样钳
全部项目
YY/T 0178-2010 直肠、乙状结肠活体取样钳
扩项
33
鼻咽活体取样钳
全部项目
YY/T 0246-2010 鼻咽活体取样钳
扩项
34
带定位球囊的肠营养导管
全部项目
扩项
8
医用电热毯
全部项目
YY 0834-2011 医用电气设备 第二部分:医用电热毯、电热垫和电热床垫 安全专用要求
扩项
9
牙科低压电动马达
全部项目
YY 0836-2011 牙科手机 牙科低压电动马达
扩项
10
牙科气动马达
全部项目
YY 0837-2011 牙科手机 牙科气动马达
扩项
11
医用电气设备周期性测试和修理后测试
扩项
42
人工血管
全部项目
YY 0500-2004 心血管植入物 人工血管
扩项
43
创面敷料(阻菌性)
阻菌性
YY 0471.5-2011 创面敷料阻菌性
扩项
44
血液透析和相关治疗用水
全部项目
YY 0572-2005 血液透析和相关治疗用水
扩项
45
分析用水
全部项目
GB/T 6682-2008 分析实验室用水规格和试验方法
扩项
24
取石篮
全部项目
YY 0847-2011 医用内窥镜 内窥镜器械 取石网篮
扩项
25
冷光源
全部项目
YY 1081-2011 医用内窥镜 内窥镜功能供给装置 冷光源
(局发文式样)---国家食品药品监督管理总局

扩项
18
激光焊接材料
1
化学成分(Ga Rh Ge Au Pb In Li Co Sn Ir Pd Pt Mn Ag Be Na Zn Cd Ba Ca Fe Ni Cu Cr Mo Ti)
牙科学 激光焊接
ISO 28319:2010
扩项
19
金属材料
1
金属材料腐蚀试验方法
磷矿石和磷精矿中氧化钙含量的测定容量法GB/T 1871.4-1995
不能测羟基磷灰石含量
扩项
2
红外吸收谱
14
羟基磷灰石生物陶瓷
1
微量杂质元素及重金属元素含量极限(Cd Pb As)
羟基磷灰石生物陶瓷
YY 0305-1998
磷矿石和磷精矿中五氧化二磷含量的测定磷钼酸喹啉重量法和容量法GB/T 1871。1-1995
附件
医疗器械检测资格认可范围及限制要求
名称:国家食品药品监督管理局北大医疗器械质量监督检验中心
地址:北京市海淀区中关村南大街22号
序号
产品
名称
项目/参数
检测标准(方法)名称
及编号(含年号)
限制范围及说明
序号
名称
1
牙科学义齿基托聚合物(义齿基托树脂)
1
未聚合的材料-液剂成分
牙科学 基托聚合物 第1部分:义齿基托聚合物
磷矿石和磷精矿中氧化钙含量的测定容量法GB/T 1871。4—1995
不能测相成分及结晶度
扩项
2
红外吸收谱
15
种植体附件
(基台、螺钉、愈合帽、上部结构、牙龈成型器)
1
化学成分(Ga Rh Ge Au Pb In Li Co Sn Ir Pd Pt Mn Ag Be Na Zn Cd Ba Ca Fe Ni Cu Cr Mo C H O N S Ti )
医疗器械检测机构资格认可办法(试行)

医疗器械检测机构资格认可办法(试行)第一章总则第一条为了保证医疗器械检测机构工作的规范性、公正性和科学性,根据《医疗器械监督管理条例》的规定,制定本办法。
第二条国家药品监督管理局负责医疗器械检测机构资格的认可工作和监督管理工作。
第三条国家药品监督管理局依据GB/T15481-2000《校准和检验实验室能力的通用要求》对医疗器械检测机构的质量体系和运行能力进行认可。
第四条国家药品监督管理局根据《医疗器械监督管理条例》及相关配套规章、医疗器械通用和专用安全要求标准以及产品标准确定医疗器械检测机构的医疗器械受检目录。
各医疗器械检测机构必须在确定的医疗器械受检目录范围内开展检测工作。
第五条国家药品监督管理局的职责:(一)组织对医疗器械检测机构资格认可评审员的培训及资格评定,建立医疗器械检测机构资格认可评审员专家库;(二)受理医疗器械检测机构资格认可申请。
组织对申请资格认可的医疗器械检测机构进行评审;(三)组织或委托对资格认可后的医疗器械检测机构进行监督和复审。
根据监督或复审结果做出维持认可、限期改正、撤销认可或变更认可范围的决定;(四)受理对医疗器械检测机构资格认可工作和对资格认可的医疗器械检测机构检测工作的申诉。
第二章认可条件和认可程序第六条医疗器械检测机构资格认可条件:(一)医疗器械检测机构应是具有法人资格的专职检测机构;(二)已获得计量认证证书。
具有按GB/T15481-2000《校准和检验实验室能力的通用要求》进行质量体系运行的能力;(三)具备受检目录内医疗器械的检测能力,检测设备配备率不低于95%,并按标准或相应的指导检测实施的技术性文件,作模拟运转,建立并保存原始记录和检验报告;(四)符合《医疗器械检测机构评审细则表》(附后〔略〕)的要求;(五)遵守本办法中的有关规定。
第七条申请资格认可的医疗器械检测机构(以下简称申请方)可向国家药品监督管理局提交意向申请并可咨询有关认可事宜。
国家药品监督管理局向申请方提供最新版本的认可规则和其他有关认可要求的文件。
根据医疗器械监督管理条例及医疗器械检测机构资格认可办法

根据医疗器械监督管理条例及医疗器械检测机构资格认可办法医疗器械监督管理条例介绍与医疗器械检测机构资格认可办法随着医疗技术的不断发展与进步,医疗器械在医疗行业中发挥着重要的作用。
然而,医疗器械的安全性与有效性是保障患者生命健康安全的核心。
为了规范和加强医疗器械的监管工作,我国制定了医疗器械监督管理条例,并制定了医疗器械检测机构资格认可办法。
本文将深入介绍医疗器械监督管理条例的相关内容以及医疗器械检测机构资格认可办法的具体要求。
一、医疗器械监督管理条例医疗器械监督管理条例是我国针对医疗器械管理所制定的法规,旨在加强对医疗器械的生产、销售、使用等环节的监督与管理,确保医疗器械的安全性和有效性。
该条例于2014年6月开始施行,对医疗器械的监督管理起到了重要的法律支撑作用。
医疗器械监督管理条例主要包括以下几个方面的内容:1. 定义和分类:明确了医疗器械的定义,并将其分为三个类别,分别是一类、二类和三类医疗器械。
不同类别的医疗器械在注册、备案、监督等方面要求也有所不同。
2. 注册与备案:对于一类和二类医疗器械,要求生产和经营者必须进行注册备案,以确保其品质可靠、安全有效。
3. 临床试验与评价:针对新的医疗器械产品,要求进行临床试验和评价,确保其安全性和有效性。
4. 监督与管理:明确了医疗器械监督管理的责任部门和职责,包括对医疗器械生产、销售、使用环节进行监督,对不符合要求的医疗器械进行召回、停产等处理措施。
5. 法律责任:对于违反医疗器械监督管理条例的行为,明确了相关的法律责任和处罚措施。
二、医疗器械检测机构资格认可办法为了确保医疗器械的安全可靠,医疗器械检测机构起到了重要的作用。
医疗器械检测机构资格认可办法是我国对医疗器械检测机构进行认可和管理的规定,为推动医疗器械检测的质量提升和标准化发展提供了指导。
医疗器械检测机构资格认可办法主要包括以下几个方面的内容:1. 机构资质要求:规定医疗器械检测机构必须具备合格的检测设备、仪器和设施,同时要求检测人员具备相关的专业知识和技能。
根据医疗器械监督管理条例及医疗器械检测机构资格认可办法
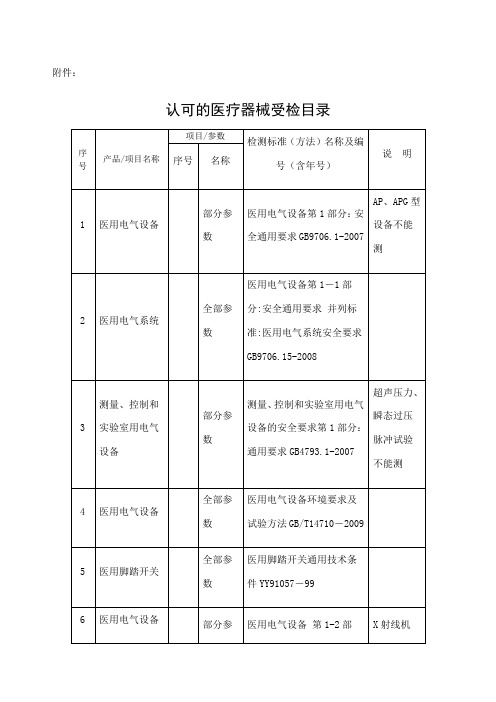
无菌塑柄手术刀
全部参数
无菌塑柄手术刀YY/T0454-2008
27
小针刀
全部参数
小针刀YZB/苏0044-2007
28
止血钳
全部参数
止血钳YY/T0452-2003
29
气管异物钳
全部参数
气管异物钳通用技术条件YY0078-92
30
穿鳃式止血钳
全部参数
穿鳃式止血钳 通用技术条件GB/T 2766-2006
医用电气设备
部分参数
医用电气设备 第1-2部分:安全通用要求 并列标准:电磁兼容 要求和试验YY0505-2005
X射线机EMC性能不能测
7
医用电气设备
全部参数
电磁兼容 家用电器、电动工具和类似器具的要求 第1部分:发射GB 4343.1-2003
8
医用电气设备
部分参数
信息技术设备抗扰度限值和测量方法GB/T17618-1998
全部参数
心电遥测监护系统YZB/苏0372-2006
101
动态心电记录仪
全部参数
动态心电监护仪YZB/苏0802-2007
102
麻醉气体监护仪
全部参数
麻醉气体监护仪YY0601-2007
103
多导睡眠图仪
全部参数
多导睡眠图仪YZB/苏0396-2005
104
肌电生物反馈仪
全部参数
肌电生物反馈仪YY/T1095-2007
3
测量、控制和实验室用电气设备
部分参数
测量、控制和实验室用电气设备的安全要求第1部分:通用要求GB4793.1-2007
超声压力、瞬态过压脉冲试验不能测
4
医用电气设备
北京医疗器械制度

北京医疗器械制度北京医疗器械管理制度一、总则1. 为加强医疗器械管理,保障公众健康,根据《医疗器械监督管理条例》及相关法律法规,制定本制度。
2. 本制度适用于北京市行政区域内医疗器械的研制、生产、经营、使用和监督管理。
二、医疗器械分类管理1. 医疗器械按照风险程度分为三类:第一类为低风险,第二类为中等风险,第三类为高风险。
2. 第一类医疗器械实行备案管理,第二类医疗器械实行注册管理,第三类医疗器械实行注册管理,并实施更为严格的监管。
三、医疗器械研制管理1. 医疗器械研制单位应具备相应的研发能力和质量管理体系。
2. 研制过程中应遵循医疗器械安全有效性评价原则,确保研制的医疗器械符合国家和行业标准。
四、医疗器械生产管理1. 生产企业必须取得医疗器械生产许可证,并在许可范围内进行生产。
2. 生产过程中应建立完善的质量管理体系,确保产品质量符合规定要求。
五、医疗器械经营管理1. 经营企业必须取得医疗器械经营许可证,并在许可范围内进行经营。
2. 经营企业应对所经营的医疗器械进行质量审核,确保其合法性和安全性。
六、医疗器械使用管理1. 使用单位应建立医疗器械使用管理制度,确保医疗器械的正确使用。
2. 使用单位应定期对医疗器械进行维护和校验,确保其性能稳定。
七、医疗器械监督管理1. 北京市医疗器械监督管理部门负责本行政区域内医疗器械的监督管理工作。
2. 监督管理部门应定期对医疗器械研制、生产、经营和使用单位进行监督检查。
八、法律责任1. 违反本制度规定的单位和个人,将依法承担相应的法律责任。
2. 对于严重违法违规行为,依法予以行政处罚,构成犯罪的,依法追究刑事责任。
九、附则1. 本制度自发布之日起实施,由北京市医疗器械监督管理部门负责解释。
2. 本制度如有与上级法律法规相抵触的,以上级法律法规为准。
请根据实际情况和具体要求,对上述内容进行适当调整和补充。
根据《医疗器械监督管理条例》及《医疗器械检测机构资格认可办法

自停开颅钻
全部参数
自停开颅钻YZB/苏0643-2020
62
椎板咬骨钳
全部参数
椎板咬骨钳YZB/苏0810-2020
63
髓核钳
全部参数
髓核钳YZB/苏0811-2020
64
咬骨钳
全部参数
咬骨钳YY/T1127-2006
65
腰椎穿刺针
全部参数
腰椎穿刺针YY91148-1999
66
外固定支架
全部参数
全部参数
心电遥测监护系统YZB/苏0372-2006
101
动态心电记录仪
全部参数
动态心电监护仪YZB/苏0802-2007
102
麻醉气体监护仪
全部参数
麻醉气体监护仪YY0601-2007
103
多导睡眠图仪
全部参数
多导睡眠图仪YZB/苏0396-2005
104
肌电生物反馈仪
全部参数
肌电生物反馈仪YY/T1095-2007
医用电气设备
部分参数
医用电气设备 第1-2部分:安全通用要求 并列标准:电磁兼容 要求和试验YY0505-2005
X射线机EMC性能不能测
7
医用电气设备
全部参数
电磁兼容 家用电器、电动工具和类似器具的要求 第1部分:发射GB 4343.1-2003
8
医用电气设备
部分参数
信息技术设备抗扰度限值和测量方法GB/T17618-1998
全部参数
医用有机硅材料生物学评判试验方法GB/T16175-2020 医疗器械生物学评判 第5部分:体外细胞毒性试验GB/T16886.5-2003 口腔材料生物学评判 第2单元:口腔材料生物试验方法 细胞毒性试验:琼脂覆盖法及分子滤过法YY/T0127.9-2001 医用输液、输血、注射器具检验方法 第2部分:生物学试验方法GB/T14233.2-2005
北京市医疗器械质量监督检验中心承检范围
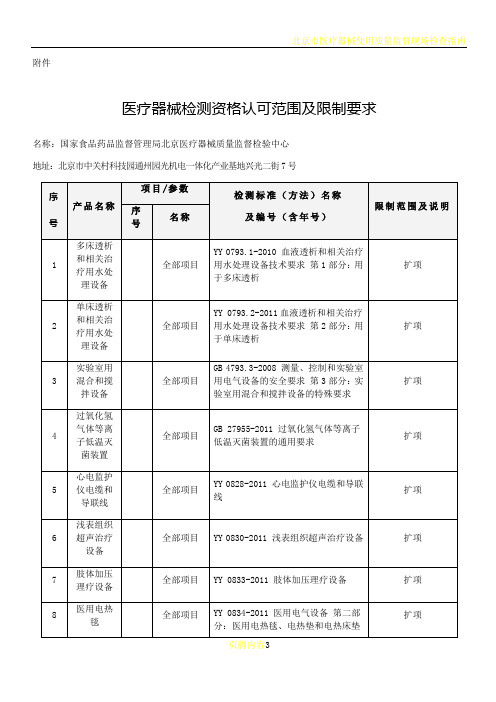
YY 0831.1-2011 γ射束立体定向放射治疗系统 第1部分:头部多源γ射束立体定向放射治疗系统
扩项
19
头部X射线放射治疗立体定向及计划系统
全部项目
YY 0832.1-2011 X射线放射治疗立体定向及计划系统 第1部分:头部X射线放射治疗立体定向及计划系统
扩项
20
气腹机
全部项目
YY 0843-2011 医用内窥镜 内窥镜功能供给装置 气腹机
扩项
碳量的测定
GB/T 4698.14-2011 海绵钛、钛及钛合金化学分析方法 碳量的测定
扩项
氢量的测定
GB/T 4698.15-2011 海绵钛、钛及钛合金化学分析方法 氢量的测定
扩项
37
血袋
全部项目
GB/T 14232.3-2011 人体血液及血液成分袋式塑料容器 第3部分:含特殊组件的血袋系统
扩项
15
呼吸面罩及应用附件
全部项目
YY 0671.2-2011 睡眠呼吸暂停治疗 第2部分:面罩和应用附件
扩项
16
腹腔镜用剪
全部项目
YY 0672.2-2011 内镜器械 第2部分:腹腔镜用剪
扩项
17
转运培养箱
全部项目
YY 0827-2011 医用电气设备 第2部分:转运培养箱安全专用要求
扩项
18
头部多源γ射束立体定向放射治疗系统
扩项
24
取石篮
全部项目
YY 0847-2011 医用内窥镜 内窥镜器械 取石网篮
扩项
25
冷光源
全部项目
YY 1081-2011 医用内窥镜 内窥镜功能供给装置 冷光源
扩项
医疗器械检测资格认可范围及限制要求1

医疗器械检测资格认可范围及限制要求摘要医疗器械的使用是与人类健康息息相关的,因此,医疗器械的安全性、有效性和质量是必须保障的。
对于医疗器械检测实验室,必须具备相应的检测资格认证,以确保检测结果的准确性和可靠性,从而保证其检测结果的真实性和可信性。
本文主要介绍了医疗器械检测资格认可的范围及限制要求。
一、医疗器械检测资格认可的范围医疗器械检测资格认可的范围包括检测实验室、检测人员、检测方法、检测设备等。
在进行医疗器械检测资格认证时,需要对检测实验室、检测人员等进行审核,并要求其满足特定的认证标准和要求,以确保其通过了认证后能够独立完成医疗器械检测工作。
1. 检测实验室医疗器械检测实验室需要经过国家相关机构的认证审核,包括但不限于:国家食品药品监督管理总局、中国合格评定国家认可委员会等。
审核主要针对实验室的检测能力、人员素质、设备、质量保障体系等方面。
实验室需要具备完善的质量管理体系和文件管理系统,建立健全的校准和检验体系,对设备进行定期检验和校准,维护设备的正常运转状态。
实验室还需要建立规范的实验室环境,包括通风、照明、温湿度等。
2. 检测人员医疗器械检测人员需要具备相关的资格认证和培训,确保其具备足够的检测技能和专业知识。
相关的认证机构主要有国家高级资格认证机构、中国合格评定国家认可委员会、国家食品药品监督管理总局等。
为确保检测人员的工作能力和素质,相关的认证机构会对检测人员的进行考核和审核,包括考核其理论知识、实验技能和操作规范等,同时也会对检测人员的聘用合同、福利待遇等进行审核和评估。
3. 检测方法医疗器械检测方法是指从医疗器械性能、安全性、有效性等多个方面进行检测的方法。
检测方法主要包括定性和定量两种。
定性测试主要用于评价医疗器械的性能、安全性等方面,例如耐冲击性测试、耐高温测试等。
定量测试主要用于评估医疗器械的定量特性,例如医疗器械的准确性、重复性、灵敏度等。
检测人员需要按照标准化流程进行检测,并记录检测结果。
国家食品药品监督管理总局关于认可国家食品药品监督管理局北大医

国家食品药品监督管理总局关于认可国家食品药品监督管理局北大医疗器械质量监督检验中心医疗器械产品和项目检测
资格的通知
【法规类别】质量管理监督机构与人员
【发文字号】食药监械管[2013]42号
【发布部门】国家食品药品监督管理总局
【发布日期】2013.07.01
【实施日期】2013.07.01
【时效性】现行有效
【效力级别】部门规范性文件
国家食品药品监督管理总局关于认可国家食品药品监督管理局北大医疗器械质量监督检
验中心医疗器械产品和项目检测资格的通知
(食药监械管〔2013〕42号)
国家食品药品监督管理局北大医疗器械质量监督检验中心:
根据《医疗器械监督管理条例》及《医疗器械检测机构资格认可办法(试行)》(国药监械〔2003〕125号)的规定,2012年6月23日至24日,原国家食品药品监督管理局组织专家组对国家食品药品监督管理局北大医疗器械质量监督检验中心的医疗器械检测能力进行了现场评审。
经审查,认可该中心修复用人工牙等133个医疗器械产品和项目(见附件)检测资格,有效期5年。
附件:医疗器械检测资格认可范围及限制要求
国家食品药品监督管理总局
2013年7月1日
附件
医疗器械检测资格认可范围及限制要求
名称:国家食品药品监督管理局北大医疗器械质量监督检验中心
地址:北京市海淀区中关村南大街22号。
根据《医疗器械监督管理条例》及《医疗器械检测机构资格认

超声洁牙设备YY0460-2003
超声理疗设备YY/T1090-2004
高强度聚焦超声(HIFU)治疗系统
YY 0592-2005
71.
超声共振骨切割系统
全部项目
超声共振骨切割系统YZB/SF 0001-2006
72.
医用超声耦合剂
全部项目
医用超声耦合剂YY 0299-2008
29.
立体定位射波手术平台
全部项目
立体定位射波手术平台YZB/USA 1671-2005
30.
X射线诊断机
全部项目
医用电气设备第2部分:诊断X射线发生装置的高压发生器安全专用要求
GB9706.3-2000/IEC60601-2-7:1998
医用电气设备第二部分:医用诊断X射线源组件和X射线管组件安全专用要求
GB18988.2-2003/ IEC 61675-2:1998
54.
伽玛照相机
全部项目
放射性核素成像设备性能和试验规则第3部分:伽玛照相机全身成像系统
GB18988.3-2003/IEC61675-3:1998
放射性核素成像设备性能和试验规则伽玛照相机GB18989-2003/IEC60789:1992
医用电气设备第2-37部分:超声诊断和监护设备安全专用要求GB 9706.9-2008/
IEC 60601-2-37:2001,IDT
超声经颅多普勒血液分析仪
YY 0593-2005
66.
超声治疗设备
全部项目
医用电气设备第2-5部分:超声理疗设备安全专用要求GB 9706.7-2008/
IEC 60601-2-5:2000,IDT
北京医疗器械检测资格认可范围及限制要求
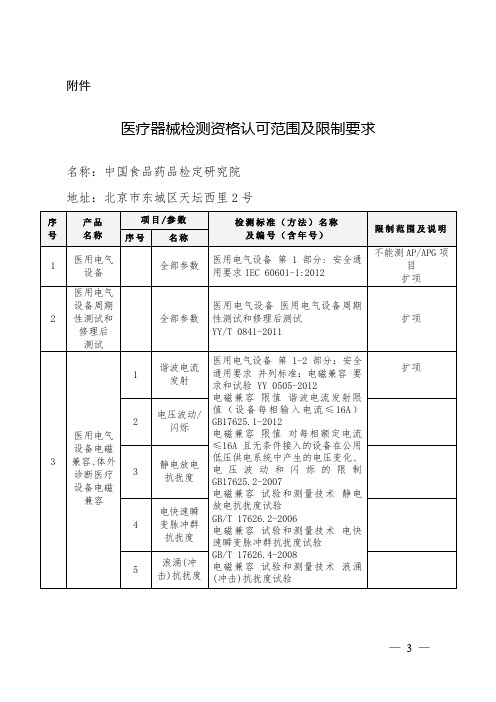
扩项
32
医用超声诊断设备
1
全部参数
超声声场特性确定医用诊断超声场热和机械指数的试验方法
YY/T 0642-2013
扩项
2
全部参数
B型超声诊断设备性能试验方法配接腔内探头YY/T 0906-2013
扩项
33
眼科仪器
全部参数
Ophthalmic instruments-Fundamental requirements and test methods-Part 2:Light hazard protection
扩项
74
脑电生物反馈仪
全部参数
脑电生物反馈仪YY 0903-2013
扩项
75
气腹机
全部参数
医用电气设备内窥镜功能供给装置气腹机YY 0843-2011
扩项
76
眼科高频超声诊
断仪
全部参数
眼科高频超声诊断仪YY 0849-2011
扩项
77
心脏射频消融治疗设备
全部参数
心脏射频消融治疗设备
YY 0860-2011
2
全部参数
超声洁牙设备输出特性的测量和公布YY/T 0751-2009
扩项
55
牙科手机
1
全部参数
牙科手机牙科低压电动马达
YY 0836-2011
扩项
2
全部参数
牙科手机牙科气动马达
YY 0837-2011
扩项
56
牙科综合治疗台
全部参数
牙科学病人椅YY 0949-2012
扩项
57
医用微波设备附件
全部参数
北京市医疗器械质量监督检验中心承检范围

YY 0831.1—2011γ射束立体定向放射治疗系统第1部分:头部多源γ射束立体定向放射治疗系统
扩项
19
头部X射线放射治疗立体定向及计划系统
全部项目
YY 0832。1—2011 X射线放射治疗立体定向及计划系统第1部分:头部X射线放射治疗立体定向及计划系统
扩项
20
气腹机
全部项目
YY 0843—2011医用内窥镜内窥镜功能供给装置气腹机
扩项
全部项目
ISO 14243—3—2004外科植入物—全膝关节假体的磨损—第3部分:位移控制磨损试验机的负载和位移参数及相关的试验环境
扩项
67
无菌心耳夹及输送系统
全部项目
Q/BJMZM 0015—2013无菌心耳夹及输送系统
扩项
68
骨内牙种植体
全部项目
YY/T 0521—2009牙科学骨内牙种植体动态疲劳试验
扩项
15
呼吸面罩及应用附件
全部项目
YY 0671。2—2011睡眠呼吸暂停治疗第2部分:面罩和应用附件
扩项
16
腹腔镜用剪
全部项目
YY 0672。2—2011内镜器械第2部分:腹腔镜用剪
扩项
17
转运培养箱
全部项目
YY 0827-2011医用电气设备第2部分:转运培养箱安全专用要求
扩项
18
头部多源γ射束立体定向放射治疗系统
扩项
全部项目
ISO 25539-2—2008心血管植入物—血管内器械—第2部分:血管支架
扩项
56
超高分子量聚乙烯
全部项目
YY/T 0815-2010差示扫描量热法测定超高分子量聚乙烯熔化焓、结晶度和熔点
医疗器械检测资格认可范围及限制要求
医用有机硅材料生物学评价试验方法GB/T16175-2008
2
医疗器械及医用材料
31
急性全身毒性
医用输液输血、注射器具检验方法 第2部分:生物学试验法GB/T14233.2-2005
医疗器械生物学评价 第11部分:全身毒性试验GB/T16886.11-1997
35
细菌内毒素试验
医用输液输血、注射器具检验方法 第2部分:生物学试验法GB/T14233.2-2005
医疗器械生物学评价 第11部分:全身毒性试验GB/T16886.11-1997
《中国药典》2010年版
36
无菌试验
医用输液、输血、注射器具检验方法 第二部分:生物试验法GB/T14233.2-2005
医用输液输血、注射器具检验方法 第2部分:生物学试验法B/T14233.2-2005
口腔材料生物学评价 第2单元:口腔材料生物试验方法 皮下植入试验YY/T 0127.8-2001
23
皮内反应试验
医用输液输血、注射器具检验方法 第2部分:生物学试验法GB/T14233.2-2005
医疗器械生物学评价 第10部分:刺激与迟发型超敏反应试验GB/T16886.10-2005
口腔医疗器械生物学评价第2单位:试验方法急性全身毒性试验:静脉途径 YY/T 0127.2-2009
口腔材料生物实验方法 短期全身毒性试验:经口途径 YY/T 0244-1996
医用有机硅材料生物学评价试验方法GB/T16175-2008
32
亚急性全身毒性
医疗器械生物学评价 第11部分:全身毒性试验 GB/T16886.11-1997
《北京市医疗器械经营企业检查验收标准》

《北京市医疗器械经营企业检查验收标准》总则:一、根据《医疗器械监督管理条例》和《医疗器械经营企业许可证管理办法》制定本标准。
二、北京市行政区域内《医疗器械经营企业许可证》的核发、换证、变更和监督管理工作适用于本标准。
三、本标准根据《医疗器械分类目录》(国药监械[2002]302号),结合北京市医疗器械经营企业实际情况,将医疗器械产品划分以下类别:A类:Ⅲ-6846植入材料和人工器官、Ⅲ-6877介入器材;B类:Ⅲ-6821医用电子仪器设备、Ⅲ-6822医用光学器具、仪器及内窥镜设备、Ⅲ-6845体外循环及血液处理设备、Ⅲ-6854手术室、急救室、诊疗室设备及器具;C类:Ⅲ-6815注射穿刺器械、Ⅲ-6863口腔科材料、Ⅲ-6864医用卫生材料及敷料、Ⅲ-6865医用缝合材料及粘合剂、Ⅲ-6866医用高分子材料及制品;D类:Ⅲ-6822医用光学器具、仪器及内窥镜设备(软性、硬性角膜接触镜及护理用液);E类:Ⅱ-6846植入材料和人工器官(助听器);F类:除上述类外的其它类代号医疗器械。
四、经营医疗器械的门店及药品零售企业申请“Ⅲ-6815注射穿刺器械、Ⅲ-6866医用高分子材料及制品”经营范围的按本标准F类专用部分要求验收。
申请“Ⅲ-6822医用光学器具、仪器及内窥镜设备”经营范围的非验配类企业按B类专用部分要求验收;申请“Ⅱ-6846植入材料和人工器官”经营范围的非验配类企业按F类专用部分要求验收。
五、本标准分为通用部分和专用部分,企业应符合本标准通用部分要求和申请特定经营范围所涉及的专用部分要求。
检查验收时,现场验收结果全部符合本标准的,评定为验收合格,有不符合本标准的,评定为验收不合格。
六、经营体外诊断试剂及国家食品药品监督管理局另有规定的医疗器械产品的经营企业验收标准从其规定。
七、本标准由北京市药品监督管理局负责解释。
北京医疗器械经营企业许可证管理办法

北京医疗器械经营企业许可证管理办法医疗器械经营企业许可证管理办法1经营第二类、第三类医疗器械应当持有《医疗器械经营企业许可证》,国家食品药品监督管理局另有规定除外。
2北京市药品监督管理局负责在国家工商总局登记注册企业的《医疗器械经营企业许可证》的发证、换证、变更和监督管理工作。
3北京市药品监督管理局负责制定北京市医疗器械经营企业检查验收标准。
申请《医疗器械经营企业许可证》条件1人员条件:1)企业法定代表人、企业负责人应熟悉国家有关医疗器械监督管理的法律、法规和规章。
2)应设立与经营规模和经营范围相适应的质量管理机构或专职质量管理人员。
2经营医疗器械的门店,使用面积不小于20平方米.3应具有与经营规模、经营范围相适应的独立于生活区的经营场所和仓库. 管理制度:医疗器械经营企业应建立健全产品管理制度,包括采购制度、进货验收制度、仓库保管制度、进出库复核制度、销售和质量跟踪制度、不良事件的报告适度、不合格产品处理制度、效期产品管理制度、用户投诉制度、售后服务制度、培训制度等。
申请《医疗器械经营企业许可证》应当提交如下资料:1) 《医疗器械经营企业许可证申请表》;2)工商行政管理部门出具的《企业名称预先核准通知书》或《营业执照》原件及复印件; 3) 质量管理人员的身份证、学历或者职称证明原件和复印件及个人简历; 4) 组织机构于职能;5)注册地址、仓库地址的地理位置图、平面图、房屋产权证明原件及上述材料的复印件 6) 质量管理制度文件目录;7)储存设施。
设备目录;8) 拟经营产品目录;9) 申请材料真实行的自我保证声明,并对材料作出如有虚假承担法律责任的承诺; 10)饭申请企业申报材料时,申请人不是法定代表人或负责人本人,企业应当提交《授权委托书》;11)按申请材料顺序制作目录;12)药品、医疗器械经营企业许可证管理系统企业客户端“器械开办申请"导出盘北京市药品监督管理局及各分局应当在受理之日起30个工作日内做出是否核发的决定,认为符合要求的,在做出决定之日起10个工作日内颁发.《医疗器械经营企业许可证》项目变更分为:许可事项变更:质量管理人、注册地址、经营范围、仓库地址的变更.登记事项变更:企业名称、法定代表人、企业负责人的变更。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
全部参数
电声学测听设备第1部分:纯音听力计GB 7341.1-2010
扩项
44
助听器
1
全部参数
助听器交货时质量检验的性能测量SJ 10862-1996
扩项
2
部分参数
电声学 助听器通用规范
GB/T 14199-2010
不能测电磁兼容
扩项
3
全部参数
电声学助听器第1部分:具有感应拾音线圈输入的助听器
GB/T 25102.1-2010
扩项
17
激光辐射功率和功率不稳
定度
全部参数
激光辐射功率和功率不稳定度测试方法GB/T 13863-2011
扩项
18
激光设备
全部参数
激光光束宽度、发散角的测试方法以及横模的鉴别方法
GB/T 13739-2011
扩项
19
激光共聚焦扫描仪
全部参数
激光共聚焦扫描仪YY/T 1154-2009
扩项
20
麻醉呼吸系统
测量、控制和实验室用的电设备电磁兼容性要求第26部分:特殊要求体外诊断(IVD)医疗设备
GB/T 18268.26-2010
扩项
2
电压波动/闪烁
3
静电放电抗扰度
4
电快速瞬变脉冲群抗扰度
5
浪涌(冲击)抗扰度
6
射频场感应的传导骚扰抗扰度
7
工频磁场抗扰度
8
电压暂降,短时中断和电压变化抗扰度
4
压力灭菌器
全部参数
医用内窥镜内窥镜器械取石网篮YY 0847-2011
扩项
66
眼用剪
全部参数
眼用剪YY/T 0176-2011
扩项
67
分离钳
全部参数
医用内窥镜内窥镜器械分离钳YY/T 0944-2013
扩项
68
咬切钳
全部参数
医用内窥镜内窥镜器械咬切钳YY/T 0941-2013
扩项
69
腹腔吸
引管
全部参数
腹腔吸引管YY/T 0191-2011
扩项
4
全部参数
电声学助听器第2部分:具有自动增益控制电路的助听器
GB/T 25102.2-2010
扩项
5
全部参数
电声学助听器第0部分:电声特性的测量GB/T 25102.100-2010
扩项
45
耳声阻抗导纳的测量设备
全部参数
耳声阻抗/导纳的测量设备
GB/T 15953-1995
扩项
46
医用电子体温计
扩项
85
紫外治疗设备
全部参数
紫外治疗设备YY 0901-2013
扩项
86
接触式远红外理疗设备
部分参数
接触式远红外理疗设备
YY 0902-2013
不能测4.2
扩项
87
电热恒温培养箱
全部参数
电热恒温培养箱YY 0027-1990
扩项
88
医用额戴式照明灯
全部参数
医用照明光源医用额戴式照明灯YY/T 0932-2013
用氧
全部参数
医用及航空呼吸用氧
GB8982-2009
扩项
29
肌电及诱发反应
设备
全部参数
医用电气设备第2部分:肌
30
眼科晶状体超声摘除和玻璃体切除
设备
全部参数
眼科晶状体超声摘除和玻璃体切除设备YY 0766-2009
扩项
31
眼科B型超声诊
断仪
全部参数
2
全部参数
超声洁牙设备输出特性的测量和公布YY/T 0751-2009
扩项
55
牙科手机
1
全部参数
牙科手机牙科低压电动马达
YY 0836-2011
扩项
2
全部参数
牙科手机牙科气动马达
YY 0837-2011
扩项
56
牙科综合治疗台
全部参数
牙科学病人椅YY 0949-2012
扩项
57
医用微波设备附件
全部参数
医用微波设备附件的通用要求
YY 0899-2013
扩项
58
高频电灼治疗仪
全部参数
高频电灼治疗仪YY 0322-2009
扩项
59
浅表组织超声治疗设备
全部参数
浅表组织超声治疗设备
YY 0830-2011
扩项
60
肢体加压理疗设备
全部参数
肢体加压理疗设备YY 0833-2011
扩项
61
微波热凝设备
全部参数
微波热凝设备YY 0838-2011
医用内窥镜内窥镜功能供给装置冷光源YY 1081-2011
扩项
82
掺钬钇铝石榴石激光治疗机
全部参数
激光治疗设备掺钬钇铝石榴石激光治疗机YY 0846-2011
扩项
83
脉冲二氧化碳激光治疗机
全部参数
治疗激光设备——脉冲二氧化碳激光治疗机YY 0844-2011
扩项
84
半导体激光光动力治疗机
全部参数
激光治疗设备半导体激光光动力治疗机YY 0845-2011
全部参数
吸入式麻醉系统第1部分:麻醉呼吸系统YY 0635.1-2013
扩项
21
角膜地形图仪
全部参数
眼科仪器角膜地形图仪
YY 0787-2010
扩项
22
飞秒外科激光治
疗仪
全部参数
飞秒外科激光治疗仪
YZB/SWI 0474-2009
扩项
23
手术显
微镜
全部参数
灯和灯系统的光生物安全性
GB/T 20145-2006
扩项
74
脑电生物反馈仪
全部参数
脑电生物反馈仪YY 0903-2013
扩项
75
气腹机
全部参数
医用电气设备内窥镜功能供给装置气腹机YY 0843-2011
扩项
76
眼科高频超声诊
断仪
全部参数
眼科高频超声诊断仪YY 0849-2011
扩项
77
心脏射频消融治疗设备
全部参数
心脏射频消融治疗设备
YY 0860-2011
1
全部参数
医用电子体温计GB/T 21416-2008
扩项
2
全部参数
临床体温计——连续测量的电子体温计性能要求YY 0785-2010
扩项
47
浮标式氧气吸入器
全部参数
浮标式氧气吸入器YY 1107-2003
扩项
48
准分子激光角膜屈光治疗机
全部参数
治疗激光设备准分子激光角膜屈光治疗机YY 0599-2013
测试
全部参数
医用电气设备医用电气设备周期性测试和修理后测试
YY/T 0841-2011
扩项
3
医用电气设备电磁兼容、体外诊断医疗设备电磁兼容
1
谐波电流发射
医用电气设备第1-2部分:安全通用要求并列标准:电磁兼容要求和试验YY 0505-2012
电磁兼容限值谐波电流发射限值(设备每相输入电流≤16A)GB17625.1-2012
扩项
89
动态心电图系统
全部参数
医用电气设备第2部分:动态心电图系统安全和基本性能专用要求YY 0885-2013
设备
全部参数
耳鼻喉射频消融设备YY 0897-2013
扩项
42
眼科A型超声测
量仪
全部参数
眼科A型超声测量仪YY 0107-2013
扩项
43
听力计
1
全部参数
听力计-第二部分-语言测听设备GB/T 7341.2-1998
扩项
2
全部参数
听力计-第四部分-延伸高频测听的设备GB/T 7341.4-1998
扩项
ISO 15004-2:2007
扩项
34
医用蒸汽发生器
全部参数
医用蒸汽发生器YY 0791-2010
扩项
35
糖化血红蛋白分
析仪
全部参数
糖化血红蛋白分析仪
YY/T 1246-2013
扩项
36
红细胞沉降率测
定仪
全部参数
红细胞沉降率测定仪
YY/T 1251-2013
扩项
37
金属制件的镀层
分类
全部参数
金属制件的镀层分类技术条件YY 0076-1992
附件
医疗器械检测资格认可范围及限制要求
名称:中国食品药品检定研究院
地址:北京市东城区天坛西里2号
序号
产品
名称
项目/参数
检测标准(方法)名称
及编号(含年号)
限制范围及说明
序号
名称
1
医用电气设备
全部参数
医用电气设备第1部分:安全通用要求IEC 60601-1:2012
不能测AP/APG项目
扩项
2
医用电气设备周期性测试和修理后
GB/T 17626.5-2008
电磁兼容试验和测量技术射频场感应的传导骚扰抗扰度
GB/T 17626.6-2008
电磁兼容试验和测量技术电压暂降、短时中断和电压变化的抗扰度试验GB/T 17626.11-2008
电磁兼容试验和测量技术工频磁场抗扰度试验
GB/T 17626.8-2006
测量、控制和实验室用的电设备电磁兼容性要求第1部分:通用要求GB/T 18268.1-2010
扩项
62
微波热疗设备
全部参数
微波热疗设备YY 0839-2011
