物料衡算与热量衡算培训课件
物料衡算和热量衡算

3 物料衡算依据原理:输入的物料量=输出的物料量+损失的物料量3.1 衡算基准年生产能力:2000吨/年年开工时间:7200小时产品含量:99%3.2 物料衡算反应过程涉及一个氧化反应过程,每批生产的产品相同,虽然有原料对叔丁基甲苯和溶剂甲苯的循环,第一批以后循环的物料再次进入反应,但每批加料相同。
在此基础上,只要计算第一个批次的投料量,以后加料一样。
反应釜内加热时间2h、正常的反应时间18h、冷却时间1h。
加上进料和出料各半个小时,这个生产周期一共2+18+1+1=22h。
所以在正常的生产后,每22小时可以生产出一批产品。
每年按300天生产来计算,共开工7200小时,可以生产327个批次。
要求每年生产2000吨对叔丁基苯甲酸,则每批生产2000÷327=6.116吨。
产品纯度99 %( wt %)实际过程中为了达到高转化率和高反应速率,需要加入过量对叔丁基甲苯做溶剂,反应剩余的原料经分离后循环使用。
3.2.1 各段物料(1) 原料对叔丁基甲苯的投料量设投料中纯的对叔丁基甲苯为X kg,则由C11H16C11H14O2 M 148.24 178.23m x 6054.8得x=6054.8×148.24÷178.23=5036.0 kg折合成工业原料的对叔丁基甲苯质量为5036.0÷0.99=5086.9kg实际在第一批生产过程加入的对叔丁基甲苯为6950.3kg(2)氧气的通入量生产过程中连续通入氧气,维持釜内压力为表压0.01MPa,进行氧化反应。
实际生产过程中,现场采集数据结果表明,通入的氧气量为1556.8 kg,设反应消耗的氧气量为x kg3/2O2C11H14O2 M 31.99 178.23m x 6054.8 得x= 3/2×6054.8×31.99÷178.23=1630.1kg此时采用的空气分离氧气纯度可达99%,因此折合成通入的氧气为1630.1÷0.99=1646.6 kg即在反应过程中,需再连续通入1646.6kg氧气。
3 物料衡算和热量衡算

2.1 物料衡算 四、物料衡算的程序
(1)确定衡算的对象、体系与环境,并画出计算对象
的草图。对于整个生产流程,要画出物料流程示意图
(或流程框图)。绘制物料流程图时,要着重考虑物 料的种类和走向,输入和输出要明确;
(2)确定计算任务,明确哪些是已知项,哪些是待求
项,选择适当的数学公式,力求计算方法简便; (3)确定过程所涉及的组分; (4)对物流流股进行编号,并标注物流变量;
2.2 热量衡算 三、热量衡算基准
关于计算基准:包括基准量(物料基准)、基准温度、基
准相态 基准量:和物料衡算的基准相同 基准温度:原则上可以任意选定,在计算过程中只要采用 统一基准即可,但一般热量衡算常用焓衡算,此时常用
0℃为温度基准
相态基准:只有在物料的组成中含有水而出现汽化或水蒸 气凝结时才需要规定。通常选择液态为基准。
2.1 物料衡算
物料衡算方程:质量守恒定律
F F D D F
I O P R
A
式中:
FI——输入系统的物料量;
Fo——从系统输出的物料量;
Dp—系统内生成的物料量; DR—系统内消耗的物料量; FA——系统内积累的物料量;
2.1 物料衡算
对于连续过程(稳定操作过程),系统内不积累物料,
2.1 物料衡算
(5)收集数据资料 (6)列出物料衡算方程
(7)列出过程的全部独立物料平衡方程式及其他相关
约束式 (8)选择计算基准 (9)统计变量个数与方程个数,确定设计变量的个数 及全部设计变量 (10)整理计算结果 (11)绘制物料流程图
2.1 物料衡算
数据资料收集包括:
2.3 常用化工计算软件
物料衡算和热量衡算

化学反应过程中,物质的量和组分的质量都发生变化,只有 各物料流的质量m守恒(衡算联系物的质量和摩尔数仍守 恒)。
反应过程的物料衡算式
m入 m出
m反 m产
水 %(质量)其它 水 乙苯 (0.0217) 苯乙烯 (0.04) 焦油 (60) ∑
热量衡算是利用能量守恒的原理,通过计算传入和 传出的热量以确定:加热(或冷却)剂用量、设备需要 传递的热量多少等,为工程设计、设备设计提供设 计依据,以保证热量利用方案的合理性,提高热量 的综合利用效果。热量衡算是能量计算的一种,全 面的能量计算应包化算括工。热生产能中、的动能能量和衡电算主能要等是。热量衡
(1) 计算范围 全装置。见图16-5。
(2) 主副反应 反应式见计算过程。甲醇发生五个反应的分 配率为主氧化51.2%,脱氢39.2%,加氢0.6%,深度氧化 0.8%,完全氧化8.2%。
(3) 计算任务 甲醇消耗量,干尾气摩尔组成。
(4) 基准 年工作时为7200 h。以1 h为基准。 8000×1000 kg÷7200 h = 1111.11 kg/h
旁路分流和混合并流都是物理过程。由于没有化学变化,因此可以对总物料及 其中某组分进行衡算。如图16-1所示。
结点A V0=V1+V2 结点B Vl+V3=V4
V2
V3
不合格产品
V0
V1
A
V4 合格产品 B
图 16.1.1 以结点做衡算的示意图
【例16.1.2】 某工厂用烃类气体制合成气生产甲醇。 合化符除H气2成 后 合 装 ,89气的要置以.75体气求,便%量 体 。置 达,为 摩 将换 到气尔 部2脱 工体32组 分艺C1体O成转要m积2后3为化求/减,:气。h小,气送C求2O摩体%去转4尔摩。C化3.O比尔1用气2变为组%此、换C成,变变O反为H换换:H应2:气气52器=4调C各.12和:O%2节为.C48,转。多O.7不62化转少脱%?,
《化工设计》 第三章物料衡算和热量衡算

对于没有化学反应的过程,一般上列写各组分的衡算方程, 只有涉及化学反应量,才列写出各元素的衡算方程。
• 稳态过程(连续),体系内无物料积累。
F
x f1
P
xp1
W
xw1
F
x f2
P xp2
W
xw2
7.将物料衡算结果列成输入-输出物料表(物料平 衡表),画出物料平衡图。
物料衡算表
组分
输入
质量,kg/d
组分
输出
质量,kg/d
杂质 合计
杂质 合计
8.校核计算结果(结论)。
五、无化学反应的物料衡算
• 在系统中,物料没有发生化学反应的过程, 称为无反应过程。
(三)、物料衡算基准 物料衡算过程,必须选择计算基准,并在整个运算
中保持一致。若基准选的好,可使计算变得简单。
①时间基准 (单位时间可取1d、1h或1s等等)。 ②批量基准; ③质量基准 例如: 可取某一基准物流的质量为100Kg
为基准计算。 ④物质的量基准; ⑤标准体积基准;
(四)、物料衡算的基本程序
100.00
解:
水F1 1200kg/h
吸 收 塔
混合气体F2,1.5 (mol)%丙酮
空气F3
蒸 馏 塔
冷凝器
废料F5:丙酮5%,
95% 水
产品F4 丙酮99%,水1%
本系统包括三个单元.即吸收塔、蒸馏塔和冷凝器。由于 除空气进料外的其余组成均是以质量百分数表示的,所以 将空气-丙酮混合气进料的摩尔百分数换算为质量百分数。 基准:100kmol气体进进料。
第3章 物料衡算和热量衡算-1 反应器设计基础

北京理工大学BEIJING INSTITUTE O F TECHNOLOGY第3章物料衡算、能量衡算及反应器工艺计算授课教师:赵芸化工与环境学院•反应器设计基础•物料衡算•热量衡算•反应器工艺计算典型化工过程反应器设计基础•化学反应的特点及其对反应器的要求•反应器的分类及特点•反应器设计的相关概念•反应器放大方法•化学反应复杂:平行反应,连串反应,可逆反应及链反应•反应物料的相态多样化:气、液、固非均相系统•许多反应过程热效应大•工艺条件变化范围宽:多步反应T\P高低•反应介质的腐蚀性强一、化学反应的特点及其对反应器的要求停留时间传质传热耐热耐压耐腐蚀二、反应器分类及特点•根据反应器的结构形式•根据反应器的传热方式•根据反应器内物料相态•根据反应器的操作方式(一)反应器的结构形式•釜式反应器•管式反应器•固定床反应器•滴流床反应器•塔式反应器•流化床反应器•喷射式反应器•泵式反应器•膜反应器(燃料电池)•等等1、釜式反应器液体介质内进行的各种反应结晶型产物或需静止分层的产物加压下的反应带固体沉淀物的反应需要不断粉碎结块固体的场合2、管式反应器气相或均液相反应非均液相反应气液相反应,带悬浮固体的液固或气液固反应粘稠物料与半固态物料的反应高压低密度聚乙烯:1000~2000 atm,10万吨/年3、固定床反应器●催化剂为固体;●催化剂固定在反应器床层内;●温度分布不均;●不易于更换催化剂气固、液固、气液固相催化反应反应热较大的快速气固相催化反应天然气制气4、滴流床反应器•+高空速•+ 小返混•+无催化剂夹带•-高床层压降•-长混合时间•-流动分布差•-仅能并流操作5、塔式反应器气液相反应气液固三相反应气体的化学吸收气液相逆流操作的反应,要求伴随蒸馏的化学反应非均相反应及要求伴随萃取的反应6、流化床反应器•气固流化床反应器•气液固三相流化床反应器–鼓泡式气液固三相反应器–循环式气液固三相流化床反应器气固流化床反应器•催化剂为固体颗粒;•催化剂在气体作用下进行流化;•温度均一;•易于更换催化剂高低并列的提升管FCC 装置鼓泡式气液固三相反应器•可实现恒温操作•易于取热•有效利用反应热•可随时卸、补催化剂•气体强化气液传质•通气量大循环式气液固三相反应器•可实现恒温操作•易于取热•有效利用反应热•可随时卸、补催化剂•气体强化气液传质•通气量小2011/9/23217、喷射反应器气液、液液相快速反应8、泵式反应器液相、气液相快速反应(二)反应器的传热方式•间壁传热式•绝热式•自热式T0CLLL•直接传热式(冷激式)•蒸发传热式•外循环传热式L T℃t (hr) T℃(三)反应器内物料相态•均相反应器–气相反应器–均液相反应器•非均相反应器–气液两相反应器–液液两相反应器–气固两相反应器–气液固三相反应器(四)反应器的操作方式•分批(或间歇式)操作–参与反应的物料一次投入,反应完毕后产物一次卸出•连续式操作–反应物料连续通过反应器的操作方式•半分批(或半连续)操作–一部分物料一次投入反应器内,另一部分物料则连续地加入或排出反应器,反应完毕后放料搅拌釜式反应器串联釜式反应器管式,塔式反应器搅拌釜式反应器•沸腾温度下进行的强放热反应•严控A 浓度•B 浓度高,A 、C 浓度低对反应有利的场合•可逆反应•严控A 浓度•低温进行的放热反应•A 浓度低,B 浓度高对反应有利的场合•控制产物C (如沉淀反应)•A 、B 浓度低对反应有利的场合•控制产物C (如沉淀反应)•可逆反应BA CB CACA BA BC三、反应器设计相关概念•反应相关基本概念•反应器内物料流动模型(一)反应相关基本概念•转化率•产率•选择性•时间•返混转化率2011/9/2331•转化率:反应所消耗掉的物料量与投入反应器的物料量之比x A =反应消耗A 组分的量投入反应器A 组分的量针对主要原料产率•产率:收率,主产物的实际得量与按投入原料计算的理论产量之比反应后主产物实际得量投入反应器原料计算的理论产量η=反应后主产物实际得量折成原料量投入反应器的原料量η=或针对主产物•阶段收率:某阶段产品的实际得量与理论得量的比例百分率。
第七章化工工艺计算-PPT

统 O2 0.109Wmol
N2 0.803Wmol
CO2 0.0555Wmol
产物(P) C2H4O 0.83mol
H2O Zmol
采用元素得原子守恒计算,即 C 平衡 2X=(0、83×2)+(0、0325W×2+0、0555W) H 平衡 4X=(0、83×4+2Z)+0、0325W×4
例1: 在银催化剂作用下,乙烯被空气氧化成环氧乙烷(C2H4O),副反应就是乙烯 完全氧化生成CO2与H2O。已知离开氧化反应器得气体干基组成就是:C2H43、 22%,N2 79、64% ,O2 10、81% , C2H4O 0、83% , CO2 5、5%(均为体积分数)。 该气体进入水吸收塔,其中得环氧乙烷与水蒸气全部溶解于水中,而其她气体不 溶于水,由吸收塔顶逸出后排放少量至系统外,其余全部循环回氧化反应器。
设新鲜原料气(FF)中C2H4得量为Xmol;空气为Ymol(含79%N2与21%O2); 弛放气Wmol;乙烯完全氧化生成得H2O量为Zmol。
RC
FF
MF
反应器
RP
水吸收塔 SP
W
A
B
P
围绕总系统做物料衡算。
C2H4
新鲜原料气 O2
(FF)
N2
Xmol 0.21Ymol 0.79Ymol
弛放气(W) 系
第七章化工工艺计算
§7、1 概述
化工生产过程:主副产品量、原材料消耗、能量消耗、三废指标
化工工艺计算 物料衡算、热量衡算 进行化工设计、过程经济评价、节能分析与过程优化得基础
1、物料衡算与热量衡算得主要步骤
(1)收集计算数据:化工装置得生产操作数据,如输入与输出物料得 流量、温度、压力、浓度等,涉及物质物化常数,如密度、热容等。 (2)写出相关反应方程式(包括主副反应)并配平,标明相对分子量。 (3)绘出流程得方框图,标明相关参数。
化工工艺物料衡算和能量衡算

PPT文档演模板
2024/2/9
化工工艺物料衡算和能量衡算
第一节连续过程的物料衡算
w 教学内容: w 结合具体实例,理解利用化学反应速率进行反
应过程的物料衡算的方法。 w 重点和难点: w 重点掌握利用化学反应速率进行反应过程的物
料衡算的方法。 w 难点是衡算基准的选择,包括基准物流的名称
•
第 三 章
物 料 衡 算 与 能 量 衡 算
PPT文档演模板
•输入:
•O2(需要)= 0.5mol;
• O2(输入)= 1.5×0.5 = 0.75mol;
• N2(输入)= N2(输出)= 0.75×(79/21)
•
= 2.82mol;
• 反应的CH3OH =0.75×1 = 0.75mol
•输出: • HCHO(输出)= 0.75mol; • CH3OH(输出)= 1- 0.75 = 0.25mol; • O2(输出)= 0.75- 0.75×0.5=0.375mol; • H2O(输出)= 0.75mol
• •
F2 x2B x2C
单 元 Ⅰ单
元 Ⅱ
F3 x3B=0.025 x3C=0.35 x3D
F4 x4B=0.08 x4C=0.72
F5 x5C x5D
化工工艺物料衡算和能量衡算
•每一个单元列出一组平衡方程式,再列出整个系统 的平衡方程式。
•
第 三 章
物 料 衡 算 与 能 量 衡 算
PPT文档演模板
•(3)孤立体系 •= 0
化工工艺物料衡算和能量衡算
•三、能量衡算的一般方法 • ⑴ 正确绘制系统示意图,标明已知条件和物料状态; • ⑵ 确定各组分的热力学数据; • ⑶ 选择计算基准(大部分在物料衡算的基础上进行); • 同时,还要选取热力学函数的基准态。 • ⑷ 列出能量衡算方程式,进行求解。
第3章 物料衡算和能量衡算
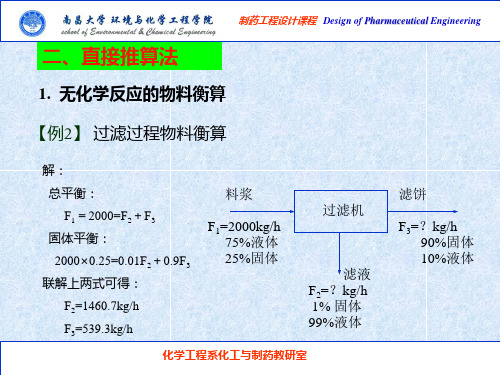
化学工程系化工与制药教研室
制药工程设计课程 Design of Pharmaceutical Engineering
未反应的乙苯量(980-435.11)kg/h=544.89 kg/h,即为5.140kmol/h
化学工程系化工与制药教研室
制药工程设计课程 Design of Pharmaceutical Engineering
进反应器纯乙苯量1000kg/h×98%=980kg/h,即为
9.245kmol/h
原料中甲苯量1000 kg/h×2%=20kg/h,即为0.217kmol/h
水蒸气量980 kg/h×1.5=1470kg/h,即为81.667kmol/h
制药工程设计课程 Design of Pharmaceutical Engineering
表3-1 各物料的摩尔质量
物料
摩尔质量/(g/mol)
C6H5C2H5
106
C6H5C2H3
104
C6H6
78
C6H5CH3
92
H2O
18
CH4
16
C2H4
28
C
12
H2
2
基准:选1000kg/h乙苯原料为计算基准
【例7】 试计算合成甲醇过程中反应混合物的平衡组成。设原料气中H2
由苯乙烯选择性,生成苯乙烯量4.109 kmol/h×90%=3.698 kmol/h, 即为384.60kg/h 由各物质的选择性,有 输出的甲苯量4.109 kmol/h×5%+0.217 kmol/h =0.423 kmol/h,即为38.92kg/h 生成的苯量4.109 kmol/h×3% =0.123 kmol/h,即为9.60kg/h 生成的乙烯量4.109 kmol/h×3% =0.123 kmol/h,即为3.44kg/h 生成的碳量4.109 kmol/h×2%×7 =0.575 kmol/h,即为6.9kg/h 生成的甲烷量4.109 kmol/h×(5%+2%) =0.288 kmol/h,即为4.61kg/h 输出的氢量4.109 kmol/h×(90%-5%+2%×3) =3.739 kmol/h,即为7.48kg/h 输出水量=输入水量(不参与反应)1470kg/h,即为81.667kmol/h 实际每小时要求苯乙烯的产量10000×1000kg/8000h=1250kg/h 比例系数1250/384.60=3.25
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
结果分析
F1=138 kg/h H2SO4 Z1,1=0.40
1
H2O Z1,2=0.60
F2=862 kg/h
2
H2SO4 Z2,1=0.98
H2O Z2,2=0.02
混 合
3 F3=1000 kg/h
H2SO4 Z3,1=0.90
器
H2O Z3,2=0.10
图5.3 硫酸简单混合系统计算结果
几个组分就有几个独立方程; 几个组分就有几个独立变量; 几个组分流股方程中就有几项。
(i-C4),20%异戊烷(i-C5)和40%正戊烷(n-C5)的混合物
引入精馏塔分离,塔顶馏分为含50%C3,44%i-C4,
5%i-C5和 1%n-C5的混合物,塔底引出流股中仅含1%
的C3。完成物料衡算。
物料衡算的作用与意义
➢ 物料衡算还可以检验生产过程的完善程度,对生产 工艺设计工作也有着重要指导作用。物料衡算是计 算原料与产品之间的定量关系,由此定出原料和辅 助材料的用量、制订原料和辅助材料的单耗指标以 及生产过程中各个阶段的原料和辅助材料的损耗量 及其组成。
➢ 物料衡算也是能量衡算、定型设备选型、非定型设 备工艺计算和其他工艺计算的基础。通过物料衡算 可以算出各工段所处理的物料量(各组分的成分、重 量和体积),便可以定出生产过程所需设备台数、容 量和主要尺寸以及计算管道尺寸等。所以物料衡算 是复合材料工艺计算的重要部分。
F1=? H2SO4 Z1,1=0.40
1Hale Waihona Puke H2O Z1,2=0.60
F2=?
2
H2SO4 Z2,1=0.98
H2O Z2,2=0.02
混 合
3 F3=1000 kg/h
H2SO4 Z3,1=0.90
器
H2O Z3,2=0.10
图5.3 硫酸简单混合系统示意图
计算结果
解: 水: 0.6F1+0.02F2=0.1F3=100 总: F1+F2=F3=1000
物料衡算的类型
物料衡算可分操作型计算和设计型计算。 操作型计算是指对已建立的工厂、车间或单元 操作及设备等进行计算。 设计型计算是指对建立一个新的工厂、车间或 单元操作及设备进行物料衡算,这是设计计算 的第一步,也是整个设计的基础,在此基础上 进行热量衡算、设备工艺计算,则可以确定设 备选型、工艺尺寸、台数以及公用工程所需水、 电、汽、冷冻、真空及压缩空气等需要量。
联立:F1= 138 kg/h F2= 862 kg/h
流股 40%硫酸 (1) 98%硫酸 (2) 90%硫酸 (3) 组分 kg/h 质量分率 kg/h 质量分率 kg/h 质量分率
H2SO4 55.2 0.40 844.8 0.98 900.0 0.90 H2O 82.8 0.60 17.2 0.02 100.0 0.10 合计 138.0 1.00 862. 1.00 1000 1.00
物料衡算与热量衡算培训课件
路漫漫其悠远
少壮不努力,老大徒悲伤
4 物料衡算与热量衡算
物料衡算的作用与意义
依据质量守衡定律,以设备或生产过程作 为研究对象,对其进、出口处进行定量计算, 称之为物料衡算。
在复合材料生产过程中,物料衡算对于控 制生产过程有着重要的指导意义。在实际生产 过程中,物料衡算可以揭示物料的浪费和生产 过程的反常现象,从而帮助找出改进措施,提 高成品率及减少副产品、杂质和三废排放量。
式中:Fi—第i个股的总流率,kg/h (kmol/h); Fi,j—第i个股中j 组分的流率,kg/h (kmol/h); Zi,j—第i个股中j 组分的组成; NI —进入流股数; NT — 物质流股总数;NC — 总组分数目;
Vj —反应物中第j 组分的化学计量系数,反应物为负,生成物为正。
4.1.2 混合器和分离器的物料衡算
b.简单分离
NT
F1 Fi i2
NT
F1Z1,j FiZi,j i2 F1=F2+F3;
1
分
2
离 器
3
图5.4 简单分离系统示意图
( j =1,2, ……, NC )
F 1Z1,j F iZi,j (i2,3,,N)T (j1,2,,N)C
b.简单分离例题-自由度分析
例5.2 将一个含有20%(摩尔分率)丙烷(C3), 20%异丁烷
NI
Fi
NT
Fi
图5.1 简单衡算系统示意图 Fiei Fmem
i1
iNI1
NI
NT
(2) 组分的物料衡算: FiZi,j FiZi,j
FiZi,j FmZm,j
(j=1,2, ……,NC)
i1
iNI1
(3) 组成的约束条件:NCZi,j 1; Zi,jej 1 (i=1,2, ……,NT) j1
∑F损--总的损失量; ∑F积--系统中积累量。 分批操作(间歇操作)的设备,当终点时,物料全部 排出则系统内物料积累为零,对于稳定连续操作,系统 物料累积量亦为零。在此情况下,上式可写成:
∑F进=∑F出+∑F损
4.1 简单的物料衡算
4.1 简单的物料衡算
质量守恒定律: 物料衡算的基本准则是质量守恒定律。 以稳态为例:
a. 简单混合
1
混合器
NT
2
NT-1
NT1
图3.2 简单混合系统示意图
FNT Fi Fiei
i1
NT 1
(FiZi,j)iNT (FiZi,j) (j=1,2, ……, NC)
i1
FNZ TN,T j FiZi,j
i=1,2, ……, NT-1 j=1,2, ……, NC
简单混合例题
例5.1 将含有40%(质量百分率)硫酸的废液与98%浓硫 酸混合生产90%的硫酸,产量为1000kg/h。各溶液的 第二组分为水,试完成其物料衡算。
物料衡算常用基本概念和方法
质量守恒定律 质量守恒定律是指“进入一个系统的全部物料量必等 于离开这个系统的全部物料量,再加上过程中损失量和 在系统中积累量”。依据质量守恒定律,对一研究系统 作物料衡算,可用下式表示:
∑F进=∑F出+∑F损+∑F积 式中 ∑F进--输入物料总和; ∑F出--离开物料量总和;
物质总流量守恒 原子总数量守恒 摩尔流率守恒 (无化学反应)
4.1 简单的物料衡算
① 分析问题; ② 画流程图; ③ 确定系统,分析自由度; ④ 选定计算基准; ⑤ 列出衡算模型,并求解。
美国黄石公园
4.1.1 简单的衡算模型
1
NI +1
2
NI +2
(张量基本知识)
NI
NT
(1)
总体物料衡算:
