2020人教版高三化学选修3课件【全册】
合集下载
2020人教版高三化学选修3电子课本课件【全册】

2020人教版高三化学选修3电子课 本课件【全册】
பைடு நூலகம்
归纳与整理 复习题
2020人教版高三化学选修3电子课 本课件【全册】
2020人教版高三化学选修3电子 课本课件【全册】目录
0002页 0236页 0238页 0347页 0428页 0564页 0652页
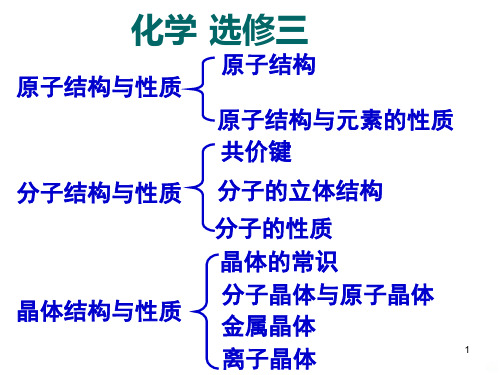
第一章 原子结构与性质 第一节 原子结构 归纳与整理 复习题 第二节 分子的立体结构 归纳与整理 复习题 第二节 分子晶体与原子晶体 第四节 离子晶体 开放性作业——元素周期表
第一章 原子结构与性质 第一 节 原子结构
2020人教版高三化学选修3电子课 本课件【全册】
第二节 原子结构与元素的性质
பைடு நூலகம்
归纳与整理 复习题
2020人教版高三化学选修3电子课 本课件【全册】
2020人教版高三化学选修3电子 课本课件【全册】目录
0002页 0236页 0238页 0347页 0428页 0564页 0652页
第一章 原子结构与性质 第一节 原子结构 归纳与整理 复习题 第二节 分子的立体结构 归纳与整理 复习题 第二节 分子晶体与原子晶体 第四节 离子晶体 开放性作业——元素周期表
第一章 原子结构与性质 第一 节 原子结构
2020人教版高三化学选修3电子课 本课件【全册】
第二节 原子结构与元素的性质
高中化学选修三全套共张PPT课件
①电子云
处于一定空间运动状态的电子在原子核外空间
的概率密度分布的形象化描述
小黑点:概率密度
单位体积内出现的概率
小黑点越密概率密度越大
小黑点不是电子!
23
②电子云轮廓图
电子出现的概率约为90%的空间
即精简版电子云
③电子云轮廓图特点
a.形状
ns能级的电子云轮廓图:球形
np能级的电子云轮廓图:双纺锤形
nd能级的电子云轮廓图:多纺锤形
能级符号:ns、np、nd、nf…… n代表能层
最多容纳电子的数量 s:2 p:6 d:10 f:14
能层: 一
K
二
L
三
M
四……
N ……
能级: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f
14
3、注意问题
①能层与能级的关系
每一能层的能级从s开始,s,p,d,f……
能层中能级的数量不超过能层的序数
2、电离能
①第一电离能
气态电中性基态原子失去一个电子转
化为气态基态正离子所需最低能量
同周期主族元素第一电离能从左至右逐渐升高
ⅡA、ⅤA反常!比下一主族的高
②逐级电离能
利用逐级电离能判断化合价
43
3、电负性(第三课时)
键合电子:参与化学键形成
原子的价电子
孤对电子:未参与化学键形成
①电负性
不同元素的原子对键合电子吸引能力
②特点
头碰头
重叠程度大,稳定性高
轴对称
可绕键轴旋转
H
Cl
s-p σ键
H
H
56
5、π键
定义:两个原子轨道以平行
即“肩并肩”方式重叠
处于一定空间运动状态的电子在原子核外空间
的概率密度分布的形象化描述
小黑点:概率密度
单位体积内出现的概率
小黑点越密概率密度越大
小黑点不是电子!
23
②电子云轮廓图
电子出现的概率约为90%的空间
即精简版电子云
③电子云轮廓图特点
a.形状
ns能级的电子云轮廓图:球形
np能级的电子云轮廓图:双纺锤形
nd能级的电子云轮廓图:多纺锤形
能级符号:ns、np、nd、nf…… n代表能层
最多容纳电子的数量 s:2 p:6 d:10 f:14
能层: 一
K
二
L
三
M
四……
N ……
能级: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f
14
3、注意问题
①能层与能级的关系
每一能层的能级从s开始,s,p,d,f……
能层中能级的数量不超过能层的序数
2、电离能
①第一电离能
气态电中性基态原子失去一个电子转
化为气态基态正离子所需最低能量
同周期主族元素第一电离能从左至右逐渐升高
ⅡA、ⅤA反常!比下一主族的高
②逐级电离能
利用逐级电离能判断化合价
43
3、电负性(第三课时)
键合电子:参与化学键形成
原子的价电子
孤对电子:未参与化学键形成
①电负性
不同元素的原子对键合电子吸引能力
②特点
头碰头
重叠程度大,稳定性高
轴对称
可绕键轴旋转
H
Cl
s-p σ键
H
H
56
5、π键
定义:两个原子轨道以平行
即“肩并肩”方式重叠
高中化学选修三全套184页PPT

拉
60、生活的道路一旦选定,就要勇敢地 走到底 ,决不 回头。 ——左
56、书不仅是生活,而且是现在、过 去和未 来文化 生活的 源泉。 ——库 法耶夫 57、生命不可能有两次,但许多人连一 次也不 善于度 过。— —吕凯 特 58、问渠哪得清如许,为有源头活水来 。—— 朱熹 59、我的努力求学没有得到别的好处, 只不过 是愈来 愈发觉 自己的 无知。 ——笛 卡儿
高中化学选修三全套
26、机遇对于有准备的头脑有特别的 亲和力 。 27、自信是人格的核心。
28、目标的坚定是性格中最必要的力 泉源 之一, 也是成 功的利 器之一 。没有 它,天 才也会 在矛盾 无定的 迷径中 ,徒劳 无功。- -查士 德斐尔 爵士。 29、困难就是机遇。--温斯顿.丘吉 尔。 30、我奋斗,所以我快乐。--格林斯 潘。
60、生活的道路一旦选定,就要勇敢地 走到底 ,决不 回头。 ——左
56、书不仅是生活,而且是现在、过 去和未 来文化 生活的 源泉。 ——库 法耶夫 57、生命不可能有两次,但许多人连一 次也不 善于度 过。— —吕凯 特 58、问渠哪得清如许,为有源头活水来 。—— 朱熹 59、我的努力求学没有得到别的好处, 只不过 是愈来 愈发觉 自己的 无知。 ——笛 卡儿
高中化学选修三全套
26、机遇对于有准备的头脑有特别的 亲和力 。 27、自信是人格的核心。
28、目标的坚定是性格中最必要的力 泉源 之一, 也是成 功的利 器之一 。没有 它,天 才也会 在矛盾 无定的 迷径中 ,徒劳 无功。- -查士 德斐尔 爵士。 29、困难就是机遇。--温斯顿.丘吉 尔。 30、我奋斗,所以我快乐。--格林斯 潘。
人教版高中化学选修3(物质结构与性质)全套优质课件(及章节复习课件)

YOUR SITE HERE
化学4X10课件
1、通过教材18页的图1-21试分析为什么同周期主族元素中, 第IIIA族和第VIA族元素的第一电离能出现了反常现象呢?
交流合作
LOGO
2、通过教材18页的学与问试分析第一电离能的大小一定能说明 金属的活泼性强弱吗?通过逐级电离能如何判断原子的化合价?
离核 越远 能量 越高
LOGO
1 K
2 L
3 M
4 N
5 O
6 P
7 Q
2 8 18 32
… …
最多容纳2n2
YOUR SITE HERE
构造原理: 核外电子排布必须遵循一
LOGO
定的能级顺序。电子先排能
量低的内层,再排能量高的
7 6
7s
6s 5s 4s 3s 2s
7p
6p 6d 5p 5d 5f 4p 4d 4f 3p 3d 2p
YOUR SITE HERE
三、电子排布图
LOGO
实例:
Al原子的电子排布图
C原子的电子排布图
YOUR SITE HERE
以铝原子为例,电子排布图中各符号数字的意义:
LOGO
电子排布图能直观地体现原子核外电子分层、 分能级分轨道排布情况以及电子的自旋状态。
YOUR SITE HERE
四、价电子排布式
层时 不超过2个); 次外层电子数最多不超过18 个;倒数第 三层不超过32个;
LOGO
(3)核外电子总是尽先排满能量最低、离核 最近的能层,后由里往外依次排能量较高能层。 而失电子总是先失最外层电子。
注意: 以上几点是相互联系的,不能孤立地理 解,须同时满足。
YOUR SITE HERE
2020高中化学人教版选修三教学课件:1-1-1 能层与能级 构造原理与电子排布式(共49张)

④次外层电子数目不能超过 18 个(K 层为次外层时不能
超过 2 个),倒数第三层电子数目不能超过 32 个。
(说明:以上规律是互相联系的,不能孤立地理解。)
(2)能级交错现象
由构造原理可知,从第三层开始各能级不完全遵循能层顺
序,产生能级交错排列,即产生“能级交错现象”。
如 : E3d >
E4s , E5d >
课堂互动探究 K
师生互动 合作探究
知识点一 能层与能级
1.能层 多电子原子中,原子核外电子是分层排布的。请完成下表:
2.能级
(1)任一能层的能级都是从 s 能级开始,能级数目等于
该 能层序数 。N 能层有
4 个能级,能级符号依次为
4s、4p、4d、4f 4d、4f 能层最多容纳的电子数为: 10 、
(2)电子排布式:
①电子排布式是用核外电子分布的能级及各能级上的电子
数 表 示 电 子 排 布 的 式 子 。 如 Al 原 子 的 电 子 排 布 式 是
1s22s22p63s23p1,Ca 原子的电子排布式是 1s22s22p63s23p64s2。
②简化电子排布式:将电子排布式中的内层电子排布用相应 的稀有气体元素符号加方括号来表示,而得到的式子称为简化电 子排布式。如碳、镁、钙的简化电子排布式分别为[He]2s22p2、 [Ne]3s2、[Ar]4s2。
[答案] C
2.(1)写出下列原子的电子排布式和简化的电子排布式。 简化的电子
元素原子 电子排布式 排布式
N Mg S Ti (2)X 元素的+1 价阳离子的核外电子排布与氩原子相同,则 X 元素的原子核外电子排布式为________。
[解析] (1)根据原子核外电子排布遵循的规律书写原子核 外电子排布式,注意从 3d 能级开始出现能级交错现象。
高中化学选修三全 课件

副族序数=(n-1)d + ns的电子数= 价电子数
ⅢB~ⅦB
元素周期表从左到右族顺序依次为:
ⅠA,ⅡA,ⅢB,ⅣB,ⅤB,ⅥB,ⅦB第VIII族;ⅠB,ⅡB,ⅢA,ⅣA,ⅤA,ⅥA,ⅦA,零族
各周期中元素种数
周期 元素 数目 金属 元素 数目 一 2 0 二 8 2 三 8 3 四 18 14 五 18 15 六 32 30 七 32 31 八 50
键合电子:参与化学键形成
原子的价电子 孤对电子:未参与化学键形成 ①电负性 不同元素的原子对键合电子吸引能力 电负性越大,对键合电子吸引能力越大 同周期主族元素从左至右电负性逐渐变大 同主族元素从上至下电负性逐渐变小
②电负性应用 一般而言 金属<1.8,非金属>1.8 1.8左右的既有金属性,又有非金属性 对角线规则:元素周期表中的某些主族元素 其某些性质与右下角元素相似
特点:
注意: He在p区,但它无p电子
3、d区: 含ⅢB至ⅦB和Ⅷ族共六族八列 (镧系和锕系属f区); 特点: ①价层电子为(n-1)d1-9ns1-2 ②价电子总数=副族序数;
若价电子总数为8、9、10,则为Ⅷ族
4、ds区: 含ⅠB与ⅡB共两族两列; 特点:
①价层电子为(n-1)d10ns1或2
S能级的原子轨道图
*
S能级的原子轨道是球形对称的
P能级的原子轨道
z
z
z
y x
x
y
x
y
Px
Py
Pz
纺锤形
P 能 级 的 原 子 轨 道
d能级的原子轨道有5个.
d 能 级 的 原 子 轨 道
2、原子轨道
①s轨道电子云呈球形。
②p轨道px py pz电子云呈相互 垂直的纺锤形。
ⅢB~ⅦB
元素周期表从左到右族顺序依次为:
ⅠA,ⅡA,ⅢB,ⅣB,ⅤB,ⅥB,ⅦB第VIII族;ⅠB,ⅡB,ⅢA,ⅣA,ⅤA,ⅥA,ⅦA,零族
各周期中元素种数
周期 元素 数目 金属 元素 数目 一 2 0 二 8 2 三 8 3 四 18 14 五 18 15 六 32 30 七 32 31 八 50
键合电子:参与化学键形成
原子的价电子 孤对电子:未参与化学键形成 ①电负性 不同元素的原子对键合电子吸引能力 电负性越大,对键合电子吸引能力越大 同周期主族元素从左至右电负性逐渐变大 同主族元素从上至下电负性逐渐变小
②电负性应用 一般而言 金属<1.8,非金属>1.8 1.8左右的既有金属性,又有非金属性 对角线规则:元素周期表中的某些主族元素 其某些性质与右下角元素相似
特点:
注意: He在p区,但它无p电子
3、d区: 含ⅢB至ⅦB和Ⅷ族共六族八列 (镧系和锕系属f区); 特点: ①价层电子为(n-1)d1-9ns1-2 ②价电子总数=副族序数;
若价电子总数为8、9、10,则为Ⅷ族
4、ds区: 含ⅠB与ⅡB共两族两列; 特点:
①价层电子为(n-1)d10ns1或2
S能级的原子轨道图
*
S能级的原子轨道是球形对称的
P能级的原子轨道
z
z
z
y x
x
y
x
y
Px
Py
Pz
纺锤形
P 能 级 的 原 子 轨 道
d能级的原子轨道有5个.
d 能 级 的 原 子 轨 道
2、原子轨道
①s轨道电子云呈球形。
②p轨道px py pz电子云呈相互 垂直的纺锤形。
相关主题
