多组分系统
3-3-多组分体系

实际混合物中组分的化学势
理想溶液
正偏差
负偏差
实际混合物中组分的化学势
在实际混合物中,拉乌尔定律应修正为:
p B p B xB
* B
路易斯(G.N.Lewis)提出了活度的概念。
B (T ) RT ln aB
* B
活度的定义:
aB exp
B
RT
* B
惯 例
选定为温度T,压力为pθ下液体纯物质B的状态为 参考。
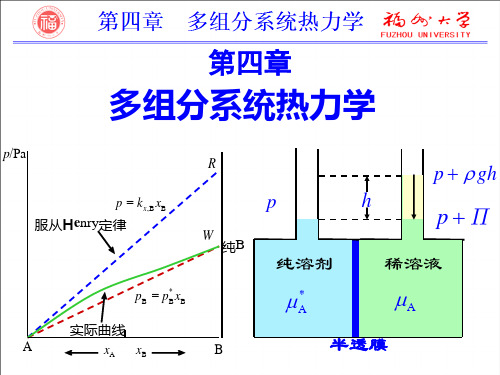
Raoult定律适用范围:
(1) 无限稀溶液中的溶剂,且其蒸气服从理想气体 状态方程,无论溶质挥发与否。 (2) 如果两种分子大小和结构越相近,则适用浓度 范围越宽。
拉乌尔(Raoult)定律
p
* B
p
* pB p B xB
p
* A
p A p* x A A
0
xB
1
亨利(Henry)定律
1803年 亨利(Henry W) 一定温度下,微溶气体B在溶剂A中 的溶解度xB与该气体在气相中的分 压pB成正比。
溶液的气液平衡
拉乌尔(Raoult)定律
1886年,拉乌尔(Raoult F M) 恒温下,稀溶液中溶剂A在气相中的蒸气分压pA等 于该纯溶剂的饱和蒸气压pA*与该溶液中溶剂的摩 尔分数xA的乘积。
pA p xA
* A
拉乌尔(Raoult)定律
p pA p x
* A
* A B
溶剂蒸气压下降的相对值决定于溶质的浓度或 数量,与其本性无关。
活度与组成:
实际混合物中组分的化学势
作业:P163的14、17、20题
预习: P150-155
I
实际混合物中组分的化学势
第四章 多组分系统1

B B B B B
B
(2)
此式与前式相减得:
n dX 0 除以 n= n → x dX 0
等TP,
B
B
B
B
B
B
B
——吉布斯-杜亥姆方程
B
例:
二组分系统, nAdX A nB dX B =0
或
xAdX A xB dX B =0
5.偏摩尔量间函数关系
H B = U B p VB
G=G(T,P,nA,nB,……nk)
G G ) P ,n dT + ( )T , n dP dG= ( T P
+
B A
k
G ( )T , P,nC dnB nB
G G 组成不变:有 ( ) P,n S, ( )T ,n V T p
dG=-SdT+VdP+
B
G 定义式:μ B= ( )T , P ,nC nB
X 引起系统容量性质 dX 的改变值 ( )T , p ,nC nB
注意:
1)必须在等 TP 下的偏微商
其它条件下不是偏摩尔量
X XB =( )T , p ,nC nB
GB
X ( )T ,V ,nC ≠ X B nB
G ( )T ,V ,nC nB
=
G ( )T , p ,nC nB
k
Z Z dp dZ= ( ) p ,nA ,nB ,n C nk dT + ( ) p T Z Z )T , p ,nA ,nC nK dnB +( ) p ,nB ,n C nk dnA + ( nB nA Z + ……+ ( )T , p ,nA ,nB , nk 1 dnk nk
物理化学:第4章_多组分系统热力学_
真实混合物:实曲线
Vm xBVB xCVC VB (VC VB)xC
当混合物组成改变时,两组 分偏摩尔体积随之改变,且二者 变化相互关联。
组成接近某纯组分,其偏摩 尔体积也接近该纯组分摩尔体积。
5. 吉布斯 − 杜亥姆方程
对广度量 X (T , p, nB, nC , nD ,) 求全微分:
dX
X T
p,nB
dT
X p
T ,nB
dp
B
X nB
dnB T , p,nC
恒温、恒压
另一方面,由加和公式
,恒温恒压下求导:
比较两式,得
或
或
吉布斯-杜亥姆方程--在一定温度压力下,当混合物
组成变化时,各组分偏摩尔量变化的相互依赖关系。
➢ 系统中各组分的偏摩尔量并非完全独立,而是相 互依存的。
➢ 例:固体溶解、过饱和溶液析出、…
组分B在α、β两相中迁移达平衡的条件:该组分
在两相中的化学势相等。
➢ 物质总是从其化学势高的相向化学势低的相迁移, 直至物质迁移达平衡时为止,此时系统中每个组分在 其所处的相中的化学势相等。
化学势 判据
② 化学平衡
<0:自发不可逆; =0:平衡、可逆
任一化学反应,假定系统已处于相平衡,
任一组分B在每个相中的化学势都相等: Bα B
B
B
整个系统中B组分物质的量的变化量: dnBα dnB
α
BdnB
B
化学平衡时
平衡条件:与化学反应达到平衡的方式无关。
§4.3 气体组分的化学势
1、纯理想气体的化学势 2、理想气体混合物中任一组分的化学势 3、纯真实气体的化学势 4、真实气体混合物中任一组分的化学势
物理化学4 多组分体系热力学 1

几点说明
(1)偏摩尔量只对体系中某组分才具有的,对整体而 言无所谓偏摩尔量的概念; (2)只有体系的广度性质才有偏摩尔量(质量除外) ; (3)偏摩尔量本身是强度性质; (4)注意右下角标的条件; (5)任何偏摩尔量都是T、p、组成的函数; (6)纯物质的偏摩尔量就是摩尔量; (7)偏摩尔量可能是负值。 (8)偏摩尔量是1mol B对整体热力学性质的贡献量, 而不应该理解为它在混合体系中所具有的量。
分类
气态混合物:空气 混合物液态混合物:甲醇 + 乙醇 固态混合物:Cu + Ni 气态溶液:萘溶解于高压CO 2中 非电解质溶液:糖水 − − − 本章 溶液液态溶液 电解质溶液:盐水 - - -电化学 固态溶液:单体溶解于聚合物中 − − − 又称固溶体
§4-2 化学势 化学势μ μB
• 4-2-1 化学势定义 • 4-2-2 平衡判据与平衡条件 • 4-2-3 理想气体的化学势表达式
4-2-1 化学势定义
混合物或溶液中,组分B的偏摩尔吉布斯函数 GB在化学热力学中有特殊的重要性,又把它叫 做化学势,用符号μB表示。
∂G µ B = GB = ∂nB T , p ,nc≠B
dX = ∑ X B dnB
B =1 k
( 2)
• 可得Gibbs-Duhem方程:
∑ n dX
B B=1
k
B
=0
∑ x dX
B B=1
k
B
=0
Gibbs-Duhem方程的意义: (1) 某一偏摩尔量的变化可从其它偏摩尔量的变 化中求得。 (2) 对一个含有K个组分的均相体系,K个偏摩 尔量Xi中,只有 K-1个是独立的。
如果在溶液中不按比例地添加各组分,则溶液浓 度会发生改变,这时各组分的物质的量和偏摩尔量均 会改变。 根据集合公式
多组分系统

第四章 多组分系统热力学及其在溶液中的应用§4.1 引 言1.基本概念1)多组分系统:由两种或两种以上物质所组成的系统。
(多组分系统可以是单相的也可以是多相的。
)2)混合物:由两种或两种相互均匀混合而构成的系统。
(可以是气相、液相或固相) 3)溶 液(1)定义:由两种或两种以上物质在分子级别呈均匀混合而成的系统。
(2)溶液组分命名:溶质,溶剂。
(3)分类:(1)固态溶液、液态溶液。
(2)电解质溶液、非电解质溶液。
(4)应注意问题:形成溶液后,一般溶质、溶剂受力 情况与纯组分受力情况不同,所以对它们研究方法是不同的。
2.溶液中物质受力情况溶剂-溶剂 f 11 ,溶质-溶质 f 22 ,溶剂-溶质 f 12。
1) 纯态: 溶质 f 22 溶剂 f 11 2) 稀溶液: 溶质 f 22 溶剂 f 11 3) 中等浓度: 溶质 f 22,f 12 溶剂 f 12, f 11 4) 高浓度: 溶质 f 22 溶剂 f 12 3.受力变化同热效应关系1) 放热2) 吸热3) 不吸热不放热§4.2 多组分系统的组成表示法1.组成表示法1)B 的质量浓度:单位体积混合物中所含B 的质量。
1211,22f f f >121122,f f f <121122f f f ==()B B m Vρ=单位 与T 有关2)B 的质量分数:单位质量混合物中所含B 的质量。
单位为1,与T 无关3)B 的浓度:单位体积混合物中所含B 的物质的量。
单位 或 同T 有关。
4)B 的摩尔分数( 或):组分B 的物质的量与混合物中总物质的量的比值。
单位为1,与T 无关液体用 ,气体用5)溶质B 的质量摩尔浓度:每千克溶剂中所含溶质的物质的量。
单位 与T 无关。
6)溶质B 的摩尔比:单位物质的量的溶剂中所含溶质的物质的量。
单位为1,与T 无关。
2.常用的浓度表示法之间的关系 1) 与 的关系:若取1000 g 溶剂对稀溶液 2) 与 关系:-3kg m ⋅B B W w W =B Bn c V =-3mol m ⋅-3mol dm ⋅B x B y B B n x n=B x By ()BB A n m m =⋅-1mol kg BB A n r n =B x B m B BB A B n n x n n n ==+∑AB B A B BB A10001000m x m m M M m M ==++∑∑A B 1000M m <<∑B AB 1000m M x =B x BC A B B BW W c M ρρ=-=-∑∑AB B B B A AB B B B B BB A A c c c M x W c M c M c M c c M M ρρ===--+++∑∑∑∑∑()B AB A B Bc M x c M M ρ=+-∑若溶液很稀则3) 同 的关系: 取 取若溶液很稀则 若 取 对水§4.3 偏摩尔量1.偏摩尔量的定义 1. 问题的引出对简单均相系统 ,要描述其状态,只需要两个状态性质(T 、p )就可以了。
物理化学课件第9讲-多组分体系

cB
nB V
mol.m-3 常用mol.dm-3
4. 质量分数 (mass fraction)
wB
mB mB
注:(1) 各种浓度的换算:选合适量的溶液
例:某H2SO4(B)溶液 wB = 5%,则
xB
5
5 98 98 95
18
0.0096
bB
5 98 95
1000
0.5371mol.kg-1
二、偏摩尔量
V = V (T, P, n1, n2, … nk)
dV
V T
P,n1 ,n2 ,nK
V P
T ,n1 ,n2 ,nK
V nB
T , p,nC (C B)
➢ 定义:
VB
V nB
T , p,nC (C B)
B的偏摩尔体积
(1) 物理意义:
(2) 注意:下标是 T,p,nC(C≠B) 均相 容量性质才有相应的偏摩尔量
质点数目可变 敞开系统 (质量不守恒)
2. 溶液的状态描述:
➢ 容量性质: V V (T , p, n1, n2,nk )共k+2个变量
二元溶液
V V (T , p, nA, nB)
➢ 强度性质:
(T , p, x1, xk-1,) 共k+1个变量
二元溶液
(T , p, xB) (T , p, x )
HB UB pVB AB UB TSB GB AB pVB HB TSB UB pVB TSB
三、集合公式 (Additive formula)
k
nBVB
B 1
(1) 意义: (2) 二元溶液,
nAVA nBVB V
(3) 其他偏摩尔量的集合公式: 自己写出
物理化学课件:第四章 多组分系统

混合物,气体、液体或固体溶于液体溶剂中即形成 溶液。
溶质有电解质和非电解质之分,本章主要讨 论非电介质所形成的溶液。
按规律性来划分 混合物:理想混合物、真实混合物。
溶液:理想稀溶液、真实溶液。
理想混合物在全部浓度范围内,理想稀溶液在 适当小的范围内,均有简单的规律性。
组成表示 ① 质量摩尔浓度(molality) bB:
bB
def
nB mA
溶质物质的量,单位 mol 溶剂的质量,单位 kg
bB 的单位:mol kg 1 。
② 物质的量浓度(molarity) cB:
cB
def
nB V
cB 的单位:mol m 3 。如果文献中用 molarity,则指单位 为 mol dm 3 。
B
dnB
=0
B
dnB
BdnB 0
B
该平衡条件与化学反应达到平衡的方式无关。
23
§4.3 气体组分的化学势
标准态:温度 T,标准压力 p 100 kPa ,理想气体。
该状态下的化学势称为标准化学势,以符合μBΘ(g)表示。 对于纯气体则省略下标B。 1.纯理想气体的化学势
使某纯理想气体B在温度T下由标准压力pΘ变至某一压力p,
Bl
Bg
RT
ln
pB* p
RT lnxB
* Bl
Bg
RT
ln
pB* p
40
因此
Bl
B* l RT lnxB
由纯液体 B 标准态的定义可知,
p
* Bl
Bl
p Vm*,B l dp
最后得到理想液态混合物中 B 组分化学势表达式:
第三章 多组分系统

1000 n1 55.5087 mol 18.0152
V2,m=b+2cn2=51.832+20.1394×1.000=52.111 cm3· mol-1 V1,m=(a-cn22)/n1=(1002.935-0.139412)/55.5087=18.0656 cm3· mol-1
其物质的量和偏摩尔 体积分别为 n1 ,V1 和 n2 ,V2 ,则体系的总体积为:
V n1V1 n2V2
X nB X B,m
B 1
i
如二组分溶液的体积
U nBU B
B
U UB ( )T , p ,nc ( c B) nB H HB ( )T , p ,nc ( c B) nB F A AB ( )T , p ,nc ( c B) F nB S SB ( )T , p , nc ( c B) nB G GB ( )T , p ,nc ( c B) nB
第三章 多组分系统热力学
Thermodynamics of the solution
第一节 多组分系统和组成表示法
一、多组分均相系统分类
1. 混合物:在热力学中,任何组分可按同样的方法来处理的均 相系统; 2. 溶液:在热力学中,各组分不能用同样的方法来处理 含量较多的组分称为溶剂 其他组分称为溶质 3. 稀溶液:溶质摩尔分数的总和远小于1 稀溶液有依数性质 有溶质和溶剂之分为溶液,否则为混合物
化学势是状态函数,是强度量,由于其绝对值不可知, 因此不同物质的化学势大小不能比较。 同偏摩尔量一样,没有体系的化学势可言。 化学势在判断相变和化学变化的方向和限度方面有重 要作用。
二、广义化学势和热力学基本公式
G=f(T, p, n1, n2…)
第3章 多组分系统的热力学,逸度和活度

3.1 引言
I.
多组分系统的热力学
3.2 偏摩尔量 3.3 化学势与热力学基本方程 3.4 平衡判据与平衡条件 3.5 相律
返回首页
II. 3.6 3.7 3.8 3.9 3.10 3.11 3.12 3.13
逸度、活度和混合性质 化学势与逸度 逸度和逸度因子的求取 拉乌尔定律和亨利定律 理想混合物和理想稀溶液 化学势与活度(1) 活度和活度因子的求取 化学势与活度(2) 混合性质与超额函数
2.组成可变的多相多组分系统 多相系统的广延性质
X X ( 1 ) X ( 2 ) X ( ) X ( )
dX dX
(1)
dX
( 2)
dX
1 ( )
dX ( )
1
热力学基本方程
dU TdS pdV
返回章首
I. 多组分系统的热力学
3.2 偏摩尔量
1.偏摩尔量的定义与物理意义
根据关于状态函数的基本假定,对于均相 多组分系统的广延性质X,可写出
X X (T , p, n1 , n2 , , nK )
K
X X dX dT dp T p p ,n j T ,n j
51.823 0.2788nB / mol cm 3 mol -1
A
返回章首
V nAVA nBVB
VA V nBVB / nA M A / m A V nBVB 18.0152 / 1 10 3 1002.935 51.832nB / mol 0.1394nB / mol
多组分系统

例如:一个封闭容器中,装有一定数量的乙醇水
溶液,上方为蒸气,整个容器是一个封闭系统, 若分别选取液相或气相作为系统,由于两相之间 有物质交换,所以液相或气相都是敞开系统。
(2)多组分系统的广度性质,一般说来不 多组分系统的广度性质, 再具有简单的加和性, 再具有简单的加和性,即并不等于各组分 在纯态时该广度性质之和。 在纯态时该广度性质之和。
19
在等温等容且定组成的条件下
µ
B
∂A = ( )T ∂nB
,V , n ( C ' , C ' ≠ B )
三 个 偏 导 数 都 叫 化 学 势
20
在等熵等压且定组成的条件下
µB
∂H = ( ) S , P , n ( C ' ,C ' ≠ B ) ∂nB
在等熵等容且定组成的条件下
∂U µB = ( ) S ,V , n ( C ' ,C ' ≠ B ) ∂n B
>自发 =平衡
相平衡判据
22
它表明,在等温等压且没有非体积功的条件下, 它表明,在等温等压且没有非体积功的条件下, 则组分B将自动由α 若 α β ,则组分B将自动由α相转移
µB > µB µB = µB
α
到 β相 。 则组分B 则组分B在α和β两相中达 平衡。 平衡。
若
β
纯物质B*达成两相平衡的条件是: 纯物质 达成两相平衡的条件是: 达成两相平衡的条件是
Z = f (T , P, nB , nC ......)
12
若系统的状态发生任意一个微小变化,即T,P,nB,nC,诸 变量任意独立改变无限小量时,则Z也会有相应的微 小变化,其全微分为:
∂Z ∂Z dZ = ( ) P ,n ( B ) dT + ( )T ,n ( B ) dP ∂P ∂T ∂Z +( )T , P ,n ( C ,C ≠ B ) + ...... ∂nB
多组分系统热力学

多组分系统热力学
多组分系统热力学是研究多个组分构成的系统的热力学行为的科学。
在多组分系统中,各个组分之间可能会相互作用,从而影响整个系统的热力学性质。
多组分系统热力学的研究内容包括:
1.热力学第一定律:能量守恒定律,即在一个封闭系统中,能量不
能被创造或消除,只能从一种形式转化为另一种形式。
2.热力学第二定律:熵增定律,即在一个封闭系统中,熵(即系统
的混乱程度)只能增加,不能减少。
这意味着,系统总是朝着熵增的方向演化,而不是熵减的方向。
3.相平衡:研究在给定的温度和压力下,不同物质之间是如何平衡
的。
4.化学平衡:研究在给定的温度和压力下,化学反应是如何平衡的。
5.热力学第三定律:绝对零度不能达到原理,即任何物质在绝对零
度下的熵均为零。
这些定律和原理对于理解多组分系统的热力学行为非常重要。
在化学工程、材料科学、生物工程等领域中,多组分系统热力学被广泛应用于研究复杂系统的热力学性质和行为。
5第五章多组分系统

5第五章多组分系统多组分系统:两种或两种以上的组分组成的系统,组成(组元):组成系统的化学物质——构成系统的化学物质总数组分,独立组成数(独立组元数)例,O2,CO,CO2气体混合,CO+O2->CO2三者平衡有一定数量关系,三者中仅有两组元为独立组分为二,组成为三多组分系统:包括溶液,混合气体,合金(溶体:多组元均匀系)溶液:液态溶体混合气体:气态溶体合金:金属固态溶体和金:非金属固态溶体广义溶液:多组分的均匀系(不仅是指液体,气体也可以)从纯物质热力学到多组分系统热力学的过渡是以偏摩尔量和化学势为基础的。
5-1内能与化学成分的关系1.内能的试验测定法假设,一均匀系,包含r种不同的化学组分,其中质量分别为:M1,M2,……Mr摩尔数分别为:n1,n2,……nr分子量分别为:μ1,μ2……μr有(以上参量关系式为)MI=μInI(I=1,2,……r)记Ni为可独立变动的摩尔数.以θ,P,n1,n2,…,nr为描写均匀系的平衡态的独立变量.其中,θ为任一温标所定的温度.容积V=V(θ,P,n1,n2,…,nr)任意地变动θ,P,n1,n2,…,nr,都可直接测得V由于内能U---不可直接测得.故应用等压过程P不变,有:Q=△H其中,H=H(θ,P,n1,n2,…,nr)其值可由实验测定∴由U=H-PV可求解内能U.上述焓的确定-----由实验法测得.∵H=H(ni)增加某一组元数量,即将一定数量的化学能物质加入到均匀系,以增加某组元的数量,然后用绝热法或等温法测量物质的吸热量.其中,绝热法指:物系与外界绝热,测量过程中的温度改变.等温法指:对物系供给热量,或取出热量,维持温度不变.以下分别详细介绍绝热法和等文法:1)绝热法:假定:第i组元,数量为n’摩尔加入均匀系,过程中为等压,无化学反应.∴H=cont.初温为θ,终温为θ’第I种化学纯物质的焓为H’.H’与n’成正比即H’=n’h’h’=h’(θ,p)初始的总焓,H(θ,p,n1,n2,…,nr)+H’终态的总焓,H(θ’,p,n1,n2,…,ni+n’,…,nr)∵总焓不变∴两者相等(其中两者指初始的总焓和终态的总焓).若,Cp以(已)在各种情况下求得,则H(θ’,p,n1,n2,..,ni+n’,…,nr)-H(θ,p,n1,…,ni+n’,…,nr)=Cp(,p,n1,n2,...,nin',...,nr)d.'H(θ,p,n1,…,ni+n’,…,nr)=H(θ’,p,n1,n2,…,ni+n’,…,nr)-'Cp(,p,n1,n2,...,nin',...,nr)d即H(θ,p,n1,n2,…,ni+n’,…,nr)=H(θ,p,n1,n2,…,nr)+H’-Cp(,p,n1,n2,...,nin',...,nr)d.'方程确定了H~ni的关系对全部r种组元作一连串实验,可确定H与化学成分的关系.2)等温法:θ保持不变,测量物质放出的热量Q.该热量相当于公式的Cp(,p,n1,n2,...,nin',...,nr)d'∴H(θ,p,n1,n2,…,ni+n’,…,nr)=H(θ,p,n1,n2,…,nr’)+H’-Q2.广延量与偏摩尔物质.广延量与总质量成正比设:有一均匀系,其θ,p不变,ni→ni(i=1,2,…,r)总质量M’=M.(ni’=ni,i=1,2,3,…,r)有:V’=VU’=U∴V’=V(θ,p,n1,n2,…,nr)=V(θ,p,n1,…,nr)U’=U(θ,p,n1,n2,…,nr)=U(θ,p,n1,…,nr)即V’,U’作为θ,p,ni’的函数,与V,U作为θ,p,ni的函数相同,此为广延量的数学性质.------一阶齐次函数.以下给出一阶齐次函数的数学定义:已知:f(某1,某2,…,某r)=m(某1,某2,…,某r)称f为某1,某2,…,某r的m阶齐次函数,举例来说,强度量为零阶齐次函数.若函数中包含广延量与强度量,应将强度量看作参数项.以下给出Euler定理的数学定义:假设:函数f对各变量某1,某2,…,某r有连续的偏微商,则,m阶齐次函数有:136i某if某imf.-----------------Euler定理.Euler定理应用:将此定理用到V,U,ni相当于某i,m=1(一次齐次函数).Vnivni1rU.p.niUni1r.p.Vni.p.vi------------组元i的偏摩尔容积Uni.p.ui------------组元i的偏摩尔内能其它偏摩尔变量:hi=riHni.p.,CPi=Cpnir.p.,CVi=Cvni.p.偏摩尔变量符合ripivHnhCi1pnCC1nCivi1化学成分,用各组元的某i表示.某i=rninn=ni某1i1---------r种摩尔百分比中,仅(r-1)种为独立(组分r-1,.组成r个)平均摩尔内能umUnVn其他平均摩尔能:vm5-2基本方程,hmHn1多组分的热力系函数确定简单可压缩封闭系的热力状态,需要独立热力参数2个,相应于一种做功形式和热量交换.例U=U(,v)定成分,定质量系统,U取决于,v,若有物质加入系统(开口系)U↗∴dU与加入物质dn有关,又与加入物质的种类有关.∴uu(,v,n1,n2,,nr)∴确定变成分,多组分系统的热力状态,需独立热力参数及组分变量(组分多少,浓度多少,——也是独立变量)137组元数量的表示:摩尔数u1,u2——nr,在含r个组分的均相系中,状态由r+2个参数确定。
多组分体系热力学.ppt

常用的偏摩尔量:
XB
def
X nB
T , p,nC
U nBUB B
H nB HB B
A nB AB B
S nB SB B
G nBGB B
U
UB
( nB
)T , p,nC (CB )
偏摩尔热力学能
H
HB
( nB
)T ,
p,nC (CB)
A
AB
( nB
)T , p,nC (CB )
dp
B
nB
T , p,nC
dnB
偏摩尔量
X B def
X nB
T , p,nC
X
X
dX
T
p,nB
dT
p
T ,nB
dp
B
X BdnB
2、偏摩尔量的物理含义:
X B def
X nB
T , p,nC
偏摩尔量XB是在恒温、恒压及除组分B以外其余各 组分的物质的量均保持不变的条件下,系统广度量X随 组分B的物质的量的变化率
四、同一组分的各种偏摩尔量之间的关系 对单组分系统有:
H=U+pV A=U-TS G=H-TS
G S T p
对多组分系统有:
G p
T
V
HB=UB+pVB AB=UB-TSB GB=HB-TSB
GB T
p
SB
GB p
T
VB
§4.2 化学势
定义:
B
GB
( G nB
)T , p,nC (CB)
3、偏摩尔量的加和公式
X nB X B
B
多组分系统的广度量X为系统各组分的物质的量与其偏摩尔量 XB乘积的加和。
物理化学-溶液多组分体系热力学公开课获奖课件百校联赛一等奖课件

5. 溶质B旳质量摩尔浓度mB(molality)
mB def
nB WmmAAA
6. 溶质B旳摩尔比
rB nB / nA
(二) 偏摩尔量和化学势
(二) 偏摩尔量和化学势 1.偏摩尔量旳定义
2. 应注意旳问题
ZB
Z nB
T , p,nC (C B)
(1) 只有容量性质才有偏摩尔量,而偏摩尔量是强 度性质。 (2) 偏摩尔数量旳下标是 T , p, nC (C B) 。
XE= ΔmixXre -ΔmixXid
(九)渗透因子和超额函数
超额吉布斯自由能
GE
GE def G mix re G mix id
GE nB RT ln B B
当 GE 0 ,表达系统对理想情况发生正偏差;
当
,则发生负偏差。
GE 0
(十) 分配定律
“在定温、定压下,若一种物质溶解在两个同步存在旳 互不相溶旳液体里,到达平衡后,该物质在两相中浓度 之比等于常数” ,这称为分配定律。用公式表达为:
pB kccB
(b) 溶质在气相和在溶液中旳分子状态必须相同
(c) 溶液浓度愈稀,对亨利定律符合得愈好。
(四) 稀溶液中旳两个经验定律
在很稀旳溶液中,溶质旳蒸气压仅与溶质旳浓 度有关,且两者成正比。但是kx可能不等于pB*(环境 与纯溶质旳环境大不相同)。 kx与溶剂对溶质分子旳 引力F大小有关。
MA
合用条件: 稀溶液,且溶质不挥发
(七) 稀溶液旳依数性
若A,B组分都挥发:
Tb
kBmB (1
yB xB
)
xB为液相构成, yB为气相构成。
xB yB ΔTb 0
升高
xB yB
多组分体系

3. 非理想气体
用逸度代替压力,并引入逸度系数校正对理想的偏差
单组分
理想气体的结果,用到非理想气体,保持公式形式不变,
多组分
第四章 多组分系统 (第一部分)
第一节 偏摩尔量与化学势
组成不变 封闭系统 组成可变 开放系统
新增状态参量:各个组分的物质的量 nB
浓度表示法请阅读教材自学
一、偏摩尔量
1atm, 298K
1mol H2O
DV=18cm3 H2O
1atm, 298K 1mol H2O DV=14cm3
相互作用排列堆积不同
3. Gibbs-Duhem 公式
T, p一定条件下
偏摩尔量之间是相互关联的
以A-B两组分体系为例
• 一个上升,另一 个下降 –– 反号性质 • 浓度大者变化小 –– 反比性质
例题
常温常压下,1Kg 某溶剂逐渐加入某溶质B, 测得溶液体积变化,求溶质与溶剂的偏摩尔量
作业: 教材211页例题通式
二、 化学势
偏摩尔吉布斯自由能
等温等压 可逆过程非体积功
1. 组成可变开放系统热力学基本公式
可逆过程非体积功
2. 相平衡
设多组分系统存在a,b两相,等温等压下,组分B在相间有微小转移
设dn=dnB(a)= - dnB(b) 即ba, dn>0 dG=dG(a)+dG(b)=mB(a)dnB(a)+mB(b)dnB(b)=[mB(a)-mB(b)]dn mB(a)>mB(b), dG>0, 逆向自发, ab mB(a)<mB(b), dG<0, 正向自发, ba mB(a)=mB(b), dG=0, 两相平衡(可逆过程) 变化方向:物质从化学势较大的相流向化学势较小的相 平衡条件:该组分在两相中的化学势相同
一种多组分分析仪器系统

一种多组分分析仪器系统多组分分析仪器系统是一种广泛应用于工业生产、环境监测和化学研究等领域的仪器系统,它能够同时检测多种物质成分的含量,具有高效、准确、快速的特点。
这种仪器系统通常由多个部件组成,包括样品处理模块、分析模块、检测模块和数据处理模块等。
下面我将介绍一种典型的多组分分析仪器系统。
首先,样品处理模块是多组分分析仪器系统的第一个部件,它主要用于对待测样品进行预处理。
通常包括样品进样系统、样品准备系统和样品处理系统。
样品进样系统用于将待测样品引入仪器系统中,通常可以通过自动进样或手动进样的方式进行。
样品准备系统用于将样品处理成符合分析要求的形式,例如将固体样品溶解、液体样品稀释、气体样品稀释等。
样品处理系统则用于进一步处理样品,例如进行反应、提取、分离等操作。
其次,分析模块是多组分分析仪器系统的核心部件,它主要用于对待测样品中的多种成分进行分析。
通常包括分析仪器、分析方法和分析程序等。
分析仪器可以是不同类型的仪器,如红外光谱仪、质谱仪、色谱仪等,每种仪器都有其适用的分析范围和特点。
分析方法是指根据待测成分的特性设计的分析方案,包括取样、处理、检测等步骤。
分析程序则是通过仪器控制软件实现的程序,用于控制仪器的运行、采集数据、处理数据等。
第三,检测模块是多组分分析仪器系统的另一个重要部件,它主要用于对待测样品中的成分进行检测。
通常包括检测器、信号放大器、数据采集系统等。
检测器是用于检测待测成分的仪器,可以根据不同的检测原理分为光学检测器、电化学检测器、质谱检测器等。
信号放大器则用于放大检测器输出的信号,以便进行下一步处理。
数据采集系统用于采集检测到的信号,并将其转换成数字信号,以便后续的数据处理。
最后,数据处理模块是多组分分析仪器系统的最后一个部件,它主要用于处理检测到的数据,提取出样品中各种成分的含量。
通常包括数据处理软件、数据处理算法和数据展示界面等。
数据处理软件是用于处理检测到的原始数据的软件,可以进行数据校正、数据拟合、数据分析等操作。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
溶液组成数 xB (mole fraction) )
xB
def
nB n(总)
溶质B的物质的量与溶液中总的物质的量之比 溶质 的物质的量与溶液中总的物质的量之比 称为溶质B的物质的量分数 又称为摩尔分数, 的物质的量分数, 称为溶质 的物质的量分数,又称为摩尔分数,单 位为1。 位为 。
溶液组成的表示法
在液态的非电解质溶液中,溶质B 在液态的非电解质溶液中,溶质B的浓度表 示法主要有如下四种: 示法主要有如下四种: 1.物质的量分数 1.物质的量分数 2.质量摩尔浓度 质量摩尔浓度 3.物质的量浓度 物质的量浓度 4.质量分数 质量分数
上一内容
下一内容
回主目录
返回
2011-6-7
4.2
上一内容 下一内容 回主目录
返回
2011-6-7
4.1 引言
溶剂( 溶剂(solvent)和溶质(solute) )和溶质( ) 如果组成溶液的物质有不同的状态,通常将液 如果组成溶液的物质有不同的状态,通常将液 态物质称为溶剂,气态或固态物质称为溶质。 态物质称为溶剂,气态或固态物质称为溶质。 如果都是液态,则把含量多的一种称为溶剂, 如果都是液态,则把含量多的一种称为溶剂, 含量少的称为溶质。 含量少的称为溶质。
摩尔Helmholz自由能(molar Helmholz free energy) A * Am,B = nB 摩尔Gibbs 自由能(molar Gibbs free energy) G * Gm,B = nB 这些摩尔热力学函数值都是强度性质。
上一内容 下一内容 回主目录
返回
2011-6-7
多组分体系的偏摩尔热力学函数值
k
∂Z =∑ ( )T , p ,nc ( c ≠ B) B=1 ∂nB
上一内容 下一内容 回主目录
返回
2011-6-7
偏摩尔量的集合公式
按偏摩尔量定义,
∂Z ZB = ( )T , p , nc ( c ≠ B) ∂nB
则
dZ = Z1dn1 + Z 2 dn2 + ⋅ ⋅ ⋅ + Z k dnk
d 根据纯组分的基本公式, G = − SdT + Vdp
∂Gm ( ) p = − Sm ∂T 将 µ B代替 Gm ,则得到的摩尔体积 Sm 换为偏摩 尔体积 S B 。
上一内容 下一内容 回主目录
返回
2011-6-7
4.4
稀溶液中的两个经验定律
拉乌尔定律(Raoult’s Law) 1887年,法国化学家Raoult从实验中归纳出一个经验 定律:在定温下,在稀溶液中,溶剂的蒸气压等于纯 * pA乘以溶液中溶剂的物质的量分数 xA ,用 溶剂蒸气压 公式表示为: *
上一内容
下一内容
回主目录
返回
2011-6-7
4.2
溶液组成的表示法
4.质量分数wB(mass fraction)
mB wB = m(总)
溶质B的质量与溶液总质量之比称为溶质B的 质量分数,单位为1。
上一内容
下一内容
回主目录
返回
2011-6-7
4.3
偏摩尔量与化学势
(1)单组分体系的摩尔热力学函数值 体系的状态函数中V 体系的状态函数中 ,U,H,S,A,G等是 等是 nB 广度性质,与物质的量有关。设由物质B组成的单 广度性质,与物质的量有关。设由物质 组成的单 组分体系的物质的量为 ,则各摩尔热力学函数 值的定义式分别为: 值的定义式分别为: 摩尔体积(molar volume)
= ∑ Z B dnB
B=1 k
在保持偏摩尔量不变的情况下,对上式积分
Z = Z1 ∫ dn1 + Z 2 ∫ dn2 + ⋅ ⋅ ⋅ + Z k ∫ dnk
0 0 0 n1 n2 nk
上一内容
下一内容
回主目录
返回
2011-6-7
偏摩尔量的集合公式
= n1 Z1 + n2 Z 2 + ⋅ ⋅ ⋅ + nk Z k
上一内容
下一内容
回主目录
返回
2011-6-7
4.1 引言
混合物( 混合物(mixture) ) 多组分均匀体系中,溶剂和溶质不加区分,各 组分均可选用相同的标准态,使用相同的经验定律, 这种体系称为混合物,也可分为气态混合物、液态 混合物和固态混合物。
上一内容
下一内容
回主目录
返回
2011-6-7
4.2
S = ∑ nB S B
B
G = ∑ nB GB
B
=µ B
上一内容
下一内容
回主目录
返回
2011-6-7
Gibbs-Duhem公式
如果在溶液中不按比例地添加各组分,则溶液浓 度会发生改变,这时各组分的物质的量和偏摩尔量均 会改变。 根据集合公式
Z = n1 Z1 + n2 Z 2 + ⋅ ⋅ ⋅ + nk Z k
Z= ∑ n B Z B
B=1
k
这就是偏摩尔量的集合公式,说明体系的总的容 量性质等于各组分偏摩尔量的加和。 例如:体系只有两个组分,其物质的量和偏摩尔 体积分别为 n1 , V1 和 n2 , V2 ,则体系的总体积为:
V = n1V1 + n2V2
上一内容 下一内容 回主目录
返回
2011-6-7
即: 同理:
dU = TdS − pdV + ∑ µ B dnB
B
dH = TdS + Vdp + ∑ µ B dnB
dA = − SdT − pdV + ∑ µ B dnB
dG = − SdT + Vdp + ∑ µ B dnB
B
B
B
上一内容
下一内容
回主目录
返回
2011-6-7
化学势与压力的关系
上一内容
下一内容
回主目录
返回
2011-6-7
4.2
溶液组成的表示法
3.物质的量浓度cB(molarity) 物质的量浓度 )
cB
def
nB V
溶质B的物质的量与溶液体积V的比值称为溶 质B的物质的量浓度,或称为溶质B的浓度,单位 是 mol ⋅ m −3 ,但常用单位是 mol ⋅ dm −3 。
上一内容
下一内容
回主目录
返回
2011-6-7
多组分体系中的基本公式
在多组分体系中,热力学函数的值不仅与其特征 变量有关,还与组成体系的各组分的物质的量有关。 例如:热力学能 U = U ( S ,V , n1 , n2 , ⋅ ⋅ ⋅, nk )
k ∂U ∂U ∂U ) S ,V ,nc (c ≠ B) dnB 其全微分 dU = ( )V ,nB dS + ( ) S ,nB dV + ∑ ( ∂S ∂V B =1 ∂nB
上一内容 下一内容 回主目录
∂G m ( ) T = Vm ∂p
返回
2011-6-7
化学势与温度的关系
∂µ B ∂ ∂G ( ) p ,nB ,nc = [ ( )T , p ,nc ] p ,nB ,nc ∂T ∂T ∂nB
∂ ∂G =[ ( ) p ,nB ,nc ]T , p ,nc ∂nB ∂T ∂ (− S ) =[ ]T , p ,nc = − S B ∂nB
(1)(2)两式相比,得:
n1dZ1 + n2 dZ 2 + ⋅ ⋅ ⋅ + nk dZ k = 0 即
∑ n dZ
B B=1
k
B
=0
这就称为Gibbs-Duhem公式,说明偏摩尔量之间 是具有一定联系的。某一偏摩尔量的变化可从其它偏 摩尔量的变化中求得。
上一内容 下一内容 回主目录
返回
2011-6-7
在多组分体系中,每个热力学函数的变量就不 止两个,还与组成体系各物的物质的量有关。 设Z代表V,U,H,S,A,G等广度性质,则 对多组分体系 Z = Z (T , p, n1 , n2 ,K , nk ) 偏摩尔量ZB的定义为:
ZB
def
∂Z ( )T , p ,nc (c≠B) ∂nB
ZB称为物质B的某种容量性质Z的偏摩尔量 (partial molar quantity)。
第四章 多组分系统热力学 及其在溶液中的应用
气态溶液 固态溶液 液态溶液
正规溶液
非电解质溶液
上一内容
下一内容
回主目录
返回
2011-6-7
4.1 引言
溶液( 溶液(solution) ) 广义地说, 广义地说,两种或两种以上物质彼此以分子或 离子状态均匀混合所形成的体系称为溶液。 离子状态均匀混合所形成的体系称为溶液。 溶液 溶液以物态可分为气态溶液、固态溶液和 溶液以物态可分为气态溶液、固态溶液和液态 气态溶液 溶液。根据溶液中溶质的导电性又可分为电解质溶 溶液。根据溶液中溶质的导电性又可分为电解质溶 液和非电解质溶液。 非电解质溶液。 本章主要讨论液态的非电解质溶液。
偏摩尔量的集合公式
写成一般式有: U = n U ∑ B B
B
∂U UB = ( )T , p ,nc ( c ≠ B) ∂nB HB = ( ∂H )T , p , nc ( c ≠ B) ∂nB
H = ∑ nB H B
B
A = ∑ nB AB
B
∂A AB = ( )T , p ,nc ( c ≠ B) ∂nB ∂S SB = ( )T , p , nc ( c ≠ B) ∂nB ∂G GB = ( )T , p , nc ( c ≠ B) ∂nB
化学势的定义
广义定义:
