举例蛋白质1
蛋白质一级结构二级结构三级结构四级结构解释

蛋白质一级结构二级结构三级结构四级结构解释【摘要】蛋白质是生物体内重要的大分子,负责许多生物学功能。
蛋白质的结构可分为四个级别:一级结构指的是氨基酸的简单线性排列,二级结构是氨基酸的局部区域形成α螺旋或β折叠,三级结构是整个蛋白质分子的空间构象,四级结构是多个蛋白质分子相互组装在一起形成的复合物。
蛋白质的结构决定了其功能,例如酶的特异性和亲和力。
蛋白质的结构与功能高度相关,对于研究蛋白质功能和疾病治疗有着重要意义。
蛋白质的结构从简单到复杂,具有多种不同层次的组织关系,这些不同级别的结构相互作用,共同决定了蛋白质的生物学功能。
【关键词】蛋白质,一级结构,二级结构,三级结构,四级结构,解释,总结1. 引言1.1 蛋白质概述蛋白质是生物体内功能性非常重要的大分子,它们参与了生物体内的几乎所有生物过程。
蛋白质是由氨基酸分子通过肽键连接而成的多肽链,具有多种结构和功能。
蛋白质的结构可以分为四个层次:一级结构、二级结构、三级结构和四级结构。
一级结构是指蛋白质的氨基酸序列,即多肽链的线性排列方式。
二级结构是指多肽链中氨基酸的局部空间构象,包括α-螺旋和β-折叠等。
三级结构是指整个多肽链的立体空间结构,由各个二级结构元素的折叠方式决定。
四级结构则是由多个多肽链之间的相互排列和交互作用所形成的整体结构。
通过这四个层次的结构,蛋白质可以实现其特定的生物功能,如催化化学反应、传递信号等。
蛋白质的结构和功能密切相关,任何一个层次的结构改变都可能影响到其功能。
对蛋白质结构的深入理解对于揭示其功能机制具有重要意义。
2. 正文2.1 蛋白质一级结构蛋白质的一级结构指的是它的氨基酸序列。
氨基酸是组成蛋白质的基本单位,共有20种不同的氨基酸,它们通过肽键连接在一起形成多肽链。
蛋白质的氨基酸序列是由基因决定的,不同的基因编码不同的氨基酸序列,从而确定了蛋白质的结构和功能。
在蛋白质的一级结构中,氨基酸序列的特定顺序决定了蛋白质的二级结构。
新人教必修1专题复习课件:06 蛋白质

〖细胞内蛋白质发生水解时,通常需要另一种蛋白质的参与.(√ )〗 〖蛋白质的基本性质不仅与碳骨架有关,也与功能基团有关.( √)〗
一.生命活动的主要承担者——蛋白质
例3(2018年全国卷,Ⅲ卷,T30)回答下列与蛋白质相关的问题: (1)生物体中组成蛋白质的基本单位是_氨__基__酸____,在细胞中合成蛋白质 时,肽键是在_核__糖___体__这一细胞器上形成的。合成的蛋白质中有些是分泌蛋 白,如_胃__蛋___白__酶___(填“胃蛋白酶”“逆转录酶”或“酪氨酸酶”)。分 泌蛋白从合成至分泌到细胞外需要经过高尔基体,此过程中高尔基体的功 能是_对__蛋___白__质__进__行__加___工__、__分__类___和__包__装_。 (2)通常,细胞内具有正常生物学功能的蛋白质需要有正确的氨基酸序列 和_空___间_____结构,某些物理或化学因素可以导致蛋白质变性,通常,变性 的蛋白质易被蛋白酶水解,原因是 _蛋__白__质___变__性__使__肽___键__暴__露__,___暴__露__的__肽___键__易__与__蛋___白__酶__接__触__,___使__蛋__白__质___降_。解
R基的意义:决定氨基酸的 种类 和理化 性质 组成生物体的氨基酸的种类约为21种
一.生命活动的主要承担者——蛋白质 1.基本组成单位--氨基酸
(1)结构 C、H、O、N
C2H4O2N-R
氨基
羧基 同一
(13种)
仅在含硒的蛋白质存在第21种氨基酸(硒代半胱氨酸)。 P二67,密码子表,UGA是终止密码,但在特殊情况下可编码硒代半胱氨酸。
蛋白质一级结构测序解析

蛋白质顺 序测定基 本方法路 线
纯蛋白质
二硫键拆开
末端氨基酸测定 专一性裂解
将肽段分离并测出顺序
将肽段顺序进行叠联以确定完整的顺序
测定一级结构的基本方法
基本步骤: (1) 测定末端氨基酸数目,确定蛋白质分子是由几条 肽链构成的; (2) 拆分蛋白质分子的多肽链,断开多肽链内二硫键 并分离出每条肽链。 (3)将肽链完全水解,测定每条多肽链的氨基酸组成 (4)鉴定多肽链N-末端、C-末端氨基酸残基 (5)至少用两种方法将多肽链水解成较小的片段; (6)分离并测定各肽段的氨基酸序列; (7)片段重叠法重建完整多肽链一级结构; (8)确定半胱氨酸残基间形成二硫键交联桥的位置。
胰岛素
-巯基乙醇
碘乙酸
尿素和盐酸胍与蛋白质的可能作用方式: a.与肽链竞争氢键 b.增加非极性侧链在 水中的溶解度
(NH)
脲或胍 脲或胍
(四)氨基酸组成的分析
氨基酸分析仪进行测 定,测定每条多肽链 的AA组成,并计算出 AA成分的分子比。
(五)裂解多肽链成较小的片段
酶解法:如胰蛋白酶
胰凝乳蛋白酶 化学法:如溴化氰法 羟胺法
二硫键位置的确定
+
ቤተ መጻሕፍቲ ባይዱ第 二 向
a b
-
pH6.5 图中a、b两个斑点是 由一个二硫键断裂 产生的肽段
+
第一向
-
Brown和Hartlay对角线电泳图解
(九)蛋白质测序举例
• 胰岛素测序自学
胰岛素的分子量为5734道尔顿,由51个氨基酸组成。
含A、B两条链,(A链:21肽 ,B链:30肽)。 A链和B链之间由两个链间二硫键(A7-B7,A20B19)连接,A链本身第6位和第11位的2个Cys残基之 间形成一个链内二硫键。
蛋白质的一级结构与功能的关系

功能的表现有关。
蛋白质结构预测
❖ 一种生物体的基因组规定了所有构成该生物体的蛋白质,基因规定了组成蛋白质的氨基酸 序列。虽然蛋白质由氨基酸的线性序列组成,但是,它们只有折叠成特定的空间构象才能 具有相应的活性和相应的生物学功能。了解蛋白质的空间结构不仅有利于认识蛋白质的功 能,也有利于认识蛋白质是如何执行其功能的。确定蛋白质的结构对于生物学研究是非常 重要的。目前,蛋白质序列数据库的数据积累的速度非常快,但是,已知结构的蛋白质相 对比较少。尽管蛋白质结构测定技术有了较为显著的进展,但是,通过实验方法确定蛋白 质结构的过程仍然非常复杂,代价较高。因此,实验测定的蛋白质结构比已知的蛋白质序 列要少得多。另一方面,随着DNA测序技术的发展,人类基因组及更多的模式生物基因组 已经或将要被完全测序,DNA序列数量将会急增,而由于DNA序列分析技术和基因识别方 法的进步,我们可以从DNA推导出大量的蛋白质序列。这意味着已知序列的蛋白质数量和 已测定结构的蛋白质数量(如蛋白质结构数据库PDB中的数据)的差距将会越来越大。人 们希望产生蛋白质结构的速度能够跟上产生蛋白质序列的速度,或者减小两者的差距。那 么如何缩小这种差距呢?我们不能完全依赖现有的结构测定技术,需要发展理论分析方法, 这对蛋白质结构预测提出了极大的挑战。20世纪60年代后期,Anfinsen首先发现去折叠蛋 白或者说变性(denatured)蛋白质在允许重新折叠的实验条件下可以重新折叠到原来的结构, 这种天然结构(native structure)对于蛋白质行使生物功能具有重要作用,大多数蛋白质只 有在折叠成其天然结构的时候才能具有完全的生物活性。自从Anfinsen提出蛋白质折叠的 信息隐含在蛋白质的一级结构中,科学家们对蛋白质结构的预测进行了大量的研究,分子 生物学家将有可能直接运用适当的算法,从氨基酸序列出发,预测蛋白质的结构。本章主 要着重介绍蛋白质二级结构及空间结构预测的方法。
蛋白质的一级结构(共价结构)

1.蛋白质的一级结构(共价结构)蛋白质的一级结构也称共价结构、主链结构。
1.蛋白质结构层次一级结构(氨基酸顺序、共价结构、主链结构)↓是指蛋白质分子中氨基酸残基的排列顺序二级结构↓超二级结构↓构象(高级结构)结构域↓三级结构(球状结构)↓四级结构(多亚基聚集体)1.一级结构的要点.1.蛋白质测序的一般步骤祥见 P116(1)测定蛋白质分子中多肽链的数目。
(2)拆分蛋白质分子中的多肽链。
(3)测定多肽链的氨基酸组成。
(4)断裂链内二硫键。
(5)分析多肽链的N末端和C末端。
(6)多肽链部分裂解成肽段。
(7)测定各个肽段的氨基酸顺序(8)确定肽段在多肽链中的顺序。
(9)确定多肽链中二硫键的位置。
2.蛋白质测序的基本策略对于一个纯蛋白质,理想方法是从N端直接测至C端,但目前只能测60个N端氨基酸。
3. 直接法(测蛋白质的序列)两种以上特异性裂解法 N CA 法裂解 A1 A2 A3 A4B 法裂解 B1 B2 B3 B4用两种不同的裂解方法,产生两组切点不同的肽段,分离纯化每一个肽段,分离测定两个肽段的氨基酸序列,拼接成一条完整的肽链。
4. 间接法(测核酸序列推断氨基酸序列)核酸测序,一次可测600-800bp5. 测序前的准备工作6. 蛋白质的纯度鉴定纯度要求,97%以上,且均一,纯度鉴定方法。
(两种以上才可靠)⑴聚丙烯酰胺凝胶电泳(PAGE)要求一条带⑵DNS —cl (二甲氨基萘磺酰氯)法测N 端氨基酸7. 测定分子量用于估算氨基酸残基n=方法:凝胶过滤法、沉降系数法8. 确定亚基种类及数目多亚基蛋白的亚基间有两种结合方式:⑴非共价键结合8mol/L 尿素,SDS SDS-PAGE 测分子量⑵二硫键结合过甲酸氧化:—S —S —+HCOOOH → SO 3Hβ巯基乙醇还原:举例:: 血红蛋白 (α2β2)(注意,人的血红蛋白α和β的N 端相同。
)分子量: M拆亚基: M 1 、M 2 两条带拆二硫键: M 1 、M 2 两条带分子量关系: M = 2M 1 + 2M 29. 测定氨基酸组成主要是酸水解,同时辅以碱水解。
(完整)全国部分名校考博生物化学真题大全,推荐文档

2004年中山大学医学院博士生入学考试-生物化学一、名词解释1、端粒酶2、嘌呤核苷酸循环3、断裂基因4、模序5、抑癌基因6、RT-PCR7、密码子摆动性8、核心酶9、解偶联机制10、顺式作用元件二、简答题1、血红蛋白氧离曲线为何呈S形?2、DNA双螺旋结构的特点?3、酶促反应的机制4、维生素B12为何能导致巨幼红细胞性贫血?5、IP3、DAG是什么?其在信号传导中的作用是什么?三、问答题1、试述蛋白质一级结构和空间结构与蛋白质功能的关系。
2、试述人类基因组计划的内容、意义,以及后基因组计划的研究方向。
3、以操纵子理论说明:细菌如何利用乳糖作为碳源?当葡萄糖与乳糖共存时,如何调节?4、1分子葡萄糖子体内完全氧化生成38个ATP:(1)各个途径以及其中的能量生成?(2)NADH进入线粒体的途径?(3)NADH的呼吸链组成?5、试述血浆脂蛋白分类及作用,载脂蛋白的含义,作用。
LDL升高、HDL降低为何导致动脉粥样硬化?2003年中山大学医学院博士生入学考试-生物化学一、选择题1、限制性内切酶识别的序列是A、粘性末端B、回文结构C、TATAATD、聚腺苷酸E、AATAA2、由氨基酸生成糖的过程称为A、糖酵解B、糖原分解作用C、糖异生作用D、糖原合成作用3、四氢叶酸不是下列哪种基团或化合物的载体?A、-CHOB、CO2C、-CH=D、-CH3E、-CH=NH ;4、细胞色素aa3的重要特点是A、可使电子直接传递给氧分子的细胞色素氧化酶B、以铁卟啉为辅基的递氢体C、是递电子的不需氧脱氢酶D、是分子中含铜的递氢体E、含有核黄素5、转氨酶的辅酶含有哪种维生素?A、Vit B1B、Vit B2C、Vit PPD、Vit B6E、Vit B126、下列哪种成分的含量高,则双螺旋DNA的溶解温度也增高?A、G+GB、C+TC、A+TD、A+GE、A+C7、胆红素在肝脏中的转变主要是A、转变成胆绿素B、受加单氧化酶体系氧化C、与葡萄糖醛酸结合D、与清蛋白结合E、直接排除8、密度最低的血浆脂蛋白是A、VLDLB、C、MDLD、HDLE、CM9、操纵子的基因表达调控系统属于A、复制水平调节B、转录水平调节C、翻译水平调节D、逆转录水平调节E、翻译后水平调节10、关于DNA复制,下列哪项叙述是错误的?A、原料是4种dNTPB、链的合成方向是C、以DNA链为模板D、复制的DNA与亲代的DNA完全相同E、复制的DNA需要剪切加工二、名词解释1、酮体2、基因3、肽链4、锌指5、核酶6、糖异生7、胆色素8、复制叉9、Km 10、一碳单位三、简答题1、什么是反式作用因子?2、简述脂蛋白的种类。
蛋白质(一)

R
+
R
R
_
OHH+
+
OHH+
_
H3N—CH—COOH
H3N—CH—COO
H2N—CH—COO
在酸性溶液中 的氨基酸
在晶体状态或水 溶液中的氨基酸
在碱性溶液中 的氨基酸
等电点时,氨基酸带等量正、负电荷,净电荷 为零,易聚集沉淀。利用这一性质可以分离氨基酸。
高于或低于等电点时,氨基酸带净的正电荷或 负电荷,由于相同电荷互相排斥,不易聚集沉淀。
核酸也具有紫外吸收的能力,可在最大吸收波长(260 nm)处测定核酸的浓度。
P习题集15页 2010年江苏省初赛第66题 如果使用紫外分光光度计对蛋白质和核酸进行定性和 定量分析,需要将波长调到( ) A.蛋白质:260 nm;核酸:280 nm B.蛋白质:280 nm;核酸:260 nm C.都调到260 nm D.都调到280 nm
A. 赖氨酸 B. 蛋氨酸 C. 谷氨酸 D. 色氨酸 E. 苏氨酸
(答案:C)
2.2.3 氨基酸的一般物理性质
P6 自己看
谷氨酸钠有鲜味,是味精的主要成分。
2.2.4 氨基酸的两性解离和等电点
COOH
COO+H N 3
H2N — C— H R
不带电形式
— C— H
R
两性离子形式
—NH3+ 能放出质子(H+),可视为酸 —COO-能接受质子(H+),可视为碱
无论在晶体状态还是水溶液中,AA主要以两性离子 形式存在,不带电荷的中性分子为数极少。
R
+
R
R
_
OHH+
+
蛋白质的一级结构

H H N CH C NHNH2 +H2N CH C OH NH2NH2 2 C -端 氨 基 酸 氨基酸酰肼
R
C-端氨基酸分析法--羧肽酶 (carboxyp它能从多肽链的C-端逐个的 水解AA。根据不同的反应时间测出酶水解所释放出的氨 基酸种类和数量,从而知道蛋白质的C-末端残基顺序。 目前常用的羧肽酶有四种:A,B,C和Y;A和B来自胰脏; C来自柑桔叶;Y来自面包酵母。 羧肽酶A能水解除Pro,Arg和Lys以外的所有C-末端氨基酸 残基;B只能水解Arg和Lys为C-末端残基的肽键。
顺序同源的生物学意义
在不同种属来源的细胞色素c中,可以变换的 氯基酸残基数目与这些种属在系统发生上的位 置有密切关系,即在进化位置上相距愈远,则 氨基酸顺序之间的差别愈大; 反之,亲缘关系 越近,其顺序同源性越大。 细胞色素c的氨基酸顺序分析资料己被用来核 对各个物种之间的分类学关系,以及绘制系统 发生树-进化树。 根据进化树不仅可以研究从单细胞有机体到多 细胞有机体的生物进化过程,而且可以粗略估 计现存的各类种属生物在进化中的分歧时间。
蛋白质的结构
蛋白质是由一条或多条多肽 (polypeptide)链以特殊方式结合而成 的生物大分子。 蛋白质与多肽并无严格的界线,通常是 将分子量在6000道尔顿以上的多肽称为 蛋白质。 蛋白质分子量变化范围很大, 从大约 6000到1000000道尔顿甚至更大。
示例
虾红素
木瓜蛋白酶
6.舒缓激肽:促进血管舒张,促进水、钠离子的排出。
7.脑啡肽:为五肽,具有镇痛作用。
在正常人的脑内存在内源性脑啡肽和脑啡肽受体。在正常情况下,内 源性脑啡肽作用于脑啡肽受体,调节着人的情绪和行为。人在吸食海洛因 后,抑制了内源性脑啡肽的生成,逐渐形成在海洛因作用下的平衡状态, 一旦停用就会出现不安、焦虑、忽冷忽热、起鸡皮疙瘩、流泪、流涕、出 汗、恶心、呕吐、腹痛、腹 泻等。冰毒和摇头丸在药理作用上属中枢兴 奋药,毁坏人的神经中枢。
食物蛋白质含量表1

鸡爪 百页 牛肚 羊肉 鸭舌 鸭肉 鸭肝 牛奶 豆浆 麦乳精 啤酒 韭黄 青椒 蘑菇 草菇 金针菇 香菇 西兰花 青豆 荷兰豆 豆苗 蚕豆 草头 紫菜 萝卜 豆芽 小红萝卜
100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100
蛋白质 (克) 6.7 9.7 6.1 7.4 9.6 1.1 11.1 7.3 7.3 8.3 11.8 13 9.6 16.9 17.1 20 14.6 15.5 20.1 21.2 16.6 16.6 23.3 18.2 23.3
脂肪(克) 0.8 1.7 0.2 1.4 4.3 0.4 0.4 5.8 1.4 1.6 15 14.7 0.1 29.2 6.3 4 2.9 4.8 10.2 0.4 14.2 14.2 1.2 3.5 1.2
1 0.1 0.3 2.1 15.2 2.3 3.4 2.4 0 2.4 0.2 3 7 1 12.1 4.1 23.8 64 57.2 0.8 0 0 10 0 10
345 / 82.14 261 / 62.14 303 / 72.14 581 / 138.33 421 / 100.24 1432 / 340.95 401 / 95.48 309 / 73.57 323 / 76.9 318 / 75.71 201 / 47.86 501 / 119.29 365 / 86.9 295 / 70.24 780 / 185.71 175 / 41.67 1912 / 455.24 340 / 80.95 785 / 186.9 1340 / 319.05 2320 / 552.38 34 / 8.1 376 / 89.52 376 / 89.52 166 / 39.52 374 / 89.05 375 / 89.29
蛋白质一级结构

蛋白质一级结构蛋白质是组成生物体的重要有机化合物,不仅参与维持生命活动,还具有结构和功能的多样性。
蛋白质的一级结构是指由氨基酸按照特定的序列线性排列而成的单链多肽。
这篇文章将以2000字为篇幅,简要介绍蛋白质一级结构的组成、特征和相关知识。
蛋白质是由20种氨基酸组成的,每一种氨基酸都包含有一碳酸基、一氨基基团、一个氢原子和一个R基团。
R基团的不同决定了氨基酸的性质和功能。
蛋白质的一级结构由氨基酸以特定的顺序连接而成,形成了具有特定功能的多肽链。
例如,胰岛素是由51个氨基酸组成的多肽,它的一级结构决定了其在调节血糖水平中的重要作用。
蛋白质的一级结构在其它结构层次起着重要的作用。
它决定了蛋白质在空间中的折叠和三维构象,从而影响了蛋白质的功能和性质。
一级结构中的序列特征决定了氨基酸之间的相互作用,包括氢键、离子键、疏水作用等。
这些相互作用进一步促使蛋白质折叠为特定的二级、三级和四级结构。
蛋白质的一级结构可由基因组中的DNA序列编码。
DNA中的三个碱基组成一个密码子,每个密码子对应一个具体的氨基酸。
核糖体通过翻译作用将DNA中的信息转录为多肽链,从而形成蛋白质的一级结构。
这一过程称为蛋白质合成。
蛋白质的一级结构具有一定的稳定性和灵活性。
稳定性体现在将氨基酸正确地连接为一条线性多肽链,而灵活性则体现在氨基酸之间的旋转自由度。
通过改变一级结构中的氨基酸序列,可以改变蛋白质的性质和功能。
这种改变可以是突变导致的,也可以是人为设计的。
例如,某些蛋白质的一级结构突变会导致蛋白质功能的丧失或改变,从而引发疾病的发生。
此外,蛋白质的一级结构在进化中发挥着重要的作用。
由于氨基酸序列的差异,蛋白质在不同生物体中表现出不同的性质和功能。
在进化过程中,与环境适应性密切相关的蛋白质的一级结构可能会发生变化。
这种变化有时可以通过比较不同物种的氨基酸序列来研究。
总之,蛋白质的一级结构是由氨基酸按特定顺序线性排列形成的单链多肽。
它具有决定蛋白质折叠和功能的重要作用。
生化第一章和第二章(新)

生化第一第二章一、名词解释1.α-螺旋:.α-螺旋为蛋白质的二级结构类型之一。
在α-螺旋中,多肽链围绕中心轴作顺时针方向的螺旋上升,即所谓右手螺旋。
每3.6个氨基酸残基上升一圈,氨基酸残基的侧链伸向螺旋的外侧,α-螺旋的稳定依靠上下肽之间所形成的氢键维系。
2.脱氧核苷酸:脱氧核苷与磷酸通过酯键结合即构成脱氧核苷酸,它们是构成DNA的基本结构单位,包括dAMP、dGMP、dTMP、dCMP四种。
3.TφC环:TφC环是tRNA的茎环结构之一,因含有假尿嘧啶(φ)而命名。
4. 小分子核糖核蛋白体:由snRNA和核内蛋白质组成,作为RNA剪接的场所。
5.三联体密码: mRNA分子上从5'至3'方向,由AUG开始,每3个核苷酸为一组,决定肽链上某一个氨基酸或蛋白质合成的起始、终止信号,称为三联体密码。
6. 结构域:分子量大的蛋白质三级结构常可分割成一个和数个球状或纤维状的区域,折叠得较为紧密,称为结构域。
7.核酶:具有自我催化能力的RNA分子自身可以进行分子的剪接,这种具有催化作用的RNA被称为核酶。
8.β折叠:在多肽链β折叠结构中,每个肽单元以Cα为旋转点,依次折叠成锯齿状结构,氨基酸残基侧链交替地位于锯齿状结构的上下方。
两条以上肽链或一条肽链内地若干肽段的锯齿状结构可平行排列,其走向可相同,也可相反。
9. Z-DNA:这种DNA是左手螺旋。
在体内,不同构象的DNA在功能上有所差异,可能参与基因表达的调节和控制。
10.Heterogeneous RNA (hnRNA):不均一核糖核酸HnRNA molecules are the primary transcripts of DNA and are the precursors of mRNA. It is processed by splicing and modification to form mRNA.11.脱氧核苷酸:脱氧核苷与磷酸通过酯键结合即构成脱氧核苷酸,它们是构成DNA的基本结构单位,包括dAMP、dGMP、dTMP、dCMP四种。
生化大题及答案

生化大题及答案1.什么是蛋白质的一级结构?为什么说蛋白质的一级结构决定其空间结构?答:蛋白质一级结构指蛋白质多肽链中氨基酸残基的排列顺序。
因为蛋白质分子肽链的排列顺序包含了自动形成复杂的三维结构(即正确的空间构象)所需要的全部信息,所以一级结构决定其高级结构2.什么是蛋白质的空间结构?蛋白质的空间结构与其生物功能有何关系?答:蛋白质的空间结构是指蛋白质分子中原子和基团在三维空间上的排列、分布及肽链走向。
蛋白质的空间结构决定蛋白质的功能。
空间结构与蛋白质各自的功能是相适应的3.蛋白质的α—螺旋结构和β—折叠结构有何特点?答A(1)多肽链主链绕中心轴旋转,形成棒状螺旋结构,每个螺旋含有3.6 个氨基酸残基,螺距为0.54nm,氨基酸之间的轴心距为0.15nm.。
(2)α-螺旋结构的稳定主要靠链内氢键,每个氨基酸的N H 与前面第四个氨基酸的C=O 形成氢键。
(3)天然蛋白质的α-螺旋结构大都为右手螺旋。
B β-折叠结构又称为β-片层结构,它是肽链主链或某一肽段的一种相当伸展的结构,多肽链呈扇面状折叠。
(1)两条或多条几乎完全伸展的多肽链(或肽段)侧向聚集在一起,通过相邻肽链主链上的氨基和羰基之间形成的氢键连接成片层结构并维持结构的稳定。
(2)氨基酸之间的轴心距为0.35nm(反平行式)和0.325nm(平行式)。
(3)β-折叠结构有平行排列和反平行排列两种。
5.举例说明蛋白质的结构与其功能之间的关系。
答:蛋白质的生物学功能从根本上来说取决于它的一级结构。
蛋白质的生物学功能是蛋白质分子的天然构象所具有的属性或所表现的性质。
一级结构相同的蛋白质,其功能也相同,二者之间有统一性和相适应性。
6.什么是蛋白质的变性作用和复性作用?蛋白质变性后哪些性质会发生改变?答:蛋白质变性作用是指在某些因素的影响下,蛋白质分子的空间构象被破坏,并导致其性质和生物活性改变的现象。
蛋白质变性后会发生以下几方面的变化:(1)生物活性丧失;(2)理化性质的改变,包括:溶解度降低,因为疏水侧链基团暴露;结晶能力丧失;分子形状改变,由球状分子变成松散结构,分子不对称性加大;粘度增加;光学性质发生改变,如旋光性、紫外吸收光谱等均有所改变。
蛋白质的一级结构

蛋白质的一级结构●一般将由50个氨基酸以上的氨基酸残基组成的肽称为蛋白质。
按照合成场所,天然存在的活性肽可分为核糖体合成肽和非核糖体合成肽。
●蛋白质的化学组成和分类●蛋白质平均含氮量为16%。
●缀合蛋白质:除含有氨基酸外,还含有其他化学成分作为其永久性结构的一部分。
其中非蛋白质称为辅基或配体,通常辅基在蛋白质的功能方面起重要作用。
●辅基与蛋白质共价结合需水解才能去除,除去辅基后,剩下部分称为脱辅基蛋白质。
●根据形态和溶解度可分为三大类●纤维状蛋白质:主要起结构作用●球状蛋白质:大多数可溶性蛋白质●膜蛋白:不溶于水但溶于去污剂,所含亲水氨基酸残基较多。
●单体蛋白质:仅由一条肽链构成●寡聚蛋白质或多聚蛋白质:两条或多条肽链构成,每条多肽链称为亚基,亚基之间通过非共价力连接。
●氨基酸顺序的多样性●具有不同功能的蛋白质总是具有不同的氨基酸序列●功能相同或相似的蛋白质具有相似的氨基酸序列,这些蛋白质被称为同源蛋白质●泛素:76个残基组成,参与调节其他蛋白质的降解,人和果蝇的泛素氨基酸序列完全一致●蛋白质分子结构的组织层次●一级结构:蛋白质肽链的氨基酸残基排列顺序或氨基酸序列。
一级结构也称共价结构或化学结构。
●二级结构:肽链主链中局部肽段借助氢键形成的周期性结构,包括α-螺旋、β-折叠、β-转角●三级结构:多肽链借助非共价力折叠成具有特定走向的完整球状实体。
●四级结构:具有三级结构的亚基借助非共价力彼此缔合成寡聚蛋白质。
●一级结构举例及简要表达式●胰岛素:胰岛β细胞分泌的一种激素。
含两条多肽链,A链(约含21个残基)和B链(约含30个残基),两条多肽链通过链间二硫键连接起来,其中A链还有一个链内二硫键。
●合成过程:生物体内在核糖体上初合成时,是一条相对分子质量比胰岛素大一倍多的单链多肽,称为前胰岛素原。
是胰岛素原的前身,在它的N端(即胰岛素B链的N端)比胰岛素原多一段肽链(约含20个残基),称为信号肽。
信号肽引导新生多肽链进入内质网腔后,立即被酶切除,剩余的多肽链折叠成含3个二硫键的胰岛素原。
举例说明蛋白质结构和功能的关系

举例说明蛋白质结构和功能的关系示例文章篇一:嘿,同学们!今天咱们来聊聊蛋白质这个超级神奇的东西,特别是它的结构和功能的关系。
你们想想看,蛋白质就像是一个个超级小战士,它们有着不同的样子和本领。
先来说说蛋白质的结构吧!就像我们盖房子,房子的结构决定了它能住多少人,能有多牢固。
蛋白质也有自己的“房子结构”。
有的蛋白质结构简单,就像一个小木屋,虽然简单但也能发挥作用。
比如一些小的激素蛋白质,它们结构不那么复杂,但是在我们身体里传递消息可厉害啦!这难道不神奇吗?还有的蛋白质结构复杂得像一座大城堡!它们由好多好多的部分组成,每一部分都有自己的任务。
就比如说血红蛋白,它就像一个运输大队,专门负责把氧气运送到身体的各个角落。
它的结构那么精妙,才能完成这么重要的任务呀!那蛋白质的结构怎么就决定了它的功能呢?这就好比不同的工具,锤子是用来敲钉子的,因为它的形状和材质适合敲;而剪刀是用来剪纸的,因为它的构造就是为了剪开东西。
蛋白质也是这样啊!如果蛋白质的结构不合适,就没法完成特定的功能。
比如说,酶这种蛋白质,它们的结构就像一把专门的钥匙,能打开特定的“锁”,也就是参与特定的化学反应。
如果这把“钥匙”变形了,还能打开那把“锁”吗?当然不能啦!再想想看,抗体蛋白就像是我们身体里的小卫士,它们的结构让它们能够准确地识别和抓住入侵的病菌。
要是结构变了,还能这么厉害地保护我们吗?所以说,蛋白质的结构和功能的关系,那可真是紧密得不得了!结构就像是蛋白质的“身份证”,决定了它们能做什么,能做得有多好。
总之,蛋白质的结构和功能相互依存,缺一不可。
只有合适的结构,才能让蛋白质在我们身体里发挥出神奇又重要的作用!同学们,现在你们是不是对蛋白质的结构和功能的关系更清楚啦?示例文章篇二:哎呀呀,蛋白质这个东西可神奇啦!你知道吗?蛋白质的结构就像是一座精心搭建的城堡,而它的功能就像是城堡里的各种设施和活动。
先来说说蛋白质的结构吧。
蛋白质就像一个复杂的拼图,由一个个小小的“拼图块”组成,这些“拼图块”就是氨基酸。
举例说明蛋白质一级结构空间结构与功能的关系

举例说明蛋白质一级结构空间结
构与功能的关系
蛋白质的结构与功能的关系
1.蛋白质一级结构与功能的关系(1)一级结构是空间构象的基础,蛋白质一级结构是空间构象和功能的基础。
(2)一级结构相似的蛋白质具有相似的高级结构与功能
(3)氨基酸序列提供重要的生物进化信息
(4)重要蛋白质的氨基酸序列改变可引起疾病
若一级结构发生改变影响其功能,称分子病。
如血红蛋白β亚基的第6位氨基酸由谷氨酸转变成缬氨酸后,可导致镰刀形贫血。
但并非一级结构的每个氨基酸都很重要。
2.蛋白质高级结构与功能的关系
蛋白质空间构象与功能有密切关系。
生物体内蛋白质的合成、加工和成熟是一个复杂的过程,其中多肽链的正确折叠对其正确构象的形成和功能的发挥至关重要。
若蛋白质的折叠发生错误,尽管其一级结构不变,但蛋白质的构象发生改变,仍可影响其功能,严重时可导致疾病的发生,称为蛋白质构象疾病医学教育|网搜集整理。
成年人红细胞中的血红蛋白主要由两条α肽链和两条β肽链组成(α2β2),α链含141个氨基酸残基,β链含146个氨基酸残基。
胎儿期主要为α2γ2,胚胎期主要为α2ε2.血红蛋白的4条肽链组成4个亚基,各亚基构象变化可影响亚基与氧的结合。
疯牛病是由朊病毒蛋白(prp)引起的一组人和动物神经的退行性病变,具有传染性、遗传性或散在发病的特点。
其致病的生化机制是生物体内正常α螺旋形式的prpc转变成了异常的β-折叠形式的prpsc.。
蛋白质一级结构测序-1

基 • 目前常用的羧肽酶有四种:A,B,C和Y;
酸 A和B来自胰脏;C来自柑桔叶;Y来自
测 定
面包酵母。 • 羧肽酶A能水解除Pro,Arg和Lys以外的
所有C-末端氨基酸残基;B只能水解
Arg和Lys为C-末端残基的肽键。
E.多肽链断裂成多个肽段,可采用两种或
蛋 多种不同的断裂方法将多肽样品断裂成
结 构
多肽链(亚基).
的
测
定
C.二硫键的断裂
蛋 几条多肽链通过二硫键交联在一起。可
白 质
在8mol/L尿素或6mol/L盐酸胍存在下,
一 用过量的-巯基乙醇(还原法)处理,使
级 结 构
二硫键还原为巯基,然后用烷基化试剂 (ICH2COOH)保护生成的巯基,以
的 防止它重新被氧化。
测
定
SH-CH2-CH2-OH
巯
O
-SH
基 (
-OOC CHCH2 SH NH3+
) 的
C H 2O C C-O l OC CHCH2 SOCCH2
NH3+
O
CH2Cl
-OOC CH CH 2 SCH 2
O
NH 3+
ICH2CNH2 -OOC CHCH2 SCH2CNH2
NH3+
O
保 护 作用:这些反应可用于巯基的保护。
SS
多
肽
CH3 S:
链
CH2
的 选
CH2 O
RO
Br-
NH CH C NH CH C + Br C+ N
择
CH3 S+ C N
性
CH2
降 解
CH2 O
生物化学第一章 蛋白质——结构与功能的关系
Edman法(苯异硫氰酸脂反应)
氨肽酶法
C端 肼解法
还原法
羧肽酶法
丹磺酰氯法:在碱性条件下,丹磺酰氯(二甲氨基萘磺酰氯)可以与N-端氨基 酸的游离氨基作用,得到丹磺酰-氨基酸。此法的优点是丹磺 酰-氨基酸有很强的荧光性质,检测灵敏度可以达到110-9 mol。
脑肽
•已发现的有几十种,其中一类5肽化合物--脑啡肽; 31肽化合物--β内啡肽;11肽--P物质
•脑啡肽的镇痛作用比吗啡还强,同时是生物体自身合成 的“鸦片剂”,所以不具成瘾性,目前已被人工合成
•β内啡肽的镇痛作用比脑啡肽还强,可用于晚期癌症的 解痛,同时其对精神分裂症及忧郁症病人的症状有明显 的改善作用;
Arg
缩,有催产及排乳功能,并促进遗
Gly NH2
忘; 加压素:使血管平滑肌收缩,增加
牛加压素
血压,减少排尿,故又叫抗利尿素; 并增强记忆
(3)、神经肽
➢·脑啡肽
+H3N-Tyr-Gly-Gly-Phe-Met-COO-
➢·Leo脑啡肽
+H3N-Tyr-Gly-Gly-Phe-Leu-COO-
➢·有镇痛麻醉作用。
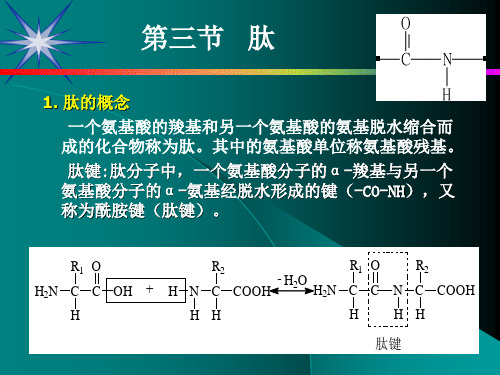
由于肽键的双键特性使得该键不能旋转,保持酰胺基处 于平面。所以参与肽键形成的2个原子以及另外4个取代成员: 羰基氧原子、酰胺氢原子、以及2个相邻的-碳原子构成的肽 单位处于同一平面,该平面称为肽平面,或称为酰胺平面。
肽键的部分双键特性足以防止肽健C-N的旋转,但蛋白 质中的每一个N-C键和每一个C-N键都可以自由旋转。所以 肽平面内的两个C可以处于顺式构型或反式构型。
2.蛋白质的一级结构特点
蛋白质的一级结构(Primary structure)包括: (1)组成蛋白质的多肽链数目. (2)多肽链的氨基酸顺序, (3)多肽链内或链间二硫键的数目和位置。
.4蛋白质是生命活动的主要承担者(第一课时)(教师版)-高一生物同步精品讲义(人教2019必修1)

2.4 蛋白质是生命活动的主要承担者(1)目标导航2.阐明氨基酸是蛋白质的基本组成单位,说出组成蛋白质的氨基酸有21种。
3.分析氨基酸的结构特点,归纳、概括氨基酸的结构通式。
4.举例说明根据氨基酸在人体细胞能否合成,氨基酸被分为必需氨基酸和非必需氨基酸。
知识精讲知识点01 蛋白质的功能1.蛋白质是目前已知的结构最复杂、功能最多样的分子。
细胞核中的遗传信息,往往要表达成蛋白质才能起作用。
蛋白质是生命活动的主要承担者。
2.不同功能需要不同蛋白质完成:种类功能举例结构蛋白构成细胞和生物体结构的重要物质羽毛、肌肉、蛛丝、头发等含有结构蛋白催化蛋白细胞中的化学反应离不开酶作用绝大多数酶是蛋白质运输蛋白运输物质的作用血红蛋白能运输氧气信息传递蛋白能够调节机体的生命活动胰岛素等蛋白质类激素防御蛋白有些蛋白质有免疫功能抗体可抵御抗原的侵害【视野拓展】德国研究人员进行的最新动物实验发现,“关闭”一种调节脂类代谢的蛋白质,可以让小鼠多吃不胖。
德国马克斯·普朗克研究所等机构研究人员发现,当小鼠通过高脂饮食变胖时,某种特定长度的神经酰胺分子会在肝脏积聚,而这种脂类物质由神经酰胺合成酶5和神经酰胺合成酶6两种蛋白质合成。
实验显示,如果“关闭”神经酰胺合成酶6,使其无法发挥作用,肥胖小鼠虽然继续高脂饮食,肝脏却没有脂肪堆积,体重还出现下降,体内糖代谢也有所改善;但“关闭”神经酰胺合成酶5并不会出现上述效果。
知识点02 氨基酸的种类和结构1.组成生物体蛋白质的的氨基酸有21种。
2.蛋白质的基本组成元素是C、H、O、N。
3.每种氨基酸分子中至少都有一个氨基(—NH2)和一个羧基(—COOH),并且都有一个氨基和一个羧基连接在同一个碳原子上。
连接着一个氨基和一个羧基的碳原子还连接着一个氢原子和一个侧链基团(R),各种氨基酸之间的区别在于R基不同。
【易错提示】1.氨基、羧基和侧链基因在书写时要先写“—”,不可省略。
2.氨基酸氨基、羧基的书写方法结构式书写方法1 结构式书写方法2 化学简式书写方法氨基“—NH2”或“H2N—”羧基“—COOH”或“HOOC—”知识点03 必需氨基酸和非必需氨基酸1.划分必需氨基酸和必需氨基酸的依据是氨基酸是否能在人体细胞合成。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Company Logo
Logo
完全蛋白
概念:一类所含必需氨基
酸种类齐全,数量充足, 彼此比例适当的优质蛋白 质。
功效:不但维持人体健康,
还促进生长发育。
含有这类蛋白的食物:
奶、蛋、鱼、肉等
Company Logo
Logo
半完全蛋白
概念:含有的必需氨基酸
种类尚全,但含量不均, 相互比例不合适.。
Company Logo
Logo
乳清蛋白
乳清蛋白越来越受到人们关注
低胆固醇 高蛋白质 低脂肪
乳清蛋白质 的特点
高营养
易被消化 低乳糖
Company Logo
Logo
乳清蛋白
β-乳球蛋白 α-乳白蛋白
乳过氧化物酶
乳铁蛋白 生长因子
Company Logo
Logo
1.必需氨基酸和支链氨基酸的来 源
也不能促进生长发育。但 对人体也是很重要的蛋白 质Leabharlann 含有这类蛋白:胶原蛋白
Company Logo
Logo 免疫球蛋白:具有抗体活性或化学结构与抗体相似的球蛋白,分
子中含有糖,属于糖蛋白
Company Logo
Logo
免疫球蛋白
生物特性
• 抗体Ig能识别 抗原,并与之发 生特异性结合
生物活性
• Ig或Fab段与抗原决 定簇立体构型吻合 • 两者所带的电荷互 相对应
酸奶
乳饮 料
一般 食品
乳清蛋白的实 际应用
功能 食品
肉类 制品
配方 食品
Company Logo
Logo 大豆蛋白 大豆中的蛋白质:
1.B-伴大豆球蛋白(Bcong ycinin) 2.大豆球蛋白(glyc-inin) 大豆蛋白结构复杂,这里 就不展开赘述了。
Company Logo
Logo 大豆蛋白
Company Logo
Logo
小麦蛋白功能
抑制胆固醇上升作用
促进胰岛素分泌作用
调节人的血糖
降血压作用
Company Logo
Logo
应用:一些功能保健食品,面制 品,肉类物质,奶产品等中
Company Logo
Logo
胶原蛋白
1.加速血红蛋白和红细胞生成 2.预防动脉硬化、高血压等心血管 疾病 1.抑制癌细胞的增殖或转移,抗癌 作用明显 2.预防老年痴呆症 帮助钙质吸收,有利于生长发育
功效:仅能维持生命的一
类蛋白质。
含有这类蛋白的食物:
小麦,稻谷等一些谷物中
半完全蛋白和完全蛋白区 别:/show/ZtKWOd2aKKgaNWXy.html
Company Logo
Logo
不完全蛋白
概念:所含有的必需氨基
酸种类不全的一类蛋白质。
功效:虽既不能维持生命
胶原蛋白 的营养功 能
Company Logo
Logo
应用:一些保健功能食品,美容制品等。
Company Logo
Logo
Logo
举例说明食品中常见蛋白质和营养功能
Logo
Contents
营养学上将蛋白质分为以下三类: 完全蛋白的概念 举例完全蛋白的种类和特性
完全蛋白
半完全蛋白
半完全蛋白概念 举例半完全蛋白种类,特性
不完全蛋白
不完全蛋白概念 举例不完全蛋白种类,特性
Company Logo
Logo
概念
赖氨酸(Lys) 蛋氨酸(Met) 亮氨酸(Leu) 色氨酸(Trp) 苏氨酸(Thr) 缬氨酸(Val) 异亮氨酸(Ile) 苯丙氨酸(Phe)
2.促进蛋白质的合成 β-乳球蛋白 3.减少蛋白质的分解 4.凝胶性优于乳白蛋白 5.许多食品系统中功能性高的配料
Company Logo
Logo
1.必需氨基酸和支链氨基酸的来 源
α-乳白蛋白 2.唯一一种能结合钙的乳清蛋 白成分
Company Logo
Logo
乳清蛋白
乳清蛋白:应用很广泛,下面就是一些乳清蛋白在食品上的应 用
活性
• IgY具有抗体活 性
• 引起特异性的结合
应用:婴幼儿
食品和老年食品 中
实际功能
• 提高免疫力 • 增强人体抵抗力 • 延缓衰老
Company Logo
Logo
乳清蛋白
牛奶中提取出来的一 种蛋白质 干酪生产过程中所产 生的副产品乳清经过 特殊工艺浓缩精制而 得的一类蛋白质 由一些细小而紧密的 球状蛋白质组成
降血压作用
促进脂肪代谢
降脂作用
大豆蛋白 特点
此处添加标题2
抑瘤作用
减肥作用
抗氧化作用
大豆蛋白应用:婴幼儿奶粉,保健食品
Company Logo
Logo 小麦蛋白的组成
少量脂肪
麦醇溶蛋白 麦醇溶蛋白
43.02%
麦谷蛋白
其他蛋白
39.1%
麦谷蛋白
其他蛋白
TYPE_02 少量淀粉
TYPE_02 少量糖 4.4%
