217-克必信简短处方资料 通用名称:注射用达托霉素
达托霉素介绍

•
感染性心内膜炎治疗新药———达托霉素,中 国 临 床 药 理 学 杂 志 第26卷 第6期 2010年6月(总第128期)
手术指征
协和住院医师手册 第二版
ABX指南
肾功能不全患者的药代动力学
•肥胖:不用调整剂量 •儿童:<18岁无数据 •老人:无调整剂量的依据,>65岁有效率低,不良反应高
感染性心内膜炎-天然瓣膜-培养阳性
桑德福抗微生物治疗指南 43版
感染性心内膜炎-天然瓣膜-培养阳性
桑德福抗微生物治疗指南 43版
治疗感染性心内膜炎的临床研究
禁忌:过敏
妊娠分级: B级 哺乳: 慎用 药物过量:透析可清除 血透:4小时可清除15%,高通量透析会增加清除量 腹透:48h可消除11%
说明书
不良反应
复杂性皮肤感染 不良反应发生率>2% 金黄色葡萄球菌血症/心内膜炎 不良反应发生率>5%
说明书
药物相互作用
• 协同作用(体外研究) – 氨基糖苷类 – Β-内酰胺类药物 – 利福平 • 不是细胞色素P450的阻滞剂或诱导剂
• 体外活性:很强的广谱抗革兰阳性菌的活性,但对革兰阴性菌无效。
– – – – 葡萄球菌:包括MRSA、MRSE 链球菌:包括青霉素敏感和耐药的肺炎链球菌、化脓性链球菌、无乳链球菌和草绿色链球菌 肠球菌:包括万古霉素敏感和耐药的菌株 艰难梭状芽胞杆菌和痤疮丙酸杆菌
•
体内活性:
– – – – – 艰难梭菌引起的仓鼠大肠验证模型,达托霉素比万古霉素强100倍 MRS引起的大鼠心内膜炎,优于万古霉素 金葡菌与肠球菌引起的小鼠骨感染,有效 肺炎链球菌和耐喹诺酮菌株引起的家兔脑膜炎模型,较好 肺炎链球菌引起的支气管肺泡肺炎模型,无效 由于肺部气道具有独特组织构造,其含有复杂的
达托霉素的作用机制和药物来源的研究进展

达托霉素的作用机制和药物来源的研究进展洪娟;刘佳佳【摘要】Daptomycin was a novel lipopeptide antibiotic used in the treatment of certain infections caused by multi - resistant organisms which were Gram - positive. The mechanism of actions of daptomycin and its drug source were summe- rized, and the virous synthesis methods of daptomycin, such as precursor induce, biosynthesis, solid and two methods for its analogues -solid synthesis and chemical enzyme synthesis were reviewed and compared synthesis%达托霉素是一种环脂肽类抗生素,对耐药性革兰氏阳性细菌具有强大杀灭作用。
本文详细介绍了达托霉素的作用机制,总结了其药物来源,分别对达托霉素的各种合成方法——前体诱导法、生物合成、固液相合成法及其类似物的全固相合成法和化学酶法进行了概述和比较。
【期刊名称】《广州化工》【年(卷),期】2012(040)009【总页数】3页(P28-30)【关键词】达托霉素;抗生素;耐药性【作者】洪娟;刘佳佳【作者单位】中南大学化学化工学院,湖南长沙410083;中南大学化学化工学院,湖南长沙410083【正文语种】中文【中图分类】R978.1近年来,由于抗生素的滥用,细菌的耐药性日趋强大.临床上出现的耐甲西林金黄葡萄球菌(MRSA),耐万古霉素的肠球菌(VRE),糖肽类敏感的金葡菌(GISA)等是目前医院中传播率和致死率很高的病原体[1].其中的MRSA的强毒性、多重及高度耐药性、传播快等特征,一旦发生感染,病情就难以控制,某些发达国家已将其与烈性传染病对等[2].达托霉素是由美国Lilly公司最初研究,Cubist制药公司开发的一种环脂肽类抗生素,对革兰阳性耐药菌有活性且具更好抗菌谱和较低耐药性[3],能成功应对上述耐药菌且良好疗效、制剂简单、毒副作用小.本文对达托霉素的作用机制及其药物来源的研究进展进行了综述.达托霉素分子由连接到一个环状13-氨基酸肽的N-末端色氨酸上的癸酰基侧链构成[4].肽环由氨基酸和非蛋白质源氨基酸(如:Asn,OmAsp,3mGlu等)按照酰胺键或酯键构成肽环或羧酸肽环.环脂肽类抗生素分子结构中既含有亲水性氨基酸,又含有脂链以及疏水性氨基酸,这就决定了其两亲性的生物学特性.达托霉素偏酸性,在中性pH下分子带负电荷,因而具有极好的水溶性.同时,脂链和疏水性基团的存在,使得其有一定的脂溶性,容易与细菌磷脂层反应,因而有良好的抗菌效果[5].达托霉素的具体作用机制现在尚无定论,许多研究人员对其独特的作用机制行了研究.达托霉素为Ca2+浓度依赖型抗生素[6],在缺乏Ca2+时,达托霉素的抗菌活性很小或几乎没有.只有Ca2+浓度为1.25 mmol/L时抗菌活性才达到最大.圆二色谱和核磁共振研究结果显示,达托霉素与Ca2+结合后结构发生改变,增加其分子的两亲性减少带电荷,使其更有利于与细菌磷脂反应.Schriever CA[7]研究认为达托霉素使细胞膜去极化而使细菌细胞死亡:首先,达托霉素与Ca2+结合,而后其亲脂尾部插入细菌细胞质膜中;第二步,达托霉素寡聚化,使其亲脂尾部在细菌细胞膜上起"离子通道"的作用,破坏了细胞膜,使大量胞内离子的外流;第三步,K+的流失使细胞快速除极,破坏离子梯度.缺乏合适的离子梯度,细菌胞内的三磷酸腺苷合成受到阻遏,失去合成DNA、RNA及大分子蛋白质的能力,细胞死亡.Boarctti M[8]的研究表明,达托霉素的作用靶点不是青霉素结合蛋白,而是结合在细菌细胞膜上,通过扰乱细胞膜对氨基酸的转运,从而阻碍细菌细胞壁肽聚糖的磷壁(酸)脂质(LTA)的生物合成,干扰细胞的复制,导致细菌迅速死亡.卜一珊等[9]对经达托霉素处理的金葡菌进行电镜扫描,相片显示,达托霉素可以在细胞没有发生自溶的情况下迅速杀死细胞,这样就避免了因细胞磷壁酸、肽聚糖和DNA的释放而引起的炎症反应.综上,由于达托霉素的作用机制与现已上市的各类抗菌药物都不相同,这意味着达托霉素将不易受到来自其它抗生素所致交叉耐药性的影响.达托霉素的最早获得是在20世纪80年代它是玫瑰孢链霉菌(Streptomyces roseosporus)发酵产生的环十脂肽类物质经化学修饰的产物[3].在玫瑰孢链霉菌发酵过程中加入正癸酸,利用筛选的癸酸抗性突变株流加法发酵以及激光诱导突变株结合链霉素抗性筛选生产达托霉素的方法都将产量提高35%以上.采用广布多点的方法分散添加癸酸,产出的达托霉素为主要成分,并易于纯化.王玮等[3]研究表明,Streptomyces roseosporus的发酵产物通常是一组包含不同长度脂酰侧链的环十脂肽复合物.发酵产物中除了3种主要成分外,还含有许多杂质,如果在玫瑰孢链霉菌发酵时不优化发酵条件,达托霉素的产量很低,分离纯化难度大,采用前体诱导法,可以改善分离效果.达托霉素的生物合成基因是从Streptomyces roseosporus的Tn5099突变体中获得的,Baltz RH等[10]对得到的DNA片断做了分子克隆,部分序列测定以及插入诱变的操作.用10~20 kb长的编码区去干扰可能的糖肽的生物合成基因,从而确定了两个肽合成编码区.达托霉素是一种非核糖体合成的抗菌肽(多肽).合成酶基因每个模板都可识别、激活一个氨基酸残基,并且在必要的时候对其进行修饰,添加到正在合成的肽链上.Miao等[11]研究报道,达托霉素NRPS(non-ribosomal peptide synthetases非核糖体肽合成酶)的组织结构包含了dptA、dptB、dptC、dptD、dptH等部分.dptA内含五个模块(模块1~5),dptB内含三个(模块6~8)以及模块9的催化功能域,dptC内含模块9~11的酰化硫化功能域,dptD内含模块12~13,以及一个硫化功能域.Baltz RH等[10]对环肽基因簇的两个区域cspA和cspB作了DNA序列分析.他们将Hmγ基因插入到cpsA模块,从而得到了玫瑰孢链霉菌双向交叉阳性检测系统.达托霉素基因簇的CpsB模块包括了氨基酸激活,硫酯键的形成和异构化.利用基因手段对达托霉素分子进行生物合成,可以有效的控制多肽链的合成及其结构修饰,从而得到目标分子.基因工程在医学领域的研究和应用有待于更多学者的参与和发掘.徐红岩等[12]根据多年大量多肽合成工作的经验积累,巧妙地设计了达托霉素的固液相合成策略,该方法被证明可快速合成目标分子.另外运用该方法可对这类环肽主骨架进行修饰或改造,根据组合化学的基本原理,快速合成出一系列大量天然环肽的类似物,以期找到结构相对简单而具有达托霉素相似或更强生物活性的化合物,供临床前的筛选.可是,固液相合成方法中采用的液相环合后再剪切的方法使得产物产率和纯度低,无法满足临床需求,且作为单体的犬尿氨酸和3-甲基谷氨酸自然来源稀少,其化学合成又非常困难,因此,要将该合成方法工业化仍需要进一步研究和完善.目前在合成上取得的最大进展是利用化学酶合成法得到了达托霉素类似物.天蓝色链霉菌中钙依赖性抗生素(cDA)生物合成途径中的硫酯环化酶A3(2)(CdaPS3 Te)被用于合成达托霉素类似物(12位Glu代替3 mGlu,2位L-Asn代替D-Asn).由于缺少Glu-12上的β-甲基,且Asn一2为D型,此类似物比达托霉素MIC高7倍.使用这种方法又合成了许多类似物来研究其构效关系.如Trp替换Kyn-13,MIC升高.Asn取代7, 9位的Asp,则完全丧失活性,用其他酸性残基取代3和12位则可保留大部分活性.在内酯环中额入酸性残基则破坏其活性.采用cdaPS3 Te可以建立一个达托霉素类似物的组合库来进一步筛选抗菌活性更好的分子[3].钦传光等[13]发明出一种达托霉素类似物及其全固相合成制备方法,希望通过达托霉素的主骨架设计出一系列结构相对简单的衍生物,以期找到与达托霉素相似或更强生物活性的化合物,供临床筛选.该方法是将第一个侧链带有羧基的Fmoc氨基酸(其α-羧基被选定的基团保护)连接到固相树脂载体上,再继续依次连接七个Fmoc 氨基酸,期间依次脱Fmoc;连接第九个侧链带有羟基(巯基或氨基)并被选择性基团保护的Fmoc氨基酸并脱Fmoc;再继续依次连接后面的三个Fmoc氨基酸并脱Fmoc;连接脂肪酸后,再选择性的脱去第九个氨基酸侧链羟基(巯基或氨基)上的保护基团,然后将其与最后一个Fmoc氨基酸的羧基进行反应,脱Fmoc;再脱去第一个氨基酸α-羧基的保护基团后,直接在固相树脂上进行环合,随后将产物从树脂上剪切下来,经冷乙醚沉淀,收获产品.全固相合成制备方法解决了达托霉素固液相合成法中犬尿氨酸和3-甲基谷氨酸自然来源稀少的弊端,为临床药物筛选提供了更广的来源. 达托霉素作为应用到临床的首个环脂肽类抗生素,鲜有交叉耐药菌的报道,这在医院院内感染严重、高致病耐药菌肆虐的今天,显得尤为重要.自2003年起,达托霉素药物在美国、德国、英国和荷兰陆续上市[14].2010年,中国SFDA也批准阿斯利康公司对克必信(注射用达托霉素)产品在国内免注册临床试验并授予上市许可.但是由于专利保护等原因,玫胞链霉菌不易得,且发酵过程需要精密控制,下游纯化过程对设备级别及技术的要求都很高,目前在国内还未见药厂对达托霉素开始工业化生产.因此,开发扩大达托霉素的药物来源,使国内拥有该药物的自主研发生产能力,有待众多学者的进一步努力.【相关文献】[1] 崔玉彬.处于临床试验研究阶段的抗生素候选药物总览[J].国外医药:抗生素分册,2011,32(2):79-82.[2] 顾觉奋,戴君.新一代抗MRSA抗生素的临床研究进展[J].抗感染药学,2009,6(4):223-228.[3] 王玮,穆青.从天然产物到药物-达托霉素的发展历程[J].国外医药:抗生素分册,2009,3(2):59-62.[4] Baltz RH,Miao V,wrigley SK.Natural products to drug daptomycin and relatedlipopepride antibiotics[J].Nat Prod Rep,2005,22(6):717-741.[5] 史丽娟,石磊.新型抗革兰阳性菌药物---达托霉素[J].中国医药导刊,2008,10(7):1100-1102.[6] 张石革.糖肽和环脂肽抗生素的进展与临床评价[J].中国医院用药评价与分析,2009,9(2):88-89.[7] Schriever CA,Fernandez C,Rodvold KA.Daptomycin:A novel cyclic lipopeptide antimicrobial[J].Clinical Review,2005,62(11):1145-1158.[8] Boaretti M,Canepari P.Purification of daptomycin binding proteins(DBPs)from the membrane of enterococcushirae[J].New Microbiol,2000, 23(3):305-317.[9] 卜一珊,崔蓉.新的抗革兰阳性菌药物---达托霉素[J].中国药师,2005,8(7):594-595.[10] Baltz RH,McHenney MA,Cantwell CA,et al.Applications of transposition mutagenesis in antibiotic producing streptomycetes[J].Kluwer Academic Publishers,1997,71(1-2):179-187.[11] Miao V,Coëffet-LeGal MF,Brian P,et al.Daptomycin biosynthesis in Streptomyces roseosporus:cloning and analysis of the gene cluster and revision of peptide stereochemistry[J].Microbiology,2005,151(5): 1507-1523.[12] 徐红岩,陆婷婷.一种达托霉素的合成方法:CN,101235080A[P]. 2008-08-06.[13]钦传光,任锦,牛卫宁,等.达托霉素类似物及其全固相合成制备方法:CN,101696235A[P].2010-04-21.[14] 韩培,陈继业,王岩,等.达托霉素生物合成研究进展及临床研究[J].中国医药工业杂志,2011,42(6):466-471.。
申请挂网新通用名品种一览表
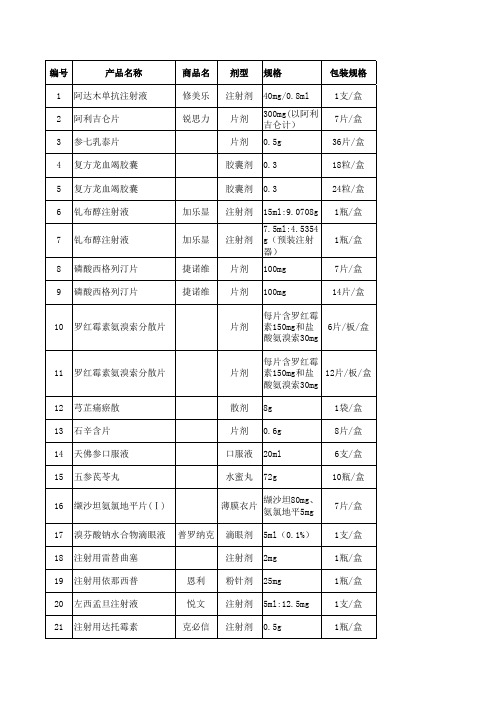
包装规格 1支/盒 7片/盒 36片/盒 18粒/盒 24粒/盒 1瓶/盒
加乐显
注射剂
7
钆布醇注射液
加乐显
注射剂
1瓶/盒
8 9
磷酸西格列汀片 磷酸西格列汀片
捷诺维 捷诺维
片剂 片剂
7片/盒 14片/盒
10
罗红霉素氨溴索分散片
片剂
6片/板/盒
11
罗红霉素氨溴索分散片
片剂
每片含罗红霉 素150mg和盐 12片/板/盒 酸氨溴索30mg 8g 0.6g 20ml 72g 缬沙坦80mg、 氨氯地平5mg 5ml(0.1%) 2mg 25mg 5ml:12.5mg 0.5g 1袋/盒 8片/盒 6支/盒 10瓶/盒
2010.1.15
2009.8.26
2009.8.26
2010.3.15 2010.3.15
南京圣和药业有限公司
2009.8.13
辉瑞制药有限公司 辉瑞制药有限公司 Genentech.Inc
2010.7.13 2010.7.13 2010.2.26
四川科伦药业股份有限公司
四川科伦药业股份 有限公司
H20090843 国药准字 H20090325
2009.9.29 2009.9.02 2010.2.26 2010.4.29 2010.1.4
北京科园信海医药 经营有限公司 齐鲁制药有限公司 阿斯利康制药有限 公司
S20100019 国药准字 H20100043 国药准字 J20100001
沈阳光大制药有限公司 诺和诺德(中国)制药有限 公司 诺和诺德(中国)制药有限 公司 海南国瑞堂制药有限公司 海南国瑞堂制药有限公司
编号 1 2 3 4 5 6
达托霉素

江苏省人民医院ICU 王 勇
实用文档
达托霉素---第一个环脂肽类抗生素
环脂肽类抗生素
体外微生物学特性:
Gram (+) 各类革兰阳 性菌包括耐药的: MRSA、VRSA、LRSA, GISA、VRE 杀菌性: 快速杀菌剂
批准适应症 达托霉素4mg/kg治疗由对本 品敏感的金黄色葡萄球菌(包 括甲氧西林耐药菌株)、化脓 链球菌、无乳链球菌、停乳链 球菌似马亚种及粪肠球菌(仅 用于万古霉素敏感的菌株)导 致的复杂性皮肤及软组织感染 达托霉素6mg/kg用于治疗金 黄色葡萄球菌(包括甲氧西林 敏感和甲氧西林耐药)血流感 染(菌血症),以及伴发的右 侧感染性心内膜炎
• 嗜酸性粒细胞肺炎
•CPK 检测 –所有接受达托霉素治疗的患者 –监测肌痛或乏力,尤其是四肢的 远端
• FDA妊娠期用药B类
–每周监测CPK
• 18岁以下患者安全性尚未确 立;
•CPK升高的患者 –更频繁的监测
–出现无法解释的肌病症状和体征 伴CPK>1000 U/L (~5X ULN),终 止治疗。
as demonstrated American Society
with of
Microbiology General Meeting; May 23−27, 2004; New Orleans, La. Poster O-022.
治疗革兰阳性球菌感染的抗生素
万古霉素 替考拉宁 达托霉素 利奈唑胺 替加环素
• 继续保持胸腔引流通畅
实用文档
• 5月2日、5月5日两次复查血常规结果正常 • 5月2日后患者体温回落至37°C左右 • 5月2日CT显示感染较前明显吸收 • 5月4日行引流液培养,结果阴性 • 患者生命体征平稳,5月6日出院回当地 • 随访一个月,患者病情好转,在当地出院
注射用达托霉素说明书

注射用达托霉素说明书一、药品名称:注射用达托霉素二、成分:每支注射用达托霉素含有主要成分达托霉素。
三、性状:本品为无色至浅黄色透明液体。
四、适应症:注射用达托霉素适用于以下疾病的治疗:1. 呼吸道感染:包括肺炎、咽炎、扁桃体炎等;2. 泌尿系感染:包括膀胱炎、尿道感染等;3. 皮肤组织感染:包括疖、蜂窝组织炎等;4. 腹腔感染:包括腹膜炎、急性阑尾炎等;5. 骨关节感染:包括骨髓炎、关节炎等。
五、用法与用量:成人建议用量:根据病情轻重和感染部位的不同,一般每日使用量为0.3g至0.6g,分2次至4次静脉注射。
儿童建议用量:根据儿童体重和感染病情,一般每日使用量为10mg/kg至20mg/kg,分2次至4次静脉注射。
六、不良反应:接受注射用达托霉素治疗的患者中,约有10%的人可能会出现以下不良反应:1. 胃肠道不适:包括恶心、呕吐、腹泻等;2. 皮肤过敏:包括皮疹、瘙痒等;3. 肝功能异常:包括转氨酶升高等;4. 肾功能异常:包括血肌酐升高、尿毒症等。
若出现以上不良反应,应立即停药并咨询医师。
七、禁忌症:以下人群禁止使用达托霉素:1. 对达托霉素过敏者;2. 孕妇、哺乳期妇女禁用。
八、注意事项:1. 根据医生指导合理使用,严格按照剂量和疗程进行治疗;2. 注意药品的保存环境,避免阳光直射;3. 请勿超量使用本品。
九、药物相互作用:在与其他药物同时应用时,需谨慎慎重,如与其他青霉素类药物、链霉素类药物或保护肝脏药物同时使用时,可能会增加肝、肾功能异常的风险。
十、规格:每支注射用达托霉素的规格为10ml/支。
十一、生产企业:本药品由XXX制药公司生产。
十二、有效期:请查看药品包装上标示的有效期。
备注:本说明书仅供医生参考,患者使用本药品需在医生指导下进行。
如有药品使用上的疑问,请咨询医师。
注射用阿奇霉素通用名注射用阿奇霉素英文名Azithromycinfor

注射用阿奇霉素通用名:注射用阿奇霉素英文名:Azithromycin for Injection【性状】本品为白色或类白色疏松块状物。
【药理毒理】阿奇霉素为15元环大环内酯类抗生素。
体外试验证明阿奇霉素对临床上多种常见致病菌有抗菌作用,包括:革兰阳性需氧菌、金黄色葡萄球菌、酿脓链球菌(A组β溶血性链球菌)、肺炎(链)球菌、a溶血性链球菌(草绿色链球菌)和其他链球菌、白喉(棒状)杆菌。
本品对于耐红霉素的革兰阳性细菌,包括粪链球菌(肠球菌)以及耐甲氧西林的多种葡萄球菌菌株呈现交叉耐药性。
革兰阴性需氧菌:流感嗜血杆菌、副流感嗜血杆菌、卡他摩拉菌、不动杆菌属、耶尔森菌属、嗜肺军团菌、百日咳杆菌、副百日咳杆菌、志贺菌属、巴斯德菌属、霍乱弧菌、副溶血性杆菌、类志贺吡邻单胞菌。
本品对下列革兰阴性菌的活性视菌株而定,并需作敏感性测定:大肠埃希菌、伤寒沙门菌、肠肝菌属、亲水性单胞菌、克雷白菌属。
厌氧菌:脆弱类杆菌、类杆菌属、产气荚膜杆菌、消化链球菌属、坏死梭杆菌、痤疮丙酸杆菌。
性传播疾病微生物:梅毒螺旋体、淋病奈瑟菌、杜克嗜血杆菌。
其他微生物:包括特南包柔螺旋体(Lyme病体)、肺炎支原体、人型支原体、解脲交原体、沙眼衣原体、卡氏肺孢子虫、鸟分枝杆菌属、弯曲菌属、单核细胞增多性李斯德杆菌。
下列革兰阴性菌通常是耐药的:变形杆菌属、沙雷菌属、摩根杆菌、假单胞杆菌。
作用机制与红霉素相同,主要与细菌核糖体的50S亚单位结合,抑制依赖于RNA的蛋白合成。
【药代动力学】每日静脉滴注阿奇霉素0.5g,连续2~5日,平均血浆峰浓度(Cmax)为3.63±1.60μg/ml,平均血浆谷浓度(Cmin)为0.20±0.15μg/ml,AUC24为9.60±4.80μg﹒h /ml。
单次静脉滴注阿奇霉素1~4g,滴注时间大于2小时,其清除率(CLt)和表观分布体积(Vd)分别为10.18ml/min/kg和33.3L/kg。
达托霉素介绍

•
•
•
• 非FDA批准的适应症:脾脓肿、外科伤口感染、肝脓肿、急性骨髓炎、慢性骨 髓炎、糖尿病足感染、社区获得性的脓毒性关节炎
药理作用
膜电位迅速去极化,抑 制蛋白、DNA、RNA合 成,造成细胞快速死亡
• 达托霉素具有独特的抗菌机制,即“分步作用”模式 • 第1步:当有游离钙离子存在时,达托霉素结合到G+菌的细胞膜上,其亲 脂尾不可逆地插入细胞膜中; • 第2步:通过寡聚化作用,达托霉素的亲脂尾在细菌细胞膜上起“离子通 道”的作用; • 第3步:细菌细胞内的钾离子(可能还有其他离子)通过该“离子通道” 大量外流,因而细菌细胞迅速除极,继而失去合成DNA、RNA及大分子蛋 白质的能力,导致细菌死亡。
• 体外活性:很强的广谱抗革兰阳性菌的活性,但对革兰阴性菌无效。
– – – – 葡萄球菌:包括MRSA、MRSE 链球菌:包括青霉素敏感和耐药的肺炎链球菌、化脓性链球菌、无乳链球菌和草绿色链球菌 肠球菌:包括万古霉素敏感和耐药的菌株 艰难梭状芽胞杆菌和痤疮丙酸杆菌
•
体内活性:
– – – – – 艰难梭菌引起的仓鼠大肠验证模型,达托霉素比万古霉素强100倍 MRS引起的大鼠心内膜炎,优于万古霉素 金葡菌与肠球菌引起的小鼠骨感染,有效 肺炎链球菌和耐喹诺酮菌株引起的家兔脑膜炎模型,较好 肺炎链球菌引起的支气管肺泡肺炎模型,无效 由于肺部气道具有独特组织构造,其含有复杂的
不良反应
• 最常见:为胃肠道紊乱、注射部位反应、发热、头痛、失眠、晕眩和皮疹等。胃肠道反
应主要是其对肠道菌群的影响所致。
• 罕见
– – – – – 速发过敏反应/超敏反应 肌病和横纹肌溶解:肌痛、肌无力、CPK↑(>1000或5倍)、肾功能↓,剂量相关 嗜酸粒细胞性肺炎:有报道2-4周出现,发热、咳嗽、气短、呼吸困难。 周围神经病变 国际标准化比值(INR)升高/凝血酶原时间延长
阿斯利康

阿斯利康阿斯利康是全球领先制药公司,由前瑞典阿斯特拉公司和前英国捷利康公司于1999年合并而成。
阿斯利康在诸多治疗领域为患者提供富于创新,卓有成效的处方药产品,包括消化、心血管、肿瘤、中枢神经、麻醉、呼吸和抗感染领域等,其中许多产品居于世界领先地位。
阿斯利康总部位于英国伦敦,研发总部位于瑞典。
产品销售覆盖全球100多个国家和地区。
2008年公司全球销售收入逾316亿美元。
阿斯利康拥有强大的研发能力,年研发总投入超过50亿美元。
我们在8个国家设有17个研发机构,共有12,000名员工从事与新药研发相关的工作。
阿斯利康拥有极具希望的早期开发产品组合,详细信息参见公司全球网站。
阿斯利康在全球多个国家拥有26个生产基地,致力于为全球客户提供安全、有效、高质量的产品。
阿斯利康在全球拥有65,000余名员工,从事医药产品和医疗服务的研发、生产和销售业务。
阿斯利康被列入道琼斯可持续发展指数(全球)以及显示企业良好社会责任度的富时社会责任指数(FTSE4Good Index)o19931993 年 10 月,前瑞典阿斯特拉公司正式在江苏省无锡市注册成立中外合作经营企业o19941994 年 4 月,前英国捷利康公司和中国医药对外贸易总公司(中国医药集团的前身)合资成立捷利康医药开发咨询有限公司。
o19991999 年 6 月,前瑞典阿斯特拉公司与前英国捷利康公司在中国业务正式合并,成立阿斯利康中国区。
o20012001 年 4 月,阿斯利康无锡工厂正式投产。
o20022002 年 11 月,阿斯利康在上海建立临床研究中心。
这是跨国制药公司在中国建立的第一个覆盖中国大陆、香港、台湾、韩国等东亚地区的临床研究中心。
o20032003 年 9 月,阿斯利康宣布成立面向国内医学专业人员的“阿斯利康学院”,旨在支持医学继续教育,推动临床医学发展。
2003 年 12 月,阿斯利康公司宣布与北京大学光华管理学院合作,资助北京大学中国医药经济研究中心,共同培育新一代卫生经济人才。
达托霉素

达托霉素
达托霉素是由Lilly(礼来)公司最初研究,在2012年湖北威德利化学科技有限公司通过高新技术仿制环脂肽类抗生素--达托霉素(Daptomycin),达托霉素是继万古霉素之后第二代糖肽类抗生素药,湖北威德利化学科技有限公司通过链霉菌发酵液中提取得到,具有不同的化学结构,而且其作用与其他抗生素不同,是万古霉素有效的替代者。
基本信息:
[产品名称]:达托霉素
[中文同义名]:达妥霉素
[英文名]:Daptomycin
[CAS No]:103060-53-3
[分子量]:1620.67
[分子式]:C72H101N17O26
[质量标准]:企业出口标准
[包装规格]:100克/袋,1KG/铝听。
[质量标准]:含量≥93.0%
产品优势:我司研发达托霉素的外观是黄.色或者淡黄.色精细无定形粉末,在达托霉素HPLC 和达托霉素IR以及达托霉素UV均符合国外药典注册标准规定,达托霉素比旋度是+17°到+28°,达托霉素酸碱度PH呈偏酸性,在3到5之间,我司的达托霉素原料产品质量高于国外注册标准,如炽灼残渣国外标准规定是≤4%,而我司可以达到≤2%以下。
含量更是高于规定的93%以上,达到98%以上。
更详细的其他指标信息可以向我司销售经理索要详细质检报告。
储存建议:湖北威德利化学科技有限公司建议达托霉素于密闭容器储存,温度在-20℃到5℃之间,如需运输,请保持温度为2℃到8℃。
注射用达托霉素说明书

注射用达托霉素注射用达托霉素,适应症为金黄色葡萄球菌(包括甲氧西林敏感和甲氧西林耐药)导致的伴发右侧感染性心内膜炎的血流感染(菌血症)。
如果确定或怀疑的病原体包括革兰阴性菌或厌氧菌,则临床上可采用联合抗菌治疗。
在患有由金黄色葡萄球菌引起的左侧感染性心内膜炎的患者中,尚未证实克必信的有效性。
在金黄色葡萄球菌血流感染的患者中进行的克必信临床试验,包含来自左侧感染性心内膜炎患者的资料;在这些患者中,疗效不佳(见临床研究)。
在人工瓣膜心内膜炎或脑膜炎患者中,尚未对克必信进行评价。
若患者患有持续性或复发性金黄色葡萄球菌感染,或临床疗效欠佳,应该重复进行血培养。
如果金黄色葡萄球菌的血培养为阳性,则应采用标准操作规程进行该菌株的MIC药敏试验,并且应进行诊断性评估,以排除罕见的感染病灶存在(见注意事项)。
本药不适用于治疗肺炎。
应获得适当的标本进行微生物学检查,以便分离和鉴定引起感染的病原体,并测定其对达托霉素的敏感性。
当等待试验结果时,可以采用经验性治疗。
根据微生物学检查结果,应对抗菌治疗进行调整。
为了延缓耐药性的发展,并维持本药和其它抗菌药的疗效,克必信应仅用来治疗被确定或强烈怀疑由敏感菌引起的感染。
在获得培养和药敏结果后,应考虑选择或调整抗菌治疗。
缺乏这些资料的情况下,当地的流行病学和敏感性趋势有助于经验性治疗的抗菌药物选择。
目录1.1成份2.2适应症3.3用法用量3.6注意事项1.7包装成份达托霉素适应症金黄色葡萄球菌(包括甲氧西林敏感和甲氧西林耐药)导致的伴发右侧感染性心内膜炎的血流感染(菌血症)。
如果确定或怀疑的病原体包括革兰阴性菌或厌氧菌,则临床上可采用联合抗菌治疗。
在患有由金黄色葡萄球菌引起的左侧感染性心内膜炎的患者中,尚未证实克必信的有效性。
在金黄色葡萄球菌血流感染的患者中进行的克必信临床试验,包含来自左侧感染性心内膜炎患者的资料;在这些患者中,疗效不佳(见临床研究)。
在人工瓣膜心内膜炎或脑膜炎患者中,尚未对克必信进行评价。
宜妥利说明书

宜妥利说明书
通用名称:依托咪酯注射用乳剂
功能主治:全身麻醉诱导(短期麻醉须与镇痛药合用)。
用法用量:缓慢静脉注射,一次每公斤体重0.15至0.3mg,相当于每公斤体重0.075至0.15 ml的依托咪酯脂肪乳注射液,于30~60秒内注射完毕。
不良反应:单次剂量可使肾上腺皮质对应激的反映明显减慢4-6小时。
没有接受适当前期给药的病人,在应用单剂量本药后可能出现肌阵挛。
偶有恶心、呕吐、咳嗽、呃逆和寒颤,个别病例可出现喉痉挛。
大剂量使用本药或与中枢神经抑制剂合用时,偶见短暂呼吸暂停。
禁忌:6个月以内的新生儿和婴幼儿,哺乳妇女禁用。
达托霉素介绍 PPT

禁忌:过敏
妊娠分级: B级
哺乳:
慎用
药物过量:透析可清除
• 注意:
蛋白和脂类混合物构成的表面活性剂,它们的存 在大大降低了达托霉素的疗效。
– MRSA和VRSA的耐药机制是兼容的,这2种强大的耐药机制组合使万古霉素在将来也可能 会被淘汰。
– 达托霉素在无钙离子的条件下几乎不具有抗菌活性,而在钙离子浓度为50 mg/L(为在人 血清中的正常浓度)时达到最大抗菌活性。注意血钙正常。
药代动力学
•线性代谢 •非时间依赖性 •3天达稳态波谷浓度
•动物研究口服吸收差
•Cmax(血药浓度峰值):58mcg/ml,药时曲线下面积494mcg hr/ml
•分布:Vd(表观分布容积)=0.096L/KG;不透过血脑屏障(动物)。骨组织透过性差
(动物)
•蛋白结合率:92%
•代谢/排泄:主要以药物原型自肾脏排泄(78%),极少量代谢为无活性代谢产物。
从天然产物到药物——达托霉素的发展历程,国外医药抗生素分册2009年第30卷第2期·
抗菌活性
• 体外活性:很强的广谱抗革兰阳性菌的活性,但对革兰阴性菌无效。
– 葡萄球菌:包括MRSA、MRSE
– 链球菌:包括青霉素敏感和耐药的肺炎链球菌、化脓性链球菌、无乳链球菌和草绿色链球菌
– 肠球菌:包括万古霉素敏感和耐药的菌株
正常剂量(> 肾功能不全(<30ml/min,
30ml/min)
达托霉素介绍PPT课件
• 开展了评价达托霉素对社区获得性肺炎住院患者疗效的Ⅲ期临床试验,未发现其疗效优 于头孢曲松,因此不能作为治疗肺炎的药物(达托霉素在治疗肺内感染时由于表面活性剂 的存在而降低其疗效)。
• 达托霉素具有独特的抗菌机制,即“分步作用”模式 • 第1步:当有游离钙离子存在时,达托霉素结合到G+菌的细胞膜上,其亲
脂尾不可逆地插入细胞膜中; • 第2步:通过寡聚化作用,达托霉素的亲脂尾在细菌细胞膜上起“离子通
道”的作用; • 第3步:细菌细胞内的钾离子(可能还有其他离子)通过该“离子通道”
– 2003年,FDA批准:复杂皮肤和软组织感染 – 2005年,FDA批准:金黄色葡萄球菌感染的菌血症和心内膜炎 – 2007 年在中国开发和销售
• 目前尚未批准系统用药。
2019/11/19
2
适应症进展
• 复杂皮肤和软组织感染(包括创伤感染、脓疮、感染性糖尿病和非糖尿病溃疡等)与标准 治疗法(万古霉素、苯唑西林或萘夫西林)疗效相当。2003年,FDA批准达托霉素治疗上 述适应证。
应主要是其对肠道菌群的影响所致。
• 罕见
– 速发过敏反应/超敏反应 – 肌病和横纹肌溶解:肌痛、肌无力、CPK↑(>1000或5倍)、肾功能↓,剂量相关 – 嗜酸粒细胞性肺炎:有报道2-4周出现,发热、咳嗽、气短、呼吸困难。 – 周围神经病变 – 国际标准化比值(INR)升高/凝血酶原时间延长
禁忌:过敏
•分布:Vd(表观分布容积)=0.096L/KG;不透过血脑屏障(动物)。骨组织透过性差
达托霉素药理作用临床应用及注意事项

达托霉素药理作用临床应用及注意事项一、单选题1. 达托霉素为两性化合物,等电点约为pH4-5,其常规配制溶液是()*A、0.9%氯化钠√B、5%葡萄糖溶液C、乳酸盐化林格注射液√D、10%葡萄糖溶液2. 达托霉素主要用于治疗()所导致的感染[单选题] *A、厌氧革兰氏阳性菌B、需氧革兰氏阳性菌√C、厌氧革兰氏阴性菌D、需氧革兰氏阴性菌3. 达托霉素成人患者可静推和静滴给药,其中静推和静滴持续时间分别为()[单选题]A、1分钟;30分钟B、1分钟;60分钟C、2分钟;30分钟√D、2分钟;60分钟4. 达托霉素儿童患者可按年龄进行相应时间的静脉滴注给药,其中1-6岁和7-17岁儿童患者分别滴注时间为()[单选题] *A、30分钟;30分钟B、30分钟;60分钟C、60分钟;30分钟√D、90分钟;60分钟5. 治疗复杂性皮肤及软组织感染的成人患者时,达托霉素的推荐给药剂量和周期分别是()[单选题] *A、4 mg/kg;1-2周√B、4 mg/kg;2-4周C、6 mg/kg;1-2周D、6 mg/kg;2-4周6. 治疗金黄色葡萄球菌血流感染的成人患者时,达托霉素的推荐给药剂量和周期分别是()[单选题] *A、4 mg/kg;1-2周B、4 mg/kg;2-6周C、6 mg/kg;1-2周D、6 mg/kg;2-6周√7. 一名8岁金黄色葡萄球菌血流感染患者,达托霉素的推荐给药剂量和周期分别是()[单选题] *A、7 mg/kg;≤14天B、7 mg/kg;≤42天C、9 mg/kg;≤14天D、9 mg/kg;≤42天√8. 重度肾功能损害患者,其肌酐清除率<30 mg/min,治疗MRSA血流感染的推荐剂量为()[单选题] *A、每24小时4 mg/kgB、每24小时6 mg/kgC、每48小时4 mg/kgD、每48小时6 mg/kg√9. 达托霉素注射剂配置时必须采用无菌操作技术,稳定性研究显示,稀释后的溶液以输液袋保存时,室温下总保存时间和冰箱中(2-8℃)总保存时间分别是()[单选题] *A、≤3h;≤6hB、≤6h;≤12hC、≤12h;≤24hD、≤12h;≤48h√10. 达托霉素溶解后静推给药时,药物浓度为()[单选题] *A、10 mg/mLB、20 mg/mLC、50 mg/mL√D、100 mg/mL11. 达托霉素作用机制独特,其主要作用机制为()[单选题] *A、与细菌细胞膜结合,导致细菌快速去极化√B、抑制细菌细胞壁的合成C、抑制细菌DNA的复制导致细菌死亡D、与核糖体50S亚基结合,抑制细菌蛋白质的合成12. 达托霉素属于(),体外抗菌谱覆盖大多数与临床有关的革兰氏阳性病原菌[单选题] *A、时间依赖性杀菌剂B、时间依赖性抑菌剂C、浓度依赖性杀菌剂√D、浓度依赖性抑菌剂13. 下述关于达托霉素药理作用描述不正确的是()[单选题] *A、抗菌谱可覆盖临床常见G+病原菌B、对稳定期金黄色葡萄球菌无杀菌作用√C、对骨骼肌有影响D、未发现致突变或致畸变倾向14. 达托霉素给药过量时,建议进行支持治疗以维持肾小球滤过作用,血液透析4 h和腹膜透析48 h 以上可分别消除相当于所给剂量的()[单选题] *A、10%;8%B、10%;11%C、15%;8%D、15%;11%√15. 以下不属于革兰氏阳性菌的为()[单选题] *A、脑膜炎球菌√B、金黄色葡萄球菌C、粪肠球菌D、化脓链球菌16. 达托霉素的骨骼肌效应与哪些因素有关()[单选题] *A、给药次数√B、给药剂量C、给药疗程D、给药途径17. 关于达托霉素骨骼肌效应的特点,下列说法错误的是()[单选题] *A、对心肌和平滑肌无毒性B、停药后3天内症状缓解或消失C、CPK>1000 U/L且有肌肉症状的患者应终止治疗D、CPK≥2000 U/L的患者若没有肌肉症状可以不终止治疗√18. 健康青年成人每24小时静脉注射(IV)4-12 mg/kg达托霉素,药代动力学结果显示,用药至第()天时达到药物稳态波谷浓度[单选题] *A、1B、2C、3√D、419. 严重肾损害患者(CLCR<30 mL/min)和接受血液透析(透析后给药)患者的平均AUC与正常肾功能患者相比()[单选题] *A、高1-2倍B、高2-3倍√C、低1-2倍D、低2-3倍20. 健康青年成人每24小时静脉注射(IV)达托霉素4 mg/kg和6 mg/kg(30分钟给药),达稳态时,平均(标准差)稳态Cmax分别为()[单选题] *A、57.8(3.0)µg/mL;93.9(6.0)µg/mL√B、77.7(8.1)µg/mL;116.6(12.2)µg/mLC、116.6(12.2)µg/mL;123.3(16)µg/mLD、123.3(16)µg/mL;183.7(25.0)µg/mLD、123.3(16)µg/mL;183.7(25.0)µg/mL21. 健康青年成人每24小时静脉注射达托霉素4 mg/kg(30分钟给药),平均(标准差)半衰期是()[单选题] *A、6.2(1.0)hB、8.1(1.0)h√C、12.2(1.1)hD、24.5(2.0)h22. 达托霉素的排泄部位是()[单选题] *A、肝脏B、肾脏√C、皮肤D、消化道23. 肌酐清除率是评价肾功能的重要指标,达托霉素对于肾损害患者也可使用,当肌酐清除率为(),仅需调整给药剂量为两天一次。
达托霉素

31.注射用达托霉素(H20100107 Cubist Pharmaceuticals, Inc. 86979424000050)2.注射用达托霉素(国药准字J20100001 Cubist Pharmaceuticals, Inc. 86979424000029)3.注射用达托霉素(H20090781 Cubist Pharmaceuticals Inc. 86979424000036)注射用达托霉素1. 项目背景达托霉素(daptomycin,Cubicin)作为一全新结构类别的抗生素,最早由礼来公司(Eli Lilly)于二十世纪80年代发现,1997年Cubist制药公司受让获得全球范围的开发权,2003年9月获FDA批准在美国首次上市,据统计,此药上市后第一年即取得约6000万美元的收入。
2. 药物特性达托霉素能在多个方面破坏细菌细胞膜功能,由此迅速杀死革兰阳性菌。
本品除能作用于大多数临床相关革兰阳性菌外,更重要的是在体外对已呈甲氧西林(methicillin)、万古霉素和利奈唑胺等耐药性分离菌株仍具强力活性。
本品现被批准用于治疗下列革兰阳性体外敏感菌所致并发性皮肤及皮肤结构感染:包括耐甲氧西林菌在内的金黄色葡萄球菌、酿脓链球菌、无乳链球菌、停乳链球菌亚种似马链球菌和对万古霉素敏感粪肠球菌。
3. 临床研究临床研究证实达托霉素与苯唑西林、萘夫西林钠法疗效相当,即:对临床可评价患者,本品治疗的临床成功率为83.4%,而对照药物的相应值是84.2%。
本品在临床研究中极少致使病原菌产生耐药性。
4. 市场情况新颖抗生素——达托霉素(Cubicin)对革兰阳性耐药菌有活性且具更好抗菌谱和较低耐药性,其在上市后的第一年即取得约6000万美元的收入,而且销售额正在稳步上升。
由于达托霉素的成功上市,导致了Cubist制药公司股票价格的快速上涨,去年11月,该公司通过出售手中的股票净赚了1.124亿美元。
处方医嘱的审查与点评要点说明

处方医嘱的审查与点评要点目录一审核与点评过敏试验 (2)(一)《处方管理办法》要求 (2)(二)《2005年版中国药典临床用药须知》规定 (3)(三)药品说明书中有关皮试的规定 (4)二审核与点评处方使用权限 (6)(一)《麻醉药品和精神药品管理条例》要求 (6)(二)《抗菌药物使用指导原则》要求 (6)(三)《糖皮质激素类药物临床应用指导原则》使用要求 (6)三审核与点评注射剂分散媒 (7)3.1 不宜以葡萄糖注射液为溶媒的药品 (7)3.2 不宜用氯化钠注射液做溶媒的药品 (8)3.3 不适与钙制剂配伍的抗菌药注射剂 (9)3.4 溶媒使用量或配制的药物浓度 (11)3.5 输液速度 (11)3.6 输液配制六注意 (11)3.7 附带溶媒注射液 (12)3.8 药品可用溶媒 (13)四审核与点评用药与临床诊断的一致性 (18)4.1 年龄禁忌 (18)4.2 临床不对症用药问题 (21)4.3 涉药医疗纠纷 (22)4.4 药师的注意义务 (23)4.5 用药与临床诊断不一致的处置——加强沟通 (23)五审核与点评给药剂量 (24)(一)药物剂量与效应关系 (24)1 药物量效关系 (24)2 药物量效关系的个体差异 (25)3 量效关系与连续用药 (26)4 量效关系、药物剂型和给药途径 (26)5 量效关系与年龄、性别 (27)(二)处方用量差错与超剂量 (27)2.1 治疗窗大的超剂量问题 (28)2.2 治疗窗小的超剂量问题 (29)2.3 非线性药物动力特征的药物超剂量问题 (29)附1. 老幼用药剂量折算方法 (31)附2. 成人常用药物极量表 (33)附3. 新生儿抗感染药物的用法、用量 (35)六审核与点评剂型与给药途径 (35)6.1 口服与静脉或肌肉注射给药 (36)6.2 局部与全身给药 (36)6.3 临床常见剂型不合理使用 (36)七审核给药次数(使用频率) (38)(一)匀速给药 (38)(二)非匀速给药 (40)(三)抗菌药使用 (42)八审核是否重复给药 (43)九审核相互作用和配伍禁忌 (43)药物配伍基础知识 (43)配伍定义 (43)药物相互作用 (43)药代动力学的相互作用 (44)药效动力学的相互作用 (45)体外药物的相互作用 (46)中西药之间的相互作用 (46)常用注射药物配伍禁忌参考表 (47)静脉滴注药物配伍禁忌表 (53)中西药配伍禁忌表 (58)药物相互作用引起的严重不良反应 (63)致命性药物相互作用 (64)药物相互作用 (69)抗菌药相互作用 (100)十有关问题的讨论 (101)10.1 临床不规用药问题 (101)10.2 患者和家属不同意更改药疗方案或拒绝治疗 (102)10.3 药师调配处方的要求 (102)《处方管理办法》对药师如何审核处方用药的合理性提出了详细的指导意见,对药师药学专业素质提出了更高的要求。
达托霉素

Generic Name】Daptomycin Injection,Powder,Lyophilized,for Solution[FDA]【Brand Name】Cubicin【Active Ingredients】达托霉素【Description】CUBICIN contains daptomycin, a cyclic lipopeptide antibacterial agent derived from the fermentation of Streptomyces roseosporus. The chemical name isN-decanoyl-L-tryptophyl-D-asparaginyl-L-aspartyl-L-threonylglycyl-L-ornithyl-L-aspartyl-D-alanyl-L-aspartylglycyl-D-seryl-threo-3-methyl-L-glutamyl-3-anthrani loyl-L-alanine ε1-lactone. The chemical structure is:The empirical formula is C72H101N17O26; the molecular weight is 1620.67. CUBICIN issupplied as a sterile, preservative-free, pale yellow to light brown, lyophilized cake containing approximately 900 mg/g of daptomycin for intravenous (IV) use following reconstitution with 0.9% sodium chloride injection. The only inactive ingredient is sodium hydroxide, which is used in minimal quantities for pH adjustment. Freshly reconstituted solutions of CUBICIN range in color from pale yellow to light brown.【Clinical Pharmacology】PharmacokineticsThe mean (SD) pharmacokinetic parameters of daptomycin at steady-state following IV administration of 4 to 12 mg/kg q24h to healthy young adults are summarized in Table 1.Daptomycin pharmacokinetics were generally linear and time-independent at doses of 4 to 12 mg/kg q24h. Steady-state trough concentrations were achieved by the third daily dose. The mean (SD) steady-state trough concentrations attained following administration of 4, 6, 8, 10, and 12 mg/kg q24h were 5.9 (1.6), 6.7 (1.6), 10.3 (5.5), 12.9 (2.9), and 13.7 (5.2) µg/mL, respectively.Table 1. Mean (SD) CUBICIN Pharmacokinetic Parameters in HealthyVolunteers at Steady-StatePharmacokinetic Parameters*Dose†AUC0-24t1/2V ss CL T C max(mg/kg) (µg*h/mL)(h) (L/kg) (mL/h/kg) (µg/mL)4 (N=6) 494 (75) 8.1(1.0) 0.096(0.009)8.3 (1.3) 57.8 (3.0)6 (N=6) 632 (78) 7.9(1.0) 0.101(0.007)9.1 (1.5) 93.9 (6.0)8 (N=6) 858 (213) 8.3(2.2) 0.101(0.013)9.0 (3.0) 123.3(16.0)10 (N=9) 1039 (178) 7.9(0.6) 0.098(0.017)8.8 (2.2) 141.1(24.0)12 (N=9) 1277 (253) 7.7(1.1) 0.097(0.018)9.0 (2.8) 183.7(25.0)*AUC0-24, area under the concentration-time curve from 0 to 24 hours; t½, terminalelimination half-life; Vss , volume of distribution at steady-state; CLT, plasmaclearance; Cmax, maximum plasma concentration.†Doses of CUBICIN in excess of 6 mg/kg have not been approved.DistributionDaptomycin is reversibly bound to human plasma proteins, primarily to serum albumin, in a concentration-independent manner. The overall mean binding ranged from 90 to 93%.In clinical studies, mean serum protein binding in subjects with CLCR≥30 mL/min was comparable to that observed in healthy subjects with normal renalfunction. However, there was a trend toward decreasing serum protein binding amongsubjects with CLCR<30 mL/min (87.6%), including those receiving hemodialysis (85.9%) and continuous ambulatory peritoneal dialysis (CAPD) (83.5%). The protein binding of daptomycin in subjects with hepatic impairment (Child-Pugh B) was similar to that in healthy adult subjects.The volume of distribution at steady-state (Vss) of daptomycin in healthy adult subjects was approximately 0.10 L/kg and was independent of dose.MetabolismIn vitro studies with human hepatocytes indicate that daptomycin does not inhibit or induce the activities of the following human cytochrome P450 isoforms: 1A2, 2A6, 2C9, 2C19, 2D6, 2E1, and 3A4. In in vitro studies, daptomycin was not metabolized by human liver microsomes. It is unlikely that daptomycin will inhibit or induce the metabolism of drugs metabolized by the P450 system.In 5 healthy young adults after infusion of radiolabeled 14C-daptomycin, the plasma total radioactivity was similar to the concentration determined by microbiological assay. In a separate study, no metabolites were observed in plasma on Day 1 following administration of CUBICIN at 6 mg/kg to subjects. Inactive metaboliteshave been detected in urine, as determined by the difference in total radioactive concentrations and microbiologically active concentrations. Minor amounts of three oxidative metabolites and one unidentified compound were detected in urine. The site of metabolism has not been identified.ExcretionDaptomycin is excreted primarily by the kidney. In a mass balance study of 5 healthy subjects using radiolabeled daptomycin, approximately 78% of the administered dose was recovered from urine based on total radioactivity (approximately 52% of the dose based on microbiologically active concentrations) and 5.7% of the dose was recovered from feces (collected for up to 9 days) based on total radioactivity.Because renal excretion is the primary route of elimination, dosage adjustment is necessary in patients with severe renal insufficiency (CLCR<30 mL/min) (see DOSAGE AND ADMINISTRATION).Special PopulationsRenal InsufficiencyPopulation derived pharmacokinetic parameters were determined for infected patients (complicated skin and skin structure infections and S. aureus bacteremia) and noninfected subjects with varying degrees of renal function (Table 2). Plasmaclearance (CLT ), elimination half-life (t1/2), and volume of distribution (Vss) weresimilar in patients with complicated skin and skin structure infections compared with those with S. aureus bacteremia. Following the administration of CUBICIN 4 mg/kg q24h, the mean CLTwas 9%, 22%, and 46% lower among subjects and patients withmild (CLCR 50–80 mL/min), moderate (CLCR30–<50 mL/min), and severe (CLCR<30 mL/min)renal impairment, respectively, than in those with normal renal function (CLCR>80mL/min). The mean steady-state systemic exposure (AUC), t1/2, and Vssincreased withdecreasing renal function, although the mean AUC was not markedly different for patients with CLCR30–80 mL/min compared with those with normal renal function. Themean AUC for patients with CLCR<30 mL/min and for patients on hemodialysis (dosed post-dialysis) was approximately 2 and 3 times higher, respectively, than for patients with normal renal function. Following the administration of CUBICIN 4mg/kg q24h, the mean Cmax ranged from 60 to 70 µg/mL in patients with CLCR≥30 mL/min,while the mean Cmax for patients with CLCR<30 mL/min ranged from 41 to 58 µg/mL. Themean Cmaxranged from 80 to 114 µg/mL in patients with mild-to-moderate renal impairment and was similar to that of patients with normal renal function after the administration of CUBICIN 6 mg/kg q24h. In patients with renal insufficiency, both renal function and creatine phosphokinase (CPK) should be monitored more frequently. CUBICIN should be administered following the completion of hemodialysis on hemodialysis days (see DOSAGE AND ADMINISTRATION for recommendeddosage regimens).Table 2. Mean (SD) Daptomycin Population Pharmacokinetic Parameters Following Infusion of 4 mg/kg or 6 mg/kg to Infected Patients and Noninfected Subjects with Varying Degrees of Renal FunctionRenal Functiont1/2*V ss*CL T*AUC0-∞*AUC ss†C min,ss†(h) (L/kg) (mL/h/kg) (µg*h/mL)(µg*h/mL)(µg*h/mL)4 mg/kg 4 mg/kg 4 mg/kg 4 mg/kg 6 mg/kg 6 mg/kgNote: CL CR, creatinine clearance estimated using the Cockcroft-Gault equation with actual body weight; AUC0-∞, area under theconcentration-time curve extrapolated to infinity; AUC ss, area under the concentration-time curve calculated over the 24-hour dosing interval at steady-state; C min,ss, trough concentration at steady-state; NA, not applicable.Normal 9.39(4.74) 0.13(0.05)10.9 (4.0) 417 (155) 545 (296) 6.9 (3.5)(CL CR >80mL/min)N=165 N=165 N=165 N=165 N=62 N= 61Mild Renal Impairment 10.75(8.36)0.12(0.05)9.9 (4.0) 466 (177) 637 (215) 12.4 (5.6)(CL CR 50−80mL/min)N=64 N=64 N=64 N=64 N=29 N=29Moderate Renal Impairment 14.70(10.50)0.15(0.06)8.5 (3.4) 560 (258) 868 (349) 19.0 (9.0)(CL CR 30−<50mL/min)N=24 N=24 N=24 N=24 N=15 N=14Severe Renal Impairment 27.83(14.85)0.20(0.15)5.9 (3.9) 925 (467) 1050, 892 24.4, 21.4(CL CR <30mL/min)N=8 N=8 N=8 N=8 N=2 N=2Hemodialysis 29.81(6.13) 0.15(0.04)3.7 (1.9) 1244 (374) NA NAN=21 N=21 N=21 N=21*Parameters obtained following a single dose from patients with complicated skin and skin structure infections and healthy subjects.†Parameters obtained at steady-state from patients with S. aureus bacteremia. Hepatic InsufficiencyThe pharmacokinetics of daptomycin were evaluated in 10 subjects with moderatehepatic impairment (Child-Pugh Class B) and compared with healthy volunteers (N=9) matched for gender, age, and weight. The pharmacokinetics of daptomycin were not altered in subjects with moderate hepatic impairment. No dosage adjustment is warranted when administering CUBICIN to patients with mild-to-moderate hepatic impairment. The pharmacokinetics of daptomycin in patients with severe hepatic insufficiency have not been evaluated.GenderNo clinically significant gender-related differences in daptomycin pharmacokinetics have been observed. No dosage adjustment is warranted based on gender when administering CUBICIN.GeriatricThe pharmacokinetics of daptomycin were evaluated in 12 healthy elderly subjects (≥75 years of age) and 11 healthy young controls (18 to 30 years of age). Following administration of a single 4 mg/kg IV dose, the mean total clearance of daptomycinincreased approximately 58% in was reduced approximately 35% and the mean AUC0-∞elderly subjects compared with young healthy subjects. There were no differences . No dosage adjustment is warranted for elderly patients with normal renal in Cmaxfunction.ObesityThe pharmacokinetics of daptomycin were evaluated in 6 moderately obese (Body Mass Index [BMI] 25 to 39.9 kg/m2) and 6 extremely obese (BMI ≥40 kg/m2) subjects and controls matched for age, sex, and renal function. Following administration of a single 4 mg/kg IV dose based on total body weight, the plasma clearance of daptomycin normalized to total body weight was approximately 15% lower in moderately obese subjects and 23% lower in extremely obese subjects compared with nonobeseof daptomycin increased approximately 30% in moderately obese controls. The AUC0-∞and 31% in extremely obese subjects compared with nonobese controls. The differences were most likely due to differences in the renal clearance of daptomycin. No dosage adjustment of CUBICIN is warranted in obese subjects.PediatricThe pharmacokinetics of daptomycin in pediatric populations (<18 years of age) have not been established.Drug-Drug InteractionsDrug-drug interaction studies were performed with CUBICIN and other drugs that arelikely to be either coadministered or associated with overlapping toxicity. AztreonamIn a study in which 15 healthy adult subjects received a single dose of CUBICIN 6mg/kg IV, aztreonam 1 g IV, and both in combination, the Cmax and AUC0-∞of daptomycinwere not significantly altered by aztreonam; the Cmax and AUC0-∞of aztreonam alsowere not significantly altered by daptomycin. No dosage adjustment of either antibiotic is warranted when coadministered.TobramycinIn a study in which 6 healthy adult males received a single dose of CUBICIN 2 mg/kgIV, tobramycin 1 mg/kg IV, and both in combination, the mean Cmax and AUC0-∞ofdaptomycin increased 12.7% and 8.7%, respectively, when administered withtobramycin. The mean Cmax and AUC0-∞of tobramycin decreased 10.7% and 6.6%,respectively, when administered with CUBICIN. These differences were not statistically significant. The interaction between daptomycin and tobramycin with a clinical dose of CUBICIN is unknown. Caution is warranted when CUBICIN is coadministered with tobramycin.WarfarinIn 16 healthy subjects, concomitant administration of CUBICIN 6 mg/kg q24h for 5 days followed by a single oral dose of warfarin (25 mg) had no significant effect on the pharmacokinetics of either drug and did not significantly alter the INR (International Normalized Ratio) (see PRECAUTIONS, Drug Interactions).SimvastatinIn 20 healthy subjects on a stable daily dose of simvastatin 40 mg, administration of CUBICIN 4 mg/kg IV q24h for 14 days (N=10) was not associated with a higher incidence of adverse events than in subjects receiving placebo once daily (N=10) (see PRECAUTIONS, Drug Interactions).ProbenecidConcomitant administration of probenecid (500 mg 4 times daily) and a single doseof CUBICIN 4 mg/kg IV did not significantly alter the Cmax and AUC0-∞of daptomycin. Nodosage adjustment of CUBICIN is warranted when CUBICIN is coadministered with probenecid.MICROBIOLOGYDaptomycin is an antibacterial agent of a new class of antibiotics, the cyclic lipopeptides. Daptomycin is a natural product that has clinical utility in the treatment of infections caused by aerobic Gram-positive bacteria. The in vitro spectrum of activity of daptomycin encompasses most clinically relevantGram-positive pathogenic bacteria. Daptomycin retains potency againstantibiotic-resistant Gram-positive bacteria, including isolates resistant to methicillin, vancomycin, and linezolid.Daptomycin exhibits rapid, concentration-dependent bactericidal activity against Gram-positive organisms in vitro. This has been demonstrated both by time-kill curves and by MBC/MIC ratios (minimum bactericidal concentration/minimum inhibitory concentration) using broth dilution methodology. Daptomycin maintained bactericidal activity in vitro against stationary phase S. aureus in simulated endocardial vegetations. The clinical significance of this is not known.Mechanism of ActionThe mechanism of action of daptomycin is distinct from that of any other antibiotic. Daptomycin binds to bacterial membranes and causes a rapid depolarization of membrane potential. This loss of membrane potential causes inhibition of protein, DNA, and RNA synthesis, which results in bacterial cell death.Mechanism of ResistanceAt this time, no mechanism of resistance to daptomycin has beenidentified. Currently, there are no known transferable elements that confer resistance to daptomycin.Cross-ResistanceCross-resistance has not been observed with any other antibiotic class.Interactions with Other AntibioticsIn vitro studies have investigated daptomycin interactions with other antibiotics. Antagonism, as determined by kill curve studies, has not been observed. In vitro synergistic interactions of daptomycin with aminoglycosides, β-lactam antibiotics, and rifampin have been shown against some isolates of staphylococci (including some methicillin-resistant isolates) and enterococci (including some vancomycin-resistant isolates).Complicated Skin and Skin Structure Infection (cSSSI) StudiesThe emergence of daptomycin non-susceptible isolates occurred in 2 infected patients across the set of Phase 2 and pivotal Phase 3 clinical trials. In one case, a non-susceptible S. aureus was isolated from a patient in a Phase 2 study who received CUBICIN at less than the protocol-specified dose for the initial 5 days of therapy. In the second case, a non-susceptible Enterococcus faecalis was isolated from a patient with an infected chronic decubitus ulcer enrolled in a salvage trial.S. aureus Bacteremia/Endocarditis and Other Post-Approval StudiesIn subsequent clinical trials, non-susceptible isolates were recovered. S. aureus was isolated from a patient in a compassionate-use study and from 7 patients in the S. aureus bacteremia/endocarditis study (see PRECAUTIONS). An E. faecium was isolated from a patient in a VRE study.Daptomycin has been shown to be active against most isolates of the following microorganisms both in vitro and in clinical infections, as described in the INDICATIONS AND USAGE section.Aerobic and facultative Gram-positive microorganisms:Enterococcus faecalis (vancomycin-susceptible isolates only)Staphylococcus aureus (including methicillin-resistant isolates)Streptococcus agalactiaeStreptococcus dysgalactiae subsp. equisimilisStreptococcus pyogenesThe following in vitro data are available, but their clinical significance is unknown. Greater than 90% of the following microorganisms demonstrate an in vitro MIC less than or equal to the susceptible breakpoint for daptomycin versus the bacterial genus. The efficacy of daptomycin in treating clinical infections due to these microorganisms has not been established in adequate and well-controlled clinical trials.Aerobic and facultative Gram-positive microorganisms:Corynebacterium jeikeiumEnterococcus faecalis (vancomycin-resistant isolates)Enterococcus faecium (including vancomycin-resistant isolates)Staphylococcus epidermidis (including methicillin-resistant isolates) Staphylococcus haemolyticusSusceptibility Testing MethodsSusceptibility testing by dilution methods requires the use of daptomycin susceptibility powder. The testing of daptomycin also requires the presence of physiological levels of free calcium ions (50 mg/L of calcium, using calcium chloride) in Mueller-Hinton broth medium.Dilution TechniqueQuantitative methods are used to determine antimicrobial MICs. These MICs provide estimates of the susceptibility of bacteria to antimicrobial compounds. The MICs should be determined using a standardized procedure1, 2 based on a broth dilution method or equivalent using standardized inoculum and concentrations of daptomycin. The use of the agar dilution method is not recommended with daptomycin2. The MICs should be interpreted according to the criteria in Table 3.A report of “Susceptible” indicates that the pathogen is likely to be inhibited if the antimicrobial compound in the blood reaches the concentrations usually achievable.Table 3. Susceptibility Interpretive Criteria forDaptomycinPathogenBroth Dilution MIC* (µg/mL)S I RNote: S, Susceptible; I, Intermediate; R, Resistant.Staphylococcus aureus≤1(†) (†)(methicillin-susceptible andmethicillin-resistant)Streptococcus pyogenes, Streptococcusagalactiae,≤1(†) (†)and Streptococcus dysgalactiaesubsp. equisimilisEnterococcus faecalis≤4(†) (†)(vancomycin-susceptible only)*The MIC interpretive criteria for S. aureus and E. faecalis are applicable only to tests performed by broth dilution using Mueller-Hinton broth adjusted to a calcium content of 50 mg/L; the MIC interpretive criteria for Streptococcus spp. other than S. pneumoniae are applicable only to tests performed by broth dilution using Mueller-Hinton broth adjusted to a calcium content of 50 mg/L, supplemented with 2 to 5% lysed horse blood, inoculated with a direct colony suspension and incubated in ambient air at 35ºC for 20 to 24 hours.†The current absence of data on daptomycin-resistant isolates precludes defining any categories other than “Susceptible.” Isolates yielding test results suggestive of a “Non-Susceptible” category should be retested, and if the result is confirmed, the isolate should be submitted to a reference laboratory for further testing.Diffusion TechniqueQuantitative methods that require measurement of zone diameters have not been shown to provide reproducible estimates of the susceptibility of bacteria to daptomycin. The use of the disk diffusion method is not recommended with daptomycin2, 3.Quality ControlStandardized susceptibility test procedures require the use of quality control microorganisms to control the technical aspects of the procedures. Standard daptomycin powder should provide the range of values noted in Table 4. Quality control microorganisms are specific strains of organisms with intrinsic biological properties relating to resistance mechanisms and their genetic expression within bacteria; the specific strains used for microbiological quality control are not clinically significant.Table 4. Acceptable Quality ControlRanges for Daptomycin to Be Used inValidation of Susceptibility TestResultsQuality Control StrainBroth DilutionMIC Range*(μg/mL) Enterococcusfaecalis ATCC292121−4Staphylococcusaureus ATCC 292130.25−1Streptococcuspneumoniae ATCC49619†0.06−0.5*The quality control ranges for S. aureus and E. faecalis are applicable only to tests performed by broth dilution using Mueller-Hinton broth adjusted to a calcium content of 50 mg/L; the quality control ranges for S. pneumoniae are applicable only to tests performed by broth dilution using Mueller-Hinton broth adjusted to a calcium content of 50 mg/L, supplemented with 2 to 5% lysed horse blood, inoculated witha direct colony suspension and incubated in ambient air at 35ºC for 20 to 24 hours.†This organism may be used for validation of susceptibility test results when testing Streptococcus spp. other than S. pneumoniae.【Animal Pharmacology】In animals, daptomycin administration has been associated with effects on skeletal muscle with no changes in cardiac or smooth muscle. Skeletal muscle effects were characterized by degenerative/regenerative changes and variable elevations in CPK. No fibrosis or rhabdomyolysis was evident in repeat-dose studies up to the highest doses tested in rats (150 mg/kg/day) and dogs (100 mg/kg/day). The degree of skeletal myopathy showed no increase when treatment was extended from 1 month to up to 6 months. Severity was dose-dependent. All muscle effects, including microscopic changes, were fully reversible within 30 days following cessation of dosing.In adult animals, effects on peripheral nerve (characterized by axonal degeneration and frequently accompanied by significant losses of patellar reflex, gag reflex, and pain perception) were observed at doses higher than those associated with skeletal myopathy. Deficits in the dogs’ patellar reflexes were seen within 2 weeks of the start of treatment at 40 mg/kg (9 times the human Cat the 6 mg/kgmaxq24h dose), with some clinical improvement noted within 2 weeks of the cessation of dosing. However, at 75 mg/kg/day for 1 month, 7/8 dogs failed to regain full patellar reflex responses within the duration of a 3-month recovery period. In a separate study in dogs receiving doses of 75 and 100 mg/kg/day for 2 weeks, minimal residual histological changes were noted at 6 months after cessation of dosing. However, recovery of peripheral nerve function was evident.Tissue distribution studies in rats have shown that daptomycin is retained in the kidney but appears to only minimally penetrate across the blood-brain barrier following single and multiple doses.【Clinical Studies】Complicated Skin and Skin Structure InfectionsAdult patients with clinically documented cSSSI (Table 10) were enrolled in two randomized, multinational, multicenter, investigator-blinded studies comparing CUBICIN (4 mg/kg IV q24h) with either vancomycin (1 g IV q12h) or ananti-staphylococcal semi-synthetic penicillin (i.e., nafcillin, oxacillin, cloxacillin, or flucloxacillin; 4 to 12 g IV per day). Patients known to have) bacteremia at baseline were excluded. Patients with creatinine clearance (CLCR between 30 and 70 mL/min were to receive a lower dose of CUBICIN as specified in the protocol; however, the majority of patients in this subpopulation did not have the dose of CUBICIN adjusted. Patients could switch to oral therapy after a minimum of 4 days of IV treatment if clinical improvement was demonstrated.One study was conducted primarily in the United States and South Africa (study 9801), and the second (study 9901) was conducted at non-US sites only. Both studies were similar in design but differed in patient characteristics, including history of diabetes and peripheral vascular disease. There were a total of 534 patients treated with CUBICIN and 558 treated with comparator in the two studies. The majority (89.7%) of patients received IV medication exclusively.The efficacy endpoints in both studies were the clinical success rates in the intent-to-treat (ITT) population and in the clinically evaluable (CE) population. In study 9801, clinical success rates in the ITT population were 62.5% (165/264) in patients treated with CUBICIN and 60.9% (162/266) in patients treated with comparator drugs. Clinical success rates in the CE population were 76.0% (158/208) in patients treated with CUBICIN and 76.7% (158/206) in patients treated with comparator drugs. In study 9901, clinical success rates in the ITT population were 80.4% (217/270) in patients treated with CUBICIN and 80.5% (235/292) in patients treated with comparator drugs. Clinical success rates in the CE population were 89.9% (214/238) in patients treated with CUBICIN and 90.4% (226/250) in patients treated with comparator drugs.The success rates by pathogen for microbiologically evaluable patients are presented in Table 11.Table 10. Invest igator’s Primary Diagnosis in the cSSSI Studies(Population: ITT)Study 9801 Study 9901 Pooled PrimaryDiagnosisCUBICIN/Comparator*CUBICIN/Comparator* CUBICIN/Comparator* N=264/N=266 N=270/N=292 N=534/N=558Wound Infection 99 (37.5%)/116(43.6%)102 (37.8%)/108(37.0%)201 (37.6%)/224(40.1%)Major Abscess 55 (20.8%)/43(16.2%)59 (21.9%)/65(22.3%)114 (21.3%)/108(19.4%)Ulcer Infection 71 (26.9%)/75(28.2%)53 (19.6%)/68(23.3%)124 (23.2%)/143(25.6%)Other Infection†39 (14.8%)/32(12.0%)56 (20.7%)/51(17.5%)95 (17.8%)/83(14.9%)*Vancomycin or anti-staphylococcal semi-synthetic penicillins.†The majority of cases were subsequently categorized as complicated cellulitis, major abscesses, or traumatic wound infections.Table 11. Clinical Success Rates by InfectingPathogen, Primary Comparative cSSSI Studies(Population: Microbiologically Evaluable)Success Rate Pathogen CUBICIN Comparator*n/N (%) n/N (%)Methicillin-susceptible Staphylococcus aureus (MSSA)†170/198(85.9)180/207(87.0)Methicillin-resistant Staphylococcus aureus (MRSA)†21/28(75.0)25/36 (69.4)Streptococcus pyogenes79/84(94.0)80/88 (90.9)Streptococcus agalactiae23/27(85.2)22/29 (75.9)Streptococcus dysgalactiaesubsp. equisimilis8/8 (100) 9/11 (81.8)Enterococcus faecalis (vancomycin-susceptible only)27/37(73.0)40/53 (75.5)*Vancomycin or anti-staphylococcal semi-synthetic penicillins.†As determined by the central laboratory.S. aureus Bacteremia/EndocarditisThe efficacy of CUBICIN in the treatment of patients with S. aureus bacteremia was demonstrated in a randomized, controlled, multinational, multicenter open-label study. In this study, adult patients with at least one positive blood culture for S. aureus obtained within 2 calendar days prior to the first dose of study drug and irrespective of source were enrolled and randomized to either CUBICIN (6 mg/kg IV q24h) or standard of care [anti-staphylococcal semi-synthetic penicillin 2 g IV q4h (nafcillin, oxacillin, cloxacillin, or flucloxacillin) or vancomycin 1 g IV q12h, both with initial gentamicin 1 mg/kg IV every 8 hours for first 4 days]. Of the patients in the comparator group, 93% received initial gentamicin for a median of 4 days compared with 1 patient (<1%) in the CUBICIN group. Patients with prosthetic heart valves, intravascular foreign material that was not planned for removal within 4 days after the first dose of study medication, severe neutropenia, known osteomyelitis, polymicrobial bloodstream infections, creatinine clearance <30 mL/min, and pneumonia were excluded.Upon entry, patients were classified for likelihood of endocarditis using the modified Duke criteria (Possible, Definite, or NotEndocarditis). Echocardiography, including a transesophageal echocardiogram。
利巴韦林片

达诺欣(注射用头孢哌酮钠)【药品名称】商品名称:达诺欣通用名称:注射用头孢哌酮钠英文名称:Acetamide Injection【成份】本品主要成分为头孢哌酮钠,其化学名为(6R,7R)-3-[[(1-甲基-1H-四唑-5基)硫]甲基]-7-[(R)-2-(4-乙基-2,3-二氧代-1-哌嗪碳酰氨基)-2-对羟基苯基-乙酰氨基]-8-氧代-5-硫杂-1-氮杂双环[4.2.0]辛-2-烯-2-甲酸钠盐。
其分子式:C25H26N9NaO8S2。
【适应症】适用于敏感菌所致的各种感染如肺炎及其他下呼吸道感染、尿路感染、胆道感染、皮肤软组织感染、败血症、腹膜炎、盆腔感染等,后两者宜与抗厌氧菌药联合应用。
【用法用量】可供肌内注射、静脉注射或静脉滴注。
成人常用量:一般感染,一次1~2g,每12小时1次;严重感染,一次2~3g,每8小时1次。
接受血液透析者,透析后应补给1次剂量。
成人一日剂量不超过9g,但在免疫缺陷病人有严重感染时,剂量可加大至每日12g。
小儿常用量:每日50~200mg/kg,分2~3次静脉滴注。
制备肌内注射液,每1g药物加灭菌注射用水2.8ml及l2%利多卡因注射液1ml,其浓度为250mg/ml。
静脉徐缓注射者,每1g 药物加葡萄糖氯化钠注射液40ml溶解;【不良反应】1 皮疹较为多见,达2.3%或以上。
2 少数病人尚可发生腹泻、腹痛、嗜酸粒细胞增多,轻度中性粒细胞减少。
3 暂时性血清氨基转移酶、碱性磷酸酶、尿素氮或血肌酐升高。
4 血小板减少、凝血酶原时间延长等可见于个别病例。
偶有出血者,可用维生素K预防或控制。
5 菌群失调可在少数病人出现。
6 应用本品期间饮酒或接受含酒精药物或饮料者可出现双硫仑(disulfiram)样反应。
【禁忌】对头孢菌素类过敏及有青霉素过敏休克和即刻反应史者禁用本品。
【注意事项】1 本品治疗婴儿感染也获较好疗效,但对早产儿和新生儿的研究尚缺乏资料。
2 对诊断的干扰:用硫酸铜法进行尿糖测定时可出现假阳性反应,直接抗球蛋白(Coombs)试验呈阳性反应。
头孢克肟详细说明书

【药物名称】中文通用名称:头孢克肟英文通用名称:Cefixime其他名称:阿帕奇、安的克妥、安的克威、安捷仕、氨噻肟烯头孢菌素、奥德宁、彼优素、达力芬、扶欣抗、汉光妥、汇新沙、积大希夫、基洛、今辰(头孢克肟)、久邦、君特、康哌、抗之霸(头孢克肟)、克力罗、克林盾、克沃莎(头孢克肟)、魁克、乐宁(头孢克肟)、立健克、洛伟克、诺百优、欧健、琪安、勤克沃、青可奕、瑞优达、赛可恩、舍尔、士瑞克、世福素、舒妥、数码宝贝、司力捷、速普乐、特力素、特普宁、天立威、威尤可、西复欣、先强严灵、新达欣、新福素、严逸、依萌泰、誉舒、再握、正卫佳、Aerocef、Cefiximum、Cefixoral、Ce fnixime、Cefspan、Cephoral、Denvar、Fixim、Necopen、Novacef、Oro ken、Suprax、Tricef。
【临床应用】CFDA说明书适应症本药适用于治疗敏感菌所致的下列感染:1.呼吸系统感染,如慢性支气管炎急性发作、急性支气管炎并发细菌感染、支气管扩张合并感染、肺炎、鼻窦炎。
2.泌尿系统感染,如肾盂肾炎、膀胱炎、淋球菌性尿道炎。
3.急性胆道系统细菌性感染,如胆囊炎、胆管炎。
4.其他感染,如中耳炎、猩红热。
其他临床应用参考用于性侵犯受害者预防性传播疾病。
临床指南2014年欧洲儿童急性胃肠炎治疗循证指南——抗感染治疗方案解读2015年美国疾病控制中心性传播疾病的诊断和治疗指南(续)——淋病的诊断和治疗指南2015年美国疾病控制中心性传播疾病诊断和治疗指南更新内容和解读(续完) 解读“美国感染性疾病学会儿童和成人急性细菌性鼻及鼻窦炎临床指南”抗菌药物临床应用指导原则(2015年版)慢性阻塞肺疾病急性加重抗感染治疗川渝专家建言欧洲2015年儿童泌尿系感染诊治指南解读欧洲儿童急性胃肠炎处理循证指南(2014年版)实用儿科诊疗规范-儿科:感染性疾病(五)血液净化急诊临床应用专家共识中国成人社区获得性肺炎诊断和治疗指南(2016年版)中国儿童急性感染性腹泻病临床实践指南【用法与用量】成人·常规剂量·普通感染1.口服给药一次100mg,一日2次。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Cubicin_V(1) 2010-06-09
克必信简短处方资料 通用名称:注射用达托霉素 商品名称:克必信/CUBICIN 成份 本品主要成份为达托霉素。 规格 0.5g 适应症 金黄色葡萄球菌(包括甲氧西林敏感和甲氧西林耐药)导致的伴发右侧感染性心内膜炎的血 流感染(菌血症)。如果确定或怀疑的病原体包括革兰阴性菌或厌氧菌,则临床上可采用联 合抗菌治疗。 在患有由金黄色葡萄球菌引起的左侧感染性心内膜炎的患者中,尚未证实克必信的有效性。 克必信不适用于治疗肺炎。 其他请详见说明书。 用法用量 将 6mg/kg 克必信溶解在 0.9%氯化钠注射液中,以 30 分钟的时程滴注,每 24 小时一次,至 少 2~6 周。克必信的给药次数不得超过每天一次。 成年患者的克必信(注射用达托霉素)推荐剂量
肌酐清除率(CLCR)
剂量方案
≥30ml/min
每 24 小时 6mg/Байду номын сангаасg
<30ml/min,包括血液透析或 CAPD
每 48 小时 6mg/kg
对肾功能不全的患者,应增加对肾功能和 CPK 进行监测的频率。如有可能,在血液透析日 完成血液透析后,再给予克必信。 克必信不得与含右旋糖的稀释液联合使用。 实验室改变: 在金黄色葡萄球菌菌血症/心内膜炎研究中,共有11名(9.2 %)以克必信治疗的患者因治疗 导致CPK>500 U/L,其中4人CPK升高超过10倍ULN。这11名患者中的3人在继续使用克必信 治疗的过程中CPK水平回落到正常范围内,6名患者在随访期内恢复正常值,1名患者在末次 评估时回到基线水平,1人未报告任何随访期数据。3名患者因CPK升高而停用克必信。 其他请详见说明书。 不良反应 按系统器官分类,在金黄色葡萄球菌菌血症/心内膜炎(6mg/kg 克必信)患者最常见的不良 事件(发生率>5%)为感染、胃肠道症状、全身疾病及注射部位情况、呼吸器官、胸部及纵 隔疾病、皮肤和皮下组织症状、肌肉骨骼及结缔组织症状、精神症状、神经系统症状、检查、 血液及淋巴系统疾病、代谢及营养紊乱、血管疾病、肾及泌尿疾病等。 其它请详见说明书。 禁忌 已知对达托霉素和辅料有过敏反应的患者禁用克必信。 注意事项 警告:对于包括克必信在内的几乎所有的抗菌剂,均已报告能够引起艰难梭状芽孢杆菌相关 性肠炎(CDAD),严重程度从轻度腹泻至致命的结肠炎不等。抗菌制剂治疗会改变结肠的 正常菌群,导致艰难梭状芽孢杆菌过度生长。 其它请详见说明书。 孕妇及哺乳期妇女用药 妊娠期用药
Cubicin_V(1) 2010-06-09
致畸作用:妊娠期药品安全分级 B 在大鼠和家兔体内进行了生殖和畸形学研究,给药剂量达 75mg/kg(按体表面积计算,此剂 量分别为人用剂量 6mg/kg 的 2 倍和 4 倍) 未见因达托霉素对妊娠或胚胎发育影响的证据。, 只有在非常必要的情况下才可在妊娠期间使用本品。 哺乳期妇女用药 尚不知达托霉素是否能够分泌至人乳中。因此哺乳期妇女应慎用克必信。 儿童用药 尚未在 18 岁以下的患者中建立克必信的安全性和有效性。 老年用药 在 cSSSI 和金黄色葡萄球菌菌血症/心内膜炎的 3 期临床研究中,与年龄小于 65 岁的患者相 比,年龄≥65 岁的患者的临床有效率较低。另外,与年龄小于 65 岁的患者相比,在年龄≥65 岁的患者中更常在治疗中出现不良事件。 药物相互作用 在人体对克必信和其它药物(可能与克必信联合用药或产生重叠毒性)进行了药物相互作用 研究。克必信对氨曲南、华法林和丙磺舒的生物利用度无影响。 其他请详见说明书。 药物过量 药物过量时,建议进行支持治疗以维持肾小球滤过作用。通过血液透析 小时恢复约 15 %)(4 或腹膜透析(48 小时恢复约 11 %),达托霉素能从体内缓慢清除。在进行血液透析的 4 小 时内使用高通量透析膜较低通量膜可以增加清除的药物量。 贮藏 2~8℃(36~46℉)冰箱中原包装保存,避免受热。 包装 一次性使用的 10mL 1 型光亮的西林瓶,1 型橡胶塞和带蓝色拉环的铝帽,0.5g/瓶:每盒 1 瓶 有效期 36 个月 执行标准 JX20070250
