3.1第三章 水环境化学-1
环境化学第三章水

二节 气体在水中的溶解性
水的质量特征:
• 酸度和碱度
第一节 概述
• 盐度和氯度:1千克水中碳酸盐转变为氧化物、溴化物 和碘化物转变为氯化物、有机物完全氧化后所含固体 的总克数。
• 硬度 • 溶氧量:25℃时的饱和浓度
[O2 (aq)] = 2.6×10-3 mol/L = 8.32 mg/L
• 清度和色度
化合物直接与 pH值有关,实际涉及到水解和羟基配合物的平
衡过程,该过程往往复杂多变,这里用强电解质的最简单关 系式表述: Me(OH)n(s) → Men+ + nOH根据溶度积表达式 可导出金属离子浓度 等号两边取负对数: Ksp = [Men+][OH-]n [Men+] = Ksp/[OH-]n = Ksp[H+]n/Kwn -lg[Men+] =-lgKsp-nlg[H+] + nlgKw (3-21)
HS- → H+ + S2则总反应: H2S →2 H+ + S2-
K2= 1.3×10-15
K1,2=K1K2=1.16×10-22
三、溶解沉淀平衡
在饱和水溶液中,H2S浓度总是保持在0.1mol/L,则 [H+]2[S2-] = K1,2×[H2S] = 1.16×10-22×0.1 = 1.16×10-23 由于在水溶液中 H 2 S 的二级电离甚微,故可近似认为 [H+] = [HS-],因此可求得溶液中[S2-]浓度:
三、溶解沉淀平衡
第二节 天然水中的平衡
溶解和沉淀是污染物在水环境中迁移的重要途径,一般金
属化合物在水中迁移能力,直观地可以用溶解度来衡量。
溶解度小者,迁移能力小; 溶解度大者,迁移能力大。 在固—液平衡体系中,需用溶度积来表征溶解度。
第三章 水环境化学-1

37
1.2 天然水的基本特征
计算25 ℃饱和水中CO2的溶解度。
25℃时 [O2(aq)]= 8.32 mg/L
30
1.2 天然水的基本特征
溶解的气体成分
¾ 主要气体有:N2、O2、CO2、H2S 等
气体 mg/L
海水中主要溶解气体的含量范围
O2
N2
CO2 H2S
Ar
0-8.5 8.4-14.5 34-56 0-12 0.2-0.4
31
1.2 天然水的基本特征
链接2:东湖水污染严7重
水环境化学
研究化学物质在天然水体中的分布、 形态、反应机理、迁移转化、归趋的规律 与化学行为及其对生态环境的影响。
存在、运动、效应
8
全球水循环示意图
9
本章要点
¾水的结构与性质、天然水的基本特征; ¾水中重要污染物存在形态及分布; ¾污染物在水环境中的迁移转化原理及水质模型。
[H+]=[HCO3-] [H+]2/([CO2]CӨ)=K1=4.45×10-7
38
1.2 天然水的基本特征
计算25 ℃饱和水中CO2的溶解度。 [H+]=(1.028×10-5×4.45×10-7)0.5 mol/L
= 2.14×10-6 mol/L pH= 5.67 CO2在水中的溶解度为:
¾ 自养生物利用太阳能或化学能,把简单的无机元素 引至复杂的生物分子中组成生命体。
(完整版)第三章水环境化学答案

第三章水环境化学1、请推导出封闭和开放体系碳酸平衡中[H 2CO 3*]、[HCO 3-]和[CO 32-]的表达式,并讨论这两个体系之间的区别。
解: 开放体系,考虑到CO 2在气液相之间的平衡,[H 2CO 3*] 不变根据亨利定律: [CO 2(aq)] = K H Pco 2 lg[H 2CO 3*] ≈ lg[CO 2(aq)] = lg K H + lg Pco 2 = - 4.9lg[HCO 3-] = lg K 1 + lg [H 2CO 3*] + pH= -11.3 + pHlg[CO 32-] = lgK 1 + lgK 2 + lg[H 2CO 3*] + 2pH= -21.6 + 2pH*][][][*][]][[32133231CO H H K HCO CO H HCO H K +--+==*][][][*][][][32221233223221CO H H KK CO CO H CO H K K +--+⋅==⋅][][][233*32--++=CO HCO CO H C T 是常数。
的总和为各种碳酸化合态浓度假设,T C TC HCO ⎥⎦⎤⎢⎣⎡-=31αTC CO ⎥⎦⎤⎢⎣⎡-=232αTC CO H ⎥⎦⎤⎢⎣⎡*=320α122122][][1(-+++=K H K K H α1211)][][1(-++++=H K K H α122110][][1(-++++=H K K H K α*][][][*][]][[32133231CO H H K HCO CO H HCO H K +--+==*][][][*][][][32221233223221CO H H K K CO CO H CO H K K +--+⋅==⋅][][][][21233*32+--H K K CO HCO C CO H T 和含有的表示式,,为变量表示以:,][],[*],[21023332得到,,代入把αααT C CO HCO CO H --eg oo d 2、请导出总酸度、CO 2酸度、无机酸度、总碱度、酚酞碱度和苛性碱度的表达式作为总碳酸量和分布系数(α)的函数。
3.1.2天然水的基本特征(1)

第三章:水环境化学——天然水的性质第三章:水环境化学——天然水的基本特征以及污染物存在形态一、水和水分子结构的特异性二、天然水的基本特征1、天然水的组成(离子、溶解气体、水生生物)2、天然水的化学特征3、天然水的性质(1)碳酸盐系统(2)酸度和碱度(3)天然水的缓冲能力● 缓冲溶液能够抵御外界的影响,使其组分保持一定的稳定性,pH 缓冲溶液能够在一定程度上保持pH 不变化。
● 天然水体的pH 值一般在6-9之间,而且对于某一水体,其pH 几乎保持不变,这表明天然水体具有一定的缓冲能力,是一个缓冲体系。
● 一般认为各种碳酸盐化合物是控制水体pH 值的主要因素,并使水体具有缓冲作用。
但最近研究表明,水体与周围环境之间发生的多种物理、化学和生物化学反应,对水体的pH 值也有着重要作用。
● 但无论如何,碳酸化合物仍是水体缓冲作用的重要因素。
因而,人们时常根据它的存在情况来估算水体的缓冲能力。
对于碳酸水体系,当pH<8.3时,可以只考虑一级碳酸平衡,故其pH 值可由下式确定:][][lg 3*321--=HCO CO H pK pH如果向水体投入△B 量的碱性废水时,相应由△B 量H 2CO 3*转化为HCO 3-,水体pH 升高为pH ',则:B HCO BCO H pK pH ∆+∆--=-][][lg 3*321'水体中pH 变化为△pH=pH '-pH ,即:][][lg ][][lg 3*323*32--+∆+∆--=∆HCO CO H B HCO BCO H pH由于通常情况下,在天然水体中,pH=7左右,对碱度贡献的主要物质就是[HCO 3-],因此经常情况下,可以把[HCO 3-]作为碱度。
若把[HCO 3-]作为水的碱度,[H 2CO 3*]作为水中游离碳酸[CO 2],就可推出:△B=[碱度][10△pH -1]/(1+K 1×10pH+△pH )△pH 即为相应改变的pH 值。
第三章水环境化学

TDS=[K++Na++Ca2++Mg2+]+[HCO3-+NO3-+Cl-+SO42-
2、天然水的性质
(Characteristic of Natural Waters) (1)碳酸平衡(Balance of H2CO3) 水体中存在四种化合态:
CO2、CO32-、HCO3-、H2CO3
第三章 水环境化学
(Water Environmental Chemistry)
本章重点
1、无机污染物在水体中进行沉淀-溶解、氧化-还原、 配合作用、吸附-解吸、絮凝-沉淀的基本原理;
2、计算水体中金属存在形态;
3、pE计算;
4、有机污染物在水体中的迁移转化过程和分配系数、 挥发速率、水解速率、光解速率和生物降解速率的 计算方法。
农药
有机氯 有机磷
多氯联苯 (PCBS) 卤代脂肪烃 醚
单环芳香族化合物 苯酚类和甲酚类 酞酸酯类 多环芳烃(PAH) 亚硝胺和其他化合物
2、金属污染物 (Metal Pollutant)
Cd、 Hg、 Pb、 As、 Cr、 Cu、 Zn、 Tl、 Ni、 Be
第二节 水中无机污染物的迁移转化
强酸 弱酸 强酸弱碱盐
总酸度= [H+]+ [ HCO3-] +2[H2CO3*] - [ OH-] CO2酸度= [H+]+ [H2CO3*] - [CO32-] - [ OH-] 无机酸度= [H+]- [ HCO3-]-2 [CO32-] - [ OH-]
二、水中污染物的分布及存在形态
1、有机污染物 (Organic Pollutant)
环境化学课件第三章 水环境化学

图 水环境体系(水体)
<返回>
水环境化学是研究化学物质在天然水体中的存在形态、反应机制 、迁移转化和归趋的规律及其化学行为对生态环境的影响。水环 境化学是环境化学的重要组成部分,为水污染控制和水资源的保 护提供了科学依据。
水环境化学研究的领域包括河口、海洋、河流、湖泊等。
研究的特点是: (1)体系非常复杂 离子、分子、胶体微粒 (2)界面现象突出、重要 重金属、有机物附着在胶体微粒面
海湾 海
大洋 海洋沉积物间隙水
DP Dg K
P 0
水循环 Water cycle
1.水的自然循环: 特点:①由降雨量自然循环的大致尺度
②水的性质基本不变 2.水的社会循环 特点:①工业与生活污水的产生与排放是主
要的污染源 ②水的性质不断变化
水资源的主要问题
●我国水资源人均和亩均水量少; ●水资源在地区分布上很不均匀,水土资源 组合不平衡 ●水量年内及年际变化大,水旱灾害频繁 ●水土流失严重,许多河流含沙量大; ●我国水资源开发利用各地很不均衡
第三章 水环境化学 Aquatic chemistry
知识点:认识天然水的基本特征和污染物的分布形 态,掌握水中污染物的迁移转化规律,学 会建立水质模型
重 点:水中污染物的迁移和转化规律 难 点:水质模型的建立
水圈:Hydrosphere 1978年.R.A.Horne
环境化学:第三章 水环境化学 1

第一节 天然水的基本特征及污染物的存在形态
②
CO2的溶解度
已知: 干空气中CO2的含量为0.0314%(体积),水
在25℃时蒸气压为0.03167×105 Pa, CO2的亨利定律
常数是3.34×10-7mol/(L·Pa) (25℃), CO2溶于水后发生
的化学反应是:
CO2+H2O = H++HCO3-
CO32-
60
α 40
20
0
2
4
6
8
10
pH
图3-1 碳酸化合态分布图
12
第一节 天然水的基本特征及污染物的存在形态
对于开放体系,应考虑大气交换过程:
[CO 2 (aq)] K H pCO 2
CT [CO 2 (aq)] / 0
1
0
K H pCO 2
1
K1
[HCO ] CT 1
人均水资源量相当于世界人均量的1/4。已经被联合
国列为13个贫水国家之一。
第一节 天然水的基本特征及污染物的存在形态
一、天然水的基本特征
1.天然水的组成
天然水体——包括水、水中的溶解物、悬浮物
以及底泥和水生生物。
天然水的组成按形态分为:可溶性物质和悬浮物质。
悬浮物质包括:
悬浮物、颗粒物、水生生物等。
一般情况下,天然水中存在的气体有O2、CO2、
H2S、N2和CH4等。
表3-2 海水中主要溶解气体的含量范围
气体
含量范围
/mg·L-1
O2
0~8.5
N2
CO2
H2S
Ar
8.4~14.5
第三章-环境水化学1

TDS=[ K++Na++Ca2++Mg2+]
+[HCO3-+Cl-+SO42-]
(2)水中的金属离子:可通过酸-碱、沉淀、配 合及氧化-还原等化学反应达到最稳定的状态。 水中可溶性金属离子可以多种形态存在。这些 形态在中性水体中的浓度可通过平衡常数加以计 算: Kc Θ =
[G]g ·[D]d [A]a · b [B]
无机酸度
酸度
总酸度 苛性碱度
碱度
cT ,CO3 CO32
pH 10 11
碳酸盐碱度 总碱度
cT ,CO3 CO32 pH=10 11 cT ,CO3 HCO3 pH=8.3 cT ,CO3 H 2 CO pH=4.5
1929年美国合成,我国70年代开始生产 主要用途: 用作润滑材料、增塑剂、杀菌剂、 热载体及变压器油等。 危害:可燃、高毒 辛醇-水分配系数(Kow) :有机化合物在水 和N-辛醇两相平衡浓度之比。辛醇对有机物的 分配与有机物在土壤有质的分配极为相似,分配 系数的数值越大,有机物在有机相中溶解度也越 大,即在水中的溶解度越小。
aA + bB
Kc Θ =
gG + dD
[G]g ·[D]d [A]a · b [B]
本章内容:
1、天然水的基本特征及污染物的存在形式 2、水中无机污染物的迁移转化 3、水中有机污染物的迁移转化
第一节 天然水的基本特征及污染物的存 在形态
一、天然水的基本特征 1.天然水的组成 天然水中一般含有可溶性物质和悬浮物质 (包括悬浮物、颗粒物、水生生物等)。 可溶性物质主要是地壳矿物质。
如果滴定是以酚酞作为指示剂,当溶液的pH值达 到8.3时,表示OH-被中和,CO32-全部转化为 HCO3-,作为碳酸盐只中和了一半,因此,得到 酚酞碱度的表示式: 酚酞碱度= [ CO32-]+[OH-]-[H2CO3*]-[H+] 达到pH CO32- 所需酸量时的碱度称为苛性碱度。
环境化学-第三章-水环境化学-第二节-水中无机污染物的迁移转化

(c)之间的关系可用吸附等温线表达。
Henry 型等温线为直线型
G = k ·c
k:分配系数
Freundlich 型等温线
G = k ·c ·exp(1/n) lgG = lgk + 1/n lgc
Langmuir 型等温线
G = G0·c /(A+c)
1/G = 1/G0 + (A/ G0)(1/c)
①不同离子强度有不同VR曲线,呈指数下降; ②VA与粒子强度无关,只随颗粒间的距离变化; ③不同离子强度有不同的VT曲线;离子强度较小时,综合位能曲 线上出现较大位能峰,排斥力占优势,体系保持分散稳定状态;
离子强度较大时,双电层被压缩,Vmax 降低,一部分颗粒可能超 越该位能峰。
2、异体凝聚理论
②范德化引力和静电排斥力是仅有的作用因素 ③没有化学专属吸附作用 颗粒在水溶液中进行热运动,其平均动能为3/2 kT (2)理论描述 总的综合作用位能:VT = VR + VA VA——由范德华力产生的位能 VR——由静电排斥力所产生的位能
VHale Waihona Puke VRVTVmax
VA
d 两个离子靠得 很近时,要考 虑水化膜阻力
专属吸附:指在吸附过程中,除了化学键作用外,尚有加 强的憎水键和范德华力或氢键作用。该作用不单可以使表 面点荷改变符号,还可以使离子化合物吸附在同号电荷的 表面上。
项目 作用
离子交换吸附 离子交换作用
电性 表面电荷 动力学
同种电性不发生 不变
快速可逆
专属吸附
范德化力、化学键、氢键、 增水键
同种电性发生 可变
G0——单位表面上达到饱和时间的最大吸附量;
A——常数。
《环境化学》第三章 水环境化学

d) 水体悬浮沉积物:水体中胶体物质聚集体。矿物微粒为 骨架,有机物和水合物结合在表面
e) 藻类、细菌、病毒、油迹、表面活性物质
一、颗粒物与水之间的迁移
二、水中颗粒物的聚集
异体凝聚理论
适用于处理物质本性不同、粒径不等、电荷符号不同、电位 高低不等之类的分散体系
电性相异的胶粒相接近,吸引力占优势 电性相同的胶粒相接近,位能最大值取决于荷电较弱而
电位较低的一方。 只要有一种的稳定性甚低而电位达到临界状态,就必然
发生快速凝集
二、水中颗粒物的聚集
口沉积物氧化还原电位降低 ③ 降低pH值, 导致碳酸盐和
氢氧化物溶解 ④ 增加水中配合剂的含量, 稳
定的配合物的形成导致重金 属元素的形态变化
二、水中颗粒物的聚集
凝集:由电解质促成的胶体颗粒聚集 絮凝:由聚合物促成的胶体颗粒聚集
DLVO理论——解释胶体聚集的理论
DLVO理论假设: a) 胶粒为粒度相等的球体 b) 引力:多分子范德华力(VA) c) 斥力:扩散双电层排斥力(VR)(静电+水化膜) d) 胶粒间的综合位能: VT = VR + VA
(1)
Fe3+ + 2H2O = 2H+ + Fe(OH)2+
(2)
H++OH-=H2O
(3)
Fe(OH)3(s) = Fe(OH)2+ + OH-
(4)
lgK4=lgK1+lgK2+2lgK3=(-38)+(-6.74)+214=-16.74
水环境化学-第三章 天然水的主要离子(专业知识模板)

第三章天然水的主要离子第一节水的硬度及钙镁离子一、水硬度的概念及表示单位硬度是指水中二价及多价离子含量的总和。
这些离子包括Ca2+, Mg2+、Fe2+、Mn2+、Fe3+、Al3+等。
构成天然水硬度的主要离子是Ca2+, Mg2+,一般都以这两种离子的含量来计算硬度。
表示水硬度的单位有很多种,目前应用较多的有以下三种:1)毫摩/升(mmol/L)这个单位以1L水中含有的形成硬度离子的物质的量之和来表示。
为常用硬度单位。
2)毫克/升(CaCO3) 以1L水中所含有的与形成硬度离子的量所相当的CaCO3的质量表示,符号为mg/L (CaCO3)。
3)德国度(°H G) 此单位是将水中的Ca2+和Mg2+含量换算为相当的CaO量后,以1L水中含10mgCaO为1德国度(°H G)。
以上三个水硬度单位的换算关系为:1mmol/L =2.804德国度=50.05 mg/L (CaCO3)二、天然水的硬度与Ca2+, Mg2+(一)钙、镁钙在天然水中主要以Ca2+离子形式存在,是天然水中重要的离子。
钙的来源主要有含石膏地层中CaSO4 2H2O的溶解,白云石(CaCO3 MgCO3),方解石(CaCO3)在水和CO2作用下的溶解等。
地面水中,含钙量少的只有每升数毫克。
海水含钙量较多。
钙是多数淡水中含量最多的阳离子。
随着含盐量的增加,其含量也增加,但由于其易生成碳酸钙沉淀,使积累减慢,以致钠、镁的含量在盐度高的水中就大大超过钙。
镁存在于所有的天然水中,含量仅次于钠或钙,常居阳离子第二。
多数淡水中,1-40 mg/L。
(二)天然水的硬度主要是由Ca2+, Mg2+离子形成的。
考虑到水中与硬度共存的阴离子的组成,可将硬度分为碳酸盐硬度与非碳酸盐硬度。
1)碳酸盐硬度是指水中与HCO3-及CO32-所对应的硬度。
这种硬度在水加热煮沸后,绝大部分可以因生成CaCO3沉淀而除去,故又称为暂时硬度。
2)非碳酸盐硬度是对应于硫酸盐和氯化物的硬度,即由钙镁的硫酸盐、氯化物形成的硬度。
第三章 水环境化学
pKc1
pKc2
结论:
Ⅰ Ⅱ Ⅲ Ⅳ Ⅴ pH<<pKc1 pH=pKc1 pH=pKc2 pH>>pKc2 pH=1/2(pKc1+pkc2) H2CO3* αH2CO3*=αHCO3αHCO3-=αCO32CO32HCO3-
3:开放碳酸体系
= -21.6 + 2pH
由以上方程式作lgc—pH图可看出
3. 碱度的测定:
(原理: 中和滴定法,根据消耗的酸量求出)
c V 1000 碱度(mmol/L ) Vs 单位:mmol[H ]/L
式中:Vs——水样体积)(mL) c——HCl浓度(mol/L) V——HCl体积(mL)
思考:碱度和碱性的区别
例如:若一个天然水的pH为7.0,碱度为1.4mmo1/l, 求需加多少酸才能把水体的pH降低到6.0。
二、水体中的污染物
病原体污染物
耗氧污染物 植物营养物 石油类污染物 放射性物质
酸、碱、盐无机污染物
热污染
有毒污染物
(1)重金属
(2)无机阴离子 (3)有机农药、多氯联苯 (4)致癌物质 (5)一般有机物质
三、水体中的污染物的运动过程
大气降落物 污水排入
1.稀释、扩散过程
3.转化过程
溶解在天然水中的物质
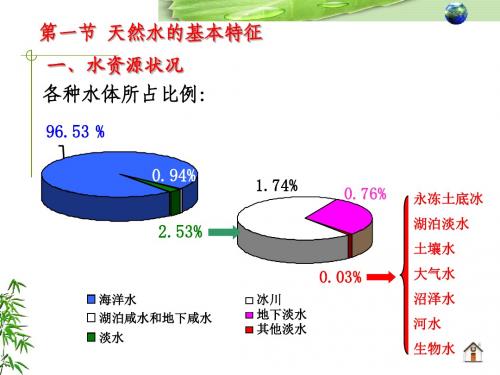
1、主要离子 主要阳离子有: Ca2+、Mg2+、Na+、K+。 主要阴离子有: Cl-、SO42-、HCO3-、CO32-。 这八种离子可占水中溶解固体总量的95%~99%以上。 陆地水中下列成分的含量顺序一般为: HCO3- >SO42- >Cl-,Ca2+ >Na+ >Mg2+ 海水中相应的含量顺序为: Cl- >SO42- >HCO3-,Na+ >Mg2+ >Ca2+。
第三章 水环境化学习题解答

第三章水环境化学一、填空题1、天然水体中常见的八大离子包括:K+、Na+、Ca2+、Mg2+、HCO3-、NO3-、Cl-、SO42-。
2、天然水体中的碳酸平衡体系a0、a1、a2分别表示[H2CO3*]、[HCO3-]、[CO32-]的分配系数,其表达式分别为:(用pH\K1\K2表达):a 0=[H2CO3*]/{[ H2CO3*]+[ HCO3-]+[ CO32-]}=[H+]2/{[H+]2+K1[H+]+K1K2}a 1=[ HCO3-] /{[ H2CO3*]+[ HCO3-]+[ CO32-]}= K1[H+]/{[H+]2+K1[H+]+K1K2}a 2=[ CO32-] /{[ H2CO3*]+[ HCO3-]+[ CO32-]}= K1K2/{[H+]2+K1[H+]+K1K2}。
(注:此三个公式前半段教材119-120页有错误!)a 0+a1+a2=13、根据溶液质子平衡条件得到酸度低表达式:总酸度=[H+]+2[ H2CO3*]+[HCO3-]-[OH-];CO2酸度= [H+]+[H2CO3*]-[CO32-]-[OH-](注:教材121此公式错误),无机酸度= [H+]-[HCO3-]-2[CO32-] -[OH-] 。
4、根据溶液质子平衡条件得到酸度低表达式:总碱度= [OH-] +2[CO32-]+[HCO3-]-[H+];酚酞碱度= [OH-] +[CO32-]-[H+]-[ H2CO3*];苛性碱度= [OH-] -2[ H2CO3*]-[HCO3-]-[H+]。
5、“骨痛病事件”的污染物是镉;水俣病的污染物是汞(或甲基汞)。
6、水体的富营养化程度一般可用总磷(TP)、总氮(TN)、叶绿素a、透明度等指标来衡量。
7、水环境中氧气充足的条件下有机物发生的生物降解称为有氧(或好氧)降解,最终产物主要为二氧化碳和水,有机氮转化为硝酸根,有机硫转化为硫酸根。
水中的有机物在无氧条件经微生物分解,称为厌氧降解,降解产物除二氧化碳和水外,还有小分子的醇、酮、醛、酸等,无机态氮主要以氨氮存在、硫主要以硫化物存在,水体发臭发黑。
资源与环境化学 第三章 第一部分(天然水组成与化学平衡)

不同温度下气体在水中的溶解度:Clausius-Clapeyron方程
C2 H 1 1 lg ( ) C1 2.303 R T1 T2 C1 , C2 为绝对温度为T1 , T2时气体在水中的溶解度 H 溶解热, J/mol R 气体常数,8.314 J/mol K
《资源与环境化学》 第三章 水环境化学
第三章 水环境化学
Chapter 3. Aquatic Environmental Chemistry
第一部分 天然水的组成与化学平衡
主讲:刘耀驰
中南大学化学化工学院
第1页
《资源与环境化学》 第三章 水环境化学
本章重点
无机污染物在水体中进行沉淀-溶解、氧化还原、配合作用、吸附-解吸、絮凝-沉淀的基 本原理; 计算水体中金属存在形态;
《资源与环境化学》 第三章 水环境化学
(3) 气体在水中的溶解性
亨利定律:大气中的气体与溶液中同种气体间的平衡为:
kH 是各种气体在一定温度 下的亨利定律常数 (mol/L· Pa),pg为分压
[G(aq)] = kH×pg
亨利定律并不能说明气体在溶液中进一步的化学反应 溶解于水中的实际气体量,可以大大高于亨利定律表示的量
K2
2 ] [H ][CO 3 -] [HCO 3
K1[H 2CO3 ] [HCO 3 ] [H ] 2 ] K 2 K1[H 2CO3 ] [CO3 [H ]
第10页
《资源与环境化学》 第三章 水环境化学
(4) 水生生物
生态系统、食物链中的一个重要环节; 生产者、消费者、分解者; 自养生物、异养生物; 生产率、富营养化、C、N、P
第11页
03-1环境化学第三章__水环境化学

由于k2特别小,所以只考虑一级电离方程,可得:
[H+]=[HCO3-]
[H+]2/[CO2]= K1=4.45×10-7 [H+]=(1.03×10-5×4.45×10-7)1/2=2.14×10-6mol/L 故CO2在水中的溶解度为[CO2]+[HCO3-]=1.24×10-5mol/L。
4、水生生物
水生生物可直接影响许多物质的浓度,其作用有代
谢、摄取、转化、存储和释放等。
从生态学角度看,藻类是水体中的生产者,藻类的生
成和分解就是在水体中进行光合作用 (P)和呼吸作用 (R) 的一典型过程,可用一简单的化学计量关系表征:
106CO2 16NO3 HPO42 122H2O 18H( +痕量元素和能量)
过平衡常数加以计算:
Fe3++H2O=Fe(OH)2++H+
[Fe(OH)2+][H+]/[Fe3+]=K1
Fe3++2H2O=Fe(OH)2+ +2H+ [Fe(OH)2+][H+]2/[Fe3+]=K2 2Fe3++2H2O=Fe2(OH)24+2H+ [Fe2(OH)24+][H+]2/[Fe3+]2=K3
解:由于酸碱反应十分迅速,因此可以用封闭体系的 方法进行计算:
pH=8.3 时 , 河水中主要的碳酸盐为 HCO3- ,因此可以假设此时 [HCO3-]=CTC=3×10-3molL-1, 如果排入酸性废水 ,则将会使河水中的一部分 HCO3- 转化为 H2CO3*,即有反应: HCO3-+H+→H2CO3*
第3章:水环境化学2-1

一、颗粒物与水之间的迁移
1、水中颗粒物的类别
天然水中颗粒物主要包括五大类:矿物、金属水合氧 化物、腐殖质、悬浮物、其他泡沫、表面活性剂等半胶体 以及藻类、细菌、病毒等生物胶体。
(1)非粘土矿物和粘土矿物:都是原生岩石在风化过程 中形成的。
非 粘 土 矿 物 : 天 然 水 中 常 见 为 石 英 (SiO2) 、 长 石 (KalSi3O8)等,晶体交错,结实、颗粒粗,不易碎裂,缺 乏粘结性(例如沙子主要成分为:SiO2)。
第二节、水中无机污染物的迁移转化
一、颗粒物与水之间的迁移 二、水中胶体颗粒物聚集的基本原理和方式 三、溶解和沉淀 四、氧化—还原
五、配合作用
无机污染物,特别是重金属和准金属等污染物,一旦进入 水环境,不能被生物降解;
主要通过吸附—解吸、沉淀—溶解、氧化—还原、配合作 用、胶体形成等一系列物理化学作用进行迁移转化,参与和 干扰各种环境化学过程和物质循环过程; 最终以一种或多种形式长期存留在环境中,造成永久性的 潜在危害。 重点介绍重金属污染物在水环境中迁移转化的基本原理。
在水环境中,配合离子、有机离子、有机高分子和无机高 分子的专属吸附作用特别强烈。例如,简单的Al3+、Fe3+高 价离子并不能使胶体电荷因吸附而变号,但其水解产物却 可达到这种效果,这就是发生专属吸附的结果。 水合氧化物胶体对重金属离子有较强的专属吸附作用,这 种吸附作用发生在胶体双电层的 Stern层中,被吸附的金属 离子进入Stern层后。不能被通常提取交换性阳离子的提取 剂提取,只能被亲和力更强的金属离子取代,或在强酸性 条件下解吸。
粘土矿物:天然水中常见为云母、蒙脱石、高 岭石,层状结构,易于碎裂,颗粒较细,具有粘 结性,可以生成稳定的聚集体。
第三章水环境化学环境化学第二版

第三章水环境化学环境化学第二版
物对溶质的吸附是一个动态平衡过程。
• 在一定的温度条件下,当吸附达到平衡时,颗粒物表面上
的吸附量(G)与溶液中的溶质的平衡浓度之间的关系,可用吸附
等温线表示。 •Henry 型吸附等温线 • G=kc • k------(分配)系数
•G
•Freundlich型吸附等温线
G=kc1/n
• lgG=lgk+1/nlgc
•[OH-] + [HCO3-] + 2[CO32-] = 1.00 × 10-3 mol/L
(1)
•[H+] = 1.00 × 10-10 mol/L; [OH-] = 1.00 × 10-4 mol/L (2)
• (3)
第三章水环境化学环境化学第二版
•第一节 水环境化学基础 •若一个天然水的pH为7.0,碱度为1.4mmol/L,求需加多少酸 才能把水体的pH降低到6.0? •解:
•
Fe3+, Fe(OH)2+, Fe(OH)2+, Fe2(OH)24+, Fe(OH)3
第三章水环境化学环境化学第二版
•第二节 水体中无机污染物的迁移转化
• 腐殖质
•
腐殖质是一种带负电的高分子弱电解质。腐殖质
是生物体物质在土壤、水和沉积物中转化而成。分子量
300-30000。
•
3.1水分子结构天然水基本特征

▪ 矿化过程和矿化度 ➢矿化过程:天然水中主要离子成分的形成过程,称为矿 化过程;
➢矿化度:矿化过程中进入天然水体中的离子成分的总量, 以溶解总固体(TDS-Total dissolved Solid)表示
➢一般天然水中的TDS可以表示为: TDS=[Ca2++Mg2++Na++K++Fe2++Al3+]+[HCO3+SO42-+Cl-+CO32-+NO3-+PO43-]
[Fe(OH)2+][H+]2/[Fe3+]=4.9×10-7 [Fe2(OH)24+][H+]2/[Fe3+]2=1.23×10-3 假如存在固体Fe(OH)3(s),则Fe(OH)3(s)+3H+= Fe3++3H2O
[Fe3+]/[H+]3=9.1×103 在 pH=7 时 : [Fe3+]=9.1×103× ( 1.0×10-7 ) 3=9.1×1018mol/L
CO2·H2O HCO3-+H+ 一级电离
K1
[H][H=C4.O 34]5×10-7molL-1
[CO2 H2O]
HCO3- CO32-+H+ 二级电离
K2
[H=][4C.O6382×] 10-11molL-1
[HCO3]
由于k2特别小,所以只考虑前面两个方程,可得: [H+]=[HCO3-] [H+]2/[CO2]= K1=4.45×10-7 [H+]=(1.028×10-5×4.45×10-7)1/2=2.14×10-6mol/L pH=5.67(酸雨判别标准的由来)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
本章重点: 本章重点: 1、无机污染物在水体中进行沉淀 溶解、氧 溶解、 、无机污染物在水体中进行沉淀-溶解 还原、 解吸、 化-还原、配合作用、吸附 解吸、絮凝 沉淀的基 还原 配合作用、吸附-解吸 絮凝-沉淀的基 本原理 2、计算水体中金属存在形态 、 3、pE计算 、 计算 4、有机污染物在水体中的迁移转化过程和 、 分配系数、挥发速率、水解速率、 分配系数、挥发速率、水解速率、光解速率和生 物降解速率的计算方法
1)天然水中的主要离子组成 )
天然水中的八大离子: 阳离子: Na+、K+ 、 Ca2+、Mg2+ 、 阳离子 阴离子: 阴离子:HCO3—、 SO42—、Cl—、NO3— 占离子总量的95%—99%。
1)天然水中的主要离子组成 )
表 水体主要化学特征性指标
硬度 Ca2+ Mg2+ 碱度 HCO3- CO32-
2.2 金属污染物
4)砷:水生生成有机砷。 5)铬:来源于冶炼、电镀、制革、印染等工 业, 6)铜:水体中大量有机和无机颗粒物能强烈 吸附或螯合铜离子,使之最终进入底部沉积物 中。 7)锌:水生生物对锌有很强的吸收能力,因 而使锌向生物体内迁移。
2.1 有机污染物
6)苯酚类和甲酚类 7)酞酸酯类 8)多环芳烃 9)亚硝胺和其他化合物
2.2 金属污染物
1) 镉:除硫化镉外,镉的化合物都溶于水。悬 浮物和沉积物对镉吸附能力强,水生生物有很 强的富集能力。 2)汞:悬浮物和沉积物对汞有强烈的吸附能 力,无机汞由于微生物作用,转化为甲级汞 甲级汞。 甲级汞 通过食物链危害人体健康—水俣病 水俣病 3)铅:来源于矿山开采、金属冶炼、汽车废 气、燃煤、油漆、涂料等
3)气体在水中的溶解性 )
(b)CO2: 水中存在:HCO3—、CO2, 且 [HCO3—]=[H+], 由CO2的离解常数K及亨利定律: [CO2] + [HCO3—] =1.028×10-5+2.14×10-6 =1.24×10-5mg/L
4)水生生物 )
水生生物分为自养生物 异养生物。氧 自养生物和异养生物 自养生物 异养生物。 是决定水中生物种类和数量的关键物质。 生物(生化)需氧量( 生物(生化)需氧量(BOD):一定体 ) 积的水中有机物降解所需耗用的氧的量。
第一节 天然水的基本特征 及污染物的存在形态
1、天然水体的基本特征 、 1.1 天然水的组成 1.2 天然水的性质 2、水中污染物的分布和存在形态 、 2.1 有机污染物 2.2金属污染物 金属污染物
1、天然水体的基本特征 、
1.1 天然水的组成 1.2 天然水的性质
1.1 天然水的组成
1)天然水中的主要离子组成 硬度:Ca2+、Mg2+ 酸度:H+ 碱度:HCO3—、CO32—、OH— 碱金属:Na+、K+ 酸根:SO42—、Cl—、NO3—
1.2 天然水的性质
1)碳酸平衡: 对于调节天然水的pH及组成起着重要的 作用。 CO2 + H2O = H2CO3 H2CO3 = HCO3— + H+ HCO3— = CO32— + H+
2)天然水中的碱度和酸度 )
以甲基橙为指示剂,终点pH=4.3,所以总碱度 也称为甲基橙碱度: 总碱度= 总碱度 [HCO3—] + 2[CO32—] + [OH—] –[H+] 如果以酚酞为指示剂,终点pH=8.3,CO32—全 部转化为HCO3—, 得到的测定值称为酚酞碱度: 酚酞碱度 = [CO32—] + [OH—] –[H2CO3]–[H+]
3)气体在水中的溶解性 )
服从亨利定律, 即:
[G (aq)] = K H ⋅ pG
但对于和水有化学反应的气体,溶解度 要大的多。如: CO2 +H2O = HCO3— + H+
3)气体在水中的溶解性 )
(a)O2 溶解度与水的温度、氧在空气中的分压及水 中盐含量有关。 在P0、25℃的水中的溶解度为8.32mg/L, 随温度的升高,氧在水中的溶解度逐渐降低, 如35℃时为:7.03mg/L。
2、水中污染物的分布和存在形态 、
2.1 有机污染物 2.2金属污染物 金属污染物
2.1 有机污染物
1)农药:有机氯、有机磷 2)多氯联苯(PCBs):不易溶于水,但 易溶于有机溶剂和脂肪。 3)卤代脂肪烃:在水中的溶解度较高。 4)醚类:有七种醚类化合物属美国EPA 优先污染物 5)单环芳香族化合物
2.2 金属污染物
8)铊 9)镍 10)铍
酸度 H+
碱金属 Na+ K+ 酸根
阳离子 阴离子
OH-
SO42- Cl- NO3-
1)天然水中的主要离子组成 )
水的总含盐量(TDS): TDS=[ Na+ + K+ + Ca2++ Mg2+] + [HCO3—+ SO42—+ Cl—]
2)水中的金属离子 )
水中可溶性金属离子可以多种形态存在, 例如铁: Fe(OH)2+, Fe(OH)2+, Fe2(OH)24+, Fe3+ 等形式存在。
2)天然水中的碱度和酸度 )
用碱溶液滴定,当终点pH=10.8时,得到总酸 度,但此时滴定曲线没有明显突跃 没有明显突跃。 没有明显突跃 总酸度= 总酸度 [H+] + [HCO3—] + 2[H2CO3] — [OH—] 如果以酚酞为指示剂,终点pH=8.3,得到CO2 酸度: CO2酸度 = [H+] + [H2CO3] —2[CO32—] — [OH—]
