NA疑难汇总
高考中有关“NA”问题解析归纳

高考中有关“NA”问题的解析及归纳阿伏加德罗常数是物质的量的标准,1mol任何粒子的粒子数叫做阿伏加德罗常数,也就是0.012kg12c中所含有的碳原子数,其符号为n a,通常用6.02×1023mol-1这个近似值来表示。
该知识点一直备受高考的青睐。
此类题目多以选择题的形式出现,涉及的内容主要是通过阿伏加德罗常数与粒子数的关系进行相互转化或进行正误判断。
解答时要正确理解相关物理量的内涵,把握好各物理量的运用范围和使用条件,在分析和计算的基础上进行判断。
例1.(2010年四川,7题). n a表示阿佛加德罗常数的值,下列说法正确的是()a.标准状况下,22.4l二氯甲烷的分子数约为na个。
b.盛有so2的密闭容器中含有n a个氧原子,则so2的物质的量为0.5mol.c.17.6g丙烷中所含有的极性共价键为4n a个.d.电解精炼铜时,若阴极得到电子数为2n a个,则阳极质量减少64g.解析:气体摩尔体是单位物质的量的气体所占的体积积,其研究对象是气体,可有公式pv=nrt计算,气体摩尔体积的数值不是固定不变的,它取决于气体所处的温度和压强,常用的单位有l/mol 和m3/mol。
例如在0℃和101kpa(标准状况)的条件下,气体的摩尔体积约为22.4l/mol;在25℃和101kpa的条件下,气体摩尔体积约为24.5l/mol。
选项a中二氯甲烷在标准状况下是液体,故a错;b选项:由so2的分子式可知1mol二氧化硫中含有2mol 氧原子,n a个氧原子的物质的量为1mol,故b正确。
c选项:一个丙烷分子含有8个c—h极性共价键两个c—c非极性共价键而题目要求计算的是极性共价键,丙烷的物质的量为17.6g÷44g/mol=0.4mol,所含有的极性共价键为0.4×8=3.2mol即3.2n a个,故c错。
d选项中电解精炼铜时阳极为粗铜,粗铜中常含有锌、镍、银、金等杂质,电解时比铜活泼的锌、镍等杂质也失电子,以离子状态进入溶液;银、金等杂质在电解时不溶解,而以小粒状态由阳极上落下,形成所谓的阳极泥。
关于Na问题汇总-(含答案)

关于N A 问题汇总:判断下列说法的正误,不正确的进行改正1、常温常压下,22.4LO 2所含的原子数为2N A (错,<2N A )2、常温常压下,3.2克O 3所含的氧原子数为0.2N A (对)3、常温常压下,1摩尔氦气所含原子数为N A (对)4、标准状况下,2.24LH 2和C 2H 2的混合气体所含分子数约为0.1N A (对)5、标准状况下,8克SO 3所含原子数为0.4N A (对)6、标准状况下,2.24L Cl 2完全溶于水转移电子数为0.1N A (错,溶于水不等于与水反应)7、标准状况下,22.4L HF 所含分子数为N A (标准状况下HF 是液体)8、标准状况下,2.24L Cl 2与氢氧化钠完全反应转移电子0.2N A (错,0.1N A )9、7.8克Na 2O 2与CO 2完全反应,转移电子0.2N A (错,0.1N A ) 10、标准状况下,1L 辛烷完全燃烧生成CO 2 8 L (错,标准状况下辛烷是液体) 11、3.4g H 2O 2完全分解转移电子0.2N A_ (错,0.1N A ) 12、2.4g Mg 无论与O 2还是N 2完全反应,转移电子都是0.2N A (对) 13、5.6g Fe 与Cl 2 完全反应,转移电子0.2N A (错,0.3N A ) 14、6.4g Cu 与S 完全反应,转移电子0.2N A (错,0.1N A ) 15、3.1g 白磷中含P-P 键0.15N A (对)16、1mol 白磷分子中含有P-P 键为1.5N A (错,6N A ) 17、12g 金刚石中含C-C 键4N A (错,2N A ) 18、12g 石墨中含C-C 键1.5N A (对 ) 19、28 g 乙烯、丙烯的混合物中含有6 N A 对共用电子对 (对 ) 20、1molC 17H 36含有共价键总数为52N A (对 ) 21、6.0g SiO 2晶体中含有0.2N A 个Si-O 键, (错,0.4N A ) 22、6.0g SiO 2晶体中含有0.2N A 个O 原子 (对) 23、1L1mol/LCH 3COOH 溶液中,所含CH 3COO — CH 3COOH 的总数为N A (对) 24、1L 1mol/L NH 4Cl 溶液中,所含NH 4+的总数为N A (错,< N A ) 25、1L1mol/L 饱和FeCl 3溶液滴入沸水中完全水解生成Fe(OH)3胶粒N A 个 (错,< N A ) 26、10g46%的乙醇水溶液中所含H 原子数为0.6N A (错,还要考虑水,应为1.2 N A ) 27、1mol/LCH 3COOH 溶液中,所含CH 3COO —小于N A (错,无体积不能确定) 28、1mol —OH 中所含电子数为9N A (对) 29、1molCH 3+所含的电子数为8N A (对) 30、2 NO 2和 44g N 2O 4的混合气体所含原子数为3N A (对) 31、25℃ 1mLH 2O 中所含OH -为10-10N A (对) 32、2.9g2CaSO 4·H 2O 含有的结晶水分子数为0.02N A (错,0.01N A )33、2molSO 2和1molO 2混合,在密闭容器中一定条件下反应,充分反应后容器中的分子数大于2N A (对)34、T ℃1LPH=6的纯水中含10-6N A 个OH -(对) 35、18g D 2O 所含的电子数为10N A (错)36、过量的Fe 粉加入稀硝酸中,当溶解5.6g 时转移的电子数为0.3N A (错,0.2N A ) 解题策略:要正确解答本类题目,首先要认真审题。
二轮专题二 NA选择题分析及练习

二轮专题二 N A 选择题分析及练习一、N A 常考二十大陷阱总结陷阱一:涉及体积的计算,隐含物质的状态。
在标准状况下,水为液体或固体,SO 3为固体,碳原子数大于4的烃为液体或固体。
22.4L ·mol -1使用的对象是气体(包括混合气体)。
命题者常把一些容易忽视的液态或固态物质作为气体来命题,让考生落入陷阱。
例如:标准状况下,2.24 L 的CCl 4中含有的C —Cl 键数为0.4N A常见不能用NA 做题物质:陷阱二:涉及体积的计算,混淆温度和压强。
22.4L ·mol -1是在标准状况(0℃,1.01×105Pa )下的气体摩尔体积。
命题者有意在题目中设置非标准状况下的气体体积或质量,让考生与22.4L ·mol -1进行转换,从而误入陷阱。
如:常温常压下,2.24 LC 2H 4中含有共用电子对的数目为0.6N A陷阱三:隐含物质的化学键结构。
某些物质在组成上或在不同的环境中形成的微粒是不相同的,在用NA 表示其微粒数目时,应注意该物质的真实结构,知道某些物质中的化学键数目。
1mol 金刚石(晶体硅)中含2molC —C (2 molSi —Si )键;1mol 二氧化硅中含4 molSi —O 键;1 mol 白磷中含6molP —P 键;1 mol 石墨中含1.5molC —C 键;例如:12 g 金刚石含有C —C 键数目为2N A ;60 g 二氧化硅中含有Si —O 键数目为2N A ;31 g 白磷晶体中含有P —P 键1N A 个;在含有1mol 碳原子的石墨晶体中, C —C 键数目为1.5N A 。
陷阱四:隐含氧化还原反应中真实的电子转移情况。
固定的关系式:2Na 2O 2—2CO 2—O 2—2e -;2Na 2O 2—2H 2O —O 2—2e -;2NaOH —Cl 2—e - 例如:足量7.8 g 过氧化钠与足量二氧化碳反应转移的电子数为0.1N A在过氧化钠与水的反应中,每生成1mol 氧气,转移电子的数目为4 N A ;78 g 过氧化钠与足量水反应转移电子数为2N A ;7.1g 氯气与足量NaOH 溶液反应转移的电子数为0.2N A 。
河北衡水高中化学高三一轮复习Na及其重要化合物知识点汇总带答案

钠1、钠的储存:存放在煤油或石蜡油中自然界中有游离态钠吗?没有2、钠的取用:取一小块钠,用滤纸吸干表面的煤油后,放在表面皿或玻璃片上,用刀切去一端的外皮,用小刀切取绿豆粒大小的钠,剩余钠需要放回试剂瓶中。
3、钠与氧气反应,条件不同,产物不同,写出两个方程式: 4Na+O2=2Na2O 2Na+O2Na2O24、钠在空气中长期放置,最终变为碳酸钠。
5、钠的燃烧实验在坩埚中进行,现象为剧烈反应,黄色火焰。
6、钠和硫的反应: 2Na+S Na2S 钠和氯气的反应:2Na+Cl22NaCl7、钠和水反应的化学方程式: 2Na+2H2O=2NaOH+H2↑现象:浮溶游响红钠着火能用水扑灭吗?为什么?不能,钠和水反应产生氢气。
应用什么?沙子8、钠和盐溶液反应,先和水反应,再和盐反应。
钠放入CuSO4、FeCl3、NH4Cl溶液中:(举一例)化学方程式 2Na+CuSO4+2H2O=Cu(OH)2↓+H2↑+Na2SO4离子方程式 2Na + Cu2+ + 2H2O =C u(O H)2↓+ H2↑+ 2Na+9、能用氢气还原氧化钠制取钠吗?不能,钠比氢气活泼。
应如何制备?2NaCl 2Na+ Cl2↑钠氧化物(氧化钠和过氧化钠)1、Na2O颜色白色,阴阳离子个数比1:2,Na2O2颜色黄色,阴阳离子个数比1:22、Na2O和Na2O2均属于碱性氧化物,对吗?不对,过氧化钠和酸反应除了生成盐和水还生成氧气。
3、Na2O2和H2O反应 2Na2O2+2H2O=4NaOH+O2↑ Na2O2和CO2反应 2Na2O2+2CO2=2Na2CO3+O2氧化剂:还原剂=1:14、 2 Na2O2----- 2 CO2/ 2 H2O-----1O2------ 2 e-Na2O2----KMnO4 1 Na2O2---- 2 e- Na2O2----SO2 1 Na2O2---- 2 e-5、5Na2O2和H2O反应增重的是H2 Na2O2和CO2反应增重的是CO 例:mgCO和H2在足量氧气中燃烧后通过足量过氧化钠,增重 m g例:将CO2通过足量过氧化钠,增重ag,转移电子aN A/286、Na2O2可用做宇航员的供氧剂,可以消耗呼出的二氧化碳和水,产生氧气。
NA总结
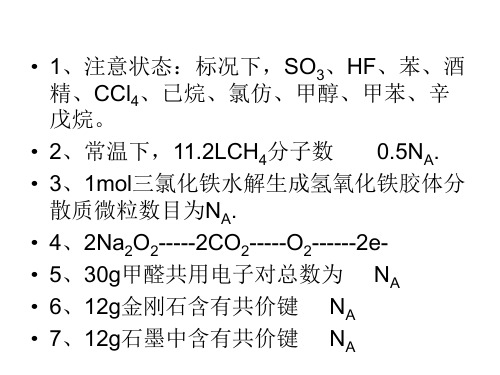
• 8、1molSiO2含有硅氧键 NA • 9、31g白磷中含有共价键 NA • 10、常温下,PH=13的1L氢氧化钡溶液中含有 氢氧根数目为0.2NA • 11、将CO2通过过氧化钠使其增重ag时,反应 转移电子数为aNA/28 • 12、1molFe和1molCl2反应转移 电子 • 足量Fe和1.5molCl2反应转移 电子 • 1molFe和足量Cl2反应转移 电子 • 13、将NA个NH3溶于1L水中得到1mol/L氨水 • 14、标况下,2.24LCCl4 Cl原子数目大于4NA
• 1、注意状态:标况下,SO3、HF、苯、酒 精、CCl4、已烷、氯仿、甲醇、甲苯、辛 戊烷。 • 2、常温下,11.2LCH4分子数 0.5NA. • 3、1mol三氯化铁水解生成氢氧化铁胶体分 散质微粒数目为NA. • 4、2Na2O2-----2CO2-----O2------2e• 5、30g甲醛共用电子对总数为 NA • 6、12g金刚石含有共价键 NA • 7、12g石墨中含有共价键 NA
• 28、电解1L氯化钠溶液至氢氧根浓度为 0.2mol/L时,转移电子数为0.4NA • 29、1mol铁在氧气中充分燃烧失去3NA个电子 • 30、1mol铁和水蒸气在高温条件下反应失去3 NA个电子
• 15、9gD2O中含有的电子数目为5NA • 16、120gNaHSO4和KHSO4组成的混合物中共 有3NA的阴阳离子 • 17、122.5gKClO3晶体中氯离子总数等于3NA • 18、22.4L空气含有NA个单质分子。 • 19、0.1mol甲基含有质子数为 NA • 20、常见可逆反应 • 标准状况下,11.2LNO和11.2LO2混合后所含分 子数为0.75NA • 21、标准状况下,22.4LCl2和足量氢氧化钠溶液 反应,转移2NA个电子。
2020人教版九年级化学下册疑难知识点03 酸和碱难点突破(含答案解析)

第十单元酸和碱难点突破考点一:PH值及酸碱指示剂的应用1.下列有关测定氢氧化钠溶液pH的实验操作或描述,你认为正确的是()A.用镊子夹取pH试纸直接伸入氢氧化钠溶液中测量B.先用蒸馏水将pH试纸润湿,再用滴管吸取氢氧化钠溶液滴到pH试纸上测量C.用洁净干燥的玻璃棒蘸取氢氧化钠溶液滴到pH试纸上,再与标准比色卡对照D.用pH试纸测得该氢氧化钠溶液的pH12.6【答案】C本题考查利用pH试纸测定溶液的pH值的实验,测定时取一片pH试纸放在玻璃片或白瓷板上,用玻璃棒蘸取少量待测液滴在干燥的pH试纸上,与标准比色卡对比来确定pH;不能将试纸伸入液体中,也不能先将试纸润湿,通过pH试纸测定的溶液pH值为整数值。
【解析】A、用pH试纸测定未知溶液的pH时,正确的操作方法为取一片pH试纸放在玻璃片或白瓷板上,用玻璃棒蘸取少量待测液滴在干燥的pH试纸上,与标准比色卡对比来确定pH,不能将pH试纸伸入待测液中,以免污染待测液,A选项说法错误,不符合题意;B、用pH试纸测定未知溶液的pH时,应该用玻璃棒蘸取少量待测液滴在干燥的pH试纸上,与标准比色卡对比来确定pH,不能用水湿润pH试纸,用水润湿试纸就稀释了待测溶液,使溶液的碱性减弱,测定结果偏小,B选项说法错误,不符合题意;C、用洁净干燥的玻璃棒蘸取氢氧化钠溶液滴到pH试纸上,再与标准比色卡对照,C选项说法正确,符合题意;D、由于标准比色卡上的数字只有整数,用pH试纸测得该氢氧化钠溶液的pH不可能精确为12.6,D选项说法错误,不符合题意。
故选C。
2.向盛有稀盐酸的烧杯中逐滴加入NaOH溶液,测得烧杯中溶液的pH变化如图所示,下列说法正确的是()A.a点所示的溶液中含有的溶质是NaOH和NaClB.b点所示的溶液能使紫色石蕊溶液变红C.c点表示NaOH和稀盐酸恰好完全反应D.a、b、c所示的溶液中都含有Na+、Cl﹣【答案】D【解析】a点时溶液的pH小于7,溶液显酸性,说明稀盐酸过量,所得溶液中的溶质为HCl和NaCl,故A选项说法错误。
内分泌疑难病例分享

病史资料
既往史:从小注意力不集中,抵抗力差,数学成绩稍差。儿时运动正 常,运动时无明显心悸气短,30岁时自觉心率增快,90-100次/分。 血脂升高7-8年(24岁体检发现)。否认“糖尿病,高血压,冠心病”病 史。
个人史:孕1次 产1次 流产0次。
家族史:无特殊
体格检查
生命体征
T:36.5
℃
P:83
Inzucchi SE,et al. JAMA. 2014 Dec 24-31;312(24):2668-75. CHN/GLUP/1216/0017 Valid until Dec .2017
2型糖尿病管理指南:2015 ADA /EASD立场声明 放宽二甲双胍用于中度肾功能不全T2DM患者的限制
实验室检查
血尿便常规:正常
甲状腺功能:FT4 23.58 pmol/L ↑、FT3 6.11 pmol/L ↑、TSH 1.24 mIU/L 、 TPOAb 0.22 IU/L、TGAb 11.21 IU/L↑(0.-4.11 IU/L)、TRAb 0.63 IU/L 肝功:正常 ALP 43U/L、AST 13U/L、ALT 14U/L、GGT 17U/L、TBIL 9.9umol/L、ALB 41.0g/L
<1.8 mmol/L;TG<1.6 mmol/L
选择的甲状腺癌治疗方案
治疗方案/剂量的描述
• 2018-3-18 • 行甲状腺结节手术,术中病理证实甲状
腺癌,行甲状腺全切术。 • 术后病理:甲状腺左叶、右叶乳头状甲
状腺癌
问题1:手术后还需要哪些治疗?
选择的降糖治疗方案
治疗方案/剂量的描述
治疗方案/剂量的依据和思路
物理检查
甲状腺彩超: 甲状腺右叶大小约:横径约:23.5mm,前后径约:18.9mm,上下径约: <55mm。 甲状腺左叶大小约:横径约:20.6mm,前后径约:16.5mm,上 下径约:<55mm。 甲状腺峡部约:4.1mm。 甲状腺回声欠均匀,局部细小 网格状,腺体后未见结节。CDFI彩色血流未见血管扩张。 右叶上极中部可见 网状结节,大小约:4.7×2.8mm,较规则,边界清楚,无血流显示,下1/3偏 前可见低回声结节,大小约:3.0×2.4×2.3mm,欠规则,边界尚清晰,可见 彗尾状强光条堆积,未见血流显示。 左叶可见多个结节,上极者囊实样,大 小约:4.0×2.3mm,较规则,无血流显示,上1/3偏后者回声减低,大小约: 8.5×5.8×5.2mm,欠规则,边界欠清晰,可见多个强光条及彗尾状强回声, 后缘贴近被膜,边缘可见条状血流显示。 右颈部可见多发淋巴结回声,大者 约:10.1×2.5mm,位于Ⅲ区。 左颈部可见多发淋巴结回声,大者约: 11.5×2.3mm,位于Ⅲ区。 结论:甲状腺双叶结节液性变,右叶低回声结节伴彗尾状钙化,纵橫比大于1, 左叶低回声结节伴粗钙化彗尾状钙化,欠规整( TI-RADS4a级),双颈淋巴结 显示。
化学na题型知识点总结

化学na题型知识点总结Na题型知识点总结一、元素的周期表排布及性质1. 元素的周期表排布元素周期表是将元素按照其原子序数从小到大排列成横行(周期)和竖列(族)的一张表。
根据周期表的排布,我们可以得到元素的周期性规律,比如周期性趋势。
元素的周期性规律包括原子半径、电离能、电负性、金属活性等。
这些性质都具有一定的周期性规律,比如原子半径随着周期数的增加递减,电离能和电负性则会呈现出周期性的增减变化。
2. 元素的性质根据元素在周期表中的位置,我们可以初步判断出元素的化学性质。
比如,周期表上同一周期内的元素,它们的电子排布相似,因此它们具有类似的化学性质。
而同一族的元素,它们的化学性质也有一些共同之处,比如同族元素的离子半径随族数的增加而增加。
二、化合物的构成及性质1. 化合物的构成化合物是由两种或两种以上的原子组成的化学物质。
化合物的构成一般由化学键的形成所决定,化合物的化学键主要有共价键和离子键两种。
2. 化合物的性质化合物的性质受其组成元素以及化学键的影响。
比如,共价化合物的熔沸点较低,大多数共价化合物为非电离化合物。
离子化合物的熔沸点较高,具有良好的导电性等。
三、化学反应及平衡1. 化学反应的类型化学反应主要包括:氧化还原反应、酸碱中和反应、沉淀反应、燃烧反应等。
不同类型的反应具有不同的特点和条件。
2. 化学反应的平衡在化学反应中,反应物转化为生成物,反应速率随着反应进行逐渐减缓,并最终达到动态平衡。
动态平衡是指反应物和生成物的浓度比例在一定范围内不再发生变化。
四、酸碱的性质及中和反应1. 酸碱的定义酸呈酸性溶液,有酸味和酸性反应;碱呈碱性溶液,有碱味和碱性反应。
酸和碱是化学中两种重要的化合物类别。
2. 酸碱的性质酸碱的性质主要包括酸碱指示剂、酸碱中和反应等。
其中,酸碱指示剂是一种染料,它能根据pH值的不同在酸性、中性和碱性溶液中呈现不同颜色。
而酸碱中和反应是酸和碱在适当条件下作用产生盐和水的反应。
NA题考点归纳

N A 题考点归纳2011-9-25考点一:气体摩尔体积的考查:解题技巧:一看标况二看气体如:判断正误:(2010·上海高考)标准状况下,2.24L 戊烷所含分子数为0.1 N A 个(2010·广东高考)常温常压下,22.4L 2CO 中含有N A 个2CO 分子(2010·四川高考)标准状况下,22.4L 二氯甲烷的分子数约为N A 个(2009·广东高考)标准状况下,22.4LSO 3的分子数约为N A 个(2011·广州一模)常温常压下,22.4L O 3中含有3n A 个氧原子(2011·深圳一模)标准状况下,11.2L CO 2中含有n A 个O 原子考点二:离子个数的考查:解题技巧:一看溶液中离子是否有弱离子(即弱酸阴离子或弱碱阳离子)或弱电解质。
弱离子会水解,弱电解质部分电离,都会影响离子的数目。
例:判断正误:(2009·广东)将0.1molFeCl 3溶于1L 水中,所得溶液含有0.1N A Fe 3+(2008·江苏)1L 浓度为1mol ·L -1的Na 2CO 3溶液中含有N A 个CO 32-(2010·江苏)常温下,100ml 1.0mol/L 的43NH NO 溶液中铵根离子为0.1 N A(2009·福建)1L 0.1mol·L -1乙酸溶液中H +数为0.1N A(2011·佛山一模)500mL 1mol/L 氯化铁溶液中的Fe 3+数小于0.5N A二看是否给出体积: 例(2010·广东)1mol ·1L -NaCl 溶液含有N A 个Na +(2011·广州一模)0.1mol·L -1 Mg(NO 3)2溶液中含有0.2n A 个NO 3-(2011·深圳一模)0.1mol/L Na 2CO 3溶液中含有0.1n A 个CO 32-考点三: 电子个数的考查1. 具体的某一微粒中电子个数的考查: 技巧:原子或分子:电子数=质子数 阳离子:电子数=质子数-电荷数 阴离子:电子数=质子数+电荷数 例:(2009·福建)24g 镁的原子最外层电子数为N A(2010·江苏)1mol 羟基中电子数为10A N(2011·深圳一模)20g 重水(O H 221)中含有10n A 个个电子(2011·广州一模)8g CH 4中含有10n A 个电子 (2011·东莞一模)1mol 甲基(-CH 3)的电子数目为7A N N A 题考点归纳2011-9-25考点一:气体摩尔体积的考查:解题技巧:一看标况二看气体如:判断正误:(2010·上海高考)标准状况下,2.24L 戊烷所含分子数为0.1 N A 个(2010·广东高考)常温常压下,22.4L 2CO 中含有N A 个2CO 分子(2010·四川高考)标准状况下,22.4L 二氯甲烷的分子数约为N A 个(2009·广东高考)标准状况下,22.4LSO 3的分子数约为N A 个(2011·广州一模)常温常压下,22.4L O 3中含有3n A 个氧原子(2011·深圳一模)标准状况下,11.2L CO 2中含有n A 个O 原子考点二:离子个数的考查:解题技巧:一看溶液中离子是否有弱离子(即弱酸阴离子或弱碱阳离子)或弱电解质。
专题04 钠及其化合物【考点清单】(讲+练)(解析版)高一化学上学期期中考试复习

专题04钠及其化合物01钠物理性质银白色质软比水轻熔点低(水中变成液体小球)化学性质非金属单质O2(常温:4Na+O2===2Na2O、加热:2Na+O2=====△Na2O2)Cl2(2Na+Cl2=====△2NaCl现象:剧烈燃烧,产生白烟)S H2水2Na+2H2O=2Na++2OH-+H2↑现象:浮、球、游、响、红酸2Na+2H+=2Na++H2↑盐水溶液钠先与水发生置换反应,生成的碱再与盐发生复分解反应熔融液与盐发生置换反应:4Na+TiCl4====Δ4NaCl+Ti应用①制取钠的化合物,如Na2O2;②制高压钠灯;③从钛、锆等熔融氯化物中置换出金属单质。
保存钠易与空气中的O2、H2O反应,且钠的密度比煤油的密度大,不与煤油反应,故通常将钠保存在煤油中。
【疑难点拨】钠与水、酸与盐溶液反应规律反应实质—钠与纯水及各种水溶液均易发生反应,其实质就是钠与水的反应,反应中钠作还原剂,水作氧化剂↓反应快慢—钠与酸的反应实质是与H+的反应,由于酸中H+浓度比纯水中H+的浓度大的多,所以钠与酸反应要比与水反应剧烈的多。
反应的离子方程式为2Na+2H+===2Na++H2↑↓反应过程—钠与盐溶液反应时,钠首先与水反应生成NaOH和H2,然后NaOH与盐中的某些离子发生复分解反应。
如钠与CuSO4溶液的反应为2Na+2H2O===2NaOH+H2↑CuSO4+2NaOH===Cu OH2↓+Na2SO4总反应的化学方程式为2Na+2H2O+CuSO4===Cu OH2↓+Na2SO4+H2↑02氧化钠和过氧化钠1.Na 2O 与Na 2O 2的比较物质氧化钠(Na 2O)过氧化钠(Na 2O 2)组成Na +与O 2−以2∶1形成化合物Na +与22O(过氧根离子)以2∶1形成化合物色态白色固体淡黄色固体所属类别碱性氧化物过氧化物氧元素化合价﹣2(最低价态)﹣1(中间价态)生成条件在空气中(缓慢氧化)加热或点燃化学性质与H 2O 反应Na 2O+H 2O===2NaOH 2Na 2O 2+2H 2O===4NaOH+O 2↑与CO 2反应Na 2O+CO 2===Na 2CO 32Na 2O 2+2CO 2===2Na 2CO 3+O 2与酸反应Na 2O+2HCl===2NaCl+H 2O2Na 2O 2+4HCl===4NaCl+2H 2O+O 2↑氧化性较弱较强主要用途强氧化剂、漂白剂、供氧剂保存干燥、封闭干燥、封闭2.Na 2O 2的强氧化性与还原性从元素化合价角度分析Na 2O 2的性质:O 02――――――――――→失去电子,化合价升高表现为还原性Na 2O -12――――――――――→得到电子,化合价降低表现为氧化性O -2过氧化钠中的氧是-1价,处于中间价态,既能表现氧化性,又能表现还原性。
高考试题中有关NA题的常设陷阱

高考试题中有关NA题的常设陷阱作者:葛春艳赵晓磊来源:《中学化学》2014年第05期有关NA题是高考选择题中的一种常见题型。
虽然原理简单,但是出题者在设置问题时,往往在一些细节问题上设置陷阱,学生稍不留意就会掉进出题人的陷阱。
笔者将此类题目常见的陷阱模式进行总结,以攻破这一高考难点。
一、陷阱汇总陷阱1条件(1)在不知是否为标准状况时,误认为1 mol气体的体积为22.4 L,一定要特别注意,在不指明温度压强时,气体的体积没有任何意义。
(2)在不知溶液体积只知溶液浓度的情况下来求溶质的物质的量。
干扰项:0.5 mol· L-1 MgCl2溶液中Cl-的数目为 NA。
解析由于不知溶液的体积,无法求Cl-的数目,故不正确。
陷阱2状态某些物质在标准状况下为液体或固体,但是干扰项却说22.4 L该物质为1 mol。
干扰项:标准状况下22.4 LSO3含有3 NA个氧原子。
解析由于标准状况下SO3为固体,所以22.4 L SO3中氧原子数要远远大于3NA。
注意:(1)常考的标准状况下为非气体的物质有SO3、HF、CH2Cl2、CHCl3、CCl4、辛烷。
(2)烃的含氧衍生物中只有甲醛为气体,其它的一律为非气体。
陷阱3转移电子(1)转移的电子数目应该依据不足的反应物计算。
干扰项:1 mol Cl2与足量的Fe反应转移的电子数为3NA。
解析由于Cl2不足,转移的电子数应该用Cl2来计算,应该为2NA。
(2)在可逆反应中误以为反应物反应完全,计算转移的电子数偏多。
干扰项:0.1 mol Cl2通入足量水中充分反应后转移电子数目为0.1NA。
解析Cl2和水的反应为可逆反应,故0.1 mol Cl2未反应完,转移的电子数小于0.1NA。
陷阱4忽略电离平衡或水解平衡(1)由于弱电解质电离时存在电离平衡,所以其不能全部电离。
干扰项:1 L 1 mol· L-1醋酸溶液中离子总数为2NA。
解析醋酸未全部电离,故离子总数小于2NA。
高考化学选择题-NA考点知识点归纳(判断)

高三化学复习N A选择题考查学问点热点归纳练习(推断)(一)依据质量求微粒数:关键是摩尔质量及微粒类型1、48 g O3气体含有6.02×1023个O3分子()2、14 g乙烯和丙烯的混合物中总原子数为3N A个()3、7 g C n H2n中含有的氢原子数目为N A()4、120g由NaHSO4和KHSO3组成的混合物中含有硫原子N A个()5、18g冰水混合物中有3N A个原子和10N A个电子()6、常温常压下,3g甲醛气体含有的原子数是0.4N A()7、250C时,1.01×105Pa时,4g氦气所含原子数为N A()8、常温常压下,32 g氧气和臭氧混合气体中含有2 N A个原子()9、62 g白磷中含有2 N A个白磷分子()10、106 gNa2CO3固体中含有N A个CO32-()(二)依据体积求微粒数:用到22.4L·mol-1必需留意物质的状态及是否是标准状况11、标准状况下,33.6 L H2O含有9.03×1023个H2O分子()12、2.24 L CO2中含有的原子数为0.3×6.02×1023()13、常温下11.2 L的甲烷气体含有甲烷分子数为0.5N A个()14、标准状况下,22.4 L CHCl3中含有的氯原子数目为3N A()15、常温常压下28 g CO与22.4 L O2所含分子数相等()16、标准状况下,11.2L SO3所含的分子数为0.5N A()17、标准状况下,22.4 L氦气与22.4 L氟气所含原子数均为2 N A()18、标准状况下,以随意比混和的氢气和一氧化碳气体共8.96L,在足量氧气中充分燃烧时消耗氧气的分子数为0.2N A()19、在标准状况下,11.2L氖气含有N A个氖原子()20、常温常压下,11.2L氧气含有的分子数为0.5 N A()21、标准状况下,密度为dg/L的某气体纯净物一个分子的质量为22.4d/N A g()22、标准状况下,含6.02×1023个氩原子的氩气的体积精确值为22.4L()23、00C,1.01×106Pa时,11.2L氧气所含的氧原子数为N A()24、标准状况下,80gSO3所占的体积约为22.4L()25、25 ℃,1.013×105 Pa下,11.2 L氯气所含原子数为N A个()26、标准状况下,22.4 L氦气中所含原子数为N A个()27、标准状况下,1L辛烷完全燃烧后所生成气态产物的分子数为8N A /22.4 ()28、标准状况下,0.5N A个HCHO分子所占体积约为11.2 L()(三)依据浓度求微粒数:留意弱电解质的电离和盐类的水解29、0.5 mol·L-1 CuCl2溶液中含有3.01×1023个Cu2+()30、0.1 L 3 mol·L-1的NH4NO3溶液中含有的NH4+数目为0.3×6.02×1023()31、0.1 mol/L的氢氧化钠溶液中含钠离子数为0.1N A个()32、1 L 0.5 mol/L Na2CO3溶液中含有的CO32-数目为0.5N A()33、100 mL 2.0 mol/L的盐酸与醋酸溶液中氢离子均为0.2N A()34、1L1mol/LCuCl2溶液中含有的Cu2+的个数为N A()35、25℃时,1L纯水中含有10-7N A个阴阳离子()36、1L0.1mol/L的硫化钠溶液中硫离子数目为0.1N A()37、100mL1mol/L的Na3PO4溶液中含有离子数多于0.4N A()38、0.1mol/L的100mLH2SO3溶液中,含有的离子数约为0.03 N A()39、浓度分别为1 mol/L和0.5 mol/L的CH3COOH和CH3COONa混合溶液共1 L,含CH3COOH和CH3COO-共1.5 mol()40、1 mol冰醋酸中含有N A个CH3COO-()41、1 L0.2 mol/L Ba (NO3 )2溶液中含有0.2N A个NO3-()二、物质结构的考查(一)“基”,“根”的区分42、等物质的量的甲基(—CH3)和羟基(—OH)所含电子数相等()43、17g羟基中所含电子数为10N A()44、在1mol的CH5+中所含的电子数为10N A()45、常温常压下,1mol碳烯(:CH2)所含的电子数为8N A()46(二)胶体中的胶粒数47、1 mol FeCl3跟水反应完全转化成氢氧化铁胶体后,生成胶体粒子的数目为N A()(三)特别物质中的原子、离子48、在标准状况下,2g氖气含有N A个氖原子()49、62 g白磷中含有2 N A个磷原子()50、1molNa2O2含有阴阳离子总数为4N A()51、1mol固体NaHSO4含有阴阳离子总数为2N A()52、1molMgCl2中含有的离子数为2N A()(四)同位素原子的差异53、18 g D2O中含有的质子数目为10N A()54、9gD2O中含有的电子数为5N A()55、20 g重水(D2O)中含有的电子数为10N A()56、由2H和18O所组成的水11g,其中所含的中子数为N A()57、标准状况下,1.12LDT所含的中子数为0.15N A()58、2g重氢所含的中子数目为N A()59、3g氘变为氘离子时失去的电子数目为N A()(五)物质的空间结构和化学键的数目60、在石英晶体中,N A个硅原子与2N A个氧原子形成共价键()61、4.5 g SiO2晶体中含有的硅氧键数目为0.3×6.02×1023()62、6 g金刚石晶体中含有的碳碳键数目为6.02×1023()63、12 g石墨晶体中含有的碳碳键数目为3×6.02×1023()64、31g白磷分子中,含有的共价单键数目是N A个()65、60gSiO2和12g金刚石中各含有4N A个Si-O键和C-C键()66、1molCH4分子中共价键总数为4N A()67、1molC10H22中含共价键的数目为30N A()三、计算氧化还原反应中得失电子数目68、2.4 g镁变为镁离子失去电子数为0.1N A()69、标准状况下,将m1克锌加入到m2克20%的盐酸中共放出nLH2,则转移电子数为n N A /11.270、电解饱和食盐水时,每得到1molNaOH,在阳极上反应的离子就得到1 mol电子()71、1 molNa2O2与足量水蒸气反应转移电子数为2N A()72、标准状况下,用MnO2和浓盐酸反应制取Cl2,当有4 molHCl被氧化时,生成44.8 LCl273、32 gCu与S完全反应转移的电子数为N A()74、5.6 g铁粉与硝酸反应失去的电子数肯定为0.3×6.02×1023()75、5.6 g铁与足量的稀硫酸反应失去电子数为0.3N A个()76、1 mol Cl2作为氧化剂得到的电子数为N A()77、7.1g C12与足量NaOH溶液反应转移的电子数为0.2N A()78、1mol氯气参与氧化还原反应,转移的电子数肯定为2N A()79、3N A个NO2分子跟水分子充分作用,转移(偏移)的电子数为2N A()80、用惰性电极电解500mL饱和食盐水时,若溶液的pH值变为14时,则电极上转移的电子数目为N A()81、1mol硫原子同足量的铜粉充分反应时,铜失去的电子数为2 N A()82、电解CuCl2溶液时,若有N A个电子通过,则阴极增重64g()83、16gCuO被CO完全还原,转移电子数为0.1N A()四、关于阿伏加德罗定律84、N A个氧分子与N A个氢分子的质量比等于16 :1()85、相同条件下,N2和O3混合气与等体积的N2所含原子数相等()86、在同温同压下,相同体积的任何气体单质所含的原子数目相同()87、同温同压同体积的卤素单质所含原子个数相等()88、同温同压同体积的CO2和SO2所含氧原子数均为2N A()五、关于化学平衡89、常温常压下,4.6 g NO2气体含有1.81×1023个NO2分子()90、46g NO2和N2O4的混合物所含的分子数为1N A()91、肯定条件下,1molN2与足量H2反应,可生成2N A个NH3分子()92、在密闭容器中建立了N2+3H22NH3的平衡,每有17gNH3生成,必有0.5N A个NH3分子分解()六、涉及化学反应的发生及反应进行状况的计算93、标准状况下,11.2 LNH3和11.2 LHCl混合后分子总数为N A()94、含n molHCl的浓盐酸与足量MnO2反应可生成n N A /4 个氯分子()95、含2molH2SO4的浓硫酸与足量的铜片在加热条件下完全反应,可产生N A个SO2气体分子()高三化学复习N A选择题考查学问点热点归纳练习(推断)答案1——5:√√√√√6——10:√√√√√11——15:×××××16——20:××√××21——25:√××××26——30:√×√××31——35:×××××36——40:×√×√×41——45:√√×√√46——50:×××√×51——55:√×××√56——60:×√√√×61——65:√√×××66——70:√××√×71——75:×√×××76——80:×××√×81——85:×××√×86——90:×××××91——95×××××。
五笔难打字、疑难字、难拆字编码大全(大汇总)

五笔难打字、疑难字、难拆字编码大全一、按笔画数索引一画乙〔NNLL〕二画丁〔SGH 〕七〔AGN 〕九〔VTN 〕匕〔XTN 〕刁〔NGD 〕了〔BNH 〕乃〔ETN 〕乜〔NNV 〕三画三〔DGGG〕干〔FGGH〕亍〔FHK 〕于〔GFK 〕亏〔FNV 〕才〔FTE 〕下〔GHI 〕丈〔DYI 〕与〔GNGD〕万〔DNV 〕上〔HHGG〕千〔TFK 〕乞〔TNB 〕川〔KTHH〕么〔TCU 〕久〔QYI 〕丸〔VYI 〕及〔EYI 〕亡〔YNV 〕丫〔YHK 〕义〔YQI 〕之〔PPPP〕已〔NNNN〕己〔NNGN〕巳〔NNGN〕卫〔BGD 〕孑〔BNHG〕孓〔BYI 〕也〔BNHN〕飞〔NUI 〕习〔NUD 〕乡〔XTE 〕四画丰〔DHK 〕井〔FJK 〕开〔GAK 〕亓〔FJJ 〕夫〔FWI 〕天〔GDI 〕元〔FQB 〕无〔FQV 〕云〔FCU 〕专〔FNYI〕丐〔GHNV〕廿〔AGHG〕五〔GGHG〕支〔FCU 〕卅〔GKK 〕不〔GII 〕牙〔AHTE〕屯〔GBNV〕互〔GXGD〕中〔KHK 〕内〔MWI 〕午〔TFJ 〕壬〔TFD 〕升〔TAK 〕夭〔TAK 〕长〔TAYI〕反〔RCI 〕爻〔QQU 〕乏〔TPI 〕氏〔QAV 〕丹〔MYD 〕乌〔QNGD〕卞〔YHI 〕为〔YLYI〕尹〔VTE 〕尺〔NYI 〕丑〔NFD 〕巴〔CNHN〕以〔CYWY〕予〔CBJ 〕书〔NNHY〕贝(mhny)五画末〔GSI 〕未〔FII 〕击〔FMK 〕戋〔GGGT〕正〔GHD 〕甘〔AFD 〕世〔ANV 〕本〔SGD 〕术〔SYI 〕可〔SKD 〕丙〔GMWI〕左〔DAF 〕丕〔GIGF〕右〔DKF 〕布〔DMHJ〕戊〔DNYT〕平〔GUHK〕东〔AII 〕卡〔HHU 〕北〔UX 〕凸〔HGMG〕归〔JVG 〕且〔EGD 〕申〔JHK 〕甲〔LHNH〕由〔MHNG〕史〔KQI 〕央〔MDI 〕册〔MMGD〕冉〔MFD 〕凹〔MMGD〕生〔TGD 〕失〔RWI 〕乍〔THFD〕丘〔RGD 〕斥〔RYI 〕卮〔RGBV〕乎〔TUHK〕丛〔WWGF〕用〔ETNH〕甩〔ENV 〕氐〔QAYI〕乐〔QII 〕匆〔QRYI〕包〔QNV 〕玄〔YXU 〕兰〔UFF 〕半〔UFK 〕头〔UDI 〕必〔NTE 〕司〔NGKD〕民〔NAV 〕弗〔XJK 〕疋〔NHI 〕出〔BMK 〕丝〔XXGF〕六画戎〔ADE 〕孝〔FTGN〕老〔FTXB〕亚〔GOGD〕亘〔GJGF〕吏〔GKQI〕再〔GMFD〕戌〔DGNT〕在〔DHFD〕百〔DJF 〕而〔DMJJ〕戍〔DYNT〕死〔GQXB〕成〔DNNT〕夹〔GUWI〕夷〔GXWI〕尧〔ATGQ〕至〔GCFF〕乩〔HKNN〕师〔JGMH〕曳〔JXE 〕曲〔MAD 〕网〔MQQ 〕肉〔MWW 〕年〔RHFK〕朱〔RII 〕丢〔TFCU〕乔〔TDJJ〕乒〔RGTR〕乓〔RGYU〕向〔TMKD〕囟〔TLQI〕后〔RGKD〕兆〔IQV 〕舛〔QAHH〕产〔UTE 〕关〔UDU 〕州〔YTYH〕兴〔IW U〕农〔PEI 〕尽〔NYUU〕丞〔BIGF〕买〔NUDU〕七画戒〔AAK 〕严〔GODR〕巫〔AWWI〕求〔FIYI〕甫〔GEHY〕更〔GJQI〕束〔GKII〕两〔GMWW〕丽〔GMYY〕来〔GOI 〕芈〔GJGH〕串〔KKHK〕邑〔KCB 〕我〔TRNT〕囱〔TLQI〕希〔QDMH〕坐〔WWFF〕龟〔QJNB〕卵〔QYTY〕岛〔QYNM〕兑〔UKQB〕弟〔UXHT〕君〔VTKD〕八画奉〔DWFH〕武〔GAHD〕表〔GEU 〕者〔FTJF〕其〔ADWU〕直〔FHF 〕丧〔FUEU〕或〔AKGD〕事〔GKVH〕枣〔GMIU〕卖〔FNUD〕非〔DJDD〕些〔HXFF〕果〔JSI 〕畅〔JHNR〕垂〔TGAF〕乖〔TFUX〕秉〔TGVI〕臾〔VWI 〕卑〔RTFJ〕阜〔WNNF〕乳〔EBNN〕周〔MFKD〕枭〔QYNS〕氓〔YNNA〕卷〔UDBB〕单〔UJFJ〕肃〔VIJK〕隶〔VII 〕承〔BDII〕亟〔BKCG〕九画奏〔DWGD〕哉〔FAKD〕甚〔ADWN〕巷〔AWNB〕柬〔GLII〕咸〔DGKT〕威〔DGV 〕歪〔GIGH〕面〔DMJD〕韭〔DJDG〕临〔JTYJ〕禺〔JMHY〕幽〔XXMK〕拜〔RDFH〕重〔TGJF〕禹〔TKMY〕俎〔WWEG〕胤〔TXEN〕养〔UDYJ〕叛〔UDRC〕首〔UTHF〕举〔IWFH〕昼〔NYJG〕咫〔NYKW〕癸〔WGDU〕十画艳〔DHQC〕袁〔FKEU〕哥〔SKSK〕鬲〔GKMH〕孬〔GIVB〕乘〔TUXV〕鬯〔QOBX〕玺〔QIGY〕高〔YMKF〕离〔YBMC〕弱〔XUXU〕哿〔LKSK〕能〔CEXX〕十一画焉〔GHGO〕黄〔AMWU〕乾〔FJTN〕啬〔GULK〕戚〔DHIT〕匏〔DFNN〕爽〔DQQQ〕匙〔JGHX〕象〔QJEU〕够〔QKQQ〕馗〔VUTH〕孰〔YBVY〕兽〔ULGK〕艴〔XJQC〕胬〔VCMW〕十二画棘〔GMII〕黹〔OGUI〕辉〔OQPL〕鼎〔HNDN〕甥〔TGLL〕黍〔TWIU〕粤〔TLON〕舒〔WFKB〕就〔YIDN〕喾〔IPTK〕巯〔CAYQ〕彘〔XGXX〕十三画鼓〔FKUC〕赖〔GKIM〕嗣〔KMAK〕叠〔CCCG〕十四画嘉〔FKUK〕截〔FWYY〕赫〔FOFO〕聚〔BCTI〕斡〔FJWF〕兢〔DQDQ〕嘏〔DNHC〕臧〔DNDT〕夥〔JSQQ〕舞〔RLGH〕毓〔TXGQ〕睾〔TLFF〕鼐〔EHNN〕疑〔XTDH〕孵〔QYTB〕暨〔VCAG〕十五画虢〔FEHM〕颐〔AHKM〕靠〔TFKD〕勰〔LLLN〕豫〔CBQE〕翰〔FJWN〕噩〔GKKK〕整〔GKIH〕臻〔GCFT〕冀〔UXLW〕赢〔 YNKY〕十七画戴〔FALW〕豳〔EEMK〕黻〔OGUC〕黏〔TWIK〕爵〔ELVF〕赢〔YNKY〕馘〔UTHG〕隳〔BDAN〕十八画馥〔TJTT〕冁〔UJFE〕十九画黼〔OGUY〕鼗〔IQFC〕蠃〔YNKY〕羸〔YNKY〕疆〔XFGG〕锤:QTGF 舞:RLGH 浅:IGT二、按拼音索引“凹”::mmgd “翱”::rdfn “傲”::wgqt “粤”::tlon-----------------B-------------------“靶”::afcn “霸”::fafe “拜”::rdfh “稗”::trtf “版”::thgc “拌”::rufh “伴”::wufh “半”::ufk“绊”::xufh “豹”::eeqy “碑”::drtf “悲”::djdn“卑”::rtfj “辈”::djdl “贝”: mhny “敝”::umit “弊”::umia “鞭”::afwq “彪”::hame “鳖”::umig“憋”::umin “斌”::ygah “濒”::ihim “秉”::tgvi “拨”::rnty “博”::fgef “搏”::rgef “膊”::egef“哺”::kgey “埠”::fwnf “簿”::tigf-----------------C-------------------“蚕”::gdju “槽”::sgmj “策”::tgmi “豺”::eeft“搀”::rqku “谗”::yqku “厂”::dgt “曹”::gmaj“槽”:SGMJ “乘”::tuxv “承”::bdii “成”:DNNT“虫”::jhny “丑”::nfd “亍”::fhk “锄”::qegl“楚”::ssnh “处”::thi “捶”::rtgf “锤”::qtgf“垂”::tgaf “寸”::fghy “撮”::rjbc “刺”:gmi-----------------D-------------------“歹”::gqi “耽”::bpqn “丹”::myd “蛋”:NHJ“岛”::qynm “凳”:WGKM “氐”::qayi “第”::txht “帝”:UPMH “碘”::dmaw “典”::mawu “叼”::kngg“懂”::natf “毒”::gxgu “犊”::trfd “锻”::qwdc-----------------E-------------------“蛾”::jtrt “峨”::mtrt “鹅”::trng “娥”::vtrt“饿”::qntt “耳”::bghg “尔”: qi “贰”::afmi-----------------F-------------------“筏”::twar “伐”::wat “乏”::tpi “阀”::uwae“翻”:TOLN “飞”::nui “非”:DJD “缶”::rmk“夫”::fwi “敷”::geht “釜”::wqfu “脯”::egey“赋”::mgah “阜”::wnnf “父”::wqu “缚”::xgef-----------------G-------------------“尬”::dnwj “丐”::ghnv “尴”::dnjl “感”::dgkn“皋”::rdfj “革”::afj “根”::svey “跟”::khve“耕”::difj “更”::gjqi “庚”::yvwi “寡”: pde“羹”::ugod “躬”::tmdx “共”:AW “辜”::duj“瓜”::rcyi “罐”::rmay “惯”::nxfm “贯”::xfmu“瑰”::grqc “鬼”::rqci “裹”::yjse-----------------H-------------------“喊”::kdgt “撼”::rdgn “憾”::ndgn “毫”::yptn“黑”::lfou “很”::tvey “哼”::kybh “亨”::ybj“喉”::kwnd “猴”::qtwd “弧”::xrcy “互”::gxgd“缓”::xefc “换”::rqmd “惠”: gjh “昏”::qajf “豁”::pdhk “惑”::akgn-----------------J-------------------“击”::fmk “稽”: tdnm “棘”::gmii “脊”::iwef“既”::vcaq “荚”::aguw “颊”::guwm “甲”::lhnh“兼”::uvou “缄”::xdgt “拣”::ranw “减”::udgt“践”::khgt “贱”::mgt “见”::mqb “件”::wrhh“溅”::imgt “建”::vfhp “谏”::ygli “降”::btah“浇”::iatq “嚼”::kelf “睫”::hgvh “戒”::aak“巾”::mhk “斤”::rtth “谨”::yakg “韭”::djdg“九”::vtn “厩”::dvcq “救”::fiyt “臼”::vthg“舅”::vllb “巨”:AN(D)“疽”::uegd “倦”::wudb“眷”::udhf “卷”::udbb “撅”::rduw “攫”::rhhc“抉”::rnwy “爵”::elvf “君”::vtkd “俊”::wcwt注:焗(不能用86版五笔打出来)。
高频考点NA突破技巧

理综高参A.湖盆蒸发量增多B.盐湖面积缩小C.湖水富营养化加重D.湖水盐度增大。
分析:联想和推导下列数量关系:大量种植耐旱植物,需要引河水灌溉,使入湖径流减少,湖泊的面积缩小,B项正确;湖泊面积和水量减小,湖盆蒸发量就会减少,A项不正确;题目文字中“湖水浅,盐度饱和,”说明湖水盐度不变了,不断有盐结晶沉积湖底,D项不正确;湖水总量减少,湖水盐度高至饱和会抑制水藻生长,不能加重湖水的富营养化,C项不正确。
六、地理试题中的知识分类关系和解题方法地理事物存在着本质特征、种属关系(并列、种属、包含、交叉、不相关)、时间特征、区域特征,形成原因、相互影响、产生意义等方面的相同点与不同点。
高考常常要求学生学会类比筛选,归纳表达。
做选择题时扣准提问和材料,从某个地理角度对四个选项进行求同存异,找三同出一异,这一异项一般就是答案。
例如2017年全国Ⅱ卷第8题:①热带沙漠中的尼罗河泛滥区孕育了古埃及农耕文明。
②尼罗河在每年6-10月泛滥,③从上游带来的类似肥沃土壤的沉积物,与上游来水和周边区域的植物资源,都对农耕文明的形成意义重大。
据此完成:8.古埃及人从周边区域引入植物用于种植,引入植物的生长期必须与尼罗河泛滥区的耕种期一致。
由此判断这些植物最可能来自于:A.热带雨林气候区B.地中海气候区C.热带草原气候区D.热带季风气候区。
分析:从尼罗河流域四种气候降水特征来看,只有地中海气候仅仅冬季多雨。
这样“三同一异”,B项正确。
具体从温度条件分析,埃及可以四季随种随收;从水分条件来说,埃及在6-10月河水定期泛滥,耕地被淹没较深,不可能种植作物,所以选择11至次年5月热带草原气候干季,尼罗河两岸沃土裸露松软,可种植作物,又具有灌溉水源。
这个时期也是北部地中海气候温暖多雨,适合种植麦类作物。
两种气候地缘相邻,作物生长期或耕种期一致。
扣准提问和材料,有时要求选答范畴大的地理概念,有时要求选答范畴小的地理概念。
例如除天气因素之外,影响到达地面的的太阳辐射量变化的因素是“太阳高度”,如果选答“纬度因素”就无法说明太阳辐射量的时间变化原因;如果选答“阳光通过的大气路径长度”就狭义了,因为“太阳高度”影响原理中包含了“太阳高度”不同,“等量的太阳辐射照射面积”和“阳光通过的大气路径长度”两个方面不同。
高考化学选择题-NA考点知识点归纳(判断)汇编

高三化学复习N A选择题考查知识点热点归纳练习(判断)(一)根据质量求微粒数:关键是摩尔质量及微粒类型1、48 g O3气体含有6.02×1023个O3分子()2、14 g乙烯和丙烯的混合物中总原子数为3N A个()3、7 g C n H2n中含有的氢原子数目为N A()4、120g由NaHSO4和KHSO3组成的混合物中含有硫原子N A个()5、18g冰水混合物中有3N A个原子和10N A个电子()6、常温常压下,3g甲醛气体含有的原子数是0.4N A()7、250C时,1.01×105Pa时,4g氦气所含原子数为N A()8、常温常压下,32 g氧气和臭氧混合气体中含有2 N A个原子()9、62 g白磷中含有2 N A个白磷分子()10、106 gNa2CO3固体中含有N A个CO32-()(二)根据体积求微粒数:用到22.4L·mol-1必须注意物质的状态及是否是标准状况11、标准状况下,33.6 L H2O含有9.03×1023个H2O分子()12、2.24 L CO2中含有的原子数为0.3×6.02×1023()13、常温下11.2 L的甲烷气体含有甲烷分子数为0.5N A个()14、标准状况下,22.4 L CHCl3中含有的氯原子数目为3N A()15、常温常压下28 g CO与22.4 L O2所含分子数相等()16、标准状况下,11.2L SO3所含的分子数为0.5N A()17、标准状况下,22.4 L氦气与22.4 L氟气所含原子数均为2 N A()18、标准状况下,以任意比混和的氢气和一氧化碳气体共8.96L,在足量氧气中充分燃烧时消耗氧气的分子数为0.2N A()19、在标准状况下,11.2L氖气含有N A个氖原子()20、常温常压下,11.2L氧气含有的分子数为0.5 N A()21、标准状况下,密度为dg/L的某气体纯净物一个分子的质量为22.4d/N A g()22、标准状况下,含6.02×1023个氩原子的氩气的体积准确值为22.4L()23、00C,1.01×106 Pa时,11.2L氧气所含的氧原子数为N A()24、标准状况下,80gSO3所占的体积约为22.4L()25、25 ℃,1.013×105 Pa下,11.2 L氯气所含原子数为N A个()26、标准状况下,22.4 L氦气中所含原子数为N A个()27、标准状况下,1L辛烷完全燃烧后所生成气态产物的分子数为8N A /22.4 ()28、标准状况下,0.5N A个HCHO分子所占体积约为11.2 L()(三)根据浓度求微粒数:注意弱电解质的电离和盐类的水解29、0.5 mol·L-1 CuCl2溶液中含有3.01×1023个Cu2+()30、0.1 L 3 mol·L-1的NH4NO3溶液中含有的NH4+数目为0.3×6.02×1023()31、0.1 mol/L的氢氧化钠溶液中含钠离子数为0.1N A个()32、1 L 0.5 mol/L Na2CO3溶液中含有的CO32-数目为0.5N A()33、100 mL 2.0 mol/L的盐酸与醋酸溶液中氢离子均为0.2N A()34、1L1mol/LCuCl2溶液中含有的Cu2+的个数为N A()35、25℃时,1L纯水中含有10-7N A个阴阳离子()36、1L0.1mol/L的硫化钠溶液中硫离子数目为0.1N A()37、100mL1mol/L的Na3PO4溶液中含有离子数多于0.4N A()38、0.1mol/L的100mLH2SO3溶液中,含有的离子数约为0.03 N A()39、浓度分别为1 mol/L和0.5 mol/L的CH3COOH和CH3COONa混合溶液共1 L,含CH3COOH和CH3COO-共1.5 mol()40、1 mol冰醋酸中含有N A个CH3COO-()41、1 L0.2 mol/L Ba (NO3 )2溶液中含有0.2N A个NO3-()二、物质结构的考查(一)“基”,“根”的区别42、等物质的量的甲基(—CH3)和羟基(—OH)所含电子数相等()43、17g羟基中所含电子数为10N A()44、在1mol的CH5+中所含的电子数为10N A()45、常温常压下,1mol碳烯(:CH2)所含的电子数为8N A()46、16g CH4与18 g NH4+所含质子数相等()(二)胶体中的胶粒数47、1 mol FeCl3跟水反应完全转化成氢氧化铁胶体后,生成胶体粒子的数目为N A()(三)特殊物质中的原子、离子48、在标准状况下,2g氖气含有N A个氖原子()49、62 g白磷中含有2 N A个磷原子()50、1molNa2O2含有阴阳离子总数为4N A()51、1mol固体NaHSO4含有阴阳离子总数为2N A()52、1molMgCl2中含有的离子数为2N A()(四)同位素原子的差异53、18 g D2O中含有的质子数目为10N A()54、9gD2O中含有的电子数为5N A()55、20 g重水(D2O)中含有的电子数为10N A()56、由2H和18O所组成的水11g,其中所含的中子数为N A()57、标准状况下,1.12LDT所含的中子数为0.15N A()58、2g重氢所含的中子数目为N A()59、3g氘变为氘离子时失去的电子数目为N A()(五)物质的空间结构和化学键的数目60、在石英晶体中,N A个硅原子与2N A个氧原子形成共价键()61、4.5 g SiO2晶体中含有的硅氧键数目为0.3×6.02×1023()62、6 g金刚石晶体中含有的碳碳键数目为6.02×1023()63、12 g石墨晶体中含有的碳碳键数目为3×6.02×1023()64、31g白磷分子中,含有的共价单键数目是N A个()65、60gSiO2和12g金刚石中各含有4N A个Si-O键和C-C键()66、1molCH4分子中共价键总数为4N A()67、1molC10H22中含共价键的数目为30N A()三、计算氧化还原反应中得失电子数目68、2.4 g镁变为镁离子失去电子数为0.1N A()69、标准状况下,将m1克锌加入到m2克20%的盐酸中共放出nLH2,则转移电子数为n N A /11.270、电解饱和食盐水时,每得到1molNaOH,在阳极上反应的离子就得到1 mol电子()71、1 molNa2O2与足量水蒸气反应转移电子数为2N A()72、标准状况下,用MnO2和浓盐酸反应制取Cl2,当有4 molHCl被氧化时,生成44.8 LCl273、32 gCu与S完全反应转移的电子数为N A()74、5.6 g铁粉与硝酸反应失去的电子数一定为0.3×6.02×1023()75、5.6 g铁与足量的稀硫酸反应失去电子数为0.3N A个()76、1 mol Cl2作为氧化剂得到的电子数为N A()77、7.1g C12与足量NaOH溶液反应转移的电子数为0.2N A()78、1mol氯气参加氧化还原反应,转移的电子数一定为2N A()79、3N A个NO2分子跟水分子充分作用,转移(偏移)的电子数为2N A()80、用惰性电极电解500mL饱和食盐水时,若溶液的pH值变为14时,则电极上转移的电子数目为N A()81、1mol硫原子同足量的铜粉充分反应时,铜失去的电子数为2 N A()82、电解CuCl2溶液时,若有N A个电子通过,则阴极增重64g()83、16gCuO被CO完全还原,转移电子数为0.1N A()四、关于阿伏加德罗定律84、N A个氧分子与N A个氢分子的质量比等于16 :1()85、相同条件下,N2和O3混合气与等体积的N2所含原子数相等()86、在同温同压下,相同体积的任何气体单质所含的原子数目相同()87、同温同压同体积的卤素单质所含原子个数相等()88、同温同压同体积的CO2和SO2所含氧原子数均为2N A()五、关于化学平衡89、常温常压下,4.6 g NO2气体含有1.81×1023个NO2分子()90、46g NO2和N2O4的混合物所含的分子数为1N A()91、一定条件下,1molN2与足量H2反应,可生成2N A个NH3分子()92、在密闭容器中建立了N 2+3H22NH3的平衡,每有17gNH3生成,必有0.5N A个NH3分子分解()六、涉及化学反应的发生及反应进行情况的计算93、标准状况下,11.2 LNH3和11.2 LHCl混合后分子总数为N A()94、含n molHCl的浓盐酸与足量MnO2反应可生成n N A /4 个氯分子()95、含2molH2SO4的浓硫酸与足量的铜片在加热条件下完全反应,可产生N A个SO2气体分子()高三化学复习N A选择题考查知识点热点归纳练习(判断)答案1——5:√√√√√6——10:√√√√√11——15:×××××16——20:××√××21——25:√××××26——30:√×√××31——35:×××××36——40:×√×√×41——45:√√×√√46——50:×××√×51——55:√×××√56——60:×√√√×61——65:√√×××66——70:√××√×71——75:×√×××76——80:×××√×81——85:×××√×86——90:×××××91——95×××××。
动作电位--有关疑难问题例析

动作电位有关疑难问题例析动作电位是指可兴奋细胞在受到适当刺激后,其细胞膜在静息电位的基础上发生的迅速而短暂的、可向周围扩布的电位波动。
这种电位波动也可称为神经冲动或者兴奋。
浙科版教材中关于动作电位的产生传导和传递的内容十分注重科学性,改正了以前版本教材的一些错误观点。
但限于篇幅及学生的阅读层次,有关内在机理的解释不是很详尽,加上各种版本教参说法不一致,导致许多教师在该块内容上也模糊不清或者存在误解。
下面针对有关疑难问题利用例题进行分析,以供参考。
1动作电位的检测例题1(“2009上海生物高考试卷”28题):神经电位的测量装置如右上图所示,其中箭头表示施加适宜刺激,阴影表示兴奋区域。
用记录仪记录A、B 两电极之间的电位差,结果如右侧曲线图。
若将记录仪的A、B两电极均置于膜外,其它实验条件不变,则测量结果是检测动作电位的记录仪可以是电流表或示波器,题干中所记录的单相电位反映的是膜内某点(A点)与膜外参考电极(B点电极)之间的电位差变化。
静息状态时,膜电位分布为外正内负,即膜外电位高于膜内。
当规定膜外为零电位(如膜外电极接地,其实B电极如果不接地,则B点兴奋时,该处电位也会发生变化,记录到的应是两次波动),则膜内为负电位。
电流表指针表现为向负方向偏转,波形表现为负值水平曲线。
兴奋时,电位发生反转,膜内电位高于膜外,然后很快又恢复为静息电位。
电流表指针表现为向正方向偏转一次又恢复,波形表现为一次正方向的单向波峰。
当两个电极均置于膜外时,静息状态下,两电极之间没有电位差,电流表指针不偏转,示波器表现为与X轴重合的水平曲线。
受刺激后A、B两点先后兴奋,电流表发生两次相反方向的偏转后归零,示波器上则可看到方向相反的两个波峰,这就是双相电位。
该题答案之所以选C而不选D,是因为根据题干单相电位图可知,当A点电位低于B点时,电流表指针向负方向偏转,示波器波形在X轴下方。
例题2(“2010年海南生物高考卷”第9题):将记录仪(R)的两个电极置于某一条结构和功能完好的神经表面,如右图,给该神经一个适宜的刺激使其产生兴奋,可在R上记录到电位的变化。
高中化学钠的知识点总结

高中化学钠的知识点总结高中化学钠的知识1一、钠单质1.Na与水反应的离子方程式:命题角度为是否违反电荷守恒定律。
2.Na的保存:放于煤油中而不能放于水中,也不能放于汽油中;实验完毕后,要放回原瓶,不要放到指定的容器内。
3.Na失火的处理:不能用水灭火,必须用干燥的沙土灭火。
4.Na的焰色反应:颜色为黄色,易作为推断题的推破口。
注意做钾的焰色反应实验时,要透过蓝色的钴玻璃,避免钠黄光的干扰。
5.Na与熔融氯化钾反应的原理:因钾的沸点比钠低,钾蒸气从体系中脱离出来,导致平衡能向正反应移动。
【Na+KCl(熔融)=NaCl+K】二、氢氧化钠1.俗名:火碱、烧碱、苛性钠2.溶解时放热:涉及到实验室制取氨气时,将浓氨水滴加到氢氧化钠固体上,其反应原理为:一是NaOH溶解放出大量的热,促进了氨水的分解,二是提供的大量的OH-,使平衡朝着生成NH3的方向移动。
与之相似的还有:将浓氨水或铵盐滴加到生石灰上。
涉及到的方程式为NH4++OH- NH3?H2ONH3↑H2O。
3.与CO2的反应:主要是离子方程式的书写(CO2少量和过量时,产物不同)。
4.潮解:与之相同的还有CaCl2、MgCl2。
三、过氧化钠1.非碱性氧化物:金属氧化物不一定是碱性氧化物,因其与酸反应除了生成盐和水外,还有氧气生成,化学方程式为:2Na2O2+4HCl=4NaCl+2H2O+O2↑。
2.过氧化钠中微粒的组成:1mol过氧化钠中所含有离子的数目为3NA,或说它们的微粒个数之比为2:1,命题角度为阿伏加德罗常数。
3.过氧化钠与水、CO2的反应:一是过氧化钠既是氧化剂也是还原剂,水既不是氧化剂也不是还原剂;二是考查电子转移的数目(以氧气的量为依据)。
4.强氧化性:加入过氧化钠后溶液离子共存的问题;过氧化钠与SO2反应产物实验探究。
四、碳酸钠与碳酸氢钠1.俗名:Na2CO3(纯碱、苏打);NaHCO3(小苏打)2.除杂:CO2(HCl),通入饱和的NaHCO3溶液而不是饱和Na2CO3溶液。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
根据路由器的第一种做法,在规划网络时可以使用子网,但要求属于同一主网的所有子网必须使用相同的掩码,且规划网络时应使属于同一主网的子网连续(中间不 插入属于其它主网的网络)。如图1所示,两个同属于A类的子网掩码相同且连续使用,两个同属于B类的子网掩码相同且连续使用。被配置了属于同一主网的子网 地址的路由器可以交换子网路由。路由器B可以和A交换子网路由,也可以和C交换子网路由。所以路由器B收到的全部是子网路由条目。
例如,路由器有到达网络172.14.3.0 和172.14.4.0的路由,如果有到达172.14.5.0等其他一些属于172.14.0.0网络的子网的数据包,并且没有开启ip classless功能,路由器会认为既然172.14.3.0和172.14.4.0存在于路由表中,那么该主网(172.14.0.0)的所有子网都 应该存在,只是此时没有具体的172.14.5.0这条路由罢了。即使存在默认路由也不会使用默认路由传送该数据包。如果开启ip classless功能,它们则使用默认路由转发这些数据包。
图2
根据以上特点,当使用有类路由协议时还需要谨慎规划网络地址,除了保证子网连续外,还必须保证同一主网内的子网掩码要相同。如果掩码不同,也会造成路由表不正确。
下面以图3所示的地址规划方案解释该问题。
图3
图中两个同属于B类的子网是连续规划的,但他们的掩码不同,一个使用24位掩码,一个使用26位掩码。
C 172.16.4.64/26 is directly connected, FastEthernet0/0
R 10.0.0.0/8 [120/1] via 172.16.4.66, 00:00:16, FastEthernet0/0
R 192.168.1.0/24 [120/1] via 172.16.3.1, 00:00:03, FastEthernet0/1
CCNA疑难解析之七:show ip eigrp topology
router4#show ip eigrp topology
Codes: P - Passive, A - Active, U - Update, Q - Query, R - Reply,
r - reply Status, s - sia Status
FastEthernet0/0 1 1 2
FastEthernet0/1 1 1 2
Automatic network summarization is in effect
C 10.11.0.0 is directly connected, FastEthernet0/0
R 10.12.0.0 [120/1] via 10.11.0.2, 00:00:03, FastEthernet0/0
R 192.168.1.0/24 [120/2] via 172.16.4.65, 00:00:11, FastEthernet0/1
CCNA疑难解析之பைடு நூலகம்:network x.x.x.x
在配置动态路由协议的时候,在路由进程下,都会用到network x.x.x.x 。该命令的作用一般认为是向邻居路由器宣告自己直连的网络,其实还有一个功能,那就是让地址在该网络上的接口参与路由进程,接收和发送路由信息。因为所有 运行了动态路由协议的路由器都要依靠邻居路由器获取远程路由信息。所以,在宣告自己直连的网络的同时,还要让接口参与路由进程中,接收邻居宣告的路由信 息。
观察它们的路由表是否有错误。
(1)路由器Middle 的路由表:
Middle#sh ip route
(代码部分省略)
172.16.0.0/16 is variably subnetted, 2 subnets, 2 masks
C 172.16.3.0/24 is directly connected, FastEthernet0/1
Right#
路由表中既没有172.16.3.0的路由也没有172.16.0.0的路由。
CCNA疑难解析之二:IP classless
在运行有类路由协议的路由器上,如果收到数据包,目的地是它直连子网所在的主类网络中的一些该路由器未知的子网,路由器就会丢弃这些数据包。如果让路由器为这些数据选择默认路由转发,则必须使用ip classless命令开启该功能。
1. 有类路由协议的路由表
由于有类路由协议只发送路由条目,不携带掩码,所以运行有类路由协议的路由器在接收到路由条目后,进行如下的判断:
u 如果路由更新信息中的路由条目与自己的接收接口的地址属于同一主类网络(A类、B类、C类网络号叫主网号),路由器则使用自己接口上的子网掩码作为接收到的路由条目的网络掩码。
CCNA疑难解析之三:本网/本地广播 vs. 子网广播
地址255.255..255.255,被定义为广播地址,也就是本网广播地址,也称为本地广播地址。既然是本地广播,所以只在发送该广播数据的主机所在 的网段内传播。这种数据也不会被路由器转发,否则与“本地”概念相矛盾。另外一个广播地址是这样定义的:所有主机比特位都为 1。这个广播地址称为特定子网的广播地址,简称子网广播,也叫直接地址广播。如果主机需要向其它特定子网发广播数据,就使用那个子网的广播地址。这种数据 是可以被路由器转发的。在路由器的接口上有个 directed broadcast 命令,就是用来控制路由器是否转发此种广播数据的。
Routing Protocol is "rip"
Sending updates every 30 seconds, next due in 8 seconds
Invalid after 180 seconds, hold down 180, flushed after 240
Outgoing update filter list for all interfaces is not set
R 10.0.0.0/8 [120/2] via 172.16.3.3, 00:00:20, FastEthernet0/0
C 192.168.1.0/24 is directly connected, FastEthernet0/1
Left#
路由表显示,既没有172.16.4.0的路由也没有172.16.0.0的路由。也就是说既没有子网路由也没有主网路由。
(3)路由器Right的路由表:
Right#sh ip route
(代码部分省略)
172.16.0.0/26 is subnetted, 1 subnets
C 172.16.4.64 is directly connected, FastEthernet0/1
10.0.0.0/16 is subnetted, 2 subnets
P 172.16.0.0/16, 1 successors, FD is 33280
via 192.168.10.2 (33280/30720), FastEthernet0/1
30720 表示AD值。
CCNA疑难解析之八:哪个接口在更新路由信息?
router# show ip protocols
图1
根据路由器的第二种做法,所有子网路由信息在到达主网边界时都被丢弃,即当路由信息跨越主类网络时只通告相应的主类网络路由。所以路由器A收到的路由是172.16.0.0;路由器C收到的路由是10.0.0.0。
当属于同一主网的子网不连续时,如图2所示,路由器A和C都向路由器B通告可以到达网络172.16.0.0,路由器B可能作出不正确的转发决定。
CCNA疑难解析之一:有类路由协议与不连续子网
路由协议的分类方法有多种,根据路由协议的运行原理划分,可以分为距离矢量型路由协议、链路状态型路由协议和综合型路由协议。根据在路由更新时是否携带网络掩码划分,可以把路由协议分为有类路由协议(classful)和无类路由协议(classless)。
RIPv1和IGRP协议属于有类路由协议。
Middle#
该路由表是正确的。
(2)路由器Left的路由表:
Left#sh ip route
(代码部分省略)
172.16.0.0/24 is subnetted, 1 subnets
C 172.16.3.0 is directly connected, FastEthernet0/0
01:03:49: IGRP: Total routes in update: 2
含义是:路由器在f0/1接口上收到了来自邻居172.16.4.3的路由更新信息,更新中包含一个内部(interior)路由(子网号代表的路由), 一个系统(system)路由(主网号代表的路由)和零个外部(exterior)路由(非IGRP的路由)。这次更新的路由总量为2条。
Maximum path: 4
Routing for Networks:
172.14.0.0
192.168.1.0
Routing Information Sources:
Gateway Distance Last Update
172.14.3.3 120 00:00:07
Incoming update filter list for all interfaces is not set
Redistributing: rip
Default version control: send version 1, receive any version
Interface Send Recv Triggered RIP Key-chain
