16届高三下学期开学(零模)检测考试化学试卷(附答案)
海淀2016年高三3月零模化学
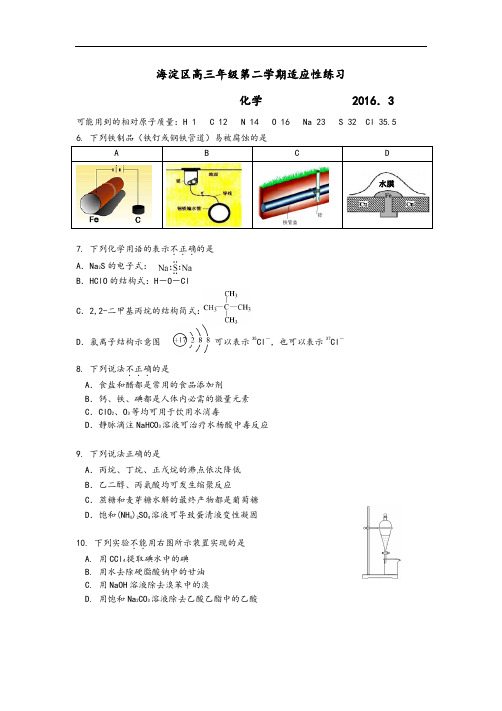
海淀区高三年级第二学期适应性练习化学 2016.3 可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32 Cl 35.56. 下列铁制品(铁钉或钢铁管道)易被腐蚀的是A B C D水膜7. 下列化学用语的表示不正确...的是A.Na2S的电子式:B.HClO的结构式:H-O-ClC.2,2-二甲基丙烷的结构简式:D.氯离子结构示意图可以表示35Cl-,也可以表示37Cl-8. 下列说法不正确...的是A.食盐和醋都是常用的食品添加剂B.钙、铁、碘都是人体内必需的微量元素C.ClO2、O3等均可用于饮用水消毒D.静脉滴注NaHCO3溶液可治疗水杨酸中毒反应9. 下列说法正确的是A.丙烷、丁烷、正戊烷的沸点依次降低B.乙二醇、丙氨酸均可发生缩聚反应C.蔗糖和麦芽糖水解的最终产物都是葡萄糖D.饱和(NH4)2SO4溶液可导致蛋清液变性凝固10. 下列实验不能..用右图所示装置实现的是A. 用CCl4提取碘水中的碘B. 用水去除硬脂酸钠中的甘油C. 用NaOH溶液除去溴苯中的溴D. 用饱和Na2CO3溶液除去乙酸乙酯中的乙酸11. W、X、Y、Z是四种原子序数依次增大的短周期主族元素。
W元素的最高正化合价与最低负化合价的代数和为0,X元素原子的电子层数是最外层电子数的3倍,Y元素原子M层上的电子数为6。
则下列说法正确的是A.原子半径:Z > Y > XB.简单阴离子还原性:Z > YC.最高价氧化物对应水化物的酸性:Z > YD.W与Z形成的化合物一定是易溶于水的气体12. 某化工厂采用稀NaOH溶液脱除CO2。
若碱洗脱除后所得废液的pH约为13(已知:相同温度下饱和Na2CO3溶液的pH约为12),则下列说法正确的是A. 该溶液中:c(OH-) > c(Na+) > c(CO32-) > c(HCO3-) > c(H+)B. 该溶液中:c(Na+) + c(H+) = c(OH-) + 2c(CO32-) + c(HCO3-)C. 加水稀释该溶液,恢复至原温度,pH增大,K w不变D. 该溶液pH约为13的原因:CO 32-+H2O HCO3-+OH-25.(17分)天然橡胶和香料柑青酸甲酯衍生物F的合成路线如下:已知:①②(R、R’可以是氢原子、烃基或官能团)(1)F中所含官能团的名称是________。
北京市怀柔区2016届高考化学零模试卷含解析

2016年北京市怀柔区高考化学零模试卷一、选择题(共7小题,每小题6分,满分42分)1.春节是我国的传统节日,下列与春节相关的各项中,涉及到氧化还原反应的是:()A.A B.B C.C D.D2.下列解释事实的化学用语,不合理的是()A.碳酸氢钠溶液中加入氢氧化钠反应:HCO3﹣+OH﹣=CO2↑+H2OB.用氯化铁溶液腐蚀铜电路板:2Fe3++Cu=2Fe2++Cu2+C.用热浓盐酸洗涤试管壁上附着的MnO2:MnO2+4H++2Cl﹣Mn2++Cl2↑+2H2O D.盛放氢氧化钠溶液的试剂瓶不能使用玻璃塞:SiO2+2OH﹣=SiO32﹣+H2O3.关于有机物的下列说法中,正确的是()A.所有醇和卤代烃都能发生消去反应B.甲苯能使溴水因化学反应褪色而苯不能C.苯酚在70℃水中溶解度不大D.低级酯的密度一般小于水4.已知X、Y、Z、M四种短周期元素的原子序数依次增大,X与M同主族,X原子的最外层电子数为内层电子数的三倍,Y与X形成的一种化合物常用作潜水艇的供氧剂,Z的氧化物有两性.下列说法正确的是()A.最高价氧化物的水化物的碱性:Z>YB.离子的还原性:M>XC.电子层数:Y<MD.离子半径:Y<Z5.一种燃料电池如图所示,关于它的说法正确的是()A.MnO2极为负极B.C n(H2O)m发生了氧化反应C.电子从负极区经交换膜移向正极区D.放电过程中,H+从正极区移向负极区6.下列说法正确的是()A.图中△H1=△H2+△H3B.从图可看出CO2的能量高于CO+O2C.从图可看出反应中加入催化剂可降低反应物能量D.图中t0时间段后(不包含t0)电解质溶液中,弱电解质分子与离子都存在7.下列实验能达到预期目的是()A .AB .BC .CD .D二、解答题(共4小题)8.合成聚乙烯醇、PF 树脂和聚酯纤维PET 的路线如下:已知:Ⅰ.(R 为H 原子或烃基) Ⅱ.RCOOR ′+R 〃OHRCOO R 〃+R ′OH (R 、R ′、R ″代表烃基) 回答下列问题: (1)A 的核磁共振氢谱有3组吸收峰,A 的结构简式为(2)B 的官能团名称是(3)X 是由电石和饱和食盐水反应生成的烃,B 和X 以物质的量之比1:1发生加成反应生成C ,则C →D 的反应类型是(4)Y 是合成PF 树脂的一种单体,Y 的结构简式为(5)A →E 的化学方程式为(6)的同分异构体W也能被酸性高锰酸钾溶液氧化为G,W的所有可能结构简式为(7)Z与A互为同系物,Z的相对分子质量比A小14.G→I的化学方程式为(8)已知:A Q,Q的沸点高于A,所以Q用作汽车防冻液.Q 的结构简式是(9)I→PET的化学方程式为.9.硫酸铜是一种应用极其广泛的化工原料,由于铜不能与稀硫酸直接反应,实验中将铜加入浓硫酸,加热使之反应完全(装置如图1、2所示).再通过一定的操作得到硫酸铜晶体.(1)仪器A的名称为(2)写出铜与浓硫酸反应的化学方程式(3)写出烧杯中发生反应的离子反应方程式(4)装置图2与图1相比的优点是(5)为符合绿色化学的要求,某研究性学习小组进行如下设计:将铜与稀硫酸混合,同时加入试剂X,可生成硫酸铜溶液.则X可以是(填序号).a.热空气b.FeCl3c.KNO3d.H2O2(6)在不加入试剂X的情况下,某同学利用电解法也制得了硫酸铜溶液.装置如图3:写出石墨电极上发生的电极反应式(7)写出由硫酸铜稀溶液制得硫酸铜晶体的操作方法为.10.2015年冬北京出现了两次严重雾霾,发布了“空气重污染红色预警”.其中大气中可吸入颗粒物PM2.5主要来源为燃煤、机动车尾气等.(1)若取某PM2.5样本,用蒸馏水处理,测得溶液中含有的离子有:K+、Na+、NH4+、SO42﹣、NO3﹣、Cl﹣,则该溶液为(填“酸性”或“碱性”)溶液,其原因用离子方程式解释是:.(2)①“洗涤”燃煤烟气可减轻PM2.5中SO2的危害,下列可适用于吸收SO2的试剂有(填代号)a.CaCl2溶液b.氨水c.Ca(OH)2悬浊液d.浓H2SO4②汽车尾气系统中装有催化转化器,可将NOx还原成N2排出,减少氮氧化物及一氧化碳的排放,已知下列热化学方程式:Ⅰ.N2(g)+O2(g)⇌2NO(g)△H=+180.5kJ•mol﹣1Ⅱ.2C(s)+O2(g)⇌2CO(g)△H=﹣221.0kJ•mol﹣1Ⅲ.C(s)+O2(g)⇌CO2(g)△H=﹣393.5kJ•mol﹣1写出一氧化氮与一氧化碳反应的热化学方程式(3)开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题.氢气、甲醇是优质的清洁燃料,也可制作燃料电池.生产甲醇的原料CO和H2来源于:CH4(g)+H2O (g)⇌CO(g)+3H2(g)△H>0①一定条件下CH4的平衡转化率与温度、压强的关系如图.则T l T2(填“<”、“>”、“=”)②100℃时,将1mol CH4和2mol H2O通入容积为1L的定容密闭容器中,发生反应,能说明该反应已经达到平衡状态的是a.容器内气体密度恒定b.单位时间内消耗0.1mol CH4同时生成0.3molH2c.3v正(CH4)=v逆(H2)d.容器中气体的分子总数不随时间而变化(4)氢气燃料电池可以提升能量利用率.下图是利用氢气燃料电池电解50mL 2mol/L的氯化铜溶液的装置示意图:请回答:①氢气燃料电池的负极反应式是.②当线路中有0.1mol电子通过时,b极增重g11.实验小组的同学探究铁与浓、稀硝酸反应的还原产物.他们通过查资料得知:Nessler 试剂(K2HgI4的KOH溶液)可与NH4+反应生成沉淀(1)将铁加入足量浓硝酸时,无明显现象,加热,产生红棕色气体,同时溶液变为黄色,红棕色气体为(填化学式),黄色溶液中含有的金属阳离子.(填离子符号)(2)将过量铁加入稀硝酸中一段时间后,取反应完全的溶液少量加入几滴NaOH溶液加热,产生使红色石蕊试纸变蓝的气体,该气体为(填化学式).(3)通过以上实验同学们认为铁与稀硝酸反应,原理复杂.所以增加了以下实验:实验装置如图,注射器中吸有空气.按图示装置反应完毕后,取适量溶液于试管,滴加足量盐酸,再逐滴加入KOH至pH4.5﹣﹣5.5,待沉淀完全后,向上层清液中加入Nessler试剂.①向溶液中滴加盐酸时发生的离子方程式为:②注射器中空气的作用:观察到的实验现象如下:液面上、注射器内:无色气体逐渐变为浅棕色,注射器内气体体积下降加入Nessler试剂:出现沉淀③注射器内气体体积下降可能原因为(用化学用语解释)(4)请将以上实验结论补充完整:铁与浓硝酸反应还原产物为NO2、.2016年北京市怀柔区高考化学零模试卷参考答案与试题解析一、选择题(共7小题,每小题6分,满分42分)1.春节是我国的传统节日,下列与春节相关的各项中,涉及到氧化还原反应的是:()A.A B.B C.C D.D【考点】氧化还原反应.【专题】氧化还原反应专题.【分析】发生的反应中存在元素的化合价变化,则发生氧化还原反应,以此来解答.【解答】解:A.烟花的颜色,是金属离子发生的焰色反应,属于物理性质,不涉及到氧化还原反应,故A不选;B.贴春联,没发生化学变化,不发生氧化还原反应,故B不选;C.鞭炮的燃放,火药爆炸,发生化学变化,有元素的化合价变化,发生氧化还原反应,故C选;D.包饺子,不是化学变化,不发生氧化还原反应,故D不选;故选C.【点评】本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应的应用及化学与生活的考查,题目难度不大.2.下列解释事实的化学用语,不合理的是()A.碳酸氢钠溶液中加入氢氧化钠反应:HCO3﹣+OH﹣=CO2↑+H2OB.用氯化铁溶液腐蚀铜电路板:2Fe3++Cu=2Fe2++Cu2+C.用热浓盐酸洗涤试管壁上附着的MnO2:MnO2+4H++2Cl﹣Mn2++Cl2↑+2H2OD.盛放氢氧化钠溶液的试剂瓶不能使用玻璃塞:SiO2+2OH﹣=SiO32﹣+H2O【考点】离子方程式的书写.【专题】离子反应专题.【分析】A.反应生成碳酸钠和水;B.反应生成氯化铜、氯化亚铁;C.反应生成氯化锰、水和氯气;D.反应生成硅酸钠和水.【解答】解:A.碳酸氢钠溶液中加入氢氧化钠反应的离子反应为HCO3﹣+OH﹣=CO32﹣+H2O,故A错误;B.用氯化铁溶液腐蚀铜电路板的离子反应为2Fe3++Cu=2Fe2++Cu2+,故B正确;C.用热浓盐酸洗涤试管壁上附着的MnO2的离子反应为MnO2+4H++2Cl﹣Mn2++Cl2↑+2H2O,故C正确;D.盛放氢氧化钠溶液的试剂瓶不能使用玻璃塞的离子反应为SiO2+2OH﹣=SiO32﹣+H2O,故D正确;故选A.【点评】本题考查离子反应的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,题目难度不大.3.关于有机物的下列说法中,正确的是()A.所有醇和卤代烃都能发生消去反应B.甲苯能使溴水因化学反应褪色而苯不能C.苯酚在70℃水中溶解度不大D.低级酯的密度一般小于水【考点】有机物的结构和性质;有机化学反应的综合应用.【专题】有机反应.【分析】A.甲醇、卤代甲烷不能发生消去反应;B.甲苯与溴水发生萃取;C.苯酚不易溶于冷水;D.酯中C原子个数少的密度比水小.【解答】解:A.甲醇、卤代甲烷不能发生消去反应,而与﹣OH、﹣X相连C的邻位C上有H可发生消去反应,故A错误;B.甲苯与溴水发生萃取,不能发生反应,苯也与溴水发生萃取,故B错误;C.苯酚不易溶于冷水,温度升高,溶解度增大,故C错误;D.酯中C原子个数少的密度比水小,则低级酯的密度一般小于水,故D正确;故选D.【点评】本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机物的结构为解答的关键,侧重分析与应用能力的考查,题目难度不大.4.已知X、Y、Z、M四种短周期元素的原子序数依次增大,X与M同主族,X原子的最外层电子数为内层电子数的三倍,Y与X形成的一种化合物常用作潜水艇的供氧剂,Z的氧化物有两性.下列说法正确的是()A.最高价氧化物的水化物的碱性:Z>YB.离子的还原性:M>XC.电子层数:Y<MD.离子半径:Y<Z【考点】位置结构性质的相互关系应用;元素周期律和元素周期表的综合应用.【专题】元素周期律与元素周期表专题.【分析】已知X、Y、Z、M四种短周期元素的原子序数依次增大,X与M同主族,X原子的最外层电子数为内层电子数的三倍,X为O,则M为S;Y与X形成的一种化合物常用作潜水艇的供氧剂,则Y为Na;Z的氧化物有两性,Z为Al,结合元素的性质来解答.【解答】解:已知X、Y、Z、M四种短周期元素的原子序数依次增大,X与M同主族,X 原子的最外层电子数为内层电子数的三倍,X为O,则M为S;Y与X形成的一种化合物常用作潜水艇的供氧剂,则Y为Na;Z的氧化物有两性,Z为Al,A.金属性Na>Al,则最高价氧化物的水化物的碱性:Z<Y,故A错误;B.非金属性O>S,则离子的还原性:M>X,故B正确;C.Y、M均在第三周期,电子层相同,故C错误;D.Y、Z的离子具有相同电子排布,原子序数大的离子半径小,则离子半径:Y>Z,故D 错误;故选B.【点评】本题考查位置、结构与性质,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,题目难度不大.5.一种燃料电池如图所示,关于它的说法正确的是()A.MnO2极为负极B.C n(H2O)m发生了氧化反应C.电子从负极区经交换膜移向正极区D.放电过程中,H+从正极区移向负极区【考点】原电池和电解池的工作原理.【专题】电化学专题.【分析】A、原电池的负极上是元素化合价升高失电子的氧化反应的电极;B、原电池的正极上是元素化合价降低得电子的还原反应的电极;C、原电池中电子从负极流向正极;D、原电池中电解质中的阳离子移向正极,阴离子移向负极.【解答】解:A、MnO2极Mn元素的化合价降低,所以是正极,故A错误;B、MnO2极Mn元素的化合价降低,所以是正极,碳水化合物转化为二氧化碳的电极是负极,发生氧化反应,故B正确;C、原电池中电子从负极流向正极,即从负极区沿导电移向正极区,电子不会经过导电,故C错误;D、原电池中电解质中的阳离子移向正极,阴离子移向负极,即H+从负极区移向正极区,故D错误.故选B.【点评】本题考查了燃料电池,侧重于有关原理的应用的考查,题目难度中等,注意知识的归纳和梳理是关键.6.下列说法正确的是()A.图中△H1=△H2+△H3B.从图可看出CO2的能量高于CO+O2C.从图可看出反应中加入催化剂可降低反应物能量D.图中t0时间段后(不包含t0)电解质溶液中,弱电解质分子与离子都存在【考点】反应热和焓变.【专题】化学反应中的能量变化.【分析】A、根据盖斯定律的内容来回答;B、对于放热反应,反应物的能量高于产物的能量;C、反应中加入催化剂不会改变反应物的能量;D、弱电解质的电离最终达到电离平衡状态.【解答】解:A、根据盖斯定律的内容:﹣△H1=△H2+△H3,故A错误;B、一氧化碳燃烧属于放热反应,反应物CO和氧气的能量高于产物二氧化碳的能量,故B 错误C、反应中加入催化剂不会改变反应物的能量,只可以加快反应速率,故C错误;D、弱电解质的电离最终达到电离平衡状态,图中t0时间段后(不包含t0)电解质溶液中,达到了电离平衡,弱电解质分子与离子存在,故D正确.故选D.【点评】本题涉及盖斯定律的应用、反应热的判断以及弱电解质的电离平衡等知识,属于综合知识的考查,难度不大.7.下列实验能达到预期目的是()A.A B.B C.C D.D【考点】化学实验方案的评价.【专题】实验评价题.【分析】A.溴、三溴苯酚均易溶于苯;B.氢氧化钠过量,不能比较溶解度大小;C.Na2CO3溶液水解显碱性,加BaCl2溶液后水解平衡逆向移动,氢氧根离子浓度减小;D.证明元素非金属性强弱是依据:元素最高价氧化物对应水化物的酸的酸性越强,则该元素的非金属性越强.【解答】解:A.溴、三溴苯酚均易溶于苯,不能除杂,应选NaOH溶液分液来除杂,故A 错误;B.氢氧化钠过量,不能比较溶解度大小,可在饱和氢氧化镁溶液中滴加氯化铁溶液比较,故B错误;C.Na2CO3溶液水解显碱性,加BaCl2溶液后水解平衡逆向移动,氢氧根离子浓度减小,所以颜色褪去,故C正确;D.证明元素非金属性强弱是依据:元素最高价氧化物对应水化物的酸的酸性越强,则该元素的非金属性越强,不能看盐酸与碳酸的酸性大小,故D错误.故选C.【点评】本题考查化学实验方案的评价,为高频考点,涉及除杂、沉淀转化、水解平衡和非金属性比较等,把握物质的性质及反应原理为解答的关键,侧重分析与应用能力的考查,题目难度不大.二、解答题(共4小题)8.合成聚乙烯醇、PF树脂和聚酯纤维PET的路线如下:已知:Ⅰ.(R为H原子或烃基)Ⅱ.RCOOR′+R〃OH RCOO R〃+R′OH(R、R′、R″代表烃基)回答下列问题:(1)A的核磁共振氢谱有3组吸收峰,A的结构简式为CH3CH2OH(2)B的官能团名称是羧基(3)X是由电石和饱和食盐水反应生成的烃,B和X以物质的量之比1:1发生加成反应生成C,则C→D的反应类型是加聚反应(4)Y是合成PF树脂的一种单体,Y的结构简式为(5)A→E的化学方程式为(6)的同分异构体W也能被酸性高锰酸钾溶液氧化为G,W的所有可能结构简式为(7)Z与A互为同系物,Z的相对分子质量比A小14.G→I的化学方程式为(8)已知:A Q,Q的沸点高于A,所以Q用作汽车防冻液.Q 的结构简式是HOCH2CH2OH(9)I→PET的化学方程式为.【考点】有机物的合成.【专题】有机推断;结构决定性质思想;演绎推理法;有机物的化学性质及推断.【分析】A的核磁共振氢谱有3组吸收峰,由A的分子式可知,A为CH3CH2OH,A催化氧化得E为CH3CHO,根据PF树脂的结构可知,Y为,A被重铬酸钾氧化得B为CH3COOH,X是由电石和饱和食盐水反应生成的烃,B和X以物质的量之比1:1发生加成反应生成C,所以X为CH≡CH,C为CH3COOCH=CH2,C发生加聚反应得D为,D再发生水解反应生成聚乙烯醇,A与浓溴化氢反应生成F为CH3CH2Br,对二乙苯被氧化生成G为,Z与A互为同系物,Z的相对分子质量比A小14,则Z为CH3OH,G与Z发生酯化反应生成I为,I与P 在催化剂加热的条件下发生类似信息Ⅱ中的反应生成聚酯纤维PET,根据A Q,Q的沸点高于A,所以Q用作汽车防冻液,所以Q为HOCH2CH2OH,PET为,据此答题;【解答】解:A的核磁共振氢谱有3组吸收峰,由A的分子式可知,A为CH3CH2OH,A催化氧化得E为CH3CHO,根据PF树脂的结构可知,Y为,A被重铬酸钾氧化得B为CH3COOH,X是由电石和饱和食盐水反应生成的烃,B和X以物质的量之比1:1发生加成反应生成C,所以X为CH≡CH,C为CH3COOCH=CH2,C发生加聚反应得D为,D再发生水解反应生成聚乙烯醇,A与浓溴化氢反应生成F为CH3CH2Br,对二乙苯被氧化生成G为,Z与A互为同系物,Z的相对分子质量比A小14,则Z为CH3OH,G与Z发生酯化反应生成I为,I与P 在催化剂加热的条件下发生类似信息Ⅱ中的反应生成聚酯纤维PET,根据A Q,Q的沸点高于A,所以Q用作汽车防冻液,所以Q为HOCH2CH2OH,PET为,(1)根据上面的分析可知,A的结构简式为CH3CH2OH,故答案为:CH3CH2OH;(2)BB为CH3COOH,的官能团名称是羧基,故答案为:羧基;(3)根据上面的分析可知,C→D的反应类型是加聚反应,故答案为:加聚反应;(4)Y根据上面的分析可知,Y的结构简式为,故答案为:;(5)A发生催化氧化生成E,A→E的化学方程式为,故答案为:;(6)的同分异构体W也能被酸性高锰酸钾溶液氧化为G,说明与苯环相连的碳上有氢原子,则符合条件的W的所有可能结构简式为,故答案为:;(7)G为,G→I的化学方程式为,故答案为:;(8)根据上面的分析可知,Q的结构简式是HOCH2CH2OH,故答案为:HOCH2CH2OH;(9)I→PET的化学方程式为,故答案为:.【点评】本题考查有机物推断,为高频考点,根据PMMA聚合物结构简式结合反应条件采用逆向思维方法进行推断,正确推断物质结构简式是解本题关键,注意知识的灵活运用,题目难度不大.9.硫酸铜是一种应用极其广泛的化工原料,由于铜不能与稀硫酸直接反应,实验中将铜加入浓硫酸,加热使之反应完全(装置如图1、2所示).再通过一定的操作得到硫酸铜晶体.(1)仪器A的名称为分液漏斗(2)写出铜与浓硫酸反应的化学方程式Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O (3)写出烧杯中发生反应的离子反应方程式SO2+2OH﹣=SO32﹣+H2O(4)装置图2与图1相比的优点是增加了防倒吸装置(5)为符合绿色化学的要求,某研究性学习小组进行如下设计:将铜与稀硫酸混合,同时加入试剂X,可生成硫酸铜溶液.则X可以是ad(填序号).a.热空气b.FeCl3c.KNO3d.H2O2(6)在不加入试剂X的情况下,某同学利用电解法也制得了硫酸铜溶液.装置如图3:写出石墨电极上发生的电极反应式2H++2e﹣=H2↑(7)写出由硫酸铜稀溶液制得硫酸铜晶体的操作方法为加热浓缩、冷却结晶、过滤.【考点】制备实验方案的设计.【专题】制备实验综合.【分析】(1)根据仪器A的构造可知A为分液漏斗;(2)铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫气体和和水;(3)烧杯中盛有氢氧化钠溶液,用于吸收有毒的二氧化硫气体;(4)根据二氧化硫与氢氧化钠溶液反应,易发生倒吸现象分析;(5)根据“符合绿色化学”要求:不产生污染气体、不引进杂质进行分析;(6)根据电解池工作原理分析,阳极发生氧化反应,阴极发生还原反应;(7)实验目的是“硫酸铜稀溶液制得硫酸铜晶体”分析操作方法.【解答】解:(1)根据图示可知,仪器A为分液漏斗,故答案:分液漏斗;(2)铜与浓硫酸加热反应生成硫酸铜、二氧化硫和水,反应的化学方程式为:Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O,故答案为:Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O;(3)二氧化硫有毒,需要用碱液吸收,所以烧杯中发生反应的离子方程式为:SO2+2OH﹣=SO32﹣+H2O,故答案为:SO2+2OH﹣=SO32﹣+H2O;(4)由于二氧化硫与氢氧化钠溶液反应,易发生倒吸现象,应该使用防倒吸装置,图示装置中图2与图1相比的优点是增加了防倒吸装置,故答案为:增加了防倒吸装置;(5)将铜与稀硫酸混合,同时加入试剂X,可生成硫酸铜溶液,由于铜与稀硫酸不反应,需要加入具有氧化性的试剂,且不能产生污染气体,可以用a.热空气、d.H2O2,不能选用b.FeCl3(引进杂质)、c.KNO3(生成污染气体、引进杂质),故答案为:a、d;(6)装置图3中,铜连接电源正极,为电解池的阳极,则铜电解失去电子生成铜离子,石墨电极连接电源负极,为电解池的阴极,则石墨电解上氢离子得到电子生成氢气,发生的电极反应式:2H++2e﹣=H2↑,故答案为:2H++2e﹣=H2↑;(7)硫酸铜稀溶液制得硫酸铜晶体,温度过高无法得到硫酸铜晶体,所以需要通过加热浓缩、冷却结晶、过滤的操作方法获得硫酸铜晶体,故答案为:加热浓缩、冷却结晶、过滤.【点评】本题考查了制备方案的设计,题目难度中等,明确实验目的、实验原理为解答关键,涉及实验方案的评价、实验装置的理解与评价、常用化学用语、物质推断、实验条件控制、电解原理等知识,注意掌握制备方案设计与评价原则,明确电解原理、化学实验基本操作方法,试题培养了学生的分析能力及化学实验能力.10.2015年冬北京出现了两次严重雾霾,发布了“空气重污染红色预警”.其中大气中可吸入颗粒物PM2.5主要来源为燃煤、机动车尾气等.(1)若取某PM2.5样本,用蒸馏水处理,测得溶液中含有的离子有:K+、Na+、NH4+、SO42﹣、NO3﹣、Cl﹣,则该溶液为酸性(填“酸性”或“碱性”)溶液,其原因用离子方程式解释是:NH4++H2O NH3•H2O+H+.(2)①“洗涤”燃煤烟气可减轻PM2.5中SO2的危害,下列可适用于吸收SO2的试剂有b、c(填代号)a.CaCl2溶液b.氨水c.Ca(OH)2悬浊液d.浓H2SO4②汽车尾气系统中装有催化转化器,可将NOx还原成N2排出,减少氮氧化物及一氧化碳的排放,已知下列热化学方程式:Ⅰ.N2(g)+O2(g)⇌2NO(g)△H=+180.5kJ•mol﹣1Ⅱ.2C(s)+O2(g)⇌2CO(g)△H=﹣221.0kJ•mol﹣1Ⅲ.C(s)+O2(g)⇌CO2(g)△H=﹣393.5kJ•mol﹣1写出一氧化氮与一氧化碳反应的热化学方程式()()2()2()△H=﹣746.5kJ/mol(3)开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题.氢气、甲醇是优质的清洁燃料,也可制作燃料电池.生产甲醇的原料CO和H2来源于:CH4(g)+H2O (g)⇌CO(g)+3H2(g)△H>0①一定条件下CH4的平衡转化率与温度、压强的关系如图.则T l<T2(填“<”、“>”、“=”)②100℃时,将1mol CH4和2mol H2O通入容积为1L的定容密闭容器中,发生反应,能说明该反应已经达到平衡状态的是cda.容器内气体密度恒定b.单位时间内消耗0.1mol CH4同时生成0.3molH2c.3v正(CH4)=v逆(H2)d.容器中气体的分子总数不随时间而变化(4)氢气燃料电池可以提升能量利用率.下图是利用氢气燃料电池电解50mL 2mol/L的氯化铜溶液的装置示意图:请回答:①氢气燃料电池的负极反应式是H2+2OH﹣﹣2e﹣=2H2O.②当线路中有0.1mol电子通过时,b极增重 3.2g【考点】"三废"处理与环境保护;原电池和电解池的工作原理;化学平衡状态的判断.【专题】化学平衡专题;电化学专题.【分析】(1)NH 4+水解显酸性,PM2.5的酸碱性为酸性;(2)①二氧化硫是酸性氧化物和碱或碱性盐溶液反应;②根据盖斯定律,NO (g )和CO (g )反应生成N 2(g )、CO 2(g )的热化学方程式可由 ③×2﹣①﹣②得到;(3)①正反应为吸热反应,压强一定时,升高温度,平衡向正反应方向移动,甲烷的转化率增大,据此判断温度大小;②a .100℃时,反应混合物都是气体,混合气体总质量不变,容器的容积不变,容器内气体密度始终不变;b .单位时间内消耗0.1mol CH 4同时生成0.3molH 2,反应始终按此比例进行;c .3v 正(CH 4)=v 逆(H 2),不同物质的正逆速率之比等于化学计量数之比,反应到达平衡;d .随反应进行混合气体总物质的量增大,如容器中气体的分子总数不随时间而变化,反应到达平衡;(4)①负极发生氧化反应,氢气被氧化生成水;②根据装置图可知,b 电极与燃料电池的负极相连,作阴极,阴极析出铜,电极反应式是Cu 2++2e ﹣=Cu ,质量增大,当线路中有0.1mol 电子通过时,阴极析出0.05mol 铜.【解答】解:(1)NH 4+水解显酸性,离子方程式为:NH 4++H 2O ⇌NH 3•H 2O+H +,故答案为:酸性;NH 4++H 2O NH 3•H 2O+H +;(2)①二氧化硫是酸性氧化物和碱或碱性盐溶液反应,故答案为:b 、c ;②ⅰN 2(g )+O 2(g )═2NO (g )△H=+180.5kJ •mol ﹣1﹣﹣﹣﹣﹣﹣﹣①ⅱ2C (s )+O 2(g )═2CO (g )△H=﹣221.0kJ •mol ﹣1﹣﹣﹣﹣﹣﹣﹣﹣②ⅲC (s )+O 2(g )═CO 2( g )△H=﹣393.5kJ •mol ﹣1﹣﹣﹣﹣﹣﹣﹣﹣③由盖斯定律,NO (g )和CO (g )反应生成N 2(g )、CO 2(g )的热化学方程式可由③×2﹣①﹣②得到,即2NO (g )+2CO (g )=N 2(g )+2CO 2(g )△H=﹣746.5kJ/mol , 故答案为:2NO (g )+2 CO (g )=N 2(g )+2CO 2(g )△H=﹣746.5kJ/mol ;(3)①由图开始,压强一定时,温度T 2的转化率较大,正反应为吸热反应,升高温度,平衡向正反应方向移动,甲烷的转化率增大,故温度T l <T 2,故答案为:<;②a .100℃时,反应混合物都是气体,混合气体总质量不变,容器的容积不变,容器内气体密度始终不变,不能说明得到平衡,故a 错误;b .单位时间内消耗0.1mol CH 4同时生成0.3molH 2,反应始终按此比例进行,不能说明到达平衡,故b 错误;c .3v 正(CH 4)=v 逆(H 2),不同物质的正逆速率之比等于化学计量数之比,反应到达平衡,故c 正确;d .随反应进行混合气体总物质的量增大,如容器中气体的分子总数不随时间而变化,反应到达平衡,故d 正确,故答案为:cd ;(4)①负极发生氧化反应,氢气被氧化生成水,电极方程式为H 2+2OH ﹣﹣2e ﹣=2H 2O ,故答案为:H 2+2OH ﹣﹣2e ﹣=2H 2O ;②根据装置图可知,b 电极与燃料电池的负极相连,作阴极.溶液中的铜离子在阴极放电,电极反应式是Cu 2++2e ﹣=Cu ,所以b 电极质量增加0.05mol ×64g/mol=3.2g ,故答案为:3.2.【点评】本题考查了盖斯定律求焓变、化学平衡影响因素,化学反应速率,平衡常数概念计算应用,原电池电解池原理的分析应用,注意平衡的条件分析,电极反应和电子守恒的计算是解题关键,题目难度中等.11.实验小组的同学探究铁与浓、稀硝酸反应的还原产物.他们通过查资料得知:Nessler 试剂(K 2HgI 4的KOH 溶液)可与NH 4+反应生成沉淀(1)将铁加入足量浓硝酸时,无明显现象,加热,产生红棕色气体,同时溶液变为黄色,红棕色气体为 NO 2 (填化学式),黄色溶液中含有的金属阳离子 Fe 3+ .(填离子符号)(2)将过量铁加入稀硝酸中一段时间后,取反应完全的溶液少量加入几滴NaOH 溶液加热,产生使红色石蕊试纸变蓝的气体,该气体为 NH 3 (填化学式).(3)通过以上实验同学们认为铁与稀硝酸反应,原理复杂.所以增加了以下实验:实验装置如图,注射器中吸有空气.按图示装置反应完毕后,取适量溶液于试管,滴加足量盐酸,再逐滴加入KOH 至pH4.5﹣﹣5.5,待沉淀完全后,向上层清液中加入Nessler 试剂. ①向溶液中滴加盐酸时发生的离子方程式为: 3Fe 2++4 H ++NO 3﹣=3Fe 3++NO ↑+2 H 2O ②注射器中空气的作用: 检验产生的NO观察到的实验现象如下:液面上、注射器内:无色气体逐渐变为浅棕色,注射器内气体体积下降加入Nessler 试剂:出现沉淀③注射器内气体体积下降可能原因为(用化学用语解释) 2NO 2⇌N 2O 4。
北京市海淀区2016届高三化学下学期(零模)适应性练习试题(含解析)

海淀区高三年级第二学期适应性练习理科综合能力测试化学试题2016. 3.116. 下列铁制品(铁钉或钢铁管道)易被腐蚀的是【考点】电解池原电池【试题解析】A 、为电解池,铁为阴极,受保护,不发生反应;B 、为原电池,镁为负极,铜铁输水管为正极,受保护,不发生反应;C 、锌比铁活泼,形成原电池,锌为负极,铁为正极,受保护,不发生反应;D 、铁的活动性比铜弱,铁为负极,发生反应,易被腐蚀,所以答案为D 。
【答案】D7. 下列化学用语的表示不.正确..的是 A .Na 2S 的电子式:B .HClO 的结构式:H -O -ClC .2,2-二甲基丙烷的结构简式:D .氯离子结构示意图 可以表示35Cl -,也可以表示37Cl-【考点】化学用语【试题解析】A.Na 2S 的电子式为,错误;B .HClO 的结构式:H -O -Cl ,正确;C .2,2-二甲基丙烷的结构简式:,正确;D.氯离子结构示意图可以表示35Cl -,也可以表示37Cl -,正确;故答案为A 。
【答案】A8. 下列说法不.正确..的是 A .食盐和醋都是常用的食品添加剂B .钙、铁、碘都是人体内必需的微量元素C .ClO 2、O 3等均可用于饮用水消毒D .静脉滴注NaHCO 3溶液可治疗水杨酸中毒反应【考点】生活中的营养元素化学与健康【试题解析】A .食盐和醋都是常用的食品添加剂,正确;B .铁、碘都是人体内必需的微量水膜元素,钙为大量元素,错误;C.ClO2、O3均具有强氧化性,可用于饮用水消毒,正确;D.静脉滴注NaHCO3溶液可治疗水杨酸中毒反应,正确;故答案为B。
【答案】B9. 下列说法正确的是A.丙烷、丁烷、正戊烷的沸点依次降低B.乙二醇、丙氨酸均可发生缩聚反应C.蔗糖和麦芽糖水解的最终产物都是葡萄糖D.饱和(NH4)2SO4溶液可导致蛋清液变性凝固【考点】糖类蛋白质有机物的研究【试题解析】A.丙烷、丁烷、正戊烷的沸点随着碳数的增加沸点应依次增大,错误; B.乙二醇可与乙二酸发生缩聚反应、丙氨酸中含有氨基和羧基可发生缩聚反应,正确; C.蔗糖水解的最终产物为葡萄糖和果糖,麦芽糖水解的最终产物是葡萄糖,错误; D.饱和(NH4)2SO4溶液可导致蛋清液发生盐析而凝固,错误;故答案为B。
北京市通州区2016届高三摸底考试化学试题 含答案

通州区高三年级摸底考试化学试卷2016年2月考 生 须 知 1。
本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共8页.第Ⅰ卷1-20题将答案填涂在机读答题卡上;第Ⅱ卷21-25题将答案写在答题卡上。
2。
全卷满分100分,考试时间120分钟。
3.选择题必须用2B 铅笔作答;非选择题必须用黑色字迹的签字笔作答.考试结束后,将答题纸及答题卡一并交回.可能用到的相对原子质量:H —1 C-12 O-16 S —32 Fe —56Cu-64第Ⅰ卷(选择题 共40分)一、选择题(本题包括20小题,每小题2分,共40分。
每小题只.有.一个..选项符合题意。
) 1.下列操作正确的是2.下列有关化学用语使用正确的是A .次氯酸的结构式:H —Cl-OB .铝离子结构示意图:C .甲烷分子的球棍模型:D .醛基的电子式: 3.下列叙述不正确...的是A .生理盐水的浓度为0.9%B .阿司匹林具有解热镇痛的作用C .垃圾是放错地方的资源,应分类回收利用D .甲烷、乙烯和苯在工业上都可通过石油分馏得到A .测溶液pHB .稀释浓硫酸C .干燥Cl 2D .制氢氧化亚铁+134.下列有关物质分类正确的是A .NO 2、CO 、CO 2均为酸性氧化物B .1682O 和1882O 的质子数相同,互为同位素 C. 与 互为同系物D .淀粉、纤维素和蛋白质都属于高分子化合物5.已知单质A 、B 和化合物C 符合下列转化关系:A+B 点燃C 溶于水后电解(惰性电极)A+B ,则C 物质可能为A .HClB .Na 2O 2C .CuOD .FeCl 36.下列说法正确的是A .HClO 是弱酸,所以NaClO 是弱电解质B .HCl 溶液和NaCl 溶液均通过离子导电,所以HCl 和NaCl 均是离子化合物C .1。
00 mol NaCl 中含有6。
02×1023个NaCl 分子D .纯净矿泉水、铝热剂、漂白粉均为混合物 7.下列说法不正确...的是A .浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体B .浓硫酸与含有水分的蔗糖作用,不显示酸性C .鸡蛋白溶液遇到浓硝酸可以变为黄色D .向装有Fe(NO 3)2溶液的试管中加入稀硫酸,在试管口观察到红棕色气体8.下列叙述正确的是A .氨水使酚酞溶液变红的原因:NH 3•H 2O = NH +4+ OH - B .硫酸氢钠溶液显酸性:NaHSO 4Na + + H + + SO -24C .明矾净水原理:Al 3+ + 3 H 2O Al (OH )3↓+ 3 H +D .制备TiO 2纳米粉:TiCl 4 +(x +2)H 2O (过量) TiO 2·x H 2O ↓+ 4 HCl9.密闭容器中有反应CH 4(g ) + H 2O (g) CO (g ) + 3 H 2(g) ΔH >0 ,测得c (CH 4)随反应时间(t )变化如右图所示。
2016级高三毕业班摸底测试化学答案

北京市第八十中学2016届高三化学下学期开学(零模)检测考试试卷(含解析)

2016届高三理科综合化学训练一(2016.2.24) 本试卷共14页,共300分.考试时长150分钟.考生务必将答案答在答题卡上,在试卷上作答无效.考试结束后,只交机读卡和答题纸.第一部分 (选择题共120分)本部分共20小题,每小题6分,共120分.在每小题列出的四个选项中,选出最符合题目要求的一项6.2013年4月24日,东航首次成功进行了由地沟油生产的生物航空燃油的验证飞行.能区别地沟油(加工过的餐饮废弃油)与矿物油(汽油、煤油、柴油等)的方法是【试题解析】A、地沟油属于油脂,含有C、H、O三种元素,矿物油中含有C、H元素,均可燃烧,错误;B、矿物油为混合物,没有恒定的溶沸点,错误;C、地沟油与矿物油的密度均小于水,都会浮在水面上,错误;D、地沟油的主要成分为油脂,与NaOH可发生水解,矿物油不能与其反应,会浮在液面上方,正确;所以答案为D。
【答案】D7.实验室制备下列气体时,所用方法正确的是A.制乙烯时,用排水法或向上排空气法收集气体B.制氯气时,用饱和NaHCO3溶液和浓硫酸净化气体C.制氧气时,用Na2O2或H2O2作反应物可选择相同的气体发生装置D.制二氧化氮时,用水或NaOH溶液吸收尾气【知识点】物质的分离、提纯和检验烯烃【试题解析】A.制乙烯时,乙烯难溶于水,密度与空气接近,所以可用排水法收集,不能用向上排空气法收集气体,错误;B.制氯气时,氯气与水反应生成盐酸和次氯酸,可与NaHCO3溶液反应,错误;C.制氧气时,用Na2O2与水反应制氧气,应是固体与液体不加热的装置,H2O2与二氧化锰制氧气,也是固体与液体不加热的装置,选择相同的气体发生装置,正确;D.制二氧化氮时,二氧化氮与水反应会生成NO,会生成污染物,错误; 所以答案为C。
【答案】C8.CPAE是蜂胶的主要活性成分,由咖啡酸合成CPAE路线如下:下列分析正确的是A.1molCPAE与NaOH溶液,浓溴水和氢气反应时最多消耗的NaOH、Br2和H2的物质的量分别是3mol、4mol和7molB.咖啡酸分子中至少有9个碳原子共平面C.咖啡酸、苯乙醇及CPAE都能发生取代,加成和消去反应D.用FeCl3溶液可以检测上述反应中是否有CPAE生成【知识点】有机反应类型酯醇酚烯烃【试题解析】A.CPAE中含有1个酯基与2个酚羟基,可与NaOH反应,含有2个酚羟基与1个碳碳双键,可与溴水发生反应,含有苯环与碳碳双键,可与氢气发生加成反应,则1molCPAE 与NaOH溶液,浓溴水和氢气反应时最多消耗的NaOH、Br2和H2的物质的量分别是3mol、4mol 和7mol,正确;B.咖啡酸分子中,苯环上6个碳原子与6个H原子共面,碳碳双键中的碳取代苯环上的氢原子,则分子中至少有7个碳原子共平面,错误;C.咖啡酸中含有酚羟基,可与溴水发生取代,与氢气发生加成反应,但不能发生消去反应,错误;D.CAPE与咖啡酸均含有酚羟基,遇FeCl3溶液均可显紫色,所以不能检测上述反应中是否有CPAE生成,错误;所以答案为A。
中学2016届高三下学期第一次模拟考试化学试题(附答案)

7.下列过程属于物理变化的有( )①石油分馏得到汽油②煤通过干馏获得焦炭③用铝土矿冶炼铝④用海带提取碘单质⑤空气液化⑥白酒变酸⑦粉尘爆炸⑧干冰气化⑨同素异形体之间的互变⑩氯化钠溶液通电后导电⑾活性炭使红墨水褪色⑿新制氯水使有色布条褪色A.3个B.4个C.5个D.6个8.设N A为阿伏加德罗常数的值,下列说法正确的是( )A.在过氧化钠与水的反应中,每生成0.1 mol氧气,转移电子的数目为0.4N AB.氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为2N A C.常温常压下,3.2 g O2和3.2 g O3中所含氧原子数都是0.2 N AD.将常温下含N A个NO2、N2O4分子的混合气体的温度降至标准状况,其体积约为22.4 L9. 的苯环上的二溴取代物的同分异构体有( )A.7种B.8种C.9种D.10种10.下列装置或操作能达到实验目的的是( )A.①③B.②④C.③④D.①②③④11. X、Y、Z、W、R属于短周期主族元素。
X的原子半径是短周期主族元素中最大的,Y 元素的原子最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M 层电子数为m-n,W元素与Z元素同主族,R元素原子与Y元素原子的核外电子数之比为2:1。
下列叙述错误的是()A.X与Y形成的两种化合物中阴、阳离子的个数比均为1∶2B.Y的氢化物比R的氢化物稳定,熔沸点高C.Z、W、R最高价氧化物对应水化物的酸性强弱顺序是:R>W>ZD.RY2、WY2通入BaCl2溶液中均有白色沉淀生成。
12.A1/MnO4–电池是一种高能电池,以Ga2O3为缓蚀剂,其示意图如图所示。
已知电池总反应为Al+ MnO4–+2H2O==Al(OH)4-+MnO2。
下列说法正确的是( )A.电池工作时,K+向负极移动B.电池工作时,Al电极周围溶液pH增大C.正极反应为MnO4–+2H2O+3e一== MnO2+4OH–D.电池工作时,电子由Al经溶液流向Ni13.常温下,用0.10 mol·L-1NaOH溶液分别滴定20.00 mL浓度均为0.10 mol·L-1的CH3COOH 溶液和HCN溶液,滴定曲线如图所示。
北京市大兴区普通中学2016届高三下学期2月开学综合测试化学试卷 含答案

北京市大兴区普通中学2016年2月高三化学开学综合测试卷Ⅰ卷一。
选择题(每小题可有1~2个正确选项)1. 据报道,科学家发现了一种新的氢微粒,它是由三个氢原子核和二个电子构成的。
关于这种氢微粒的叙述正确的是( )A。
与氢气是同素异形体B。
是一种新型化合物C。
其中含有离子键D。
能被还原成H2 2。
由CO H22、和CO组成的混合气在同温同压下与N2的密度相同.则该混合气体中CO2、H2和CO的体积比为()A。
13:8:29B。
14:1:22 C. 29:8:13D。
57:16:263. 随着人们生活质量的提高,废电池必须集中处理的问题被提上议事日程,其首要原因是()A。
利用电池外壳的金属材料 B. 防止电池中汞、镉、铅等重金属离子对土壤和水源的污染C。
回收其中的石墨电极 D. 不使电池中渗出的电解液腐蚀其他物品4。
下列叙述正确的是()A. 原子晶体中,共价键的键能越大,其熔、沸点越高B. 分子晶体中,分子间的作用力越大,该分子越稳定C. 分子晶体中,共价键的键能越大,其熔、沸点越高D. 某晶体溶于水后,可电离出自由移动的离子,该晶体一定是离子晶体5。
若N 表示阿伏加德罗常数的数值,在34364242322()NH SO N NH SO H O ∆↑+↑+↑+的反应中,当有N 个电子转移时,以下说法中错误的是( )A 。
有N /3个二氧化硫生成 B. 有N /2个硫原子被还原C 。
有23N /个硫酸铵分解D 。
有N /3个氮原子被氧化6。
下列离子方程式书写正确的是:( )A 。
氢氧化铁溶于氢碘酸中O H Fe H OH Fe 23333)(+=+++B. 次氯酸钙溶液中通入过量的二氧化碳HClO CaCO CO O H ClO Ca 223222+↓=+++-+C 。
向100mL 0。
1moL /L 的溴化亚铁溶液中通入0。
015 mol 的氯气-+-+++=++Cl Br Fe Cl Br Fe 6223422322D 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
、2016届高三理科综合化学训练一(2016.2.24) 本试卷共14页,共300分.考试时长150分钟.考生务必将答案答在答题卡上,在试卷上作答无效.考试结束后,只交机读卡和答题纸.第一部分(选择题共120分)本部分共20小题,每小题6分,共120分.在每小题列出的四个选项中,选出最符合题目要求的一项6.2013年4月24日,东航首次成功进行了由地沟油生产的生物航空燃油的验证飞行.能区别地沟油(加工过的餐饮废弃油)与矿物油(汽油、煤油、柴油等)的方法是7.实验室制备下列气体时,所用方法正确的是A.制乙烯时,用排水法或向上排空气法收集气体B.制氯气时,用饱和NaHCO3溶液和浓硫酸净化气体C.制氧气时,用Na2O2或H2O2作反应物可选择相同的气体发生装置D.制二氧化氮时,用水或NaOH溶液吸收尾气8.CPAE是蜂胶的主要活性成分,由咖啡酸合成CPAE路线如下:下列分析正确的是A.1molCPAE与NaOH溶液,浓溴水和氢气反应时最多消耗的NaOH、Br2和H2的物质的量分别是3mol、4mol和7molB.咖啡酸分子中至少有9个碳原子共平面C.咖啡酸、苯乙醇及CPAE都能发生取代,加成和消去反应D.用FeCl3溶液可以检测上述反应中是否有CPAE生成9.如图所示,甲池的总反应式为:N2H4+O2═N2+2H2O下列关于该电池工作时说法正确的是A.甲池中负极反应为:N2H4﹣4e﹣═N2+4H+B.甲池溶液pH不变,乙池溶液pH减小C.甲池中消耗2.24L O2,此时乙池中理论上最多产生12.8g固体D.反应一段时间后,向乙池中加一定量CuO固体,能使CuSO4溶液恢复到原浓度10.根据元素周期律,由下列事实进行归纳推测,推测不合理...的是的分解温度介于二者之间与高温时反应,加热能反应与11.已知:25℃时某些弱酸的电离平衡常数(如表).下面图象表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是A.相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO﹣)>c(CH3COO﹣)>c(OH﹣)>c(H+)B.向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO﹣+CO2+H2O═2HClO+CO32﹣C.图象中a、c两点处的溶液中相等(HR代表CH3COOH或HClO) D.图象中a点酸的总浓度大于b点酸的总浓度12.下列实验的实验目的、图示操作和实验现象均正确的是13.与新能源相关的核反应是21H+31H→42He+10n,关于这个核反应的下列说法中正确的是A.聚变反应释放核能B.聚变反应吸收核能C.裂变反应释放核能D.裂变反应吸收核能第二部分(非选择题共180分)本部分共11小题,共180分.25.(16分)苯酚是一种重要的化工原料.以苯酚为主要起始原料,经下列反应可制得香料M 和高分子化合物N.(部分产物及反应条件已略去)(1)由苯酚生成A的化学方程式是.(2)已知C的分子式为C5H12O,C能与金属Na反应,C的一氯代物有2种.C的结构简式是.(3)B与C反应的化学方程式是.(4)由苯酚生成D的化学方程式是由D生成N的反应类型是由D生成N的反应方程式是(5)以苯酚为基础原料也可以合成防腐剂F.经质谱分析F的相对分子质量为152,其中氧元素的质量分数为31%,F完全燃烧只生成CO2和H2O.则F的分子式是.已知:①芳香族化合物F能与NaHCO3溶液反应,且不能发生水解反应;②F的核磁共振氢谱显示其分子中含有4种氢原子;③分子结构中不存在“-O-O-”的连接方式.F的结构简式是.26.(13分) 利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:(1)已知:N2(g)+O2(g) = 2NO(g) △H=+180.5kJ/molN(g)+3H2(g) 2NH3(g) △H=-92.4kJ/mol2H2(g)+O2(g) = 2H2O(g) △H=-483.6kJ/mol若有17 g 氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为.(2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对N 2(g)+3H2(g)2NH3(g)反应的影响.实验结果如图所示:(图中T 表示温度,n 表示物质的量)①图像中T 2和T 1的关系是:T 2 T 1(填“高 于”、“低于”、“等于”“无法确定”)②比较在a 、b 、c 三点所处的平衡状态中,反应物N 2 的 转化率最高的是 (填字母).③在起始体系中加入N 2的物质的量为 mol 时,反应后氨的百分含量最大; 若容器容积为1L ,n=3mol 反应达到平衡时H 2的转化率为60%,则此条件下(T 2), 反应的平衡常数K= .(3)N 2O 5是一种新型硝化剂,其性质和制备受到人们的关注. ①一定温度下,在恒容密闭容器中N 2O 5可发生下列反应:2N 2O 5(g)4NO 2(g)+O 2(g) ΔH >0下表为反应在T 1温度下的部分实验数据则500s 内NO 2的平均生成速率为 . ②现以H 2、O 2、熔融盐Na 2CO 3组成的燃料电池,采用电解法制备N 2O 5,装置如图所示,其中Y 为CO 2.写出石墨I 电极上发生反应的电极反应式 .在电解池中生成N 2O 5的电极反应式为. 27.(15分)某化学课外活动小组通过实验研究NO 2的性质. 已知:2NO 2 + 2NaOH=== NaNO 3 + NaNO 2 + H 2O).CE(1)E 装置中制取NO 2反应的化学方程式是 . (2)若NO 2能够被NH 3还原,预期观察到C 装置中的现象是 . (3)实验过程中,未能观察到C 装置中的预期现象.该小组同学从反应原理的角度分析了原因,认为可能是:①NH 3还原性较弱,不能将NO 2还原;②在此条件下,NO 2的转化率极低; ③ . (4)此实验装置存在一个明显的缺陷是 . 任务2:探究NO 2能否与Na 2O 2发生氧化还原反应. (5)实验前,该小组同学提出三种假设. 假设1:二者不反应; 假设2:NO 2能被Na 2O 2氧化; 假设3: .(6)为了验证假设2,该小组同学选用任务1中的B 、D 、E 装置,将B 中的药品更换为Na 2O 2,另选F 装置(如右图所示),重新组装,进行实验.①装置的合理连接顺序是(某些装置可以重复使用) .②实验过程中,B 装置中淡黄色粉末逐渐变成白色.经检验,该白色物质为纯净物,且无其他物质生成.推测B 装置中反应的化学方程式为 . 28.(14分)合成氨是人类科学技术上的一项重大突破,其反应原理为: N 2(g)+3H 2(g)2NH 3(g) ∆H=—92.4kJ•mol‾1一种工业合成氨的简易流程图如下:(1)天然气中的H 2S 杂质常用氨水吸收,产物为NH 4HS .一定条件下向NH 4HS 溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式: . (2)步骤II 中制氢气原理如下:F对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是.a.升高温度b.增大水蒸气浓度c.加入催化剂d.降低压强利用反应②,将CO进一步转化,可提高H2产量.若1mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18mol CO、CO2和H2的混合气体,则CO转化率为.(3)图1表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系.根据图中a点数据计算N2的平衡体积分数:.(4)依据温度对合成氨反应的影响,在图2坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图.(5)上述流程图中,使合成氨放出的热量得到充分利用的主要步骤是(填序号) ,简述本流程中提高合成氨原料总转化率的方法:.2016届高三理科综合训练一(2016.2.24)第一部分 (选择题 共120分)本部分共20小题,每小题6分,共120分.在每小题列出的四个选项中,选出最符合题目要求的一项1.C 2.D 3.D 4.B 5.C 6.D 7.C 8. A 9.D 10.B 11.C 12.C 13.A 14.D 15.B 16.C 17.A 18.B 19.B 20.D第二部分 (非选择题 共180分)本部分共11小题,共180分. 21.(18分,每问3分)(1)(0.395~0.399) (2)甲 (3)如答图3(4)如答图3 (4.3~4.7) (5)C (6)CD22.(16分) 答案:(1)s =0.90 m ;(2)E k =0.90 J ;(3)v 0=4.0 m/s (1)由平抛运动规律,有:竖直方向221gt h = 2分水平方向s =vt2分 得水平距离v ghs 2==0.5m1分(2)由机械能守恒定律,动能 E k =21mv 2+mgh 3分=0.90 J2分(3)由动能定理,有-μmgl =21mv 2-21mv 02 4分 得初速度大小v 0=22v gl +μ=4.0 m/s2分答图4答案图323.(18分,每问6分)(1)由v -t 图可知,起跳后前2s 内运动员的运动近似是匀加速直线运动,其加速度为11v a t == 9.0 m/s 2……………2分设运动员所受平均阻力为f ,根据牛顿第二定律有 m 总g – f = m 总a……………2分 解得 f =m 总(g –a )=80N……………2分(2)由v -t 图可知,运动员脚触地时的速度v 2 = 5.0m/s ,经时间t 2 = 0.2s 速度减为零, 设此过程中运动员所受平均冲击力大小为F ,根据动量定理有22()0mg F t mv -=-……………4分解得 F = 2450N……………2分(3)由v -t 图可知,10s 末开伞时的速度v =40m/s ,开伞前10s 内运动员下落的高度约为1818323840223522402296222h ++=⨯+⨯+⨯+⨯+⨯=m …2分 (说明:得出280m ~320m 均可得分.)设前10s 内空气阻力对运动员所做功为W ,根据动能定理有212m gh W m v +=总总……………2分 解得 W = -1.73×105J……………2分说明:此步得出-1.60×105J ~-1.92×105J 均可得分,若没有写“-”扣1分.24.(20分)(1)a .设电子经过电场加速后的速度为v 1 由动能定理2121mv eU =……………………………………2分得meUv 21=……………………………………2分b .令电子恰好打在圆筒上时,加速电压为U 0,设电子进入磁场时速度为v 2,轨道半径为r ,做出电子的轨迹如图所示,O 2为轨道的圆心。
