第2章 流体的压力、体积、温度关系
流体力学-第2章

流体静压强是空间点坐标的标量函数 说明: 1) 静止流体中不同点的压强一般是不等的,同一点的各向静 压强大小相等。 2) 运动状态下的实际流体,流体层间若有相对运动,则由于 粘性会产生切应力,这时同一点上各向法应力不再相等。 流体力学
§2.2
流体平衡微分方程
• 流体平衡微分方程的推导
p ρ= R T
T =T0 − βz
z 5.256 ⇒ p =101.3(1− ) kPa 44300
(2)同温层压强的分布 流体力学 见 P23
三、压强的度量 1、压强的两种计算基准 绝对压强pabs:以无气体分子存在的完全真空为零点起算的压强 相对压强p:以当地同高程的大气压强pa为零点起算的压强 p= pabs - pa • 正压 负压 真空度pv pv= -p = pa - pabs
流体力学
例 2-5 封 闭 水 箱 如 图 , 水 箱 顶 面 安 装 的 压 力 表 读 值 为 p0=10kN/m2,水箱内水深 h =3m,当地大气压pa=98kN/m2。求 水面下2m处的绝对压强和相对压强。 解:
p = p0 + γh = 10 + 9.8 × 2 = 29.6 kPa
p0 3m A 封闭水箱
(2)质量力
ρ dxdydz
X ρ dxdydz
Y ρ dxdydz
Z ρ dxdydz
流体力学
x 方向平衡微分方程
∂p dx ∂p dx (p− ) dydz − ( p + ) dydz + X ρ dxdydz = 0 ∂x 2 ∂x 2
1 ∂p X− =0 ρ ∂x
流体力学
1 ∂p X− =0 ρ ∂x
第2章 流体的压力、体积、温度关系解读

• 流体P-V-T数据+状态方程EOS是计算热力学性 质最重要的模型之一。
一、纯流体的p-V-T相图
液体水 带有活塞的汽缸保持恒压
T
5
2
3
4
1
v
临界点
气体
液体
液体和蒸汽
饱和液相线 (泡点线)
饱和汽相线 (露点线)
V
RT p
1
B V
C V2
Vi1
RT p
1
B Vi
C Vi 2
以理想气体状态方程所计算出的摩尔体积作为迭代初
值,即V0=3.934m3·kmol-1
V1
RT p
1
B V0
C V02
3.934 1
0.388 3.934
理想气体状态方程: PV=nRT
在本书中V代表摩尔体积,理想气体状态方程的表达式 为:
PV=RT
式中V是摩尔体积,R为通用气体常数,其值见表2-1
例2:将1kmol甲烷压缩储存于容积为0.125m3,温度为
323.16K的钢瓶内.问此时甲烷产生的压力多大?其实
验值为1.875x107Pa.
解:
P nRT 1000 8.314 323.16 2.150107 Pa
1)过热蒸汽等温冷凝为过冷液体; 2)过冷液体等压加热成过热蒸汽; 3)饱和蒸汽可逆绝热膨胀; 4)饱和液体恒容加热; 5)在临界点进行的恒温膨胀
1)过热蒸汽等温冷凝为过冷液体;
2)过冷液体等压加热成过热蒸汽;
化工热力学讲义-1-第二章-流体的p-V-T关系36页PPT文档

二、研究方法 热力学研究方法:分为宏观、微观两种。本书就工程应用而言, 主要介绍的是宏观研究方法。
宏观研究方法特点: ①研究对象:将大量分子组成的体系视为一个整体,研究大量 分子中发生的平均变化,用宏观物理量来描述体系的状态;
②研究方法:采取对大量宏观现象的直接观察与实验,总结出 具有普遍性的规律。
2a
VC3
而:V2p2 T
2RT
Vb3
6a V4
V 2p2TTC V2CRbC T3 V 6C a4 0
2RTC VC b
3
6a
VC4
上两式相除,得:
VC b VC 23
1
b 3 VC
则: a
VC3 2
②图3中高于临界温度Tc的等温线T1、T2,曲线平滑且不与相界线相交, 近似于双曲线,即:PV=常数; 小于临界温度Tc的等温线T3、T4,由三个部分组成,中间水平线表示 汽液平衡共存,压力为常数,等于饱和蒸汽压。
③从图3还可知道:临界等温线(蓝线所示)在临界点处的斜率和 曲率等于零,即:
p 0 V TTC
第二章 流体的P-V-T关系
①P、V、T的可测量性:流体压力P、摩尔体积V和温度T是可以 直接测量的,这是一切研究的前提;
②研究的目的与意义:利用P、V、T数据和热力学基本关系式可 计算不能直接测量的其他性质,如焓H、内能U、熵S和自由能G。
一、p-V-T图
2.1纯物质的P-V-T关系
说明:①曲面以上或以下的空间为不平衡区; ②三维曲面上“固”、“液”和“气(汽)”表示单相区 ; ③“固-液”、“固-汽”和“液-汽”表示两相区;
③超临界流体的特殊性:它的密度接近于液体,但同时具有气体的 “体积可变性”和“传递性质”。所以和气体、液体之间的关系是: 既同又不同,
流体的压力、体积、温度关系:状态方程式

2.2.2 维里(Virial)方程
• Virial方程的几种形式
Z
pV RT
1
B V
C V2
压力小于 1.5 MPa 时
Z pV1B RT V
Z pV1 Bp RT RT
V B RT p
压力为数 个MPa时
ZR pV T1V BVC2
流体的压力、体积、温度关系:状 态方程式
2.2.2 维里(Virial)方程
流体的压力、体积、温度关系:状 态方程式
2.2.3 立方型状态方程
二、 Redlich - Kwong ( RK )方程(1949年)
• 1 在较低压力和较高温度下可用理想气体 方程进行计算。
• 2 为真实气体状态方程计算提供初始值。
• 3 判断真实气体状态方程的极限情况的正 确程度,当 P 0 或者 V 时,任何的状 态方程都还原为理想气体方程。
通常几百千帕压力下,理想气体状态方程能满足一 般工程技术需要。 流体的压力、体积、温度关系:状态方
(3)临界点C的斜率和曲率都 为零。
B
纯物质的P-V图
流体的压力、体积、温度关系:状 态方程式
•
在临界点 C :
P V
Tc
0
ห้องสมุดไป่ตู้
2P V2
Tc
0
2-1式 2-2式
流体的压力、体积、温度关系:状态方 程式
2.2 流体的状态方程式
• 纯流体的状态方程(EOS) 是描述流体P-VT性质的关系式。
• 目前采用维里方程计算气体PVT性质时,一般最多采取 三项。这是由于多于三项的维里方程中的常数奇缺,所 以多于三项的维里方程一般不大采用。高压下,气体 PVT性质的计算一般采用其它状态方程。
第2章流体的压力、体积、温度关系:状态方程式

2.3.3 偏心因子与三参数压缩因子图
化工热力学
2.3.3 偏心因子与三参数压缩因子图
化工热力学
2.3.4 普遍化第二维里系数关联式
VanNess和Abbott通过对14种非极性流体的研究和计算,得 出了最简单的表达式,也是许多专著和教材中引用的方程,其 具体表达如下:
化工热力学
2.3.4 普遍化第二维里系数关联式
化工热力学
2.3.5 立方型状态方程的对比形式
RK方程的对比形式为
vdW方程的对比形式为
鉴于临界体积不易测准,而且数据也相对较少,故拟用 代替 ,则RK和vdW方程的改良对比形式状态方程相应可表达 为 RK方程 vdW方程
化工热力学
2.3.6 临界参数和偏心因子的估算
2.3.6.1 临界参数 (1)Magoulas和Tassios法
2.4 液体的p-V-T关系
1 Rackett方程式 2 Yen-Woods关系式 3 Lydersen,Greenkorn和Hougen
对应态法 4 基团贡献法
化工热力学
2.4.1 Rackett方程式
用立方型状态方程计算液体的摩尔体积,其精确度并不 高。饱和液体的摩尔体积 可用普遍化方程计算,常用的 是Rackett方程
当压力达到数个MPa时,第三维里系数渐显重要。其近似 的截断式为
化工热力学
2.2.3 立方型方程式
2.2.3.1 范德瓦耳斯方程式
化工热力学
2.2.3 立方型方程式
拟考察当压力趋近于零,温度趋近于无穷大时, 方程 式的极限情况。将式(2-9)展开,可写成 2.2.3.2 Redlich Kwong方程(RK方程) (1)求蒸气相摩尔体积 (2)求液相摩尔体积
化工热力学第2章流体的PVT关系
例如:H2 和N2这两种流体
对于H2
状态点记为1,P1 V1 T1
Tr1 =T1/TcH2
Pr1=P1/PcH2
对于N2
状态点记为2,P2 V2 T2
Tr2 =T2/TcN2
Pr2=P2/PcN2
当Tr1=Tr2 ,Pr1=Pr2 时,此时就称这两种流体处
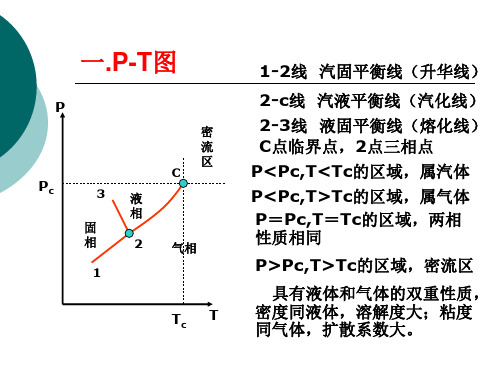
一.P-T图
P
Pc
3液
相
固
相
2
1
密 流 区 C
气相
Tc T
1-2线 汽固平衡线(升华线)
2-c线 汽液平衡线(汽化线) 2-3线 液固平衡线(熔化线) C点临界点,2点三相点 P<Pc,T<Tc的区域,属汽体 P<Pc,T>Tc的区域,属气体 P=Pc,T=Tc的区域,两相 性质相同
P>Pc,T>Tc的区域,密流区
压缩因 子,方 程的计 算值和 实测值 的符合 程度是 判断方 程的优 劣标志 之一。
2. R-K Equation (1949年,Redlich and Kwong)
(1) R-K Eq的一般形式:
P
RT V-b
-
a T0.5V(V
b)
(2-11)
① R-K Equation中常数值不同于范德华方程中的a、b值, 不能将二者混淆。 在范德华方程中,修正项为a/V2,没有考虑温度的影响 在R-K方程中,修正项为,考虑了温度的影响。 ② R-K Equation中常数a、b值是物性常数,具有单位。
为表征物质分子的偏心度,既非球型分子偏离球对称的 程度,简单流体为0
R-K Eq经过修改后,应用范围扩宽。 SRK Eq:可用于两相PVT性质的计算,对烃类计算,其 精确度很高。
第2章流体的PVT关系

R-K Eq中 a=f (Tc,pc) SRK Eq中 a( T )=f (Tc,pc,T, ω)
Soave-Redlish-Kwang 方程(简称RKS方程)
使用情况和意义 (1) RKS方程提高了对极性物质及含有氢键物质的p –V –T
计算精度。 (2) 可以用于液体p V T 性质计算。如在饱和液体密度的计
算中更准确。
Peng-Robinson方程(简称PR方程)
方程形式:
p
RT V b
V
V
aT b b
V
b
方程参数:
aT a T 0.45724R2Tc2 / pc T
b 0.07780RTc / pc
(T
)
1
k(1
a/V2 — 分子引力修正项。
由于分子相互吸引力存在,分子撞击器壁的力减小,造成压力减小。
b —分子本身体积的校正项。
分子本身占有体积,分子自由活动空间减小,由V变成V-b。分子 自由活动空间的减小造成分子撞击器壁的力增大。造成压力增大
• 参数a和b获得途径:
(1)从流体的p-V-T实验数据拟合得到
中间根无意义。
ps
•当p≠ps时,只有一个根有意义,
其他两个实根无意义。
Vsl
T>Tc T=Tc
T<Tc
Vsv
V
Redlich-Kwong方程
方程形式:
RT
a
p V b T 0.5V (V b)
vDW方程的引力项没有考虑温度的影响,而RK方程的引力
项加入了温度项。
方程参数:
化工热力学习题答案 第一至五、第七章

第一章 绪论一、选择题(共3小题,3分)1、(1分)关于化工热力学用途的下列说法中不正确的是( ) A.可以判断新工艺、新方法的可行性。
B.优化工艺过程。
C.预测反应的速率。
D.通过热力学模型,用易测得数据推算难测数据;用少量实验数据推算大量有用数据。
E.相平衡数据是分离技术及分离设备开发、设计的理论基础。
2、(1分)关于化工热力学研究特点的下列说法中不正确的是( ) (A )研究体系为实际状态。
(B )解释微观本质及其产生某种现象的内部原因。
(C )处理方法为以理想态为标准态加上校正。
(D )获取数据的方法为少量实验数据加半经验模型。
(E )应用领域是解决工厂中的能量利用和平衡问题。
3、(1分)关于化工热力学研究内容,下列说法中不正确的是( )A.判断新工艺的可行性。
B.化工过程能量分析。
C.反应速率预测。
D.相平衡研究参考答案一、选择题(共3小题,3分) 1、(1分)C 2、(1分)B 3、(1分)C第二章 流体的PVT 关系一、选择题(共17小题,17分)1、(1分)纯流体在一定温度下,如压力低于该温度下的饱和蒸汽压,则此物质的状态为( )。
A .饱和蒸汽 B.饱和液体 C .过冷液体 D.过热蒸汽2、(1分)超临界流体是下列 条件下存在的物质。
A.高于T c 和高于P c B.临界温度和临界压力下 C.低于T c 和高于P c D.高于T c 和低于P c3、(1分)对单原子气体和甲烷,其偏心因子ω,近似等于 。
A. 0 B. 1 C. 2 D. 34、(1分)0.1Mpa ,400K 的2N 1kmol 体积约为__________A 3326LB 332.6LC 3.326LD 33.263m5、(1分)下列气体通用常数R 的数值和单位,正确的是__________ A K kmol m Pa ⋅⋅⨯/10314.833B 1.987cal/kmol KC 82.05 K atm cm /3⋅D 8.314K kmol J ⋅/ 6、(1分)超临界流体是下列 条件下存在的物质。
第二章 流体的压力、体积、温度关系:状态方程讲解

Virial方程不同形式的关系
PV B C Z 1 2 RT V V 1 B ' P C ' P 2
二种形式的Virial方程是等价的,其系数之间也有相 互关系。
C '
CB ( RT )
2
2
B B' RT
如何证明?
——试试看
33
实际中常用Virial截断式
只能计算气体,不能同时用于汽、液两相 Virial方程的价值已超出PVT的应用,能描述气体的粘度、声速和热容
例2-1 P14
34
2.2.3 立方型方程式 2.2.3.1 范德华方程
理想气体 PV=RT ∴P=RT/V
van der Waals(vdW) EOS ①
(2)分子间力的修正项 a为引力参数。
Peng-Robinson方程
多参数 高次型
Virial(维里)方程 BWR方程、马丁——侯方程等等
30
Virial方程的形式
2.2.2 Virial (维里)方程
PV B C Z 1 2 RT V V
2
1 B' P C ' P
P 0,V
dG SdT VdP dA SdT PdV
S V - P T T P
S P V T T V
Maxwell关系式特点是将难测的量用易测的量代 S V P S 替。如 P T 用 T P 代; 用 V T 代 T V ; 建立了S=S(T,P)。
5
2.1 纯物质的PVT行为
化工热力学第二章习题答案

习题:2-1.为什么要研究流体的pVT 关系?答:在化工过程的分析、研究与设计中,流体的压力p 、体积V 和温度T 是流体最基本的性质之一,并且是可以通过实验直接测量的。
而许多其它的热力学性质如内能U 、熵S 、Gibbs 自由能G 等都不方便直接测量,它们需要利用流体的p –V –T 数据和热力学基本关系式进行推算;此外,还有一些概念如逸度等也通过p –V –T 数据和热力学基本关系式进行计算。
因此,流体的p –V –T 关系的研究是一项重要的基础工作。
2-2.理想气体的特征是什么?答:假定分子的大小如同几何点一样,分子间不存在相互作用力,由这样的分子组成的气体叫做理想气体。
严格地说,理想气体是不存在的,在极低的压力下,真实气体是非常接近理想气体的,可以当作理想气体处理,以便简化问题。
理想气体状态方程是最简单的状态方程:RT pV =2-3.偏心因子的概念是什么?为什么要提出这个概念?它可以直接测量吗?答:纯物质的偏心因子ω是根据物质的蒸气压来定义的。
实验发现,纯态流体对比饱和蒸气压的对数与对比温度的倒数呈近似直线关系,即符合:⎪⎪⎭⎫ ⎝⎛-=r sr Tp 11log α 其中,c s s r p p p =对于不同的流体,α具有不同的值。
但Pitzer 发现,简单流体(氩、氪、氙)的所有蒸气压数据落在了同一条直线上,而且该直线通过r T =0.7,1log -=sr p 这一点。
对于给定流体对比蒸气压曲线的位置,能够用在r T =0.7的流体与氩、氪、氙(简单球形分子)的sr p log 值之差来表征。
Pitzer 把这一差值定义为偏心因子ω,即)7.0(00.1log =--=r s r T p ω任何流体的ω值都不是直接测量的,均由该流体的临界温度c T 、临界压力c p 值及r T =0.7时的饱和蒸气压s p 来确定。
2-4.纯物质的饱和液体的摩尔体积随着温度升高而增大,饱和蒸气的摩尔体积随着温度的升高而减小吗?答:正确。
化工热力学第二章.

第2章流体的p-V-T关系
主要内容
1) 流体的压力p、摩尔体积V 和温度T是物质最基
本的性质;
2)p、V、T 性质可以通过实验直接测量;
3)pVT+c p ig能推算其它不能直接从实验测量的热力
学性质如H、S、U、G等。
1
)
c
A B
对任何气体,
根据气体的临界参数,即可求出Z
计算常数需要
同时适用于汽液两相,
(1)
(2) EOS
(3)
与立方型状态方程相比,多参数状态方程的优多参数方程的基础是
能同时适用于汽、液两相
在计算和关联烃类混合物时极有价值;计算结果明显高于立方型状态方程;
该方程的数学规律性较弱,给方程的求解。
第二章 流体压力体积温度关系状态方程

2.2.3 RK方程
RK方程
a P 1 V b T 2V V b
RT
说明: a、b的物理意义与vdW方程相同,a、b的计 算方法也相同;改变了引力项,使得计算的V减 小,改进计算P-V-T的准确性,但不能同时应用 气液两相 RK方程优于vdW方程,是正真的EoS
2.2.3 RK方程
2.3 .3偏心因子与三 参压缩因子图
Tc 305.4 K Pc 4.884MPa
Pr 21.5 4.40 4.884
0.098
计算 Tr 查图 计算
382 1.25 305.4
Z 0 0.770
Z 1 0.06
Z Z 0 Z 1 0.772 0.098 0.06 0.776
C
Pc Tc
T1
超临界区 气体
液相区
T3
液体和蒸汽
1
B
V
纯物质的p-T图
纯物质的p-V图
P-T及P-V图特征及重要 点
汽化曲线、熔化曲线、升华曲线 F=C-P+2的应用
临界点C处的P、V数学关系?
2 P P 0 2 V T Tc V
4.248Vk 0.08058 Vk 1 6.814 Vk Vk 0.08058 RT 8.314 300 3 V0 6.734m / kmol P 370.4 4.2486.734 0.08058 V1 6.814 6.198 6.7346.734 0.08058 4.2486.198 0.08058 V2 6.814 6.146 6.1986.198 0.08058
B为物性 和温度 的函数
流体密度和比体积随温度和压力而变化的关系

流体密度和比体积随温度和压力而变化的关系
流体的密度和比体积是流体的两个基本性质,它们随着温度和压力的变化而发生改变。
本文将探讨流体密度和比体积随温度和压力的变化关系。
一、流体密度随温度和压力变化的关系
1. 温度对流体密度的影响
在固定压力下,流体的密度随着温度的升高而减小。
这是因为温度升高会使分子热运动加剧,分子间的相互作用力减弱,分子的平均间距增大,因此单位体积内分子数目减少,导致密度降低。
2. 压力对流体密度的影响
在固定温度下,流体的密度随着压力的升高而增大。
这是因为压力增大能压缩流体,导致单位体积内分子数目增加,因此密度增大。
二、流体比体积随温度和压力变化的关系
1. 温度对流体比体积的影响
在固定压力下,流体的比体积随着温度的升高而增大。
这是因为温度升高使流体的体积膨胀,同时密度降低,因此比体积增大。
2. 压力对流体比体积的影响
在固定温度下,流体的比体积随着压力的升高而减小。
这是因为压力增大会压缩流体,使其体积减小,同时密度增大,因此比体积减小。
总之,流体的密度和比体积是流体的两个基本性质,随着温度和压力的变化而发生改变。
温度升高会使流体的密度降低,比体积增大;压力升高会使流体的密度增大,比体积减小。
了解流体密度和比体积随温度和压力的变化规律,对于工程领域的设计和实际生产,具有很重要的指导意义。
流体的压力变化

流体的压力变化引言流体是指可以流动的物质,包括液体和气体。
在自然界和工业生产中,我们经常遇到流体的压力变化现象。
流体的压力变化与其密度、体积、高度和外力的作用有关。
本文将详细讨论流体的压力变化规律及其应用。
流体的压力定义流体的压力定义为单位面积上的力,可以用以下公式表示:P = F / A其中,P为压力,F为作用在流体上的力,A为力作用的面积。
单位面积上的力越大,压力就越大。
流体的压强和压力变化规律流体的压强定义为单位面积上所受压力的大小,可以用以下公式表示:P = F / A在流体静止的情况下,任意一点的压强相等。
而对于流体的压力变化,我们需要考虑流体的密度、体积、高度和外力的作用。
流体的密度对压力变化的影响流体的密度决定了单位体积内的质量,对压力变化有一定影响。
根据流体的密度定义和压力定义,我们可以得到以下关系式:ρ = m / V其中,ρ为流体的密度,m为流体内的质量,V为流体的体积。
根据这个关系式,我们可以推导出流体的压力变化规律:P = ρgh其中,P为流体的压力,ρ为流体的密度,g为重力加速度,h为流体的高度。
由于流体的密度是常量,所以我们可以得出结论:流体的压力与其高度成正比。
外力对压力变化的影响除了流体的密度和高度,外力也会对压力变化产生影响。
当外力作用于流体时,流体会受到更大的压力。
例如,当我们将一个球体浸入水中,球体表面受到的压力将增加。
这是因为流体压力会将外力传递到球体上。
流体压力的应用流体压力的变化规律在生活和工业生产中有着广泛的应用。
液压系统液压系统是利用流体的压力进行传递和控制力的一种技术。
液压系统由液体、泵、阀门、管路和执行元件等组成。
通过改变液体的压力和流量,可以实现力的放大、传递和控制。
液压系统广泛应用于机械工程、航空航天、冶金、军事等领域。
气压系统气压系统是利用气体的压力进行传递和控制的一种技术。
气压系统由气体、压缩机、阀门、管路和执行元件等组成。
通过改变气体的压力和流量,可以实现力的放大、传递和控制。
第二章 流体的压力、体积、温度关系:状态方程讲解

态附近 , T、P微小变化会导致溶质的溶解度发生几个 数量级的突变 ,超临界流体正是利用了这一特性,通 过对T、P的调控来进行物质的分离。
17
超临界流体特性
气体
性质
密度 /(g/mL)
粘度 /[g/(cm•s)]
超临界流体
Pc Tc
液体
1atm, 15~30℃
PV Z 1 RT
Z为压缩因子
当
31
Virial系数
B、C…(或B’、C’…)称作Virial系数,物理意义:
微观上,Virial系数反映了分子间的相互作用,第二维里
系数B反映了两个分子之间的相互作用;第三维里系数C反 映了三重分子的相互作用。 宏观上,Virial系数仅是温度的函数。 最初的 Virial 方程是以经验式提出的,之后由统计力学 得到证明。
23
一切实际气体的状态方程必须符合下列条件: ⑴ P→0时,该方程趋向理想气体状态方程;
P ⑵ 在临界点处 V
2P 0 0 2 ; V T T T TC
C
⑶ 由此方程计算得到的PVT关系应与实测数据 尽可能吻合。
24
PV B Z 1 RT V BP Z 1 B P 1 RT
适用于T<Tc,P<1.5MPa蒸汽
PV B C Z 1 2 RT V V
所以对于更高的压力,维里方程不合适.
适用于T<Tc, 1.5MPa < P < 5MPa蒸汽
许多气体的第二virial系数B有实验数据;C较少;D更少,
如何解决?
3
Maxwell方程
第2章 流体的PVT关系-状态方程式(3版)

a Vi b RT b P PT 1 / 2Vi Vi b
(2)液体的摩尔体积
RT a P 1/ 2 V b T V V b
将方程写成三次展开式
RT 2 1 2 a ab V V Pb bRT 0.5 V 0.5 0 P P T PT
m3· kmol-1。(a) 用理想气体方程;(b) 用普遍
化压缩因子关联;(c) 用普遍化维里系数关联。 例2-5 某容器置于65℃的恒温浴中,体积为 0.03m3,内装0.5kg气体氨。试分别用下列三 种方法计算气体的压力。已知实验值为 2.382MPa。 (a) 用理想气体方程;(b) 用R-K 方程;(c) 用普遍化维里系数关联。
偏心因子的物理意义为:其值的大小,是反
映物质分子形状与物质极性大小的量度。球形
分子(Ar、Kr、Xe等)ω=0;非球形分子ω>0。 根据以上结论,Pitzer提出了两个非常有用
的普遍化关系式。一种是以压缩因子的多项式
表示的普遍化关系式(简称普压法),一种是以
两项维里方程表示的普遍化第二维里系数关系
用 ,
如第二 Virial 系数反映了两分子间的相互作
用,
第三 Virial 系数反映了三分子间的相互作用 等等。 Virial 系数是物性和温度的函数。
Virial
系数的获取
( 1 ) 由统计力学进行理论计算
目前应用很少
( 2 ) 由实验测定或者由文献查得
精度较高
( 3 ) 用普遍化关联式计算
2.3.1 普遍化状态方程式 R-K方程的普遍化 1 a h Z 1.5 1 h bRT 1 h b b bP h V ZRT / P ZRT
化工热力学第三版课件第二章4

kmol
1
聊城大学 化学化工学院
化工热力学 第二章 流体的热力学性质
第三节
将a、b及V、T代入R-K方程得到:
8314 323.15
1.7924 105
P
19.03MPa
0.1247 0.02985 0.1247 (0.1247 0.02985)
(c) 三参数普遍化压缩因子关系式:ω=0.008 因为Pr是未知,所以应进行迭代计算: 以Z0=1为初值
化工热力学 第二章 流体的热力学性质
第三节
2、三参数压缩因子图: Z f Pr、Tr、
(1) 偏心因子ω
Pitzer发现:
∴ a b
log
prs
a Tr
b
又临界点处: Tr pr 1
log
prs
1
a
Tr
1
其中:
prs
PS PC
球形分子(非极性,量子)Ar, Kr, Xe做logPrs~1/Tr图,
第三节
0.033
聊城大学 化学化工学院
化工热力学 第二章 流体的热力学性质
Homework: P58 习题 2-1 加(5)三参数普遍化关联法
第三节
聊城大学 化学化工学院
V
124.7
聊城大学 化学化工学院
化工热力学 第二章 流体的热力学性质 线性内插法
1、若M是独立变量x的函数,
第三节
X1 X X2
T1=140℃ T=140.8℃
M1 ?
M
(
X2 X2
X X1
)M1
(
X1 X2
第2 章 流体的p –V -T 关系

第2章流体的p –V -T关系本章目的能熟练掌握流体(特别是气体)的各种类型的P、V、T关系(包括状态方程法和对应状态法)及其应用、优缺点和应用范围。
本章主要内容(1) 通过纯物质的p –V –T图、p –V图和p –T图,了解纯物质的p –V –T关系。
(2) 掌握维里方程的几种形式及维里系数的物理意义。
(3) 熟练运用二阶舍项的维里方程进行pVT计算。
(4) 理解立方型状态方程的普遍特点。
(5) 重点掌握RK方程一般形式和迭代形式的使用。
熟练运用RK方程进行气体的pV T 计算。
(6) 掌握RKS和PR方程。
并能运用RKS和PR方程进行纯流体的pVT计算。
(7) 掌握偏心因子的概念。
(8) 理解对比态原理的基本概念和简单对比态原理。
(9) 熟练掌握三参数的对应状态原理和压缩因子图的使用。
(10) 熟练运用普遍化状态方程式解决实际流体的pVT计算。
(11) 初步了解液体的pVT关系。
(12) 掌握混合物的pVT关系。
重点掌握kay规则、气体混合物的第二维里系数和立方型状态方程的混合规则。
在化工过程的分析、研究与设计中,流体的压力p、体积V和温度T是流体最基本的性质之一,并且是可以通过实验直接测量的。
而许多其它的热力学性质如内能U、熵S、Gibbs 自由能G等都不方便直接测量,它们需要利用流体的p –V –T数据和热力学基本关系式进行推算。
因此,流体的p –V –T关系的研究是一项重要的基础工作。
2.1 纯物质的p –V –T关系纯物质在平衡态下的p –V –T关系,可以表示为三维曲面,如图2-1。
图2-1 纯物质的p –V –T图曲面上分单相区及两相共存区。
曲线AC和BC代表汽液共存的边界线,它们相交于点C,C点是纯物质的临界点,它所对应的温度、压力和摩尔体积分别称为临界温度T c、临界压力p c和临界体积V c。
将p –V –T曲面投影到平面上,则可以得到二维图形。
图2-2和2-3分别为图2-1投影出的p –T图和p –V图。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Z
PV RT
1
B V
C V
2
例3:已知200℃是异丙醇蒸汽的第二和第三维里系数分别 为:B=-0.388m3· kmol-1,C=-0.026m6· kmol-2
试计算200 ℃、1MPa时异丙醇蒸汽的V和Z:(a)用
理想气体方程;(b)用维里截断式2-7;(c)用维里截断 式2-8 解:R=8.314m3· mol-1· -1,T=472.15K Pa· K (a)用理想气体状态方程:
V RT p 1000 8 . 314 473.15 1000000 3.934m
3
kmol
-1
Z=1
(b)用式2-7
V Z RT p pV RT V RT/ p B 1000 8 . 314 473.15 1000000 3 . 546 3 . 934 0 . 9014 - 0.388 3.546m
第二章
流体的pVT关系——状态方程
孙德伟 citizen_81@
1 2
纯流体的p-V-T相图
流体的状态方程
3
4 5
对应态原理及其应用
真实气体混合的p-V-T关系
液体的p-V-T关系
热力学最基本性质有两大类
P,V ,T,Cp,x
怎么办??? U,H, S,G
易测
从容易获得的物性数据(P、V、 T、x)来推算较难测定的数据 ( H,U,S,G )
P* T<Tc
⑶ Redlich-Kwong状态方程
P RT V b a V
2
P
RT V b
T
a
1/2
V V b
①已知T,V,如何求P?
直接计算,很方便。 在计算时,一定要注意单位,
1atm=0.101325×106Pa=0.101325MPa
②已知P,T,如何求V? 工程上最常用的情况,因为P,T易测。用各种迭代法求解。 ③已知P, V,如何求T ? 用各种迭代法求解。
② 已知p,T求V
P RT V b T a
1/2
V V b
V
RT p
b T
a V - b
1/ 2
p V V b
V i 1
RT p
b T
a V i - b
1/ 2
p V i V i b
以理想气体状态方程计算的摩尔体积为初值V0
PV=RT
式中V是摩尔体积,R为通用气体常数,其值见表2-1
例2:将1kmol甲烷压缩储存于容积为0.125m3,温度为 323.16K的钢瓶内.问此时甲烷产生的压力多大?其实 验值为1.875x107Pa. 解:
P nRT V 1000 8 . 314 323 . 16 0 . 125
P
C
1)过热蒸汽等温冷凝为过冷液体; 2)过冷液体等压加热成过热蒸汽; 3)饱和蒸汽可逆绝热膨胀; 4)饱和液体恒容加热; 5)在临界点进行的恒温膨胀
5 4 1
3(T降低)
2
V
二、流体的状态方程
1. 什么是状态方程(EOS)? 流体的状态方程是物质p-V-T关系的解析式。即
用一个EOS即可精确地代表相当广泛范围内的p、V、
过冷液体区
过热蒸汽区
汽液两相平衡区 F=C-P+2=1
临界点数 据见附表1; 正常沸点 在哪?
饱和液相线
饱和汽相线
恒温线
• • • • • • •
单相区(V,G,L) 两相共存区(V/L) 饱和线(饱和液体线、饱和气体线) 过热蒸汽 过冷液体 等温线(T=Tc、T>Tc、T<Tc) 临界等温的数学特征
b 1 RT c 8 Pc
a
27 R T c 64 Pc
2
2
1)T>Tc
2)T=Tc 三个重实根 V=Vc
仅有一个实根,对应于超临界 流体和气体的摩尔体积。
P
Pc
*
C
P
Pc
*
C
P
P
T Tc
T Tc Vc
V
*
V
Vc
V
*
V
P-V图上的超临界等温线和临界等温线
P
C
3)T<Tc 三个不同实根,发生于两相区 V大—对应于饱和汽摩尔体积 V小—对应于饱和液摩尔体积 V中—无物理意义。
V1 RT B C 1 2 p V0 V0 0 . 026 0 . 388 3 3 .9 3 4 1 3 . 539 m kmol 2 3 . 934 3 . 934
-1
代
V1=3.539与V0=3.934相差较大,进行第二次迭
一、纯流体的p-V-T相图
液体水
带有活塞的汽缸保持恒压
T 5 2 1 v 3 4
临界点
气体
液体
液体和蒸汽
饱和液相线 (泡点线) 饱和汽相线 (露点线)
①纯物质的P-V图
临界点
P
V
T
2
0
在 C 点 在 C 点
2
P V
T
0
超临界流体区
(T>Tc和P>Pc)
a 0 . 42748 R Tc Pc
2 2 .5
b 0 . 08664
RT Pc
c
例2:将1kmol甲烷压缩储存于容积为0.125m3,温度为323.16K的钢
瓶内.问此时甲烷产生的压力多大?其实验值为1.875x107Pa.
解:1)理想气体 误差高达14.67%!!! 2) RK方程 查附录二得TC=190.6K,PC=4.600MPa=4.6x106Pa
P
V
T
2
0
在 C 点 在 C 点
2
P V
T
0
• 超临界流体(T>Tc和P>Pc)
②纯物质的P-T图
临界等容线
液固平衡线
超临界流体区 液体区
(T>Tc和P>Pc)
临界点 固体区
汽液平衡线
气体区
三相点F=C-P+2=0
汽固平衡线
水的三相点:0.0098℃
• 单相区 • 两相平衡线(饱和曲线)
微观上,Virial系数反映了分子间的相互作用,第二 维里系数B反映了两个分子之间的相互作用;第三维里 系数C反映了三重分子的相互作用。 宏观上,Virial系数仅是物性和温度的函数。
实际中常用Virial截断式
Z
PV RT
1
B V
适用于T<Tc,P<1.5MPa蒸汽 适用于T<Tc, 1.5MPa < P < 5MPa蒸汽
多参数高次型 立 方 型
⑵ van der Waals( vdW范德华)状态方程 ⑶ Redlich-Kwong状态方程
⑷ Soave- Redlich-Kwong状态方程
⑴ 维里(Virial)方程
Z为压缩因子,其大小反映出真实气体对理想气体的偏 差程度 。
B,C分别为第二,第三维里系数。是有物理意义的:
求体积。
本题经过5次迭代即可: V=3.488m3· kmol-1,Z=pV/RT=0.8867
⑵ 范德华方程
P RT V b a V
2
◆考虑了分子的体积,对体积V
进行了修正,b为有效分子体积。
◆考虑分子间引力的影响,引入
气体的内压项,a为引力参数。
◆是第一个同时能计算汽,液两
相和临界点的方程。
V2 RT B C 1 2 p V1 V1 0 . 026 0 . 388 3 3 . 924 1 3.495 m kmol 2 3.539 3.539
-1
V2=3.495与V1=3.539依然相差较大,进行第三次迭 代……直到Vi+1-Vi的直满足要求为止,最后的Vi+1即为所
R=8.314x103 m3.Pa/kmol.K
a 0 . 42748 R Tc Pc
2 2 .5
b 0 . 08664
RT c Pc
P
RT V b
T
a
1/2
V V b
1 . 8978 10 Pa
7
误差仅为1.216%!!!
7
2 . 150 10 Pa
7
( 2 . 150 1 . 875 ) 10 误差 100 % 14 . 67 % 7 1 . 875 10
误差高达14.67%!!!
理想气体EOS只适合压力非常低的气体,不适合真 实气体。
2. 真实气体的状态方程
⑴ Virial(维里)状态方程
– 汽化曲线、熔化曲线、升华曲线
• 三相点(Tt,Pt)和临界点(Tc,Pc,Vc)
• 等容线
– 临界等容线V=Vc、V>Vc、V<Vc
பைடு நூலகம்1 、将下列纯物质经历的过程表示在P-V图上:
1)过热蒸汽等温冷凝为过冷液体; 2)过冷液体等压加热成过热蒸汽; 3)饱和蒸汽可逆绝热膨胀; 4)饱和液体恒容加热; 5)在临界点进行的恒温膨胀
难测!
但存在问题: 1)有限的P-V-T数据,无法全面了解流体的P-V-T 行为; 2)离散的P-V-T数据,不便于求导和积分,无法获得数据点 以外的P-V-T 和H,U,S,G数据。
如何解决?
• 如何解决?
– 只有建立能反映流体P-V-T关系的解析形式 才能解决。 – 这就是状态方程Equation of State(EOS) 的由来。 – EOS反映了体系的特征,是推算实验数据之 外信息和其它物性数据不可缺少的模型。 • 流体P-V-T数据+状态方程EOS是计算热力学性 质最重要的模型之一。
