外源硫化氢对盐胁迫下玉米叶片中ASA和GSH的影响
外源硫化氢对铝胁迫下水稻幼苗生长及生理生化的影响

外源硫化氢对铝胁迫下水稻幼苗生长及生理生化的影响作者:孟丹刘玲陈露周思敏安敏敏罗玉明杨立明来源:《江苏农业科学》2014年第06期摘要:探究硫化氢(H2S)对铝胁迫下水稻幼苗生长的影响,以硫氢化钠(NaHS)作为硫化氢的供体,分别采用0.2、0.4 mmol/L NaHS,75 μmol/L AlCl3,75 μmol/L AlCl3与0.2 mmol/L NaHS,75 μmol/L AlCl3与0.4 mmol/L NaHS处理水稻幼苗。
结果表明,低浓度铝离子对水稻幼苗根的生长产生明显的抑制效果,株高、根长、鲜重、干重和生物量均下降,叶片叶绿素含量,可溶性蛋白含量和SOD活性下降。
而H2S供体NaHS能够显著缓解AlCl3的胁迫作用,其中 0.4 mmol/L NaHS缓解AICl3胁迫的效果最为显著。
关键词:水稻;铝胁迫;硫化氢;生物量;生理生化指标中图分类号: S511.01文献标志码: A文章编号:1002-1302(2014)06-0063-03收稿日期:2013-09-11基金项目:江苏省农业科技自主创新资金[编号:CX(12)3048];淮阴师范学院生命科学学院大学生实践创新训练计划(编号:201210323006);国家级及江苏省高等学校大学生实践创新训练计划(编号:2012JSSPITP2485)。
作者简介:孟丹(1992—),女,江苏淮安人,研究方向为植物资源与生物技术。
E-mail:chenlu1201@。
通信作者:杨立明,博士,副教授,研究方向为植物生物技术。
E-mail:yanglm@。
土壤中重金属对作物的生长发育产生了严重的不良影响,而铝对植株产生的毒害主要表现在根尖的伸长生长受到明显抑制[1-2],根变得粗短而脆,根冠易于脱落,表皮脱落,侧根变粗短,分枝根变少,根毛易脱落,根的生物量有一定程度的降低[3]。
根尖受到铝的毒害并被铝富集,根系的生长受抑制,影响水分和养料(钙、镁、磷等)的吸收、运输和利用[4-6],最终影响了作物的产量和品质。
外源Ca2+对盐胁迫下玉米幼苗生理指标的影响

外源Ca2+对盐胁迫下玉米幼苗生理指标的影响作者:武燕解丹丹马小亭徐熔王倩来源:《安徽农业科学》2014年第12期摘要[目的]分析外源Ca2+对玉米幼苗在盐胁迫下的缓解效果。
[方法]以玉米为试验材料,用 100 mmol/L NaCl对玉米进行盐胁迫处理(对照组),试验组在此基础上加入20 mmol/L CaCl2溶液,待玉米幼苗长至三叶期后测定其生理生化指标。
[结果]施加了外源Ca2+后玉米幼苗叶片中POD活性在005水平显著升高,可溶性糖和叶绿素含量在005水平显著增加;MDA 和脯氨酸含量在005水平显著降低。
[结论]外源 Ca2+对玉米幼苗NaCl盐害有一定的缓解作用。
关键词盐胁迫;外源Ca2+;玉米叶片;生理生化指标中图分类号S513文献标识码A文章编号0517-6611(2014)12-03471-02基金项目黑龙江省大学生创新创业项目(201310235007)。
作者简介武燕(1975-),女,黑龙江肇州人,讲师,从事植物生理生态学方面的研究。
收稿日期20140411全世界有1/3的土地是盐碱地,我国约有3 000万hm2。
黑龙江省大庆地区是土壤盐渍化程度非常高的地区之一。
土壤盐化严重影响和限制植物的生长,制约了农业生产[1]。
玉米是大庆地区主要的粮食作物。
土地盐渍化对玉米生长、产量有很大的威胁。
为了更好地利用盐渍地资源,通过施加外源缓解剂来改善土壤的盐渍化的研究越来越受到人们的重视,其中外源施加CaCl2是目前采用的缓解土壤盐渍化的方法之一。
Ca2+不仅作为植物必须营养元素,而且具有稳定膜结构及作为某些酶分子结构“稳定剂”的功能。
同时,Ca2+作为第二信使,在植物体对外界信号的感应、传递和响应过程中起着重要作用。
已有不少研究证实,外源CaCl2处理可改进植物在逆境条件下的生长状况,减轻胁迫伤害,提高植物的抗逆性[2]。
该研究考察了外源CaCl2处理对盐胁迫下玉米幼苗生理指标的缓解作用,为地区农业生产中提高玉米产量提供参考。
盐胁迫对玉米的影响及抗逆栽培

盐胁迫对玉米的影响及抗逆栽培作者:苏东涛党德宣薄晓峰王静傅君来源:《天津农业科学》2014年第09期摘要:介绍了植物在盐胁迫发生时的生理响应机制,并且论述了盐胁迫对玉米生长和光合作用的影响。
针对现阶段我国盐碱地的不同特性,对在盐碱地上种植玉米时存在的问题进行了分析,并且提出了相应的玉米抗逆栽培措施。
关键词:盐胁迫;玉米;抗逆栽培中图分类号:S513 文献标识码: A DOI 编码:10.3969/j.issn.1006-6500.2014.09.004Abstract:The physiological reaction of plants to salt stress was introduced and effects of salt stress on the growth and photosynthesis of maize was discussed. According to the diverse characteristics of salt stress, the paper analyzed the problems of maize cultivation on saline-alkali soil and put forward relevant adverse-resistant cultivation of maize.Key words:salt stress;maize;adverse-resistant cultivation现阶段科学技术的发展极大地推动了经济发展和社会进步,但是人类面临的各种环境问题却日趋严重[1]。
在我国,随着工业化和城镇化的快速发展,土地面积在逐年减少,再加上不合理的耕作栽培方式,导致大量土壤盐渍化,对我国的粮食生产和安全造成了严重威胁[2]。
因此,如何利用和开发我国上亿亩盐渍化土壤、培育耐盐作物品种、提高作物的耐盐性就成为我国农业生产中十分重要和迫切的任务,也是农业科研工作者亟须解决的一个问题。
盐胁迫对植物的影响及植物耐盐研究进展

盐胁迫对植物的影响及植物耐盐研究进展彭程【摘要】盐胁迫是一个影响植物生长发育的重要环境因素.该文总结了盐胁迫对植物生长发育及代谢的影响,并从植物自身结构、渗透调节、活性氧清除、内源激素等方面分析了植物对盐胁迫的适应性机制.近年来,国内外对植物耐盐性的研究已取得了相当大的进展,但仍许多重要问题有待深入探索研究.【期刊名称】《山东商业职业技术学院学报》【年(卷),期】2014(014)002【总页数】6页(P123-128)【关键词】盐胁迫;生长发育;渗透调节;活性氧;ABA【作者】彭程【作者单位】济南市天桥区民族宗教事务局,山东济南250113【正文语种】中文【中图分类】Q945土壤盐渍化属于一个全球性生态问题,是当今世界耕地退化和土地荒漠化的主要因素之一。
当前,全球盐碱地面积已达9.5×108 hm2[1]。
中国盐渍土总面积约1×108 hm2,其中现代盐渍化土壤约0.37×108 hm2,残余盐渍化土壤约0.45×108 hm2,潜在盐渍化土壤约0.17×108 hm2[2]。
土壤盐渍化是现代农业所面临的主要问题之一,盐分胁迫影响着植物产量、蛋白质合成和光合作用以及能量代谢[3]。
因此,研究如何提高植物抗盐性,提高盐渍土地中农作物的产量和质量有着极为重要的意义。
该文就盐胁迫对植物生长发育的影响以及盐胁迫下植物的适应性调节方面的研究进展作简要论述,以期为深入揭示植物耐盐机理,筛选高效、高质量耐盐植物品种资源提供参考依据。
盐胁迫对种子的萌发的影响主要有三方面效应,即增效效应、负效效应和完全阻抑效应[4]。
大多数实验证明盐生植物的种子在蒸馏水中萌发得最好,随着NaCl浓度的升高,NaCl对种子萌发的抑制程度不断加重,直至完全抑制[5-6];也有实验证明低浓度盐分可以促进一些植物种子的萌发[7-10]。
盐胁迫对种子萌发的影响,不仅表现为对萌发率的影响,还表现为延迟种子萌发的起始时间[11-12]。
外源硫化氢对干旱胁迫下玉米幼苗水分生理特性的影响

文 章编 号 : 1 0 0 0 . 7 6 0 1 ( 2 0 1 5 ) 0 5 — 0 0 8 0 . 0 5
d o l : 1 0 . 7 6 o 6 / j . i s s n . 1 0 0 0 — 7 6 0 1 . 2 0 1 5 . 0 5 . 1 5
外 源 硫 化 氢 对 干 旱 胁 迫 下 玉 米 幼 苗 水 分 生 理 特 性 的 影 响
单 长 卷 2 , 赵 元增 2
( 1 . 河南科技学 院,河南 新 乡 4 5 3 0 0 3 ; 2 . 现代生物育种河南省协 同创新 中心 ,河南 新 乡 4 5 3 0 0 3 )
摘 要 :采 用溶 液培养 方 法, 研究了0 . O 1 、 0 . 1 、 0 . 3 、 0 . 6 、 1 m m o l ・ L 等 不 同浓度 外源硫 化氢供 体 硫氢 化钠 ( N a i l S ) 对干旱条件下玉米幼苗叶片及根 系水分 生理特 性的影响。结果表 明, 干旱胁迫 显著提高 了玉米幼苗根 系活
Ab s t r a c t :Ef f e c t s o f d i f f e r e n t c o n c e n t r a t i o n s o f e x o g e n o u s h y d r o g e n s u l i f d e we r e s t u d i e d o n t he p h y s i o l o g i c a l c h a r a c — t e r i s t i c s o f ma i z e s e e d l i n g s u n d e r d r o u g h t c o n d i t i o n s.Th e r e s u l t s s h o we d t h a t pr e t r e a t me n t wi h t 0. 01 mmo l ・ L一 Na iS r
盐胁迫及外源物质对植物抗盐性影响的研究进展

盐胁迫及外源物质对植物抗盐性影响的研究进展李海萍【摘要】从植物种子萌发和生长、渗透调节物质、质膜透性和抗氧化酶活性以及光合作用等方面阐述了盐胁迫对植物的影响作用的研究进展,并论述了外源物质对盐胁迫的调控作用的国内外研究状况.【期刊名称】《青海农技推广》【年(卷),期】2018(000)004【总页数】3页(P48-50)【关键词】盐胁迫;渗透调节物质;质膜透性;抗氧化酶;外源物质【作者】李海萍【作者单位】青海师范大学,青海西宁810000【正文语种】中文【中图分类】S6植物生长在大自然中,受到各个方面的逆境胁迫,比如干旱、盐碱、高温、冻害、洪涝、酸雨等等。
盐渍土和土壤次生盐渍化问题已成为制约人类社会发展和进步的一个世界性的资源与环境问题,受到了社会越来越普遍的关注。
我国盐渍土地资源面积之大、分布之广,是世界之最。
但是从另一个角度来看,盐渍土是一种十分具有潜力的特殊的土地资源。
了解盐胁迫对植物的影响并研究如何通过外源物质减少盐胁迫对植物的伤害意义重大。
1 关于盐胁迫对植物影响的研究1.1 对植物种子萌发和生长的影响据统计,非生物逆境会影响作物常量的正常发挥,其中盐化引起的伤害是限制作物生长和产量提高的重要因子。
对盐胁迫下玉米(Zea maysL.)种子萌发的研究发现玉米种子的胚芽长度和胚芽重都被显著抑制[1]。
朱义等[2]报道,高羊茅(Festuca arundinacea)在盐胁迫下,其生长量、株高、干重等降低且随着浓度的升高趋势更加明显,而且盐胁迫对植物不同部位生长的抑制作用也不同,地上部分较根部受抑制明显[2][3]。
对黄瓜的研究得出了相同的结论,即盐胁迫致使黄瓜(Cucumis sativus Linn.)叶面积减少,生长缓慢,根系吸收能力下降,水分代谢失衡,继而导致产量降低[3]。
杨科等[4]的研究结果也都表明,随着盐碱胁迫浓度的增强,燕麦(Avena Sativa L.)种子的发芽率、发芽指数、活力指数和幼苗生长与对照相比都呈下降趋势。
外源Ca~(2+)对盐胁迫下玉米萌发与幼苗生长的影响

Ch n s rc l r l c e c l t ie e Ag iu t a in eBu l i u S en
外源 C 2 盐胁迫下玉米 萌发 与幼 苗生长的影响 a+ 对
刘雪琴 , 仝瑞 建 , 佳妮 施
g r n t n a d g o h o ie t e s l b e p o e n c n e t n h o o h l c n e to ie s e l g e e e mi a i n r w fmaz , h o u l r t i o t n d c l r p y l o t n fmaz e d i s w r o t a n d c e s d b 9 4 % a d 2 .7 , e ra e y3 .3 n 9 % MDA o t n a n r a e y 6 . 5 . h o u l r t i o t n n 1 c n e tw s i c e s d b 2 0 % T e s l b e p oe n c n e ta d c lr p y l o t n f ie s e l g e e i c e s d a d MDA c n e t a e r a e e d i gd f r n h o o h l c n e to z e d i s w r r a e , n ma n n o tn sd c e s d wh n a d n i e e t w f
中 图分类 号 :5 3 S 1
文献 标 志码 : A
论 文编 号 :0 00 3 2 1 .5 3
Efe t fCa cu n G e mi a i n a d S e l g Gr wt f a z n e a t t e s f c li m o r n t n e d i o h o i eu d rS l S r s o o n M
外源GSH对NaCl胁迫下番茄幼苗生长及AsA-GSH循环的影响

A b s t r a c t : H y d r o p o n i c e x p e i r m e n t s w e r e c o n d u c t e d t o i n v e s t i g a t e t h e e f f e c t s o f f o l i a r s p r a y i n g w i t h r e d u c e d g l u t a t h i o n e( G S H ) , o x i d i z e d g l u t a t h i o n e( G S S G )a n d g l u t a t h i o n e s y n t h e s i s i n h i b i t o r( B S O )o n p l a n t g r o w t h , a s w e l l a s H 2 0 2 a n d MD A c o n t e n t s a n d
关键词 : 番茄 : N a C 1 胁迫; G S H; As A— GS H循 环 中图 分 类号 : ¥ 6 4 1 . 2 文献 标 志 码 : A
Ef f e c t s o f Ex o g e n o us G S H o n t h e Gr o wt h a nd As A-GS H Cy c l e
( 石 河子 大 学 农 学 院 园 艺系 , 石河子 8 3 2 0 0 3 )
摘 要: 采 用 营 养 液 栽 培法 , 研究 叶片 喷 施 还原 型 谷胱 甘肽 ( G S H) 、 氧 化 型谷 胱 甘 肽 ( G S S G) 和 谷 胱 甘肽 合 成 抑 制 剂 ( B S O)
219387074_外源NO_对低温胁迫下仁用杏花器官AsA-GSH_循环的影响

第46卷第3期2023年5月河北农业大学学报JOURNAL OF HEBEI AGRICULTURAL UNIVERSITYVol.46 No.3May.2023外源NO对低温胁迫下仁用杏花器官AsA-GSH循环的影响赵子媛1,2,佟冠杰1,李彦慧1(1.河北农业大学,河北 保定 071000;2.河北绿景工程咨询服务有限公司,河北 石家庄 050000)摘要:为探讨低温胁迫下不同浓度外源一氧化氮(NO)对仁用杏花器官AsA-GSH循环的影响,本试验选用3个品种的仁用杏花器官作为试验材料,喷施0(CK)、0.1、0.2、0.3、0.4、0.5 mmol/L的外源NO供体硝普钠(Sodium nitroprusside,SNP)处理,研究经低温胁迫4 h后仁用杏花器官活性氧水平及AsA-GSH循环的变化。
结果表明,与CK相比,不同浓度的外源NO均降低了3种仁用杏花器官过氧化氢(H2O2)含量和超氧阴离子(O2-)产生速率;‘优一’(‘Youyi’)在0.4 mmol/L SNP处理下H2O2含量和O2-产生速率分别比CK降低了13.71%、65.20%;‘龙王帽’(‘Longwangmao’)在0.4 mmol/L SNP处理下分别比CK降低了25.17%、85.62%;‘围选1号’(‘Weixuan 1’)在0.5 mmol/L SNP处理下分别比CK降低了25.17%、77.11%。
不同浓度的外源NO可以提高3种仁用杏花器官抗坏血酸(AsA)含量、谷胱甘肽(GSH)含量、AsA+DHA含量、GSH+GSSG含量和AsA/DHA、GSH/GSSG;降低脱氢抗坏血酸(DHA)含量、氧化型谷胱甘肽(GSSG)含量;同时增强抗坏血酸过氧化物酶(APX)活性、谷胱甘肽过氧化物酶(GPX)活性和脱氢抗坏血酸还原酶(DHAR)活性,以提高AsA-GSH循环的速率,减少活性氧的累积,降低膜脂过氧化作用,缓解低温对花器官的伤害,提高其抗寒性。
H2O2对盐胁迫下羽衣甘蓝幼苗生长的影响

定[ J ] 。林 业科技开发 , 2 0 0 9 , 2 3 ( 3) : 3 6— 3 8 . [ 4] 王学奎.植物生理生化实验原 理和技术 [ M] .北京 : 高等教育 出
版社 , 2 O 0 6: 2 1 1— 2 3 2 .
体为 3 0 %H 2 0 : , H 2 0 2 清除剂为二 甲基硫脲 , 均为国产分析纯。
1 . 2 试 验 处理
把羽衣甘蓝种子 , 消毒后 , 用蒸馏水冲洗数次 , 滤纸吸干 。 处理后的种子 放入 垫好 滤 纸 的培养 皿 中, 温 室培 养 [ 温度: ( 2 4±2 )℃ , 光照~黑暗 : 1 6 h ~8 h , 光照度 : 2 0 0 0 l x ] 。待羽
胁迫能使植物体 内活性氧增高
。近年来 , 许 多试 验表 明,
H 0 : 是一种重要的信号分子 , 当植 物细胞在响应于各种胁迫 反应时能生成该物质 , 并进 一步调节应 激反应 的一 系列信号
转 导 。有 证 据 显 示 , 逆境条 件下 内源 H : 0 积 累能 增 加
植物的抗逆性 , 过量 的 H : O 等 R O S能引起细 胞 内大分 子氧 化损伤 ; Wa h i d等的研究表 明, 过 氧化氢预处理 可以使细胞膜
江苏农业科学
1 材 料 与 方 法 1 . 1 试 验 材 料
2 0 1 7年第 4 5卷第 2 2期
的影 响
研究发现 , 用5 0 m m o l / L N a C 1 处理的羽衣甘蓝幼苗 与对 照没 有显著 差异 , 仅 有部分 老 叶枯 萎。在 1 0 0 m m o l / L N a C 1 胁迫下 , 羽衣甘蓝幼苗 受伤害程度增加 , 上 部部分叶片变黄 , 下部老 叶萎 蔫。当 N a C 1 浓 度达到 1 5 0 、 2 0 0 m m o l / L时 , 叶片 严重失水 , 导致甘蓝幼苗全 株死亡 。因此 , 在此后试 验 中, 选
外源NaHS对盐胁迫下板栗幼苗的缓解效应

外源NaHS对盐胁迫下板栗幼苗的缓解效应作者:孙晓莉田寿乐沈广宁许林来源:《山东农业科学》2017年第04期摘要:为探讨外源硫化氢对盐胁迫下板栗幼苗的缓解作用,以两年生红栗2号板栗幼苗为试材,研究不同浓度(0、0.1、0.2、0.5、1.0、2.0 mmol·L-1)的硫化氢供体硫氢化钠(NaHS)对100 mmol·L-1 NaCl胁迫下板栗幼苗叶片光合特性、叶绿素含量、脯氨酸含量及丙二醛(MDA)含量的影响。
结果表明:喷施外源NaHS可不同程度缓解盐胁迫对板栗幼苗叶片造成的伤害,与100 mmol·L-1 NaCl胁迫处理相比,叶绿素含量提高,MDA含量降低,脯氨酸含量升高,从而有效降低了盐胁迫下细胞膜受损程度,提高了板栗对盐渍环境的适应性,且这种缓解效应存在明显的剂量效应,以0.5、1.0 mmol·L-1 NaHS两个浓度效果较好。
关键词:板栗;NaHS;盐胁迫;缓解效应中图分类号:S664.201 文献标识号:A 文章编号:1001-4942(2017)04-0051-04Alleviation Effect of Exogenous Sodium Hydrosulfideon Chestnut Seedlings under Salt StressSun Xiaoli, Tian Shoule, Shen Guangning, Xu Lin(Shandong Institute of Pomology, Taian 271000, China)Abstract In order to study the alleviation effect of exogenous hydrogen sulfide on chestnut seedlings under salt stress,using two years old chestnut ‘Hongli 2’ seedlings as materials, the effects of different concentrations (0, 0.1, 0.2, 0.5, 1.0, 2.0 mmol·L-1) of sodium hydrosulfide (NaHS) on the photosynthetic characteristics, chlorophyll content, proline content and malondialdehyde (MDA) content of chestnut leaves were investigated under 100 mmol·L-1 NaCl stress. The results showed that spraying exogenous NaHS could alleviate the damage caused by salt stress on the leaves of chestnut seedlings in different degrees. Compared with 100 mmol·L-1 NaCl treatments,the chlorophyll and proline content increased, MDA content significantly dropped,which effectively reduced the damage of cell membrane under salt stress and improved the adaptability of chestnut to saline environment. In addition, the NaHS dosage influenced the alleviation effect obviously, and 0.5 mmol·L-1 and 1.0 mmol·L-1 NaHS had better alleviation effect.Keywords Chestnut; NaHS;Salt stress; Alleviation effect土壤盐碱化是世界范围内农业面临的主要非生物胁迫之一,盐胁迫常导致渗透胁迫、离子毒害、营养失衡和氧化胁迫[1]。
硫化氢缓解铝、镉和盐胁迫及硫营养影响大麦生长与品质的生理机制

硫化氢缓解铝、镉和盐胁迫及硫营养影响大麦生长与品质的生理机制硫是植物生长必需元素,硫缺乏抑制作物生长,降低产量和品质。
近二十年来,作物硫缺乏在世界范围内呈增长趋势,其主要原因是工业排放二氧化硫减少,低含硫肥料的持续增加使用及含硫杀菌剂和杀虫剂的持续减少使用。
另一方面,酸(铝)、盐咸及重金属等环境胁迫正严重制约着作物产量与品质。
大麦是全球各地普遍栽培的禾谷类作物,是重要的粮食、饲料以及工业原料作物。
硫缺乏也可能影响大麦生长和品质。
本研究旨在探讨硫营养对大麦生长、产量及籽粒品质的影响及基因型差异。
同时,探讨了外源H2S缓解大麦铝、镉和盐胁迫的生理机制,为通过化学调控手段减轻作物铝、镉和盐胁迫及减少铝、镉积累提供理论与技术指导。
主要研究结果如下:1.外源H2S对大麦铝毒害的缓解效应温室水培试验,探讨了外源H2S 缓解大麦Al毒害的机理。
试验设5个处理:(1)对照,0.5mM CaCl2溶液:(2)Pre-S,Al处理前1d用0.5mM CaCl2溶液+200μM NaHS预处理24h,次日更换为0.5mM CaCl2溶液;(3) Al,0.5mM CaCl2处理24h,次日更换为0.5mM CaCl2+100μM AlCl3溶液;(4) Pre-S+Al,0.5mM CaCl2+200μM NaHS预处理24h,次日更换为0.5mM CaCl2+100μM AlCl3溶液;(5) Pre-Na2SO4+Al,0.5mM CaCl2+200μM Na2S04预处理24h,次日更换为0.5mM CaCl2+100μ M AlCl3溶液。
结果表明,外源H2S(Pre-S+Al处理)显著缓解大麦A1毒害,增加幼苗根长,显著减少A1诱导膜脂过氧化物产物MDA积累,降低根系电解液渗透和根Al含量,激活Na+K+-ATPase and H+-ATPase 活性。
不同浓度NaHS处理(100、200、400μMNaH)对Al毒害缓解效应的比较研究结果显示,H2S对铝诱导毒害的缓解作用也存在时间和剂量依赖效应,与对照仅有Al毒害的幼苗相比,100μM AlCl3溶液中添加200和400μM NaHS,有效缓解铝毒害,显著减少铝诱导产生的MDA积累,增加叶绿素含量、净光合速率及最大光化学效率。
《外源硅对苜蓿盐胁迫的缓解效应及调控机理》范文

《外源硅对苜蓿盐胁迫的缓解效应及调控机理》篇一一、引言盐胁迫是苜蓿种植中常见的问题,它严重影响了苜蓿的生长和产量。
为了应对这一问题,越来越多的研究者开始探索不同方法以减轻盐胁迫对苜蓿的伤害。
近年来,外源硅在改善作物对盐胁迫的抗性方面表现出了显著的潜力。
本文将重点探讨外源硅对苜蓿盐胁迫的缓解效应及其调控机理。
二、外源硅在苜蓿中的重要性外源硅作为一种重要的环境友好型物质,能够显著提高植物对多种生物和非生物胁迫的抗性。
在苜蓿中,外源硅的施用可以显著提高其生长速度和产量,同时也能提高其对盐胁迫的耐受性。
三、外源硅对苜蓿盐胁迫的缓解效应(一)生长状况改善外源硅的施用可以有效减轻盐胁迫对苜蓿生长的抑制作用,使苜蓿的生长速度加快,叶片颜色更加鲜绿。
此外,还能提高苜蓿的生物量,增加其根系发育,提高土壤的保水保肥能力。
(二)生理生化响应外源硅可以调节苜蓿体内的离子平衡,减少盐胁迫引起的离子毒害。
同时,还能提高苜蓿体内的抗氧化酶活性,降低活性氧的积累,从而减轻盐胁迫对苜蓿细胞的氧化损伤。
此外,外源硅还能促进苜蓿体内营养元素的吸收和利用,提高其抗逆能力。
四、外源硅调控苜蓿盐胁迫的机理(一)影响植物激素水平外源硅可以影响植物激素的合成和分布,从而调节植物对盐胁迫的响应。
例如,硅可以诱导植物产生更多的脱落酸(ABA),而ABA是一种重要的植物激素,能够提高植物对盐胁迫的抗性。
(二)改变细胞壁结构外源硅可以与细胞壁中的成分发生反应,增加细胞壁的厚度和机械强度,从而提高细胞的抗逆能力。
此外,硅还可以改变细胞壁的结构和功能,影响细胞的生长和分化。
(三)调控基因表达外源硅可以通过调控基因的表达来影响植物对盐胁迫的响应。
例如,硅可以诱导一些与抗逆相关的基因的表达,从而提高植物对盐胁迫的抗性。
这些基因可能涉及到离子平衡、抗氧化防御、信号传导等多个方面。
五、结论外源硅在缓解苜蓿盐胁迫方面具有显著的效应和调控机理。
通过改善苜蓿的生长状况、调节生理生化响应以及影响植物激素水平、改变细胞壁结构、调控基因表达等多种途径,外源硅可以提高苜蓿对盐胁迫的抗性,促进其正常生长和发育。
硫化氢对盐碱胁迫下裸燕麦光合生理的影响

第51卷 第7期2023年7月西北农林科技大学学报(自然科学版)J o u r n a l o f N o r t h w e s t A&F U n i v e r s i t y(N a t .S c i .E d .)V o l .51N o .7J u l .2023网络出版时间:2022-12-27 10:59 D O I :10.13207/j .c n k i .jn w a f u .2023.07.006网络出版地址:h t t ps ://k n s .c n k i .n e t /k c m s /d e t a i l //61.1390.s .20221223.1831.002.h t m l 硫化氢对盐碱胁迫下裸燕麦光合生理的影响[收稿日期] 2022-04-22[基金项目] 国家自然科学基金项目(31960375,31860114);甘肃省自然科学基金重点项目(20J R 5R A 491,20J R 5R A 486) [作者简介] 刘建新(1964-),男,甘肃通渭人,教授,主要从事植物逆境生理生态研究㊂E -m a i l :l i u jx 1964@163.c o m 刘建新,刘瑞瑞,刘秀丽,欧晓彬,贾海燕,王风琴,卜 婷,李 娜(陇东学院生命科学与技术学院甘肃省陇东生物资源保护利用与生态修复重点实验室,甘肃庆阳745000)[摘 要] ʌ目的ɔ研究硫化氢(H 2S)对盐碱胁迫下裸燕麦光合生理的影响,为揭示H 2S 增强裸燕麦耐盐碱性机理提供理论依据㊂ʌ方法ɔ以盆栽砂培裸燕麦品种 定莜9号 为材料,在抽穗期灌根施用50mm o l /L 的盐碱溶液,同时喷施50μm o l /L H 2S 供体硫氢化钠(N a H S )溶液或结合灌根施用1mm o l /L H 2S 合成抑制剂羟胺(HA ),研究H 2S 对盐碱混合胁迫下裸燕麦叶片叶绿素含量㊁光合气体交换参数㊁叶绿素荧光参数㊁叶黄素循环色素含量和相关基因相对表达量㊁卡尔文循环关键酶活性及植株生长的影响㊂ʌ结果ɔ盐碱混合胁迫下,喷施N a H S 可显著缓解裸燕麦叶片光合速率(P n )㊁气孔导度(G s )㊁蒸腾速率(T r )㊁气孔限制值(L s )㊁水分利用效率(WU E )的下降和胞间C O 2浓度(C i )的提高;显著提高光化学淬灭系数(q L ),紫黄质脱环氧化酶(V D E )和玉米黄质环氧化酶(Z E P )基因相对表达水平以及转酮醇酶(T K )活性;降低紫黄质(V )㊁单环氧玉米黄质(A )㊁玉米黄质(Z )含量和叶黄素循环的脱环氧化状态(A+Z )/(V+A+Z )以及1,5-二磷酸核酮糖羧化酶活化酶(R C A )㊁3-磷酸甘油醛脱氢酶(G A P D H )和景天庚酮糖-1,7-二磷酸酶(S B P a s e )活性;缓解裸燕麦根系和地上部干质量的下降幅度;而对裸燕麦叶片叶绿素含量㊁初始荧光(F o )㊁最大荧光(F m )㊁最大光化学量子产量[(F m -F o )/F m ]㊁实际光化学量子产量[Y (Ⅱ)]㊁非光化学淬灭系数(N P Q )㊁非调节性能量耗散量子产量[Y (N O )]㊁调节性能量耗散量子产量[Y (N P Q )]和相对电子传递速率(E T R ),以及1,5-二磷酸核酮糖羧化酶(R u b i s c o )和果糖-1,6-二磷酸醛缩酶(F B A )活性无显著影响㊂增施HA 后部分或完全逆转了上述喷施N a H S 的作用㊂ʌ结论ɔH 2S 通过加快叶黄素循环运转㊁提高光系统Ⅱ反应中心开放程度㊁协调卡尔文循环关键酶活性,缓解盐碱胁迫对裸燕麦光合作用和生长的抑制作用,从而增强裸燕麦耐受盐碱胁迫的能力㊂[关键词] 裸燕麦;盐碱胁迫;硫化氢;叶绿素荧光参数;光合生理[中图分类号] S 512.6[文献标志码] A[文章编号] 1671-9387(2023)07-0045-11E f f e c t s o f h y d r o g e n s u l f i d e o n p h o t o s y n t h e t i c p h y s i o l o g y of n a k e d o a t u n d e r s a l i n e -a l k a l i s t r e s sL I U J i a n x i n ,L I U R u i r u i ,L I U X i u l i ,O U X i a o b i n ,J I A H a i ya n ,WA N G F e n g q i n ,B U T i n g,L I N a (G a n s u K e y L a b o r a t o r y o f P r o t e c t i o n a n d U t i l i z a t i o n f o r B i o l o g i c a l R e s o u r c e s a n d E c o l o gi c a l R e s t o r a t i o n ,C o l l e g e o f L i f e S c i e n c e s a n d T e c h n o l o g y ,L o n g d o n g U n i v e r s i t y ,Q i n g y a n g ,G a n s u 745000,C h i n a )A b s t r a c t :ʌO b j e c t i v e ɔT h i s s t u d y i n v e s t i g a t e d t h e e f f e c t o f h y d r o g e n s u l f i d e (H 2S )o n p h o t o s yn t h e t i c p h y s i o l o g y o f n a k e d o a t u n d e r s a l i n e -a l k a l i s t r e s s t o p r o v i d e b a s i s f o r r e v e a l i n gt h e m e c h a n i s m o f s a l t -a l k a l i t o l e r a n c e e n h a n c e m e n t b y H 2S .ʌM e t h o d ɔS a n d -c u l t i v a t e d n a k e d o a t v a r i e t y D i n g yo u 9 i n p o t s w e r e s p r a y e d w i t h 50μm o l /L H 2S d o n o r s o d i u m h yd r o s u l f i de (N a H S )s o l u t i o n w i t h a n d w i t h o u t 1mm o l /L H 2S s y n t h e s i s i n h i b i t o r h y d r o x y l a m i n e (H A )a t h e a d i n g s t a g e .T h e ef f e c t s o f H 2S o n c h l o r o p h yl l c o n t e n t ,p h o t o s y n t h e t i c g a s e x c h a n g e p a r a m e t e r s ,c h l o r o p h y l l f l u o r e s c e n c e p a r a m e t e r s ,k e y e n z ym e a c t i v i t i e s o f C a l -v i n c yc l e i n l e a v e s a nd p l a n t g r o w t h o f n a ke d o a t s u n d e r 50mm o l /L s a l i n e -a l k a l i m i x e d s t r e s s w e r e s t u d -Copyright ©博看网. All Rights Reserved.i e d.ʌR e s u l tɔU n d e r s a l i n e-a l k a l i m i x e d s t r e s s,s p r a y i n g N a H S s i g n i f i c a n t l y a l l e v i a t e d t h e d e c r e a s e i n p h o-t o s y n t h e t i c r a t e(P n),s t o m a t a l c o n d u c t a n c e(G s),t r a n s p i r a t i o n r a t e(T r),s t o m a t a l l i m i t v a l u e(L s)a n d w a t e r u s e e f f i c i e n c y(WU E)a n d t h e i n c r e a s e o f i n t e r c e l l u l a r C O2c o n c e n t r a t i o n(C i)i n n a k e d o a t l e a v e s.I t s i g n i f i c a n t l y i n c r e a s e d p h o t o c h e m i c a l q u e n c h i n g c o e f f i c i e n t(q L),r e l a t i v e e x p r e s s i o n l e v e l s o f v i o l a x a n t h i n d e-e p o x i d a s e(V D E)a n d z e a x a n t h i n e p o x i d a s e(Z E P)g e n e s a n d a c t i v i t y o f t r a n s k e t o l a s e(T K),w h i l e s i g-n i f i c a n t l y r e d u c e d c o n t e n t s o f v i o l a x a n t h i n(V),a n t h e r a x a n t h i n(A)a n d z e a x a n t h i n(Z),d e-e p o x i d a t i o n s t a t e o f x a n t h i n c i r c l e(A+Z)/(V+A+Z)a n d a c t i v i t i e s o f r i b u l o s e-1,5-b i s p h o p h a t e c a r b o x y l a s e a c t i v a s e (R C A),g l y c e r a l d e h y d e-3-p h o s p h a t e d e h y d r o g e n a s e(G A P D H)a n d s e d o h e p t u l o s e-1,7-b i s p h o s p h a t a s e(S B-P a s e).I t a l s o m i t i g a t e d t h e d e c l i n e i n d r y w e i g h t o f r o o t s a n d s h o o t s o f n a k e d o a t s,b u t h a d n o s i g n i f i c a n t e f f e c t o n c h l o r o p h y l l c o n t e n t,i n i t i a l f l u o r e s c e n c e(F o),m a x i m u m f l u o r e s c e n c e(F m),m a x i m u m p h o t o-c h e m i c a l q u a n t u m y i e l d[(F m-F o)/F m],a c t u a l p h o t o c h e m i c a l q u a n t u m y i e l d[Y(Ⅱ)],n o n-p h o t o c h e m i c a l q u e n c h i n g c o e f f i c i e n t(N P Q),u n r e g u l a t e d e n e r g y d i s s i p a t i o n q u a n t u m y i e l d[Y(N O)],r e g u l a t e d e n e r g y d i s s i p a t i o n q u a n t u m y i e l d[Y(N P Q)],r e l a t i v e e l e c t r o n t r a n s p o r t r a t e(E T R)a n d a c t i v i t i e s o f r i b u l o s e-1,5-b i s p h o p h a t e c a r b o x y l a s e(R u b i s c o)a n d f r u c t o s e-1,6-b i s p h o s p h a t e a l d o l a s e(F B A)i n l e a v e s.T h e a d d i t i o n o f H A p a r t i a l l y o r c o m p l e t e l y r e v e r s e d t h e e f f e c t s o f N a H S s p r a y i n g.ʌC o n c l u s i o nɔH2S a l l e v i a t e d t h e i n h i-b i t i o n o f p h o t o s y n t h e s i s a n d g r o w t h o f n a k e d o a t s u n d e r s a l i n e-a l k a l i s t r e s s a n d e n h a n c e d t h e a b i l i t y o f n a-k e d o a t s t o t o l e r a t e s a l i n e-a l k a l i s t r e s s b y a c c e l e r a t i n g x a n t h o p h y l l s c y c l e,i m p r o v i n g o p e n i n g d e g r e e o f p h o t o s y s t e mⅡr e a c t i o n c e n t e r a n d c o o r d i n a t i n g a c t i v i t i e s o f k e y e n z y m e s r e l a t e d t o t h e C a l v i n c y c l e.K e y w o r d s:n a k e d o a t;s a l i n e-a l k a l i s t r e s s;h y d r o g e n s u l f i d e;c h l o r o p h y l l f l u o r e s c e n c e p a r a m e t e r s;p h o-t o s y n t h e t i c p h y s i o l o g y土壤盐碱化是全球面临的生态环境问题[1],我国广泛分布着各种类型的盐碱地,面积高达9913万h m2[2],且多为盐化和碱化伴生的复合类型,对植物生长发育造成盐㊁碱双重胁迫[3]㊂盐碱混合胁迫下,植物遭受渗透胁迫[4]㊁离子毒害[3]和高p H胁迫[5],导致细胞生理缺水㊁营养失衡和活性氧代谢紊乱[3-4],光合作用和生长发育受阻,甚至死亡[6]㊂因此,探讨增强植物耐盐碱性的途径,对合理利用盐碱地资源,从而改善生态环境和保障农业可持续发展具有重要意义㊂硫化氢(H2S)是一种植物内源气体信号分子,广泛参与植物多种生理过程及植物对逆境响应的调控[7]㊂研究表明,H2S参与气孔运动[8]和开花调节[9],可通过促进叶绿素合成来提高冷胁迫下辣椒(C a p s i c u m a n n u u m)光合作用[10],减轻高温下白杨(P o p u l u s t r i c h o c a r p a)活性氧/氮诱导的细胞氧化损伤[11],还可通过提高抗氧化能力和脱落酸响应基因表达水平提高水稻(O r y z a s a t i v a)抗旱性[12]㊂H2S参与褪黑素诱导的黄瓜(C u c u m i s s a t i v u s)耐盐性提高[13]和盐胁迫下紫花苜蓿(M e d i c a g o s a t i v a)氧化还原平衡重建[14]㊂外源H2S处理可促进盐胁迫下的杨树(I p o m o e a a q u a t i c)细胞N a+外排,减弱K+外流[15]㊂H2S可通过提高H+-A T P酶活性和N a+/H+转运体基因的表达水平维持盐胁迫条件下大麦(H o r d e u m v u l g a r e)的N a+/K+平衡[16],还可通过增强茶树(C a m e l l i a s i n e n s i s)抗氧化酶活性来减轻盐胁迫造成的氧化损伤[17],缓解盐胁迫下茄子(S o l a n u m m e l o n g e n a)矿质元素含量下降和植株生长受抑程度[18]㊂H2S触发一氧化氮信号,从而改善盐胁迫下药用植物青钱柳(C y c l o c a r y a p a l i u r u s)的光合作用,提高其生物量的积累[19]㊂外源H2S处理还可通过上调机体抗氧化能力及促进光合作用㊁糖酵解和三羧酸循环㊁胁迫响应等相关蛋白基因的表达,对盐胁迫下的水稻幼苗产生保护作用[20]㊂然而,有关H2S增强植物耐盐性机理的探讨主要以单一N a C l胁迫下的植物幼苗为材料,迄今人们对盐碱混合胁迫下作物其他生育时期光合生理的H2S 调控效应知之甚少㊂裸燕麦(A v e n a n u d a)是我国西北和西南山区广泛种植的禾本科燕麦属杂粮作物,其籽粒蛋白质和不饱和脂肪酸含量高,富含黄酮㊁酚酸㊁皂甙和β-葡聚糖,具有降低血糖㊁血脂和清除自由基等保健作用[21]㊂裸燕麦耐盐抗旱,是盐碱地等质地较差土地的首选种植品种,盐碱胁迫成为其生长发育和产量㊁质量提升的重要限制因素[3]㊂喷施H2S供体N a H S能有效缓解盐碱胁迫造成的裸燕麦氧化伤64西北农林科技大学学报(自然科学版)第51卷Copyright©博看网. All Rights Reserved.害,以抽穗期喷施50μm o l/L N a H S的效果最优[22-23]㊂本试验模拟甘肃省中部裸燕麦种植地土壤盐碱含量和组成,以甘肃省农业科学研究院选育的高产抗旱裸燕麦新品种 定莜9号 为材料,采用盆栽砂培试验,在裸燕麦抽穗期叶面喷施N a H S或添加H2S生成抑制剂羟胺(h y d r o x y l a m i n e,H A),研究H2S对盐碱混合胁迫下裸燕麦叶片叶绿素含量㊁光合气体交换参数㊁叶绿素荧光参数㊁叶黄素循环和卡尔文循环关键酶的影响,揭示盐碱胁迫下H2S对裸燕麦光合生理的调控效应,为阐明H2S增强植物耐盐碱性机理提供理论依据㊂1材料与方法1.1供试材料试验于2021年4-8月在甘肃省陇东生物资源保护利用与生态修复重点实验室科技园进行㊂挑选大小一致的裸燕麦品种 定莜9号 饱满种子,于2021年4月5日播种在塑料盆(上口径26.5c m㊁高17.5c m)内珍珠岩基质中,每盆播40粒,常规管理㊂5月16日定苗,每盆保留15株壮苗,待3叶1心期后每周浇灌2次H o a g l a n d营养液,培养至抽穗期(6月21日)时进行试验处理㊂1.2试验设计配制50mm o l/L盐碱溶液(N a C l㊁N a2S O4㊁N a2C O3㊁N a H C O3物质的量比为12ʒ8ʒ1ʒ9),模拟甘肃省中部裸燕麦主产地土壤盐碱含量和组成㊂试验设7个处理,具体为:对照(C K):用蒸馏水浇灌根部,蒸馏水喷施叶面;盐碱胁迫(S A):用50 mm o l/L盐碱溶液浇灌根部,蒸馏水喷施叶面; S A+N a H S:用50mm o l/L盐碱溶液浇灌根部,50μm o l/L N a H S喷施叶面;S A+H A:用50mm o l/L 盐碱溶液+1mm o l/L H A溶液浇灌根部,蒸馏水喷施叶面;S A+H A+N a H S:用50mm o l/L盐碱溶液+1mm o l/L H A溶液浇灌根部,50μm o l/L N a H S喷施叶面;N a H S:用蒸馏水浇灌根部,50μm o l/L N a H S喷施叶面;H A:用1mm o l/L H A溶液浇灌根部,蒸馏水喷施叶面㊂试验中N a H S和H A浓度均由前期试验筛选确定[22-23]㊂根部浇灌每天每盆浇灌处理液500m L,叶面喷施只在处理的第1~3天早晚各喷1次,每次每盆喷施80m L,喷施液中添加体积分数0.01%的T w e e n-80以增加与叶面的黏附性㊂每盆作为1个重复,每处理8次重复,随机排列㊂处理后第14天测定各处理5个重复倒2叶的叶绿素含量㊁光合气体交换参数和叶绿素荧光参数㊂剪取倒2叶装入冻存管,用液氮速冻干冰包埋后,一部分邮寄至苏州帕诺米克生物医药科技有限公司检测叶黄素循环色素含量,一部分邮寄至上海普平生物科技有限公司用实时荧光定量P C R法(R T-q P C R)检测紫黄质脱环氧化酶(v i o l a x a n t h i n d e-e p o x i d a s e,V D E)和玉米黄质环氧化酶(z e a x a n t h i n e p o x i d a s e,Z E P)基因的相对表达量,另一部分于冰箱-80ħ保存,用于测定卡尔文循环关键酶活性㊂处理后第21天测定剩余3个重复的植株生长量㊂1.3测定项目与方法1.3.1叶绿素含量㊁光合气体交换参数和叶绿素荧光参数采用叶绿素仪(Y a x i n-1260型,北京雅欣理仪科技有限公司)于上午10:00-11:00测定叶片叶绿素含量,用S P A D值表征相对叶绿素含量㊂利用便携式光合仪(L I-6800p r o t a b l e p h o t o s y n t h e s i s s y s t e m,L I-C O R,美国)在上午09:00-11:30测定净光合速率(P n)㊁蒸腾速率(T r)㊁气孔导度(G s)㊁胞间C O2浓度(C i)等光合气体交换参数,计算气孔限制值(L s)和瞬时水分利用效率(WU E),具体计算公式为:L s=1-C i/C a;WU E=P n/T r㊂式中:C a为测量时空气C O2浓度㊂采用超便携调制叶绿素荧光仪(M I N I-P AM-Ⅱ型,德国H e i n z W a l z公司)于上午09:00-11:30测定叶绿素荧光参数㊂叶片暗适应30m i n后测定初始荧光(F o),饱和脉冲光后测定最大荧光(F m)㊂当F m回落接近F o时,施加一个饱和脉冲光,测定最大荧光(F m');关闭作用光打开远红光,测定最小荧光(F o')㊂运用仪器的W i n C o n t r o l-3软件自动计算P SⅡ最大光化学量子产量[(F m-F o)/F m]㊁P SⅡ实际光化学量子产量[Y(Ⅱ)]㊁光化学淬灭系数q L㊁非光化学淬灭系数(N P Q)㊁激发能中非调节性能量耗散量子产量[Y(N O)]㊁激发能中调节性能量耗散量子产量[Y(N P Q)]和相对电子传递速率(E T R)㊂以上测定重复5次,结果取平均值㊂1.3.2叶黄素循环色素含量和V D E㊁Z E P基因相对表达量叶黄素循环色素紫黄质(v i o l a x a n t h i n, V)㊁单环氧玉米黄质(a n t h e r a x a n t h i n,A)和玉米黄质(z e a x a n t h i n,Z)含量,均由苏州帕诺米克生物医药科技有限公司采用Q T R A P6500+型(S C I E X公司,美国)液相色谱串联质谱仪(L C-M S/M S)测定,以V+A+Z表示叶黄素循环库的大小,用(A+Z)/74第7期刘建新,等:硫化氢对盐碱胁迫下裸燕麦光合生理的影响Copyright©博看网. All Rights Reserved.(V+A+Z)表示叶黄素循环脱环化状态㊂V D E㊁Z E P基因相对表达量委托上海普平生物科技有限公司采用R T-q P C R法检测,以3-磷酸甘油醛脱氢酶(G A P D H)基因为内参基因㊂用T r i z o l 提取试剂(R N A i s o P l u s,T a K a R a,9108)提取m R-N A,采用5ˑ反转录盒(H i S c r i p tⅡQ S e l e c t R T S u p e r M i x f o r q P C R(+g D N A w i p e r),v a z y m e, R233-01)将m R N A反转录成c D N A㊂用2ˑq P C R M i x(T a q P r o H S U n i v e r s a l P r o b e M a s t e r M i x, v a z y m e,Q N113-01)进行q P C R检测㊂试验所用引物序列见表1㊂采用2-ΔΔC t法计算V D E和Z E P 的相对表达量㊂表1本研究所用引物信息T a b l e1I n f o r m a t i o n o f p r i m e r s u s e d i n t h i s s t u d y基因G e n e引物序列P r i m e r s e q u e n c eV D E F:5'-T C T G A T G T G G G A G A A T T T C C-3'R:5'-T C A T G C A A T T G G C A A T C A A A-3'Z E P F:5'-T A C A C T G G T A T C G C A G A T T T-3'R:5'-T G A A A C G C A T A C C A C T G C A T-3'G A P DH F:5'-A A C G A C C C C T T C A T C A C C A C-3'R:5'-G T T C C T G C A G C C A A A C A C A G-3' 1.3.3卡尔文循环关键酶活性取0.5g鲜叶冻存样品,用5.0m L预冷的100mm o l/L T r i s-H C l 缓冲液研磨匀浆,4ħ下15000r/m i n离心15m i n,上清液即为待测酶提取液㊂采用上海酶联生物科技有限公司的试剂盒按说明书方法,用M u l t i s k a n F c 型酶标仪(T h e r m o公司,美国)测定1,5-二磷酸核酮糖羧化酶(1,5-b i s p h o p h a t e r i b u l o s e c a r b o x y l a s e, R u b i s c o)㊁R u b i s c o活化酶(R u b i s c o a c t i v a s e, R C A)㊁G A P D H㊁果糖-1,6-二磷酸醛缩酶(F r u c t o s e-1,6-b i s p h o s p h a t e a l d o l a s e,F B A)㊁景天庚酮糖-1,7-二磷酸酶(s e d o h e p t u l o s e-1,7-b i s p h o s p h a t a s e,S B-P a s e)㊁转酮醇酶(t r a n s k e t o l a s e,T K)活性㊂重复测定5次,取平均值㊂1.3.4植株生长量从盆中取出裸燕麦植株㊁洗净,统计每盆株数,将根系和地上部分开,采用烘干法[24]分别测定根系和地上部干质量,计算根冠比和全株干质量㊂根冠比=根系干质量/地上部干质量;全株干质量=根系干质量+地上部干质量㊂1.4数据处理采用S P S S20.0软件进行单因素方差分析,运用D u n c a n s法比较处理间在0.05水平的差异显著性;采用M i c r o s o f t E x c e l2007软件绘图;试验结果以 平均值ʃ标准差 表示㊂2结果与分析2.1 H2S对盐碱胁迫下裸燕麦叶片叶绿素含量的影响如图1所示,与C K处理相比,S A和H A处理裸燕麦叶片的S P A D值无显著变化,但N a H S处理裸燕麦叶片S P A D值显著升高㊂与S A处理相比, S A+N a H S和S A+H A处理的裸燕麦叶片S P A D 值略有下降,但差异不显著;S A+N a H S+H A处理裸燕麦叶片S P A D值显著高于S A+N a H S和S A+ H A处理㊂结果表明,H2S对盐碱混合胁迫下裸燕麦叶片的叶绿素含量影响不大㊂图柱上不同小写字母表示处理间差异显著(P<0.05)㊂下图同D i f f e r e n t l o w e r c a s e l e t t e r s i n d i c a t e s i g n i f i c a n t d i f f e r e n c e sa m o n g t r e a t m e n t s(P<0.05).T h e s a m eb e l o w图1 H2S对盐碱胁迫下裸燕麦叶片S P A D值的影响F i g.1 E f f e c t o f H2S o n S P A D v a l u e i n l e a v e s o fn a k e d o a t u n d e r s a l i n e-a l k a l i s t r e s s2.2 H2S对盐碱胁迫下裸燕麦叶片光合气体交换参数的影响光合气体交换参数是反映植物光合作用状况的重要指标㊂由表2可知,与C K处理相比,S A处理裸燕麦叶片P n㊁G s㊁T r㊁L s和WU E显著降低,C i 显著提高㊂与S A处理相比,S A+N a H S处理裸燕麦叶片P n㊁G s㊁T r㊁L s和WU E显著提高,C i显著降低;S A+H A处理裸燕麦叶片L s和WU E显著降低,G s㊁C i和T r显著提高,P n有所下降,但差异不显著㊂S A+N a H S+H A处理裸燕麦叶片P n和L s显著低于S A+N a H S处理,但显著高于S A+ H A处理;G s与S A+N a H S和S A+H A处理差异不显著;C i显著高于S A+N a H S处理,却显著低于S A+H A处理;T r显著低于S A+N a H S处理,但与84西北农林科技大学学报(自然科学版)第51卷Copyright©博看网. All Rights Reserved.S A+H A 处理差异不显著;WU E 与S A+N a H S 处理无显著差异,却显著高于S A+H A 处理㊂与C K处理相比,N a H S 处理裸燕麦叶片的P n ㊁C i 和L s 无显著变化,G s ㊁T r 显著降低,WU E 却显著提高;H A 处理裸燕麦叶片的P n ㊁G s ㊁T r 和WU E 均显著降低,C i 和L s 无显著变化㊂结果表明,H 2S 参与裸燕麦光合气体交换调控,能够缓解盐碱混合胁迫下由非气孔因素引起的光合速率下降[25]㊂表2 H 2S 对盐碱胁迫下裸燕麦叶片光合气体交换参数的影响T a b l e 2 E f f e c t s o f H 2S o n p h o t o s y n t h e t i c g a s e x c h a n ge p a r a m e t e r s i n n a k e d o a t l e a v e s u n d e r s a l i n e -a l k a l i s t r e s s 处理T r e a t m e n t净光合速率/(μm o l ㊃m -2㊃s -1)P n 气孔导度/(mm o l ㊃m -2㊃s -1)G s胞间C O 2浓度/(μm o l ㊃m o l -1)C i蒸腾速率/(mm o l ㊃m -2㊃s -1)T r 气孔限制值L s 水分利用效率/(μm o l ㊃mm o l -1)WU E C K 6.49ʃ0.78a152.48ʃ8.97a305.35ʃ4.47e2.84ʃ0.06a0.23ʃ0.04a2.29ʃ0.30bS A1.36ʃ0.07d e 73.60ʃ1.32d364.28ʃ3.02b 1.63ʃ0.05e0.11ʃ0.01c0.83ʃ0.05cS A+N a H S5.62ʃ0.93b 90.69ʃ6.38b 334.90ʃ5.89d 2.26ʃ0.17b 0.15ʃ0.01b 2.48ʃ0.34b S A+HA0.77ʃ0.09e88.68ʃ0.76b 373.79ʃ2.02a1.99ʃ0.01c0.05ʃ0.01d 0.39ʃ0.04dS A+N a H S +HA4.72ʃ0.63c85.13ʃ3.91b347.76ʃ3.57c1.89ʃ0.07c d 0.11ʃ0.01c2.51ʃ0.42b N a H S 6.50ʃ0.49a57.70ʃ1.40e304.01ʃ2.56e 1.26ʃ0.02f0.23ʃ0.01a 5.14ʃ0.34aH A2.02ʃ0.08d76.21ʃ6.95c306.34ʃ2.43e1.76ʃ0.22d e0.21ʃ0.01a1.16ʃ0.15c注:同列数据后标不同字母表示处理间差异显著(P <0.05)㊂下表同㊂N o t e :D i f f e r e n t l e t t e r s i n s a m e c o l u m n i n d i c a t e s i g n i f i c a n t d i f f e r e n c e s a m o n g tr e a t m e n t s (P <0.05).T h e s a m e b e l o w.2.3 H 2S 对盐碱胁迫下裸燕麦叶片叶绿素荧光参数的影响叶绿素荧光参数可反映植物对光能吸收㊁转化㊁传递和分配的情况[26]㊂由表3可知,S A 处理裸燕麦叶片F o ㊁F m ㊁Y (Ⅱ)㊁N P Q 和E T R 均显著高于C K ,而(F m -F o )/F m ㊁q L ㊁Y (N O )和Y (N P Q )与C K 处理无显著差异㊂与S A 处理相比,S A+N a H S处理q L 显著提高,其他指标均无显著变化;S A+H A 处理q L 和E T R 显著提高,其他指标变化不显著㊂与S A+N a H S 处理相比,S A+N a H S +H A 处理除E T R 显著提高外,其他指标均无显著变化;与S A+H A 处理相比,S A+N a H S+H A 处理N P Q和E T R 显著降低,其他指标变化不显著㊂与C K 相比,N a H S 处理裸燕麦叶片F m 和N P Q 显著提高,Y (N O )显著降低,其他荧光参数均无显著变化;H A 处理除N P Q 显著降低外,其他指标均无显著变化㊂结果表明,盐碱胁迫导致裸燕麦叶片P S Ⅱ反应中心遭受破坏,外源H 2S 可增加P S Ⅱ天线色素吸收光能用于光化学反应的份额[26-27]㊂表3 H 2S 对盐碱胁迫下裸燕麦叶片叶绿素荧光参数的影响T a b l e 3 E f f e c t s o f H 2S o n c h l o r o p h yl l f l u o r e s c e n c e p a r a m e t e r s i n n a k e d o a t l e a v e s u n d e r s a l i n e -a l k a l i s t r e s s 处理T r e a t m e n tF oF m(F m -F o )/F mY (Ⅱ)qL C K 342.0ʃ25.9c1123.3ʃ62.7b0.695ʃ0.022a 0.708ʃ0.024b1.253ʃ0.116bS A403.7ʃ8.7a b1368.3ʃ17.2a0.721ʃ0.032a 0.755ʃ0.011a1.220ʃ0.153bS A+N a H S 434.7ʃ39.9a1426.7ʃ42.4a0.713ʃ0.015a0.761ʃ0.013a1.609ʃ0.018aS A+H A381.3ʃ10.0b c 1466.3ʃ82.6a0.702ʃ0.045a0.728ʃ0.012a b 1.571ʃ0.186aS A+N a H S +HA404.7ʃ40.6a b1377.3ʃ24.9a0.713ʃ0.012a0.757ʃ0.014a1.487ʃ0.252a b N a H S 380.0ʃ29.5b c 1407.7ʃ128.3a0.728ʃ0.044a0.736ʃ0.029a b 1.387ʃ0.066a b H A 347.3ʃ14.8c1149.3ʃ170.7b 0.694ʃ0.034a0.724ʃ0.043a b 1.295ʃ0.066b处理T r e a t m e n tN P QY (N O )Y (N P Q )E T RC K 0.198ʃ0.021c0.248ʃ0.019a b0.049ʃ0.007a b1.800ʃ0.200d eS A 0.360ʃ0.044a b 0.216ʃ0.016b c 0.070ʃ0.002a2.400ʃ0.173b c S A+N a H S 0.324ʃ0.023b 0.185ʃ0.003c0.060ʃ0.004a2.100ʃ0.346c dS A+H A0.417ʃ0.024a0.197ʃ0.018c0.074ʃ0.010a3.643ʃ0.309aS A+N a H S +HA0.340ʃ0.036b 0.207ʃ0.031b c 0.064ʃ0.030a2.833ʃ0.252b N a H S 0.334ʃ0.068b 0.199ʃ0.031c0.065ʃ0.006a1.867ʃ0.306d eH A 0.116ʃ0.035d0.267ʃ0.040a0.030ʃ0.010b1.400ʃ0.200e2.4 H 2S 对盐碱胁迫下裸燕麦叶片叶黄素循环色素含量和相关基因相对表达量的影响叶黄素循环是类囊体膜上类胡萝卜色素V ㊁A和Z 相互转化的现象,(A+Z )/(V+A+Z )与叶绿体过剩光能耗散密切相关[28]㊂从图2可知,与C K处理相比,S A 处理显著提高了裸燕麦叶片Z ㊁V+A+Z 含量及(A+Z )/(V+A+Z ),而V 和A 含量无显著变化㊂与S A 处理相比,S A+N a H S 处理不94第7期刘建新,等:硫化氢对盐碱胁迫下裸燕麦光合生理的影响Copyright ©博看网. All Rights Reserved.同程度降低了V ㊁A ㊁Z 和V+A+Z 含量及(A+Z )/(V+A+Z ),其中Z 和V+A+Z 含量的下降达显著水平;S A+H A 处理对V ㊁A 和V+A+Z 含量的影响不显著,但显著降低了Z 含量及(A+Z )/(V+A+Z )㊂与S A+N a H S 处理相比,S A+N a H S+H A 处理显著提高了V ㊁A 和V+A+Z 含量,显著降低了(A+Z )/(V+A+Z ),而Z 含量无显著变化;与S A+H A 处理相比,S A+N a H S +H A 处理V 和V+A+Z 含量显著提高,而A ㊁Z 含量和(A+Z )/(V+A+Z )的变化不显著㊂与C K 处理相比,N a H S 处理显著提高了V ㊁Z 和V+A+Z 含量,而A 含量和(A+Z )/(V+A+Z )的变化不显著;H A 处理对V ㊁A ㊁Z 和(V+A+Z )含量及(A+Z )/(V+A+Z )无显著影响㊂图2 H 2S 对盐碱胁迫下裸燕麦叶片叶黄素循环的影响F i g .2 E f f e c t s o f H 2S o n x a n t h o p h y l l c yc l e i n n a k ed o a t le a v e s u n d e r s a l i n e -a l k a l i s t r e s s V D E 是叶黄素循环中催化V 经A 转化为Z 的关键酶,而Z E P 是催化这一反应逆反应的酶[28]㊂由图3可知,S A 处理裸燕麦叶片V D E 和Z E P 基因相对表达量均显著高于C K 处理㊂与S A 处理相比,S A+N a H S 和S A+H A 处理V D E 和Z E P 的相对表达量均显著提高;与S A+N a H S 处理相比,S A+N a H S +H A 处理显著降低了V D E 的相对表达量,但显著提高了Z E P 的相对表达量;与S A+H A 处理相比,S A+N a H S +HA 处理V D E 的相对表达量降低,但差异不显著,而Z E P 相对表达量显著提高㊂与C K 处理相比,N a H S 和HA 处理均显著提高了V D E 和Z E P 相对表达水平㊂结果表明,5西北农林科技大学学报(自然科学版)第51卷Copyright ©博看网. All Rights Reserved.H 2S 参与调控正常和盐碱胁迫条件下裸燕麦依赖于类囊体膜上叶黄素循环的过剩光能的耗散㊂图3 H 2S 对盐碱胁迫下裸燕麦叶片V D E 和Z E P 基因相对表达量的影响F i g .3 E f f e c t s o f H 2S o n r e l a t i v e e x pr e s s i o n l e v e l s o f V D E a n d Z E P i n n a k e d o a t l e a v e s u n d e r s a l i n e -a l k a l i s t r e s s2.5 H 2S 对盐碱胁迫下裸燕麦叶片卡尔文循环关键酶活性的影响卡尔文循环是机体利用光反应形成的三磷酸腺苷(A T P )和还原型辅酶Ⅱ(N A D P H )固定C O 2的过程,有许多酶参与反应,其中R u b i s c o ㊁R C A ㊁G A P D H ㊁F B A ㊁S B P a s e 和T K 是关键酶[29]㊂从表4可知,与C K 处理相比,S A 处理裸燕麦叶片R u b i -s c o ㊁R C A ㊁G A P D H 和S B P a s e 活性显著升高,F B A 活性显著下降,T K 活性无显著变化㊂与S A 处理相比,S A+N a H S 处理裸燕麦叶片T K 活性显著提高了28.58%,R C A ㊁G A P D H 和S B P a s e 活性分别显著降低了21.59%,53.78%和29.78%,而R u b i s c o 和F B A 活性变化不显著;S A+H A 处理F B A 和T K 活性分别显著提高了12.90%和32.81%,R C A 和G A P D H 活性分别显著降低了10.23%和12.70%,而R u b i s c o 和S B P a s e 活性无显著变化㊂与S A+N a H S 处理相比,S A+N a H S +H A 处理显著提高了R C A 和G A P D H 活性,但显著降低了T K活性,而R u b i s c o ㊁F B A 和S B P a s e 活性变化不显著㊂与S A+H A 处理相比,S A +N a H S+H A 处理G A P D H ㊁F B A ㊁S B P a s e 和T K 活性均显著降低,而R u b i s c o 和R C A 活性变化不显著㊂与C K 处理相比,N a H S 处理显著提高了R u b i s c o 和S B P a s e 活性,显著降低了G A P D H 和F B A 活性,而R C A 和T K 活性无显著变化;HA 处理显著提高了G A P D H和T K 活性,显著降低了R u b i s c o ㊁R C A 和F B A 活性,而S B P a s e 活性的变化无统计学意义㊂结果表明,H 2S 参与盐碱胁迫下裸燕麦叶片卡尔文循环关键酶活性的调控㊂表4 H 2S 对盐碱胁迫下裸燕麦叶片卡尔文循环关键酶活性的影响T a b l e 4 E f f e c t s o f H 2S o n k e y e n z y m e a c t i v i t i e s o f t h e C a l v i n c yc l e i n n a k ed o a t le a v e s u n d e r s a l i n e -a l k a l i s t r e s s U /g处理T r e a t m e n tR u b i s c oR C AG A P D HF B AS B P a s eT KC K 27.52ʃ2.12c1.62ʃ0.11b2.54ʃ0.34c1.48ʃ0.05a1.44ʃ0.03c21.07ʃ1.30cS A32.23ʃ2.12b 1.76ʃ0.09a3.70ʃ0.20a0.93ʃ0.03c d 2.25ʃ0.18a 22.43ʃ1.79b c S A+N a H S 32.90ʃ0.78b 1.38ʃ0.01c1.71ʃ0.07d 0.90ʃ0.03d1.58ʃ0.05b c 28.84ʃ1.47a S A+H A31.43ʃ1.87b1.58ʃ0.07b 3.23ʃ0.34b 1.05ʃ0.00b2.32ʃ0.19a29.79ʃ1.08aS A+N a H S +H A32.41ʃ2.15b1.53ʃ0.06b2.36ʃ0.32c0.92ʃ0.01c d 1.63ʃ0.12b 22.18ʃ1.70b c N a H S 36.24ʃ2.10a1.52ʃ0.05b1.28ʃ0.17e1.02ʃ0.03b c1.66ʃ0.06b22.65ʃ1.27b c HA 24.65ʃ1.70d 1.33ʃ0.07c3.10ʃ0.25b0.94ʃ0.03c1.53ʃ0.06b c24.09ʃ1.16b注:R u b i s c o .1,5-二磷酸核酮糖羧化酶;R C A.R u b i s c o 活化酶;G A P D H.3-磷酸甘油醛脱氢酶;F B A.果糖-1,6-二磷酸醛缩酶;S B P a s e .景天庚酮糖-1,7-二磷酸酶;T K.转酮醇酶㊂N o t e :R u b i s c o .1,5-b i s p h o p h a t e r i b u l o s e c a r b o x y l a s e ;R C A.R u b i s c o a c t i v a s e ;G A P D H.3-p h o s p h a t e g l y c e r a l d e h y d e d e h y d r o ge n a s e ;F B A.F r u c t o s e -1,6-b i s p h o s p h a t e a l d o l a s e ;S B P a s e .S e d o h e p t u l o s e -1,7-b i s p h o s ph a t a s e ;T K.T r a n s k e t o l a s e .2.6 H 2S 对盐碱胁迫下裸燕麦植株生长的影响从表5可知,与C K 处理相比,S A 处理裸燕麦植株根系㊁地上部㊁全株干质量及根冠比分别显著降低了40.86%,26.21%,27.24%和17.28%㊂与S A 处理相比,S A+N a H S 处理裸燕麦根系㊁地上部㊁全株干质量及根冠比分别显著提高了32.73%,15.31%,16.14%和11.64%;S A+H A 处理显著降低了根系干质量和根冠比,而地上部和全株干质量变化不显著㊂与S A +N a H S 处理相比,S A+N a H S +H A 处理显著提高了裸燕麦根系干质量和根冠比,而地上部和全株干质量无显著变化;与S A+H A 处理相比,S A+N a H S +H A 处理裸燕麦根系㊁地上部㊁全株干质量和根冠比均显著提高㊂与C K 处理相比,N a H S 处理显著提高了裸燕麦植株根系干质量和根冠比,而地上部和全株干质量变化不显著;H A处理显著降低了根系干质量和根冠比,而地上部和15第7期刘建新,等:硫化氢对盐碱胁迫下裸燕麦光合生理的影响Copyright ©博看网. All Rights Reserved.全株干质量变化不显著㊂结果表明,外源H 2S 能够缓解盐碱胁迫对裸燕麦生长的抑制作用㊂表5 H 2S 对盐碱胁迫下裸燕麦植株生长的影响T a b l e 5 E f f e c t s o f H 2S o n g r o w t h o f n a k e d o a t p l a n t s u n d e r s a l t -a l k a l i s t r e s s处理T r e a t m e n t根系干质量/(g㊃株-1)R o o t d r y w e i g h t 地上部干质量/(g㊃株-1)S h o o t d r y w e i g h t 全株干质量/(g㊃株-1)T o t a l d r y w e i g h t 根冠比R o o t /S h o o tC K 0.093ʃ0.014b1.133ʃ0.101a1.226ʃ0.115a0.081ʃ0.005bS A 0.055ʃ0.001e0.836ʃ0.056c0.892ʃ0.056c0.067ʃ0.004dS A+N a H S 0.073ʃ0.005d 0.964ʃ0.015b 1.036ʃ0.015b 0.075ʃ0.006b c S A+H A0.035ʃ0.004f0.827ʃ0.005c0.862ʃ0.002c0.042ʃ0.005eS A+N a H S +HA0.084ʃ0.006b c 0.912ʃ0.017b 0.996ʃ0.015b 0.093ʃ0.007aN a H S 0.105ʃ0.006a1.128ʃ0.039a 1.233ʃ0.042a 0.093ʃ0.005aH A 0.079ʃ0.008c d1.132ʃ0.017a1.212ʃ0.025a0.070ʃ0.006c d3 讨 论3.1 H 2S 对盐碱胁迫下裸燕麦叶绿素含量和光合气体交换的影响光合作用是与植物生长发育密切关联的重要生理过程,叶绿素参与光合作用光能的吸收㊁传递与转化,光合速率和有机物积累都与叶绿素含量密切相关[6]㊂干旱胁迫下,H 2S 可引起拟南芥叶片气孔关闭和C i 升高,提高光合速率[30]㊂镉胁迫下,外源H 2S 能改善大白菜(B r a s s i c a p e k i n e n s i s )光合性能,促进植株生长[31]㊂而目前有关盐碱混合胁迫下H 2S 对植物光合作用的调控效应尚未见报道㊂本研究结果显示,S A 和S A+N a H S 处理裸燕麦叶片的叶绿素含量并无显著变化,这与郑州元等[32]对番茄(L y c o pe r s i c o n e s c u l e n t u m )的研究结果不同,其原因可能与盐碱类型㊁胁迫强度和作物耐盐碱能力不同有关㊂结果说明,盐碱胁迫及H 2S 并没有改变裸燕麦叶绿素合成和分解相关酶的活性㊂然而,喷施H 2S 显著缓解了盐碱混合胁迫下裸燕麦叶片P n ㊁G s ㊁T r ㊁L s ㊁WU E 的下降和C i 的提高;添加H 2S 生成抑制剂后H 2S 的上述作用受到部分逆转㊂植物P n 的变化受气孔因素和非气孔因素影响,若G s 和C i 同时降低,说明P n 下降由气孔因素引起;若G s 下降而C i 升高,说明P n 降低主要由非气孔因素所致[25]㊂由此可知,本研究盐碱混合胁迫下祼燕麦P n 的下降是由非气孔因素所致,而H 2S 可能主要通过增强吸水和蒸腾耗水的利用效能来提高光合底物传导功能,进而缓解盐碱胁迫下裸燕麦非气孔因素引起的光合速率下降㊂这与H 2S 能提高受旱烤烟(N i c o t i a n a t a b a c u m )[26]和N a C l 胁迫下番茄[32]光合速率的结果一致㊂3.2 H 2S 对盐碱胁迫下裸燕麦光化学效率和能量耗散的影响叶绿素荧光参数可反映光合机构的运行状态,F o 和F m 分别是P S Ⅱ反应中心全部开放和完全关闭时的荧光水平;(F m -F o )/F m 和Y (Ⅱ)分别反映P S Ⅱ反应中心的原初光能转化效率和实际光能捕获效率;F o 上升表明P S Ⅱ反应中心受到破坏或失活,(F m -F o )/F m 下降是光抑制的特征[26]㊂q L 表示P S Ⅱ反应中心的开放程度,反映P S Ⅱ天线色素吸收的光能用于光化学电子传递的份额;N P Q 反映P S Ⅱ天线色素吸收的光能不能用于光合电子传递,而以热的形式耗散掉,是光合机构的自我保护机制[27]㊂Y (N O )反映非调节性热耗散和荧光发射量子产量水平;Y (N P Q )代表依赖Δp H 和玉米黄质的非光化学荧光淬灭量子产量高低[33]㊂本试验结果显示,盐碱混合胁迫导致裸燕麦叶片F o ㊁F m ㊁Y (Ⅱ)㊁N P Q 和E T R 显著提高,而(F m -F o )/F m ㊁qL ㊁Y (N O )和Y (N P Q )无显著改变,表明盐碱胁迫造成了裸燕麦叶片P S Ⅱ反应中心的破坏或可逆失活(F o 升高),但通过增加天线热耗散(N P Q 升高)㊁提高原初光能捕获效率[Y (Ⅱ)升高]和加快电子传递(E T R 升高),并未使P S Ⅱ反应中心的开放程度受到影响(q L 未变),未产生光抑制((F m -F o )/F m 未变)㊂盐碱混合胁迫下,喷施H 2S 显著提高了裸燕麦q L ,增添H 2S 生成抑制剂后仅E T R 显著提高,而其余荧光参数均无显著变化,说明外源H 2S可通过提高P S Ⅱ反应中心的开放程度,增加盐碱胁迫下裸燕麦叶片P S Ⅱ天线色素所吸收光能用于光化学电子传递的份额,从而改善P S Ⅱ光化学活性和运转效率㊂为了进一步解析H 2S 提高盐碱胁迫下裸燕麦叶片P S Ⅱ反应中心开放程度的机制,本试验检测了叶黄素循环相关色素含量和基因表达情况㊂结果表明,喷施H 2S 显著降低了盐碱胁迫下裸燕麦叶片A ㊁Z 和V+A+Z 含量,增添H 2S 生成抑制剂不同程度提高了V ㊁A ㊁Z 和V+A+Z 含量,却显著降低了(A+Z )/(V+A+Z );喷施H 2S 使盐碱胁迫下裸燕麦叶片V D E 和Z E P 基因相对表达水平显25西北农林科技大学学报(自然科学版)第51卷Copyright ©博看网. All Rights Reserved.著提高,增添H2S生成抑制剂后V D E相对表达水平显著下降,Z E P相对表达水平显著提高㊂V D E 和Z E P催化叶黄素循环中V㊁A和Z的相互转化,且Z能够直接清除激发态叶绿素(1C h l)[34]或通过结合色素蛋白(如C P26)引起蛋白构象改变而形成耗散中心耗散光能[35]㊂本研究表明,H2S可能通过加快叶黄素循环运转而非提高玉米黄质净含量耗散光能,从而维持盐碱胁迫下裸燕麦P SⅡ反应中心较高的开放程度,提高光化学活性,保护光系统反应中心免受过多能量的损伤㊂然而,植物对光能的吸收㊁传递和转化过程涉及光合链上如P SⅠ㊁P SⅡ和C y t b6f等多个电子传递体,而H2S在此过程中具体如何发挥调控作用尚需进一步深入探究㊂3.3 H2S对盐碱胁迫下裸燕麦卡尔文循环关键酶活性的影响植物对C O2的同化能力不仅与光合电子传递有关,还与叶绿体基质中卡尔文循环相关酶活性密切相关㊂R u b i s c o是催化1,5-二磷酸核酮糖(R u B P)固定C O2的关键酶,其只有经活化酶(R C A)活化后才具有催化活性[36]㊂R u B P再生过程相关酶G A P D H㊁F B A㊁S B P a s e和T K同样控制着C O2的固定[37]㊂因此,R u b i s c o㊁R C A㊁G A P D H㊁F B A㊁S B P a s e和T K是卡尔文循环的关键酶㊂本试验结果发现,盐碱混合胁迫显著提高裸燕麦叶片R u b i s c o㊁R C A㊁G A P D H和S B P a s e活性,但显著降低F B A活性,而T K活性保持不变㊂喷施H2S可显著提高盐碱胁迫下裸燕麦叶片T K活性,降低R C A㊁G A P D H和S B P a s e活性,而R u b i s c o和F B A 活性无显著变化;增添H2S生成抑制剂可显著提高R C A和G A P D H活性,显著降低T K活性,而R u b i-s c o㊁F B A和S B P a s e活性变化不显著㊂结果表明,裸燕麦可能通过改变卡尔文循环关键酶活性来协调光反应和碳同化,以适应盐碱胁迫,而盐碱胁迫下H2S对卡尔文循环关键酶活性存在正负两种调控效应,推测H2S可能通过正调控T K和负调控G A P-D H来改变R u B P再生途径,从而加速卡尔文循环运转,促进光合磷酸化和N A D P H的合成利用,提高盐碱胁迫下裸燕麦的光合速率㊂这与低温弱光下H2S参与黄瓜碳同化酶活性调控[38]类似㊂H2S调控卡尔文循环酶活性的机理可能与其参与酶基因表达调节[20]或通过对酶蛋白硫巯基化修饰改变酶的活性[39]有关,但调控的具体机制尚待深入探究㊂3.4 H2S对盐碱胁迫下裸燕麦植株生长的影响植株生长量是盐碱胁迫下体内生理生化过程改变的综合体现,也是植物对盐碱胁迫耐受能力的直接反映㊂本试验结果显示,H2S可显著缓解盐碱胁迫下裸燕麦植株生长量的下降,这与外源H2S能够减轻N a C l胁迫对番茄幼苗生长受抑程度的结果[32]一致,表明H2S能够增强裸燕麦对盐碱胁迫的耐受能力㊂加强渗透调节和启动活性氧防御机制是植物在盐碱胁迫下应对生理缺水和氧化应激从而维持光合作用正常进行的重要策略[4]㊂H2S缓解盐碱胁迫下裸燕麦生长受抑的机理,一方面可能与它能够促进渗透调节物质积累和降低活性氧对细胞的氧化伤害有关[22-23];另一方面可能是H2S通过改变叶片类胡萝卜素组成[40],调控光系统反应中心和光合碳同化酶活性,提高裸燕麦光合作用所致㊂揭示H2S对盐碱胁迫下植物光合生理调控的分子机制将是今后研究的重点㊂4结论H2S对盐碱胁迫下裸燕麦叶片叶绿素含量的影响不大,但H2S可通过促进叶黄素循环运转加强过剩光能的耗散,提高P SⅡ反应中心的开放程度,协助调节光合碳同化关键酶活性,并增强蒸腾耗水利用能力和提高光合底物传导功能,缓解盐碱胁迫下裸燕麦非气孔因素引起的光合速率下降和生长受抑程度,从而增强裸燕麦耐受盐碱胁迫的能力㊂志谢:感谢陇东学院生命科学与技术学院2018级生物制药班祝宣林和2018级生物科学班杨玫同学在指标检测和数据分析中所做的大量工作㊂[参考文献][1]J i a X M,W a n g H,S v e t l a S,e t a l.C o m p a r a t i v e p h y s i o l o g i c a l r e-s p o n s e s a n d a d a p t i v e s t r a t e g i e s o f a p p l e M a l u s h a l l i a n a t o s a l t,a l k a l i a n d s a l i n e-a l k a l i s t r e s s[J].S c i e n t i a H o r t i c u l t u r a e, 2019,245:154-162.[2]孙现军,姜奇彦,胡正,等.水稻资源全生育期耐盐性鉴定筛选[J].作物学报,2019,45(11):1656-1663.S u n X J,J i a n g Q Y,H u Z,e t a l.S c r e e n i n g a n d i d e n t i f i c a t i o n o f s a l t-t o l e r a n t r i c e g e r m p l a s m i n w h o l e g r o w t h p e r i o d[J].A c t aA g r o n o m i c a S i n i c a,2019,45(11):1656-1663.[3]刘建新,王金成,王瑞娟,等.混合盐碱胁迫对燕麦幼苗矿质离子吸收和光合特性的影响[J].干旱地区农业研究,2017,35(1):178-184,239.L i u J X,W a n g J C,W a n g R J,e t a l.E f f e c t o f c o m p l e x s a l i n e-a l-k a l i s t r e s s o n t h e m i n e r a l i o n s a b s o r p t i o n a n d p h o t o s y n t h e t i cc h a r a c t e r i s t i c s o f o a t s e ed l i n g s[J].A g r i c u l t u r a l Re s e a r c h i nt h e A r i d A r e a s,2017,35(1):178-184,239.[4]闫永庆,王文杰,朱虹,等.混合盐碱胁迫对青山杨渗透调节35第7期刘建新,等:硫化氢对盐碱胁迫下裸燕麦光合生理的影响Copyright©博看网. All Rights Reserved.。
硫化氢对盐胁迫下达乌里胡枝子生长和抗氧化系统的影响

第32卷第3期V o l.32N o.3草地学报A C T A A G R E S T I A S I N I C A2024年3月M a r.2024d o i:10.11733/j.i s s n.1007-0435.2024.03.013引用格式:张亚慧,马春,张晓燕,等.硫化氢对盐胁迫下达乌里胡枝子生长和抗氧化系统的影响[J].草地学报,2024,32(3):772-780Z HA N G Y a-h u i,MAC h u n,Z HA N G X i a o-y a n,e t a l.E f f e c t so fH y d r o g e nS u l f i d eo nt h eG r o w t ha n dA n t i o x i d a n t S y s t e mo f L e s p e d e z a d a v u r i c a u n d e r S a l t S t r e s s[J].A c t aA g r e s t i aS i n i c a,2024,32(3):772-780硫化氢对盐胁迫下达乌里胡枝子生长和抗氧化系统的影响张亚慧1,2,马春1,2,张晓燕1,2,张田1,2,王开喜1,2,赵祥1,2,朱慧森1,2,王永新1,2* (1.山西农业大学草业学院,山西太谷030801;2.草地生态保护与乡土草种质创新山西省重点实验室,山西太谷030801)摘要:为探讨外源硫化氢对盐胁迫下达乌里胡枝子(L e s p e d e z a d a v u r i c a)幼苗生长和抗氧化系统的影响,本试验以盐胁迫下的达乌里胡枝子为研究对象,通过施加不同浓度的外源硫化氢,并在盐胁迫第0,10,20,30d分别测定幼苗的生长特性和抗氧化系统指标㊂结果表明:施加外源硫化氢缓减了盐胁迫对达乌里胡枝子幼苗生长的抑制作用,提高了盐胁迫下达乌里胡枝子幼苗抗氧化酶活性以及抗坏血酸和谷胱甘肽含量,增加了叶片相对含水量,降低了叶片相对电导率以及丙二醛的含量㊂综上所述,施加外源硫化氢在一定程度上提高了达乌里胡枝子幼苗叶片的抗氧化酶活性,延缓了膜脂过氧化的发生,因此增强了达乌里胡枝子幼苗对盐的耐受性㊂关键词:达乌里胡枝子;硫化氢;盐胁迫;抗氧化系统中图分类号:S541.5文献标识码:A 文章编号:1007-0435(2024)03-0772-09E f f e c t s o fH y d r o g e nS u l f i d e o n t h eG r o w t ha n dA n t i o x i d a n t S y s t e mo fL e s p e d e z a d a v u r i c a u n d e r S a l t S t r e s sZ H A N G Y a-h u i1,2,MA C h u n1,2,Z H A N G X i a o-y a n1,2,Z H A N G T i a n1,2,WA N G K a i-x i1,2,Z H A O X i a n g1,2,Z HU H u i-s e n1,2,WA N G Y o n g-x i n1,2*(1.C o l l e g e o fG r a s s l a n dS c i e n c e,S h a n x iA g r i c u l t u r a lU n i v e r s i t y,T a i g u,S h a n x i P r o v i n c e030801,C h i n a;2.S h a n x iK e y L a b o r a t o r y o fG r a s s l a n dE c o l o g i c a l P r o t e c t i o na n dN a t i v eG r a s sG e r m p l a s mI n n o v a t i o n,T a i g u,S h a n x iP r o v i n c e030801,C h i n a)A b s t r a c t:I no r d e r t o i n v e s t i g a t e t h ee f f e c t so f e x o g e n o u sh y d r o g e ns u l f i d eo nt h e g r o w t ha n da n t i o x i d a n t s y s t e mo f L e s p e d e z a d a v u r i c a s e e d l i n g su n d e r s a l t s t r e s s,d i f f e r e n t c o n c e n t r a t i o n so f e x o g e n o u sh y d r o g e n s u l f i d ew e r e a d d e d t o L e s p e d e z a d a v u r i c a s e e d l i n g s,a n d t h e g r o w t h c h a r a c t e r i s t i c s a n d a n t i o x i d a n t s y s t e m i n d e x e s a t t h e0,10,20a n d30du n d e r s a l t s t r e s sw e r em e a s u r e d.T h e r e s u l t s s h o w e d t h a t t h e a d d i t i o no f e x o g e n o u s h y d r o g e ns u l f i d ew e a k e n e dt h e i n h i b i t i o no f s a l t s t r e s so nt h e g r o w t ho f L e s p e d e z ad a v u r i c a s e e d l i n g s,i m p r o v e d t h e a c t i v i t y o f a n t i o x i d a n t e n z y m eo f L e s p e d e z ad a v u r i c a s e e d l i n g su n d e r s a l t s t r e s s, i n c r e a s e d t h e c o n t e n t o f a s c o r b i c a c i d,g l u t a t h i o n e o f L e s p e d e z a d a v u r i c a s e e d l i n g s a n d r e l a t i v ew a t e r c o n-t e n t i n l e a v e s u n d e r s a l t s t r e s s,a n dd e c r e a s e d t h e r e l a t i v e e l e c t r o l y t e l e a k a g e a n dm a l o n d i a l d e h y d e c o n t e n t i n l e a v e s.T o s u mu p,t h e a d d i t i o no f e x o g e n o u sh y d r o g e ns u l f i d e t os o m e e x t e n t i n c r e a s e d t h e a c t i v i t y o f a n t i o x i d a n t e n z y m e i n t h e l e a v e s o f L e s p e d e z ad a v u r i c a s e e d l i n g s,r e t a r d e d t h eo c c u r r e n c eo f l i p i d p e r o x i-d a t i o n,a n d t h e n i m p r o v e d t h e s u r v i v a b i l i t y o f L e s p e d e z a d a v u r i c a s e e d l i n g s.K e y w o r d s:L e s p e d e z a d a v u r i c a;H y d r o g e n s u l f i d e;S a l t s t r e s s;A n t i o x i d a n t s y s t e m收稿日期:2023-10-25;修回日期:2023-12-05基金项目:山西省重点研发计划项目(201903D211012);山西省牧草产业技术体系项目(2023C Y J S T X11-11)资助作者简介:张亚慧(1998-),女,汉族,山西大同人,硕士研究生,主要从事饲草生产与利用,E-m a i l:z h a n g y a h u i202105@163.c o m;*通信作者A u t h o r f o r c o r r e s p o n d e n c e,E-m a i l:y o n g x w a n g@126.c o m第3期张亚慧等:硫化氢对盐胁迫下达乌里胡枝子生长和抗氧化系统的影响土壤盐渍化是限制植物生长的主要环境因素,一般广泛存在于我国华北㊁西北㊁东北等地区[1],与健康土壤相比,盐渍化土壤易使植物缺水萎蔫甚至死亡,这严重限制了我国农业生产和社会发展[2]㊂达乌里胡枝子(L e s p e d e z a d a v u r i c a)是豆科(L e g u m i n o s a e)胡枝子属(L e s p e d e z a)的多年生半灌木,是我国一种优质饲用植物,具有耐薄瘠㊁生物量高㊁根系发达等良好特性[3]㊂同时,达乌里胡枝子是我国西北黄土高原地区的一种重要的水土保持植物,因此,在山西等华北盐渍化地区,挖掘耐盐达乌里胡枝子种质资源和选育耐盐品种对保持当地水土方面有重要研究意义㊂然而达乌里胡枝子因种子较小㊁野生种发芽率较低,栽培初期产量低等因素[4-6],造成了达乌里胡枝子扩繁和培育存在一定困难㊂在生长环境难以改变以及扩繁困难等情况下通过施加外源物质提高达乌里胡枝子耐盐性就尤为重要[7]㊂目前,通过外源物质处理提升植物抗盐胁迫能力主要包括两个方面:一是植物非内源物质的外源补充,如外源补充硒㊁海藻糖及纳米金属粒子等[8-10];二是植物内源物质的外源补充,如植物激素脱落酸及水杨酸等[11-12]㊁内源过氧化氢及抗坏血酸等[13-14]以及内源气体信号分子一氧化氮(N O)㊁一氧化碳(C O)及硫化氢(H2S)等[15]㊂硫化氢(H2S)又称氢硫酸,是继C O和N O气体信号分子后,于动植物体内发现的第3种气体信号传导分子[16]㊂目前,人们普遍认为硫化氢是一种自然界抗氧化能力较强的信号调节物质,同时通过向植物叶片喷施硫化氢供体N a H S可对逆境下植物生长起到保护作用[17-18]㊂此外,有研究表明外源施加硫化氢能够有效促进种子萌发[19]㊁调节气孔运动[20]㊁增强光合作用[21]㊁延缓植物衰老[22]㊁增强抗旱能力[23]㊁缓解高温胁迫[24]以及抵抗盐胁迫[25]㊂本研究以盐胁迫下的达乌里胡枝子为研究对象,通过分析外源硫化氢对盐胁迫下达乌里胡枝子幼苗的生长和抗氧化系统的影响,探究外源硫化氢对盐胁迫下达乌里胡枝子幼苗的缓解作用,为提高达乌里胡枝子幼苗抗盐能力,增强达乌里胡枝子品质和产量,更高效地在盐渍化土地上栽培达乌里胡枝子提供理论依据㊂1材料与方法1.1试验材料与植物生长条件试验材料为山西农业大学草业学院提供的 晋农1号 达乌里胡枝子,千粒重2.2g㊂本试验在山西农业大学草业学院日光温室采用沙培法栽培幼苗㊂采用内径23.5c m,深14c m 的塑料盆装沙和蛭石(沙ʒ蛭石=3ʒ1)3k g,并播种50粒左右㊂为保证营养供给,出苗两周后每7天浇灌一次200m L1/4霍格兰氏植物营养液㊂待幼苗长至第5周后定苗,每盆选留壮苗30株㊂培养期间每5天调换塑料盆方向,确保各个盆受光条件一致㊂1.2盐胁迫处理及N a H S浓度设定试验首先通过预实验筛选出盐胁迫半致死浓度,并对培育的幼苗进行盐胁迫处理,当盐浓度达到半致死浓度时,最后进行叶面喷施N a H S溶液㊂盐胁迫处理:预实验进行盐胁迫半致死浓度的筛选,筛选得出达乌里胡枝子盐分胁迫半致死浓度为150m m o l㊃L-1[26]㊂将幼苗培养至第6周后,开始进行盐胁迫处理㊂在营养液中加入N a C l 溶液,每天递增50m m o l㊃L-1,当浓度升至150 m m o l㊃L-1时,记为处理的第1天㊂之后每3天在营养液中加入浓度为150m m o l㊃L-1的N a C l溶液(表1)并冲灌1次,以冲刷盆内积累的盐分从而使盆内盐浓度保持恒定(每盆浇灌量为600m L,冲灌量为浇灌量的3倍,即1.8L)㊂N a H S浓度设定:以浓度倍增的方式设置6个N a H S浓度,分别是25,50,100,200,400和800μm o l㊃L-1㊂将配好的N a H S溶液喷施在达乌里胡枝子的叶面上,在处理的第1天喷施一次,之后每3天喷施一次,以雾化水珠布满叶片表面为准㊂1.3试验处理在盐胁迫第0,10,20,30d分别取样,每次取样时随机抽取4盆幼苗进行测定㊂本试验设置8个处理,每个处理设置16个重复㊂试验处理见表1㊂377草 地 学 报第32卷表1 试验处理T a b l e 1 E x pe r i m e n t a l t r e a t m e n t s 处理方法P r o c e s s i n g me t h o d 缩写A b b r e v i a t i o n处理期间每3天浇灌营养液,叶面喷施清水C K 处理期间每3天浇灌营养液和150m m o l㊃L -1的N a C l 溶液,叶面喷施清水T 0处理期间每3天浇灌营养液和150m m o l ㊃L -1的N a C l 溶液,叶面喷施25μm o l ㊃L -1N a H ST 25处理期间每3天浇灌营养液和150m m o l ㊃L -1的N a C l 溶液,叶面喷施50μm o l ㊃L -1N a H S T 50处理期间每3天浇灌营养液和150m m o l ㊃L -1的N a C l 溶液,叶面喷施100μm o l ㊃L -1N a H S T 100处理期间每3天浇灌营养液和150m m o l ㊃L -1的N a C l 溶液,叶面喷施200μm o l ㊃L -1N a H S T 200处理期间每3天浇灌营养液和150m m o l ㊃L -1的N a C l 溶液,叶面喷施400μm o l ㊃L -1N a H S T 400处理期间每3天浇灌营养液和150m m o l ㊃L -1的N a C l 溶液,叶面喷施800μm o l ㊃L -1N a H ST 8001.4 测定指标与方法1.4.1 生长特性指标的测定 每个处理随机抽取4株达乌里胡枝子幼苗,分别用皮尺和游标卡尺测定幼苗的株高㊁茎粗㊁主根长㊁根粗;用天平称量幼苗茎鲜重和根鲜重㊂1.4.2 细胞膜透性指标的测定 相对含水量(R e l a t i v ew a t e r c o n t e n t ,RW C ):每个处理条件下,随机选取4片大小一致的达乌里胡枝子叶片,用纱布擦拭干净,称取植物的鲜重(W f );再将其在蒸馏水中浸泡6h 后取出,用滤纸擦干,称取植物的饱和鲜重(W t );放入烘箱中,60ħ烘12h ,记为干重(W d ),RW C =(W f -W d )/(W t -W d )ˑ100%㊂相对电导率(R e l a t i v e e l e c t r o l y t e l e a k a ge ,R E L ):每个处理随机抽取4片达乌里胡枝子叶片,用去离子水冲洗干净后,采用电导仪法测定[27]㊂丙二醛(M a l o n d i a l d e h yd e ,M D A ):采用硫代巴比妥酸法测定[27]㊂1.4.3 抗氧化系统指标的测定 抗坏血酸(A s -c o r b i c a c i d ,A s A )含量采用2,6-二氯靛酚滴定法测定[27];谷胱甘肽(G l u t a t h i o n e ,G S H )含量采用谷胱甘肽试剂盒(索莱宝)测定;过氧化物酶(P e r o x i -d a se ,P O D )活性采用愈创木酚比色法测定[27];过氧化氢酶(C a t a l a s e ,C A T )活性采用过氧化氢分解量测定[27];超氧化物歧化酶(S u p e r o x i d e d i s -m u t a s e ,S O D )活性采用氮蓝四唑(N B T )方法测定[27]㊂1.5 数据分析通过M i c r o s o f tO f f i c eE x c e l 2016进行数据整理,利用S P S S22.0进行单因素方差分析和差异显著性检验(α=0.05),采用D u n c a n 法进行差异显著性的多重比较(P <0.05),运用O r i g i n2018进行绘图㊂2 结果与分析2.1 外源硫化氢对盐胁迫下达乌里胡枝子生长特性的影响盐胁迫对达乌里胡枝子株高㊁茎粗㊁茎鲜重㊁主根长㊁根粗㊁根鲜重等指标均有显著影响(P <0.05,图1)㊂试验期间,C K 组的株高㊁茎粗㊁主根长和根粗均呈现逐渐上升趋势,而T 0组的株高㊁茎粗㊁主根长和根粗则表现为增长缓慢,除根粗外其余三个指标均与C K 组存在显著差异(P <0.05)㊂随着盐胁迫时间延长,T 0组的达乌里胡枝子幼苗地上部分均显著低于C K 组(P <0.05,图1a ,1b,1e )㊂当胁迫至第10d 时,T 50,T 100,T 200组的达乌里胡枝子株高显著高于T 0组,分别提高了4.92%,9.84%和6.57%;其中T 100组的达乌里胡枝子茎粗与C K 组无差异,与T 0组相比提高了24.77%㊂胁迫至第20d 时,T 25~T 200组的达乌里胡枝子株高显著高于T 0组(P <0.05),分别提高了15.84%,24.92%,32.29%和16.63%;其中T 100组的达乌里胡枝子茎粗较T 0组提高了27.56%;胁迫至第30d 时,T 50,T 100组的达乌里胡枝子株高与T 0组相比显著提高(P <0.05),分别提高了18.00%和29.79%;其中T 100组的达乌里胡枝子茎粗和茎鲜重与T 0组相比分别提高了23.66%和14.57%㊂随着盐胁迫时间的增加,达乌里胡枝子的地下部分总体受到的影响较小(图1c ,1d ,1f)㊂胁迫至第10d 时,T 25~T 400组的达乌里胡枝子主根长均高于T 0组(P <0.05)㊂胁迫至第20d 时,T 25~T 100组的主根长显著高于T 0组(P <0.05);其中T 100组的根粗显著高于T 0组(P <0.05),提高了18.61%㊂胁迫至第30d 时,相较于其余各组,T 100组的主根长和根鲜重显著高于T 0组(P <0.05),分别提高了17.80%和11.28%㊂477第3期张亚慧等:硫化氢对盐胁迫下达乌里胡枝子生长和抗氧化系统的影响图1 外源硫化氢对盐胁迫下达乌里胡枝子幼苗生长特性的影响F i g .1 E f f e c t s o f e x o g e n o u sh y d r o g e n s u l f i d e o n t h e g r o w t hc h a r a c t e r i s t i c s o f L e s pe d e z a d a v u r i c a s e e d l i n g su n d e r s a l t s t r e s s 注:图中不同小写字母代表相同盐胁迫时间不同处理下存在显著差异(P <0.05),下图同N o t e :D i f f e r e n t l o w e r c a s e l e t t e r s i n t h e f i g u r e r e p r e s e n t s i gn i f i c a n t d i f f e r e n c e s i n t h e s a m e s a l t s t r e s s t i m e u n d e r d i f f e r e n t t r e a t m e n t s (P <0.05),t h e s a m e a s b e l o w2.2 外源硫化氢对盐胁迫下达乌里胡枝子细胞膜透性的影响试验中C K 组达乌里胡枝子幼苗叶片相对含水量稳定在85.57%~88.92%之间,而T 0组的相对含水量则呈现出逐渐下降的趋势㊂施加不同浓度的外源硫化氢对叶片相对含水量的下降有一定缓减作用(图2a )㊂盐胁迫至第20d 时,T 50和T 100组的达乌里胡枝子幼苗叶片相对含水量较T 0组分别提高了7.28%和8.54%,呈现出显著差异(P <0.05)㊂胁迫至第30d 时,T 25~T 400组的达乌里胡枝子幼苗叶片相对含水量较T 0组分别提高了3.87%,5.75%,7.30%,5.24%和0.87%,仅有T 100组与T 0组相比呈现出显著差异(P <0.05)㊂综上所述,100μm o l㊃L -1外源硫化氢可以提高盐577草 地 学 报第32卷胁迫下达乌里胡枝子叶片的相对含水量㊂试验中C K 组达乌里胡枝子幼苗叶片相对电导率保持稳定,而T 0组的相对电导率则呈现出逐渐上升的趋势㊂施加不同浓度的外源硫化氢对叶片相对电导率的上升有一定缓减作用(图2b )㊂在试验阶段,T 0组的达乌里胡枝子幼苗在第10,20,30d 时叶片相对电导率较C K 组分别提高了7.84%,9.76%和13.57%,均有显著差异(P <0.05)㊂盐胁迫至第10,20,30d 时,T 25~T 400处理均不同程度地降低了幼苗叶片的相对电导率,而T 800处理则提高了其相对电导率㊂其中100μm o l㊃L -1外源硫化氢可以有效缓解盐胁迫下达乌里胡枝子幼苗相对电导率的增加㊂试验中C K 组达乌里胡枝子幼苗叶片的M D A含量稳定在17.97~24.13μm o l ㊃g -1F W 之间,而T 0组的M D A 含量则呈现出逐渐上升的趋势㊂施加不同浓度的外源硫化氢对叶片的M D A 含量的上升有一定缓减作用(图2c )㊂盐胁迫至第10,20,30d 时T 0组的M D A 含量较C K 组呈现出显著差异(P <0.05),并于第30d 时达到最大值,此时较C K组增加了283.47%㊂胁迫至第10d 时,T 25~T 400组较T 0组M D A 含量均显著降低(P <0.05)㊂胁迫至第20d 和30d 时,T 25,T 50,T 100,T 200和T 400组较T 0组均显著降低(P <0.05)㊂综上所述,25~400μm o l㊃L -1外源硫化氢可以显著降低盐胁迫下达乌里胡枝子幼苗的M D A 含量㊂图2 外源硫化氢对盐胁迫下达乌里胡枝子幼苗细胞膜透性的影响F i g .2 E f f e c t s o f e x o g e n o u sh y d r o g e n s u l f i d e o n c e l lm e m b r a n e p e r m e a b i l i t y o f L e s pe d e z a d a v u r i c a s e e d l i n gsu n d e r s a l t s t r e s s 2.3 外源硫化氢对盐胁迫下达乌里胡枝子幼苗叶片抗氧化系统的影响试验中C K 组达乌里胡枝子幼苗叶片的A s A含量稳定在0.84~0.88μg ㊃g -1F W 之间,随着盐胁迫时间的延长,T 0组的A S A 含量在第10,20,30d 时较C K 组有显著差异(P <0.05,图3a),并于第30d 时达到最小值,较C K 组减少79.86%㊂胁迫至第10d 时,T 50和T 100组的达乌里胡枝子叶片677第3期张亚慧等:硫化氢对盐胁迫下达乌里胡枝子生长和抗氧化系统的影响的A s A 含量较T 0组显著提高(P <0.05)㊂胁迫至20d 时,T 100组的A s A 含量较T 0组提高了4.34%;而T 400和T 800组的A s A 含量较T 0组显著降低(P <0.05),分别降低了6.74%和8.28%㊂胁迫至30d 时,T 50和T 100组的达乌里胡枝子幼苗叶片A s A 含量与T 0组相比显著提高(P <0.05),分别提高了8.48%和11.03%㊂施用一定浓度的外源硫化氢可以有效提高盐胁迫下达乌里胡枝子叶片的A s A 含量,其中100μm o l ㊃L -1外源硫化氢的效果最佳㊂试验中C K 组达乌里胡枝子幼苗叶片的G S H含量稳定在3.34~3.68m m o l ㊃g -1F W 之间,而T 0组的G S H 含量则呈现出先升高后降低的趋势,并于第10d 时达到最大值,于第30d 时达到最小值,较C K 组显著减少了27.27%(P <0.05,图3b )㊂盐胁迫至第20d 时,T 25,T 100,T 200和T 400组的G S H 含量较T 0组显著提高(P <0.05),分别提高了12.53%,14.16%,11.55%和12.57%㊂胁迫至30d 时,T 25~T 400组的G S H 含量相较于T 0组显著提高(P <0.05)㊂图3 外源硫化氢对盐胁迫下达乌里胡枝子幼苗叶片非酶促抗氧化系统的影响F i g .3 E f f e c t s o f e x o g e n o u sh y d r o g e n s u l f i d e o nn o n -e n z y m a t i c a n t i o x i d a n t s ys t e mi n l e a v e s o f L e s pe d e z a d a v u r i c a s e e d l i n g su n d e r s a l t s t r e s s 2.4 外源硫化氢对盐胁迫下达乌里胡枝子幼苗抗氧化酶活性的影响盐胁迫会影响达乌里胡枝子幼苗叶片的抗氧化酶活性(图4)㊂在试验过程中,C K 组的S O D ,P O D ,C A T 酶活性均稳定在一定的范围内,而T 0组的这三种酶活性则呈现出先上升后降低的趋势,与C K 组有显著差异(P <0.05)㊂试验中C K 组达乌里胡枝子幼苗叶片的S O D 酶活性基本稳定在233.47~248.54U ㊃g -1F W 之间,而T 0组的S O D 酶活性则呈现出先上升后降低的趋势,并于第20d 时达到最大值(图4a )㊂胁迫至第20d 时,T 25~T 200组的达乌里胡枝子幼苗叶片的S O D酶活性较T 0组有所提高,但仅有T 25组呈现出显著差异(P <0.05)㊂胁迫至第30d 时,T 100组的S O D 酶活性较T 0组显著提高了13.34%(P <0.05)㊂试验中C K 组达乌里胡枝子幼苗叶片的P O D酶活性基本稳定在3.12~3.28U ㊃g -1㊃m i n-1之间,而T 0组的P O D 酶活性则呈现出先上升后降低的趋势,并于第10d 时达到最大值(图4b )㊂胁迫至第20d 时,T 50和T 100组的P O D 酶活性较T 0组显著提高(P <0.05),分别提高了7.84%和7.65%㊂胁迫至第30d 时,T 100组的P O D 酶活性较T 0组显著提高了11.38%(P <0.05)㊂试验中C K 组达乌里胡枝子幼苗叶片的C A T 酶活性基本稳定在72.53~77.34U ㊃g -1㊃m i n-1之间,而T 0组的C A T 酶活性则呈现出先上升后降低的趋势,并于第10d 时达到最大值(图4c )㊂胁迫至第10d 时,T 25,T 50和T 100处理对C A T 酶活性具有一定的促进作用,与T 0组相比存在显著差异(P <0.05)㊂胁迫至第20d 时,T 100组的C A T 酶活性较T 0组提高了8.75%,而T 25,T 50,T 200,T 400和T 800组的C A T 酶活性较T 0组均有所降低㊂胁迫至第30d时,T 25~T 200组的C A T 酶活性较T 0组提高了16.78%,22.12%,24.16%和23.44%,呈现出显著差异(P <0.05)㊂综上所述,100μm o l㊃L -1外源硫化氢对提高S O D ,P O D ,C A T 酶活性效果较好㊂777草地学报第32卷图4外源硫化氢对盐胁迫下达乌里胡枝子幼苗叶片酶促抗氧化系统的影响F i g.4 E f f e c t s o f e x o g e n o u sh y d r o g e n s u l f i d e o n t h e e n z y m a t i c a n t i o x i d a n t s y s t e mi n l e a v e s o f L e s p e d e z a d a v u r i c aS e e d l i n g su n d e r s a l t s t r e s s3讨论3.1盐胁迫下达乌里胡枝子幼苗生长特性对外源硫化氢的响应对于植物地上部分,盐胁迫导致植株吸收水分能力下降,使植株生长缓慢,植物的株高㊁茎粗等指标可以直观反映盐胁迫对植物的影响程度,而施加外源硫化氢可以有效减少盐胁迫对植物地上部分造成的伤害㊂本试验研究结果表明:与正常生长的植株相比,随着盐胁迫时间延长,幼苗的株高㊁茎粗㊁茎鲜重显著下降㊂因为在植物生长过程中其需水量不断增加,但受盐胁迫影响,其吸收水分能力下降㊂经试验发现,施用浓度为100μm o l㊃L-1的外源硫化氢能有效提升达乌里胡枝子幼苗的株高和茎粗,这表明,一定浓度的外源硫化氢能促进植株生长,增强植株叶片吸收水分的能力缓减了盐胁迫对植株造成的伤害㊂这与王红燕等[28]研究结果一致,该研究发现盐胁迫使棉花(G o s s y p i u mh i r s u t u m)生长受阻,影响其地上部分的形态建成,而通过施加外源硫化氢有效地促进了棉花幼苗的生长发育,缓减了盐胁迫对棉花幼苗造成的伤害,并指出施加浓度为100μm o l㊃L-1外源硫化氢效果最好㊂对于植物地下部分,通过对植株主根长㊁根粗等指标的分析研究发现:施加外源硫化氢对植株地下部分影响较小㊂虽然施用100μm o l㊃L-1的外源硫化氢效果较好,但是该浓度下根系指标表现并不显著,产生该现象的主要原因可能是由于叶面喷施直接作用于植物地上部分,而地下部分必须通过极性运输才能获取硫化氢,因此对地下部分影响较小㊂高晓兰等[29]在对桃树(P r u n u s p e r s i c a)根系的研究中发现,通过浇灌方式施加外源硫化氢显著增加了根长㊁根表面积以及体积,并提高了根系活力㊂高双红等[30]研877第3期张亚慧等:硫化氢对盐胁迫下达乌里胡枝子生长和抗氧化系统的影响究结果表明,外源施加硫化氢可以有效缓减弱光胁迫对高羊茅(F e s t u c a a r u n d i n a c e a)幼苗的生长限制㊂李东波等[31]研究也表明,硫化氢直接作用于根部,可以有效促进豌豆(P i s u ms a t i v u m)胚根的伸长㊂由此表明,叶面喷施硫化氢主要依靠气孔吸收,而通过维管束及筛管等途径运输到地下部分的硫化氢较少,因此叶面喷施硫化氢对地下部分影响较小㊂3.2盐胁迫下达乌里胡枝子细胞膜透性对外源硫化氢的响应植物细胞膜为细胞的生命活动提供了一个相对稳定的内部环境,是植物细胞的保护屏障,当植物受到非生物胁迫危害时,植物细胞膜往往最先受到影响[32],通过分析植物的相对含水量㊁相对电导率㊁丙二醛含量等指标可以反映出植物细胞膜受影响程度㊂植物叶片相对含水量的高低反映植物体内水分的多少,相对含水量越高,植物耗水量就越少,抗非生物胁迫能力也就越高;相对电导率反映的是植物细胞膜透性的大小,植物细胞损伤越严重,叶片相对电导率值就越大,引起膜脂过氧化程度就越大,反之越小[33];丙二醛含量反映的是植物细胞膜的膜脂过氧化程度,随着盐胁迫过程中其含量的增加,细胞膜透性增大导致电解质外渗,从而使得植物叶片相对电导率也随之增大[34]㊂本试验中,达乌里胡枝子幼苗在盐胁迫处理下相对含水量下降,相对电导率和丙二醛含量升高㊂这表明盐胁迫下达乌里胡枝子细胞失水,细胞膜结构和功能受损,膜透性增大,膜脂过氧化程度加深;与T0组相比,施加了不同浓度的外源硫化氢叶片相对含水量增大,相对电导率和丙二醛含量下降㊂因此,可以认为施加外源硫化氢可以通过维持细胞较高的相对含水量和减小细胞膜透性的方式来缓解盐胁迫造成的伤害㊂郑州元等[35]通过对盐胁迫下番茄(S o l a n u ml y c o p e r s i c u m)幼苗施加不同浓度的硫化氢处理也阐明了这一观点㊂3.3盐胁迫下达乌里胡枝子抗氧化系统对外源硫化氢的响应盐胁迫会诱导植物体内产生大量的活性氧如超氧阴离子自由基(O-2)㊁过氧化氢(H2O2)等,这会导致植物细胞质膜过氧化,细胞质膜透性增大以及细胞液外渗[36],这是盐胁迫能够对植物造成伤害的主要原因之一㊂植物通常依靠两套抗氧化系统来清除自由基,降低盐胁迫对其造成的伤害,一类是抗氧化酶进行的酶促抗氧化系统,另一类是低分子物质进行的非酶促抗氧化系统[37]㊂酶促抗氧化系统中抗氧化酶的活性变化表明了植物抗氧化损伤程度,是研究植物非生物胁迫的关键指标[38]㊂在抗氧化酶体系中,S O D是活性氧最有效的清除剂,它是抵御活性氧损害植物细胞的第一道防线㊂S O D可以将O-2代谢为H2O2,然后通过C A T, P O D等其他抗氧化酶将H2O2代谢为H2O和O[39]2㊂在此过程中,外源硫化氢通过影响植物抗氧化酶体系中细胞膜的极性转运,并迅速抵达线粒体和叶绿体基质,从而增强抗氧化酶的活力[40],使达乌里胡枝子幼苗中过量的活性氧被清除,细胞壁结构与功能受到的破坏减少,丙二醛含量降低㊂这与张雪蒙等[41]在盐胁迫下番茄幼苗的研究结果相似㊂非酶促抗氧化系统主要由抗坏血酸(A s A)㊁还原性谷胱甘肽(G S H)构成,其中A s A被称为天然的非酶类抗氧化剂,在保护植物免受活性氧伤害发挥着重要作用㊂此外由A s A和G S H组成的A s A-G S H循环可以有效清除活性氧[42]㊂胡文成[43]研究水稻(O r y z a s a t i v a)发现,在盐胁迫下A s A-G S H循环活性会随着盐胁迫程度先升高后降低,A s A可以参与A s A-G S H循环去参与H2O2的清除,也可以通过抗坏血酸过氧化物酶当作单线态氧,发生作用并消除活性氧㊂4结论本试验探讨在盐胁迫下,施加外源硫化氢对 晋农1号 达乌里胡枝子幼苗生长特性和抗氧化系统的影响,试验结果表明,施加100μm o l㊃L-1N a H S 显著缓解了150m m o l㊃L-1盐胁迫对达乌里胡枝子幼苗生长的抑制作用㊂外源硫化氢的施加提高了盐胁迫下达乌里胡枝子幼苗的抗氧化酶活性,抑制了丙二醛合成,降低了相对电导率,延缓膜脂过氧化的发生㊂综上所述,施加外源硫化氢减轻了盐胁迫对植物细胞的伤害,提高了达乌里胡枝子幼苗对盐的耐受性,同时也提高了达乌里胡枝子的生产性能㊂参考文献[1]蒲红艳,陈亚宁,李卫红.干旱荒漠区新垦绿洲土壤改良措施对盐分变化的影响研究 以克拉玛依农业开发区为例[J].干旱区资源与环境,2007,21(7):160-164[2]齐琪,马书荣,徐维东.盐胁迫对植物生长的影响及耐盐生理机制研究进展[J].分子植物育种,2020,18(8):2741-2746[3] C H E NT,C H R I S T E N S E N M,N A NZB,e t a l.E f f e c t s o f g r a z i n gi n t e n s i t y o n s e e d s i z e,g e r m i n a t i o n a n d f u n g a l c o l o n i z a t i o n o f L e s p e-977草地学报第32卷d e z a d a v u r i c a i nas e m i-a r i d g r a s s l a n do fn o r t h w e s tC h i n a[J].J o u r n a l o fA r i dE n v i r o n m e n t s,2017,144(9):91-97[4]佟莉蓉,王娟,张亚妮,等.不同种衣剂配方对达乌里胡枝子幼苗生长和生理特性的影响[J].草地学报,2020,28(3):844-851 [5] X U B,G A OZ,WA N GJ,e t a l.M o r p h o l o g i c a l c h a n g e s i n r o o t so f B o t h r i o c h l o a i s c h a e m u m i n t e r c r o p p e d w i t h L e s p e d e z ad a-v u r i c a f o l l o w i n gp h o s p h o r u s a p p l i c a t i o na n dw a t e rs t r e s s[J].P l a n tB i o s y s t e m s,2013,149(2):298-306[6]夏传红,赵祥,邢毅,等.野生达乌里胡枝子栽培条件下的生长特性研究[J].草原与草坪,2010,30(2):74-78[7] A R N A O M B,H E R NÁN D E Z R J.M e l a t o n i n:p l a n t g r o w t hr e g u l a t o ra n d/o rb i o s t i m u l a t o rd u r i n g s t r e s s[J].T r e n d si n P l a n t S c i e n c e,2014,19(12):789-797[8]Y A O X Q,C HU JZ,WA N G G Y.E f f e c t so fs e l e n i u m o nw h e a t s e e d l i n g s u n d e r d r o u g h t s t r e s s[J].B i o l o g i c a l T r a c eE l e-m e n tR e s e a r c h,2009,130(3):283-290[9] L U O Y,X I E Y Y,H E D,e t a l.E x o g e n o u s t r e h a l o s e p r o t e c t sp h o t o s y s t e mI Ib yp r o m o t i n g c y c l i ce l e c t r o nf l o w u n d e rh e a ta n dd r o u g h t s t r e s s e s i nw i n t e rw h e a t[J].P l a n t B i o l o g y,2021,23(5):770-776[10]A HM E DF,J A V E DB,R A Z Z A QA,e t a l.A p p l i c a t i o n s o f c o p-p e r a n d s i l v e r n a n o p a r t i c l e s o nw h e a t p l a n t s t o i n d u c ed r o u g h t t o l e r a n c ea n di n c r e a s e y i e l d[J].I E T N a n o b i o t e c h n o l o g y, 2021,15(1):68-78[11]WA N G Y X,S U O B,Z H A O PF,e ta l.E f f e c to f e x o g e n o u sa b s c i s i c a c i do n p s b Ae x p r e s s i o na t g r a i nf i l l i n g s t a g e i nt w ow h e a t c u l t i v a r su n d e rd r o u g h ts t r e s s[J].A c t a A g r o n o m i c a S i n i c a,2011,37(8):1372-1377[12]K A N G GZ,L IGZ,L I U G Q,e t a l.E x o g e n o u s s a l i c y l i c a c i de n h a n c e sw h e a t d r o u g h t t o l e r a n c eb y i nf l u e n c eo nt h ee x p r e s-s i o no f g e n e s r e l a t e d t oa s c o r b a t e-g l u t a t h i o n e c y c l e[J].B i o l o-g i aP l a n t a r u m,2013,57(4):718-724[13]B H A R DWA JD R,S I N G H N,S H A RMA A,e t a l.H y d r o g e np e r o x i d e r e g u l a t e s a n t i o x i d a n t r e s p o n s e s a n d r e d o x r e l a t e d p r o-t e i n s i nd r o u g h t s t r e s s e dw h e a t s e e d l i n g s[J].P h y s i o l o g y a n d M o l e c u l a rB i o l o g y o f P l a n t s,2021,27(1):151-163 [14]A S H R A FM A MS.E x o g e n o u s a p p l i c a t i o no f a s c o r b i c a c i d s t i m u-l a t e s g r o w t h a n d p h o t o s y n t h e s i so fw h e a t(T r i t i c u m a e s t i v u m L.) u n d e r d r o u g h t[J].S o i l&E n v i r o n m e n t,2012,31(1):72-77 [15]张杰,陈彪,马晓寒,等.气体信号分子在植物干旱胁迫下的调控作用及机制的研究进展[J].中国农业科技导报,2018,20(12):52-58[16]王秋艳.硫化氢作为一种新型气体信号分子的研究进展[J].化学工程师,2021,35(9):48-51[17]李萱,刘博文,高双红,等.外源硫化氢对不同弱光下高羊茅形态和生理指标的影响[J].草地学报,2021,29(11):2435-2441 [18]刘建新,刘瑞瑞,贾海燕,等.外源H2S对盐碱胁迫下裸燕麦幼苗生长和生理特性的影响[J].麦类作物学报,2021,41(2): 245-253[19]刘锐锋,郭希凯,张华.硫化氢对小麦种子萌发早期淀粉酶活性的影响[J].安徽农业科学,2010,38(14):7218-7219 [20]金竹萍,方慧慧,张丽萍,等.硫化氢对拟南芥在干旱胁迫条件下的生理影响[J].山西大学学报(自然科学版),2013,36(1): 113-117[21]王鸿蕉,张丽萍,刘志强,等.外源硫化氢对冷胁迫下白菜幼苗生长和光合作用的影响[J].西北植物学报,2015,35(4):780-786 [22]杨靖东,高青海.N a H S对大蒜衰老与生理特性的影响[J].热带作物学,2012,33(8):1435-1439[23]孙晓莉,张鑫荣,田寿乐,等.外源硫化氢处理对板栗幼苗干旱胁迫抗性的影响[J].北方园艺,2017(15):7-12 [24]吴单华,李应林,夏眴,等.硫化氢供体硫氢化钠处理提高小麦对高温和干旱胁迫的综合抵抗能力[J].云南师范大学学报(自然科学版),2013,33(6):29-35[25]谢平凡,邱冬冬,陈珍.外源硫化氢缓解水稻盐胁迫的作用机理[J].贵州农业科学,2017,45(3):8-13[26]王开喜,杨耀国,王永新,等.硫化氢浓度对盐胁迫下胡枝子种子萌发和幼苗生长的影响[J].山西农业科学,2022,50(10): 1396-1401[27]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:164-169[28]王红燕,张淑英.外源硫化氢对盐胁迫下棉花幼苗生长及渗透调节系统的影响[J].西南农业学报,2020,33(11):2483-2489 [29]高晓兰,孙茂祥,吴雪莲,等.外源硫化氢对成龄桃树根系生长的影响[J].山东农业科学,2022,54(12):76-80 [30]高双红,李媛英,刘博文,等.H2S对弱光胁迫下高羊茅幼苗生理特性和内源激素的影响[J].草地学报,2021,29(10):2233-2239 [31]李东波,肖朝霞,刘灵霞,等.外源硫化氢对豌豆根尖及其边缘细胞的影响[J].植物学报,2010,45(3):354-362 [32]闫慧萍,彭云玲,赵小强,等.外源24-表油菜素内酯对逆境胁迫下玉米种子萌发和幼苗生长的影响[J].核农学报,2016,30(5):988-996[33]姚富文.苹果耐高温基因的鉴定及褪黑素对高温胁迫的缓解效应[D].郑州:河南农业大学,2021:32-33[34]刘建明,吕跃东.盐胁迫下山杏叶片生理响应特征研究[J].防护林科技,2023(4):51-54[35]郑州元,林海荣,崔辉梅.外源硫化氢对盐胁迫下加工番茄幼苗生理生化特性的影响[J].华北农学报,2017,32(1):208-214[36]F O Y E R C H,S H I G E O K A S.U n d e r s t a n d i n g o x i d a t i v es t r e s sa n da n t i o x i d a n t f u n c t i o n s t o e n h a n c e p h o t o s y n t h e s i s[J].P l a n tP h y s i o l o g y,2011,155(1):93-100[37]高菲,戴志华,韩丹,等.硒影响植物抗氧化系统的作用与机制[J].生物技术进展,2017,7(5):467-472[38]D E I N L E I N U,S T E P HA N B A,H O R I E T,e t a l.P l a n t s a l t-t o l e r a n c em e c h a n i s m s[J].T r e n d s i nP l a n tS c i e n c e,2014,19(6):371-379[39]刘文瑜,杨宏伟,魏小红,等.外源N O调控盐胁迫下蒺藜苜蓿种子萌发生理特性及抗氧化酶的研究[J].草业学报,2015,24(2):85-95[40]T A O BB,L I USY,Z H A N GCC,e t a l.V E G F R2f u n c t i o n s a s a nH2S-t a r g e t i n g r e c e p t o r p r o t e i n k i n a s e w i t hi t s n o v e l C y s1045-C y s1024d i s u l f i d eb o n ds e r v i n g a sas p e c i f i cm o l e c u l a rs w i t c hf o rh y d r o g e n s u l f i d e a c t i o n s i nv a s c u l a r e n d o t h e l i a l c e l l s.[J].A n t i o x i-d a n t s&Re d o xS i g n a l i n g,2013,19(5):448-464[41]张雪蒙,亢超,滕元旭,等.外源硫化氢和水杨酸对盐胁迫下加工番茄幼苗生长与生理特性的影响[J].西北植物学报,2022, 42(2):255-262[42]K A Y AC,U G U R L A RF,A S H R A F M,e t a l.N i t r i c o x i d e a n dh y d r o g e n s u l f i d ew o r k t o g e t h e r t o i m p r o v e t o l e r a n c e t o s a l i n i t ys t r e s s i n w h e a t p l a n t sb y u p r a i s i n g t h e A s A-G S H c y c l e[J].P l a n t P h y s i o l o g y a n dB i o c h e m i s t r y,2023(194):651-663 [43]胡文成.水杨酸㊁脯氨酸㊁γ-氨基丁酸对盐胁迫下水稻抗氧化系统的调控效应[D].哈尔滨:东北农业大学,2017:25-28(责任编辑刘婷婷)087。
外源BR对不同盐胁迫下番茄幼苗生长及生理抗性的影响
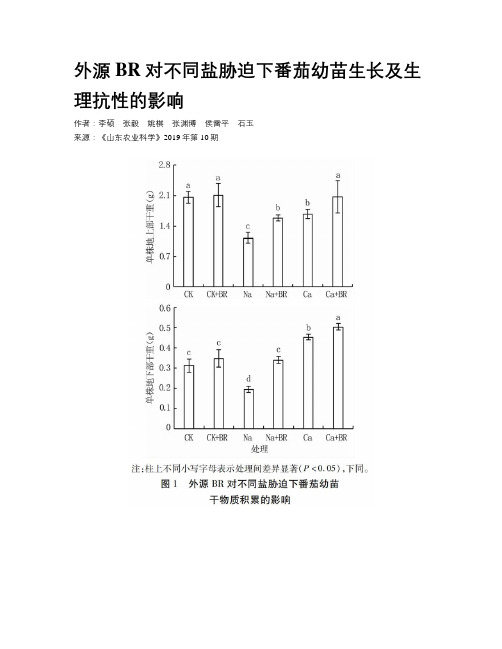
外源BR对不同盐胁迫下番茄幼苗生长及生理抗性的影响作者:李硕张毅姚棋张渊博侯雷平石玉来源:《山东农业科学》2019年第10期摘要:以外源油菜素內酯(BR)对150 mmol/L NaCl和100 mmol/L Ca(NO3)2胁迫(渗透势相等)下的番茄幼苗进行叶面喷施处理,测定植株地上部和地下部干重、根冠比、叶绿素含量、Pn、MDA含量等指标,探究外源BR对不同盐胁迫下番茄幼苗生长及生理抗性的影响。
结果表明,盐胁迫显著抑制番茄幼苗地上部干物质积累,Pn均显著降低,胁迫后期膜脂过氧化水平均呈不同程度升高,且Ca(NO3)2胁迫下植株的根冠比显著增加,NaCl胁迫下叶绿素含量显著降低;同时,Ca(NO3)2胁迫下,番茄幼苗地下部干重和叶绿素含量均显著高于对照。
外源BR显著提高了盐胁迫植株的地上部和地下部干重、叶绿素含量和Pn,但其对不同盐胁迫下膜脂过氧化伤害的缓解效应因部位而异。
由此可知,外源BR对等渗条件下不同盐胁迫造成的番茄幼苗生长受抑均有缓解作用,但对光合碳同化、叶绿素积累的调控效应存在一定差异。
关键词:番茄幼苗;外源BR;等渗盐胁迫;生理抗性;生长发育中图分类号:S641.201 文献标识号:A 文章编号:1001-4942(2019)10-0050-05Effects of Exogenous BR on Growth and Physiological Resistance ofTomato Seedlings under Different Salt StressesLi Shuo, Zhang Yi, Yao Qi, Zhang Yuanbo, Hou Leiping, Shi Yu(College of Horticulture Science, Shanxi Agricultural University/ Collaborative Innovation Center of Qualityand Profit Improvement for Protected Vegetables of Shanxi Province, Taigu 030801, China)Abstract Exogenous brassinolide (BR) was sprayed on the leaves of tomato seedlings which were respectively exposed to the stresses of 150 mmol/L NaCl and 100 mmol/L Ca(NO3)2 with equal osmotic potential. And the dry weight of shoot and root of tomato seedlings, the root-shoot ratio, chlorophyll content, Pn and MDA content were measured to study the effects of exogenous BR on physiological resistance of tomato seedlings under different salt stresses. The results showed that the aboveground dry weight accumulation of tomato seedlings were significantly inhibited, Pn decreased significantly, and the membrane lipid peroxidation increased to different degrees at the late stress stage. The dry weight root-shoot ratio under Ca(NO3)2 stress increased significantly. The chlorophyll content decreased significantly under NaCl stress. The dry weight of root and chlorophyll content of tomato seedlings were significantly higher than those of the control under Ca (NO3)2 stress. Exogenous BR significantly increased the dry weight of above-ground and under-ground parts, chlorophyll content and Pn of salt-stressed plants, but its alleviation effect on membrane lipid peroxidation injury under different salt stresses varied from site to site. These results indicated that exogenous BR could alleviate the growth inhibition of tomato seedlings caused by different salt stresses with equal osmotic potential, and there were some certain differences in the regulation effect on photosynthetic carbon assimilation and chlorophyll accumulation.Keywords Tomato seedlings;Exogenous BR;Equal osmotic salt stress;Physiological resistance; Growth and development土壤次生盐渍化已成为当前设施栽培中极难克服的影响作物生产的限制因素之一。
谷胱甘肽对盐胁迫下玉米幼苗抗氧化特性和光合性能的影响

谷胱甘肽对盐胁迫下玉米幼苗抗氧化特性和光合性能的影响单长卷;杨天佑【摘要】以80 mmol/L NaCl模拟盐胁迫,研究谷胱甘肽(GSH)对盐胁迫下‘滑玉14’幼苗叶片抗氧化特性和光合性能的影响.结果表明:盐胁迫显著提高叶片细胞质膜透性、丙二醛(MDA)质量摩尔浓度、抗氧化酶超氧化物歧化酶(SOD)、抗坏血酸氧化酶(APX)和脱氢抗坏血酸还原酶(DHAR)活性、抗氧化物质谷胱甘肽(GSH)和抗坏血酸(AsA)质量摩尔浓度及叶绿素荧光参数非光化学猝灭系数(qN),显著降低叶绿素荧光参数PSⅡ最大光化学效率(Fv/Fm)、光化学猝灭系数(qP)和PSⅡ实际量子产额(ΦPSⅡ),光合色素质量分数、光合速率和单株生物量干质量.这说明,盐胁迫对‘滑玉14’造成氧化胁迫,并对光系统Ⅱ的功能造成伤害.50mg/L GSH处理则可以显著提高盐胁迫下玉米幼苗叶片过氧化物酶(POD)、SOD、谷胱甘肽还原酶(GR)活性、GSH质量摩尔浓度、Fv/Fm、qP和ΦPSⅡ、光合色素质量分数、光合速率和单株生物量干质量,并显著降低细胞质膜透性、MDA质量摩尔浓度和qN.上述研究结果说明,GSH处理可以提高玉米幼苗的抗氧化能力和光合性能,从而缓解盐胁迫造成的伤害.【期刊名称】《西北农业学报》【年(卷),期】2017(026)002【总页数】7页(P185-191)【关键词】玉米幼苗;抗氧化特性;光合性能;谷胱甘肽;盐胁迫【作者】单长卷;杨天佑【作者单位】河南科技学院,河南新乡 453003;现代生物育种河南省协同创新中心,河南新乡 453003;河南科技学院,河南新乡 453003;现代生物育种河南省协同创新中心,河南新乡 453003【正文语种】中文【中图分类】S512.1玉米是中国的主要粮食作物之一,在整个生育过程经常受到各种环境因素的影响。
盐胁迫是影响玉米生长发育和产量的重要环境因素之一,因此,玉米抗盐性的调控研究对促进其生长和提高产量具有重要意义。
外源硫化氢对冷胁迫下白菜幼苗生长和光合作用的影响

外源硫化氢对冷胁迫下白菜幼苗生长和光合作用的影响王鸿蕉;张丽萍;刘志强;刘旦梅;金竹萍;裴雁曦【摘要】硫化氢(H2S)是调节植物生长发育和响应胁迫的重要气体信号分子,为了增加对白菜(Brassica rapa var.pekinensis)应答冷胁迫生理机制的理解,该研究分析了4℃冷胁迫条件下外源H2 S(5 μmol·L-1硫氢化钠水溶液熏蒸24 h)预处理对白菜幼苗生长、光合作用以及相关基因表达水平的影响.结果发现:(1)冷胁迫诱导后白菜内源H2S主要生成酶编码基因LCD、DCD、DES的表达水平极显著上调,并伴随H2S产率的显著增加,暗示二者之间存在着潜在紧密联系.(2)在冷胁迫条件下,外源H2S预处理的白菜幼苗地上部分高度、叶宽和相对含水量等指标均比对照表现出明显优势;其体内脯氨酸、可溶性糖以及光合色素含量大幅升高,光合速率显著提升,光合作用中部分捕光蛋白、铁氧还蛋白和硫氧还蛋白编码基因表达量同时显著上调.研究表明,生理浓度H2S预处理可通过诱导上调白菜幼苗光合作用的相关基因表达量和提升净光合速率,提高其光合作用强度,促进渗透调节物质积累,有效缓解冷胁迫对其造成的损伤,维持冷胁迫下白菜幼苗的生长.【期刊名称】《西北植物学报》【年(卷),期】2015(035)004【总页数】7页(P780-786)【关键词】白菜;冷胁迫;硫化氢;光合作用;基因表达【作者】王鸿蕉;张丽萍;刘志强;刘旦梅;金竹萍;裴雁曦【作者单位】山西大学生命科学学院,太原030006;山西大学生命科学学院,太原030006;山西大学生命科学学院,太原030006;山西大学生命科学学院,太原030006;山西大学生命科学学院,太原030006;山西大学生命科学学院,太原030006【正文语种】中文【中图分类】Q945.78;Q789继一氧化氮(NO)、一氧化碳(CO)之后,硫化氢(H2S)被确认为生物体内第3种气体信号分子,成为近年来的一个研究热点[1]。
新型气体信号分子H2S在植物中的研究进展

新型气体信号分子H2S在植物中的研究进展摘要:硫化氢(hydrogenulfide,H2S)是新近发现的一种多功能气体信号分子,最初认为其对植物有害,但近期研究表明,低浓度的H2S可对植物的生长发育及外界逆境胁迫响应产生多方面的积极影响。
本文综述了H2S在植物体内的产生途径及其生理功能,包括对离子、盐、干旱、逆温等非生物胁迫的响应及对气孔运动、生长发育、种子萌发等生理过程的调控,并对其研究前景进行了展望。
关键词:硫化氢;气体信号分子;非生物胁迫;植物AbtractHydrogenulfide(H2S),arecentdicoveredgaignalmoleculewithmultifunction,halongbeenconideredaaphytoto某in.WhilerecentreearcheindicatedthatH2Splayedmanypoitiveeffectonp lantphyiologicalproceeandtheacquiitionofplanttretoleranceatlowco ncentration.Inthipaper,thegenerationofH2Sanditpotentialphyiologicalfunctionwereummarize d,includingmediatingthereponetoabiotictree,uchaion,alt,drought,heatingandlowtemperature,andmediatingtomatalmovement,plantgrowthanddevelopment,andeedgermination.Itfuturepropectwerealopreented.KeywordHydrogenulfide;Gaignalmolecule;Abiotictre;Plant硫化氢(hydrogenulfide,H2S)作为一种无色易燃有臭鸡蛋气味的气体,长久以来被认为危害动植物的生长和发育,但最近医学方面的研究表明,H2S作为重要的信号分子,在调控动物和人体神经系统、消化系统以及心血管系统方面具有重要功能[1,2]。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
BIOLOGIA PLANTARUM XX (X): XXX-XXX, 20XX1BRIEF COMMUNICATIONEffects of exogenous hydrogen sulfide on the redox states of ascorbate and glutathione in maize leaves under salt stressC. SHAN 1*, H. LIU 2, L. ZHAO 3, and X. WANG 4Henan Institute of Science and Technology, Xinxiang 453003, P.R. China 1 Xinxiang Medical University, Xinxiang 453003, P.R. China 2College of Life Sciences, Shangqiu Normal University, Shangqiu 476000, P.R. China 3 College of Life Science, Henan Normal University, Xinxiang 453007, P.R. China 4AbstractThis study investigated the effects of exogenous hydrogen sulfide (H 2S) on the redox states of ascorbate (AsA) and glutathione (GSH) in maize leaves under NaCl (100 mM) stress. Salt stress increased the activities of ascorbate peroxidase (APX), glutathione reductase (GR), monodehydroascorbate reductase (MDHAR), dehydroascorbate reductase (DHAR), γ-glutamylcysteine synthetase (γ-ECS), and L -galactono-1,4-lactone dehydrogenase (GalLDH), malondialdehyde content and electrolyte leakage, and reduced the ratios of reduced and oxidised forms of AsA (AsA/DHA) and GSH (GSH/GSSG) compared with control. Pretreatment with NaHS (H 2S donor) further enhanced the activities of the above enzymes except MDHAR and ameliorated the decrease in the ratios of AsA/DHA and GSH/GSSG compared with the salt stress alone. Pretreatment with NaHS significantly reduced the malondialdehyde content and electrolyte leakage induced by the salt stress. Pretreatment with NaHS alone did not affect any of the above mentioned parameters compared with the control. Our results suggest that exogenous H 2S could maintain the redox states of ascorbate and glutathione by up-regulating the ascorbate and glutathione metabolism and thus play an important role for acquisition of salt stress tolerance in maize.Additional key words : ascorbate peroxidase, electrolyte leakage, glutathione reductase, malondialdehyde, NaCl, Zea mays .⎯⎯⎯⎯Salt stress is one of the main environmental factors that adversely affect plant growth, productivity, and survival (Shi et al. 2007, Ferreira-Silva et al. 2012). Salt stress usually induces the overproduction of reactive oxygen species (ROS) in plant cells. Plants can protect themselves against oxidative damage by ROS-scavenging systems (Mittler 2002). Ascorbate (AsA) and glutathione (GSH) are two crucial nonenzymatic antioxidants. A fundamental role of AsA and GSH is to protect metabolic processes against H 2O 2 and other ROS. They play important roles in enzyme-catalysed reactions to detoxify H 2O 2. Besides, GSH can also protect proteins against the denaturation caused by oxidation of protein thiol groups (Noctor and Foyer 1998). The functions of AsA and GSH are closely related to their redox states (Kocsy et al. 2001) and plants can adjust redox states of AsA and GSH by modulating their regeneration and biosynthesis. L -galactose pathway is the main biosynthetic pathway of AsA biosynthesis in plants, L -galactono-1,4-lactone dehydrogenase (GalLDH; EC 1.3.2.3) is the last enzyme in L-galactose pathway (Wheeler et al. 1998). Gamma-glutamylcysteine synthetase (γ-ECS; EC 6.3.2.2) is the first enzyme for glutathione biosynthesis (Dringen 2000). AsA-GSH cycle is the pathway for the regeneration of⎯⎯⎯⎯Received 14 December 2012, accepted 28 May 2013.Abbreviations : ABA - abscisic acid; APX - ascorbate peroxidase; AsA - reduced ascorbic acid; DHA - dehydroascorbate; DHAR - dehydroascorbate reductase; GalLDH - L-galactono-1,4-lactone dehydrogenase; GR - glutathione reductase; GSH - reduced glutathione; GSSG - oxidized glutathione; JA - jasmonic acid; MDA - malondialdehyde; MDHAR - monodehydroascorbate reductase; ROS - reactive oxygen species; γ-ECS - γ-glutamylcysteine synthetase.Acknowledgements : We appreciated financial support by the Starting Fund for High-level Talents (Doctor) of Henan Institute of Science and Technology (201010611003), Science and Technology Innovation Program of Henan Institute of Science and Technology (STIPHIST), and National Natural Science Foundation of China (U1204301). * Corresponding author; fax: (+86) 373 3040337, e-mail: shchjuan1978@C. SHAN et al.2AsA and GSH. In this cycle, ascorbate proxidase (APX; EC 1.11.1.11), monodehydroascorbate reductase (MDHAR; EC 1.6.5.4), dehydroascorbate reductase (DHAR; EC 1.8.5.1), and glutathione reductase (GR; EC 1.6.4.2) are the key enzymes (Noctor and Foyer 1998). Thus, the enzymes involved in the biosynthetic and recycling pathways of ascorbate and glutathione play important roles in maintaining the redox states of ascorbate and glutathione in plants. Hydrogen sulfide (H 2S) is the third gaseous signalling molecule after nitric oxide (NO) and carbon monoxide (CO) in animals (Hosoki et al. 1997). In plants, H 2S can promote root organogenesis (Zhang et al. 2009a), seed germination (Zhang et al. 2010a), and it is involved in responses to heavy metal, salt, drought, and osmotic stresses (Zhang et al. 2008, 2009b, 2010b, Li et al. 2012, Wang et al. 2012). However, whether H 2S participates in the regulation of ascorbate and glutathione metabolism in plants under salt stress remains unknown. Hence, we investigated the effects of exogenous H 2S on the activities of enzymes involved in ascorbate and glutathione metabolism and the ratios of AsA/DHA and GSH/GSSG in maize under NaCl stress. Seeds of maize (Zea mays L.) cv. Xindan29 were sown in plastic trays filled with a sand/Vermiculite mix (1:1, v/v) and grown in a greenhouse under temperature of 25 - 30 °C, relative humidity of 70 %, irradiance of 500 µmol m -2 s -1 (photosynthetically active radiation), and a 10-h photoperiod. The seedlings were watered with distilled water every day. Fourteen days old seedlings of uniform height were selected for all experiments. Roots of plants were washed thoroughly with tap water, placed in distilled water for 8 h, and then placed in beakers containing 100 cm 3 of 100 mM NaCl solution for 48 h at 25 °C and a continuous irradiance of 500 µmol m -2 s -1. The beakers were wrapped with aluminum foil to keep the roots in dark. In order to study the effect of H 2S, a group of plants were pretreated with 0.6 mM NaHS for 8 h and then exposed to 100 mM NaCl or distilled water (control) for 48 h under the same conditions as described above. After 24 or 48 h, the top full expanded leaves were collected, frozen in liquid nitrogen, and then kept at -80 °C until used for analyses. Five seedlings were used for each analysis.APX, GR, DHAR, and MDHAR were extracted by grounding each sample (0.5 g) into fine powder in liquid nitrogen and then homogenising the fine powder in 6 cm 3 of 50 mM KH 2PO 4 (pH 7.5) containing 0.1 mM ethylenediaminetetraacetic acid, 0.3 % (v/v) Triton X-100, and 1 % (m/v) polyvinylpolypyrrolidone, with an extra addition of 1 mM AsA for APX assay (Grace and Logan 1996). The extract was centrifuged at 13 000 g and 2 °C for 15 min and the supernatant was used for assays. The activities of APX, GR, MDHAR, and DHAR were assayed according to Nakano and Asada (1981), Graceand Logan (1996), Miyake and Asada (1992), and Dalton et al. (1986), respectively. One unit of APX activity was defined as the amount of APX catalyzing the oxidation of 1 μmol ascorbate per min. One unit of GR activity was defined as the reduction of 1 μmol NADPH per min. One unit of DHAR activity was defined as the amount of enzyme that produces 1 μmol AsA per min. One unit of MDHAR activity was defined as the amount of enzyme that oxidizes 1 μmol NADH per min.GalLDH was extracted and measured by the method of Tabata et al. (2001). γ-ECS was extracted and measured by the method of Rüeggseger and Brunold (1992). One unit of GalLDH activity was defined as the amount of extract required to oxidize 1 nmol of L -Gal (equivalent to the formation of 2 nmol of reduced Cyt c ) per min. One unit of γ-ECS activity was defined as1 μmol cysteine-dependently generated PO 43–per min. AsA and DHA were measured according to Hodges et al. (1996). GSSG and GSH were measured according to Griffith (1980). Malondialdehyde (MDA) content and electrolyte leakage were measured according to Hodges et al. (1999) and Zhao et al. (2004), respectively. Protein content was assayed according to Bradford (1976).The experimental design was a randomized complete block design with five replications. Means were compared by one-way ANOVA and Duncan’s multiple range test at the 5 % level of significance.There were no obvious changes in the activities of APX, GR, DHAR, MDHAR, GalLDH, and γ-ECS in control plants after 24 and 48 h. Compared with the controls, NaCl stress (24 or 48 h) significantly increased the activities of the above mentioned enzymes. Pretreatment with H 2S significantly increased the activities of APX, GR, DHAR, GalLDH, and γ-ECS compared with NaCl alone. However, pretreatment with exogenous H 2S alone did not affect the activities of the enzymes in ascorbate and glutathione metabolismcompared with the controls (Table 1).There were also no obvious changes in the ratios of AsA/DHA and GSH/GSSG in control leaves after 24 and 48 h. Compared with the control, the salt stress significantly decreased the ratios of AsA/DHA and GSH/GSSG after 24 or 48 h, however, less after pretreatment with H 2S. The pretreatment with H 2S alone did not affect these ratios (Table 1).To investigate whether H 2S has an important role for salt stress tolerance in maize leaves , the effects of pretreatment with exogenous H 2S on electrolyte leakage and MDA content under salt stress were studied. The results show that there was no difference between the controls and pretreatment with H 2S alone in the electrolyte leakage and MDA content after 24 and 48 h of the treatment. The addition of NaCl significantly increased the electrolyte leakage and MDA content compared to the controls but less after the pretreatment with H 2S (Table 1).Many studies have proved that salt stress can induce oxidative damage in plants (Fatehi et al. 2012, Sorkheh et al. 2012). In our study, enhanced lipid peroxidation, asASCORBATE-GLUTATHIONE CYCLE UNDER SALT STRESS3Table 1. Effects of salt stress (100 mM NaCl) and H 2S (0.6 mM NaHS) pretreatment on the activities of enzymes involved in ascorbate and glutathione metabolism, the ratios of AsA/DHA and GSH/GSSG, malondialdehyde content, and electrolyte leakage in maize leaves measured after 24 or 48 h. Means ± SE, n = 5. Different letters within the same row indicate statistically significant differences according to Duncan’s test (P < 0.05).Parameters Time [h] Control NaHS NaCl NaHS + NaCl APX [U mg -1(protein)] 24 1.50 ± 0.10c 1.60 ± 0.10c 2.30 ± 0.15b3.00 ± 0.19a 48 1.30 ± 0.08c 1.50 ± 0.11c2.50 ± 0.17b3.30 ± 0.20a GR [U mg -1(protein)] 24 1.70 ± 0.11c 1.60 ± 0.11c 2.40 ± 0.14b 3.30 ± 0.18a 48 1.60 ± 0.09c 1.60 ± 0.08c 2.30 ± 0.12b 3.20 ± 0.20a DHAR [U mg -1(protein)] 24 2.50 ± 0.15c 2.30 ± 0.12c 3.65 ± 0.24b 5.00 ± 0.41a 48 2.70 ± 0.17c 2.50 ± 0.14c3.85 ± 0.28b4.90 ± 0.38a MDHAR [U mg -1(protein)] 24 0.80 ± 0.05b 0.90 ± 0.07b 1.50 ± 0.10a 1.70 ± 0.10a 48 0.70 ± 0.05b 0.90 ± 0.06b1.70 ± 0.11a 1.60 ± 0.09a γ-ECS [U mg -1(protein)] 24 1.50 ± 0.09c 1.60 ± 0.12c 2.30 ± 0.14b 3.20 ± 0.19a 48 1.60 ± 0.10c 1.50 ± 0.11c2.50 ± 0.15b3.50 ± 0.23a GalLDH [U g -1(f.m.)] 24 0.90 ± 0.06c 1.00 ± 0.07c 1.60 ± 0.12b 2.40 ± 0.16a 48 1.00 ± 0.08c 1.10 ± 0.09c 1.70 ± 0.12b 2.30 ± 0.14a AsA/DHA 24 19.9 ± 1.43a 19.3 ± 1.36a 13.5 ± 1.04c 16.5 ± 1.18b 48 19.5 ± 1.38a 19.5 ± 1.41a 13.0 ± 1.01c 16.7 ± 1.13b GSH/GSSG 24 21.0 ± 1.58a 20.7 ± 1.52a 12.0 ± 0.99c 16.8 ± 1.16b 48 20.5 ± 1.42a 20.5 ± 1.51a12.3 ± 1.03c 17.0 ± 1.20b MDA content [nmol g -1(f.m.)] 24 7.50 ± 0.49c 7.20 ± 0.45c 14.0 ± 1.11a 10.0 ± 0.81b 48 8.00 ± 0.61c 7.50 ± 0.50c 19.0 ± 1.33a 13.0 ± 1.06b Electrolyte leakage [%] 24 8.60 ± 0.68c 8.50 ± 0.65c 15.0 ± 1.14a 11.0 ± 0.91b 48 9.00 ± 0.73c 8.50 ± 0.64c19.0 ± 1.34a14.0 ± 1.15bindicated by the increased MDA content, and the electrolyte leakage were observed in the maize leaves in response to the 100 mM NaCl treatment. This result suggests that salt stress also induced oxidative stress in maize. To cope with it, the activities of antioxidants were up-regulated.Our results show that the ratio of AsA/DHA decreased under the salt stress that was consistent with a previous study (Ferreira-Silva et al. 2012). The redox state of ascorbate is controlled by enzymes involved in its biosynthetic and recycling pathways. In the present study, the salt stress increased the activities of APX, DHAR, and MDHAR. Similarly, it has been reported that salt stress increases APX activity in lentil and mungbean (Bandeo ğlu et al. 2004, Nazar et al. 2011) and DHAR and MDHAR activities in pea (Hernández et al. 1999, 2000). However, Ferreira-Silva et al (2012) reported that salt stress decreases APX activity in cashew leaves. Talukdar (2012) reported that salt stress does not affect MDHAR activity in Lathyrus sativus . These discrepancies may be due to the use of different plant species. Besides, we also found that the salt stress increased the GalLDH activity in the maize leaves. Many studies showed that H 2S, as a signal molecule, can modulate antioxidant response in plants under stresses (Wang et al. 2010, Chen et al. 2013). It has been reported that pretreatment with H 2S increases APX activity in alfalfa under salt stress (Wang et al. 2012). In the presentstudy, we found that the pretreatment with H 2S increased the APX activity under the NaCl stress that is consistent with a previous study (Wang et al. 2012). Besides, H 2S increased the activities of DHAR and GalLDH, and the ratio of AsA/DHA in the maize leaves under the salt stress. On the other hand, the MDHAR activity was not increased. These results suggest that the pretreatment with H 2S could increase AsA/DHA through the stimu-lation of the biosynthetic and recycling pathways of AsA. The redox state of glutathione can be maintained by γ-ECS and GR which are involved in the biosynthetic and recycling pathways of glutathione, respectively. Increase in GR activity in response to salinity stress in pea plants has been reported (Hernández et al. 1999, 2000). Mittova et al. (2003) reported that salt stress up-regulates γ-ECS protein in tomato. In the present study, the salt stress up-regulated the activities of γ-ECS and GR in the maize leaves which is consistent with previous studies (Hernández et al. 1999, 2000, Mittova et al. 2003). The NaCl stress decreased the ratio of GSH/GSSG in the maize leaves. However, Ferreira-Silva et al (2012) reported that salt stress increases the ratio of GSH/GSSG in cashew. In the present study, H 2S increased the activities of γ-ECS and GR, and the ratio of GSH/GSSG under the salt stress. Therefore, the pretreatment with H 2S could maintain the redox state of GSH under the salt stress.Signal molecules, such as Ca 2+, H 2O 2, NO, abscisicC. SHAN et al.4acid (ABA), and jasmonic acid (JA), can regulate ascorbate and glutathione metabolism and have important roles in responses to stresses (Li et al. 1998, Jiang and Zhang 2003, Wendehenne et al. 2004, Arasimowicz and Floryszak-Wieczorek 2007, Ai et al. 2008, Hu et al. 2008). In the present study, we found that H 2S may regulate the ascorbate and glutathione metabolism and has an important role in defencing oxidative stress in maize leaves. Wang et al. (2012) reported that NO is involved in the signal transduction of H 2S in regulating antioxidant response to salt stress in alfalfa. It has also been reported that ABA and JA can induce the production of H 2S and H 2O 2 in the process of stomatal closure (Hou et al. 2011, Liu et al. 2011). However, the signal transduction of H 2S in regulating ascorbate and glutathione metabolism remains unclear. So, it will be very interesting to investigate the relationship between H 2S and above signal molecules in regulating ascorbate and glutathione metabolism in plants.NaHS in solutions has been widely used for production of H 2S (Hosoki et al. 1997). However, these solutions also contain Na + and other sulfur-containing components. In order to verify that H 2S/HS – rather than other compounds derived from NaHS is responsible for the regulation of the ascorbate and glutathione metabolism in the maize seedlings under the salt stress,Na 2S, Na 2SO 4, Na 2SO 3, NaHSO 4, NaHSO 3, and NaAC(0.6 mM) were used as the controls of NaHS. The results show that above mentioned sulfur-containing components and Na + were not responsible for the increases in the ratios of AsA/DHA and GSH/GSSG under the salt stress (data not shown). These results suggest that H 2S or HS – derived from NaHS play an important role in regulating the ascorbate and glutathione metabolism under salt stress.In conclusion, our results clearly suggest that exogenous H 2S regulated the ascorbate and glutathione metabolism, which, in turn, enhanced the antioxidant ability and protected the maize seedlings against oxidative stress induced by the salt stress. These results also suggest that H 2S could be used as a regulator of salt tolerance of maize.ReferencesAi, L., Li, Z.H., Xie, Z.X., Tian, X.L., Eneji, A.E., Duan, L.S.:Coronatine alleviates polyethylene glycol-induced water stress in two rice (Oryza sativa L.) cultivars. - J. Agron. Crop Sci. 194: 360-368, 2008.Arasimowicz, M., Floryszak-Wieczorek, J.: Nitric oxide as abioactive signalling molecule in plant stress responses. - Plant Sci. 172: 876-887, 2007.Bandeo ğlu, E., Eyido ğan, F., Yücel, M., Öktem, H.A.:Antioxidant responses of shoots and roots of lentil to NaCl-salinity stress. - Plant Growth Regul. 42: 69-77, 2004.Bradford, M.M.: A rapid and sensitive method for thequantitation of microgram quantities of protein utilizing the principle of protein-dye binding. - Anal. Biochem. 72: 248-254, 1976.Chen, J., Wang, W.H., Wu, F.H., You, C.Y., Liu, T.W., Dong,X.J., He, J.X., Zheng, H.L.: Hydrogen sulfide alleviates aluminum toxicity in barley seedlings. - Plant Soil 362: 301-308, 2013.Dalton, D.A., Russell, S.A., Hanus, F.J., Pascoe, G.A., Evans,H.J.: Enzymatic reactions of ascorbate and glutathione that prevent peroxide damage in soybean root nodules. - Proc. nat. Acad. Sci. USA 83: 3811-3815, 1986.Dringen, R.: Glutathione metabolism and oxidative stress inneurodegeneration. - Eur. J. Biochem. 267: 4903, 2000.Fatehi, F., Hosseinzadeh, A., Alizadeh, H., Brimavandi, T.,Struik, P.C.: The proteome response of salt-resistant and salt-sensitive barley genotypes to long-term salinity stress. - Mol. Biol. Rep. 39: 6387-6397, 2012.Ferreira-Silva, S.L., Voigt, E.L., Silva, E.N., Maia, J.M.,Aragão, T.C.R., Silveira, J.A.G.: Partial oxidative protection by enzymatic and non-enzymatic components in cashew leaves under high salinity. - Biol. Plant. 56: 172–176, 2012. Grace, S.C., Logan, B.A.: Acclimation of foliar antioxidantsystems to growth irradiance in three broad-leaved evergreen species. - Plant Physiol. 112: 1631-1640, 1996.Griffith, O.W.: Determination of glutathione and glutathionedisulfide using glutathione reductase and 2-vinylpyridine. - Anal. Biochem. 106: 207-212, 1980.Hernández, J.A., Campillo, A., Jiménez, A., Alarcon, J.J.,Sevilla, F.: Response of antioxidant systems and leaf water relations to NaCl stress in pea plants. - New Phytol. 141: 241-251, 1999.Hernández, J.A., Jiménez, A., Mullineaux, P., Sevilla, P.F.:Tolerance of pea (Pisum sativum ) to long term salt stress is associated with induction of antioxidant defences. - Plant Cell Environ. 23: 853-862, 2000.Hodges, D.M., Andrews, C.J., Johnson, D.A., Hamilton, R.I.:Antioxidant compound responses to chilling stress in differentially sensitive inbred maize lines. - Physiol. Plant. 98: 685-692, 1996.Hodges, M.D., DeLong, J.M., Forney, C.F., Prange, R.K.:Improving the thiobarbituric acid-reactive-substances assay for estimating lipid peroxidation in plant tissues containing anthocyanin and other interfering compounds. - Planta 207: 604-611, 1999.Hosoki, R., Matsuki, N., Kimura, H.: The possible role ofhydrogen sulfide as an endogenous smooth muscle relaxant in synergy with nitric oxide. - Biochem. biophys. Res. Commun. 237: 527-531, 1997.Hou, Z.H., Liu, J., Hou, L.X., Li, X.D., Liu, X.: H 2S mayfunction downstream of H 2O 2 in jasmonic acid-induced stomatal closure in Vicia faba . - Chin. Bull. Bot. 46: 396-406, 2011.Hu, X., Wang, W., Li, C., Zhang, J., Lin, F., Zhang, A., Jiang,M.: Cross-talks between Ca 2+/CaM and H 2O 2 in abscisic acid-induced antioxidant defense in leaves of maize plants exposed to water stress. - Plant Growth Regul. 55: 183-198, 2008.Jiang, M., Zhang, J.: Cross-talk between calcium and reactiveoxygen species originated from NADPH oxidase in abscisicASCORBATE-GLUTATHIONE CYCLE UNDER SALT STRESS5acid-induced antioxidant defence in leaves of maize seedlings. - Plant Cell Environ. 26: 929-939, 2003.Kocsy, G., Galiba, G., Brunold, C.: Role of glutathione inadaptation and signaling during chilling and cold acclimation in plants. - Physiol. Plant. 113: 158-164, 2001. Li, L., Wang, Y., Shen, W.: Roles of hydrogen sulfide and nitricoxide in the alleviation of cadmium-induced oxidative damage in alfalfa seedling roots. - Biometals 25: 617-631, 2012.Li, L., Van Staden, J., Jäger, A.K.: Effects of plant growthregulators on the antioxidant system in seedlings of two maize cultivars subjected to water stress. - Plant Growth Regul. 25: 81-87, 1998.Liu, J., Hou, Z., Zhao, F., Liu, X.: Hydrogen sulfide mediatesABA-induced stomatal closure of Vicia faba L. - Acta bot. boreal-occident. sin. 31: 298-304, 2011.Mittler, R.: Oxidative stress, antioxidants and stress tolerance. -Trends Plant Sci. 7: 405-410, 2002.Mittova, V., Theodoulou, F.L., Kiddle, G., Gomez, L.,Volokita, M., Tal, M., Foyer, C.H., Guy, M.: Coordinate induction of glutathione biosynthesis and glutathione metabolizing enzymes is correlated with salt tolerance in tomato. - FEBS Lett. 554: 417-421, 2003.Miyake, C., Asada, K.: Thylakoid-bound ascorbate peroxidasein spinach chloroplasts and photoreduction of its primary oxidation product monodehydroascorbate radicals in thylakoids. - Plant Cell Physiol. 33: 541-553, 1992.Nakano, Y., Asada, K.: Hydrogen peroxide is scavenged byascorbate specific peroxidase in spinach chloroplasts. - Plant Cell Physiol. 22: 867-880, 1981.Nazar, R., Iqbal, N., Syeed, S., Khan, N.A.: Salicylic acidalleviates decreases in photosynthesis under salt stress by enhancing nitrogen and sulfur assimilation and antioxidant metabolism differentially in two mungbean cultivars. - J. Plant Physiol. 168: 807-815, 2011.Noctor, G., Foyer, C.H.: Ascorbate and glutathione: keepingactive oxygen under control. - Annu. Rev. Plant Physiol. 49: 249-279, 1998.Rüegsegger, A., Brunold, C.: Effect of cadmium on γ-glutamylcysteine synthesis in maize seedlings. - Plant Physiol. 99: 428-433, 1992.Shi, Q., Ding, F., Wang, X., Wei, M.: Exogenous nitric oxideprotects cucumber roots against oxidative stress induced by salt stress. - Plant Physiol. Biochem. 45: 542-550, 2007. Sorkheh, K., Shiran, B., Rouhi, V., Khodambashi, M., Sofo, A.:Salt stress induction of some key antioxidant enzymes and metabolites in eight Iranian wild almond species. - ActaPhysiol. Plant. 34: 203-213, 2012.Tabata, K., Oba, K., Suzuki, K., Esaka, M.: Generation andproperties of ascorbic acid-deficient transgenic tobacco cells expressing antisense RNA of L-galactono-1,4-lactone dehydrogenase. - Plant J. 27: 139-148, 2001.Talukdar, D.: Ascorbate deficient semi-dwarf asfL1 mutant ofLathyrus sativus exhibits alterations in antioxidant defense. - Biol. Plant. 56: 675-682, 2012.Wang, B.L., Shi, L., Li, Y.X., Zhang, W.H.: Boron toxicity isalleviated by hydrogen sulfide in cucumber (Cucumis sativus L.) seedlings. - Planta 231:1301-1309, 2010.Wang, Y., Li, L., Cui, W., Xu, S., Shen, W., Wang, R.:Hydrogen sulfide enhances alfalfa (Medicago sativa ) tolerance against salinity during seed germination by nitric oxide pathway. - Plant Soil 351: 107-119, 2012.Wendehenne, D., Dumer, J., Klessing, D.F.: Nitric oxide: a newplayer in plant signaling and defense responses. - Curr. Opin. Plant Biol. 7: 449-455, 2004.Wheeler, G.L., Jones, M.A., Smirnoff, N.: The biosyntheticpathway of vitamin C in higher plants. - Nature 393: 365-369, 1998.Zhang, H., Hu, L.Y., Hu, K.D., He, Y.D., Wang, S.H., Luo,J.P.: Hydrogen sulfide promotes wheat seed germination and alleviates the oxidative damage against copper stress. - J. Integr. Plant Biol. 50: 1518-1529, 2008.Zhang, H., Jiao, H., Jiang, C.X., Wang, S.H., Wei, Z.J., Luo,J.P., Jones, R.L.: Hydrogen sulfide protects soybean seedlings against drought-induced oxidative stress. - Acta Physiol. Plant. 32: 849-857, 2010b.Zhang, H., Tang, J., Liu, X.P., Wang, Y., Yu, W., Peng, W.Y.,Fang, F., Ma, D.F., Wei, Z.J., Hu, L.Y.: Hydrogen sulfide promotes root organogenesis in Ipomoea batatas , Salix matsudana and Glycine max . - J. Integr. Plant Biol. 51: 1086-1094, 2009a.Zhang, H., Wang, M.J., Hu, L.Y., Wang, S.H., Hu, K.D., Bao,L.J., Luo, J.P.: Hydrogen sulfide promotes wheat seed germination under osmotic stress. - Russ. J. Plant Physiol. 57: 532-539, 2010a.Zhang, H., Ye, Y.K., Wang, S.H., Luo, J.P., Tang, J., Ma, D.F.:Hydrogen sulfide counteracts chlorophyll loss in sweetpotato seedling leaves and alleviates oxidative damage against osmotic stress. - Plant Growth Regul. 58: 243-250, 2009b.Zhao, L.Q., Zhang, F., Guo, J.K., Yang, Y.L., Li, B.B., Zhang,L.X.: Nitric oxide functions as a signal in salt resistance in the calluses from two ecotypes of reed. - Plant Physiol. 134: 849-857, 2004.。
