兰州大学 物理化学和化工原理 2009
兰州大学2009年免试攻读硕士学位研究生学生名单

兰州大学2009年免试攻读硕士学位研究生学生名单文学院16人:推荐校内:施玮妮杜冰心王亚玲普光耀张华君刘琳李雪凤刘涛蔡梦云张云虹王娟赵维娟宋洁推荐外校:李成晴闫姗姗鹿麟新闻学院16人:推荐校内:丁茜茜曹馨月屈丽丽蒋永峰张果张保英徐健张昊林媛熹武丽梅白丽媛宋燕李海瑞推荐外校:刘晶晶师同谢宽历史学院38人:推荐校内:路婷王默马兴龙侯廉洁陈芳芳田婕何瑞黄祥深崔明孟永强张晓磊张厚进魏建鹏王晶赵宇翔陈光文何小双樊遂桥关楠楠吴通宋翔陈妍蓉张江川彭露温梦煜杨建超毕雪辉姚冉冉曲江高秀军推荐外校:杨瑒鲁建娥张卫芝王炳文薛晓琳李鸿敏韩冠群冯倩哲社学院8人:推荐校内:韩秀琴谢榕何晓波赵妍田飞推荐外校:王嘉新李成雯顾璟经济学院32人:推荐校内:武蓉刘延丽周晓莲王丽娜欧阳青虎姜建英陈彦睿李岩胡建光王刚李琴任一博贾志杰王春辉安利花贺静吴南万湘媛邱宝金周丽华韩硕辰翁海晶李奇李元红贾修斌王龙魁推荐外校:洪玉娟杨帆虞文昕武宝成孙艳青田雪管理学院25人:推荐校内:徐腾阮铭华唐玉玲张方丽包军强王文静李丽娜张钦华李芳红邵千芸李毅刘庆庆李朝晖李美鑫钟守松钦晖王兴平李雨星王丝尧瞿琼丹推荐外校:马勇刘能清何莉赵静佘运成政治学院11人:推荐校内:李合香岳晓方李东坡陈金山李亚吴琳琳王静强东妮胡阳推荐外校:邓晖高栓龙法学院9人:推荐校内:贺瑞华蔡立群王更吴晓倩杨建权杨宝伟周光旭推荐外校:王斌李海彦教育学院7人:推荐校内:甘佳强桂马海燕祁娟高晓明推荐外校:胡晓琼廖红红外语学院15人:推荐校内:徐洋吴少红闫阿茹薛瑞王艳霞郭海霞马静静胡静李红英刘敬敬蒋京兰郭绍鉴推荐外校:许慧朱佳瑶谢非数学学院36人:推荐校内:赵伟刚杜善达刘存才孙午阳姚嘉张海波邢紫莉董瑶江河张晋田文义纳仁花刘佳王凡安晓娟徐州吴洁李燕陈玉柱杨立贺壬癸王凯敏张丽娜郭放徐强张玉娟杨阳阳推荐外校:曾令辉刘蒙蒙贾瑞玲孙海青吴晶李鹏肖成钟敏李好好物理学院62人:推荐校内:李阳杨科贾林玉栗云亮龚露倩史振华张莎马小明张钊琦孙小磊张晶夏海燕毛葛永李飞毛普建褚士兵张晓倩王志灵陈万军宋杰王真张文辉吕华崔鹏碧李拴魁葛洪磊魏智伟盛晓燕蒲鹏钟渊马传生齐阔方侃王朝林陈菩祥郑挺才蒲年年林安安时博刘颖路富亮史玉茸谢清水吴晓楠夏永欣张发智推荐外校:陶玲玲张云龙李远飞钟寅赵博震伍岳闫鑫郑新奇魏清余斌唐晋宇王军王月月李军旺刘朋闯陈颖慧核学院43 人:推荐校内:张成俊沈飞郭锐王永佳闫永宏杨尧杨林邹春燕杨乾王大伟钟火平朱天宝蔡凌志兰明聪赵磊林俏露姬明超梁宇张世旭张昱莹黄磊杨晶牛婷婷潘多强谈存敏叶远虑丁克非刘福强推荐外校:王勇鲁谨章卫王志刚燕新强赵皓贵王宇飞付婧高丙水龙远奎曹龙生张思纬羊本林王文华王建新信息学院 44人:推荐校内:柏京李英曲超孔德乾买小云童玲莉黄艳丽冯晓文吴喜广袁金霞谭强陈岩杜厚庆张强张范勇刘长年焦燕妮李勇昌董震金国军文平郑芳夏淑媛戚艳兵吕清泉陈帆刘沙张海燕李志勇陈炅昕刘翠林孙喜成阮钶茵李淑萍于静推荐外校:吴松涛周瑞莉孙自强李建文李濛陈丽花李波赵明王辉化学学院 67人:推荐校内:鲍旭赵常贵王瑞范大双李树文戚微岩袁圣柳崔洁马崇博段金伟马小杰王明芳杨庆杜鹏程韩润丰田昊刘健谢国强刘许强马作栋屈虎孟凯朱宜硕石晓康王玉姣杨艳芳卢念红张玉珍张媛杨晓哲李自洋张海龙薛伟伟靖鹏郝婷婷祝海涛朱俊岭朱海亮陈晨王安琪彭金宝杨二群曾维静余思敏张媛庆郭婧婧李琰宋彦林严长松赵永龙张学建胡礼梅推荐外校:郭彬杰宋学志陈博李响利于姗赵桂霞张丽晶蔡顺有赵彦超龙官奎雷静胡安华李康徐珍珍杨蓓生命学院 85人:推荐校内:唐俊峰彭守璋许莎莎杨小汇王瑶索南吉张婧彭艳玲马涛王峰熊俊兰任广朋朱宁钱东任志忠邹嘉宾王丽君张莹赵元琳赵宁宁陈照明尹稳孙旺盛贾耀梅张炳岳潇轩杨永新苏峰宋春丽关钰尚琛晶王丽艳张正琦杨冰玉杨青王斌韦雪巨富荣张林汪海基马丽娟马苗杨涛包小辉朱炜歆许秀菲李昌明邵莎苑辛英于志睿王君慕晶王德建关猛猛李博李加龙邸晓棠王婧马力德王玉鹏张济泽董利苹杨森胡泉军吴敏侯睿周翠翠薛莉推荐外校:李海森乔文慧马晓艳强敏杨晓峰王玉秋赵英杰陈赣楚海艳孙阳郭强那慧敏张玲李倩朱嘉周倩陈扬勋赵琳资环学院 75人:推荐校内:陈冠张旭昇丰华朱佳君张华安胡雅杰王泸文张曼董重王君兰吴小斌刘扬赵春升李宝锋张永姣王凡李晓亚白益军管东升李英杰郭晖李明治张肖剑祝合勇刘佳杜功元别强刘惠峰赵博张朴周利鹏侯伟杨丽娜董惟妙张鹏邓洋赵文伟李琳琳张艳丽张忱郭鹏周伟武文飞王博安娟丁杰萍闫文娟廖琴雷兴龙闫晶周炜张钦凯刘威徐燕黄波吴晟李芙蓉杨冬雪苏军德推荐外校:周冉王伟王艳茹郑荣国梁友嘉张亚玲朱美林王晓君李香钰吕丽莉李静顾建宇齐丽丽黄道杨少平徐雄推荐校内:单海霞胡菊王丽娟雒佳丽吴学珂于海鹏赵钱飞杨小银李燕军陈霖白晓平石磊胡蝶吴徐燕陈晓燕冯岚商丽楠商林刘萱孙运祥胡永亮章如东尹瑞雪王治厅李友鹏徐鑫强李宏宇王五科石晓明周天靳泰建推荐外校:刘刚刘瑞黄艳艳邢楠张淼杨世莉李进张蕊袁憧憬皇群博草业学院 16人:推荐校内:邹德富白贺兰张重丽邓斌牛学礼刘志云王生银李欣勇宋梅玲王娟张春平孙义推荐外校:李泽西石勇孙晓晨邱文敏艺术学院 8人:推荐校内:李娜顾苏娟蔺丹刘永庆肖永杰李清利推荐外校:吴双翼李璐工学院 26人:推荐校内:钱立根谢亮傅林涛陶照堂李健张娟娟韩雪冰王鹏熊立婷周天平范庆李高敏李江宋丙辉王海翠马艳萍卡毛措张妮李玲张明推荐外校:王亚敏唐学庆刘德坤苑伟娜赵楠卢一亭第一临床医学院人:推荐校内:高小倩李俊峰张亚婷赵娜肖祖容高丽王琼张娟丽靳蕊蕊王永霞韩利娜路小茸刘小琴高承霞周梅恺李榆伏晓琳张玉荣李芸芝涂巧丽蒋舒明邢艳红高向梅王静邓黎黎段丽芳王东萍葛玮张晓敏时荣索凌云李洁赵君张虹丽徐旭王海亮刘雅婷颉宾芳陈佳佳刘凤凤李思佳韦艳霞杨海静张婷婷韩晓燕罗琴辛奇周伟于敏蔡明林王媛推荐外校:郜珊珊刘雁峰赵瑜梨关晓英朱燕萍邵宁高明雅高江晖许琳涓何娟娟第二临床医学院 16人:推荐校内:宋佳郭智慧董海涛李洁郭雅琼蒋瑛李娟毛丽张红娟郭柳青王玲王静李姝汶南书玲推荐外校:苏榕毛春洁公共卫生学院9 人:推荐校内:谭姣李学平刘磊成瑶龚地萍李福轮赵娜娟史晓媛推荐外校:李睿推荐校内:陈斌齐元园梁恒燕吴溪溪药学院 10 人:推荐校内:曹静季芳张建萍张帆王娟白崇亮沈孝丽余青红推荐外校:柯钧赵永雪创新人才20人唐骁爽杨增玺移康盛晓赟叶玉伟李若冰何綦琪柳丹妮何眉徐然贾双跃陈晓洪施泽东王培培迟德中王锡洁滕飞周炜超王赟姣保海旭。
兰州大学2009年国家大学生创新性实验计划项目专家评审

类别 序号 1 2 3 4 5 6 7 8 文科 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 项目名称 负责人 晚清、民国初年小说形象中的塾师研究 董 卫 甘肃省高校慈善文化建设现状调查及对策研究 韩 笑 甘肃省肃南裕固族自治县开发利用文化资源与保护民族文化的关系研究 安江哈吾尔 陇东革命根据地的社会统合与动员机制研究 王 哲 城市金融生态视角下兰州中小企业融资问题研究 封小海 甘肃省试点农村资金互助社的运行模式与绩效评价 丁子然 不同类型音乐对小鼠依赖和抑郁性方面行为学影响 张 璐 基于修正PRA方法的合作社模式对非物质文化遗产保护的作用研究--以兰州鼓子的调查与 殷 雪 实验为例 传统工艺在市场经济条件下的机遇与挑战——以临夏葫芦和兰州葫芦两种不同发展方式 冯洪玲 为例 农产品行业协会在甘肃省特色农产品法律保护实践中的作用研究 付冠男 火车票实民名制调研与分析 李英博 行政区划对白马藏族文化传播与文化重建的影响——基于对地震灾后甘川交界地带白马 杨胜利 藏族调查研究 欠发达地区基层政府干预经济发展模式及绩效评价 战丽媛 笹川日中友好基金对中国西南地区捐助情况以及在捐助地的影响情况调查 赵珊珊 甘肃少数民族旅游文化资源保护和开发 王 昕 Salen-Fe和salen-Ni催化二氧化碳和环氧合成环碳酸酯 田 园 拟南芥抗水杨酸突变体的筛选和分子遗传学研究 管玉坤 系列酰胺型氮杂冠醚对(VI)及其裂变产物的萃取分类研究 王建涛 局域表面等离子体介导的能量及电荷传递现象研究 龚玺瑞 新型VUV激发发光材料的研制 邵丽琴 基于蓝牙的手机陈列移动分布式计算系统 盛 勇 基于视频分析的三维角色动画技术的研究 王彦斐 铬渣堆场土壤中铬污染扩散规律研究 汤薪瑶 沉积物对重金属元素的吸附性研究 刘文婧 基于地物特征的环境卫星高光谱影像几何精纠正方法的研究 郭志谦 所在学院 历史学院 政治学院 文学院 历史学院 经济学院 经济学院 艺术学院 经济学院 文学院 法学学院 管理学院 新闻学院 经济学院 外语学院 新闻学院 核学院 生命学院 核学院 化学学院 物理学院 信息学院 信息学院 资环学院 资环学院 资环学院
兰州大学分析化学和物理化学2007-2011年考研真题及答案解析

目录Ⅰ历年真题试卷 (2)兰州大学2007年招收攻读硕士学位研究生考试试题 (2)兰州大学2008年招收攻读硕士学位研究生考试试题 (6)兰州大学2009年招收攻读硕士学位研究生考试试题 (10)兰州大学2010年招收攻读硕士学位研究生考试试题 (14)兰州大学2011年招收攻读硕士学位研究生考试试题 (18)Ⅱ历年真题答案解析 (22)兰州大学2007年招收攻读硕士学位研究生考试试题答案解析 (22)兰州大学2008年招收攻读硕士学位研究生考试试题答案解析 (34)兰州大学2009年招收攻读硕士学位研究生考试试题答案解析 (49)兰州大学2010年招收攻读硕士学位研究生考试试题答案解析 (61)兰州大学2011年招收攻读硕士学位研究生考试试题答案解析 (73)Ⅰ历年真题试卷兰州大学2007年招收攻读硕士学位研究生考试试题招生专业:化学化工学院无机化学、分析化学、有机化学、物理化学、高分子化学与物理、化学信息学、药物化学生物学考试科目:613分析化学和物理化学(分析化学占40%)注意:答案请一律写在答题纸上,写在试题上无效分析化学一、填空题(20分)1误差分为系统误差和偶然误差,为了减小系统误差,通常采用____________,____________和____________试验。
为了减小偶然误差,通常____________。
2滴定分析按操作方式可分为____________,____________,____________和____________。
3在配位滴定中常用EDTA为滴定剂,它是____元酸,在水中呈____种状态,只有___与金属配位,为了保证配位滴定的顺利进行,通常体系中加入_____维持EDTA形态。
4氧化还原滴定中,等当点电位的表达式是______________,在滴定结束前,利用_______计算体系的电位。
在滴定200%处,体系电位为______的电位。
5沉淀滴定通常是银量法,分为3种方式,分别为____________,____________,___________。
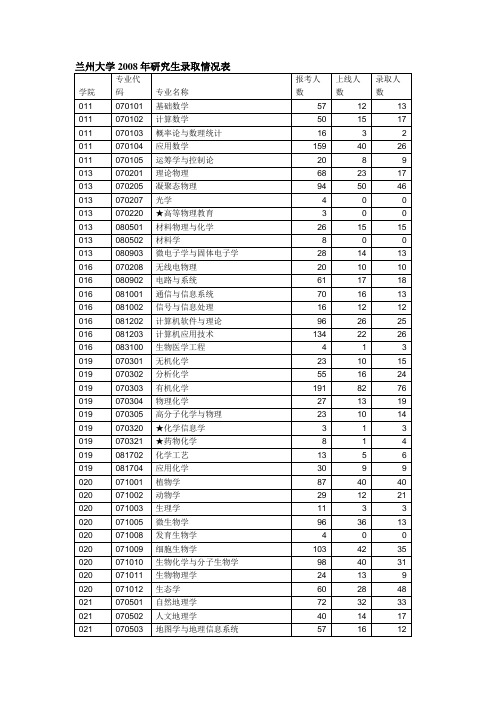
兰大历年录取
3
4
021
070902
地球化学
3
3
4
021
070903
古生物学与地层学
10
7
8
021
070904
构造地质学
12
6
6
021
070905
第四纪地质学
20
10
8
021
077501
环境科学
17
4
8
021
081501
水文学及水资源
10
5
11
021
083002
环境工程
47
28
20
022
070520
★草业地理信息学
30
3
4
14
11
3
020
生命学院
071008
发育生物学
4
1
3
0
9
6
3
020
生命学院
071009
细胞生物学
48
39
9
11
30
21
9
020
生命学院
071010
生物化学与分子生物学
44
38
6
12
28
22
6
020
生命学院
071011
生物物理学
8
5
3
1
5
2
3
020
生命学院
071012
生态学
65
34
31
8
43
12
101
25
31
076
050402
音乐学
34
兰州大学2008~2009学年第1学期期末考试试卷(A卷)

射性活度关系。 3. 简述核力的性质。 4. 简述实验发现的α 衰变的物理规律并给出物理解释。
(10 分) (10 分) (20 分)
5. 对于反应 10 B d 8 Be 17.8MeV ,当氘的能量为 0.6MeV 时,在=900 方向上观 测到四种能量的α 粒子:12.2, 10.2, 9.0, 7.5MeV, 试求 8 Be 的激发能。 6. 试判断 3/2-7/2-, 3/2-9/2-, 9/2+1/2+β 跃迁的性质。 7. 是判断 1+0+,1+1+,1+2+跃迁的类型。 (20 分) (15 分) (15 分)
N 2 (t )
2 1
1
N1 (0)(e 1t e 2t )
2 1 1 1 N1 (t )[1 e ( )t ] 2 1
2 1
2
1
N (0)e 1 [1 e ( 2 1 )t ]
由于 1 < 2 ,当 t 足够大时,有 e( )t <<1,则此时上式成为
197*1.66*1021 98.7*10-24 *1012 *0.02*19.3 197 *1.66*1021
1.2*108 (/cm )
2
N IN s
It
所以 N0= N t=1.28×108×5×60=3.84×1010(/cm2)
t 所以 A Ne =
log A 86.25log E 式中 A 为常量。
由上式可见,衰变常量 随α 粒子的能量的改变而剧烈地变化。 5.解: 当
900 时,Q 方程为
A A Q a 1 Ea b 1 Eb AB AB
代入数据,可以求得其激发能分别为:
兰州大学参考书目

兰州大学2010年硕士研究生招生参考书目
说明:从2009年起,教育部提倡各招生单位不指定参考书目。
我校部分学院不再提供相关考试科目的参考书目。
考生可根据报考专业和考试科目自行选择相关参考书作为参考。
有一部分学院的参考书目还未上报,学院上报后我办会即时更新。
高等数学参考书目
011数学与统计学院参考书目
013物理科学与技术学院参考书目
016信息科学与技术学院参考书目
019化学化工学院参考书目
020生命科学学院参考书目
021资源环境学院参考书目
022草地农业科技学院参考书目
025大气科学学院参考书目
026土木工程与力学学院参考书目
027核科学与技术学院参考书目
031基础医学院参考书目
033口腔医学院参考书目
034公共卫生学院参考书目
035药学院参考书目
036第一临床医学院不提供参考书目037第二临床医学院不提供参考书目061文学院参考书目
062历史文化学院参考书目
064哲学社会学院参考书目
065外国语学院参考书目
066法学院不提供参考数目068经济学院参考书目
069管理学院参考书目
071新闻与传播学院参考书目
073政治与行政学院参考书目
075教育学院参考书目
076艺术学院参考书目。
兰州大学化学化工学院814物理化学和化工原理(一)(各占50%)历年考研真题(含部分答案)专业课考试试题

目 录
2009年兰州大学811物理化学和化工原理考研真题2007年兰州大学411物理化学和化工原理考研真题2006年兰州大学物理化学(B)考研真题
2006年兰州大学化工原理考研真题
2005年兰州大学物理化学(A)考研真题及答案2005年兰州大学物理化学(B)考研真题
2005年兰州大学化工原理考研真题(含部分答案)2004年兰州大学物理化学考研真题及答案
2003年兰州大学物理化学考研真题及答案
2002年兰州大学物理化学考研真题及答案
2001年兰州大学物理化学考研真题及答案
2000年兰州大学物理化学考研真题及答案
2009年兰州大学811物理化学和化工原理考
研真题。
兰州大学2018年拟录取硕士研究生名单公示-物理科学与技术学院

299 88 87 全日制
277 93 87 全日制
314 92 80 全日制
279 62 82 全日制
309 88 77 全日制
300 85 78 全日制
309 67 78 全日制
297 76 82 全日制
学习方式
备注
326 67 79 全日制
274 80 88 全日制
293 78 84 全日制
323 76 89 全日制
340 80 76 全日制
332 77 80 全日制
345 81 72 全日制
339 81 73 全日制
296 86 84 全日制
304 78 89 全日制
311 60 74 全日制 少骨计划
材料科学与工程
王晗 106988620509174 080500 汪样平 106998371015858 080500 张锦云 107308021001304 080500 李泽彬 107308021001310 080500 甄立平 107308021001312 080500
范毓 107308021001364 080500 黄小玉 107308021001366 080500
337 73 66 全日制
341 61 82 全日制
312 48 90 全日制
356 76 94 全日制
340 70 89 全日制
371 75 92 全日制
376 84 94 全日制
367 80 91 全日制
363 92 90 全日制
392 60 92 全日制
404 85 94 全日制
377 56 91 全日制
材料工程 材料工程 材料工程 材料工程 材料工程 材料工程 材料工程 材料工程
兰州大学2009年硕士研究生分专业报名录取人数统计表 热

3
0
3
0
5
2
3
025
大气学院
070601
气象学
49
37
11
16
31
20
11
025
大气学院
070602
大气物理学与大气环境
29
13
16
1
18
2
16
025
大气学院
070620
★应用气象学
12
6
6
0
7
1
6
025
大气学院
070621
★干旱气象与灾害
3
2
1
1
4
3
1
026
土木学院
080102
固体力学
17
12
22
3
17
027
核科学与技术学院
070203
原子与分子物理
1
1
0
0
4
4
0
027
核科学与技术学院
070322
★放射化学
11
2
9
0
9
0
9
027
核科学与技术学院
082703
核技术及应用
25
22
3
7
5
2
3
031
基础医学院
071003
生理学
4
2
1
0
4
3
1
031
基础医学院
071007
遗传学
10
8
2
0
5
3
0
037
第二临床医学院
100204
兰州大学化工学院2016年复试名单

107306021801665
有机化学
66.0
64.0
84.0
107306021801554
有机化学
65.0
64.0
91.0
107306021801558
有机化学
71.0
53.0
80.0
107306021801593
有机化学
65.0
50.0
92.0
107306021801602
有机化学
67.0
58.0
有机化学
65.0
63.0
84.0
107306021801613
有机化学
73.0
62.0
89.0
107306021801559
有机化学
66.0
61.0 101.0
107306021801635
有机化学
62.0
59.0 119.0
107306021801599
有机化学
68.0
62.0
90.0
107306021801564
61.0
87.0
107306021801829
应用化学
65.0
74.0 128.0
107306021801830
应用化学
70.0
53.0 105.0
107306021801825
应用化学
73.0
60.0
88.0
107306021801824
应用化学
66.0
66.0
92.0
107306021801821
86.0
107306021801622
有机化学
67.0
49.0
兰州大学化学化工学院613分析化学和物理化学历年考研真题(含部分答案)专业课考试试题

目 录
2011年兰州大学812分析化学和物理化学考研真题
2010年兰州大学813分析化学和物理化学考研真题
2009年兰州大学810分析化学和物理化学考研真题
2008年兰州大学811分析化学和物理化学考研真题
2007年兰州大学410分析化学和物理化学考研真题及详解2006年兰州大学分析化学和物理化学考研真题
2005年兰州大学分析化学和物理化学考研真题及详解2004年兰州大学分析化学和物理化学考研真题及详解2003年兰州大学分析化学和物理化学考研真题及详解
2011年兰州大学812分析化学和物理化学考
研真题。
兰州大学研究生招生专业目录

兰州大学研究生招生专业目录
学术型硕士:农业科学1、植物科学与技术2、农学3、食品科学4、
农业资源与环境资源环境与安全1、环境科学2、安全工程3、生态学4、
水资源与水利工程森林资源1、林学2、森林资源保护3、林业规划4、林
业工程矿物资源与矿产地质1、矿物资源工程2、矿物材料科学3、矿产
地质学冶金加工1、冶金物理化学2、冶金环境与安全3、冶金炼浆4、复
合材料机械工程1、机械电子工程2、工程设计与理论3、制造工程4、机
械自动化电子信息科学与技术1、电子科学与技术2、电子信息科学与技
术3、电气工程及其自动化4、计算机科学与技术材料科学与工程1、金
属材料加工2、无机非金属材料3、高分子材料4、应用微结构材料化学
工程1、化工原理2、化工过程及设备3、分子工程4、精细化工轻工纺织
食品1、轻工工程2、纺织工程3、食品科学与工程4、营养与食品卫生生
物科学1、生物工程2、生物技术3、分子生物学4、生物系统科学数学1、数学基础2、应用数学物理学1、物理学基础2、应用物理学化学1、化学
基础2、应用化学航空航天1、航空航天工程2、航空宇航技术3、航空科
学技术水利1、水文学。
兰州大学2009级课表

2011 秋兰州大学班级课表班级:2009护理学1班人数:132011 秋兰州大学班级课表班级:2009临床医学10班人数:282011 秋兰州大学班级课表班级:2009临床医学11班人数:282011 秋兰州大学班级课表班级:2009临床医学12班人数:282011 秋兰州大学班级课表班级:2009临床医学13班人数:262011 秋兰州大学班级课表班级:2009临床医学14班人数:282011 秋兰州大学班级课表班级:2009临床医学1班人数:282011 秋兰州大学班级课表班级:2009临床医学2班人数:262011 秋兰州大学班级课表班级:2009临床医学3班人数:262011 秋兰州大学班级课表班级:2009临床医学4班人数:272011 秋兰州大学班级课表班级:2009临床医学5班人数:262011 秋兰州大学班级课表班级:2009临床医学6班人数:262011 秋兰州大学班级课表班级:2009临床医学7班人数:262011 秋兰州大学班级课表班级:2009临床医学8班人数:272011 秋兰州大学班级课表班级:2009临床医学9班人数:282011 秋兰州大学班级课表班级:2009临床医学(留学生)人数:12011 秋兰州大学班级课表班级:2009麻醉学1班人数:262011 秋兰州大学班级课表班级:2009麻醉学2班人数:272011 秋兰州大学班级课表班级:2009医学检验1班人数:202011 秋兰州大学班级课表班级:2009医学检验2班人数:252011 秋兰州大学班级课表班级:2009医学影像学1班人数:262011 秋兰州大学班级课表班级:2009医学影像学2班人数:28。
兰州大学考博专业参考书目

315 微分方程与动力系统 《常微分方程几何理论与分支问题》,张锦炎,冯贝叶著,1997 年第二次修订 本,北京大学出版社; 《微分方程定性理论》,1997 年版,科学出版社。 316 数学物理方程 317 偏微分方程 318 图论 《数学物理方程讲义》,姜礼尚、陈亚浙等,高等教育出版社; 《二阶椭圆型方程与椭圆型方程组》,陈亚浙、吴兰成著,科学出版社;《非线性发 《图论及其应用》(中译本),Bondy,Murity 著,科学出版社;《Introduction to 《数学物理方程》谷超素、李大潜等,高等教育出版社。 展方程》,李大潜、陈韵梅著,科学出版社。 graph theory》,Wilson 著。 319 概率论基础与数理统计 《概率论基础》,严士健等著 ,1982 年版,科学出版社;《数理统计-基本 概念及专题》,Bickel 等著,李泽慧等译,1991 年版,兰州大学出版社;《数理统计习题教程》,李泽 慧等著,兰州大学出版社。 320 微分方程数值逼近 《Numerical Approximation of Partial Differential Equations》(第一、第 二部分)A.Quarteroni,A.Valli 著,Springer-verlag(世界图书公司)北京,1998。 321 数学生态学模型概论《数学生态学》[加]E.C.皮洛著,卢泽愚等译,科学出版社,1998 年第二版。 322 抽象代数 323 复杂性理论 《代数学》,科学出版社,1964 年版。 《可计算性、复杂性及语言》,M.D.Davis 等,清华大学出版社,1989 年版。
《固体电子器件》,B.G.Streetman 著,兰州大学出版社,2005 年。
《粒子与场》,户里著,朱重远等译,科学出版社,1981 年版。 《引力论与宇宙》,温伯格著,邹振隆等译,科学出版社,1980 年版。 《统计力学》,帕斯里亚著,湛垦华等译,高等教育出版社,1985 年版。 DYNAMICS,S.NEILRASBAND。 《理论物理学中的计算机模拟方法》,Heerman 著,秦克城译。 《铁磁学》(中册),钟文定著,科学出版社,1998。 《穆斯堡尔谱学》,马如璋、徐英庭主编,科学出版社,1998。
兰大考研2024化学参考书

兰大考研2024化学参考书
对于兰州大学2024年化学考研,以下是一些常见的参考书推荐:
《无机化学》(第四版)作者:傅才德、李光明、李新生、李守宏
这本教材是无机化学的经典教材之一,内容全面且系统,适合深入学习无机化学的基本理论和应用。
《有机化学》(第八版)作者:谢新华、李光明、李新生、李守宏
这本教材是有机化学的经典教材之一,涵盖了有机化学的基本概念、反应机理和合成方法等内容,适合系统学习有机化学知识。
《物理化学》(第二版)作者:傅才德、李光明、李新生、李守宏
这本教材是物理化学的经典教材之一,内容详细且深入,适合学习物理化学的基本原理、计算方法和实验技术等。
《分析化学》(第七版)作者:傅才德、李光明、李新生、李守宏
这本教材是分析化学的经典教材之一,介绍了分析化学的基本理论、方法和仪器分析技术等内容,适合学习分析化学的基本原理和实验技术。
此外,还可以参考一些辅助教材和习题集,如《化学学科专业基础综合教程》、《化学学科专业基础习题集》等,这些教材和习题集可以帮助巩固和应用所学的化学知识。
请注意,以上仅是一些建议,具体的参考书选择还应根据个人的学习风格和需求来确定。
建议你在选择参考书时,可以咨询老师、学长学姐或其他已经考研的同学,以获取更准确的建议。
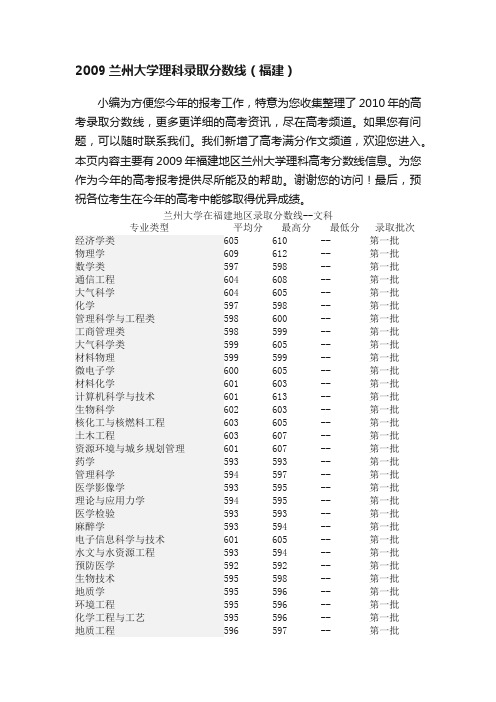
2009兰州大学理科录取分数线(福建)
2009兰州大学理科录取分数线(福建)小编为方便您今年的报考工作,特意为您收集整理了2010年的高考录取分数线,更多更详细的高考资讯,尽在高考频道。
如果您有问题,可以随时联系我们。
我们新增了高考满分作文频道,欢迎您进入。
本页内容主要有2009年福建地区兰州大学理科高考分数线信息。
为您作为今年的高考报考提供尽所能及的帮助。
谢谢您的访问!最后,预祝各位考生在今年的高考中能够取得优异成绩。
兰州大学在福建地区录取分数线--文科专业类型平均分最高分最低分录取批次经济学类605 610 -- 第一批物理学609 612 -- 第一批数学类597 598 -- 第一批通信工程604 608 -- 第一批大气科学604 605 -- 第一批化学597 598 -- 第一批管理科学与工程类598 600 -- 第一批工商管理类598 599 -- 第一批大气科学类599 605 -- 第一批材料物理599 599 -- 第一批微电子学600 605 -- 第一批材料化学601 603 -- 第一批计算机科学与技术601 613 -- 第一批生物科学602 603 -- 第一批核化工与核燃料工程603 605 -- 第一批土木工程603 607 -- 第一批资源环境与城乡规划管理601 607 -- 第一批药学593 593 -- 第一批管理科学594 597 -- 第一批医学影像学593 595 -- 第一批理论与应用力学594 595 -- 第一批医学检验593 593 -- 第一批麻醉学593 594 -- 第一批电子信息科学与技术601 605 -- 第一批水文与水资源工程593 594 -- 第一批预防医学592 592 -- 第一批生物技术595 598 -- 第一批地质学595 596 -- 第一批环境工程595 596 -- 第一批化学工程与工艺595 596 -- 第一批地质工程596 597 -- 第一批临床医学596 602 -- 第一批辐射防护与环境工程596 596 -- 第一批查看:2013福建高考分数线 2009福建高考分数线专题:全国历年高考理科分数线汇总全国历年高考文科分数线汇总兰州大学介绍:兰州大学是教育部直属的全国重点综合性大学,是国家“985工程”和“211工程”重点建设高校之一。
授权点简况表

陇东学院二级教授,现任化学化工学院副院长,省级重点学科带头人,甘肃省
高校化学化工实验示范中心主任。近五年,承担应用化学、化学工程与工艺本科专
业的 4 门专业课程,积累了丰富的专业知识和教学经验,有较深的学术造诣,在国
内同行中具有一定影响力。现主持国家自然科学基金 1 项,曾主持完成省级项目 6
骨干教师简介
六、本表中的科研经费应是本学科实际获得并计入本单位财务 账目的经费。
七、本表不能填写任何涉密内容。涉密信息请按国家有关保密 规定进行脱密,处理至可以公开后方可填写。
八、本表请用 A4 纸双面打印,左侧装订,页码依次顺序编排。 封面及填表说明不编页码。本表复制时,必须保持原格式不变。本 表封面之上,不得另加其他封面。
中级
11
7
4
0
0
0
0
00113来自其他00
0
0
0
0
0
0
0
0
0
总计
41
10
17
5
8
0
1
0
9
27
14
导师人数(比例)
博导人数(比例)
有海外经历教师人数(比例)
3 人(7.32%)
0 人(0%)
0 人(0%)
注:1.“行业经历”是指在相关行业从事工作 3 个月以上。汉语国际教育专业“行业经历”是指 1 年及以上海外学习及工作 经历,单次时长大于 3 个月。 2.“导师/博导人数”仅统计具有导师/博导资格,且截至 2016 年 12 月 31 日仍在指导研究生的导师,含在外单位兼职
九、本专业学位类别获得学位授权后,本表格将做为学位授权 点专项评估的材料之一。
2
Ⅰ 专业学位简介
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
兰州大学2009年招收攻读硕士学位研究生考试试题注意:答案请一律写在答题纸上,写在试题上无效初试科目代码:811 初试科目名称:物理化学和化工原理物理化学部分一、是非题(选择符号“”或“”填入括号;本题16分,每小题2分)1. 电解质溶液的电导率和摩尔电导率均随浓度的增大而降低。
()2. H3PO4溶液的质量摩尔浓度为m,平均活度系数为r±,则活度为4mr±。
()3. 溶液中离子强度愈大,离子氛半径就愈大。
()4. 离子氛以外的离子与该离子氛的中心离子无静电作用。
()5. H2 +21O2=H2及2H2O+O2=2H2O,两反应的ΔG不相等,但相应电池的E相等。
()6. 零级反应的半衰期与反应物的初始浓度无关。
()7. 2A(g)→B(s)+ C(g)为基元反应,若PA增大一倍,则反应速度将增加二倍。
()8.化学反应式为A + B = C,则该反应为双分子反应。
()二、选择题(本题12分,每小题2分)1. 在相同条件下,反应B→A及B→C的焓变分别为ΔH2和ΔH3,则反应A→C的焓变ΔH1为()(a)ΔH1 = ΔH2+ΔH3(b)ΔH1= ΔH3–ΔH2(c)ΔH1 = ΔH2-ΔH3(d)ΔH1= 2ΔH2-ΔH32. 101325KPa的压力下,I2在液态水和CCl2中分配达到平衡(无固态碘存在),则该体系的自由度为()(a) f* =1 (b)f* =2 (c) f* =0 (d) f* =3 3. 方程 dlnP/dT = ΔHm/RT2适用于()(a)I2(s)=I2(g)(b) H2O(l)=H2O(s)(c)C(石墨)= C(金刚石)(d) He(g,n,T1,P1)=He(g,n,T2,P2)4. 设某浓度时CuSO4的摩尔电导率为1.4×10-2Ω-1·m2·mol-1,若在该溶液中加入1m3的纯水,这时CuSO4的摩尔电导率将()(a)降低(b)增高(c)不变(d)不变5.下列化合物中哪几种溶液的无限稀释摩尔电导率可以用Λm对(C)1/2作图外推至C→0时求得()(a) HAc (b)NaCl (c) CuSO4 (d) NH3·H2O6. 某双分子反应的速率常数为K,根据阿伦尼乌斯公式K =Aexp(-Ea/RT),若指前因子A的实验值很小,则说明()(a)表观活化能很大(b)活化熵有较大的正值(c)活化熵有绝对值较大的负值(d)活化焓有绝对值较大的负值三、用正确的答案填空.(13分)1. HCl(g)的生成热Δf Hmø298= -92.31KJ。
今有H2(g)和Cl2(g)密闭在一个绝热的恒容的容器中,在298K,催化作用下反应生成HCl(g)。
反应后的温度T 298K,反应过程中的内能变化ΔU 0 。
2.一种含有K +、Na +、SO 42-、NO 3-的水溶液体系,其组分数为 ;在某一温度和压力下,此系统最多有 相平衡共存。
3. 固体氨的饱和蒸汽压为lnP=23.03–3754/T ,液态氨的饱和蒸汽压为lnP =19.49-3063/T ,其中P 的单位为mmHg ,则三相点的温度和压力分别为 和 。
4. 稀溶液的依数性是 在两相的平衡性质。
5. 相平衡条件是 。
6. 反应为 Pb 2+ + 2Cl - →PbCl 2(s)的可逆电池是 。
计算题四、 (本题12分)求298K 时反应H 2(g)+O 2(g)→H 2O(l)的K ø。
已知298K 时H 2O(g)的标准摩尔生成焓Δf Hm ø298 = -241.8KJ ·mol -1,H 2(g),O 2(g)和H 2O(g)的标准摩尔熵值Sm ø分别为130.6,205.5和188.7J ·K -1·mol -1,水的蒸汽压为3.17×103Pa 。
五、 (本题12分)反应Zn +CuSO 4(a=1)→Cu +ZnSO 4(a=1)在电池装置中进行,15℃时测得E=1.0934V ,电池的电池的PT E ⎥⎦⎤⎢⎣⎡∂∂= -4.29×10-4V ·K -1。
(1) 试写出电极反应和电池反应。
(2) 求电池反应的ΔG 、ΔS 、ΔH 、和Q r 。
六、 (本题10分)今有一化学反应历程为AM +C (1)M + B P (2)其中间产物M 的量不随时间变化,试写出产物P 的生成速度表达式。
兰州大学2009年招收攻读硕士学位研究生考试试题注意:答案请一律写在答题纸上,写在试题上无效初试科目代码:811 初试科目名称:物理化学和化工原理化工原理部分一、选择与填空(11分,每空1分)1. 层流与湍流的本质区别是(A) 层流的雷诺数 < 湍流的雷诺数 (B) 湍流流速 > 层流流苏(C) 层流无径向脉动,湍流有径向脉动 (D) 流经管道截面大的为湍流,小的为层流2. 现要输送45m3·h-1的水,若管内水的流速取2.5m·s-1,则可选择规格为的钢管。
(A) ø108mm×4mm (B) ø88.5mm×4mm (C) ø75mm×3m3. 某一台离心泵,当转速为n1时,所消耗的轴功率为1.5KW,送液量为20m3·h-1;当转速为n2时,所消耗的轴功率为1.5KW,若泵的效率不变,则泵所消耗的功率为(A)1.09KW (B)1.15KW (C)1.22KW (D)1.35KW4. 在间壁换热器中进行蒸汽——空气的换热,为强化传热过程,下列方案中的在工程上是可行的。
(A)提高蒸汽流速 (B)采用过热蒸汽以提高蒸汽流速(C)蒸汽侧管壁上装翅片,增加冷凝面积并及时导走冷凝液(D)提高蒸汽流速5. 已知某沉降室在操作条件下的气体流量为3600 m3·h-1,沉降室长、宽、高尺寸分别为5m、4m、3m,能100%除去的最小粒径的沉降速度为 m·s-1。
6. 精馏操作中,若进料摩尔流量q0,F 、进料组成xf,进料热状态参数δ和回流比R不变时,将塔顶产品量q0,D增加,其结果是。
(A)x d下降,x w下降(B)x d下降,x w不变(C)x d下降,x w上升(D)无法判断7. 某吸收任务的操作气液比、气体进出口浓度、吸收剂进口温度、操作压力、吸收剂入塔浓度均已确定,若设计时选用性质优良的填料,则。
(A) 所需传质单元数不变,填料层高度降低(B) 所需传质单元数减少,填料层高度降低(C) 所需传质单元数不变,填料层高度不变(D) 所需传质单元数减少,填料层高度不变8. 某一连续精馏塔分离双组分混合液,已知原料中轻组分含量为0.5(mol%,下同),要求塔顶蒸汽经冷凝器全凝后冷凝液轻组分含量为0.8,塔釜轻组分含量为0.2,塔顶流出液的采出率为,轻组分的回收率为。
9. 不饱和湿空气经间壁式换热器加热,在该过程中下面不变的参数是。
(A) 湿球温度(B)相对湿度(C)露点(D)焓10. 对于恒速干燥阶段,下列描述是错误的。
(A)干燥速度与物料种类有关(B)干燥速度与气体的流向有关(C)干燥速度与气体流速有关(D)干燥速度与气体性质有关二、(22分)如图所示,需将30m 3·h -1、密度为1000kg ·m -3的水由敞口水池送至高位槽,高位槽液面上方表压为0.049MPa ,与取水池水面的高度差为10m 。
输水管为ø98mm ×4mm 、直管长为18m ,管线全部阻力系数为12(阀全开始),摩擦系数为λ=0.02. (1)求输送所需的理论功率;(2)某台泵的特性可近似用下式表达: 扬程 He =22.4 -0.002778q v 2 效率 η =0.0417q v -0.000583q v 2 式中q v 2的单位为m 3·h -1求出最高效率点的效率并评价此泵是否适用。
三、(20分)某厂用套管换热器每小时冷凝甲苯蒸汽1000kg ,冷凝温度为110℃,冷凝潜热为363KJ ·kg -1,冷凝传热系数α0 =10000W ·m -2·K -1,冷却水进口温度为16℃,冷却水以每小时2500kg 的流量进入内管(内径50mm ),水在管内作湍流流动,对流传热系数α1 =2160 W ·m -2·K -1,水的比热容取4.19 KJ ·kg -1·k -1,忽略壁阻和垢阻。
试求: (1)冷却水出口温度及所需换热管长。
(2)如在夏天,冷却水入口温度将升至25℃,使换热器传热能力下降,为此建议将冷却水流量增加一倍,试通过定量计算说明该换热器的传热能力能否增加。
四、(22分)在一塔截面积为0.5m 2,填料层高度为3m 的常压吸收塔内,用清水吸收混合气体中的丙酮。
丙酮含量为0.05(摩尔比,下同),混合气体中惰性气体的流量为1120m 3·h -1(标准状况)。
已知在液气比为3的条件下,出塔气体中丙酮含量为0.005,操作条件下的平衡关系为Y *A =2X A ,试求: (1)出塔溶液中丙酮的含量;(2)气相总体积传热系数K Ya [kmol ·m3·s-1];(3)若填料层加高3m ,其他条件不变,出塔气体浓度为多少?。
