Q_HBY QF0001-2016抗体检验标准操作规程
甲状腺过氧化物酶抗体测定标准操作规程

甲状腺过氧化物酶抗体测定标准操作规程1.检验原理:采用两步法免疫检测,运用化学发光微粒子免疫检测(CMIA)技术与灵活的检测模式的结合,测定人血清和血浆中的甲状腺过氧化物酶抗体。
第一步,将样本、项目稀释液和TPo包被的顺磁微粒子混合并孵育。
将样本中甲状腺过氧化物酶抗体与甲状腺过氧化物酶抗体包被的微粒子结合。
冲洗后进入第二步,加入口丫噬酯标记的抗人IgG 抗体结合物。
再次孵育冲洗后,将预激发液和激发液加入反应混合物中;测量产生的化学发光反应,以相对发光单位(RLUS)表示。
样本中的甲状腺过氧化物酶抗体的含量和ARCHITECTi光学系统检测到的RLUs值成正比。
2.试剂主要组成成分:2.1试剂盒微粒子:甲状腺过氧化物酶(重组体)包被的微粒子,储存于含有蛋白(牛)稳定剂的2-(N-吗啡咻)乙磺酸(MES)缓冲液中。
最低浓度:0.10%固体物质。
防腐剂:抗菌剂。
结合物:口Y咤醋标记的抗人免疫球蛋白G(IgG)(小鼠、单克隆)结合物,储存于含有蛋白(牛)稳定剂的2-(N-吗啡咻)乙磺酸(MES)缓冲液中。
最低浓度:80.0ng∕mL.防腐剂:抗菌剂。
项目稀释液:项目稀释液,储存于2-(2吗啡咻)乙磺酸(MES)缓冲液中。
防腐剂:抗菌剂。
2.2需要但未提供的试剂预激发液:预激发液含有1.32%(W/V)过氧化氢激发液:激发液含有0.35N氢氧化钠浓缩清洗缓冲液:浓缩清洗缓冲液含有磷酸盐缓冲液。
防腐剂:抗菌剂。
3.样本要求:血清和血浆样本中应不含纤维蛋白、红细胞或其他颗粒物质。
可保存72小时;-10℃以下可保存30天。
样本应避免反复冻融。
4.检验方法:仪器法(详见雅培i1000标准操作规程)5.参考范围检验结果的解释1.1甲状腺过氧化物酶抗体项目通过四参数Logistic曲线拟合数据约简法(4PLC,Y加权)生成一条校准曲线7.检验方法的局限性抗体测定是多标准诊断程序上的一个参数。
诊断甲状腺疾病时,应该结合多种诊断方法的同时参考临床症状。
标准操作规程(SOP)——流感禽流感微量中和抗体检测

标准操作规程(SOP)——一、目的微量中和试验是一种敏感性高、特异性强的血清学方法,用于测定血清中的病毒特异性中和抗体水平。
中国国家流感中心的所有技术人员,必须按照本文件相关的操作规程,进行流感/禽流感微量中和抗体检测实验,以确保实验的准确性。
二、范围适用于中国国家流感中心的所有技术人员进行流感/禽流感微量中和抗体检测。
三、责任进行流感/禽流感微量中和抗体检测的技术人员需严格按照规定进行操作。
四、程序(一)生物安全要求H5,H7亚型高致病性禽流感病毒,H2N2亚型流感病毒的操作需要在生物安全3级(BSL-3)实验室中进行。
其余流感病毒的操作需要在生物安全2级(BSL-2级)实验室中进行。
操作人员必须严格按照相应实验室的要求做好个人防护。
(二)材料1.中和反应实验材料(1)病毒:一般采用接种鸡胚尿囊腔后收获的流感/禽流感病毒液,在-70℃中保存,并且注意避免反复冻融。
进行中和试验之前,需先进行病毒滴度(TCID50)的滴定。
具体步骤如下,1)病毒的稀释:可采取对数或者半对数稀释的方法。
以下介绍半对数稀释法。
取1管冻存病毒尿囊液,用病毒培养液进行1:100稀释。
第一列4个孔每孔加入146μL 1:100稀释过的病毒液,其它各列每孔加入100 μL 病毒培养液。
然后用多道加样器从第一孔吸46μL 至第二孔,做系列半对数稀释,使之成为10-2、10-2.5、10-3、10-3.5……10-7。
每孔含有100μL 病毒液。
2)每孔加入100μL MDCK 细胞悬液(1.5×104细胞/孔),37℃,5%CO 2培养箱孵育18~22h 。
每一滴度作平行4孔。
3)细胞固定、ELISA 操作如下述。
4)OD 值 〉2倍MDCK 细胞对照OD 值判定为阳性5)病毒滴度计算见组织细胞半数感染量滴定SOP 。
(2)血清样品:包括待检血清、阳性及阴性血清对照。
如果待检血清有可能需要多次检测,则需将待检血清进行小量分装,-20℃至-70℃保存均可,避免多次反复冻融。
临床免疫学检查操作规程

临床免疫学检查操作规程传染病免疫学检查乙型肝炎血清标志物(HBV一M)检测【方法】ELISA法。
【试剂】国内有商品化试剂盒供应。
但必须按规定使用经中国药品生物制品检定所检定并贴有“中国药品生物制品检定所检定合格”字样的防伪标签的试剂。
【操作】按试剂盒内说明书书进行。
【附注】1.试剂盒应置冰箱中保存,取出后平衡至室温方可使用,未用完的微孔条须密封保存;2.每次应设空白1孔(不加标本及标酶试剂,其余各步相同),阴性对照3孔,阳性对照2孔;3.洗涤液须用蒸镏水或去离子水配制,洗涤时各孔均应加满洗液,以防孔口内边缘有游离酶残存不能洗净;4.用洗板机洗板,每次洗板反复5遍,最后一次要求微孔内不残留洗涤液,如达不到要求,需扣干;5.洗板机洗板时应设定30~60秒的浸泡时间;6.滴加试剂前应将滴瓶翻转数次,使液体均匀并弃去一滴。
滴加时瓶身应保持垂直,以使滴量准确,注意勿将试剂滴在孔壁上;7.37℃温育须采用水浴箱,不可使用37℃干式恒温箱,且微孔条必须接触37℃水浴水面,不可悬空;8.不同批号试剂不可混合使用。
【结果判断】酶标仪双波长450/630nm比色测定;1.HB S Ag、抗—HB S、HBeAg;临界值(C.O)=阴性对照孔A值的均值N×2.1(阴性对照A值<0.05时按0.05计);标本A值S/C.O≥1为HBsAg,抗—HBs、HBeAg阳性(S/N ≥2.1);标本A值S/C.O<1为HBsAg、抗—HBs、HBeAg阴性(S/N <2.1)。
2.抗—HBe、抗一HB C;临界值(C.O)=阴性对照孔A值的均值N×0.5;标本A值S/C.O≤1者为抗—HBe、抗一HB C阳性(S/N≤0.50);标本A值S/C.O>1者为抗—HBe、抗一HB C阴性(S/N>0.50)。
抗甲型肝炎病毒免疫球蛋白M(Anti-HAV-IgM)测定【方法】ELISA法。
【试剂】市售合格试剂、要求同HBV两对半;【操作】按试剂说明书要求进行,要求可参考HBV两对半;【结果判断】要求同HBV两对半中HBsAg。
糖尿病快速抗体检测标准操作规程

糖尿病快速抗体检测标准操作规程1. 简介本操作规程旨在规范糖尿病快速抗体检测的操作流程,确保检测结果的准确性和一致性。
2. 检测设备和试剂准备- 检测设备:包括快速抗体检测仪、试管架、离心机等。
- 试剂准备:根据检测设备使用手册和试剂生产商提供的说明书准备所需试剂,确保试剂在适当的温度和存储条件下。
3. 样本采集和处理- 根据病人的具体情况,选择合适的样本采集方法,常见的包括血液、尿液等。
- 采集样本时要注意消毒和无菌操作,避免污染。
- 样本采集完毕后,需及时进行处理,如离心、分离血清。
4. 标本处理和试剂添加- 使用离心机对样本进行离心,使血液分离为血清和红细胞。
- 将离心后的血清移至试管中,根据试剂使用说明书添加相应试剂。
- 注意试剂的添加顺序,避免试剂相互干扰。
5. 快速抗体检测操作- 将试管插入快速抗体检测仪,并启动设备。
- 按照设备操作手册的指引,完成设备的设置和测试参数的调整。
- 将试管中的样本插入仪器中,按照设备要求选择相应的测试模式。
- 等待设备完成测试,记录结果并进行分析。
6. 结果解读- 根据设备和试剂的说明书进行结果解读,判断病人是否存在糖尿病抗体。
- 结果应根据标准值范围判断是否正常、阳性或阴性。
- 记录结果和相应的解读,并与病人的病历资料进行比对。
7. 结果报告和记录- 将测试结果整理成报告并记录,包括样本信息、测试日期、结果和解读等。
- 确保结果报告的准确性和机密性。
- 根据机构要求,将结果报告发送给相应的部门或医生,进行进一步的分析和诊断。
8. 设备和试剂维护- 定期对设备进行维护保养,如清洗、校准等,以保证设备的正常运行和准确性。
- 存储试剂时,注意温度和湿度控制,避免试剂变质影响检测结果。
9. 不良事件和质控措施- 对于出现的不良事件,应及时记录和处理,并采取相应的质控措施,确保错误不再发生。
- 定期进行质控检测,包括使用标准品、内部质控品和外部质控品等。
10. 总结本操作规程为糖尿病快速抗体检测提供了详细的操作流程,希望能够帮助实验人员准确、高效地完成检测工作,为糖尿病患者提供准确的诊断结果,进一步指导治疗和康复工作。
幽门螺杆菌抗体检查标准操作规程

幽门螺杆菌抗体检测试剂盒(胶体金法)标准操作规程1.产品名称:幽门螺杆菌抗体检测试剂盒(胶体金法)2.包装规格:24人份/盒 48人份/盒3.预期用途:用于检测试验血清中的幽门螺杆菌抗体(IgM/IgG)4.检验原理:用幽门螺杆菌抗原固相硝酸纤维素膜,应用渗滤式间接法原理,检测血清中幽门螺杆菌抗体。
5.主要组成成份:反应板 24份或48份试剂Ⅰ 1瓶 0.02mol/L PH 7.4 PBS试剂Ⅱ 1瓶胶体金标记物6.储存条件及有效期:产品应储存在2℃~8℃条件中,不能冷冻;有效期24个月。
7.样本要求:血清样品不能溶血,应为新鲜血清或2℃~8℃条件保存不超过一周。
高脂血症血清不能使用。
8.检验方法:滴入二滴试剂Ⅰ于反应板中央孔中,待完全渗入;滴入100μl血清于反应板孔中,待完全渗入;滴加三滴试剂Ⅱ于反应板孔中,待完全渗入;渗入三滴试剂Ⅰ于反应板孔中,待完全渗入。
9.结果解释:阳性:反应板孔中C端出现红色圆斑,T端出现红色圆斑,为幽门螺杆菌抗体阳性;阴性:反应板孔中C端出现红色圆斑,T端不出现红色圆斑,为幽门螺杆菌抗体阴性。
失效:反应板孔中C端不出现红色圆斑,或C端、T端均不出现红色圆斑,为试剂盒失效。
10.检验方法的局限性:本试剂试验仅用于检测幽门螺杆菌抗体而非直接检测幽门螺杆菌,因而阳性结果并不能确诊是幽门螺杆菌感染。
对患者状况的诊断应结合患者临床体征与症状和试验结果的综合分析。
抗体含量低的血清样品,不能被检测出来是可能的。
部份幽门螺杆菌感染的患者,不产生抗体或产生少量的抗体。
此时,可能显示阴性结果。
试验结果可疑时,应用培养基进行培养确诊。
11.产品性能指标:批内精密度:阳性符合率和阴性符合率均应≥95%,反应斑点颜色深浅程度应接近。
批间精密度:阳性符合率和阴性符合率均应≥95%。
12.注意事项:本产品尚未获得产品注册证号,仅供研究,不用临床诊断。
试验一旦开始操作,应按操作步骤连续进行,直至结束。
抗体效价测定操作规程

抗体效价测定操作规程 Hessen was revised in January 2021抗体效价测定操作规程操作步骤:一.IgG类1.IgG类抗体效价滴定,须取适量血清200μL加等体积2—Me溶液混合,封口,置37℃水浴箱作用60分钟,先稀释血清:200L病人血清600L生理盐水备用,排列6支试管按顺序编号。
第二管开始到第六管加样枪各加生理盐水200L,在第一管和第二管中各加入稀释血清200L,第二管混匀后移出200L转至第三管,以同样操作第六管,从第六管吸出200L暂时保留在另一试管中(可做为第七管),以备必要时作进一步稀释。
这样从第一管到第六管的血清稀释度依次是1:8,1:16,1:32,1:64,1:128,1:256。
2.加红细胞悬液(自配红细胞悬液同反定型试剂)每管各加2%相应红细胞悬液200L,混匀。
(如待检血清抗体为抗A,则加入A型标准红细胞悬液;如待检血清抗体为抗B,则加入B型标准红细胞悬液;如待检血清中既有抗A又有抗B,则倍量稀释两份血清,一份加入A型标准红细胞悬液,另一份加入B型标准红细胞悬液;)3.先直接观察离心结果,之后在每管分别加入凝聚胺试剂盒中的R1液3d,混合30S均匀后,在各加R2液2滴,操作方法同凝聚胺交叉配血法,然后判读结果。
通常以肉眼观察到的第一个“±”的凝集管作为判断的终点,终点血清稀释度的倒数为效价(Titer),或称滴度。
二.IgM1.血清连续倍量稀释法先稀释血清:100L病人血清+700L生理盐水备用,排列6支试管按顺序编号。
第二管开始到第六管加样枪各加生理盐水200L,第一管和第二管中各加入稀释血清200L,第二管混匀后移出200L转至第三管,以同样操作第六管,从第六管吸出200L暂时保留在另一试管中(可做为第七管),以备必要时作进一步稀释。
这样从第一管到第六管的血清稀释度依次是1:8,1:16,1:32,1:64,1:128,1:256。
不规则抗体检测标准操作流程

不规则抗体检测标准操作流程
不规则抗体检测标准操作流程(SOP)
目的:输血前进行检验查,可对有妊娠史,多次输血史,大量输血的病人进行不完全抗体的初选.
操作:
1、取3—5名“O”型正常人抗凝血(新鲜血常规抗凝血)进行等量混合。
2、用无菌生理盐水洗涤3—5次。
3、配制成2%红细胞悬液(上述离心沉淀红细胞1ml加生理盐水49mL混匀)待用。
4、取病人(受血者)血清或血浆100mL和2%红细胞悬液100mL等到量混合,然后离心,侄去上清液,混匀,倒在玻片上,显微镜观察是否凝集。
5、如有凝集,说明该受血者体内存在不规则抗体,毅然交叉配血不能进行。
6、如无凝集才能配血。
8人类免疫缺陷病毒抗体测定标准操作规程

滁州市第一人民医院(南区)检验科标准操作规程项目人类免疫缺陷病毒抗体测定方法(双抗原夹心法)文件编号CZYY-NQ-JYK-SOP-MY-008版本第1版编写者:郑昕审核者:陶良萍批准者:谢瑞玉批准日期:20161101 本规程自2016年11月1日起实施,每3年复审一次复审人:复审日期:文件分发部门和/或个人:医务科保管者院长办公室保管者院档案室保管者检验科主任临床免疫室√规程修订记录:修订号修订内容修订人修订日期1.原理采用双抗原夹心两步法检测人血清或血浆中的HIV1/HIV2型抗体。
在微孔板预包被基因重组HIV(1+2)型抗原,当加入的待测样本中存在HIV抗体时,将反应形成抗原抗体复合物,再与加入的酶标记基因工程HIV(1+2)型抗原反应,最后形成“固相HIV抗原-HIV抗体-酶标记HIV抗原”的免疫复合物,加入底物后形成显色反应。
2.样品要求2.1病人准备事项准备事项具体内容禁食/特种饮食不要求禁食,但由于重度脂血可能干扰检测,禁食样品最佳。
病人的准备事项安静状态下抽取静脉血,样品采集特殊要求采血时应一针见血,切忌反复穿刺,避免溶血2.2样品类型及处理方法样品类型血清或肝素、枸橼酸钠、EDTA抗凝血浆样品量最佳量5ml最少量3ml收集容器肝素抗凝管(绿帽)运输要求室温稳定性及储藏要求室温2小时冷藏温度(2-8˚C)4天-20︒C 1月-70︒C 6月标本制备4000转/分离心 5分钟制备血清/血浆标本拒收拒绝采集量不足、肉眼观察有溶血及抗凝剂类型不符的样品3.试剂名称规格储存条件有效期HIV预包被微孔板(包被基因工程HIV96人份2℃~8℃避光保存12个月抗原)HIV酶标抗原1支2℃~8℃避光保存12个月(含HRP标记基因工程HIV抗原)HIV-1型阳性对照1支2℃~8℃避光保存12个月(含HIV-1型抗体)HIV-2型阳性对照1支2℃~8℃避光保存12个月(含HIV-2型抗体)HIV抗体阴性对照1支2℃~8℃避光保存12个月(正常人血清)浓缩洗涤液2瓶2℃~8℃避光保存12个月(PBS-T缓冲液)底物A(含H2O2) 1支2℃~8℃避光保存12个月底物B(含TMB)1支2℃~8℃避光保存12个月终止液(含H2SO4)1支2℃~8℃避光保存12个月4.仪器名称厂家型号全自动酶标分析仪北京天石SM-35.方法性能5.1 特异性:阴、阳性参考品检出情况符合要求。
题目:抗体测定技术的标准操作规程

题目:抗体测定技术的标准操作规程目的:规范抗体测定(ELISA)试验技术的标准。
操作:1、目的:测定给予动物供试品后,血清(血浆)中是否产生抗体(或抗原)。
2、材料与方法:2.1材料:2.1.1物品:加样器(包括1000ul、200ul、20u),吸头(1000ul、200ul、20u),吸纸,小玻璃瓶,酶联板,酶联仪。
2.1.2试剂:2.1.2.1包被液:PH9.6的碳酸-重碳酸盐缓冲液配法:A液:0.2M碳酸钠水溶液,无水碳酸钠(Na2CO3)21.2g加蒸馏水至1000ml。
B液:0.2M碳酸钠,NaHCO3 16.8g加蒸馏水至1000ml。
取A液16ml,B液34ml,再加蒸馏水至200ml,即为所需液。
2.1.2.2 PH7.4磷酸盐缓冲液(PB)配法:A液:0.2M碳酸氢二钠(NaH2PO4)水溶液0.2M NaH2PO4.H2O27.6g ,溶于蒸馏水中,最后稀释至1000ml。
B液:0.2M磷酸氢二钠Na2HPO4水溶液0.2M NaH2PO4.7H2O 53.6g ,或NaH2PO4.12H2O 71.6g或NaH2PO4.2H2O 35.6g,溶于蒸馏水中,最后稀释至1000ml。
0.2MPH7.4 PB:取A液19ml,B液81ml即可。
2.1.2.3 PH5.0 柠檬酸-磷酸缓冲液配法:A液:0.1M柠檬酸水溶液,柠檬酸(C6H8O7。
H2O)21.0g(或C6H8O710 .21g) 加蒸馏水至1000ml。
B液:0.2M磷酸氢二钠Na2HPO4水溶液PH5.0柠檬酸-磷酸缓冲液:取A液24.3ml,B液25.7ml,加蒸馏水至100ml 即可。
2.1.2.4 固定液:2.5%戊二醛,用0.02MPH7.4PB稀释。
2.1.2.5 洗板液:0.02%吐温20,用0.01MPH7.4PB稀释。
2.1.2.6封闭液:5%BSA(牛血清白蛋白),0.02MPH7.4PB用稀释。
抗体筛检试验操作规程

抗体筛检试验操作规程一、试验目的二、试验前准备1.安全措施:在进行试验前,操作人员应穿戴好实验室所要求的防护服、手套、口罩等个人防护用品,确保实验的安全进行。
2.仪器准备:确保所需要的实验仪器设备状态良好,无损坏或故障。
三、实验步骤1.样品准备:a.样品收集:采集患者的体液样本,按照规范的采样方法进行,避免外界污染。
b.样品处理:将样品离心,去除悬浮物,得到清澈的液体。
c.样品储存:如不能立即使用,应将样品进行适当的储存,避免变质和污染。
2.标本分配:根据试剂说明书的要求,将样品分配到不同的试管或孔板中。
3.添加试剂:根据试剂的使用说明书,按照要求将试剂依次加入样品中。
注意加入试剂的顺序和时间,避免因操作不当引起实验结果的误差。
4.摇动和舍弃:轻轻摇动试管或孔板,使样品和试剂充分混合,以保证试验的均一性。
然后,按照规定的程序舍弃废弃物,避免污染和交叉感染。
5.实验读数:将样品置于分光光度计或其他适当的仪器中,按照试剂说明书要求进行读数。
记录读数结果。
6.结果判定:根据标准曲线或指标值,对读数结果进行判定,确定阳性或阴性结果。
注意结果的解读要准确和可靠。
四、结果评估根据试验结果的阳性或阴性情况,评估样品中是否含有特定抗体。
阳性结果可能表示感染或其中一种疾病的存在,而阴性结果则表示无特异抗体存在。
五、记录和报告试验过程中应详细记录试验操作和结果,包括样品信息、试剂信息、实验步骤、读数结果等。
及时准确地完成实验记录和结果报告,以便后续的数据分析和报告撰写。
六、实验后处理试验结束后,及时清洗和消毒实验用具和工作台面。
将废弃物放入指定的处置容器中,并按照实验室的废物处理规范进行处理和处置。
七、实验验证为了保证试验结果的准确性和可靠性,应定期进行实验验证,对操作流程、试剂、仪器等进行检验和验证。
必要时,可以进行重复实验或对照试验,以确保试验结果的一致性和可靠性。
八、实验质控建立适当的实验质控体系,包括对试剂的质量控制、实验仪器的校准和验证、样品处理和分配的质控和实验数据的监控等方面。
抗体筛选和鉴定操作规程

抗体筛选和鉴定操作规程(一) 抗体筛选1. 抗体筛选的目的血型抗体是体内免疫系统所产生的针对血型抗原发生特异性反应的一类免疫球蛋白类物质。
人体血清内存在的抗体有5种类型:IgG.、 IgM、IgA.、IgD和IgE,其中IgG 和IgM是最重要的2种抗体。
红细胞血型抗体可以分为:①完全抗体:这些抗体能够在盐水介质中凝集相应的红细胞,所以又称为盐水抗体,它们主要是分子量较大的IgM;②不完全抗体:这类抗体主要是分子量较小的IgG,虽然能够结合红细胞上的抗原,但在盐水介质中不能使红细胞凝集。
有临床意义的血型抗体会导致溶血性输血反应,破坏输入的不配合的红细胞或缩短其寿命,产生溶血性输血反应,轻则影响治疗效果,重则危及患者生命;此外,对孕妇而言,抗体会引起新生儿溶血病,影响新生儿脏器的发育,并使其智力发育受到伤害,严重者则会危及新生儿的生命安全。
因此,抗体筛检是很必要而且必需的。
抗体筛检试验(antibody screening tests)主要筛查与红细胞反应的血型同种抗体。
对受血者的血清和血浆应进行常规的抗体筛选试验,以发现有临床意义的不规则的血型同种抗体。
所谓不规则抗体是指抗A和抗B以外的血型抗体。
抗体筛选试验的原则是让受检者的血清与筛选红细胞反应,以发现在37℃有活性的抗体。
患者接受输血、妇女妊娠都会刺激机体产生抗体。
抗体筛检试验能有效保证临床输血安全,避免新生儿溶血症的发生。
2. 抗体筛选的方法抗体筛选试验可在交叉配血试验之前进行或一起进行,这样有利于对患者抗体的早期确认及鉴定临床上有意义的抗体,避免一些可能的异常情况而造成病情的延误。
抗体筛选和鉴定使用的方法有盐水法、白蛋白介质法、低离子强度介质法(Liss)、聚凝胺法(polybrene)、凝胶法、酶技术、抗球蛋白试验等,可按抗体的血清学行为和试验的具体条件选择,但必须进行抗球蛋白试验。
抗体筛选试验不一定能检出所有有临床意义的抗体,一些抗低频率抗原的抗体或有剂量效应的抗体可能被漏检,这时需安排抗原更完全和特异性更强的筛选细胞进行试验,或用敏感度更高的技术进行检查。
梅毒螺旋体抗体测试标准操作规程

梅毒螺旋体抗体测试标准操作规程1 检验申请单独检验项目申请:梅毒螺旋体抗体(速写TP);组合项目申请:性病检测、输血前监测定加选本项目。
临床医生根据需要提出检验申请。
2 标本采集与处理2.1 标本采集2.1.1 采用含高效促凝剂或含分离胶的真空采血管,常规静脉采血约2 ml,无需抗凝。
2.1.2 检验申请单和血标本试管标上统一且唯一的标识符号。
2.1.3 急诊标本采集后,在检验申请单上填写标本采集时间。
2.1.4 标本采集后与检验申请单一起及时送至检验科。
专人负责标本的接收并记录标本的状态,对不合格标本予以拒收。
2.1.5 下列标本为不合格标本2.1.5.1 标本量不足:少于0.5 ml的全血标本,或少于0.1ml的血清或血浆。
2.1.5.2 无法确认标本与申请单对应关系的。
2.1.5.3 其它如标识涂改、标本试管破裂等。
2.2 标本保存2.2.1 标本接收后在30min内将标本离心分离出血清。
2.2.2 标本保存时间:血清室温(15~25℃)下可稳定48h,在冰箱中(2~8℃)可稳定7天。
-20℃放置12个月。
为避免标本中水份挥发使血清浓缩,对保存超过1天的标本均加塞密闭或覆盖保鲜膜。
2.2.3 已完成测试的标本保存完整的识别号,置2~8℃冰箱内保存7天。
备复检。
2.3 标本采集的注意事项2.3.1 采血前使受检者保持平静、松弛状态。
2.3.2 不建议采集抗凝血标本,如果必须使用血浆,推荐的抗凝剂是肝素。
3 方法原理本品采用胶体金免疫检测技术和层析原理,定性检测血清(血浆)样本中的梅毒螺旋体抗体。
检测时,样本中梅毒抗体可与胶体金标记抗原(大肠杆菌表达)结合形成抗原抗体复合物,由层析作用复合物沿纸条向前移动,经过检测线时与预包被的抗原(大肠杆菌表达)结合形成“Au-TPAg-TPAb-TPAg”夹心物而凝聚显色。
游离的胶体金标记梅毒抗原(大肠杆菌表达)则在对照线处与预包被的兔抗TP抗体结合而富集显色。
疫苗使用标准和抗体检测要求word精品文档8页
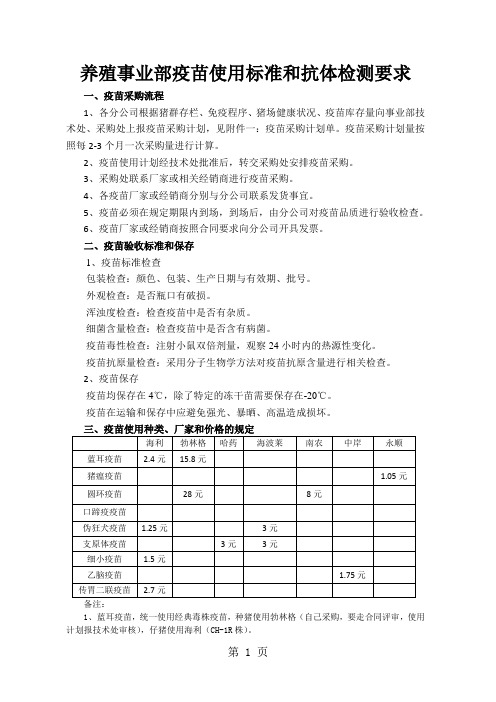
养殖事业部疫苗使用标准和抗体检测要求一、疫苗采购流程1、各分公司根据猪群存栏、免疫程序、猪场健康状况、疫苗库存量向事业部技术处、采购处上报疫苗采购计划,见附件一:疫苗采购计划单。
疫苗采购计划量按照每2-3个月一次采购量进行计算。
2、疫苗使用计划经技术处批准后,转交采购处安排疫苗采购。
3、采购处联系厂家或相关经销商进行疫苗采购。
4、各疫苗厂家或经销商分别与分公司联系发货事宜。
5、疫苗必须在规定期限内到场,到场后,由分公司对疫苗品质进行验收检查。
6、疫苗厂家或经销商按照合同要求向分公司开具发票。
二、疫苗验收标准和保存1、疫苗标准检查包装检查:颜色、包装、生产日期与有效期、批号。
外观检查:是否瓶口有破损。
浑浊度检查:检查疫苗中是否有杂质。
细菌含量检查:检查疫苗中是否含有病菌。
疫苗毒性检查:注射小鼠双倍剂量,观察24小时内的热源性变化。
疫苗抗原量检查:采用分子生物学方法对疫苗抗原含量进行相关检查。
2、疫苗保存疫苗均保存在4℃,除了特定的冻干苗需要保存在-20℃。
疫苗在运输和保存中应避免强光、暴晒、高温造成损坏。
备注:1、蓝耳疫苗,统一使用经典毒株疫苗,种猪使用勃林格(自己采购,要走合同评审,使用计划报技术处审核),仔猪使用海利(CH-1R株)。
2、猪瘟疫苗全部使用脾淋苗或细胞苗。
3、圆环疫苗,种猪使用勃林格(自己采购,要走合同评审,使用计划报技术处审核),仔猪使用南农(SH株)。
4、口蹄疫疫苗全部从政府采购,疫苗使用厂家为中农威特兰兽研。
5、支原体疫苗只免疫仔猪。
6、细小疫苗只注射后备种猪以及经产母猪前三胎。
7、乙脑疫苗只免疫后备种猪,以及每年3、4月份对种猪的普免。
8、传胃二联疫苗在每年10月、11月对种猪进行普免,对母猪产前24天进行免疫(母猪产前免疫与普免冲突时可不再普免)。
9、个别场发生副猪嗜血杆菌时,可使用中牧、海波莱、英特威品牌疫苗。
使用计划报事业部技术处批准。
10、个别场发生链球菌时,可使用海利品牌疫苗。
抗体筛检试验操作规程

抗体筛检试验操作规程
1.【目的】检查血清中是否有不完全抗体。
2.【试剂】
2.1凝聚胺试剂:
2.2筛检红细胞Ⅰ、Ⅱ、Ⅲ号:
3.【操作步骤】
3.1取试管三支,各加被检血清(或血浆)2滴,分别加入筛检红细胞(Ⅰ、Ⅱ和Ⅲ)各一滴。
3.2各加LIM0.7ml,混合均匀后,再各加Polybrene溶液2滴,并混合均匀。
3.3用BASO血库专用离心机1000g离心力,离心10秒,(若用普通离心机,离心条件为:3400rpm,离心10秒)然后把上清液倒掉,不要沥干,让管底残留约0.1ml液体。
3.4轻轻摇动试管,目测红细胞有无凝集,如无凝集,则必须重作。
3.5最后加入Resuspending2滴,轻轻转动试管混合并观察结果。
如凝集散开,表示由Polybrene引起的非特异性凝集,抗体筛检结果为阴性。
如凝集不散开,则为红细胞抗原抗体结合的特异性反应,抗体筛检结果为阳性,应进一步作抗体鉴定。
抗体筛查标准操作规程

直接或间接抗球蛋白试验(Coombs test)介绍:多克隆抗人球蛋白(AHG)常工作中常用来检测和鉴定同种异体抗体、交叉配血试验和直接抗球蛋白试验(DA T)。
试剂:6孔微柱凝胶卡,凝胶介质中含有多克隆AHG试剂(兔抗-IgG和单克隆抗-C3d,C139-9细胞系),保存于<0.1% NaN3中,置于18℃-25℃下。
器材:微量加样器,吸量管,吸嘴,微柱凝胶卡架,操作台,37℃孵育箱,微柱凝胶卡专用离心机,标本要求:为了获得最佳的试验结果,应该尽量使用新鲜的标本或者使用符合实验室接收标准的标本。
标本应该使用柠檬酸盐,EDTA或CPD-A抗凝。
当使用血清代替血浆作为标本时,必须通过1500g或10min的离心除去血浆,以免纤维蛋白影响试验结果。
标准的准备:a) DAT或对照红细胞悬液使用2号稀释液配置0.8%红细胞悬液:在使用前使稀释液恢复室温,吸取1.0ml 2号稀释液到一干净的试管中,加入10µl包被好的红细胞,混匀,这些红细胞悬液可以立即被使用。
b) 使用血浆或血清检测间接抗球蛋白试验(IAT)过程。
标本在分离后没有被使用的时候最好保存于2-8℃,最多保存48h,超过这个时间最好保存在-20℃冰箱。
测试过程:不要使用已经干涸的,有气泡的,密封膜损坏了的或者凝胶处于微孔上部或铝箔上边的微柱凝胶卡。
Ⅰ. 直接抗球蛋白试验(DAT)1.检查微柱凝胶卡,标记好患者或献血员的名字或代码。
2.根据需要移除铝箔,并保持向上。
3.加入50µl红细胞悬液到适当的微孔中。
4.将微柱凝胶卡置于专用离心机上离心10min。
5.检查和记录结果。
Ⅱ.抗体筛查(IAT)请使用准备好的测试细胞试剂(ID-DiaCell),在使用前需要恢复室温。
1. 检查微柱凝胶卡,标记好患者或献血员的名字或代码。
2. 根据需要移除铝箔,并保持向上。
3. 加每种测试细胞试剂50µl到适当的微孔中(标记相应的测试细胞类型)。
乙肝五项操作规程

乙肝五项操作规程(总4页)・CAL・FENGHAL・(YICA])・Company One 1■CAL■本页仅作为文档封面,使用请直接删除乙肝五项(乳胶法)操作规程1 •检测目的乙型肝炎病毒标志物(HBsAg、HBsAb、HBeAg、HBeAb、HBcAb)检测。
2.测定原理HBsAg检测采用双抗体夹心法原理,试剂含有被事先固定于膜上测试区(T区)的抗体。
检测时,标本滴入试剂加样处,标本与预包被的乳胶颗粒(即标记物)结合的HBsAb(即标记抗体)反应,该结合物随之在毛细效应下向上层析。
如是阳性,乳胶抗体(标记抗体)在层析过程中先与标本中的HBsAg结合,随后结合物会被固定在T区膜上的HBsAb捕获,形成HBsAb标记抗体-HBsAg-HBsAb复合物,从而在T区形成一条红杠。
如为阴性,则T 区没有红杠。
HBsAb检测采用双抗原夹心法原理,试剂含有事先固定于膜上测试区(T区)的HBsAgo检测时,标本滴入试剂加样处,标本与预包被的乳胶颗粒结合的HBsAg反应(即标记抗原)反应,该结合物随之在毛细效应下向上层析。
如是阳性,乳胶抗原(标记抗原)在层析过程中先与标本中的HBsAb结合,随后结合物会被固定在T区膜上的HBsAg捕获,形成HBsAg标记抗原-HBsAb-HBsAg复合物,从而在T区形成一条红杠。
如为阴性,则T区没有红杠。
HBeAg检测采用双抗体夹心法原理。
试剂含有事先固定于膜上测试区(T区)的HBeAbo检测时,标本滴入试剂加样处,标本与预包被的乳胶颗粒结合的HBeAb反应(即标记抗体)反应,该结合物随之在毛细效应下向上层析。
如是阳性,乳胶抗体(标记抗体)在层析过程中先与标本中的HBeAg结合,随后结合物会被固定在T区膜上的HBeAb捕获,形成HBeAb标记抗原-HBeAg-HBeAb复合物,从而在T区形成一条红杠。
如为阴性,则T区没有红杠。
HBeAg、HBeAb采用竞争抑制法原理,试剂含有事先固定于膜上测试区(T区)的抗体。
梅毒

目的:规范的梅毒螺旋体检验操作,确保检测结果准确。
适用范围:性病实验室工作人员责任人:实验操作者1、标本的采集与处理血清标本根据需要,用一次性真空采血针与促凝采血管抽取静脉血 2 ml,室温静置1-2小时(或37℃静置30分钟),待血液凝固、血块收缩后,3000r/min离心10-15分钟,分离新鲜血清,备用。
也可采用保存于2-8℃或-20℃的血清。
溶血、脂血或污染的标本可影响试验结果。
标本接收的标准核对样品与运送单,检查样品管有无破损和溢漏。
如发现溢漏应立即将尚存留的样品移出,对样品管和盛器消毒并做记录。
检查样品的状况,记录有无严重溶血、微生物污染、脂血以及黄疸等情况。
如果样品污染或者认为样品不能被接受,应将样品安全废弃。
并将样品情况立即通知运送机构。
对不合要求的标本,可以拒绝接受。
2、梅毒的实验室检查TP-RT梅毒免疫层析法-梅毒快速检测(TP-RT)TP-RT为免疫层析试验,简便快速,一般可在10~30分钟内得出结果。
以硝酸纤维膜为载体,重组的梅毒螺旋体抗原抗原线状固定在膜上,待检样品(全血、血清或血浆)沿着固相载体迁移,阳性结果在膜上抗原部位显示出有色条带。
质控带显色为有效试验。
标本采集[检验方法]1、待测样本、测试卡在室温平衡后再检2、从原包装中铝箔袋中取出试剂3,将试剂置于干净平坦的台面上,用一次性塑料试管吸取样本垂直滴加1滴样本(约25ul)于S加样孔中,然后加2滴缓冲液,同时开始记时,10-20分钟内观察结果观察显示结果。
[检验结果的解释]阳性:在检测线位置及对照线位置各出现一条反应线。
阴性:仅在对照线位置出现一条反应线。
无效:测试纸无反应线出现或仅在检测线位置出现一条反映现,表明试验失败或检测试纸失效。
请用新测试纸重试。
如果问题仍然存在,请停止使用本批产品,并与当地经销商联系。
[试验方法的局限性]1、由于技术上和操作上可能出现的失误,以及样本中可能存在的干扰物质,会导致错误的结果。
新城疫抗体测定的规范操作___

1测定的器材及使用方法1.1托盘天平托盘天平测量开始前,必须先将游码移到标尺左端的零刻度处,然后才开始调节平衡螺母,使天平平衡。
若将平衡螺母左右移至尽头天平仍不得平衡,则应检查原因,不能移动游码来达到平衡。
1.2离心机离心机使用时离心管液体不能装得太满,对称放置的试样必须配平。
1.3移液枪移液枪吸头装配时需将移液器垂直插入吸头,左右微微转动,上紧即可,切勿用移液器反复撞击吸头来上紧。
1.4移液器移液器吸液时应垂直吸液,吸头尖端侵入液面3mm以下,吸液时枪头应预润湿,然后再正式移液。
吸液可将按钮按到第一档吸液,释放按钮。
放液时先按下第一档,打出大部分液体,再按下第二档,将余液排出。
吸取的过程应该做到“慢吸快打”,在吸液时要慢、准,放液时对准后速度要快,可以避免打完后吸头下存留液体,保证加入的液体体积一致。
2规范的采血方法采血前采血者先将注射器内吸入3.8%的枸橼酸钠。
采血时,一人将鸡侧卧保定,一人固定鸡的头部和脚;从侧翅膀采血,一手固定采血部分,一手采血;采血完毕后采血者一手将抗凝剂和血液轻轻摇匀,一手用干棉球按压采血部位止血。
采血部位最好从翅静脉丛刺入,比较容易采血成功且不容易淤血。
3红细胞悬液的配制血液采集完毕需取下针头,把血液沿离心管的管壁缓慢注入离心管中,防止红细胞的破坏。
然后轻轻来回晃动离心管,使血液与抗凝剂充分混合,配平后置于离心机中开始离心。
离心完毕,应先选用5mL的移液器吸取上面的液体,然后再选用1 mL或200μL的移液器吸取,最好以画圈的方式吸取,比较容易把白细胞和血小板吸干净。
最后一次离心完毕,按照计算量用移液器从离心管底部吸取红细胞放入加好生理盐水的烧杯中,再反复回用生理盐水将移液器吸头里的红细胞洗下来,保证配制红细胞浓度的准确性。
4血凝试验血凝试验操作过程中需要注意的是使用微量移液器吸取液体时,吸头需碰壁以除去多余的液体;加样时应将所加物在V型板的底部,避免加在孔壁上部,并注意不可溅出;倍比稀释时,要注意避免产生过多的气泡,影响结果的准确性;加红细胞时最好悬滴或由后往前加,因为孔内已有稀释的抗原,如果吸头接触到孔内混合液,会造成各个孔间液体相互污文章编号:1004-2342(2013)02-0048-02中图分类号:S852.65+9.5文献标识码:C新城疫抗体测定的规范操作向双云,周珍辉(北京农业职业学院,北京房山102442)疫病防控经费管理办法》出台,完善财政投入机制,构建与国家动物疫病防治工作相适应的财政支持政策。
HPV抗体检测规程

HPV抗体检测规程
一、操作步骤:
1、将试剂盒从冰箱中取出,至室温中平衡30分钟后使用。
2、将标本对应微孔按顺序编号。
3、将10×样本稀释液和20×洗涤液用蒸馏水分别稀释成1×应用液。
4、样本血清按1:100稀释。
5、阳性对照、阴性对照、标准血清孔,每孔先
加100ul生理盐水,再分别取相应血清10ul 加入孔中。
6、将已稀释的样本血清分别加入到酶标板中,
每孔100ul。
放置37度,20分钟后弃去孔内液体。
7、洗板:酶标板每孔加入洗涤液250ul、30秒
后弃去孔中液体,重复洗板3次,拍干。
8、加酶结合物:每孔两滴,37度20分钟后弃去
孔中液体,洗板4次,拍干。
9、显色与终止:分别加底物A、底物B各一滴,
室温避光显色,见标准血清出现浅兰色时(约十分钟),目测判定结果;或每孔加终止液1滴,测OD值。
二、结果判断:
1、目测:颜色深于或等于标准血清者为阳性,否则为阴性。
2、以酶标仪450nm波长测定各孔OD值,样品
OD值大于或等于标准血清为阳性,否则为阴性。
三、注意事项:
1、不同批试剂不得混用。
2、再有效期内使用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Q/HBY
抗体检验标准操作规程
杭州博茵生物技术有限公司发布
前 言
本规范由杭州博茵生物技术有限公司提出。
本规范起草单位:杭州博茵生物技术有限公司。
本规范主要起草人:李因来、徐东鑫、陈浙、潘剑用。
本规范于2016年7月27日首次发布
编制人陈浙日期2016.07.26部门抗体研发部审核人徐东鑫日期2016.07.27部门质量部
批准人潘剑用日期2016.07.27部门抗体研发部发放编号Q/HBY QF0001‐2016生效日期2016.07.27
抗体检验标准操作规程
1.目的
对单克隆抗体成品的检验操作做出规定,以保证成品质检结果的准确性。
2.范围
适用于下述第6条“合格标准”表格中所列抗体成品的效价测定。
3.职责
操作人员依据本规程进行抗体检验。
4.材料与设备、试剂与溶液
见下述相关文件。
5.检验方法
5.1外观
包装完好,无漏液现象,标签准确。
5.2物理性能
自然光下目测,观察产品溶液是否澄清、是否有沉淀或悬浮物。
5.3浓度
按QC-0004《抗体浓度测定(A280)标准操作规程》测定样品的浓度。
5.4纯度
将样品稀释到1mg/ml,按QC-0003《蛋白SDS-PAGE检测标准操作规程》进行检测并作记录。
其中,样品缓冲液含DTT或β-巯基乙醇,样品应加热处理,浓缩胶浓度为3%,分离
胶浓度为12%,染色方法为考染。
5.5效价
按QC-0002《效价检测标准操作规程》进行。
6.合格标准
项目
产品
M010101M010102
外观包装完好,无漏液现
象,标签准确
包装完好,无漏液现
象,标签准确
物理性能无色澄清液体、无沉
淀、无悬浮物
无色澄清液体、无沉
淀、无悬浮物
浓度≥3mg/ml,且偏差±
5%
≥3mg/ml,且偏差±
5%
纯度≥95%≥95%
效价 1.28ng/ml 1.28ng/ml 7.相关文件
QC-0002《抗体效价检测标准操作规程》
QC-0003《蛋白SDS-PAGE检测标准操作规程》
QC-0004《抗体浓度测定(A280)标准操作规程》
8.相关记录
QF-0001-RE-01《抗体检验报告》
QF-0002-RE-01《抗体效价检测记录》
QC-0003-RE-01《蛋白SDS-PAGE检测记录》
QC-0004-RE-01《抗体浓度测定(A280)记录》。
