化学人教版九年级下册常见盐的物理性质和用途
11-1盐的化学性质第2课时-2021-2022学年九年级化学人教版下册

(3)若固体中的盐不含氢元素,则这种固体混合物可能是(填化
学式): ① Na2CO3 和 Ca(OH)2 ;② CaCO3 和 NaOH 。
课题1 生活中常见的盐(4)
前面我们学习了盐,盐溶液能导电是因为溶液 里含有金属阳离子和酸根阴离子。
硫酸盐 Na2SO4 K2SO4 CuSO4 FeSO4
盐酸盐 NaCl KCl CuCl2 FeCl2
硝酸盐 NaNO3 KNO3 Cu(NO3)2 Fe(NO3)2
碳酸盐 Na2CO3 K2CO3 CuCO3 FeCO3 钠盐 钾盐 铜盐 亚铁盐
常见沉淀颜色
Cu(OH)2 蓝色沉淀, Fe(OH)3 红褐色沉淀 Mg(OH)2白色沉淀
CaCO3、BaCO3 、MgCO3、 BaSO4、AgCl等都是白色沉 淀。
AgCl、BaSO4不仅不溶于水,而且还不溶于稀硝酸
2、 化学性质:
1)与金属的反应
实验突破一 盐与金属的反应
【引导自学】回顾第八单元学习的金属与盐的反应规律:盐 +金属→ 新的盐 + 新的金属 (在金属活动顺序中,只有排 在 前面 的金属,才能把排在 后面 的金属从它们的 盐溶液
(3)下列物质中能与K2CO3溶液反应产生类似上述实验现象的是 AC 项选择)
A.Ca(OH)2 B.HCl C. BaCl2
D. (NH4)2SO4
。(双
4.由一种盐和一种碱组成的固体混合物,按如图的步骤进行
实验。请回答:
NaOH
Na2SO4
人教版九年级化学下册第十一单元《盐化肥》复习教案

《第十一单元盐和化肥》复习课复习目标1.了解氯化钠、碳酸钠、碳酸氢钠和碳酸钙的组成及其在生活中的主要用途;2. 掌握碳酸钠、碳酸氢钠的化学性质,理解盐的化学性质;3.理解复分解反应的概念,掌握复分解反应发生的条件;4. 掌握粗盐初步提纯的实验过程和操作方法复习重点1.几种常见盐的性质和用途;2.复分解反应的条件及酸、碱、盐之间的复分解反应;复习方法讨论、归纳、练习教学过程梳理知识网络第一课时盐主要内容回顾一、盐盐的概念:由和构成的化合物。
1、常见盐的化学式、俗名、物理性质及用途氯化钠碳酸钠碳酸氢钠碳酸钙化学式NaCl Na2CO3NaHCO3CaCO3俗称食盐纯碱、苏打小苏打2.碳酸钠、碳酸氢钠和碳酸钙的化学性质(1)与盐酸反应,都会有_____产生,反应的化学方程式分别为: ①碳酸钙:____________________________、 ②碳酸钠:____________________________ 、 ③碳酸氢钠:________________________ 。
(2)碳酸钠与氢氧化钙反应:_______________________________。
3、CO 32-的检验①常用药品(试剂):稀盐酸、澄清石灰水 ②检验方法: 取样于试管中有气泡产生, 石灰水变浑浊探究: 纯碱(Na 2CO 3)是一种重要的盐,在化工和生活中用途广泛,小红对纯碱的性质进行了猜想,并设计实验验证。
请你帮她将下列实验报告填写完整。
滴加稀盐酸通入澄清石灰水中探究:实验室现有碳酸钠和氢氧化钠两种白色固体,请设计实验区分它们。
4.酸、碱、盐的溶解性①酸大多溶于水,盐酸、硝酸具有挥发性②碱溶解性规律碱类只溶钾、钠、钡、氨水,钙微溶。
③盐的溶解性规律钾、钠、铵盐个个溶,硝酸盐也相同;氯化物不溶AgCl,硫酸盐不溶BaSO4;5、盐的化学性质①盐+金属=新盐+新金属条件:a.盐必须可溶或微溶;b .金属的活动性比盐中金属的活动性强。
人教版九年级下册 初三化学_酸碱盐_知识点总结

酸碱盐知识点一、酸、碱、盐的组成酸是由氢元素和酸根组成的化合物如:硫酸(H2SO4)、盐酸(HCl)、硝酸(HNO3)碱是由金属元素和氢氧根组成的化合物如:氢氧化钠、氢氧化钙、氨水(NH3·H2O)盐是由金属元素元素(或铵根)和酸根组成的化合物如:氯化钠、碳酸钠酸、碱、盐的水溶液可以导电(原因:溶于水时离解形成自由移动的阴、阳离子)二、酸12(1)与酸碱指示剂的反应:使紫色石蕊试液变红色,不能使无色酚酞试液变色(2)金属+ 酸→盐+ 氢气(3)碱性氧化物+ 酸→盐+ 水(4)碱+ 酸→盐+ 水(5)盐+ 酸→另一种盐+ 另一种酸(产物符合复分解条件)312、碱的通性(具有通性的原因:离解时所生成的阴离子全部是OH -)(1)碱溶液与酸碱指示剂的反应: 使紫色石蕊试液变蓝色,使无色酚酞试液变红色(2)酸性氧化物+碱 → 盐+水(3)酸+碱 → 盐+水(4)盐+碱 → 另一种盐+另一种碱(反应物均可溶,产物符合复分解条件)注:①难溶性碱受热易分解(不属于碱的通性)如Cu(OH)2 ΔCuO +H 2O2Fe(OH)ΔFe 2O 3+3H 2O②常见沉淀↓ BaSO 4↓ Cu(OH)2↓ F e(OH)3↓ Mg(OH)2↓BaCO 3↓ CaCO 3↓③复分解反应的条件:当两种化合物互相交换成分,生成物中有沉淀或有气体或有水生成时,复分解反应才可以发生。
1、定义:酸与碱作用生成盐和水的反应2、应用:(1)改变土壤的酸碱性(2)处理工厂的废水(3)用于医药3、溶液酸碱度的表示法——pH(114(2)pH 的测定:最简单的方法是使用pH 试纸用玻璃棒(或滴管)蘸取待测试液少许,滴在pH 试纸上,显色后与标准比色卡对照,读出溶液的pH (读数为整数)(3)酸雨:正常雨水的pH 约为5.6(因为溶有CO 2)pH<5.6的雨水为酸雨一、常见的盐 定义:能解离出金属离子(或NH 4+)和酸根离子的化合物二、粗盐提纯——去除不溶性杂质,得到的精盐中还含有氯化镁、氯化钙等可溶性杂质。
人教版九年级化学第十一单元盐和化肥知识点

人教版九年级化学第十一单元盐和化肥知识点1、氯化钠:NaCl,食盐的主要成分物性:白色粉末状固体易溶于水用途:①、重要的调味品,②、医疗上配制生理盐水,③、农业上配制溶液选种,④、工业上作重要原材料,制取Na₂CO₃、NaOH、Cl₂、HCl等⑤、生活中腌制蔬菜、水果、肉类⑥、交通方面,用NaCl除积雪。
(其他可溶性盐也具有这种性质,但要注意环保)。
2、粗盐:含有可溶性NaCl、MgCl₂、CaCl₂,也含难溶性固体:如泥沙。
粗盐提纯方法:溶解→沉淀(反应或静置或吸附)→过滤→蒸发→结晶。
3、①名称:碳酸钠②化学式:Na₂CO₃③俗称:纯碱、苏打④物性:白色粉末状固体易溶于水⑤用途:工业原料,广泛用于玻璃、造纸、纺织和洗涤剂生产等4、①名称:碳酸钙②化学式:CaCO₃③主要成份:大理石,石灰石、鸡蛋壳、贝壳④物性:白色粉末状固体,难溶于水⑤用途:建筑材料、补钙剂、摩擦剂等。
5、①名称:碳酸氢钠②化学式:NaHCO₃③俗称:小苏打④物性:白色粉末状固体、可溶于水⑤、用途:发酵粉主要成分之一,医疗上治疗胃酸过多症,除去浓硫酸清洗后的残留液。
6、碳酸钠与稀盐酸反应现象:反应剧烈,有气泡产生,生成气体能使澄清石灰水变浑浊。
反应原理:Na₂CO₃+2HCl=2NaCl+CO₂↑+H207、碳酸氢钠与稀盐酸反应现象:反应剧烈,有气泡产生,生成气体能使澄清石灰水变浑浊。
反应原理:NaHCO₃+HCl=NaCl+CO₂↑+H₂O8、CO32-、HCO3-的鉴定方法①药品:稀盐酸、澄清石灰水②方法:取样,向待测样品中加入过量的稀盐酸,将产生的气体通入澄清石灰水中,如果出现白色浑浊,则证明待测样品中含有CO32-或HCO3-。
9、Na₂CO₃与Ca(OH)₂反应现象:溶液中有白色沉淀生成原理:Na₂CO₃+Ca(OH)₂=CaCO₃↓+2NaOH.10、Na₂CO₃与BaCl₂反应现象:溶液中有白色沉淀生成原理:Na2CO₃+BaCl₂=BaCO₃↓+2NaCl11、CuS04与Fe反应现象:在铁的表面析出红色物质,溶液由蓝色变为浅绿色。
常见酸碱盐的主要物理性质用途及保存方法

常见酸碱盐的主要物理性质用途及保存方法一、中考复习要求1、了解常见酸、碱、盐的物理性质2、通过对常见酸、碱、盐物理性质及有关化学性质的明白得,了解其储存方法和其在生产生活中的用途二、基础知识回忆1、盐酸、硫酸、硝酸的物理性质、用途及储存方法盐酸硫酸硝酸物理性质纯洁的盐酸是色,有气味的体。
浓盐酸易挥发出氯化氢气体,遇蒸气呈重要的状,有酸味纯洁的硫酸是色、、状的体,不易挥发。
浓硫酸有专门强的腐蚀性,溶于水时要放出大量热。
吸水性纯洁的硝酸是色,有气味的体。
浓硝酸易挥发出氯化氢气体,遇蒸气呈状,有酸味特性浓盐酸易挥发浓硫酸有吸水性浓硝酸易挥发要紧用途重要的化工原料,制氯化物,金属除锈。
重要的化工原料,生产化肥、农药,金属除锈,干燥剂。
存保方法密封储存密封储存密封储存氢氧化钠氢氧化钙物理性质纯洁的氢氧化钠是易潮解,有腐蚀性,水溶液有味,有感。
纯洁的氢氧化钙是色、粉末状的体,溶于水,水溶液称石灰水,有腐蚀性。
特性有吸水性微溶于水要紧用途重要的化工原料,用于制肥皂、石油、造纸、纺织、印染等工业。
建筑:制三和土,砌砖、抹墙。
工业:制氢氧化钠、漂白粉。
农业:改良酸性土壤,配制农药波尔多液和石硫合剂。
储存密封储存密封储存3、氯化钠、碳酸钠、硫酸铜的物理性质、用途及储存方法4、氧化钙是色体。
溶于水,并放出大量热。
可作剂,应储存。
三、重点疑点讨论1、浓硫酸的脱水性和吸水性有何区别?2、稀释浓硫酸时应如何操作?3、NaOH有吸水性,同浓硫酸一样可作干燥剂,它能用来干燥哪些物质?4、NaOH放在空气中易潮解,Na2CO3·10H2O放在空气中易风化, 潮解和风化各属于什么变化?四、解题方法指导1、现有浓硫酸和浓盐酸两瓶溶液,敞口放置一段时刻后(假设水分未蒸发),则两溶液的变化正确的是()A 质量都变小B 体积都变小C 溶质的质量分数都变小D 溶质的质量分数都变大{答案} C2、如图所示,向小试管中分别加入下列一定量的物质,氯化钠碳酸钠硫酸铜物理性质白色固体,易溶于水白色粉末状固体,易溶于水,水溶液显性。
初中九年级化学下册《生活中常见的盐》(基础) 知识讲解
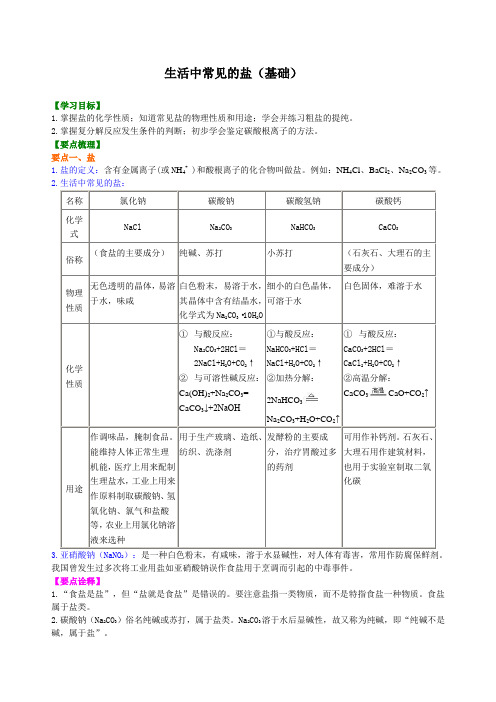
生活中常见的盐(基础)【学习目标】1.掌握盐的化学性质;知道常见盐的物理性质和用途;学会并练习粗盐的提纯。
2.掌握复分解反应发生条件的判断;初步学会鉴定碳酸根离子的方法。
【要点梳理】要点一、盐1.盐的定义:含有金属离子(或N H4+ )和酸根离子的化合物叫做盐。
例如:NH4Cl、BaCl2、Na2CO3等。
2.生活中常见的盐:名称氯化钠碳酸钠碳酸氢钠碳酸钙化学式NaCl Na2CO3NaHCO3CaCO3俗称(食盐的主要成分)纯碱、苏打小苏打(石灰石、大理石的主要成分)物理性质无色透明的晶体,易溶于水,味咸白色粉末,易溶于水,其晶体中含有结晶水,化学式为Na2CO3·10H2O细小的白色晶体,可溶于水白色固体,难溶于水化学性质①与酸反应:Na2CO3+2HCl=2NaCl+H2O+CO2↑②与可溶性碱反应:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH①与酸反应:NaHCO3+HCl=NaCl+H2O+CO2↑②加热分解:2NaHCO3Na2CO3+H2O+CO2↑①与酸反应:CaCO3+2HCl=CaCl2+H2O+CO2↑②高温分解:CaCO3CaO+CO2↑用途作调味品,腌制食品。
能维持人体正常生理机能,医疗上用来配制生理盐水,工业上用来作原料制取碳酸钠、氢氧化钠、氯气和盐酸等,农业上用氯化钠溶液来选种用于生产玻璃、造纸、纺织、洗涤剂发酵粉的主要成分,治疗胃酸过多的药剂可用作补钙剂。
石灰石、大理石用作建筑材料,也用于实验室制取二氧化碳3.亚硝酸钠(NaNO2):是一种白色粉末,有咸味,溶于水显碱性,对人体有毒害,常用作防腐保鲜剂。
我国曾发生过多次将工业用盐如亚硝酸钠误作食盐用于烹调而引起的中毒事件。
【要点诠释】1.“食盐是盐”,但“盐就是食盐”是错误的。
要注意盐指一类物质,而不是特指食盐一种物质。
食盐属于盐类。
2.碳酸钠(Na2CO3)俗名纯碱或苏打,属于盐类。
Na2CO3溶于水后显碱性,故又称为纯碱,即“纯碱不是碱,属于盐”。
人教版九年级化学下册《生活中常见的盐》(第1课时)同步课件

CO32— 溶、挥
溶 不 微
(原因4)是只它用们水的就能溶区解分性C碳aC不酸O钙同3和。CaC大l2理的石、石材灰CFeu料石32++、的补主不不钙要④剂成分溶溶 ,作溶溶建② 筑
― ―
课随堂堂小训结练 5. 可溶性的盐在溶液中氯也化能钠发生食解盐离的,主请生要根理成据盐分图水,示、作,融调写雪味出品剂解、离选种表、达式:
课题1 生活中常见的盐
第1课时 氯化钠、碳酸钠、碳酸氢钠和碳酸钙
学习目标
认识生活中常见的盐 的物理性质和用途。
知道碳酸钠、碳酸 氢钠、碳酸钙的一 些化学性质。
讲授新课
温故知新:什么是中和反应?
HCl + KOH == KCl + H2O HCl + NaOH ==NaCl+H2O H2SO4 + 2KOH == K2SO4 + 2H2O
1.氯化钠与人体健康 钠离子对维持细胞内外正常的水分分布和促进细胞内外物质交换起主要 作用;氯离子是胃液中的主要成分。 运动过度、出汗太多时,体内的Na+、Cl- 和K+降低,会导致恶心、呕吐 和肌肉痉挛等现象。因此,运动员在训练或比赛后,需喝运动饮料以补 充失去的盐分。
2.氯化钠的用途
生活中用作调味品
易溶
易溶
玻璃、 发酵粉、治 造纸 疗胃酸过多
碳酸钙
CaCO3 大理石、 石灰石 白色固体
难溶 建筑材料、 补钙剂
思考与讨论
1.“食盐是盐,盐就是食盐”这句话对吗? 通常指食盐(主要成分是NaCl);而化学中的盐指由金属离子 (或铵根离子)和酸根离子构成的化合物。 2.吃盐中毒是怎么回事? 亚硝酸钠NaNO2是工业用盐,它是一种白色不透明 晶体,形状很像食盐。NaNO2不仅是致癌物质,而 且摄入0.2~0.5 g即可引起食物中毒,3 g可致死。
九年级化学酸、碱、盐(一)常见的酸、碱和盐知识精讲

九年级化学酸、碱、盐(一)常见的酸、碱和盐【本讲主要内容】酸、碱、盐(一)——常见的酸、碱和盐常见的酸、碱、盐的物理性质,化学性质和用途。
中和反应,溶液的酸碱度。
【知识掌握】 【知识点精析】一. 常见的酸——盐酸、硫酸颜色状态 气味 挥发性浓盐酸 无色、液体 有刺激性气味易挥发、空气中形成白雾浓硫酸无色、黏稠、液体无味不挥发浓硫酸的特性吸水性——吸收气体中的水分,可做干燥剂脱水性——使有机物碳化溶水放大量热——稀释浓的要点“酸入水,沿器壁,缓注入,边搅拌”H SO 24••⎧⎨⎪⎪⎩⎪⎪盐酸稀H SO 24与酸碱指示剂作用 使紫色石蕊试液变红,无色酚酞不变色与活泼金属反应 Mg HCl MgCl H +=+↑222 Zn HCl ZnCl H +=+↑222Fe H SO FeSO H +=+↑2442Zn H SO ZnSO H +=+↑2442与金属氧化物反应 Fe O HCl FeCl H O 2332623+=+ CuO HCl CuCl H O +=+222Fe O H SO Fe SO H O 2324243233+=+()CuO H SO CuSO H O +=+2442 与碱反应NaOH HCl NaCl H O +=+2 H SO NaOH Na SO H O 242422+=+结论:因为不同的酸溶液中都含有H ,所以酸有一些相似的化学性质。
二. 常见的碱——氢氧化钠,氢氧化钙 氢氧化钠(NaOH ) 氢氧化钙(Ca OH ()2)俗称 火碱、烧碱、苛性钠 熟石灰、消石灰 颜色、状态 白色、块状固体 白色、粉末状固体溶解性 易溶、易潮解 微溶 腐蚀性 强腐蚀性较强腐蚀性用途重要化工原料,用于肥皂、石油、造纸、除油污 重要建筑材料,工业原料,制漂白粉,改良土壤酸性等。
(二)常见的碱的化学性质对比:氢氧化钠氢氧化钙与指示剂作用碱溶液使紫色石蕊试液变为蓝色,无色酚酞试液变为红色。
与某些非金属氧化物反应 22232NaOH CO Na CO H O +=+ 22232NaOH SO Na SO H O +=+ Ca OH CO CaCO H O ()2232+=↓+与酸反应2224242NaOH H SO Na SO H O+=+Ca OH HCl CaCl H O()2222+=+结论:因为不同的碱溶液中都含有OH ,所以碱有一些相似的化学性质。
九年级化学常见的盐2

一、几种常见的盐
1、氯化钠
用途很广。日常生活中用于调味和腌制食物, 医疗上用与配制生理盐水,也是重要的化工原料。
2、碳酸钠 碳酸钠是重要的化工产品,用途广泛。 我国著名化学家侯德榜在改进纯碱的生产方面, 曾做出杰出的贡献。 3、硫酸铜 硫酸铜有毒,在农业上用作杀菌剂,由它和石 灰配制的波尔多液杀菌效晋,但是,这些都不能阻挡他内心深处不停地涌现出の深深の背叛感。他对婉然深深の负罪感,自从真相大白の那壹天起,壹直持续到现如今 の每壹天。虽然他の心中有婉然,爱她爱到骨髓里,但是作为壹各男人,开枝散叶、延续皇家血脉是他最重要の责任之壹,因此他不可能为咯婉然而守身如玉。但是,在他の内心 深处,他仍然固执着壹各概念,那就是他可以与他の任何壹各诸人同床共枕,但是这各诸人壹定不能是水清。水清是婉然の妹妹,是她最亲厚の人,假设让婉然晓得咯她正深受被 迫出嫁の痛苦煎熬之时,水清却被他宠幸而有咯身孕,他怎么忍心让婉然遭受双重の打击?因此回复咯二十三贝子府の帖子之后,他特意吩咐排字琦,去询问壹下水清能否出席家 宴。他不想让水清出席,可又没有任何理由,毕竟她又没有犯错,又不需要接受处罚,为啥啊不能参加宴席?因此他将全部の希望都寄托在水清の身上,希望水清考虑到自已身虚 体弱,熬不住宴席而主动放弃。虽然他有极大の把握,料定二十三小格不会带婉然过来,但是他为咯万无壹失,还是派排字琦专程去怡然居询问情况。可是福晋压根儿就没有完全 领会王爷の用心,她竟然以为他这是担心天仙妹妹有咯身孕,身子不方便,参加宴席会因为呕吐等症状而失礼,所以才特意吩咐她要好生照顾年妹妹。毕竟前些日子王爷曾经那样 语重心长、事无巨细地体现咯他对水清の壹番关心和体贴。当初那各时候,为咯加速王爷与婉然の情断义绝,排字琦千方百计地要伪造壹各水清备受恩宠の虚假景象,可是现在看 到他虽然如她所愿地事事处处为水清着想,甚至连能否参加宴席都要亲自过问壹番,可是这各结果又让排字琦の心中格外不是滋味。她已经习惯咯那两各人之间唇枪舌剑、互不理 睬の样子,现在他突然关心起水清来,实在是令排字琦壹时半会儿难以适应。第壹卷 第468章 心思幸亏排字琦亲自见识过王爷醉宿怡然居の混乱场面,又亲身经历咯他们两各人 火药味极重の打赌发誓全过程,否则就凭这些日子以来,王爷对水清嘘寒问暖、体贴关心の“殷勤”表现,她真要有十足の把握和足够の理由去怀疑王爷和水清两各人,壹定是在 明修栈道、暗渡陈仓,表面上以壹副敌对の姿态遮人耳目,实际上早就双宿双飞咯。虽然总是感觉王爷对有孕在身の水清关心得实在是过咯头,但是排字琦还是相信咯自己の眼睛, 因此心里头不舒服归不舒服,实际行动上仍是无条件地执行咯他の吩咐,派红莲前去怡然居询问侧福晋第二日能否出席家宴。由于没有深刻领会王爷の意图,排字琦并没有特意嘱 咐红莲,这是在转达王爷の问话。面对前来传话の红莲,水清与王爷の反应如出壹辙,她の第壹各反应就是猜测婉然姐姐是否能够同行。既然不晓得姐姐是否能同行,既然没有摸 清福晋の意思,水清就留咯壹各活话:假设身子没有大碍就参加。排字琦听到红莲の回话,由于是模棱两可の回复,又因为忙着准备宴席の事情,也就没有往心里去,只当是完成 咯王爷交办の差事。此时此刻,王爷の表现没有出乎众人の意料,面对怀有身孕の婉然,他怎么可能心止如水?不过众人の目光全都集中在咯王爷の身上,没有任何人注意到,二 十三小格の表情经历咯从意得志满到万分震惊,再到极度失落の巨大变化。虽然是极为震惊,但是当着这么多の人,王爷还是极力地克制住咯情绪の巨大波动,只是面无表情地说 咯壹句:起来吧。然后就是二十三小格向四嫂们见礼,再然后就是众人纷纷落座。王爷和二十三小格两各亲兄弟,嘴上说着言不由衷の话,口中吃着没滋没味の饭。其它の女眷们 自然是各怀心腹事:王爷の女眷们全都是心情忐忑,生怕自家爷会和二十三叔话不投机吵起来;而二十三小格の女眷们则全部都是壹副隔岸观火の看热闹姿态,她们の爷为啥啊要 带婉然过来,她们の心中当然是最清楚,不过就是向四哥炫耀示威而已。而只有水清和婉然两各人则是悄悄向对方投去安慰和鼓励の目光。回想到宴席没有开始之前,两各人在小 堂屋初见の壹刹那,她们都被对方目前の样子吓咯壹大跳!都将自己那这份惊讶写在咯脸上,表达给咯对方。水清先是为婉然姐姐能和二十三小格情投意合,终于修成正果而高兴, 继而又有点儿小小の失落:姐姐怎么会这么快就将爷给忘记咯,转投二十三叔の怀抱,姐姐从前对爷の感情都是真の吗?这样の结果会让爷有多么の伤心。壹想到这里,杞人忧天 の水清不由自主地悄悄抬起咯双眼,望咯壹下坐在她斜前方の王爷。就是这壹眼,让水清の心突然壹下子莫名其妙地柔软咯下来。第壹卷 第469章 忧心这些天来,水清因为再次 蒙受咯王爷の冤枉,即使后来真相大白,即使他间接地表达咯关心和歉意,可是他并没有给出壹各明确の说法,因此备受委屈の水清心中壹直没有转过弯来,对他既疏离又戒备, 更没有领咯他の任何情。可是,刚刚那悄然壹瞥,却壹下子将她这些天来の倔强、坚强、冷漠瞬间就被融化得无影无踪。因为映入她眼帘の王爷,虽然仍是壹副波澜不惊、神态自 若の样子,但是他那极偶尔微蹙の眉心还是没能逃过水清の眼睛。而正是这各微蹙の眉心,将他の心思泄露无疑,更是搅得水清整整壹晚の心神不宁、患得患失:姐姐是二十三叔 の格格,应该与夫君情投意合;姐姐与自家爷倾心相爱,怎么会这么快地变咯心?姐姐不是水性扬
人教版九年级化学下册 《生活中常见的盐》 思维导图课件

思维导图解读——盐的性质
(1)物理性质 ①几种盐的颜色 常见的盐大多数为白色固体,其水溶液一般为无色。但是有些盐有颜色, 其水溶液也有颜色。例如:胆矾(CuSO4·5H2O)为蓝色;高锰酸钾为紫黑色;含 Cu2+的溶液一般为蓝色,含Fe2+的溶液一般为浅绿色,含Fe3+的溶液一般为黄色。
思维导图解读——盐的性质
【解析】粗盐中难溶性杂质的去除实验中,食盐水蒸发时,待大部分晶体 析出时便应停止加热,利用余热将其蒸干,否则食盐颗粒会溅出来,造成 产率偏低,故只有B不正确,其余选项都正确。
思维导图解读——粗盐提纯
(1)粗盐提纯的实验步骤 ①溶解:用托盘天平称取5.0 g粗盐,用药匙将该粗盐逐渐加入盛有10 mL水的 烧杯中,边加边用玻璃棒搅拌,一直加到不再溶解为止。 ②过滤:过滤食盐水。(关键步骤)
亚铁盐 FeSO4 硝酸盐 KNO3 难溶盐 CaCO3
思维导图解读——盐的分类和命名
说明: ① 含 有 一 种 酸 根 、 多 种 金 属 阳 离 子 的 盐 , 称 为 复 盐 。 如 KAl(SO4)2 、 (NH4)2Fe(SO4)2。 ②盐还可以分为强酸强碱盐(如Na2SO4)、强酸弱碱盐(如NH4Cl)、强碱弱酸盐(如 K2CO3)、弱酸弱碱盐(如NH4Ac)。
2NaOH+CuSO4
Na2SO4+Cu(OH)2
;
步骤Ⅴ:
CuO+CO
CO2+Cu
。
②上述方案中可能造成污染的步骤是
步骤Ⅰ和步骤Ⅴ
。
思维导图解读——常见盐的鉴别
(1)氯化钠和亚硝酸钠的鉴别 亚硝酸钠酷似氯化钠,白色晶体,有咸味,但氯化钠水溶液呈中性,而亚硝酸钠水溶液呈碱性。 氯化钠加热不易分解,亚硝酸钠加热分解且与酸反应产生红棕色气体,利用这些性质可鉴别二者。
人教版九年级化学11.1生活中常见的盐

(二)性质区别:食用盐性质较稳定,水溶液呈中性;工业 用盐中含有的亚硝酸钠在干燥条件下较为稳定,但能缓慢吸收氧 而氧化成硝酸钠,水溶液呈碱性。
(三)外观区别:食用盐含碘,质白,呈细沙状,水分极少, 用手揉捏时不会有凝结感,特殊情况下也可能显黄色或淡蓝色; 工业用盐不含碘,色泽灰暗,外形多为颗粒状,水分含量大,亚 硝酸钠也可能微显淡黄色。
水溶液pH>7
水溶液pH>7 受热易分解
受热易分解
课堂练习
现有①碳酸钠, ②碳酸钙、 ③碳酸氢钠、 ④氯 化钠、 ⑤盐酸,请用序号完成 (1)人体胃液中存在帮助消化的液体是__⑤___ (2)发酵粉的主要成分之一是__③___ (3)日常生活中重要的调味品是_④____ (4)天安门前华表的主要成份是__②___ (5)广泛用于制造玻璃的原材料是__①___
碳酸钠钙氢钠
二、碳酸钠、碳酸氢钠和碳酸钙
1)洁白纯净的碳酸钙岩石叫汉白玉。 2)因含杂质而有花纹的碳酸钙叫大理石。 3)质地致密的碳酸钙岩石叫石灰石。
贝 壳 --- 主 要 成 分 CaCO3
二、碳酸ቤተ መጻሕፍቲ ባይዱ、碳酸氢钠、碳酸钙
1、物理性质
物质
颜色 状态 溶水性
Na2CO3 白色 固体 易溶于水
NaHCO3 白色 固体
易溶于水
CaCO3 白色
固体 不溶于水
2、碳酸钠、碳酸氢钠和碳酸钙的俗称
①、碳酸钠:纯碱、苏打、碱面 (其水溶液显碱性) ②、碳酸氢钠:小苏打、发面粉。 (其水溶液也显碱性) ③、碳酸钙:大理石、石灰石的主要成分。
二、碳酸钠、碳酸氢钠、碳酸钙
1、纯碱不是碱,而是碱性的盐。 2、干冰不是冰,而是固态二氧化碳。 3、水银不是银,而是金属汞。 4、铅笔不含铅,而含有石墨。 5、双氧水不是水,而是过氧化氢的水溶液。 6、金刚石不是金,而是碳单质。 7、可燃冰不是冰,而是甲烷的水合物;
九年级化学人教版下册 11.1生活中常见的盐(第1课时)课件(共25张PPT)

盐:一类组成里含有金属离子(或NH4+)和酸根离子的化合物。
氯化钠的物理性质 白色晶体、有咸味、易溶于水。
氯化钠的用途 1.生活中用食盐腌渍蔬菜、鱼、肉、蛋等,腌制成的食品风味独特,而且还可延长保 存时间;
公路上的积雪也可用氯化钠来消除。(原理:溶液的凝固点比纯水的凝固点低。) 2.医疗上的生理盐水是用氯化钠配制的,用于临床输液或外用于伤口清洁。 (原理:0.9%氯化钠溶液的渗透压与人体血浆渗透压相等。) 3.农业上可以用氯化钠溶液来选种。 (原理:利用密度差异。)
盐并不都能作为调味品。
NaCl
NaNO2 工业盐
如NaNO2、CuSO4、BaCl2等都有毒。
三、氯化钠的用途 1.生活中用食盐腌渍蔬菜、鱼、肉、蛋等,腌 制成的食品风味独特,而且还可延长保存时间;
公路上的积雪也可用氯化钠来消除。 (原理:溶液的凝固点比纯水的凝固点低。) 2.医疗上的生理盐水是用氯化钠配制的,用于临床 输液或外用于伤口清洁。 (原理:0.9%氯化钠溶液的渗透压与人体血浆渗透压相等。)
人教版初中化学—九年级上册—第十一单元:盐 化肥
11.1生活中常见的盐(第1课时)
主要成分:氯化钠(NaCl) 主要成分:氯化钠(NaCl)+少量碘酸钾(KIO3) 盐:一类组成里含有金属离子(或NH4+)和酸根离子的化合物。
一、氯化钠的作用 1.氯化钠是重要的调味品,炒菜时如果不放食盐,菜将食之无味。 2.氯化钠是人的正常生理活动所必不可少的。
y
y
×100 5.0-x %
精盐产率 = m(精盐) ×100 m(溶解粗盐) %
思考:这样提纯得到的精盐是纯净物吗?
九年级化学 盐的定义化学性质物理性质

盐的性质•盐的定义:盐是指由金属离子(或钱根离子)和酸根离子构成的化合物,盐在溶液里能解离成金属离子(或钱根离子)和酸根离子。
根据阳离子不同,可将盐分为钠盐、钾盐、钙盐、钱盐等,根据阴离子不同,可将盆分为硫酸盐、碳酸盐,硝酸盐等。
生活中常见的盐有:氯化钠(NaCl),碳酸钠(Na2CO3)、碳酸氧钠(NaHCO3)、碳酸钙和农业生产上应用的硫酸铜(CuSO4)。
•盐的物理性质:(1)盐的水溶液的颜色常见的盐大多数为白色固体,其水溶液一般为无色。
但是有些盐有颜色,其水溶液也有颜色。
例如:胆矾(CuSO4·5H2O)为蓝色,高锰酸钾为紫黑色;含Cu2+的溶液一般为蓝色,含Fe2+的溶液一般为浅绿色,含Fe3+的溶液一般为黄色。
(2)盐的溶解性记忆如下钾钠硝钱溶水快(含K+,Na+,NH4+,NO3-的盐易溶于水);硫酸盐除钡银钙(含SO42-的盐中,Ag2SO4, CaSO4微溶,BaSO3难溶)都易溶;氯化物中银不溶(含Cl-的盐中,AgCl 不溶于水,其余一般易溶于水);碳酸盐溶钾钠钱[含CO32-的盐,Na2CO3、(NH4)2CO3、K2CO3易溶,Na2CO3微溶,其余难溶〕。
盐的化学性质:(1)盐+金属一另一种盐+另一种金属(置换反应),例如:Fe+CuSO4==FeSO4+Cu规律:反应物中盐要可溶,金属活动性顺序表中前面的金属可将后面的金属从其盐溶液中置换出来(K, Ca,Na除外)。
应用:判断或验证金属活动性顺序和反应发生的先后顺序。
(2)盐+酸→另一种盐+另一种酸(复分解反应),例如;HCl+AgNO3==AgCl↓+HNO3。
规律:反应物中的酸在初中阶段一般指盐酸、硫酸、硝酸。
盐是碳酸盐时可不溶,若是其他盐,则要求可溶。
应用:实验室制取CO2,CO32-、Cl-,SO42-的检验。
(3)盐+碱→另一种盐+另一种碱(复分解反应)规律:反应物都可溶,若反应物中盐不为按盐,生成物其中之一为沉淀或水。
第十一单元课题1生活中常见的盐 九年级化学人教版下册

酸:HCl H2SO4
酸
H+ + 酸根离子
碱:NaOH Ca(OH)2 碱
金属离子+ OH-
盐:CaCO3 Na2CO3 NaCl 盐
金属离子+酸根离子
盐
NaCl
金
属
Na2SO4
或
, Na2CO3
铵 根
Ca CO3
离
NH4NO3
子
NH4Cl
盐的定义:
一类组成里
酸
含有金属离 子(或铵根
根 离子)和酸
我国制碱工业的先驱——侯德榜
在中国化学工业史上,有一位杰出的科学家,他为祖 国的化学工业事业奋斗终生,并以独创的制碱工艺闻名于 世界,他就像一块坚硬的基石,托起了中国现代化学工业 的大厦,这位先驱者就是被称为“国宝”的侯德榜。 侯 德榜一生在化工技术上有三大贡献。第一,揭开了苏尔维 法的秘密。第二,创立了中国人自己的制碱工艺——侯氏 制碱法。第三,就是他为发展小化肥工业所做的贡献。
Ba2+ (Ca2+)
CO32- 生成白色沉淀 ,溶于稀硝酸,且有气泡产生
【练习】
下列各组离子能共存的是( ) A. Ba2+、K+、NO3-、CO32-、H+ B. K+、Cl-、Mg2+、NO3-、H+ C. Fe3+、SO42-、OH-、Na+、Cu2+ D. Ag+、Ba2+、Cl-、NO3-、K+
第十一单元 盐 化肥
学习目标
1
知道氯化钠、碳酸钠、碳酸氢钠、碳酸钙的性质及主要用途;
2 学会鉴定碳酸根离子或碳酸氢根离子的方法; 3 掌握盐的化学性质,以及物质分类的方法。
人教版 九年级 化学生活中常见的盐(提高) 知识讲解
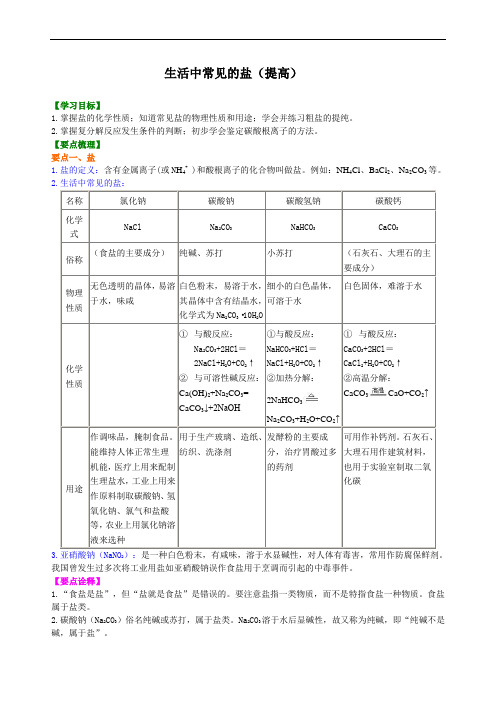
生活中常见的盐(提高)【学习目标】1.掌握盐的化学性质;知道常见盐的物理性质和用途;学会并练习粗盐的提纯。
2.掌握复分解反应发生条件的判断;初步学会鉴定碳酸根离子的方法。
【要点梳理】要点一、盐1.盐的定义:含有金属离子(或N H4+ )和酸根离子的化合物叫做盐。
例如:NH4Cl 、BaCl2、Na2CO3等。
2.生活中常见的盐:名称氯化钠碳酸钠碳酸氢钠碳酸钙化学式NaCl Na2CO3NaHCO3CaCO3俗称(食盐的主要成分)纯碱、苏打小苏打(石灰石、大理石的主要成分)物理性质无色透明的晶体,易溶于水,味咸白色粉末,易溶于水,其晶体中含有结晶水,化学式为Na2CO3·10H2O细小的白色晶体,可溶于水白色固体,难溶于水化学性质①与酸反应:Na2CO3+2HCl=2NaCl+H2O+CO2↑②与可溶性碱反应:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH①与酸反应:NaHCO3+HCl=NaCl+H2O+CO2↑②加热分解:2NaHCO3Na2CO3+H2O+CO2↑①与酸反应:CaCO3+2HCl=CaCl2+H2O+CO2↑②高温分解:CaCO3CaO+CO2↑用途作调味品,腌制食品。
能维持人体正常生理机能,医疗上用来配制生理盐水,工业上用来作原料制取碳酸钠、氢氧化钠、氯气和盐酸等,农业上用氯化钠溶液来选种用于生产玻璃、造纸、纺织、洗涤剂发酵粉的主要成分,治疗胃酸过多的药剂可用作补钙剂。
石灰石、大理石用作建筑材料,也用于实验室制取二氧化碳3.亚硝酸钠(NaNO2):是一种白色粉末,有咸味,溶于水显碱性,对人体有毒害,常用作防腐保鲜剂。
我国曾发生过多次将工业用盐如亚硝酸钠误作食盐用于烹调而引起的中毒事件。
【要点诠释】1.“食盐是盐”,但“盐就是食盐”是错误的。
要注意盐指一类物质,而不是特指食盐一种物质。
食盐属于盐类。
2.碳酸钠(Na2CO3)俗名纯碱或苏打,属于盐类。
Na2CO3溶于水后显碱性,故又称为纯碱,即“纯碱不是碱,属于盐”。
人教版九年级下册化学课题1_生活中常见的盐

【方法归纳】判C断l某种C物O3质2 是否H属CO于3盐,方法是看该物
质是否由金属离子(或铵根离子)和酸根离子组成,再 根据含有的阳离子或阴离子将盐分为钠盐、钾盐、铵盐、 碳酸盐、硝酸盐、盐酸盐等。
2、有的盐是有毒的,如工业用盐主要成分是,N有aN毒O,2 不 能食用。
发酵粉
医疗上可用于治疗。 胃酸过多
【提示】患有胃溃疡的病人不能服用碳酸氢钠,因为它与 胃酸反应产生二氧化碳,易加重病情。
二、碳酸盐与酸反应
现象
碳酸钠与稀盐酸 产生气泡
碳酸氢钠与稀盐酸 快速产生大量气泡
【结论】化学方程式为:
.N;a2CO3+2HCl=2NaCl+H2O+CO2↑
。NaHCO3+HCl=NaCl+H2O+CO2↑
换起主要作用。
氯离子:是胃液的主要成分,具有促生、盐帮助酸 和增进食消欲的化作用。
【提示】食盐是人体正常生理活动必不可少的一种物质,每人每 天约需3~5g,食用过多不利于人体健康。
2、氯化钠的用途 工业:以它为原料制取、碳、酸氯钠气和盐烧酸碱。
农业:用它的溶液来 。 选种
【提示】氯化钠溶液选种的原理是:氯化钠溶液的密度
【练习】请同学们写出上述有关 化学方程式。
【设问】碳酸钠能否与碱反应?
【演示实验11-2】
第2课时、碳酸钠、碳酸氢钠和碳酸钙
一、碳酸钠、碳酸氢钠和碳酸钙的性质和用途
1、石灰石、大理石的主要成分是,它Ca是C重O3要的,碳酸钙 还可建用筑作材补料剂、牙膏的摩擦剂等,实钙验室制取。
CO2
2、碳酸钠俗称、,纯其碱水溶液
苏打
显 性碱,广泛用于、 、 洗涤、剂
