原子核外电子排布与元素周期表
原子核外电子排布与元素周期律

原子核外电子排布与元素周期律一、核外电子的排布规律⑴核外电子运动的特征:质量小,运动空间小,运动速度快,没有确定的轨道。
(2)电子云:电子在核外空间作高速运动,没有确定的轨迹,好象带负电荷的云雾笼罩在原子核的周围,人们形象地称之为电子云。
(3)电子层:根据电子的能量差别和通常运动区域离核的远近不同,核外电子处于不同的电子层。
(4)电子层排布倾向能量最低:核外电子总是尽先排布在能量最低的电子层里,然后由里往外,依次排布在能量逐步升高的电子层里。
(5)各电子层容纳的电子数:各电子层最多容纳的电子数是2n 2个,最外层电子数不超过8个(K 层不超过2个),次外层电子数不超过18个,倒数第三层不超过32个。
(6)电子层排布的表示方法:原子结构示意图1、排布规律⑴核外电子排布与能量关系电子离核距离: 近 → 远 电子能量: 低 → 高 ⑵核外电子的分层排布 ① 核外电子层能量不同 电子层离核距离: 近 → 远 电子能量: 低 → 高电子层数(n ): 1 (K) 2(L) 3 (M) 4 (N) 5 (O)② 电子排布规律Ⅰ 能量最低原理:先排满低能量电子层,再依次排布在能量较高的电子层中。
Ⅱ 各电子层最多容纳的电子数:2n 2 Ⅲ 最外层电子数≤8 Ⅳ 次外层电子数≤18 Ⅴ 倒数第三层电子数≤32注意:以上三条规律不是孤立的,而是相互制约,必须同时满足。
2、常见元素微粒结构特点稀有气体元素原子的电子层结构与同周期的非金属元素的阴离子的电子层结构相同,与下一周期的金属元素形成的阳离子的电子层结构相同。
如:(1)核外有2个电子微粒(与He 原子电子层结构相同的离子):H -、Li +、Be 2+ (2)核外有10个电子微粒(与Ne 原子电子层结构相同的微粒):阳离子:+Na 、+2Mg 、+3Al 、+4NH 、+O H 3;阴离子:N -3、O -2、F -、OH -、NH -2;分子:Ne 、HF 、H 2O 、NH 3、CH 4(3)核外有18个电子微粒(与Ar 原子电子层结构相同的微粒):离子:Cl -、S 2-、P 3-、K +、Ca 2+ 分子:Ar 、HCl 、H 2S 、SiH 4、H 2O 2、PH 3、C 2H 6 (4)前18号元素的原子构的特殊性○111 H ○2最外层有1个电子的元素:H 、Li 、Na ○3最外层有2个电子的元素:Be 、Mg 、He ○4最外层电子数等于次外层电子数的元素:Be 、Al 。
知识点 原子核外电子排布与元素周期律

原子核外电子排布与元素周期律一、原子结构(Z 个)原子核注意:(N 个) 质量数(A)=质子数(Z)+中子数(N)1.X 原子序数= = =核外电子(Z 个)2.原子核外电子的排布规律:①电子总是尽先排布在能量 的电子层里;②各电子层最多容纳的电子数是 ;③最外层电子数不超过 个(K 层为最外层不超过 个),次外层不超过 个,倒数第三层电子数不超过 个。
电子层: 一(能量最低) 二 三 四 五 六 七 对应表示符号: 3.元素、核素、同位素元素: 。
核素: 。
同位素: 。
(对于原子来说) 二、元素周期表 1.编排原则:①按 递增的顺序从左到右排列 ②将 相同..的各元素从左到右排成一横行..。
(周期序数=原子的电子层数) ③把 相同..的元素按电子层数递增的顺序从上到下排成一纵行..。
=原子最外层电子数 2.结构特点:核外电子层数 元素种类第一周期 种元素短周期 第二周期 种元素周期 第三周期 种元素元 (7个横行) 第四周期 种元素 素 (7个周期) 第五周期 种元素 周 长周期 第六周期 种元素 期 第七周期 未填满(已有 种元素) 表 主族:ⅠA ~ⅦA 共7个主族族 副族:ⅢB ~ⅦB 、ⅠB ~ⅡB ,共7个副族 (18个纵行) 第Ⅷ族: 纵行,位于 之间 (16个族) 零族: ① 主族(A ):由 和 元素共同组成的族(除第18纵列)列序与主族序数的关系② 副族(B ):完全由 元素组成的族(第8、9、10纵列除外)③ Ⅷ族:包括 三个纵列。
④ 0族:第 纵列,该族元素又称为 元素。
三、元素周期律1.元素周期律: 。
元素性质的周期性变化实质是... 。
族碱金属元素: ( 是金属性最强的元素,位于周期表 ) 第ⅦA 族卤族元素: ( 是非金属性最强的元素,位于周期表 ) ★判断元素金属性和非金属性强弱的方法:(1)金属性强(弱)——① ;② ;③ 。
(2)非金属性强(弱)——① ;② ;③ 。
122核外电子排布与元素周期表、原子半径
主
知
题 C.R和M原子的最外层电子数之和为8
能
探
巩
究 D.R和M原子的最外层电子数之差为7
固
导
提
学
升
目 【解析】选A。本题考查“周期表→原子序数→电子
录
课 数→阴阳离子相差8个电子”。假设Ⅰ:阴离子比阳离
巩 固
导
学 考虑第3周期,最外层未成对电子数为3的是P
提 升
(1s22s22p63s23p3)。
目
录
名
课
6.下列微粒半径大小比较正确的是( )
师
程
教
目
A.r(Na+)<r(Mg2+)<r(Al3+)<r(O2-)
学
标
积
设 置
B.r(S2-)>r(Cl-)>r(Na+)>r(Al3+)
累
主
C.r(Na)<r(Mg)<r(Al)<r(Si)
积
设
累
置 于核电荷数,则r(S2-)>r(Cl-)、r(Na+)> r
主
知
题 (Al3+),而F-与Na+核外电子排布相同且Na+核电荷
能
探
巩
究 导
数比F-大,故r(F-)>r(Na+),而r(Cl-)>r(F-),
固 提
学 故上述离子半径大小顺序为r(S2-)>r(Cl-)>r(F-) 升
>r(Na+)>r(Al3+),故B正确;选项C中,四种原
录 名
课
师
程
教
核外电子的排布规律和元素周期表

(1)基态原子的价层电子构型
价层——价电子所在的亚层 价层电子构型——指价层的电子分布式
ⅠA
0
一 1 ⅡA
1s1
ⅢA ⅣA ⅤA ⅥA ⅦA 2 1s2
二3 4
5 6 7 8 9 10
三 11 12 ⅢBⅣBⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB 13 14 15 16 17 18
几率峰出现, 相当于电子靠近核, 受核 作用强, 同时回避了内层电子的屏蔽作 用, 自身能量下降. 这种效应称为钻穿 效应。
可以用钻穿效应解释能级分裂, 即同一
能级组(n 相同), l 大的电子能量高,
l 小的电子可以钻入内部, 自身能量降 低, 产生能级分裂。总之, 屏蔽效应使 电子的能量上升, 钻穿效应使电子能降 低。
原子实——原子中除去最高能级组以外 的原子实体
三、元素周期律与核外电子排布的关系
最后一个电子填入s亚层
ⅠA
1、分区
0
一
二 三
1131S最Ⅱ142A后Ⅲ一B Ⅳ个BⅤ电B Ⅵ子B一ⅦB般填Ⅷ入次Ⅰ外BⅡ层BⅢd153A亚Ⅳ164层AⅤ175ApⅥ186AⅦ197A
2
10 18
四 19
20
21
22 23
(6) 当被屏蔽电子是(nd)组或(nf)组电子
时,同组电子屏蔽为0.35,左边各组电子 屏为1.00。 在计算某原子中某个电子的值时,可将有关 屏蔽电子对该电子的值相加而得。 例:计算铝原子中其它电子对一个3P电子的 值,其Z* =? 解:按斯来特规则分组 (1S)2(2S,2P)8( 3S,3P)3
= 0.35×2 + 0.85 ×8 + 1.00 ×2 = 9.50 Z* = Z – = 13–9.50 = 3.5
核外电子排布与元素周期表

P S 110 104
K 227
Rb 248 Cs 265
Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As 197 161 145 132 125 124 124 125 125 128 133 122 122 121
Se 117
Br 114Байду номын сангаас
Kr 198
Xe 217
Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I 215 181 160 143 136 136 133 135 138 144 149 163 141 141 137 133 Ba La Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po 217 188 159 143 137 137 134 136 136 144 160 170 175 155 153
Au
Hg Tl
[Xe]4f145d106s1
[Xe]4f145d106s2 [Xe]4f145d106s26p1
82
83 84
Pb
Bi Po
[Xe]4f145d106s26p2
[Xe]4f145d106s26p3 [Xe]4f145d106s26p4
85
86
At
Rn
[Xe]4f145d106s26p5
(四)
31
32 33 34 35 36
Ga
Ce As Se Br Kr
[Ar]3d104s24p1
[Ar]3d104s24p2 [Ar]3d104s24p3 [Ar]3d104s24p4 [Ar]3dl04s24p5 [Ar]3d104s24p6
37 38 39 40
原子核外电子排布1-109
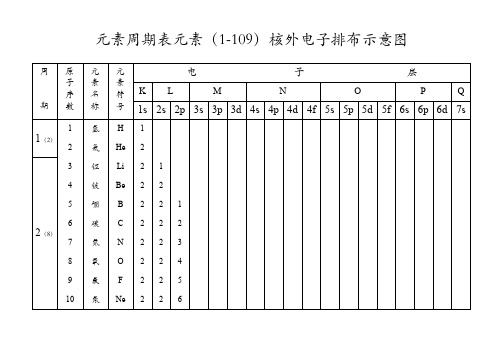
10 10 10 10 10 10 10 10 10 10 10 10 10
2 2 2 2 2 2 2 2 2 2 2 2 2
6 6 6 6 6 6 6 6 6 6 6 6 6
5 5 7 8 10 10 10 10 10 10 10 10 10
1 2 1 1
1 2 2 2 2 2 2 2 1 2 3 4 5 6
6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6
10 10 10 10 10 10 10 10 10 10 10 10 10 10 10 10
11 12 13 14 14 14 14 14 14 14 14 14 14 14 14 14
2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2
锕 钍 镤 铀 镎 钚
7 (23)
90 91 92 93 94
95 96 97 98 99 100 101 102 103 104
镅 锔 锫 鐦 锿 鐨 鍆 锘 铹
Am Cm Bk Cf Es Fm Md No Lr Rf Ha Unh Uns Uno Une
2 2 2 2 2 2 2 2 2 2 2 2 2 2 2
2 2 2 2 2 2 2 2 2 2 6 6 6 6 6 2 2 2 2 2 6 6 6 6 6 10 10 10 10 10 2 2 2 2 2 6 6 6 6 6 1 2 4 1 2 2 2 1
5 (18)
39 40 41
钇 锆 铌
42 43 44 45 46 47 48
鉬 锝 钌 铑 钯 银 铬
10 10 10 10 10 10 10
2 2 2 2 2 2 2 1 2 3 4 5 6
周
期
原 子 序 数
核外电子排布-元素周期表

碱金属
碱土金属 氧族元素
卤族 元素
练一练
3.原子序数为x的元素位于元素周期表中 的第ⅡA 族,则原子序数为x+1的元素位 于元素周期表的哪一族?
2020年5月23日
元素的“位—构”关系
以钠为例:
第3周期
ⅠA 族
1.书写原子 2.周期序数= 3.族序号=最 结构示意图 电子层数 外层电子数
2020年5月23日
练一练
4.指出Br在周期表中的位置 Br:第4周期 ⅦA族
5.某元素位于第二周期,第ⅦA 族,它 是_氟__元素。
2020年5月23日
其 它 周 期 表
其它周期表
其 它 周 期 表
门捷列夫
▪ 从学生时代开始,门捷列夫就一直对“元素”与
梦中的景象 “元素”之间可能存在的种种关联感兴趣,并且 利用一切时间对化学元素进行研究。
不过是十五 • 一天清晨,门捷列夫经过一个夜晚的研究后,疲 倦地躺在书房的沙发上,不知不觉就睡着了。睡
年来的努力! 梦中,他突然清晰地看见元素排列成周期表浮现 在他的眼前,他又惊又喜,随即清醒过来,顺手 记下梦中的元素周期表。 • 因为在梦中得到灵感,元素周期表的发现又被称 为四大名梦之一。
能量由低到高。 每层最多容纳2n2个电子。 最外层电子数都不超过8个(K层不超过2个)。1.下图所画的原子结构示意图正确的是( )
A.
B.
C.
D.
2.某元素有三个电子层,其最外层电子数是次 外层的一半,此元素是( ) A. S B. C C. Si D. Cl
1.什么是原子? 2.原子是由什么微粒构成的?
2020年5月23日
文 字
图
示 +8 2 6
专题02 核外电子排布与元素周期表(解析版)

2021-2022学年高二化学重难点专题突破模块一原子结构与性质专题02 核外电子排布与元素周期表一、选择题1. 已知某元素+3价离子的电子排布式为1s22s22p63s23p63d5,该元素在周期表中的位置是()A.第3周期Ⅷ族,p区B.第3周期ⅤB族,ds区C.第4周期Ⅷ族,d区D.第4周期Ⅴ族,f区【答案】C【解析】+3价离子的核外有23个电子,则对应的原子核外有26个电子,26号元素是铁,位于元素周期表中第4周期Ⅷ族,位于d区。
2. 元素周期表中有如图所示的元素,下列叙述正确的是()A.钛元素原子的M层上共有10个电子B.钛元素是ds区的过渡元素C.钛元素原子最外层上有4个电子D.47.87是钛原子的近似相对原子质量【答案】A【解析】钛元素原子的M层为第三层,M层电子排布式为3s23p63d2,共有10个电子,A正确;钛元素是d区元素,B错误;钛元素原子最外层电子排布式为4s2,有2个电子,C错误;47.87是钛元素的相对原子质量,D错误。
3. 某基态原子的价电子排布式为4d15s2,则下列说法正确的是()A.该元素原子最外层共有3个电子B.该元素位于第5周期ⅡA族,处于ds区C.该元素原子的M层上共有18个运动状态不同的电子D.该元素原子的N层上有5个空轨道【答案】C【解析】由价电子排布式为4d15s2可知,该元素应位于第5周期ⅢB族,该元素原子中共有39个电子,分5个电子层,其中M层上有18个电子,最外层上有2个电子,故A错误;该元素位于第5周期ⅢB族,处于d区,故B 错误;该元素基态原子的电子排布式为1s22s22p63s23p63d104s24p64d15s2,M能层上有18个电子,故C正确;该元素原子的N层的电子排布为4s24p64d1,4d轨道有4个空轨道,故D错误。
4.主族元素A和B可形成组成为AB2的离子化合物,则A、B两原子的最外层电子排布分别为()A.n s2n p2和n s2n p4B.n s2和n s2n p4C.n s2和n s2n p5D.n s2和n s【答案】选C。
第1讲 核外电子排布与元素周期表

规律:
①能量顺序按照1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4 5d 6p 7s…… • 能量由低到高 • 即按照ns (n-2)f (n-1)d np顺序排列 ②能量高低1s<2s<3s …… 2p<3p<4p…… ns<np<nd<nf
• 17
Cl的电子排布是1s22s22p63s23p5; 若写为1s12s22p63s23p6则违背了能量 最低原理
↑
↑
轨道表示法
三、原子结构与元素周期表
• 1、 鲍林近似能级图与周期表的关系: 能级组 周期 元素种数
7 6 5 4 3 2 32 32 18 18 8 8
1
2
多电子原子轨道的能级 近似能级图
P 6s O 5s 6p 4f 5p 5p 4d 4d 5s 5-3-2 多电子原子轨道的能级 4p 4p 3d 3d K<L<M<N<O<P 1. 能级 4s 3p 3p 2. 同一电子层: 3s Ens< Enp< End< Enf 2p 2p 3. 同一原子,不同电子 2s 1s 5d
+17 +17
2 8 7
2 8 8
(2)电子排布式:
• 在能级符号的右上方用数字表示该能 级上排布的电子数的式子。 实例: 氯:1s22s22p63s23p5 钪:1s22s22p63s23p63d14s2 (注:ns2 表示该原子核外的n能层数 的s能级有两个电子)
• 为避免电子结构过长,通常把内层 已达到稀有气体的电子层写成“原 子芯”(原子实),并以稀有气体 符号加方括号表示
实例: 氯: [Ne]3s23p5 1 2 钪: [Ar] 3d 4s
核外电子排布与元素周期表_图文

Zr
[Kr)4d25s2
Nb
[Kr]4d45sl
Mo
[Kr]4d55s1
Tc
[Kr]4d55s2
Ru
[Kr]4d75s1
Rh
[Kr]4d85sl
Pd
[Kr]4d10
Ag
[Kr]4d105s1
Cd
[Kr]4d105s2
In
[Kr]4d105s25p1
Sn
[Kr]4d105s25p2
Sb
[Kr]4d105s25p3
Ru Rh 13 13 35
Pd 13 8
Ag 14 4
Cd 14 9
In 16 3
Sn 14 1
Sb 14 1
Te 13 7
I 13 3
Xe 217
Cs 265
Ba 21 7
La 18 8
Hf 15 9
Ta 14 3
W 13 7
Re Os 13 13 74
Ir 13 6
Pt 13 6
Au 14 4
元素
(有个别例外) (内过渡元素)
三、元素周期律:
H 37
-
He 122
Li 152
Be 11 1
-
B C N O F Ne 88 77 70 66 64 160
Na 186
Mg 16 0
-
Al 14 3
Si 11 7
P 11 0
S 10 4
Cl Ar 99 191
K 227
Ca 19 7
Sc 16 1
最后填入电子的 亚层
包括的元素
s
ns1→2
最外层的s亚层 ⅠA族,ⅡA族
p
ns2np1→6
原子核外电子排布的周期性

一、元素周期律
元素的性质随着核电荷数递增发生周期 性的递变,称为元素周期律;元素周期律 变化是元素原子的核外电子排布周期性变 化的必然结果,也就是说,由于原子结构 上的周期性变化,引起了元素性质上的周 期性变化。
回顾
随着原子序数的递增 元素原子的核外电子排布 元素原子半径 元素主要化合价 元素金属性和非金属性的周期性变化
8 2S22p1 -5 2S22p6
3 8 3S1-2
8 3S23p1 -5 3S23p6
4 18 18 4S1-2 3d1-94s1- 2 3d104s1- 4S24p1 -5 4S24p6 2
5 18 18 5S1-2 4d1-95s1- 2 4d105s1- 5S25p1 -5 5S25p6 2
主族 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
原子核外价电
子 排布 (外围电子) ns1 ns2 ns2np1 ns2np2 ns2np3 ns2np4 ns2np5
最高正价 +1 +2 +3 +4 +5 +6 +7
最低负价
-4 -3 -2 -1
化合价变化 最高正价:+1→+7;最低负价:-4→-1
6 32 6S1-2
4f1-14 5d0-2 6S2
32 5d106s1- 6S26p1 -5 6S26p6 2
第四周期过渡元素核外电子排布
原子 序数
21 22 23 24 25 26 27 28
29
30
符号 Sc Ti V Cr Mn Fe Co Ni Cu Zn
外围 电子 排布
3d1 3d2 3d3 3d5 3d5 3d6 3d7 3d8 3d10 3d10 4s2 4s2 4s2 4s1 4s2 4s2 4s2 4s2 4s1 4s2
原子核外电子排布的周期性(最新)

f区元素
镧系和锕系元素
最后1个电子填充在倒数第三层的f轨道上,
外围电子排布是:(n–2)f0~14(n-1)d0~2ns2,它
包括镧系和锕系元素(各有14种元素)。 由于最外层的电子数基本相同,(n-1)d的电
子数基本相同,因此镧系(锕系)元素的化学性质 非常相近。
小结
各区元素特点
包括元素 价电子排布 化学性质
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
1
非金属性逐渐增强
2 金 Be B
非 金
3
属 性
Al Si
属 性
4
逐 渐
5增
Ge As
逐
渐
Sb Te
增
6
强 金属性逐渐增强
Po At 强
7
元素周期律的具体表现形式
类别 短周期
周期序数 起止元素 所含 元素种数 电子层数
1
H——He
2
1
2
Li——Ne
8
2
3
3、元素性质周期性变化的根本原因是什么?
【小结】 主族
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
原子核外 价电子排布
最高正价 最低负价
ns1 ns2 ns2np1 ns2np2 ns2np3 ns2np4 ns2np5
+1 +2 +3 +4 +5 +6 +7 -4 -3 -2 -1
化合价变化 规律
最高正价:+1→+7;最低负价:-4→-1
Na——Ar
8
3
4
K——Kr
18
4
5
Rb——Xe
18
核外电子排布元素周期表

2020年11月11日
1—18号元素原子结构示意图
周期序数=电子层数
1
族序号=最外层电子数
2
3
2020年11月11日
二、元素周期表
1.编排原则
A 按原子序数的递增顺序从左到右排列
B 将电子层数相同的元素排列成一个横行
C
把最外层电子数相同的元素按电子层数递增 的顺序从上到下排成纵行。
2020年11月11日
2020年11月11日
元素的“位—构”关系
以钠为例:
第3周期
ⅠA 族
1.书写原子 2.周期序数= 3.族序号=最 结构示意图 电子层数 外层电子数
2020年11月11日
练一练
4.指出Br在周期表中的位置 Br:第4周期 ⅦA族
5.某元素位于第二周期,第ⅦA 族,它 是_氟__元素。
2020年11月11日
门捷列夫
梦中的景象 • 从学生时代开始,门捷列夫就一直对“元素”与 “元素”之间可能存在的种种关联感兴趣,并且 利用一切时间对化学元素进行研究。
不过是十五 • 一天清晨,门捷列夫经过一个夜晚的研究后,疲 倦地躺在书房的沙发上,不知不觉就睡着了。睡
年来的努力! 梦中,他突然清晰地看见元素排列成周期表浮现 在他的眼前,他又惊又喜,随即清醒过来,顺手 记下梦中的元素周期表。 • 因为在梦中得到灵感,元素周期表的发现又被称 为四大名梦之一。
2020年11月11日
2种元素 8种元素 8种元素
18种元素 18种元素
32种元素 ……
二、元素周期表的结构
周 期
(横行)
2n2
三长三短一不全
短周期:1~3周期 长周期:4~7周期 不完全周期:第7周期
核外电子排布与元素周期表全面版

2.原子核外电子排布与元素周期表中周期划 分的本质联系
7个能级组 ―分―别→对应―→ 7个周期
能级组最多 容纳电子数
―__等―__于→____―→
本周期所包含 元素的种数
3.周期数与电子层数的关系 周期数=_最__外__层__电__子__的__主__量__子__数___
思考感悟
1.(1)在元素周期表中,同属长周期的4、5、6 周期所包含的元素种类数分别为18、18、32,试 解释原因。 (2)根据鲍林近似能级图知E4s<E3d,试分析21号 元素Sc所在的周期数是多少? 【提示】 (1)据鲍林近似能级图,第4、5周期元 素包含的能级为ns、np、(n-1)d,共有9个原 子轨道,最多容纳18个电子,对应两周期中各18 种元素;
越大
r)
一般电子层数越多, 半径越大
r(S)>r(C)
微粒特点
比较方法
实例
离 子
具有相同 电子层结
构
核电荷数越大, 半径越小
电子数和 核电荷数
均不同
通过电子数或 核电荷数相同 的微粒做参照
物
r(Na+)>r(Mg2 +)>r(Al3+)
r(Al3+)<r(O2 -)<r(S2-)
同种元素的原 子和离子
着电子层数增多原子半径增大,应为 Cs>Rb>K>Na。
探究整合应用
假定元素周期表是有限的,根据已知的元素周期 表的某些事实和理论可归纳出一些假说。 (1)已知元素周期表中的各周期可排元素种数如下:
周期 1 2 3 4 5 6 7 元素种数 2 8 8 18 18 32 32
人们预测元素周期表第8周期将来也会排满,那么
思考感悟 2.(1)是否电子层数多的元素的原子半径一定 大于电子层数小的元素的原子半径? (2)为什么过渡元素的半径同一周期内变化幅度 不大? 【提示】 (1)不一定。原子半径的大小由核电 荷数与电子层数两个因素综合决定,如碱金属 元素的原子半径比它下一周期卤素原子的半径 大。 (2)同一周期过渡元素增加的电子都分布在(n- 1)d轨道上,电子间的排斥作用与核对电子的 吸引作用、Si、Mg
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
二、核外电子排布与元素周期表
1.周期表是依据什么原则建构的?
思考:
2.周期表中,各周期元素种类数为何依次为2,8,8,18,18,32 ,…?
3.为何原子的最外层电子数不超过8个(He不超过2个), 次外层不超过18个,倒数第三层不超过32个?
4.各周期元素的外围电子分别填充在哪些原子轨道中? 5.s区、p区、d区和f区分别在周期表的什么位置?
• 【例题5】对于基态的Fe2+和Fe3+, 1. 写出它们的核外电子排布式。 2. 写出它们简写的离子轨道表示式。
【课后练习】
• 1、对于下列基态原子,填写表中空白:
Ni
Cl
Zr
Pm
核外电子 排布式
简写的电 子排布式
原子轨道 表示式
原子中未 成对电子 数
• 对于下列基态离子填写表中空白:
Cl电子排布式
• 概念:
• 在原子外层轨道上的电子由于能量较高, 因此一般化学反应只涉及外层原子轨道上 的电子,这些电子称为价电子(valence electron)。
应用
根据周期表中各周期元素原子轨道的类型填写基态原子的 电子排布式。
1.从H原子开始填写。 2.按照原子序数递增的顺序依次填写各元素。 3.同一周期从左→右, • 经过IA和IIA是,将电子填入ns轨道中,——s区 • 经过IIIA-0族时,将电子填入np轨道中,——p区 • 经过IIIB-IIB时,将电子填入(n-1)d轨道中,——d区 • 经过镧系元素和锕系元素时,将电子填入(n-2)f轨道
6.如何从核外电子排布看稀有气体是各周期中最稳定的元 素?
7.d电子从 周期开始出现,即(n-1)d,n≥ ? f电子从 周期开始出现,即(n-2)f,n≥ ?
8.为何K、Ca和Fe等元素第三层电子尚未填满就开始填充 第四电子层?
• ……
核外电子排布与周期表建构的关系
元素按照原子序数递增顺序从左→右排列。原子最外层 电子数呈现从1→8(He例外)的周期性变化。
2. 要写出阳离子的基态电子排布式,将电子从相应原 子的基态原子轨道中移除。从最高能级中的电子开 始移除。若是按照电子层数相同的原子轨道写在一 起的电子排布式书写的则非常方便,从最右边开始 移除,使移除的电子数=阳离子的电荷数。
• 【例题4】对于基态的S2-, 1. 写出核外电子排布式。 2. 写出简写的离子轨道表示式。
Cu+
Cu2+
Mn2+
简写轨道表 示式
x
y
粗铜 :含Zn、Au、Pt和C
250mL
①
②
CC
AgNO3 NaNO3溶液 A
③
④
粗
精
铜
铜
CuSO4溶液
B
如图所示,通电一段时间后,测得B中电极③质量减轻 了14g,电极④增重了12.8g。A中电极共产生气体 3.36L(STP)。(假设通电前后溶液的体积变化忽略 不计)。
• 【例题3】钚的原子序数为94,对于基态 Pu原子,
• 写出核外电子排布式。 • 写出简写的电子排布式。 • 写出原子轨道表示式(简写)。
根据元素周期表写出离子的电子排布式:
• 离子的基态电子排布式可由相应原子的基态电子排 布式写出。
1. 要写出阴离子的基态电子排布式,按照电子填充的 一般规则,将增加的电子填入该原子基态电子排布 式中。
周期表有18列,分别为7个主族、7个副族、1个0族、1 个第VIII族(3列)。 主族序数=原子最外层电子数;IIIB-VIIB族族序数=价 电子数(外围电子数);IB和IIB族序数=ns轨道上的电 子数。
二、核外电子排布与元素周期表
• 原子的核外电子排布与元素周期表中元素 的周期、族的划分有何内在联系?
(1)直流电源的y极是 极。
(2)电极③ 质量减轻>电极④ 增重的原因是
。阳极泥的成分是
。
• (3)写出各电极的反应分别是什么: •① •② •③ •④ • B池溶液电解后的浓度 (不变、变大、变
小、无法确定)。 • (4)写出A池中发生电解的化学方程式
• (5)计算通电前A溶液中C(Ag+)=? • 反应结束后,A池中C(H+)=?
中,——f区。 4.一直写到你要写的元素为止。
• 【例题1】硫元素的原子序数为16,对于基 态S原子,
• 写出核外电子排布式。 • 写出简写的电子排布式。 • 写出原子轨道表示式。
• 【例题2】Fe的原子序数为26,对于基态铁 原子,
• 写出核外电子排布式。 • 写出简写的电子排布式。 • 写出原子轨道表示式。 • 说出Fe原子中有几个未成对电子。
各周期元素与相应能级组的关系
周期 元素数目 相应能级组中的原子轨道 电子最大容量
1 2 1s
第一能级组
2 8 2s2p
第二能级组
3 8 3s3p
第三能级组
4 18 4s3d4p
第四能级组
5 18 5s4d5p
第五能级组
6 32 6s4f5d6p 第六能级组 7 26(未完) 7s5f6d7p(未第七完能级)组
1 、7 核 外6 电 子5 排 布 与4 与 周3 期 的2 划 分1
周期
元素数 第七能级组 32
第六能级组 32
第五能级组 18
↑↓ ↑↓↑↓ ↑↓ ↑↓↑↓ ↑↓↑↓↑↓ ↑↓ ↑↓ ↑↓↑↓
第四能级组 18 第三能级组 8
↑↓ ↑↓ ↑↓↑↓
第二能级组 8
↑↓
第一能级组 2
多电子原子轨道的近似能级图 电子数
2 8 8 18 18 32 未满
•周期数=元素电子层数=能级组中最高主量子数
•元素数目=相应能级组中原子轨道的最大电子容量
周期表与原子电子排布式
2、核外电子排布与族的划分
• 元素周期表有18个纵行共16个族,包括7个主族 (ⅠA-ⅦA)、7个副族(ⅠB-ⅦB)、第Ⅷ族和 零族。
• 族的划分与原子的价电子数目和价电子排 布密切相关。
将外围电子数相同(价电子数相同)的元素排在一列, 称为族。如IA:ns1、IIA:ns2、IIIA:ns2np1…由于各 族元素的价电子排布式相同,所以,同族元素的化学性 质相似。
周期表分为7个周期。周期序数=核外电子层数。各周期 最后一种元素为稀有气体。依次为: 2He、10Ne、18Ar、36Kr、54Xe、86Rn… 前三周期称为短周期,第四、第五周期称为长周期,第 六周期称为超长周期,第七周期称为不完全周期。
主族:
• 周期表中共有7个主族,ⅠA~ⅦA • 主族元素:凡内层轨道全充满,最后1个电子填
