有机化学第10章 醇酚醚
师大版有机化学第10章-醇酚醚-5

2. 醇和氢卤酸的反应
反应式
ROH + HX HX的活性: HI > HBr > HCl RX + H2O
CH3CH2CH2CH2OH
47% HI
CH3CH2CH2CH2I
48% HBr CH3CH2CH2CH2Br H2SO4 浓HCl CH3CH2CH2CH2Cl ZnCl2
醇的活性: 烯丙型 > 3oROH > 2oROH > 1oROH > CH3OH
C2H5OC2H5
甲基乙基醚(甲乙醚)
二乙醚(乙醚)
2). 系统命名法
CH3 C2H5OCHCH2CH2CH2CH3 CH3OCH2CH2OCH3
2-乙氧基己烷 1,2-二甲氧基乙烷 1,2-二甲氧基乙烷 2-乙氧基己烷
环醚
H2C
环氧化合物
CH2 O 环氧乙烷 H2C O 1,2-环氧丙烷 CHCH3
(CH3)3C + CH3OH (CH3)3CI I- HI CH3I
3.环氧化合物的反应
H 2C O CH2 + Nu- H+ HOCH2CH2Nu
Nu-:H2O/H+,ROH/H+,HX,HCN, NH3,RMgX,RONa/OH-
1).酸催化开环:
亲核试剂进攻取代较多的碳原子
(1)
CH3CH O
第十章
醇、酚、醚
第一节
1.醇的结构
醇
一、醇的结构、分类和命名
2.醇的分类
伯醇(一级醇)
根据官能团 所连烃基类型
仲醇(二级醇) 叔醇(三级醇)
饱和醇:
根据烃基结构 不饱和醇:
芳香醇: 一元醇 二元醇 多元醇
10章醇酚醚习题
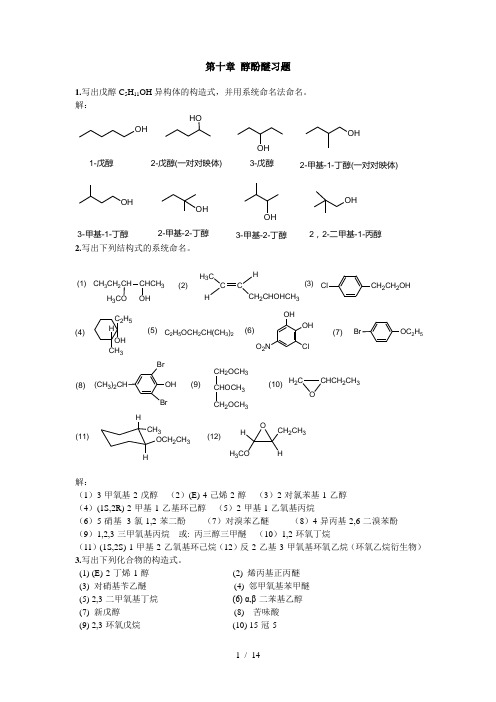
第十章 醇酚醚习题1.写出戊醇C 5H 11OH 异构体的构造式,并用系统命名法命名。
解:OHHOOHOHOHOHOHOH1-戊醇2-戊醇(一对对映体)3-戊醇2-甲基-1-丁醇(一对对映体)2-甲基-2-丁醇3-甲基-1-丁醇3-甲基-2-丁醇2,2-二甲基-1-丙醇2.写出下列结构式的系统命名。
(1)(2)(3)H 3CO CH 3CH 2CH CHCH 3OHCCHH 3C H2CHOHCH 3(11)(12)(4)(5)(6)(7)(8)(9)(10)C 2H 5OCH 2CH(CH 3)2ClCH 2CH 2OHOC 2H 5C 2H 5OH CH 3H OHOH ClO 2NBr OH(CH 3)2CHBrBrCH 2OCH 3CHOCH 3CH 2OCH 3H 2CCHCH 2CH 3OHCH 3HOCH 2CH 3OH H 3COCH 2CH 3H解:(1)3-甲氧基-2-戊醇 (2)(E)-4-己烯-2-醇 (3)2-对氯苯基-1-乙醇 (4)(1S,2R)-2-甲基-1-乙基环己醇 (5)2-甲基1-乙氧基丙烷(6)5-硝基- 3-氯-1,2-苯二酚 (7)对溴苯乙醚 (8)4-异丙基-2,6-二溴苯酚 (9)1,2,3-三甲氧基丙烷 或: 丙三醇三甲醚 (10)1,2-环氧丁烷(11)(1S,2S)-1-甲基-2-乙氧基环己烷(12)反-2-乙基-3-甲氧基环氧乙烷(环氧乙烷衍生物) 3.写出下列化合物的构造式。
(1) (E)-2-丁烯-1-醇 (2) 烯丙基正丙醚 (3) 对硝基苄乙醚 (4) 邻甲氧基苯甲醚 (5) 2,3-二甲氧基丁烷 (6) α,β-二苯基乙醇 (7) 新戊醇 (8) 苦味酸 (9) 2,3-环氧戊烷 (10) 15-冠-5解:H H 3CH CH 2OH (1)(2)(3)(4)(5)(6)(7)(8)(9)(10)H 2CCHCH 2OCH 2CH 2CH 3NO 2CH 2OCH 2CH 3OCH 3OCH 3OCH 3OCH 3PhCH 2CHOHPhOHOO O O O OOHNO 2O 2NNO 24.(1) 2,4-dimethyl-1-hexanol (2) 4-penten-2-ol(3) 3-bromo-4-methylphenol (4) 5-nitro-2-naphthol (5) tert-butyl phenyl ether (6) 1,2-dimethoxyethane 解:(1)(2)(3)(4)(5)(6)H 2CCHCH 2CHCH 3OPhHOOHOHBrCH 3OHNO 2OO5.写出异丙醇与下列试剂作用的反应式:(1) Na (2) Al(3) 冷浓H2SO4 (4) H2SO4 ,>160℃ (5) H2SO4 ,<140℃ (6) NaBr + H2SO4 (7) 红磷+碘 (8) SOCl2(9) CH3C6H4SO2Cl (10) (1)的产物+C2H5Br (11) (1)的产物+叔丁基氯 (12) (5)的产物+HI(过量) 解:(1)(2)(3)(4)(5)(6)OH +Na +++3AlONa OHOOH NaBr BrOSO 2OHH 2SO 4(浓)H 2SO 4(浓)H 2SO 4OH OH OH H 2SO 4(浓)O +Br 2(7)(8)(9)(11)(12)(10)OH ++++OOHONa OHClHI(过量)OO S I 2+ P I SOCl 2OHONa Cl O IH 3C SO2Cl 3CO6.在叔丁醇中加入金属钠,当钠被消耗后,在反应混合物中加入溴乙烷,这时可得到C6H14O ;如在乙醇与金属钠反应的混合物中加入2-甲基-2-溴丙烷,则有气体产生,在留下的混合物中仅有乙醇一种有机物,试写出所有的反应式,并解释这两个实验为什么不同? 解:第一个反应是亲核取代反应,得到的产物为醚:OHNaONaOBr第二个反应是消除反应,得到的产物是烯烃(气体):+OHNa ONaOH第一个实验是亲核取代反应,第二个实验以消除反应为主,生成烯烃,有气体放出,过量的乙醇没参加反应而留下。
有机化学第十章 醇和醚(简单)PPT课件

总目录
本章目录
21
4. 从格氏试剂制备(Grignard)
O R′MgX + R–C–H 干醚
OMgX H-C-R′
OH R-CH-R′
R
此法可制备仲醇或叔醇,尤其是叔醇。
例如:
CH2CH3 CH3CH2CH2-C-CH3
OH
有三种切断
那种原料价廉易得,就采用哪种切断法。
10.08.2020
总目录
+ CH3CH2OH2
H2O
+ CH3CH2
H+ CH2 = CH2
CH3
CH3 H CC
CH3
H+
CH3 OH
CH3
CH3
C
+ CH CH3
重排
CH3 H+
CH3 CH3
CH3
C +
CH CH3
H+
10.08.2020
CH3 CH3 C CH = CH2
CH3 (30%) 总目录
CH3 CH3 CH3 C = C CH3
CH3 (CH3–C–O)3Al
H
+
3 2
H2
异丙醇铝
10.08.2020
总目录
本章目录
29
醇的反应活性: CH2OH >伯醇> 仲醇 > 叔醇
RONa + H2O
强碱 强酸
NaOH + ROH
较弱碱 较弱的酸
注意:因反应可逆,可利用此反应制备醇钠
10.08.2020
总目录
本章目录
30
2. 生成卤代烃(取代) (1)与氢卤酸的反应
20
有机化学(第五版)第十章 醇、酚、醚

2) 根据分子中烃基的类别分为:脂肪醇、脂环醇、 和芳香醇(芳环侧链有羟基的化合物,羟基直接连在 芳环上的不是醇而是酚)。
3) 根据分子中所含羟基的数目分为:一元醇、二元 醇和多元醇。 两个羟基连在同一碳上的化合物不稳定,这种结 构会自发失水,故同碳二醇不存在。另外,烯醇是不 稳定的,容易互变成为比较稳定的醛和酮。 井冈山大学化学化工学院
井冈山大学化学化工学院
关于频哪醇重排需要注意的问题
3.某些环状结构的频哪醇,重排后可得环扩大产物
井冈山大学化学化工学院
五、Preparation of Alcohols
1.由烯烃制备 1) 烯烃的水合 2) 硼氢化-氧化反应
硼氢化反应操作简单,产率高,是制备伯醇的好办法。
井冈山大学化学化工学院
3)羟汞化-脱汞反应
井冈山大学化学化工学院
乙醇液膜
乙醇(CCl4)
四、Chemical Properties of Alcohols
醇的化学性质主要由羟基官能团所决定,同时也受到烃 基的一定影响,从化学键来看,反应的部位有 C—OH、 O—H、和C—H。
分子中的C—O键和O—H键都是极性键,因而醇分子中有 两个反应中心。 又由于受C—O键极性的影响,使得α—H具 有一定的活性,所以醇的反应都发生在这三个部位上。 井冈山大学化学化工学院
(2)双分子消除反应(E2)
一步反应:
E2反应的特点: 1)一步反应,与SN2的不同在于B:进攻β-H。 E2与SN2是互相竟争的反应。 2)反应要在浓的强碱条件下进行。 3)通过过渡态形成产物,无重排产物。 井冈山大学化学化工学院
2. 消除反应的取向
A. Saytzeff规则:优先生成具有较多烷基取代的(也是较稳定的)烯烃。
基础有机化学醇酚醚

反应随着醇分子烃基的加大而反应速率减慢。醇的活性为:
甲醇>伯醇>仲醇>叔醇
RONa + H2O
ROH + NaOH
练习:287页:10-4
(2) 卤代反应
①与氢卤酸反应
醇与氢卤酸作用,醇中的羟基被卤素原子取代而生 成卤代烃和水。
R OH + HX
R
不同氢卤酸的活泼#43; H2O
O
R C CH R" HIO4 R C R'
OH OH
O R"C H
HIO3
AgNO3
AgIO3 白
4 醇的制法
(1) 卤代烃水解
一般情况下,醇比卤代烃容易得到,通常是用醇合成 卤代烃,所以这个方法只在特殊情况下才使用。
CH2 CHCH2Cl + H2O Na2CO3 CH2 CHCH2OH + HCl
Grignard试剂和环氧乙烷发生作用,生成比原料多两 个碳的伯醇。
RMgX + CH2 CH2 Et2O RCH2CH2OMgX O
H2O RCH2CH2OH
选择适当的格氏试剂和羰基化合物,可以合成具有指 定结构的各种醇。
由格氏试剂合成下列醇:
CH2OH
CH3 CH3 C CH2CH3
OH
伯醇
仲醇
叔醇
一级醇(1º醇) 二级醇(2º醇)
三级醇(3º醇)
根据醇分子中羟基所连接的烃基不同:
H3C OH
饱和醇
OH
脂环醇
H2C CH CH2 OH
不饱和醇
CH2 OH
芳香醇
根据分子中羟基的数目:一元醇、二元醇、 三元醇等。
CH2 CH2
OH OH
大学有机化学第十章醇酚醚

(80%) Saytzeff 产物
C. 用Al2O3为催化剂时,醇在高温气相条件下脱水,
往往不发生重排反应。
C H3 C H3 C C H C H3
Al2O3 气 相
C H3 C H3 C C H3 (主要产物 ) C H= C H2 + H2O
C H3 O H
2. 分子间脱水
醇的分子间脱水生成醚(反应是SN反应)
CH3CH2CH2CH2I + H2O
H2SO4 ZnCl2
+ HBr (48%) + HCl
CH3CH2CH2CH2Br + H2O CH3CH2CH2CH2Cl + H2O
特别地:
Lucas试剂(无水ZnCl2与浓HCl配制的溶液)鉴别 六个碳以下的伯、仲、叔醇(烯丙式醇)
现象 R3C-OH
R3C-Cl
反应的立体化学特征:醇的α- 碳原子的构型保持。
R'
α
Cl C OH + Cl S O
R'
R'
δ
R H
SOCl2 α C HCl
R
O
δ
α
S O
SO2
R H
C
Cl
H Cl
ii. 与PX3 , PX5反应
ROH
+
PX 3
RX + H3PO 3
(X=Cl 、 Br、I)
优点:不发生重排
因为反应是按SN2历程进行,不生成碳正离子中间体。
3. 醛、酮还原制醇
C O [H] CH OH
[H]: 催化氢化、NaBH4、LiAlH4、 Al[OCH(CH3)2]3等
CH3CH2CH2CHO O CH3CH2-C-CH3 NaBH4 H2O NaBH4 H2O CH3CH2CH2CH2OH 85% CH3CH2-CH-CH3 OH 87%
有机化学 10醇酚醚

脂肪醇
脂环醇
芳香醇
饱和烃基与羟基相连为饱和醇,反之为不饱和醇。
烯醇:不稳定,容易转变为较稳定的醛或酮。
[CH2 CH OH ] [CH3 C CH2]
OH
CH3CH O
互变异构
CH3 C CH3 O
❖根据分子中羟基的数目:一元醇、二元醇、三元醇等。
CH2 CH2 OH OH
乙二醇
R' R C OH
5-甲基-3-己醇 5-methylhexan-3-ol
CH3CHCH2CHCH2CH3 CH3 Cl
2-甲基-4-氯己烷 4-chloro-2-methylhexane
(3) 习惯命名法 ❖根据和羟基相连的烃基命名,在“醇”字前加上烃基 的名称。英文名是在烃基名称的后面加上alcohol。
CH3
❖利用反应的快慢,区别伯、仲、叔醇,试剂用浓盐酸 和催化剂ZnCl2配成,称为Lucas试剂。
HCl- ZnCl2
R OH
R Cl
叔醇在室温下很快出现浑浊,并分层; 仲醇要5~10分钟后出现浑浊; 伯醇在室温下放置几小时,也看不到卤代烃生成。 适用范围:六个碳以下的醇。
❖大多数伯醇是按SN2历程进行的。
❖醇的羟基氢为活泼氢,能迅速进行质子交换,因此无自 旋偶合,为单峰。
❖氧的诱导效应使碳链上的氢周围的电子云密度减小, δ值增大。
❖乙醇的核磁共振谱:
a. b. c. CH3CH2OH
a.
b. c.
δ值: a,1.1 b,3.7 c,2.6
2 醇的化学性质
氧化反应
H ··
R C C ·O· H H
CH3 CH CH3 异丙醇
CH3 C CH3 叔丁醇
有机化学10醇酚醚

CH2=CH
OH
6
5
4-丙基-5-己烯-1-醇
3 21
-CH=CHCH2-OH 3-苯基-2-丙烯醇
如果为多元醇-----选择含尽可能多-OH的最长碳 链为母体。
CH3 CH3 CH3 — C — C—CH3
OH OH
2,3-二甲基-2,3-丁二醇
1CH2OH CH3CH2 -2C-CH2OH
3CH2OH
H
反应实质是SN2取代历程
醇分子间脱水和分子内脱水是两种互相竞争的反应。
较低温度——取代-----有利于生成醚(~140℃) 较高温度—消---除--—有利于生成烯烃(~170 ℃ )
4. 酯的生成
醇和无机酸、有机酸作用,生成相应的酯
与有机酸反应: O
C2H5OH + CH3-C-OH
O
H+
CH3-C-O-C2H5 + H2O
酸性
HOH pka:
>
CH3OH
> CH3CH2OH
> (CH3)2CHOH
> (CH3)3COH
15.7
16
18
18
19
碱性 -OH < CH3O ˉ < CH3CH2Oˉ < (CH3)2CHOˉ < (CH3)3COˉ
钠与其他活泼金属如镁、铝、铝汞齐(Al-Hg)、镁 汞齐(Mg-Hg)等在较高温度下作用生成醇镁、醇铝。
原因------主要是 分子间形成氢键。
CH3CH2OH
b.P. 78.5℃
HOCH2CH2OH b.P. 198℃
3. 水溶性
① 低级醇(C1 ~ C3)能与水混溶
② 从C4开始,随C 溶解度
H
R
2010第十讲义章醇酚醚

教学目的和要求
1.掌握醇的分类、同分异构及命名。 2.掌握醇的化学性质和制法。 3.了解重要的醇。 4.熟悉消除反应历程以及和亲核取代反应的竞争。 5.掌握酚的结构特点及化学性质。 6.掌握苯酚的制备方法。 7.掌握醚的命名、化学性质及制法。 8.了解重要的醚。
第十章 醇酚醚
(2) 衍生物命名法: 对于结构不太复杂的醇,可以甲醇
作为母体,把其它醇看作是甲醇的烷基衍生物来命名. (3) 系统命名法: 选择含有羟基的最长碳链作为主链, 而把支链看作取代基;主链中碳原子的编号从靠近羟基 的一端开始,按照主链中所含碳原子数目而称为某醇;支 链的位次、名称及羟基的位次写在名称的前面。
• -二醇—相隔两个碳原子的醇.
例1:
1,2-乙二醇 简称:乙二醇 俗名:甘醇 ( -二醇)
1,2-丙二醇 ( -二醇)
1,3-丙二醇 ( -二醇)
例2:
1,2,3-丙三醇 简称:丙三醇 ( 俗称: 甘油 )
2,2-双(羟甲基)-1,3-丙二醇 (俗名: 季戊四醇)
顺-1,2-环戊二醇
醇的构造异构
构造式
习惯命名法 衍生物命名法 系统
(4) 不饱和醇的系统命名:应选择连有羟基同时含有重 键(双键和三键)碳原子在内的碳链作为主链,编号时尽 可能使羟基的位号最小:
4-(正)丙基-5-己烯-1-醇
(5) 芳醇的命名,可把芳基作为取代基:
1-苯乙醇 (-苯乙醇)
1
2
CH2-CH3
OH
3-苯基-2-丙烯-1-醇 (肉桂醇)
• 醇的构造异构包括碳链的异构和官能团的异构。 例如: • 碳链异构:
CH3CH2CH2CH2OH
正丁醇
CH3—CH—CH2OH
有机化学:第十章 醇酚醚

8
醇分子中R基对酸性的影响
O H O H3C H H来自pKa=14 pKa=15 pKa=16
因为3°醇羟基受三个供 电子基团的影响,氧上电子 云密度高,O-H结合较牢, 酸性较弱。而1°醇羟基氧仅 受一个供电子基团,氧上电
C2H5OH CH3 H3C C CH3 OH
pKa≈19
子云密度较低, O-H结合 较弱,H易离解而显酸性。
CH2OH CHOH CH2OH + 3HO NO2 浓 H2SO4
CH2ONO2 CHONO2 CH2ONO2
三硝酸甘油酯/硝化甘油:炸药、心脏病急救。
18
5. 脱水反应
1。
C2H5OH
+ H2SO4
98% 170℃
CH2
CH2 80%
2。 CH3CH2CH2CHCH3 OH C2H5 3
。
62% H2SO4 95℃ 65%~80% 46% H2SO4 81℃
第十章 醇、酚、醚
1
第一节 醇
一、醇的分类、命名和结构特征 1.分类 2.命名 3.结构特征
hetrolysis
H R C H
H + C H
O
+ H
weaker acid protonated alcohol oxidation dehydration
2
二、物理性质 1. 沸点 醇的沸点特别高,随碳原子数增加而上升。之所以沸点特别 高,是因为低级醇分子间以氢键缔合,要使其从液态变为蒸气, 不仅要克服范德华引力,还要消耗能量破坏氢键,所以低级醇具 有反常的高沸点。当醇分子中烃基增多后,羟基所占比例减小, 形成氢键的比例也减小。所以随着R增大,沸点与同碳数烷烃接 近。 碳数相同的醇含支链愈多,沸点愈低。
第十章-醇酚醚-102

3. 酚的氧化
酚比醇容易被氧化,生成苯醌。
O
OH
K
2Cr2O 7
/
+
H
对苯O二醌(黄色)
二元酚和多元酚比苯酚更容易被氧化。
OH OH
Ag2O
O O + 2Ag + H2O
邻苯二醌 (红色)
利用酚的易氧化性,邻苯二酚与对苯二酚常用作照相 底片的显影剂,将氧化银还原成金属银。
4. 酚的还原
苯酚经催化加氢后得到环己醇,这是工业上大量生产 环己醇的主要方法。
40 C,2h
HO
CH3
C-
OH + H2O
CH3
双酚A 制聚碳酸酯、环氧树脂、聚砜的原料
双酚A与环氧氯丙烷反应,可制备环氧树脂:
ClCH2- CH CH2 + HO O
CH3
C-
OH + H2C CH-CH2Cl
CH3
O
NaOH
。
55-65 C
ClCH2-CH-CH2-O OH
CH3
C-
O-CH2-CH-CH2Cl
O O-C-CH3 +
乙酸苯酯
O CH3-C-OH
(HCl)
例:乙酰水杨酸(阿司匹林)的制备
COOH
OH
+
COOH
( CH3CH2O
) 2O
H2SO4 600C
O C CH3 O
④ 与三氯化铁的显色反应 大多数酚或具有 C=C OH 结构的脂肪族
化合物与三氯化铁的水溶液作用,生成有色物质。
6ArOH + FeCl3
CH2
CH2
-CH2- -CH2- -CH2- -CH2-
有机化学 第10章 02 酚、醚

Organic Chemistry醇酚醚’有机化学Organic Chemistry 第十章醇、酚、醚(6)教材:李景宁主编高等教育出版社一酚的结构及命名§10.3酚、酚的结构及命名1. 结构(p O H O H ··1)p-π共轭使O-H 键极性加强易断裂,有酸性;(2)p-π共轭使苯环上电子云密度增大,亲电活性增加。
2. 酚的命名一元酚二元酚三元酚•酚大多数为结晶固体。
•酚的沸点和溶点高于质量相近的烃——氢键。
•酚微溶于水,能溶于酒精,乙醚等有机溶剂。
酚的氢键酚与水分子之间的氢键酚与酚分子之间的氢键酚同醇一样,由于O-H的伸缩振动,在3520 ~ 3100 cm-1 有一个强而宽的吸收带(缔和羟基)。
C O伸缩振动不同但酚与醇的C-O伸缩振动不同:四、化学性质1. 酚羟基的反应OH ONa+OH⑴酸性NaOH H 原因:p 共轭使O H 极性加强故易离解O-•p-π共轭,使O—H 极性加强,故H 易离解;•解离后,p-π共轭,使酚负离子的负电荷分散在整个共轭体系而稳定散在整个共轭体系而稳定。
2个酚酸性大小比较的排序:H 2CO 3ArOH ROH>>OH OH OH OHNO 2OH NO 2O 2N NO 2CH 3Cl NO 2NO 2p K a 7.15 10.26 9.38 4.09 0.25⑵与FeCl 3反应•用于鉴定酚(注意:不同的酚,颜色不同!)6C 6H 5OH +FeCl 3H 3[Fe(OC 6H 5)6]+ 3 HCl •用于鉴定烯醇式结构C C OH⑶醚的生成OHONaORNaOHRX(CH 3O)2SO 2或用途之一:保护酚羟基OH C OOHHOOC H1.NaOH2.CH IH I3OMeC OKMnO 4-HOOC OMeHOH2. 芳环上的反应⑴卤代OH溴代Br 2OHBrBrBr 2溴代:NaHSO3BrH 2O(白)OBr Br•非常灵敏BrBr(黄)•鉴定苯酚的方法之一酚羟基活性太高,因此,制备一溴苯酚时,必须用非极性溶剂(或其他试剂)。
有机化学第十章 酚醚

Me O OAlCl3 + O C CH3
OH O CH3 OH
AlCl3
4).Claisen 重排
O CH2CHCH2 190-220C 6h O CH2CHCH2 CH3 CH2CH CH2 H3C OH CH3 OH CH2CH CH2
O CH3
H3C
NO2 (苦 味 酸 )
产率低
沸点相差较大!
H
• 分子内氢键 • 分子间氢键
O
O N O
O
H
O N
O
O
H O
H H H
N O O O H
O N O O H
⑶ 亚硝化
酚还可磺化、烷基化、酰基化。
⑷ 缩合
OH H OH O H C H CH2OH
+
• 用于制备酚醛树脂(电木、胶黏剂等)
3. 氧化
二、物理性质与光谱性质
沸点低,易挥发,良溶剂,可与水形成氢键;故部分醚能溶 于水,如(四氢呋喃、1,4-二氧六环等环醚) IR: C-O伸缩振动 1300-1100 cm-1; 1H-NMR:与氧相连的碳原子上的氢的化学位移在4附近。
三、化学性质
1. ������盐的生成
ROR
ROR
+ H+
+ BF3
+
FeCl3
H3[Fe(OC6H5)6]
+
3 HCl
C
C
OH
⑶ 醚的生成
OH NaOH ONa RX OR
或 (CH3O)2SO2
• 用途:保护酚羟基
O C H
1.NaOH 2.CH3I O C H
OMe
HI
OH
有机化学C第10章 醇酚醚问题参考答案
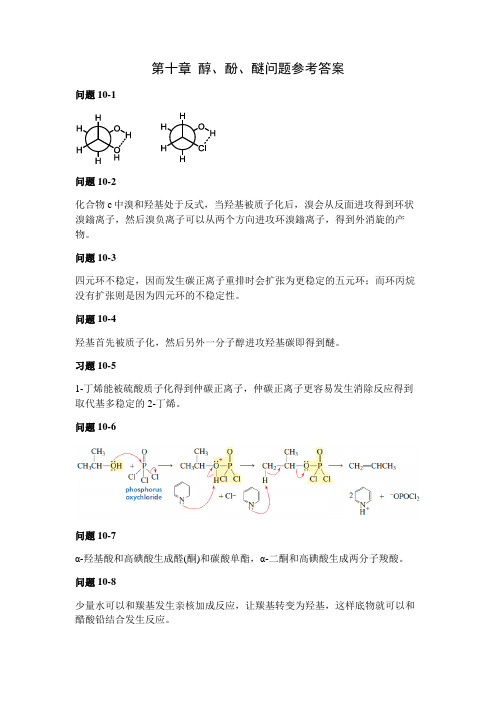
第十章醇、酚、醚问题参考答案问题10-1问题 10-2化合物c中溴和羟基处于反式,当羟基被质子化后,溴会从反面进攻得到环状溴鎓离子,然后溴负离子可以从两个方向进攻环溴鎓离子,得到外消旋的产物。
问题10-3四元环不稳定,因而发生碳正离子重排时会扩张为更稳定的五元环;而环丙烷没有扩张则是因为四元环的不稳定性。
问题10-4羟基首先被质子化,然后另外一分子醇进攻羟基碳即得到醚。
习题10-51-丁烯能被硫酸质子化得到仲碳正离子,仲碳正离子更容易发生消除反应得到取代基多稳定的2-丁烯。
问题10-6问题10-7α-羟基酸和高碘酸生成醛(酮)和碳酸单酯,α-二酮和高碘酸生成两分子羧酸。
问题10-8少量水可以和羰基发生亲核加成反应,让羰基转变为羟基,这样底物就可以和醋酸铅结合发生反应。
问题10-9乙醇中氧的电负性强,分子间形成氢键的作用比较强;而硫的电负性比氧弱,因而分子间氢键没有乙醇强,所以沸点比乙醇低。
问题10-10问题10-11二价镁具有Lewis酸性,能和羰基氧络合,然后碳负离子进攻羰基碳。
问题10-12邻硝基苯酚酸性最强,间硝基苯酚酸性最弱。
邻对位硝基苯酚由于共轭效应具有比间硝基苯酚强的酸性;而且邻硝基苯酚的诱导效应比对硝基苯酚强,同时还可以形成分子内氢键。
问题10-13邻位产物会形成分子内氢键,具有较低的沸点,因而可以将邻位产物的对位产物分开。
问题10-14硝基越多芳环的亲电性越强,反应条件越温和。
问题10-15苯酚与NaOH反应生成盐后具有更强的亲核性,可以与醛发生亲核加成反应。
问题10-16四氢呋喃为环状结构,氧更加裸露,因而更容易与水形成氢键相互作用,因而可以与水互溶。
问题10-17因为在该反应中没有进攻手性中心,所以手性构型不发生变化。
问题10-18问题10-19伯醇为S N2反应,羟基先被质子化,然后另外一分子醇进攻羰基碳得到醚。
仲醇可能会发生S N2反应和S N1反应。
问题10-20。
有机化学课件10-醇酚醚

如:乙醚中的少量乙醇,加入 CaCl2便可除去少量乙醇。
三、醇的光谱性质 IR:-OH 未缔合的在3640-3610cm-1有尖峰 缔合的在3600-3200cm-1宽峰
ROH的活泼次序:CH2=CH-CH2OH > R3C-OH > R2CH-OH > RCH2OH
当一级醇与氢碘酸(47%)一起加热就可生成碘代烃。
RCH2OH + HI
RCH2I + H2O
与氢溴酸(48%)作用是必须在H2SO4存在下加热才能生成溴代烃。
RCH2OH + HBr H2SO4 RCH2Br + H2O
与浓盐酸作用必须有氯化锌存在并加热才能产生氯代烃。
RCH2OH + HC l ZnCl2 RCH2C l + H2O
烯丙式醇(CH2=CHCH2OH或C6H5CH2OH)和三级醇在室温下和浓盐酸 一起震荡就有氯代烃生成。
(2) Lucas试剂(ZnCl2+浓HCl): 利用醇和盐酸作用的快慢,可以区别一、二、三级醇,所用试剂
1.与活泼金属作用
醇中O-H 越易断裂,反应速度越快。醇的酸性越强,O -H越易断。
2 CH3CH2OH + 2Na
2 CH3CH2ONa + H2
(CH3)3C OH + KH
(CH3)3C OK + H2
2.与氢卤酸反应
ROH + HX
RX + H2O
(1)HX的活泼次序:HI > HBr > HCl.
有机化学 醇酚醚

2. 溶解度:低级醇易溶于水.(可与水形成分子间氢键)
H H O H R O H H O H R O H H O
3. 低级醇可与MgCl2,CaCl2,CuSO4等形成结晶醇,此 结晶醇溶于水,不溶于有机溶剂.
9.2 醇的化学性质
H的酸性
H C C O H H
五、氧化成醛、酮或羧酸
O C H H
[O]
C
O
条件:有α-H的醇才能氧化 1.化学氧化
(1)用铬酸氧化
伯醇 仲醇
Na2Cr2O7,H2SO4,H2O Na2Cr2O7,H2SO4,H2O
醛 酮
酸
叔醇
不能被氧化
*选择性氧化剂PCC(氯铬酸吡啶盐):伯醇
C6H5N + CrO3 + HCl
CH3(CH2)6CH2OH PCC CH2Cl 2 CH3(CH2)6CHO
1. 与 HX的反应
ROH
+
HX
RX
+
H2 O
思考:为什么要在酸性条件下进行? (1).反应活性:酸的活性 HI > HBr > HCl >> HF
CH3CH2CH2CH2OH
+ HI(47%)
H2SO4
CH3CH2CH2CH2I
CH3CH2CH2CH2Br
+
H 2O
CH3CH2CH2CH2OH + HBr (48%)
B 催化加氢
MeO CHO
H2 Pt
MeO CH2OH
O H2 (CH3)2C=CHCH2CH2CCH3 Pt
OH (CH3)2CHCH2CH2CH2CHCH3
有机化学(第二版)第十章 醇 酚 醚

10. 10.3 物理性质
状态: 一、状态:
C4以下:无色有酒精气味的液态; C5-C11:具不愉快气味的油状液态; C12以上:无色的蜡状固体;二元醇和多元醇具 甜味,故乙二醇有时称甘醇。
二、沸点
缔合:是靠分子间相互吸引而产生的一种特 殊键-氢键。 由于分子间或分子中的氢原子和两个含 有未共享电子对而且电负性很强的原子互相 吸引而形成的键。例如O、N、F等。 聚合:是指分子靠化学作用而形成的共价键 或离子键使分子结合在一起。
优点: 1)SOCl2的bp.低,可蒸馏除去过量的SOCl2 2)副产物SO2,HCl均为气体
三、与无机酸的反应
ROH
+
H OSO3H
ROSO3H
+
OH2
蒸蒸 2 CH3OSO3H (CH3)2SO4
+
H2SO4
ROH
+
(CH3)2SO4
ROCH3
+
H2SO4
醇也能与硝酸作用生成硝酸酯,硝酸酯受 热会发生爆炸,∴多元醇的硝酸酯都是烈 性炸药。
+
.H2
+
.H2
[O] RCH2OH RCHO
[O]
RCOOH
为使1º醇氧化控制在醛阶段,常选用一些 选择性的氧化剂: • ① Sarrett试剂: CrO3.py • ②Jones试剂:CrO3.H2SO4 • ③ 活性MnO2 氧化醇到醛, 不氧化双键
10. 10.6 硫醇
一、性质 1、弱酸性
在同系列中醇的bp.也是随C数的增加而有 规律的上升,并且在同C数的一元饱和醇中, bp.也是随支链的增多而降低。
三、结晶醇 与水相似,低级醇也能与某些无机盐类形成 结晶状分子化合物。它们不溶于有机溶剂而 溶于水。利用这一性质可使醇与其它化合物 分开,或从反应产物中除去醇类。例如:乙 醚中杂有乙醇+CaCl2。 注意:在制备低级醇时不能使用无水CaCl2 作干燥剂。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
OH
OH
1,3-丙二醇
CH3
OH OH 顺 1 甲基 1,2 环己二醇
3、结构
O 原子为 sp3 杂化 由于在 sp3 杂化轨道上有未共用电子对,
两对之间产生斥力,使得∠C-O-H 小于 109.5 °
二、醇的物理性质
1、性状 2、沸点 1)比相应的烷烃的沸点高100~120℃(形成分子间氢键的原
醇的反应活性:
CH3OH > 伯醇(乙醇) > 仲醇 > 叔醇 金属镁、铝也可与醇作用生成醇镁、醇铝。
CH3 6 CH3 CH OH + 2Al
CH3 2(CH3 CH O)3 Al + 3H2
还原剂 有机合成中常用的试剂
醇钠、异丙醇铝、叔丁醇铝是有机合成中常用的碱性试剂。
2、与氢卤酸反应
R-OH + HX 反应特点:
因), 如乙烷的沸点为-88.6℃,而乙醇的沸点为78.3℃。 2) 比分子量相近的烷烃的沸点高,如乙烷(分子量为30)的沸点
为-88.6℃,甲醇(分子量32)的沸点为64.9℃。 3)含支链的醇比直链醇的沸点低,如正丁醇(117.3)、异
丁醇(108.4)、叔丁醇(88.2)。 4)若分子量相近,含羟基越多沸点越高。
R-X + H2O
1) 反应速度与氢卤酸的活性和醇的结构有关。 HX的反应活性: HI > HBr > HCl
CH3CH2CH2CH2OH + HI (47% )
CH3CH2CH2CH2I + H2O
+ HBr (48% ) H2S O4 CH3CH2CH2CH2Br + H2O
+ HCl
ZnCl2 CH3CH2CH2CH2Cl + H2O
醇的活性次序: 烯丙型醇 > 叔醇 > 仲醇 > 伯醇 > CH3OH
CH3
CH3 C OH CH3
( 浓HCl + 无水 ZnCl2 ) 室温
CH3
CH3 C Cl CH3
+ H2O
1min钟混浊,放置分层
CH3CH2CHCH 3 OH
卢卡斯试剂 室温
CH3CH2CHCH 3 + H2O Cl
10min钟混浊,放置分层
3、溶解度
①甲、乙、丙醇与水以任意比混溶 ②C4以上则随着碳链的增长溶解度减小 ③分子中羟基越多,在水中的溶解度越大,沸点越高 ④醇能溶于强酸是由于它能和酸中质子结合成金羊盐的缘故
4 、结晶醇的形成
低级醇能和一些无机盐(MgCl2、CaCl2、CuSO4等)作用形成 结晶醇,亦称醇化物。
MgCl2 CaCl2 CaCl2
①伯醇 (SN2)
②叔醇 (SN1)
3)β位上有支链的伯醇、仲醇与HX的反应常有重排产物生成。
CH3 CH3 C CH2OH + HB3 C CH2Br + CH3 C CH2CH3
CH3
Br
重排产物(主要产物)
原因:反应是以SN1历程进行的。
这类重排反应称为瓦格涅尔-麦尔外因(Wagner-Meerwein) 重排,是碳正离子的重排反应。
卢卡斯试剂 CH3CH2CH2CH2OH
室温
CH3CH2CH2CH2Cl + H2O 放置一小时也不反应(混浊) 加热才起反应(先混浊,后分层)
Lucas试剂可用于区别伯、仲、叔醇,适用于3—6个碳原子的醇。
2) 醇与HX的反应为亲核取代反应,伯醇为SN2历程,叔醇、 烯丙醇为SN1历程,仲醇多为 SN1历程。
第一节 醇
脂肪烃分子中的氢、芳香族化合物侧链上的氢被 羟基取代后的化合物称为醇。 一、醇的结构、分类和命名
2、醇的命名
1)简单的一元醇用普通命名法命名。
CH3 CH3 CH CH2OH
异丁醇
CH3 CH3 C OH
CH3 叔丁醇
OH 环己醇
CH2OH 苄醇
2)系统命名法
选择含有羟基的最长碳链为主链,以羟基的位置最小编 号,……称为某醇。
练习:
3、与卤化磷和亚硫酰氯反应
3ROH + PX3(P + X2)
3R-X + P(OH)3 X = Br、I (制备溴代或碘代烃)
3ROH + PBr3 6ROH + 2P + 4I2
3RBr + H3PO4 6 R-I + 2 H3PO4
ROH + PCl5 ROH + SOCl2
R-Cl + POCl3 + HCl R-Cl + SO2 + HCl
OH
CH3-CH-CH-CH2-CH-CH3
CH3
Cl
CH3-CH-CH2-CH=CH2 OH
2-甲基 -5- 氯 -3-己醇 4 - 戊烯 -2-醇
CH=CH-CH2OH
3 -苯基 - 2 - 丙烯醇 (肉桂醇)
多元醇的命名,要选择含-OH尽可能多的碳链为主链,羟基 的位次要标明。
CH2-CH2-CH2
第十章
醇酚醚
本章要求:
1.掌握醇、酚、醚的分类及其命名法。 2.掌握氢键对醇的熔点、沸点、水溶性、红外吸收峰、化学
位移等物理性质的影响。 3.理解醇、酚、醚的结构特点。 4.掌握醇、酚、醚的化学性质、碳正离子的重排。 5.理解β—消除 E1、E2历程,消除反应的立体化学特征。 6.理解E1与SN1,E2与SN2之间的竞争及影响因素。 7.掌握环氧乙烷的性质和用途。 8.了解醇、醚的制备方法。 9. 了解重要醇、酚、醚。 10. 了解一般冠醚及相转移催化剂。
1、与活泼金属的反应
CH3CH2OH + Na K
CH3CH2ONa + 1/2 H2 K
Na与醇的反应比与水的反应缓慢的多,反应所生成的热量 不足以使氢气自燃。
CH3CH2O-的碱性比-OH强,所以醇钠极易水解。
CH3CH2ONa + H2O
较强碱
较强酸
CH3CH2OH + NaOH
较弱酸
较弱碱
伯醇在1060~1030cm-1 仲醇在1100cm-1附近 叔醇在1140cm-1附近
NMR:
O—H的核磁共振信号由于受氢键、温度、溶剂性质等影响, 可出现δ值在0.5~4.5的范围内。
四、醇的化学性质
氧化反应
H CC H
脱 水 反 应
形成氢键形 成 金羊 盐
酸性(被金属取代)
O
H
取 代 反 应
6CH3OH 4C2H5OH 4CH3OH
不溶于有机溶剂,溶于水。 结晶醇:
可用于除去有机物中的少量醇
三、醇的光谱性质
IR:
-OH有两个吸收峰 3640~3610cm-1未缔合的OH的吸收带,外形较锐。 3600~3200cm-1缔合OH的吸收带,外形较宽。 C-O的吸收峰在1000~1200cm-1:
