酸碱盐反应图像
利用思维导图巧记酸碱盐的化学性质

❖ s2:酸能与某些盐反应,生成新盐和新酸(酸+盐
→新盐+新酸);
❖ s3:酸能与指示剂反应,能使紫色石蕊溶液变为红
色;
❖ s4:酸能与活泼金属反应(H前金属,酸+金属→
盐+ H2↑)
❖ s5:酸能与某些金属氧化物反应,生成盐和水(酸
+金属氧化物→盐+H2O)。
碱“四性”
❖ j1:碱能与酸反应,生成盐和水(碱+酸→盐 +H2O);
初三化学专题复习 巧记酸碱盐的化学性质
巧记酸碱盐的化学性质
酸
碱
盐
指示剂
酸
碱
盐
指示剂
酸
碱
盐
金属氧化物
指示剂
酸
碱பைடு நூலகம்
非金属 氧化物
盐
金属
金属氧化物 酸
指示剂
碱
非金属 氧化物
盐
金属
金属
金属氧化物 酸
指示剂
碱
非金属 氧化物
盐
盐 金属
金属
金属氧化物 酸
指示剂
碱
非金属 氧化物
盐+水
盐
盐 金属
金属
金属氧化物 酸
❖ j2:碱溶液能与某些盐溶液反应,生成新盐和 新碱(碱+盐→新盐+新碱);
❖ j3:可溶性碱能与指示剂反应,使紫色石蕊溶 液变为蓝色,使无色酚酞溶液变为红色;
❖ j4:碱能与某些非金属氧化物反应,生成盐和 水(碱+非金属氧化物→盐+ H2O);
盐“四性”
❖ y1:盐能与酸反应,生成新盐和新酸(盐+酸→ 新盐+新酸);
酸碱盐常见的化学反应

⑸盐+盐→盐+盐(反应物必须可溶且生成物之一必须是不溶物)
3 使用时间: 年 月 日
CaCl2 + K2CO3 —
Ba(NO3)2 + Na2SO4 —
※ 不属于四种基本类型的反应:
⑴金属氧化物+CO→金属+CO2
Fe2O3 + CO ——
⑵碱+酸性氧化物→盐+水(可溶性碱) NaOH + CO2 —
3、NH4Cl NaOH Na2CO3----------------------------------------------( ) 4 AgNO3 Na2CO3 选用的试剂 A 、HCl KNO3 ----------------------------------------------( ) B、 H2SO4 C、Fe D、Ba(OH)2 E、Na2CO3 F、AgNO3 G、石蕊试液
7 使用时间: 年 月 日
课 后 作 业
Na + CuSO4 —— Fe(OH)3 + H2SO4 —— BaO + H2SO4 —— H2SO4 + NaCl —— BaCl2 + H2SO4 —— NaOH + KCl —— Ba(OH)2 + Fe2(SO4)3 —— Cu(OH)2 + K2CO3 —— NH4NO3 + Ba(OH)2 —— KNO3 + NaCl ——
中含有
(写离子符号) ,硫酸中含有
(写离子符号) 。
五、 露置空气的烧碱, 会跟空气中
发生反应而混入杂质 , 反应的化学方程式是
;
若要检验某烧碱中是否含有杂质,可选用的试剂是 是 。除去这种杂质的化学方程式为
,有关反应的化学方程式 .
课 后 小 结
《酸碱盐反应图像》课件

酸碱中和反应
酸碱中和反应产生盐和水的同 时伴随着热放出,这可以通过 热显像仪进子和阴离子 结合形成不溶于水的沉淀物, 反应过程可以通过比色法进行 观察。
酸碱盐反应的应用领域
食品工业
酸碱盐反应在食品加工中用于调味、杀菌、 起泡等。
制药工业
酸碱盐反应在药物合成和中和药物的制备中 发挥重要作用。
环境保护
酸碱盐反应在环境治理中用于废水处理和酸 雨抑制。
农业
酸碱盐反应在土壤改良和植物营养调节中起 着关键性作用。
实验室中的酸碱盐反应实例
1
酸碱滴定实验
使用酸碱滴定方法测定溶液中的酸碱浓度。
2
脱色实验
利用酸碱反应将带色溶液转为无色溶液。
3
中和瓶溶液实验
通过酸碱中和反应制备中和瓶溶液。
总结和展望
酸碱盐反应在化学领域中占据重要地位,对生活和工业生产具有广泛的应用。 随着科学技术的不断发展,酸碱盐反应的研究和应用前景将更加广阔。
《酸碱盐反应图像》PPT 课件
化学中的酸碱盐概述
常见的酸碱盐反应
醋与小苏打反应
醋与小苏打反应产生二氧化碳 气体,形成起泡。
柠檬汁与小苏打反应
柠檬汁与小苏打反应产生二氧 化碳气体,形成起泡。
盐酸与锌反应
盐酸与锌反应产生氢气气体, 并生成氯化锌化合物。
酸碱盐反应的图像展示
酸碱指示剂的颜色变化
酸碱指示剂在不同酸碱环境中 显示不同的颜色,反应过程可 以通过颜色的变化进行观察。
酸碱盐的反应规律

酸碱盐的反应规律具体内容单质、氧化物、酸、碱、盐之间的相互反应,可归纳成下图来表示。
①金属+ 氧气?金属氧化物除Ag、Pt、Au外的金属,一般都可与氧气发生化合反应,金属越活泼与氧化合就越容易,由酸转化成盐有四个途径:某些金属+ 某些酸?盐+ 氢气酸+ 碱性氧化物?盐+ 水酸+ 碱?盐+ 水酸+ 某些盐?另一种酸+ 另一种盐⑧酸?酸性氧化物+ 水在一定条件下含氧酸分解可生成酸性氧化物(酸酐)和水。
⑨金属+ 非金属?无氧酸盐此处的非金属H2、O2除外。
当金属越活泼,非金属也越活泼时,反应就越容易进行。
⑩酸性氧化物+ 碱性氧化物?含氧酸盐(非初三知识)强酸(H2SO4、HNO3)的酸酐与活泼金属的氧化物在常温下即可反应,其余的需在加热或高温条件下才能发生反应。
碱性氧化物+ 酸?盐+ 水强酸(H2SO4、HNO3、HCl)可与所有碱性氧化物反应,弱酸(H2CO3、H2S等)只能和活碱、4参加反应的两种盐必须都能溶于水,若生成物中有一种是难溶性的盐时,则反应可以进行。
金属+ 盐?另一种金属+ 另一种盐在金属活动性顺序里,排在前面的金属(K、Ca、Na除外)能把排在后面的金属从它的盐溶液里置换出来。
金属+ 酸?盐+ 氢气在金属活动性顺序里,排在氢前的金属能从酸溶液中把氢置换出来。
这里的酸主要是指盐酸和稀硫酸。
浓硫酸和硝酸因有强氧化性,跟金属反应时不会生成氢气,而是生成盐、水和其它气体。
除杂1、CO2(CO):把气体通过灼热的氧化铜,2、CO(CO2):通过足量的氢氧化钠溶液3、H2(水蒸气):通过浓硫酸/通过氢氧化钠固体3除去Cu中的Fe,可将混合固体加入CuSO4溶液中,(Fe+CuSO4=Cu+FeSO4),然后过滤后取滤渣。
4除去Na2SO4溶液中的NaOH,可向溶液中加入适量的稀H2SO4溶液(2NaOH+H2SO4=Na2SO4+2H2O)5除去KCl溶液中的K2SO4,可向溶液中加入适量的BaCl2溶液(K2SO4+BaCl2=2KCl+BaSO4),然后过滤后取滤液。
酸碱盐的相互反应

酸碱盐的相互反应【知识梳理】一、常见的酸和碱1. 认识盐酸和硫酸的主要性质和用途。
2. 认识氢氧化钠和氢氧化钙的主要性质和用途。
3. 用常见酸、碱的性质解释一些常见的现象。
4. 知道常见酸、碱的腐蚀性。
5. 了解用pH试纸和酸碱指示剂检验溶液酸碱性的方法。
二、生活中常见的盐1. 了解食盐、纯碱、小苏打、碳酸钙等盐在日常生活中的用途。
2. 知道一些常用化肥的名称和作用。
物质体系→酸物质体系→碱物质体系→盐单质、氧化物、酸、碱、盐相互转化关系图1. 置换反应及其条件2. 复分解反应的发生条件(生成物)产物之一为气体、沉淀、水产物为水H+ + OH- = H2O产物为气体CO2、水2H+ + CO32-= H2O + CO2↑H+ + HCO3-= H2O + CO2↑产物为沉淀Ba2+ + SO42- = BaSO4↓Ag+ + Cl- = AgCl↓Ca2+ + CO32- = CaCO3↓Ba2+ + CO32- = BaCO3↓Al3+ + 3OH- = Al(OH)3↓Mg2+ + 2OH- = Mg(OH)2↓Cu2+ + 2OH- = Cu(OH)2↓Fe3+ + 3OH- = Fe(OH)3↓小明用如下微观示意图来说明盐酸与氢氧化钠反应的发生,用化学反应方程式表示为:NaOH+HCl=NaCl+ H2O 。
从该图可以看出,反应前后没有发生变化的微观粒子有Na+、Cl -,从微观粒子的角度分析,该反应的实质是。
部分酸、碱、盐在水中可解离出阴、阳离子,复分解反应的实质就是酸、碱、盐解离出的一些阴、阳离子相互结合生成难解离的水、气体或沉淀。
依据部分碱、盐溶解性表和复分解反应实质判断下列两组物质(①硫酸钠和氢氧化钡、②硫酸钠和氯化亚铁)在水中混合后能否发生反应,若能,仿照上述的示例在下图的圆圈中填入适当的物质或离子符号,来体现反应的实质。
3. 物质的制备(1)生成酸的反应:①酸性氧化物+水→ 对应的酸②酸+盐→ 新酸+新盐③条件:1)生成物有沉淀2)碳酸盐+酸→ CO2↑+H2O(2)生成碱的反应:①碱性氧化物+水→ 碱(条件:碱溶)②碱+盐→新碱+新盐(条件:反应物皆可溶且生成物有沉淀)(3)生成盐的反应:①金属+酸→H2↑+盐条件:1)金属:H前金属2)酸:盐酸和稀H2SO43)盐:可溶②金属+盐→新金属+新盐条件:1)金属:可置后2)盐:可溶3)K、Na、Ca不可行③酸+碱性氧化物→盐+水④碱+酸性氧化物→盐+水⑤酸+碱→盐+水⑥酸+盐→新酸+新盐⑦碱+盐→新碱+新盐⑧盐+盐→新盐+新盐4. 连续反应关系(1)Ca系列:Ca→CaO→Ca(OH)2→CaCO3→CaO(2)C系列:C→CO2→H2CO3→Na2CO3→CO2(3)Cu系列:Cu→CuO→CuCl2→Cu(OH)2→CuSO4→Cu(4)Fe系列:Fe←Fe2O3→FeCl3→Fe(OH)3→Fe2(SO4)3→FeCl2→Fe→FeSO4【典例精析】例1 判断下列反应能否发生,能发生的写出反应方程式,不发生的说明理由。
九年级化学酸碱盐相互反应及方程式

制备Cu(OH)2
2H2O 通电 2H2↑ + O2↑
2Cu +O2 Δ 2CuO
CuO + H2SO4 = CuSO4 + H2O
CuSO4 + 2NaOH = Cu(OH)2↓+Na2SO4
氢氧化铝和稀盐酸反应 Al(OH)3+3HCl=AlCl3+3H2O 氢氧化铝和稀硫酸反应 2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O
3、碱与盐
氢氧化钠和氯化铁反应 3NaOH + FeCl3= 3NaCl + Fe(OH)3↓ 氢氧化钠和硫酸铜反应 2NaOH + CuSO4= Na2SO4 + Cu(OH)2↓ 氢氧化钙和碳酸钠反应 Ca(OH)2 + Na2CO3=2NaOH + CaCO3↓ 氢氧化钙和硫酸铜反应 CuSO4+Ca(OH)2=Cu(OH)2 ↓ +CaSO4 氢氧化钙和氯化铁反应 2FeCl3+3Ca(OH)2=2Fe(OH)3↓+3CaCl2
锌与稀盐酸反应 Zn+2HCl=ZnCl2+H2↑
锌与稀硫酸反应 Zn+H2SO4(稀)=ZnSO4+H2↑
铁与稀盐酸反应
Fe+2HCl=FeCl2+H2↑
铁与稀硫酸反应
Fe+H2SO4(稀)=FeSO4+H2↑
2、酸与某些金属氧化物
氧化铁和稀盐酸反应 Fe2O3+6HCl=2FeCl3+3H2O 氧化铁和稀硫酸反应 Fe2O3+3H2SO4=Fe2(SO4)3+3H2O 氧化铜和稀盐酸反应 CuO+ HCl=CuCl2+H2O 氧化铜和稀硫酸反应 CuO+H2SO4=CuSO4+H2O
酸碱盐化学方程式及现象

酸碱盐化学方程式及现象一.两个置换反应规律1.酸+金属==盐+氢气反应条件:①酸不能用强氧化性酸,如硝酸、浓硫酸,常用稀硫酸、盐酸②金属必须位于氢以前常用Mg、Al、Zn、Fe③有铁参加的置换反应生成亚铁盐铁元素显+2价1镁与盐酸反应: Mg+ 2HCl==MgCl2+H2↑现象:金属表面均有气泡生成,金属逐渐溶解;2铝与盐酸反应 2Al+6 HCl== 2AlCl3+3H2↑现象:金属表面均有气泡生成,金属逐渐溶解;3锌与盐酸反应: Zn+ 2HCl==ZnCl2+ H2↑现象:金属表面均有气泡生成,金属逐渐溶解;4铁与盐酸反应: Fe+ 2HCl==FeCl2+H2↑现象:金属表面均有气泡生成,金属逐渐溶解,溶液由无色变为浅绿色;5镁与稀硫酸反应: Mg+ H2SO4==MgSO4+H2↑现象:金属表面均有气泡生成,金属逐渐溶解;6铝与稀硫酸反应: 2Al+3 H2SO4== 2Al2SO43+3H2↑现象:金属表面均有气泡生成,金属逐渐溶解;7锌与稀硫酸反应 Zn+ 2H2SO4==ZnSO4+ H2↑现象:金属表面均有气泡生成,金属逐渐溶解;8铁与稀硫酸反应: Fe+H2SO4===FeSO4+H2↑现象:金属表面均有气泡生成,金属逐渐溶解,溶液由无色变为浅绿色;现象 1至8现象:金属表面均有气泡生成,金属逐渐溶解;4和8另加现象:溶液由无色变为浅绿色2.盐+金属==新盐+新金属反应条件:①盐反应物必须溶于水②有铁参加的置换反应生成亚铁盐铁元素显+2价③金属单质反应物比盐中金属活泼,不用钾、钙、钠9铁与硫酸铜溶液反应: Fe+CuSO4==FeSO4+Cu现象:铁表面有紫红色固体覆盖,溶液有蓝色逐渐变为浅绿色10铝与硫酸铜溶液反应: 2Al+3CuSO4==Al2SO43+3Cu现象:铝表面有紫红色固体覆盖,溶液有蓝色逐渐变为无色11铜与硝酸银溶液反应: Cu+2AgNO3==CuNO32+2Ag现象:铜表面有银白色固体覆盖,溶液有无色逐渐变为蓝色二.五种复分解反应规律1.酸+碱==盐+水中和反应,实质是:氢离子和氢氧根离子生成水分子12氢氧化铝和盐酸反应用氢氧化铝治疗胃酸过多:AlOH3+3HCl==AlCl3+3H2O13氢氧化镁和盐酸反应用氢氧化镁治疗胃酸过多:MgOH2+2HCl ==MgCl2+2H2O14氢氧化钠和盐酸反应: NaOH +HCl== NaCl+ H2O2.酸+盐==新酸+新盐反应条件:符合复分解反应发生的条件酸和碳酸盐反应时,碳酸盐溶不溶均可15大理石与稀盐酸反应实验室制二氧化碳 CaCO3+2HCl==CaCl2+H2O+CO2↑16碳酸钠与稀盐酸反应可用于检验氢氧化钠变质Na2CO3+2HCl==2NaCl+H2O+CO2↑现象:溶液中有气泡生成,生成的气体使澄清的石灰水变浑浊17碳酸氢钠与稀盐酸反应用小苏打治疗胃酸过多NaHCO3+HCl==NaCl+H2O+CO2↑现象:溶液中有气泡生成,生成的气体使澄清的石灰水变浑浊3.盐+碱==新盐+新碱反应条件:反应物都溶于水,生成物至少有一种不溶前溶后沉18碳酸钠与氢氧化钙反应: Na2CO3+CaOH2==CaCO3↓+2NaOH工业制火碱;区别CaOH2和NaOH;除杂NaOH溶液中CaOH2或Na2CO3杂质现象生成白色碳酸钙沉淀19硫酸铜与氢氧化钠溶液反应 CuSO4+2NaOH==CuOH2↓+Na2SO4现象生成蓝色絮状氢氧化铜沉淀4.盐+盐==新盐+新盐反应条件:反应物都溶于水,生成物至少有一种不溶前溶后沉20碳酸钠溶液与氯化钙溶液反应: Na2CO3 + CaCl2 = 2NaCl + CaCO3↓现象生成白色碳酸钙沉淀5.酸+金属氧化物==盐+水211、铁锈与盐酸反应: Fe2O3+6HCl==2FeCl3+3H2O现象铁锈脱落溶解,溶液由无色变成黄色22铁锈与硫酸反应: Fe2O3+3H2SO4==Fe2SO43+3H2O现象铁锈脱落溶解,溶液由无色变成黄色23氧化铜与盐酸反应: CuO+2HCl==CuCl2+H2O 现象黑色粉末逐渐溶解,溶液由无色变成蓝色24氧化铜与硫酸反应: CuO+ H2SO4==CuSO4+H2O现象黑色粉末逐渐溶解,溶液由无色变成蓝色三、其他反应非金属氧化物+碱溶液==盐+水25氢氧化钙溶液与二氧化碳检验二氧化碳 CaOH2+ CO2== CaCO3↓+ H2O现象澄清石灰水变白色、浑浊,有白色沉淀CaCO3生成26氢氧化钠与二氧化碳反应:氢氧化钠变质、除去CO22NaOH+ CO2== Na2CO3 + H2O27氢氧化钠与二氧化硫反应:用氢氧化钠除去SO22NaOH+ SO2== Na2SO3 + H2O四、酸碱盐溶解口诀溶碱有五位,钾钠铵钡钙;钾钠铵盐均可溶,硝酸盐类也都溶;氯化物只有银不溶,硫酸盐只有钡不溶;碳酸盐只溶钾钠铵七大沉淀:。
初三酸碱盐八大反应规律

初三化学中,酸碱盐反应是非常重要的一部分,其中有8个反应规律,它们分别是:
1.酸和碱中和反应。酸和碱反应,生成盐和水。反应类型为:酸+碱→盐+水。
2.酸和碱金属反应。酸和碱金属反应,生成氢气、盐和水。反应类型为:酸+金属→氢气+盐。
3.酸和碳酸盐反应。酸和碳酸盐反应,生成盐、水和二氧化碳。反应类型为:酸+碳酸盐→盐+水+二氧化碳。
4.酸和金属氧化物反应。酸和金属氧化物反应,生成盐和水。反应类型为:酸+金属氧化物→盐+水。
5.酸和金属氢氧化物反应。酸和金属氢氧化物反应,生成盐和水。反应类型为:酸&#酸和金属的氧化还原反应,生成盐和氢气。反应类型为:酸+金属→盐+氢气。
7.碱和银盐反应。碱和银盐反应,生成银氧化物、水和碱金属盐。反应类型为:碱+银盐→银氧化物+水+碱金属盐。
酸碱盐和氧化物之间的反应-课件
A、消耗相同质量的氧化铜
B、 消耗相同质量的铁
C、消耗相同质量的硫酸
D、 生成硫酸亚铁的质量不同
哪一个方案更好?
,理由是
。
1、(问答题)就下列金属活动顺序表填空:
Sn Pb (H)
Pt Au
应用此表时要注意:
(1)
的金属能置换出酸里的氢,
换出酸里的氢。
的金属不能置
(2)只有 换出来。
金属,才能把
金属从它们的盐溶液里置
9、盐1+金属1→盐2+金属2
①盐1可溶 ②金属活动性顺序含义3 ③K、Ca、Na除外 ④Fe→亚铁盐
10、盐1+盐2→盐3+盐4 ①盐1、盐2可溶
②符合复分解反应发生的条件
11、酸性氧化物+水→含氧酸 (多数)
12、碱性氧化物+水→碱 (少数) 13、只有不溶性的碱受热才分解
练习:
1、下列转化通过一步不能实现的是( )
A、B可能是碱性氧化物
B、D不一定是碱
C、F一定是氯化银
D、B与A的反应一定属于中和反应
6、通过下列类型的反应:①化合反应;②分解反应;③置换反应; ④复分解反应,能产生二氧化碳的是( )
A、①④
B、①②④ C、①②③ D、四种反应都可以
7、有以下几种溶液:①NaCl ②MgSO4 ③NaOH ③
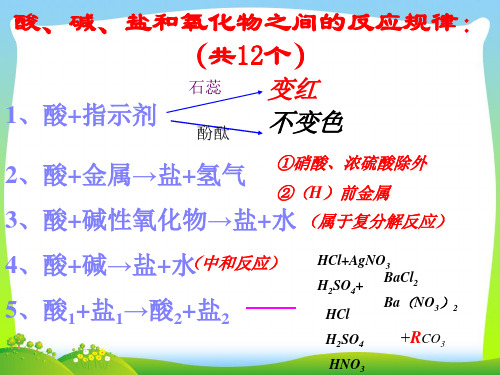
酸、碱、盐和氧化物之间的反应规律:
(共12个)
石蕊
1#43;金属→盐+氢气 ①硝酸、浓硫酸除外
②(H)前金属
3、酸+碱性氧化物→盐+水 (属于复分解反应)
4、酸+碱→盐+水(中和反应) 5、酸1+盐1→酸2+盐2
钠与酸碱盐溶液的反应(共20张PPT)

• 2Na+2H2O===2NaOH+H2↑ 【错因分析】 钠与酸反应受Na与水反应的影响,往往误以为钠先和水反应,然后产物再与酸反应,无论钠和水反应还是与酸反应,都是和H+反
应,所以钠与酸的反应是钠先与酸反应,酸反应完后与水反应。 总式为2Na+CuSO4+2H2O===Cu(OH)2↓+H2↑+Na2SO4
钠与酸反应的离子方程式:
2Na + 2H+ = 2Na+ + H2↑
思维拓展
• 2.若将金属钠投入到硫酸铜溶液中,能
否置换出铜来呢?
⑤加入酚酞,溶液变红--------金属钠与水(加了酚酞)反应的实验现象: 钠投入足量盐酸中反应的化学方程式是: 周围水雾的产生以及响声 【错因分析】 钠与酸反应受Na与水反应的影响,往往误以为钠先和水反应,然后产物再与酸反应,无论钠和水反应还是与酸反应,都是和H+反
• 钠是活泼金属,但与盐溶液反应时,不能置 换出盐中的金属,而是钠先和水反应生成 NaOH,看NaOH是否能和盐反应。
• 【正确解答】 D
• 课后知能检测:
• 1. 完成反应方程式:钠投入氯化铁溶液中
• 2 .将金属钠分别投入下列物质的溶液中, 有气体放出,且溶液质量减轻的有( )
• A.HCl
• B.K2SO4 • C.CuCl2 • D.饱和NaOH溶液
钠的保存
保存:为什么要 保存在煤油(或 石蜡油)中? 不和煤油反应,密 度比煤油大,能隔 绝空气和水。
思考:能否用手直接取用钠?
实质:钠先和水反应,生成的氢氧化钠再 盐反应。
与某些
2Na + 2H2O = 2NaOH + H2↑ 2NaOH + CuSO4 = Cu(OH)2↓+ Na2SO4
化学《酸碱盐》复习ppt课件

碱可以与酸性氧化物反应生成盐和水,如氢氧化 钠与二氧化碳反应生成碳酸钠和水。
3
与某些盐反应生成新盐和新碱
碱与某些盐反应可以生成新的盐和碱,如氢氧化 钠与硫酸铜反应生成氢氧化铜和硫酸钠。
碱的化学性质
01
02
03
04
碱具有碱性,可以与酸反应生 成盐和水。
碱可以与酸性氧化物反应生成 盐和水。
05 酸碱盐的反应规律
酸碱中和反应
总结词
酸碱中和反应是酸和碱反应生成盐和水的反应,是酸碱盐反应中的重要类型。
详细描述
酸碱中和反应的实质是氢离子与氢氧根离子结合生成水,同时生成对应的盐。 这类反应在化学实验和工业生产中广泛应用,如中和酸性废水、制备某些盐类 等。
盐与金属的反应
总结词
盐与金属的反应是金属与盐溶液反应生成另一种金属和另一 种盐的反应。
络合性
某些酸能够与金属离子络合形 成络合物,如硫酸铜、氯化铁
等。
03 碱的复习
碱的分类
氢氧化物
金属氢氧化物,如氢氧化钠、氢氧化钾等。
氨水
氨的水溶液,也属于碱类。
碱式盐
某些盐在水中发生水解反应,生成相应的碱,如 碱式碳酸铜等。
碱的通性
1 2
与酸反应生成盐和水
碱与酸反应生成对应的盐和水,这是碱的基本性 质。
和新盐。
碱的性质
具有碱性,能与酸反应生成盐和 水,能与某些盐反应生成新碱和 新盐,能与某些非金属氧化物反
应生成盐和水。
盐的性质
具有金属阳离子和酸根阴离子的 性质,能与某些金属反应生成新 金属和盐,能与某些酸反应生成 新盐和气体,能与某些碱反应生
成新盐和水。
02 酸的复习
单质氧化物酸碱盐之间的反应关系
4. 盐酸和氢氧化钙反应: 2HCl + Ca(OH)2 ==== CaCl2 + 2H2O
5. 盐酸和氢氧化铁反应: 3HCl + Fe(OH)3 ==== FeCl3 + 3H2O
6. 氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 ==== AlCl3 + 3H2O
7. 硫酸和烧碱反应:
变红色”,前者说法正确,后者说法错误。
(二)、酸与某些活泼金属反应,生成H2和盐。
金属单质 + 酸 -------- 盐 + 氢气 (置换反应)
【 注意 】
(1)浓硫酸和硝酸与活泼金属反应,不生成H2,而生 成H2O。
(2) 活泼金属指金属活动顺序表中,氢前面的金属。 (3) Fe参加置换反应,生成物中铁显+2价(亚铁离
3
CaCl2
Na2SO4
BaCl2
NaCl
CaO
Ca(OH)2
Ca(OH)2+CO2= CaCO3↓+H2O
CaCl2→CaCO
3
与Na2CO3、 K2CO3反应
CaCl2
CaCO3
CaCO3+2HCl= CaCl2+H2O+CO2↑
Ca(OH)2+2HCl= CaCl2+H2O
NaOH
CO2
Ca(OH)2
Na2CO3
NaNO Ba(OH)2 Cu(OH)2
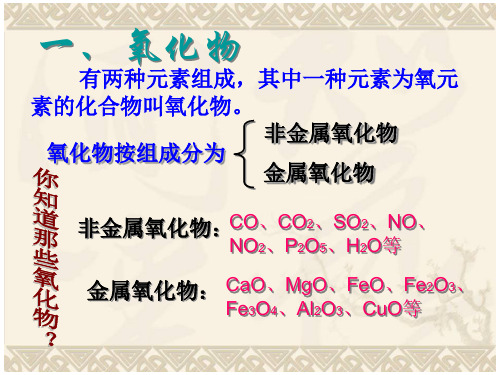
一、氧化物
有两种元素组成,其中一种元素为氧元
素的化合物叫氧化物。
氧化物按组成分为
非金属氧化物 金属氧化物
非金属氧化物:CO、CO2、SO2、NO、
NO2、P2O5、H2O等
酸和碱的中和反应

酸和碱的中和反应
实验仪器:烧杯、胶头滴管、玻璃棒
实验试剂:氢氧化钠溶液、稀盐酸、酚酞溶液
实验开始
实验步骤
一、在烧杯中加入氢氧化钠溶液,并滴入几滴酚酞溶液,用玻璃棒搅拌。
现象:溶液由无色变为红色
二、用胶头滴管慢慢滴加稀盐酸,并不断搅拌,直至溶液恰好变为无色。
实验现象:滴加稀盐酸的过程中,溶液由红色逐渐变为无色。
注意事项
指示剂的选择:选择酚酞是由于氢氧化钠滴入无色酚酞溶液,溶液变红,滴入盐酸恰好中和时溶液呈中性,变为无色(酚酞遇碱变红,遇酸不变色)。
若用紫色石蕊溶液,紫色石蕊溶液在碱性溶液中呈蓝色,在中性溶液中呈紫色,在酸性溶液中变红。
蓝色、紫色、红色间没有明显的区别。
实验结论
氢氧化钠能与盐酸反应,反应的化学式为:
HCl + NaOH == NaCl + H2O
酸碱盐水
2.中和反应的通式:酸 + 碱 == 盐 + 水。
最新中考化学-酸碱盐和氧化物-中和反应-图像

普通初中学业水平考试化学试题卷 第 1 页(共 6 页)(2018•赤峰)某化学小组利用数字化传感器探究稀盐酸和氢氧化钠溶液的反应过程,测得烧杯中溶液的pH 随滴加液体体积变化的曲线如图所示。
下列说法错误的是( )A. 该实验是将氢氧化钠溶液滴入稀盐酸中B. a 点所示溶液中,溶质只有NaClC. b 点表示稀盐酸和氢氧化钠溶液恰好完全反应D. 向点c 所示溶液中滴加紫色石蕊溶液,溶液变蓝色 (18梧州)18.某校化学兴趣小组利用数字化传感器探究稀盐酸和氢氧化钠溶液的反应过程,测得烧杯中溶液的pH 随滴加液体体积变化的曲线如右图所示。
下列说法错误的是( )A .图中b 点所示溶液中,溶质是NaCIB .向图中c 点所示溶液中滴加无色酚酞,溶液不变色C .该实验是将氢氧化钠溶液逐滴滴入到盛有稀盐酸的烧杯中D .由a 点到b 点的pH 变化过程证明酸和碱发生了中和反应(18扬州)19、向滴有酚酞的盐酸溶液中逐滴加入氢氧化钠溶液,所得溶液的pH 与加入溶液体积关系如右图所示。
下列说法正确的是A.反应过程中溶液温度降低B.A 点对应溶液的溶质为HCl 、NaClC.恰好完全反应时溶液显中性D.反应过程中溶液的颜色由红色变为无色(18益阳)17.某校化学小组在利用硫酸和氢氧化钠溶液探究酸碱中和反应时,测得烧杯中溶液 p H的变普通初中学业水平考试化学试题卷 第 2 页(共 6 页)化如图所示。
下列说法正确的是A .a 点所示溶液呈酸性B .向 b 点所示溶液中滴加石蕊溶液,溶液呈紫色C .该实验是将 N aOH 溶液逐滴滴入稀硫酸中D .c 点所示溶液中,含有的溶质是 N a 2SO 4 和 N aOH(18南京)13.下图为三种不同浓度的氢氧化钠溶液与对应浓度的盐酸反应的曲线。
下列说法正确的是A.在a 、b 、c 三种曲线所示的实验中,所用盐酸浓度越大,V 时所得溶液的pH 越大B .在a 曲线所示的实验中,若用酚酞做指示剂,酚酞溶液由红色变为无色C .在a 、b 、c 三种曲线所示的实验中,反应速率相同D .在a 、b 、c 三种曲线所示的实验中,溶液酸性由强到弱的顺序是a>b>c(18宁波)14. 向盛有20g10%氢氧化钠溶液的烧杯中逐滴滴入7.3%的稀盐酸,下列是关于溶液总质量或溶液pH 随盐酸质量变化的关系图(Q 点表示恰好完全反应)。
酸碱盐的相互转化

1、酸的化学性质(1)酸 + 金属 -------- 盐 + 氢气(见上)(2)酸 + 金属氧化物-------- 盐 + 水氧化铁和稀盐酸反应:Fe2O3 + 6HCl ==2FeCl3 + 3H2O氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 == Fe2(SO4)3 + 3H2O氧化铜和稀盐酸反应:CuO + 2HCl ==CuCl2 + H2O氧化铜和稀硫酸反应:CuO + H2SO4 == CuSO4 + H2O(3)酸 + 碱 -------- 盐 + 水(中和反应)盐酸和烧碱起反应:HCl + NaOH == NaCl +H2O盐酸和氢氧化钙反应:2HCl + Ca(OH)2 == CaCl2 + 2H2O氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 == AlCl3 + 3H2O 硫酸和烧碱反应:H2SO4 + 2NaOH == Na2SO4 + 2H2O(4)酸 + 盐 -------- 另一种酸 + 另一种盐大理石与稀盐酸反应:CaCO3 + 2HCl == CaCl2 + H2O + CO2↑碳酸钠与稀盐酸反应: Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑硫酸和氯化钡溶液反应:H2SO4 + BaCl2 == BaSO4 ↓+ 2HCl2、碱的化学性质(1)碱 + 非金属氧化物 -------- 盐 + 水苛性钠在空气中变质:2NaOH + CO2 == Na2CO3 + H2O苛性钠吸收二氧化硫气体:2NaOH + SO2 == Na2SO3 + H2O苛性钠收三氧化硫气体:2NaOH + SO3 == Na2SO4 + H2O消石灰放在空气中变质:Ca(OH)2 + CO2 == CaCO3 ↓+ H2O消石灰吸收二氧化硫:Ca(OH)2 + SO2 == CaSO3 ↓+ H2O(2)碱 + 酸-------- 盐 + 水(中和反应,方程式见上)(3)碱 + 盐 -------- 另一种碱 + 另一种盐氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH 3、盐的化学性质(1)盐(溶液) + 金属单质------- 另一种金属 + 另一种盐铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu(2)盐 + 酸-------- 另一种酸 + 另一种盐碳酸钠与稀盐酸反应: Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑(3)盐 + 碱 -------- 另一种碱 + 另一种盐氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH(4)盐 + 盐 ----- 两种新盐氯化钠溶液和硝酸银溶液:NaCl + AgNO3 == AgCl↓ + NaNO3硫酸钠和氯化钡:Na2SO4 + BaCl2 == BaSO4↓ + 2NaClZn+H2SO4=ZnSO4+H2↑有大量气泡产生、锌粒逐渐溶解实验室制备氢气Fe+H2SO4=FeSO4+H2↑有大量气泡产生、金属颗粒逐渐溶解Mg+H2SO4 =MgSO4+H2↑有大量气泡产生、金属颗粒逐渐溶解2Al+3H2SO4=Al2(SO4)3+3H2↑有大量气泡产生、金属颗粒逐渐溶解Fe2O3+3H2 Δ 2Fe+3H2O 红色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性Fe3O4+4H2 Δ3Fe+4H2O 黑色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性WO3+3H2Δ W +3H2O 冶炼金属钨、利用氢气的还原性MoO3+3H2 ΔMo +3H2O 冶炼金属钼、利用氢气的还原性2Na+Cl2Δ或点燃2NaCl 剧烈燃烧、黄色火焰离子化合物的形成H2+Cl2 点燃或光照 2HCl 点燃苍白色火焰、瓶口白雾共价化合物的形成、制备盐酸CuSO4+2NaOH=Cu(OH)2↓+Na2SO4 蓝色沉淀生成、上部为澄清溶液质量守恒定律实验2C +O2点燃2CO 煤炉中常见反应、空气污染物之一、煤气中毒原因2C O+O2点燃2CO2 蓝色火焰煤气燃烧C + CuO 高温2Cu+ CO2↑黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体冶炼金属2Fe2O3+3C 高温4Fe+ 3CO2↑冶炼金属Fe3O4+2C高温3Fe + 2CO2↑冶炼金属C + CO2 高温2COCO2 + H2O = H2CO3 碳酸使石蕊变红证明碳酸的酸性H2CO3 ΔCO2↑+ H2O 石蕊红色褪去Ca(OH)2+CO2= CaCO3↓+ H2O 澄清石灰水变浑浊应用CO2检验和石灰浆粉刷墙壁CaCO3+H2O+CO2 = Ca(HCO3)2 白色沉淀逐渐溶解溶洞的形成,石头的风化Ca(HCO3)2Δ CaCO3↓+H2O+CO2↑白色沉淀、产生使澄清石灰水变浑浊的气体水垢形成.钟乳石的形成2NaHCO3ΔNa2CO3+H2O+CO2↑产生使澄清石灰水变浑浊的气体小苏打蒸馒头CaCO3 高温 CaO+ CO2↑工业制备二氧化碳和生石灰CaCO3+2HCl=CaCl2+ H2O+CO2↑固体逐渐溶解、有使澄清石灰水变浑浊的气体实验室制备二氧化碳、除水垢Ba(OH)2+ H2SO4=BaSO4↓+2H2O 生成白色沉淀、不溶解于稀硝酸检验SO42—的原理 BaCl2+H2SO4=BaSO4↓+2HCl 生成白色沉淀、不溶解于稀硝酸检验SO42—的原理Ba(NO3)2+H2SO4=BaSO4↓+2HNO3 生成白色沉淀、不溶解于稀硝酸检验SO42—的原理1、与非金属单质(如Cl2 、 O2 )的反应:2Na + Cl2 = 2NaCl4Na + O2 = 2Na2O2Na + O2 == Na2O22、钠与水的反应:2Na + 2H2O =2NaOH + H2↑钠在反应中失去电子,表现出还原性。
化学 酸碱盐氧化物关系图(整理简洁版)

复分解反应,生成物有水
精选ppt
11
非金属氧化物+水
CO2+H2O SO3+H2O
酸(含氧酸)
H2CO3 H2SO4
精选ppt
12
碱+非金属氧化物=盐+H2O
2NaOH+SO3=Na2SO4+H2O 2NaOH+CO2=Na2CO3+H2O
Ca(OH)2+CO2=CaCO3↓+H2O 2KOH+SO2=K2SO3+H2O
+酸 +盐ห้องสมุดไป่ตู้
+盐 +碱
盐
精选ppt
盐
4
点燃
金属+氧气 或△ 金属氧化物
2Mg+O2点燃 2MgO
4Al +3O2 点燃 2Al2O3
3Fe+2O2 点燃 Fe3O4
2Cu +O2 △ 2CuO
精选ppt
5
金属氧化物+水
CaO+H2O Na2O+H2O
碱(可溶)
Ca(OH)2 2NaOH
精选ppt
6
并且反应物要全溶才能反应!
精选ppt
17
Mg(OH)2+Na2CO3≠
Al(OH)3+FeCl3≠
解释:因为反应物有沉 淀存在,不能进行
精选ppt
18
盐 + 盐 = 新盐 + 新盐
AgNO3+NaCl=AgCl↓ +NaNO3
CaCl2+Na2CO3=CaCO3↓+2NaCl
Ba(NO3)2+Na2CO3=BaCO3↓+2NaNO
酸、碱、盐反应的条件

小葳[圣人]1.酸与碱的反应反应条件:盐酸、硝酸、硫酸这三种强酸可以跟任何碱(无论可溶还是不溶)发生中和反应。
如:NaOH+HClNaCl+H2O(可溶)Cu(OH)2+2HClCuCl2+2H2O(不溶)2.碱与盐的反应反应条件:参加反应的碱和盐都必须可溶,反应在溶液里进行,生成物中有难溶性的碱或盐,或有气体产生。
如:Ca(OH)2+Na2CO3CaCO3↓+2NaOHNH4Cl+NaOHNaCl+H2O+NH3↑CuCl2+2KOHCu(OH)2↓+2KClFe(OH)3+KCl不反应,因Fe(OH)3不溶。
NaOH+KCl不反应,因为没有难溶物质或气体产生。
3.盐与盐的反应与碱跟盐的反应条件相似,即参加反应的两种盐都必须可溶,反应在溶液里进行,生成的两种盐至少有一种不溶。
例如:K2CO3+CaCl2CaCO3↓+2KClAgCl+Mg(NO3)2不反应,因AgCl不溶。
Cu(NO3)2+AlCl3不反应,因为没有难溶的盐生成。
4.盐与酸的反应(1)强酸与弱酸形成的盐能反应。
如:MgCO3+2HClMgCl2+CO2↑+H2OFeS+H2SO4(稀)FeSO4+H2S↑(2)难挥发性碱与易挥发性酸形成的盐能反应。
如:2NaCl(固)+H2SO4(浓)Na2SO4+2HCl↑NaNO3+H2SO4(浓)NaHSO4+HNO3↑Na2SO4+HCl不反应,因HCl是挥发性酸,而Na2SO4是由难挥发性酸形成的盐。
(3)生成的盐既不溶于水也不溶于反应中产生的酸,则复分解反应可以发生。
如:AgNO3+HClAgCl↓+HNO3BaCl2+H2SO4BaSO4↓+2HClCuSO4+H2SCuS↓+H2SO4说到这儿,有的同学可能会问:碱性氧化物跟酸的反应、酸性氧化物跟碱的反应是不是复分解反应。
首先看碱性氧化物跟酸的反应。
反应条件:一般地说,可溶性的碱性氧化物常温下就能跟盐酸、硝酸、硫酸三种强酸反应,不溶性的碱性氧化物与这些酸反应需加热。
