培养基验收记录
培养基和试剂技术性验收原始记录

培养基和试剂技术性验收原始记录首先,对于培养基的技术性验收,需要记录以下内容:1.培养基的名称和批号:每一种培养基都有一个唯一的名称和批号,这对于追溯实验结果的准确性非常重要。
2.外观检查:记录培养基的颜色、透明度、结块情况等外观特征。
正常的培养基应该是清晰透明的,没有结块或沉淀。
3.pH值测试:记录培养基的pH值,一般应该在特定范围内,通常为7.0-7.44.细菌检测:进行无菌测试,使用无菌培养基接种并观察是否有细菌生长。
如果有细菌生长,则说明培养基不符合无菌要求。
5.加水溶解性测试:记录培养基加水后的溶解性,检查是否完全溶解。
6.水分含量测试:通过称量和干燥的方法,测定培养基中的水分含量。
正常的培养基应该在合理的水分范围内,通常为5-10%。
7.细胞生长性能测试:使用特定的细胞系进行培养试验,观察细胞的生长情况,并记录生长速度和细胞密度的变化。
除了对于培养基的技术性验收,还需要对试剂进行技术性验收,记录以下内容:1.试剂的名称和批号:每一种试剂都有一个唯一的名称和批号,这对于追溯实验结果的准确性非常重要。
2.外观检查:记录试剂的颜色、透明度、结晶情况等外观特征。
正常的试剂应该是无色透明的,无结晶或沉淀。
3.纯度检测:根据试剂的性质和用途,进行适当的纯度检测。
例如,对于一些药物试剂,可以使用液相色谱法进行纯度检测。
4.溶解性测试:记录试剂在特定溶剂中的溶解情况,检查试剂是否能够完全溶解。
5.重量测定:使用天平对试剂进行称量,记录试剂的质量。
6.折射率测试:使用折射仪测定试剂的折射率,以评估试剂的纯度和浓度。
7.活性测试:对于具有特定生物活性的试剂,例如酶或抑制剂,可以进行相应的活性测试,以检查试剂的活性是否符合预期。
在记录培养基和试剂的技术性验收原始记录时,应该详细地记录每一步的操作过程、结果和观察,并及时记录异常情况和处理方法。
同时,应该确保原始记录的完整性和可追溯性,以便在需要时进行复查和审查。
实验室制备培养基测试结果记录单

实验室制备培养基测试结果记录单
记录单的格式可以根据实验室需求进行灵活调整,下面是一个示例:--------------
--------------
培养基名称:示例培养基
成分:
-纯水:500mL
-蛋白胨:10g
-葡萄糖:5g
-碳酸氢钠:1g
-磷酸二氢二钠:0.5g
-氯化钠:5g
-硫酸镁:0.5g
制备过程:
1.将纯水加热至80℃,并搅拌均匀。
2.加入蛋白胨,葡萄糖,碳酸氢钠,磷酸二氢二钠,氯化钠和硫酸镁,继续搅拌至溶解。
3.调整pH值至7.0。
4.通过0.2μm滤膜过滤,将培养基装入无菌瓶中。
测试方法:
1.准备无菌培养皿,每个培养皿装入约20mL培养基。
2.采用无菌技术将待测试菌株接种于培养皿中。
3.烘箱培养,温度设定为37℃,时间为24小时。
4.观察培养结果,记录菌落形态、颜色和数量等信息。
5.根据培养结果评估培养基的质量和适用性。
测试结果:
菌落形态:典型的菌落形态,呈现圆形、凹陷的形态。
菌落颜色:白色
菌落数量:在培养皿中可见约50个菌落。
评估结果:培养基质量良好,适用于该菌株的培养。
备注:由于示例培养基与不同菌株的适用性可能有所差异,建议在使用前进行更详细的测试。
-----------
这是一个简单的实验室制备培养基测试结果记录单示例,实际操作与记录单的内容可根据实验室需求进行调整和补充。
通过记录单,可以及时了解培养基的质量和适用性,为实验室提供高质量的培养环境。
培养基和试剂技术性验收记录

○其他:
仪器设备
○生物安全柜
○培养箱
○酸度计
外观
○密封完整○粉末○颗粒○均一○流动性好
○色泽:○其他:
pH值
最初:最终:
适用性
○无菌性○促生长能力○抑制能力○指示能力
○孔径大小○环氧乙烷残留○其他
回收率:○≥70%○<70%
质控菌株:
○大肠埃希菌○金黄色葡萄球菌○沙门氏菌○铜绿假单胞菌
培养基和试剂技术性验收记录(总1页)
生物检定和微生物检查用培养基验收记录
使用科室
批号
接收时间
年月日
添加剂
生产厂家
数量、单位
启封时间
年月日
技术资料
○合格证明○质控证书或检验报告(○纸质○电子文件)
○处方与要求一致○包装完整○有效期内
验收方法
及标准
○企业资料○《中国药典》
○白色念珠菌○其他:
对照培养
基名称
生产厂家
验证结论
○合格○不合格
记录日期
处理方法
○接收○退货○废弃○损耗
记录人
备注
培养基适用性检查记录
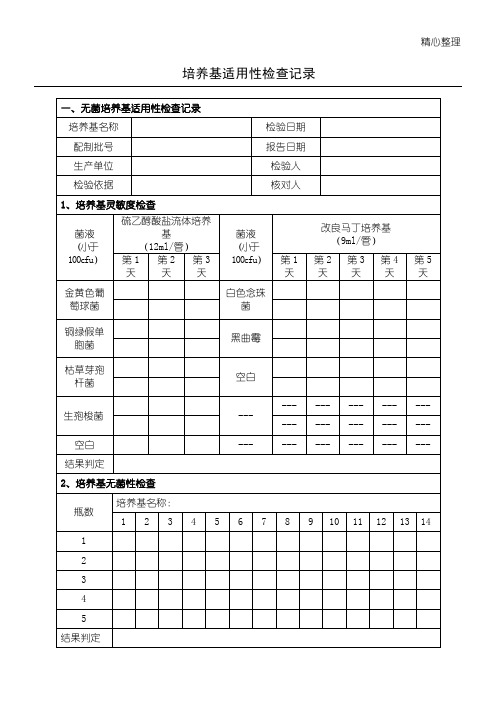
精心整理培养基适用性检查记录一、无菌培养基适用性检查记录培养基名称检验日期配制批号报告日期生产单位检验人检验依据核对人1、培养基灵敏度检查菌液(小于100cfu)硫乙醇酸盐流体培养基(12ml/管)菌液(小于100cfu)改良马丁培养基(9ml/管)第1天第2天第3天第1天第2天第3天第4天第5天金黄色葡萄球菌白色念珠菌铜绿假单胞菌黑曲霉枯草芽孢杆菌空白生孢梭菌--- --- --- --- --- --- --- --- --- --- ---空白--- --- --- --- --- --- 结果判定2、培养基无菌性检查瓶数培养基名称:1 2 3 4 5 6 7 8 9 10 11 12 13 1412345 结果判定培养基适用性检查记录二、计数培养基适用性检查记录培养基名称检验日期配制批号报告日期生产单位检验人检验依据核对人培养基灵敏度检查菌液(小于100cfu)营养琼脂培养基对照培养基24h 48h 24h 48h大肠埃希菌金黄色葡萄球菌枯草芽孢杆菌菌液(小于100cfu)玫瑰红钠琼脂培养基对照培养基24h 48h 72h 24h 48h 72h白色念珠菌黑曲霉菌液(小于100cfu)酵母浸出粉胨葡萄糖琼脂培养基对照培养基24h 48h 72h 24h 48h 72h白色念珠菌结果判定培养基适用性检查记录三、控制菌检查用培养基适用性检查记录培养基名称检验日期配制批号报告日期生产单位检验人检验依据核对人促生长能力检查菌液(小于100cfu)培养基对照培养基24h 48h 72h 24h 48h 72h结果判定抑制能力检查菌液(小于100cfu)培养基24h 48h 72h结果判定指示能力检查菌液(小于100cfu)培养基对照培养基24h 48h 72h 24h 48h 72h结果判定。
无菌检查培养基无菌性检查记录

3、实验:
每批培养基随机取不少于5支(瓶),置各培养基规定的温度培养14天,应无菌生长。
天培养基
1
2
3
4
5
6
7
8
9
10
11
12
13
14
硫乙醇酸盐
硫体培养基
胰酪大豆胨
液体培养基
说明:“+”表示生长,“-”表示未生长。
4、结论:本次所检培养基,该培养基适用性规定。
检验人: 复核人:
无菌检查培养基无菌性检查记录
记录编号:SOபைடு நூலகம்-ZL-035-A/0
检验项目
无菌检查培养基适用性检查
检验依据
《中国药典》2015年版。
检验日期
完成日期
1、实验用培养基:
名 称
生产厂家
批 号
规格
硫乙醇酸盐流体培养基
胰酪大豆胨液体培养基
2、实验用仪器设备
□立式压力蒸汽灭菌器 型号:编号:
□电热恒温培养箱型号:编号:
培养基适用性检查记录A

培养基适用性检查记录培养基名称:营养琼脂培养基样品培养基:批号:包装规格:数量:生产厂家:对照培养基:批号:包装规格:制造单位:国家食品药品检定研究院1.1 检查方法:中国药典2010版二部附录XI J1.2 验证方法:中国药典2010版二部附录XI J2.、计数方法验证2.1菌种:大肠埃希菌〔CMCC (B) 44 102〕金黄色葡萄球菌〔CMCC (B)26 003〕枯草芽孢杆菌〔CMCC (B)63 501〕2.2菌液制备2.2.1取经35℃培养22小时金黄色葡萄球菌、大肠埃希菌和枯草芽孢杆菌的肉汤培养物,用0.9%无菌氯化钠溶液制成1ml含菌为50~100cfu的菌悬液,做活菌计数用。
2.3培养基适用性检查2.3.1 取大肠埃希菌、金黄色葡萄球菌、枯草芽孢杆菌各50~100cfu,分别注入无菌平皿中,立即倾营养琼脂样品培养基,每株试验菌平行制备2个平皿,混匀,凝固,置35℃培养48小时计数。
结果见表2-A。
2.3.2取大肠埃希菌、金黄色葡萄球菌、枯草芽孢杆菌各50~100cfu,分别注入无菌平皿中,立即倾营养琼脂对照培养基,每株试验菌平行制备2个平皿,混匀,凝固,置35℃培养48小时计数。
结果见表2-A。
2.4 表2-A 培养基适用性检查培养结果检验标准:被检培养基的菌落数与对照培养基菌落数相比大于70%,且菌落形态大小应与对照培养基上的菌落一致。
判该培养基的适用性检查符合规定。
结果判定:______________________________________________实验人:复核人:年月日年月日培养基适用性检查记录培养基名称:玫瑰红钠培养基样品培养基批号:包装规格:数量:生产厂家:对照培养基批号:包装规格:制造单位:国家食品药品检定研究院1.1检查方法:中国药典2010版二部附录XI J1.2验证方法:中国药典2010版二部附录XI J2.、计数方法验证2.1菌种:白色念珠球菌〔CMCC (B)98 001〕黑曲霉〔CMCC (B)98 003〕2.2菌液制备2.2.1取经25℃培养24小时白色念珠球菌改良马丁液体培养物,用0.9%无菌氯化钠溶液制成1ml含菌为50~100cfu的菌悬液,做活菌计数用。
培养基和试剂技术性验收记录

○其他:
仪器设备
○生物安全柜
○培养箱
○酸度计
外观
○密封完整 ○粉末 ○颗粒 ○均一 ○流动性好
○色泽: ○其他:
pH值
最初: 最终:
适用性
○无菌性 ○促生长能力 ○抑制能力 ○指示能力
○孔径大小 ○环氧乙烷残留○其他
回收率:○≥70% ○<70%
质控菌株:
○大肠埃希菌 ○金黄色葡萄球菌 ○沙门氏菌 ○铜绿假单胞菌
培养基和试剂技术性验收记录
生物检定和微生物检查用培养基验收记录
使用科室:第 页 共 页
培养基
(器)名称
生产厂家
批号接收时间年 月 日 Nhomakorabea添加剂
生产厂家
数量、单位
启封时间
年 月 日
技术资料
○合格证明○质控证书或检验报告(○纸质○电子文件)
○处方与要求一致○包装完整○有效期内
验收方法
及标准
○企业资料○《中国药典》
○白色念珠菌 ○其他:
对照培养
基名称
生产厂家
验证结论
○合格○不合格
记录日期
处理方法
○接收○退货○废弃○损耗
记录人
备注
商品化培养基验收记录

商品化培养基验收记录1.验收目的验收商品化培养基的质量是否符合相关标准和规定,确保商品化培养基的质量稳定可靠,以满足科研和生产的需要。
2.验收范围本次验收针对批次商品化培养基,包括生产商提供的所有相关文件和资料。
3.验收标准4.验收步骤(1)查看生产商提供的相关文件,包括商品化培养基的生产工艺、质量控制规定、质量检验记录等。
(2)外观检验:检查商品化培养基的包装是否完好,无漏气、无污染等情况。
(3)理化性质检验:对商品化培养基的pH值、透明度、溶解度等进行测定,并与产品说明书中的标准进行比对。
(4)微生物检验:按照国家相关标准进行微生物检验,包括总菌落计数、大肠菌群检验、黄曲霉素检测等,确保商品化培养基不含有害菌群和致病因子。
(5)环境指标检验:对商品化培养基进行环境监测,检测是否存在有害气体、重金属等污染物。
5.验收记录(1)商品化培养基名称:XXX(2)生产商:XXX公司(3)验收日期:XXXX年XX月XX日(4)验收人员:XXX、XXX(5)外观检验结果:外包装完好,无漏气、无污染。
(6)理化性质检验结果:pH值符合标准要求(在X到X之间),透明度符合标准要求,溶解度符合标准要求。
(7)微生物检验结果:总菌落计数符合标准要求(在X到X之间),大肠菌群检验阴性,黄曲霉素检测阴性。
(8)环境指标检验结果:无害气体、重金属等污染物超过标准。
(9)验收结论:本批次商品化培养基质量符合标准要求,可以销售和使用。
6.验收结论本次验收结果显示,该批次商品化培养基质量稳定可靠,符合相关标准要求,可以销售和使用。
经验收合格后,可将其纳入实验室或生产车间的常备培养基品种,并妥善保存,保证质量的稳定。
同时,在日常使用过程中仍需对其进行常规的质量控制,以确保商品化培养基在使用过程中质量的稳定性。
通过以上的商品化培养基验收记录,可以对商品化培养基的质量进行全面的评估和检验,为后续的科研和生产提供质量可靠的培养基,同时也为生产商提供改善和优化产品质量的参考依据。
培养基适用性检查记录

培养基适用性检查记录一、检查目的本次检查的目的是评估所使用的培养基是否适合对特定微生物进行培养和繁殖。
检查结果可为后续的微生物实验提供方向和参考。
二、检查方法本次检查采用以下方法:1.选择微生物选择符合实验要求的微生物进行检查,包括菌株、菌液或真菌等。
2.选择培养基根据微生物的特性和需要,选择适合该微生物的常用或特殊培养基。
3.参数标准对所选定的培养基进行相关参数测定,如pH值、温度、光照、含量等,以衡量该培养基的性质和适用性。
4.培养实验设计将所选的微生物分别培养于不同的培养基下,设置对照组和实验组,观察每个样本在不同培养基下的生长情况和特性。
5.结果分析对各个实验组和对照组进行结果统计和分析,比较培养基对微生物生长情况的影响,初步评估其适用性。
三、检查结果根据以上检查方法所得实验结果,如下:1.培养基A该培养基对微生物生长效果显著,能够促进菌种生长,细菌数量有明显增加。
但对真菌等其他微生物适应性较差。
2.培养基B该培养基对某些细菌有富集效应,能够分离出比较难培养的菌种。
但对其他微生物适应性较差。
3.培养基C该培养基综合适用性较好,对各类微生物均有一定的培养效果。
同时,培养基的含量和温度等因素需进行相关调整。
四、根据以上实验结果,我们初步评估出所使用培养基C是该微生物的最佳选择,具有较好的适应性和稳定性。
但还需对其调整不同参数指标,以获得更好的培养效果。
同时,在实验中仍需注意控制其他因素的干扰,以保证结果的准确性和可信度。
五、备注本次检查结果仅供参考,实际实验中需根据具体微生物特性和实验条件进行相应调整和改进。
培养基灵敏度检验记录

空 (白 不对 接 种)
白色念珠 菌
黑曲霉
空白对照 (不接种)
1
2
3
4
备注: 培5 养结 果阳性用“+”
培养皿编号 24H菌落数 48测试
1
2
3
结果判定(Result):
检 测/
复核/日 期:
生效日期:2016年05月18日
2.2
取每管装量9ml的TSB培养基5支,分别接种小于100cfu的白色念珠菌、黑曲霉各2支,另1支不接种作为空 白对照,培养5天,逐日观察结果并记录.
3. 培养情况
培养仪器 培养箱编号
生化培养箱
校验有效期至
培养温度
30℃~35℃
23℃~28℃
天数
菌种 金黄色葡萄球 菌
铜绿假单胞 菌
枯草芽孢杆 菌
生孢梭 菌
KANGGU
嘉兴康谷医用材料有限公司
产品描述
培养基灵敏度检查记录
批号
QMR-098-00
数量
生产商
检测依据
2010版中国药典
检测日期
1. 检金测黄用色菌葡种萄球 菌
铜绿假单胞菌
枯草芽孢杆菌 生孢梭菌
白色念珠菌
黑曲霉
2. 程序
2.1
取每管装量为12ml的TSB培养基9支,分别接种小于100cfu 的金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢 杆菌、生孢梭菌各2支,另1支不接种作为空白对照,培养3天,逐日观察结果并记录.
培养基和试剂技术性验收原始记录

培养基和试剂技术性验收原始记录
生产厂商
编号/批号
生产日期
有效期
数量
接收日期
接收文件 感官判断
□企业文件 □合格证明 □外包装完整 □粉末 □均匀 □色泽 □其他
检测日期
技术验收 □GB 4789.28-2013
判断依据 □
□标识清楚 □密封完好
□颗粒
□液态
□选择性 □非选择性
对照GB 4789.28-2013表E
备注
检验员:
复核:
□固体培养基 培养基类型 □液体培养基
□试剂 □其他
目标菌:
划16线G= 形状: 直径: □稠密 □稀疏
验收结果 非目标菌:
划6线G= 形状: 直径: □稠密 □稀疏
标准限值 G1≥6 G2≤1
验收结论
不合格 处理方法
□合格 □不合格
目测浊度值: □0 澄清 □1 略浊 □2 混浊 □接种生长良好
目测浊度值: □0 澄清 □1 略浊 □2 混浊 □接种生长良好
无菌培养基的适用性检查记录

无菌培养基的适用性检查记录培养基:1.硫乙醇酸盐流体培养基批号:_______________ 检验日期:2.改良马丁培养基批号:_______________ 完成日期:以上均为符合药典规定的干燥培养基。
由北京三药科技开发公司生产。
中国药品生物制品检定所监制。
一、培养基的无菌性检查培养温度:硫乙醇酸盐流体培养基℃改良马丁培养基℃注:“+”为生长,“-”为不生长二、培养基的灵敏度检查1.菌液制备:(1)金黄色葡萄球菌新鲜肉汤培养物1ml [CMCC(B)26003] 第_____代9ml0.9%无菌NaCl溶液10倍系列稀释至_______含菌量_______CFU/ml(2)枯草芽孢杆菌新鲜肉汤培养物1ml [CMCC(B)63501]第_____代9ml0.9%无菌NaCl溶液10倍系列稀释至_______含菌量_______CFU/ml(3)铜绿假单胞菌新鲜肉汤培养物1ml [CMCC(B) 10104]第_____代9ml0.9%无菌NaCl溶液10倍系列稀释至_______含菌量_______CFU/ml(4)生孢梭菌新鲜硫乙醇酸盐培养物1ml [CMCC(B)64941]第_____代9ml0.9%无菌NaCl溶液10倍系列稀释至_______含菌量_______CFU/ml(5)白色念珠菌新鲜改良马丁培养物1ml [CMCC(F)98001]第_____代9ml0.9%无菌NaCl溶液10倍系列稀释至_______含菌量_______CFU/ml(6)黑曲霉新鲜孢子洗脱液1ml [CMCC(F)98003]第_____代9ml0.9%无菌NaCl溶液10倍系列稀释至_______含菌量_______CFU/ml2. 检查结果细菌培养温度____℃ 3天霉菌及酵母菌培养温度____℃ 5天注:“+”为生长,“-”为不生长三、结论:本品按《中华人民共和国药典2005年版(二部)》附录无菌检查法培养基的适用性检查,结果_______________。
培养基适用性检查记录

培养基适用性检查记录一、实验目的本实验旨在检查培养基的适用性,包括其成分是否合适、无污染、无毒性,并能够提供对所需生物体的适宜环境。
二、实验材料和仪器1.培养基样品:包括液体培养基和固体培养基。
2.培养基成分:包括蛋白胨、琼脂、糖类、无机盐等。
3.实验生物体:包括细菌、酵母菌等。
4.培养基制备器具:包括培养皿、试管、移液器、烧杯等。
5.实验室基本设备:包括电子天平、离心机、恒温培养箱等。
三、实验步骤1.培养基成分检查首先,检查培养基成分的符合度。
查阅培养基配方,并逐一准备并称量所需成分。
使用电子天平进行称量,确保称量准确。
检查成分是否存在误差,是否符合配方要求。
2.培养基配制检查根据培养基配方,准备液体培养基和固体培养基。
对液体培养基,按照配方将成分溶解在适量的蒸馏水中,并进行调pH处理。
对固体培养基,将成分溶解在蒸馏水中,并加入适量的琼脂糖或琼脂进行制成。
3.培养基无菌检查将配制好的培养基分别装入培养皿或试管中,并在恒温箱中进行高温高压灭菌处理。
灭菌结束后,在无菌操作台上进行无菌条件下的检查。
观察培养基是否有异常物质存在,如颜色变化、气泡、异味等。
4.培养基毒性检查将培养基分别接种相应的生物体,观察生物体的生长情况及有无异常现象。
观察时间可根据生物体的生长周期安排。
5.培养基成分调整及检查根据对培养基适用性的判断,如发现培养基的补充成分不足,或适用生物体的无法正常生长,可以对培养基的配方进行调整。
通过增加或减少特定成分的用量,或替换一些成分,再进行上述实验步骤进行再次检查。
四、实验结果和分析经过以上实验步骤,我们对培养基的适用性进行检查,并对实验结果进行记录和分析。
1.培养基成分符合度:通过称量成分的准确性和配方的符合度,可以判断培养基成分是否合适。
2.培养基配制检查:根据液体培养基和固体培养基的制备步骤,以及配方的准确性,可以判断培养基的配制是否正确。
3.培养基无菌检查:通过观察培养基灭菌后是否有异常现象,如颜色变化、气泡、异味等,可以判断培养基是否无菌。
培养基实验验收记录

培养基实验验收记录第页/共页培养基名称营养琼脂培养基、TSA、菌落计数培养基、检验日期卵磷脂-吐温80-营养琼脂培养基一、实验器材1.试验菌株名称:金黄色葡萄球菌,菌株号:GFH5823,培养代数代,普通琼脂斜面培养基培养,培养温度℃,培养时间:20 年月日时到20 年.月日时。
2.营养琼脂培养基,生产厂家批号:,见《培养基配制记录表》。
3. TSA,生产厂家批号:,见《培养基配制记录表》。
4.菌落计数培养基,生产厂家批号:,见《培养基配制记录表》。
5.卵磷脂-吐温80-营养琼脂培养基,生产厂家,批号:,见《培养基配制记录表》。
6. 磷酸盐缓冲液(PBS,0.03mol/L,PH7.2):按《消毒技术规范》(2002年版)附录A配制。
见《实验试剂配制记录表》。
二、方法1.用5mLPBS将金黄色葡萄球菌从普通培养基上洗下,取0.1mL菌悬液至5mLPBS中(约108CFU/mL),10倍系列稀释至10-6、10-7、10-8、10-9,取各稀释度1.0mL,接种到4种被检培养基中(倾注法)培养,一式二份。
选取30 CFU/皿~300CFU/皿稀释度及上下各一稀释度计数,并观察金黄色葡萄球菌在被检培养基上的生长情况。
2.培养温度:℃,培养时间:年月日时到月日时。
3.结果评价:菌落形态正常。
计算稀释度间误差率,并以30 CFU/皿~300CFU/皿稀释度计算菌悬液菌数(CFU/mL)及培养基间误差率,要求不超过10%。
第页/共页三、结果1. 金黄色葡萄球菌在被检培养基上的生长情况①营养琼脂培养基:②TSA:③菌落计数培养基:④卵磷脂-吐温80-营养琼脂培养基:阴性对照:注:各稀释度的菌落数(CFU/mL)=平皿平均菌落数(cfu/皿)/稀释度第页/共页3.结果计算注:计算公式:释度间误差率按《消毒技术规范》(2002年版)2.1.1.3.4(2),培养基间误差率如下:培养基间误差率(%)=[(4种培养基均值-被检培养基菌数)/4种培养基均值]×100四、结论1.营养琼脂培养基:试验菌在该培养基中生长,满足实验要求。
培养基适用性检查记录

培养基适用性检查记录质量部培养基名称:沙氏葡萄糖琼脂培养基来源:批号:对照培养基:来源:批号:检验依据:检验人:检验日期:一、实验菌种:白色念珠菌[CMCC(F)98 001]第代黑曲霉[CMCC(F)98 003]第代二、菌液制备将白色念珠菌接种于沙氏葡萄糖琼脂培养基上,20~25℃培养5~7天;取上述培养物用0.9%无菌氯化钠溶液稀释至10-5~10-7,制成50~100cfu/ml的菌悬液。
将黑曲霉接种于沙氏葡萄糖琼脂培养基上,20~25℃培养5~7天。
加入3-5ml含0.05%(ml/ml)聚山梨酯80的0.9%无菌氯化钠溶液稀释至10-5~10-7,制成50~100cfu/ml的菌悬液。
三、培养基适用性检查取5个无菌平皿,分别接种白色念珠菌、黑曲霉各2皿,每皿接种1ml菌液(含菌适宜浓度),另一皿接种1ml PH7.0氯化钠-蛋白胨缓冲液作为空白对照,倾注对照沙氏葡萄糖琼脂培养基,混匀。
凝固后倒置培养,20-25℃培养5天计数。
被检培养基同法操作。
四、结果判断五、结论本品按《中国药典》2015年版“非无菌产品微生物检查:微生物计数法”及培养基适用性检验操作规程检验,结果:□符合规定□不符合规定。
培养基名称:胰酪大豆胨琼脂培养基来源:批号:对照培养基:来源:批号:检验依据:检验人:检验日期:一、实验菌种:金黄色葡萄球菌[CMCC(B)26 003]第代铜绿假单胞菌[CMCC(B)10 104]第代枯草芽孢杆菌[CMCC(B)63 501]第代白色念珠菌[CMCC(F)98 001]第代黑曲霉[CMCC(F)98 003]第代二、菌液制备将金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌分别接种于胰酪大豆胨液体培养基中,30~35℃培养18~24 小时;取上述培养物用0.9%无菌氯化钠溶液稀释至10-5~10-7,制成50~100cfu/ml的菌悬液。
将白色念珠菌接种于沙氏葡萄糖琼脂培养基上,20~25℃培养5~7天;取上述培养物用0.9%无菌氯化钠溶液稀释至10-5~10-7,制成50~100cfu/ml的菌悬液。
培养基和试剂技术性验收记录

培养基和试剂技术性验收记录1.基本信息培养基名称:生产日期:生产厂家:批号:验收人:2.观察外观(1)观察验收的培养基外观是否清澈透明,无悬浮物和颜色变化;(2)观察培养基是否结晶、变色或凝固。
3.pH值测定使用pH计或试纸测定培养基的pH值,记录测得的数值。
4.渗透压测定(1)使用折射仪或渗透压计测定培养基的渗透压;(2)与生产厂家提供的标准值进行对比,判定培养基的质量。
5.抗生素灭菌效果测试(1)取一定量的培养基,用抗生素耐药菌株接种,进行灭菌效果测试;(2)观察接种培养基的不同部分是否有菌落生长,确定培养基是否达到无菌状态。
6.细菌培养效果测试(1)取一定量的培养基,接种需要评估的细菌菌种;(2)在一定温度下孵育一定时间后观察菌落的生长情况,记录培养基对细菌的培养效果。
7.理化指标测试根据培养基的成分和用途,选择适当的方法测试其理化指标,如固体含量、水分含量、氮含量等。
8.结论根据以上测试结果,结合生产厂家提供的标准要求,对培养基的质量进行评估,并得出是否合格的结论。
1.基本信息试剂名称:生产日期:生产厂家:批号:验收人:2.外观检查观察试剂的物理状态和颜色是否与标注一致,是否存在溶解、结晶或沉淀等异常情况。
3.纯度检查(1)根据试剂的用途,采用适当的方法检查其纯度;(2)与生产厂家提供的标准纯度进行对比,判断试剂的质量。
4.pH值测定使用pH计或试纸测定试剂的pH值,记录测得的数值。
5.溶解性测试将试剂溶解于适当溶剂中,观察是否能完全溶解并形成透明溶液。
6.结论根据以上测试结果,结合生产厂家提供的标准要求,对试剂的质量进行评估,并得出是否合格的结论。
以上是培养基和试剂技术性验收记录的基本内容,通过对培养基和试剂的外观、理化指标、性能等进行测试和评估,可以判断其是否符合质量要求。
这样可以保证实验结果的准确性和可重复性,提高实验的可靠性和科学性。
同时,在进行验收记录时需要遵守实验室的操作规范和安全要求,保证验收过程的安全性。
