金属及各类晶体配位数计算图总结
金属晶体配位数 计算 ppt课件

配位数
概念:一个粒子周围最近邻的粒子数称为配位数。
它可以描述晶体中粒子排列的紧密程度,粒 子排列越紧密,配位数越大,结合能越低, 晶体结构越稳定。
在提到配位数时应当分析其所处环境。
• 1、在晶体学中配位数与晶胞类型有关; • 2、离子晶体中指一个离子周围最近的异电性离子的数目; • 3、配位化学中,化合物中性原子周围的配位原子的数目。
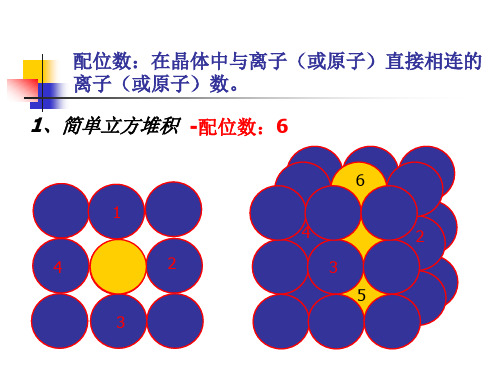
配位数:在晶体中与离子(或原子)直接相连的离 子(或原子)数。
金属晶体的原子堆积模型
非密置层,配位 数是4
密置层,配位数 是6
非密置层堆积——简单立方堆积
1、简单立方堆积
-配位数:6
1
4
2
3
6146源自2352.体心立方堆积——钾型
2.体心立方堆积——钾型
5
6
8
7
1
2
4
3
-配位数:8
二.密置层堆积
金属晶体的空间结构
影响金属键强弱的因素
金属阳离子的半径
半径越小,金属键越强
如碱金属
金属阳离子的电荷数 电荷越多,金属键越强;如
Al>Mg>Na 金属阳离子的堆积方式
• 你怎么称呼老师? • 如果老师最后没有总结一节课的重点的难点,你
是否会认为老师的教学方法需要改进? • 你所经历的课堂,是讲座式还是讨论式? • 教师的教鞭 • “不怕太阳晒,也不怕那风雨狂,只怕先生骂我
3. 六方最密堆积——镁型
配位数:12
7 19
8 2
6
3
5
4
10
11
12
4.面心立方最密堆积——铜型
金属晶体配位数计算

在提到配位数时应当分析其所处环境。
• 1、在晶体学中配位数与晶胞类型有关; • 2、离子晶体中指一个离子周围最近的异电性离子的数目; • 3、配位化学中,化合物中性原子周围的配位原子的数目。
配位数:在晶体中与离子(或原子)直接相连的离 子(或原子)数。
金属晶体的原子堆积模型
非密置层,配位 数是4
金属晶阳离子的半径
半径越小,金属键越强
如碱金属
金属阳离子的电荷数 电荷越多,金属键越强;如
Al>Mg>Na 金属阳离子的堆积方式
配位数
概念:一个粒子周围最近邻的粒子数称为配位数。
它可以描述晶体中粒子排列的紧密程度,粒 子排列越紧密,配位数越大,结合能越低, 晶体结构越稳定。
密置层,配位数 是6
非密置层堆积——简单立方堆积
1、简单立方堆积
-配位数:6
1
4
2
3
6
1
4
6
2
3
5
2.体心立方堆积——钾型
2.体心立方堆积——钾型
5
6
8
7
1
2
4
3
-配位数:8
二.密置层堆积
3. 六方最密堆积——镁型
配位数:12
7 19
8 2
6
3
5
4
10
11
12
4.面心立方最密堆积——铜型
Po
52℅
6
Na K Fe
68℅
8
Mg Zn Ti
74℅
12
Cu Ag Au
74℅
12
混合型晶体
既有共价键又有金属键和范 德华力,属于混合型晶体 C的杂化方式:SP 2
谢谢!
金属晶体配位数 计算正式版PPT文档

谢谢!
配位数:12
7 19
8 2
6
3
5
4
10
11
12
4.面心立方最密堆积——铜型
堆积模型
简单立方 体心立方 钾型 立方最密 镁型 面心立方最密
铜型
采用这种堆 积的典型代
表
空间利用率
配位数
Po
52℅
6
Na K Fe
68℅
8
Mg Zn Ti
74℅
12
Cu Ag Au
74℅
12
混合型晶体
既有共价键又有金属键和范 德华力,属于混合型晶体 C的杂化方式:SP 2
2采、用离这子•种晶堆体1积中、的指在典一型晶个代离体表子学周中围最配近位的数异电与性晶离胞子的类数型目有; 关; 配位数•:在2晶、体离中与子离晶子体〔或中原指子〕一直个接离相连子的周离围子〔最或近原的子〕异数电。性离子的数目; 采2、用离这子•种晶堆体3积中、的指配典一型位个代离化表子学周中围最,近化的合异电物性中离性子的原数子目周; 围的配位原子的数目。
影响金属键强弱的因素
金属阳离子的半径
半径越小,金属键越强
如碱金属
金属阳离子的电荷数 电荷越多,金属键越强;如
Al>Mg>Na 金属阳离子的堆积方式
配位数
概念:一个粒子周围最近邻的粒子数称为配位数。
它可以描述晶体中粒子排列的紧密程度,粒 子排列越紧密,配位数越大,结合能越低, 晶体结构越稳定。
在提到配位数时应当分析其所处环境。
在提到配位数时应当分析其所处环境。
金属晶体的原子堆积模型
非密置层,配位 数是4
密置层,配位数 是6
非密置层堆积——简单立方堆积
常见晶体配位数等
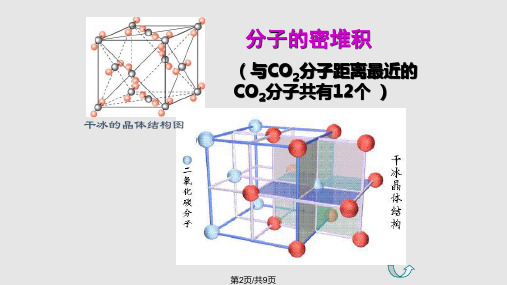
分子的密堆积
(与CO2分子距离最近的 CO2分子共有12个 )
第2页/共9页
第3页/共9页
①金刚石中每个C原子以sp3杂化,分别与4个 相邻的C 原子形成4个σ键,故键角为 109°28′,每个C原子的配位数为4;
②每个C原子均可与相邻的4个C构成实心的正 四面体,向空间无限延伸得到立体网状的金刚 石晶体,在一个小正四面体中平均含有 1+4×1/4 =2个碳原子;
第5页/共9页
(1)石墨中C原子以sp2杂化; (2)石墨晶体中最小环为六元环,含有C
2个,C-C键为 3; (3)石墨分层,层间为范德华力,硬度小, 可导电; (4)石墨中r(C-C)比金刚石中r(C-C) 短。
第6页/共9页
NaCl晶体中离子的配位数
3
1 5
6 2
3
6
1
2
5
4
4
这几个Na+在空间构成 的几何构型
为 正八面体。
每个Cl- 周围与 之最接近且距离 相等的Na+共有
个6 。
第7页/共9页
CsCl的晶体结构及晶胞构 示意图
---Cs+ ---Cl-
Cs+的配位数为:
8 Cl-的配位数为:
8
第8页/共9页
感谢您的观看!
第9页/共9页
③在金刚石中最小的环是六元环,1个环中平 均含有6×1/12=1/2个C原子,含C-C键数为 6×1/6=1;
④金刚石的晶胞中含有C原子为8个,内含4个 小正四面体,含有C-C键数为16。
第4页/共9页
ห้องสมุดไป่ตู้
①二氧化硅中Si原子均以sp3杂化,分别 与4个O原子成键,每个O原子与2个Si原子 成键;
配位数的计算

配位数的计算
配位数是描述在某个配位结构中中心原子周围配位体的数目。
在化学中,配位数通常用于描述配合物中的配位键。
配位数的计算方法主要基于中心原子的电子数和配位体的电子需求。
中心原子的电子数通常是确定的,而配位体的电子需求则取决于其与中心原子形成的键的类型。
对于一般的金属配合物,中心原子的电子数减去配位体提供的电子数,再除以2,就可以得到配位数。
例如,对于一个铁离子(Fe2+),其电子数为10,如果它与两个氮原子(每个氮原子提供2个电子)形成配合物,那么其配位数就是(10 - 4)/ 2 = 3。
所以,对于Fe2+与两个氮原子的配合物,其配位数为3。
计算结果为:配位数为 3
所以,对于Fe2+与两个氮原子的配合物,其配位数为3。
常见金属离子配位数及颜色总结
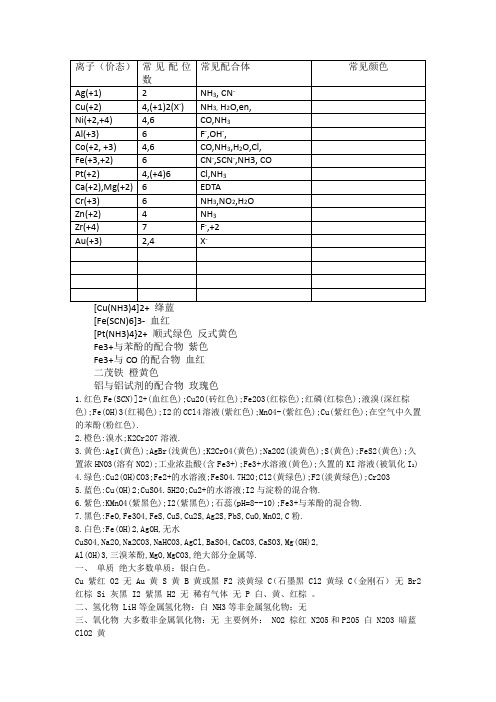
[Fe(SCN)6]3- 血红[Pt(NH3)4}2+ 顺式绿色反式黄色Fe3+与苯酚的配合物紫色Fe3+与CO的配合物血红二茂铁橙黄色铝与铝试剂的配合物玫瑰色1.红色Fe(SCN)]2+(血红色);Cu2O(砖红色);Fe2O3(红棕色);红磷(红棕色);液溴(深红棕色);Fe(OH)3(红褐色);I2的CCl4溶液(紫红色);MnO4-(紫红色);Cu(紫红色);在空气中久置的苯酚(粉红色).2.橙色:溴水;K2Cr2O7溶液.3.黄色:AgI(黄色);AgBr(浅黄色);K2CrO4(黄色);Na2O2(淡黄色);S(黄色);FeS2(黄色);久置浓HNO3(溶有NO2);工业浓盐酸(含Fe3+);Fe3+水溶液(黄色);久置的KI溶液(被氧化I2)4.绿色:Cu2(OH)CO3;Fe2+的水溶液;FeSO4.7H2O;Cl2(黄绿色);F2(淡黄绿色);Cr2O35.蓝色:Cu(OH)2;CuSO4.5H2O;Cu2+的水溶液;I2与淀粉的混合物.6.紫色:KMnO4(紫黑色);I2(紫黑色);石蕊(pH=8--10);Fe3+与苯酚的混合物.7.黑色:FeO,Fe3O4,FeS,CuS,Cu2S,Ag2S,PbS,CuO,MnO2,C粉.8.白色:Fe(OH)2,AgOH,无水CuSO4,Na2O,Na2CO3,NaHCO3,AgCl,BaSO4,CaCO3,CaSO3,Mg(OH)2,Al(OH)3,三溴苯酚,MgO,MgCO3,绝大部分金属等.一、单质绝大多数单质:银白色。
Cu 紫红 O2 无 Au 黄 S 黄 B 黄或黑 F2 淡黄绿 C(石墨黑 Cl2 黄绿 C(金刚石)无 Br2 红棕 Si 灰黑 I2 紫黑 H2 无稀有气体无 P 白、黄、红棕。
二、氢化物 LiH等金属氢化物:白 NH3等非金属氢化物:无三、氧化物大多数非金属氧化物:无主要例外: NO2 棕红 N2O5和P2O5 白 N2O3 暗蓝ClO2 黄大多数主族金属的氧化物:白主要例外: Na2O2浅黄 PbO 黄 K2O 黄 Pb3O4 红 K2O2 橙Rb2O 亮黄 Rb2O2 棕 Cs2O 橙红 Cs2O2 黄大多数过渡元素氧化物有颜色 MnO 绿 CuO 黑MnO2黑 Ag2O 棕黑 FeO 黑 ZnO 白 Fe3O4 黑 Hg2O 黑 Fe2O3 红棕 HgO 红或黄 Cu2O 红V2O5 橙四、氧化物的水化物大多数:白色或无色其中酸:无色为主碱:白色为主主要例外: CsOH 亮黄 Fe(OH)3红褐 HNO2 溶液亮蓝 Cu(OH)2 蓝 Hg(OH)2 桔红五、盐大多数白色或无色主要例外: K2S 棕黄 CuFeS2 黄 KHS 黄 ZnS 白 Al2S3 黄 Ag2S 黑 MnS 浅红 CdS 黄 FeS 黑棕 SnS 棕 FeS2 黄 Sb2S3 黑或橙红 CoS 黑 HgS 红 NiS 黑PbS 黑 CuS、Cu2S 黑 Bi2S3 黑FeCl3·6H2O 棕黄 Na3P 红FeSO4·9H2O 蓝绿 NaBiO3 黄Fe2(SO4)3·9H2O 棕黄 MnCl2 粉红 Fe3C 灰 MnSO4 淡红 FeCO3 灰 Ag2CO3 黄 Fe(SCN)3 暗红 Ag3PO4 黄 CuCl2 棕黄 AgF 黄CuCl2·7H2O 蓝绿 AgCl 白 CuSO4 白 AgBr 浅黄CuSO4·5H2O 蓝 AgI 黄 Cu2(OH)2CO3 暗绿盐溶液中离子特色: NO2- 浅黄 Cu2+或[Cu (H2O)4]2+ 蓝 MnO4- 紫红 [CuCl4]2-黄 MnO42-绿 [Cu(NH3)4]2+深蓝 Cr2O72-橙红 Fe2+ 浅绿 CrO42- 黄 Fe3+ 棕黄非金属互化物 PCl3 无 XeF2、XeF4、XeF6 无 PCl5 浅黄氯水黄绿 CCl4 无溴水黄—橙 CS2 无碘水黄褐 SiC 无或黑溴的有机溶液橙红—红棕SiF4 无 I2的有机溶液紫红六.其它甲基橙橙 CXHY(烃)、CXHYOZ 无(有些固体白色)石蕊试液紫大多数卤代烃无(有些固体白色)石蕊试纸蓝或红果糖无石蕊遇酸变红葡萄糖白石蕊遇碱变蓝蔗糖无酚酞无麦芽糖白酚酞遇碱红淀粉白蛋白质遇浓HNO3变黄纤维素白I2遇淀粉变蓝 TNT 淡黄 Fe3+遇酚酞溶液紫焰色反应 Li 紫红 Ca 砖红 Na 黄 Sr 洋红 K 浅紫(通过蓝色钴玻璃) Ba 黄绿 Rb 紫 Cu 绿稀有气体放电颜色 He 粉红 Ne 鲜红 Ar 紫V,Ti及其化合物:黄色的CrO42-,紫色的MnO4-.二氧化钛(金红石),TiCl3紫色粉末状固体,V2O5砖红色或橙黄色粉末,淡黄色的钒二氧基VO2+,VO2+蓝色,黄色的二过氧钒酸根阴离子[VO2(O2)2]3-,红棕色的过氧钒阳离子[V(O2)]3+,Cr,Mo,W:Cr2O3绿色固体,Cr(OH)3灰蓝色胶状沉淀,Cr3+紫色,CrO2−绿色,CrO42−黄色硫酸铬因含结晶水数量不同而有不同颜色:Cr2(SO4)3·18H2O紫色,Cr2(SO4)3·6H2O绿色, Cr2(SO4)3棕红。
常见晶体模型及晶胞计算
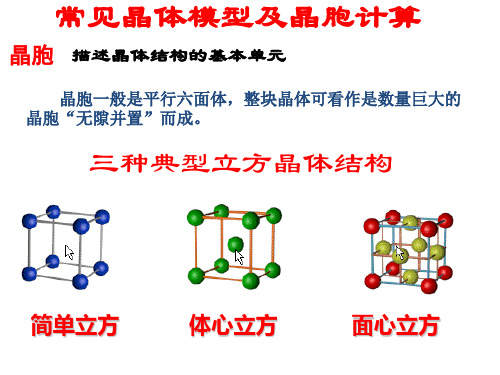
练习
-的距离为 a cm,该晶体密度为
(1)设NaCl晶胞的边长为acm,则
示晶为胞中Na+和Cl-的最近距离(( 即小)立
方体的边长)为 a/2 cm,则晶胞中 同种离子的最近距离为 a/2 cm。
(2)晶胞的边长为acm,求NaCl晶 体的密度。
ρ=
M / NA×晶胞所含粒子数 晶胞的体积
镁型[六方密堆积] (Be Mg ⅢB ⅣB ⅦB )
12
6
3
54
12
6
3
54
12
6
3
54
A B A B A
找镁型的晶胞
1200
每个晶胞含原子数: 2 配位数: 12
空间占有率:
六方密堆积(镁型)的空间利用率计算:
四点间的夹角均为60°
先求S
在镁型堆积中取出六方晶胞,平行六面体的底是
平行四边形,各边长a=2r,则平行四边形的面积:
找铜型的晶胞
面心立方最密堆积的空间占有率 =74%
金属晶体的四种堆积模型对比
堆积模型
采纳这种堆积 的典型代表
空间利用率
配位数
简单立方
Po(钋)
52%
6
体心立方 (钾型)
K、Na、Fe
68%
8
六方最密 (镁型)
Mg、Zn、Ti
74%
12
面心立方最密 (铜型)
Cu, Ag, Au
74%
12
晶胞
原子晶体
金刚石
该晶胞实际分摊到的碳原子数为 (4 + 6 ×1/2 + 8 ×1/8) = 8个。
小结:高考常见题型 (一) 晶胞中微粒个数的计算, 求化学式
金刚石的计算
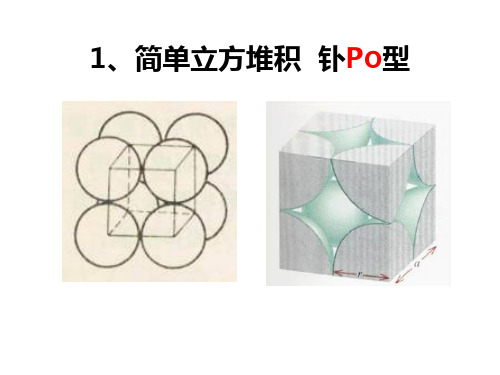
8
Ca2+:
8ห้องสมุดไป่ตู้
Ca2+: 4 F-: 8
F-: 4 F-: 4
碱土金属卤化 物、碱金属氧 化物。
氯化钠的晶胞
(1)钠离子和氯离子的位置:
①钠离子和氯离子位于立方体的顶角上,并交错排列。 ②钠离子:体心和棱中点;氯离子:面心和顶点,或者 反之。
CsCl的晶体结构及晶胞构示意 图
---Cs+
---Cl-
(3)CaF2型晶胞
①Ca2+的配位数:8 ②F-的配位数:4 ③一个CaF2晶胞中 含: 4个Ca2+和8个F-
1、简单立方堆积 钋PO型
简单立方晶胞空间利用率
2r
4 3 r V球 3 空间利用率= 100 % 100% 3 V晶胞 8r
=52%
立方体的棱长为2r,球的半径为r 过程: 1个晶胞中平均含有1个原子 4 3 V晶胞=(2r)3=8r3 V球= r 3
体心立方堆积 钾型
配位数:8 空间占有率: 68.02%
Na+: 4 Cl-: 4 Cs+: 1 Cl-:1
KBr AgCl、 MgO、CaS、 BaSe CsCl、CsBr、 CsI、TlCl
AB
CsCl 型 ZnS型
2+: Zn 4 ZnS、AgI、 4 Zn2+: Zn2+: 4 2S2-: 4 S2-: 4 S : 4 BeO
AB2
CaF2 型
Ca2+:
( 体 心 立钾 方型 堆 积 )
( 面 心 六 方铜 密型 堆 积 )
( 六 方镁 密型 堆 积 )
金属晶体的原子空间堆积模型3
六方最密堆积A3:
金属晶体配位数计算

非密置层,配位数 是4
密置层,配位数是 6
第5页,本讲稿共15页
非密置层堆积——简单立方堆积
第6页,本讲稿共15页
1、简单立方堆积
-配位数:6
1
4
2
3
6
1
4
6
2
3
5
第7页,本讲稿共15页
2.体心立方堆积——钾型
第8页,本讲稿共15页
2.体心立方堆积——钾型
5
6
8
7
1
2
4
3
-配位数:8
第9页,本讲稿共15页
二.密置层堆积
第10页,本讲稿共15页
3. 六方最密堆积——镁型
配位数:12
7
1
9
6 5
8
2 3
4
10
11
12
第12页,本讲稿共15页
堆积模型
简单立方 体心立方 钾型 立方最密 镁型 面心立方最密
铜型
采用这种堆 积的典型代
表
空间利用率
配位数
第3页,本讲稿共15页
在提到配位数时应当分析其所处环境。
• 1、在晶体学中配位数与晶胞类型有关; • 2、离子晶体中指一个离子周围最近的异电性离子的数目; • 3、配位化学中,化合物中性原子周围的配位原子的数目。
配位数:在晶体中与离子(或原子)直接相连的离子(或 原子)数。
第4页,本讲稿共15页
金属晶体的原子堆积模型
金属晶体配位数计算
第1页,本讲稿共15页
影响金属键强弱的因素
金属阳离子的半径
金属阳离子的电荷数 金属阳离子的堆积方式
半径越小,金属键越强 如碱金属
电荷越多,金属键越强;如 Al>Mg>Na
常见金属离子配位数及颜色总结 自动保存的)

[Fe(SCN)6]3- 血红[Pt(NH3)4}2+ 顺式绿色反式黄色Fe3+与苯酚的配合物紫色Fe3+与CO的配合物血红二茂铁橙黄色铝与铝试剂的配合物玫瑰色1.红色Fe(SCN)]2+(血红色);Cu2O(砖红色);Fe2O3(红棕色);红磷(红棕色);液溴(深红棕色);Fe(OH)3(红褐色);I2的CCl4溶液(紫红色);MnO4-(紫红色);Cu(紫红色);在空气中久置的苯酚(粉红色).2.橙色:溴水;K2Cr2O7溶液.3.黄色:AgI(黄色);AgBr(浅黄色);K2CrO4(黄色);Na2O2(淡黄色);S(黄色);FeS2(黄色);久置浓HNO3(溶有NO2);工业浓盐酸(含Fe3+);Fe3+水溶液(黄色);久置的KI溶液(被氧化I2)4.绿色:Cu2(OH)CO3;Fe2+的水溶液;FeSO4.7H2O;Cl2(黄绿色);F2(淡黄绿色);Cr2O35.蓝色:Cu(OH)2;CuSO4.5H2O;Cu2+的水溶液;I2与淀粉的混合物.6.紫色:KMnO4(紫黑色);I2(紫黑色);石蕊(pH=8--10);Fe3+与苯酚的混合物.7.黑色:FeO,Fe3O4,FeS,CuS,Cu2S,Ag2S,PbS,CuO,MnO2,C粉.8.白色:Fe(OH)2,AgOH,无水CuSO4,Na2O,Na2CO3,NaHCO3,AgCl,BaSO4,CaCO3,CaSO3,Mg(OH)2,Al(OH)3,三溴苯酚,MgO,MgCO3,绝大部分金属等.一、单质绝大多数单质:银白色。
Cu 紫红 O2 无 Au 黄 S 黄 B 黄或黑 F2 淡黄绿 C(石墨黑 Cl2 黄绿 C(金刚石)无 Br2 红棕 Si 灰黑 I2 紫黑 H2 无稀有气体无 P 白、黄、红棕。
二、氢化物 LiH等金属氢化物:白 NH3等非金属氢化物:无三、氧化物大多数非金属氧化物:无主要例外: NO2 棕红 N2O5和P2O5 白 N2O3 暗蓝ClO2 黄大多数主族金属的氧化物:白主要例外: Na2O2浅黄 PbO 黄 K2O 黄 Pb3O4 红 K2O2 橙Rb2O 亮黄 Rb2O2 棕 Cs2O 橙红 Cs2O2 黄大多数过渡元素氧化物有颜色 MnO 绿 CuO 黑MnO2黑 Ag2O 棕黑 FeO 黑 ZnO 白 Fe3O4 黑 Hg2O 黑 Fe2O3 红棕 HgO 红或黄 Cu2O 红V2O5 橙四、氧化物的水化物大多数:白色或无色其中酸:无色为主碱:白色为主主要例外: CsOH 亮黄 Fe(OH)3红褐 HNO2 溶液亮蓝 Cu(OH)2 蓝 Hg(OH)2 桔红五、盐大多数白色或无色主要例外: K2S 棕黄 CuFeS2 黄 KHS 黄 ZnS 白 Al2S3 黄 Ag2S 黑 MnS 浅红 CdS 黄 FeS 黑棕 SnS 棕 FeS2 黄 Sb2S3 黑或橙红 CoS 黑 HgS 红 NiS 黑PbS 黑 CuS、Cu2S 黑 Bi2S3 黑FeCl3·6H2O 棕黄 Na3P 红FeSO4·9H2O 蓝绿 NaBiO3 黄Fe2(SO4)3·9H2O 棕黄 MnCl2 粉红 Fe3C 灰 MnSO4 淡红 FeCO3 灰 Ag2CO3 黄 Fe(SCN)3 暗红 Ag3PO4 黄 CuCl2 棕黄 AgF 黄CuCl2·7H2O 蓝绿 AgCl 白 CuSO4 白 AgBr 浅黄CuSO4·5H2O 蓝 AgI 黄 Cu2(OH)2CO3 暗绿盐溶液中离子特色: NO2- 浅黄 Cu2+或[Cu (H2O)4]2+ 蓝 MnO4- 紫红 [CuCl4]2-黄 MnO42-绿 [Cu(NH3)4]2+深蓝 Cr2O72-橙红 Fe2+ 浅绿 CrO42- 黄 Fe3+ 棕黄非金属互化物 PCl3 无 XeF2、XeF4、XeF6 无 PCl5 浅黄氯水黄绿 CCl4 无溴水黄—橙 CS2 无碘水黄褐 SiC 无或黑溴的有机溶液橙红—红棕SiF4 无 I2的有机溶液紫红六.其它甲基橙橙 CXHY(烃)、CXHYOZ 无(有些固体白色)石蕊试液紫大多数卤代烃无(有些固体白色)石蕊试纸蓝或红果糖无石蕊遇酸变红葡萄糖白石蕊遇碱变蓝蔗糖无酚酞无麦芽糖白酚酞遇碱红淀粉白蛋白质遇浓HNO3变黄纤维素白I2遇淀粉变蓝 TNT 淡黄 Fe3+遇酚酞溶液紫焰色反应 Li 紫红 Ca 砖红 Na 黄 Sr 洋红 K 浅紫(通过蓝色钴玻璃) Ba 黄绿 Rb 紫 Cu 绿稀有气体放电颜色 He 粉红 Ne 鲜红 Ar 紫V,Ti及其化合物:黄色的CrO42-,紫色的MnO4-.二氧化钛(金红石),TiCl3紫色粉末状固体,V2O5砖红色或橙黄色粉末,淡黄色的钒二氧基VO2+,VO2+蓝色,黄色的二过氧钒酸根阴离子[VO2(O2)2]3-,红棕色的过氧钒阳离子[V(O2)]3+,Cr,Mo,W:Cr2O3绿色固体,Cr(OH)3灰蓝色胶状沉淀,Cr3+紫色,CrO2−绿色,CrO42−黄色硫酸铬因含结晶水数量不同而有不同颜色:Cr2(SO4)3·18H2O紫色,Cr2(SO4)3·6H2O绿色, Cr2(SO4)3棕红。
常见金属离子配位数及颜色总结自动保存的

[Fe(SCN)6]3-血红[Pt(NH3)4}2+顺式绿色反式黄色Fe3+与苯酚的配合物紫色Fe3+与CO的配合物血红二茂铁橙黄色铝与铝试剂的配合物玫瑰色1.红色Fe(SCN)]2+(血红色);Cu2O(砖红色);Fe2O3(红棕色);红磷(红棕色);液溴(深红棕色);Fe(OH)3(红褐色);I2的CCl4溶液(紫红色);MnO4-(紫红色);Cu(紫红色);在空气中久置的苯酚(粉红色).2.橙色:溴水;K2Cr2O7溶液.3.黄色:AgI(黄色);AgBr(浅黄色);K2CrO4(黄色);Na2O2(淡黄色);S(黄色);FeS2(黄色);久置浓HNO3(溶有NO2);工业浓盐酸(含Fe3+);Fe3+水溶液(黄色);久置的KI溶液(被氧化I2)4.绿色:Cu2(OH)CO3;Fe2+的水溶液;FeSO4.7H2O;Cl2(黄绿色);F2(淡黄绿色);Cr2O35.蓝色:Cu(OH)2;CuSO4.5H2O;Cu2+的水溶液;I2与淀粉的混合物.6.紫色:KMnO4(紫黑色);I2(紫黑色);石蕊(pH=8--10);Fe3+与苯酚的混合物.7.黑色:FeO,Fe3O4,FeS,CuS,Cu2S,Ag2S,PbS,CuO,MnO2,C粉.8.白色:Fe(OH)2,AgOH,无水CuSO4,Na2O,Na2CO3,NaHCO3,AgCl,BaSO4,CaCO3,CaSO3,Mg(OH)2,Al(OH)3,三溴苯酚,MgO,MgCO3,绝大部分金属等.一、单质绝大多数单质:银白色。
Cu紫红O2无Au黄S黄B黄或黑F2淡黄绿C(石墨黑Cl2黄绿C(金刚石)无Br2红棕Si灰黑I2紫黑H2无稀有气体无P白、黄、红棕。
二、氢化物LiH等金属氢化物:白NH3等非金属氢化物:无三、氧化物大多数非金属氧化物:无主要例外:NO2棕红N2O5和P2O5白N2O3暗蓝ClO2黄大多数主族金属的氧化物:白主要例外:Na 2O 2浅黄PbO 黄K2O 黄Pb3O4红K2O2橙Rb2O 亮黄Rb2O2棕Cs2O 橙红Cs2O2黄大多数过渡元素氧化物有颜色MnO 绿CuO 黑MnO2黑Ag2O 棕黑FeO 黑ZnO 白Fe3O4黑Hg2O 黑Fe2O3红棕HgO 红或黄Cu2O 红V2O5橙 四、氧化物的水化物大多数:白色或无色其中酸:无色为主碱:白色为主主要例外:CsOH 亮黄Fe(OH)3红褐HNO2溶液亮蓝Cu(OH)2蓝Hg(OH)2桔红 五、盐大多数白色或无色主要例外:K2S 棕黄CuFeS2黄KHS 黄ZnS 白Al2S3黄Ag2S 黑MnS 浅红CdS 黄FeS 黑棕SnS 棕FeS2黄Sb2S3黑或橙红CoS 黑HgS 红NiS 黑PbS 黑CuS 、Cu2S 黑Bi2S3黑FeCl3·6H2O 棕黄Na3P 红FeSO4·9H2O 蓝绿NaBiO3黄Fe2(SO4)3·9H2O 棕黄MnCl2粉红Fe3C 灰MnSO4淡红FeCO3灰Ag2CO3黄Fe (SCN )3暗红Ag3PO4黄CuCl2棕黄AgF 黄CuCl2·7H2O 蓝绿AgCl 白CuSO4白AgBr 浅黄CuSO4·5H2O 蓝AgI 黄Cu2(OH )2CO3暗绿盐溶液中离子特色:NO2-浅黄Cu2+或[Cu (H2O )4]2+蓝MnO4-紫红[CuCl 4]2-黄MnO 42-绿[Cu (NH 3)4]2+深蓝Cr 2O 72-橙红Fe2+浅绿CrO42-黄Fe3+棕黄非金属互化物PCl3无XeF2、XeF4、XeF6无PCl5浅黄氯水黄绿CCl4无溴水黄—橙CS2无碘水黄褐SiC 无或黑溴的有机溶液橙红—红棕SiF4无I2的有机溶液紫红六.其它甲基橙橙CXHY (烃)、CXHYOZ 无(有些固体白色)石蕊试液紫大多数卤代烃无(有些固体白色)石蕊试纸蓝或红果糖无石蕊遇酸变红葡萄糖白石蕊遇碱变蓝蔗糖无酚酞无麦芽糖白酚酞遇碱红淀粉白蛋白质遇浓HNO3变黄纤维素白I2遇淀粉变蓝TNT 淡黄Fe3+遇酚酞溶液紫焰色反应Li 紫红Ca 砖红Na 黄Sr 洋红K 浅紫(通过蓝色钴玻璃)Ba 黄绿Rb 紫Cu 绿V 443固体,V 2O 5砖红色或橙黄色粉末,淡黄色的钒二氧基VO 2+,VO 2+蓝色,黄色的二过氧钒酸根阴离子[VO 2(O 2)2]3-,红棕色的过氧钒阳离子[V(O 2)]3+,Cr,Mo,W:Cr 2O 3绿色固体,Cr(OH)3灰蓝色胶状沉淀,Cr 3+紫色,CrO 2?绿色,CrO 42?黄色 硫酸铬因含结晶水数量不同而有不同颜色:Cr 2(SO 4)3·18H 2O 紫色,Cr 2(SO 4)3·6H 2O 绿色,Cr 2(SO 4)3棕红。
lani5合金晶胞配位数

lani5合金晶胞配位数晶体是由许多重复有序排列的原子或分子构成的固体结构。
在晶体中,各个原子或分子之间通过化学键连接在一起,形成一个晶胞。
晶胞是晶体结构的基本单位,确定了晶体的物理和化学特性。
而晶胞配位数则是指晶胞中每个原子或离子周围的邻近原子或离子的个数。
对于一些重要的合金,晶胞配位数在一定程度上决定了其特性和应用。
在合金中,金属元素和非金属元素以一定比例混合在一起,形成具有特定晶体结构的固体。
合金的晶胞配位数相对于单组份金属晶体而言,可能更加复杂。
下面我们来具体讨论合金晶胞配位数的几个典型例子:1.纯金属晶体的晶胞配位数:纯金属晶体一般具有简单的结构,晶胞配位数较低。
例如,钠晶体属于面心立方晶系,每个钠原子周围配位数为12,即12个邻近的钠原子。
而铁晶体则属于体心立方晶系,每个铁原子周围配位数为8。
2.合金晶体的晶胞配位数:合金晶体由不同的金属元素混合而成,因此晶胞配位数相对复杂。
以黄铜为例,黄铜主要由铜和锌两种元素组成。
黄铜的晶体结构属于面心立方晶系,每个铜原子周围配位数为12,而每个锌原子周围配位数为6。
3.合金中的插层化合物的晶胞配位数:插层化合物是指在晶体中插入其他原子或离子形成的化合物。
比如,钛铝合金常指的是钛和铝组成的化合物。
钛铝合金的晶体结构属于复杂的四方晶系,晶胞中的钛原子和铝原子的配位数分别为8和12。
总的来说,合金晶胞配位数与晶体的结构密切相关。
不同的合金具有不同的晶体结构和晶胞配位数,这也导致了合金在硬度、热稳定性、导电性等方面的差异。
因此,合金晶胞配位数的研究对于理解合金的性质和应用具有重要意义。
需要注意的是,由于合金的复杂性,上述所讨论的合金晶胞配位数仅仅是一些常见合金的典型例子,实际情况可能更为复杂。
此外,合金的配位数还可能受到温度、压力等外界条件的影响。
因此,在实际研究和应用中,还需要进一步探索和研究合金晶胞配位数的变化规律和对合金性质的影响,以更好地利用和发展合金材料。
金属晶体配位数计算

金属晶体
金属晶体的空间结构
精选课件
1
影响金属键强弱的因素
金属阳离子的半径
半径越小,金属键越强
如碱金属
金属阳离子的电荷数 电荷越多,金属键越强;如
Al>Mg>Na 金属阳离子的堆积方式
精选课件
2
配位数
概念:一个粒子周围最近邻的粒子数称为配位数。
它可以描述晶体中粒子排列的紧密程度,粒 子排列越紧密,配位数越大,结合能越低, 晶体结构越稳定。
精选课件
3
在提到配位数时应当分析其所处环境。
• 1、在晶体学中配位数与晶胞类型有关; • 2、离子晶体中指一个离子周围最近的异电性离子的数目; • 3、配位化学中,化合物中性原子周围的配位原子的数目。
配位数:在晶体中与离子(或原子)直接相连的离 子(或原子)数。
精选课件
4
金属晶体的原子堆积模型
非密置层,配位 数是4
8 2
6
3
5
4
Hale Waihona Puke 101112
精选课件
11
4.面心立方最密堆积——铜型
精选课件
12
Po
52℅
6
Na K Fe
68℅
8
Mg Zn Ti
74℅
12
Cu Ag Au
74℅
12
精选课件
13
混合型晶体
既有共价键又有金属键和范 德华力,属于混合型晶体 C的杂化方式:SP 2
精选课件
14
谢谢!
精选课件
15
感谢亲观看此幻灯片,此课件部分内容来源于网络, 如有侵权请及时联系我们删除,谢谢配合!
精选课件
密置层,配位数
金属及各类晶体配位数计算图总结
立方ZnS型离子晶体:
所属晶系: 立方; 点阵: 立方F; 结构基元及每个晶胞中结构基元的数目: ZnS, 4个; Zn和S离子的配位数都是4;
CaF2型离子晶体:
所属晶系: 立方; 点阵: 立方F; 结构基元及每个晶胞中结构基元的数目: CaF2, 4个; Ca和F离子的配位数分别是8和4;
三、在配位化合物(简称配合物) 中
配位场理论认为中心原子的内层轨道受 周围配体的影响,也即关系到配位数。 例如,Ni2+离子与H2O和NH3等具有小的相 互排斥力的弱场配体,生成配位数为 6 的【Ni(H2O)6】2+和【Ni(NH3)6】2+等八面 体配离子;与Br-和I-等具有大的相互排斥 力的弱场配体则趋向于生成配位数为4的 【NiBr4】2-和【NiI4】2-等正四面体配离 子;与CN-等强场配体则生成配位数为4
3.典型结构的配位数 (1)六角密积和立方密积的配位数都是十二。即晶体中最
大配位数为十二。
(2)当晶体不是由全同的粒子组成时,相应的配位数要发
生变化—减小。由于晶体的对称性和周期性的特点,以
及粒子在结合成晶体时,是朝着结合能最小、最稳固的
方向发展。因此,相应的配位数只能取:
8(CsCl型结构)、6(NaCl型结构)、4(金刚石型结构)、
3(层状结构)、2(链状结构)。
4.氯化铯型结构的配位数
如图所示,大球(半径为R)中心为立方体顶角,小 球(半径为r)位于立方体的中心。 如果大球相切,则
立方体的边长为:
空间对角线的长度为: ak
a 2R
Cs
3a 2 3 R
RCl - 1.81 A rC s 1.69 A
o o
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2.立方密堆积(立方密积) (1)堆积形式 如图所示:ABCABC…组合 (2)堆积特点 层的垂直方向为三次象转轴。 既是立方体的空间对角线。 原胞当中包含一个粒子,是 布拉菲格子。
3.典型结构的配位数 (1)六角密积和立方密积的配位数都是十二。即晶体中最 大配位数为十二。 (2)当晶体不是由全同的粒子组成时,相应的配位数要发 生变化—减小。由于晶体的对称性和周期性的特点,以 及粒子在结合成晶体时,是朝着结合能最小、最稳固的 方向发展。因此,相应的配位数只能取: 8(CsCl 型 结 构 ) 、 6(NaCl 型 结 构 ) 、 4( 金 刚 石 型 结 构 ) 、 3(层状结构)、2(链状结构)。
影响配位数的因素如下 : 1、中心原子的大小 2、中心原子的电荷 3、配体的性质
中心原子的大小
中心原子的最高配位数决定于它在周期表中的 周次。
在周期表内,第1周期元素的最高配位数为2; 第2周期元素的最高配位数为4;
第3周期为6,以下为8、10。
最高配位数是指在配合物中,中心原子周围的最 高配位原子数,实际上一般可低于最高数。
中心离子的配位数一般是2、4、6, 最常见的是4和6,配位数的多少取决于 中心离子和配体的性质──电荷、体积、 电子层结构以及配合物形成时的条件, 特别是浓度和温度。
一般来讲,中心离子的电荷越高 越有利于形成配位数较高的配合 物
如Ag,其特征配位数为2,如 [Ag(NH3)2];Cu,其特征配位数为4,例 [Cu(NH3)4];
2-
中心离子(或原子)同单基配体结合的数 目就是该中心离子(或原子)的配位数。 例如[Cu(NH3)4]SO4中Cu离子的配位数为4, [Co(NH3)2(HO)4]Cl中Co离子的配位数为6。 中心离子(或原子)同多基配体配合时, 配位数等同于配位原子数目,例如[Cu(en)] 中的乙二胺(en)是双基配体,因此Cu离 子的配位数为4。
立方ZnS型离子晶体:
所属晶系: 立方; 点阵: 立方F; 结构基元及每个晶胞中结构基元的数目: ZnS, 4个; Zn和S离子的配位数都是4;
CaF2型离子晶体:
所属晶系: 立方; 点阵: 立方F;
结构基元及每个晶胞中结构基元的数目: CaF2, 4个; Ca和F离子的配位数分别是8和4;
三、在配位化合物(简称配合物) 中
在实际中第1周期元素原子的配位数为2,第2 周期不超过4。除个别例外,第3、4周期不超过6, 第5、6周期为8。
最常见的配位数为4和6,其次为2、5、8。配
中心原子的电荷
中心原子的电荷高,配位数就大。 例如,等电子系列的中心原子Ag+、Cd2+和 In3+与Cl-分别生成配位数为2、4和6的 【AgCl2】-、【CdCl4】2-和【InCl6】3-配 离子。同一元素不同氧化态的离子常具 有不同的配位数,例如,二价铂离子Pt2+的 配位数为4,而4价铂离子配位数Pt4+为6。
这是因为中心离子的电荷愈高,就需要愈多 的配体负电荷来中和。 中心原子的成键轨道性 质和电子构型 从价键理论的观点来说,中心原 子成键轨道的性质决定配位数,而中心原子的 电子构型对参与成键的杂化轨道的形成很重要,
例如,Zn2+和Cu+离子的5个3d轨道是全满的,适 合成键的是一个4s和3个4p轨道,经sp3杂化形成 4个成键轨道,指向正四面体的四个角。
(3)如果小球直径小于0.73R, 则小球不能与大球相切, 小 球在中心可以摇动,结构不稳定,以致不能存在,于是 结构将取配位数较低的排列(配位数为6的排列)。
当 1 r 0.73时,两种球的排列为氯化铯型。 R
5.氯化钠型结构的配位数 (1)如图所示,大球(半径 为R)相切,小球(半径为r) 也与大球相切。
当 0.73 r 0.41时,两种球的排列为氯化钠型。 R
o
RCl- 1.81 A
o
rNa 0.95 A
rNa 0.52 RCl -
配位数和半径之比的关系
配位数 12 8 6 4 3
r/R
1 1~0.73 0.73~0.41 0.41~0.23 0.23~0.16
配位数的确定
配位原子的数目。
一、晶胞密堆积、配位数
1.配位数 一个粒子周围最近邻的粒子数称为配位数。 它可以描述晶体中粒子排列的紧密程度,粒子排列越紧密,
配位数越大,结合能越低,晶体结构越稳定。
2.密堆积 如果晶体由完全相同的一种粒子组成,而粒子被看作小圆 球,则这些全同的小圆球最紧密的堆积称为密堆积。
密堆积特点:结合能低,晶体结构稳定;配位数最大为12。
4.氯化铯型结构的配位数 如图所示,大球(半径为R)中心为立方体顶角,小
球(半径为r)位于立方体的中心。
如果大球相切,则
立方体的边长为:
a 2R
Cs
空间对角线的长度为:
ak
3a 2 3R
aj
o
RCl- 1.81 A
o
rC s 0.93
ai
Cl
rC s 1.69 A
子之间的接触才算配位数,这样配位数就是真正
的配位数,即6。
面心立方堆积如果是金属原子,则其配位数
是12,因为周围的原子都与该原子形成金属键的,
这时也是真正的配位数。
我们在提到配位数时应当分 析其所处环境。
1、在晶体学中配位数与晶胞类型有关; 2、离子晶体中指一个离子周围最近的异
电性离子的数目; 3、配位化学中,化合物中性原子周围的
RCl -
a 2R
(1)如果小球恰好与大球 相切,则小球的直径为:
3a 2R 2r 2 3R
r 1 2 3R - 2R 2 3 - 1 R 0.73R 排列最紧密,结构最稳定。
(2)如果小球直径大于0.73R, 则小球可以与大球相切, 而 大球则不再相切。
成面心立方结构,称为立方密积。
层的垂直方向:立方体的对角线。
3.配位数的可能值
配位数的可能值为:12(密堆积:fcc,hcp),8(bcc,氯化铯型
结构),6(sc,氯化钠型结构),4(ZnS,金刚石型结构),3(石墨层
状结构),2(链状结构)。
Cl
Cs
ak
aj
ai
4.致密度
如果把等体积的硬球放置在晶体结构中原子所在的位置上, 球的体积取得尽可能大,以使最近邻的球相切,我们把一个晶 胞中被硬球占据的体积与晶胞体积之比称为致密度(堆积比率, 堆积因子,最大空间利用率)。
配位数:在晶体中与离子(或原子)直接相连的 离子(或原子)数。
1、简单立方堆积 -配位数:6
1
4
2
3
6
1
4
2
3
5
2、钾型(体心立方堆积) -配位数:8
5
6
8
7
1
2
4
3
3. 镁型(六方堆积)
配位数:12
7 1 9
6
5
8 2
3 4
10
11
12
§1.8 密堆积 配位数 一、密堆积和配位数
1.配位数 一个粒子周围最近邻的粒子数称为配位数。描述晶
(1)六角密积 (Be,Mg,Cd,Zn)
AB
第一层:每个球与6个球相切,有6个空隙, 如编号1,2,3,4,5,6。
第二层:占据1,3,5空位中心。 第三层:在第一层球的正上方形成ABABAB······排列方式 。
六角密积是复式晶格,其布拉维晶格是简单六角晶格。
基元由两个原子组成,一个位于(000),另一个原子位
高考备考
Cl-按面心立方堆积的配位数是12。怎么都 是配位数一会儿是6,一会儿又是12,这怎 么理解?
氯离子按面心立方堆积是没错,但那不是真
正的配位数,因为氯离子是同号离子,是相互斥
的;
同理,钠离子也是按面心立方堆积的,这两
种离子形成的面心立方堆积都产生八面体空穴,
彼此进入对方八面体空穴中就对了,此时异号离
0.4~0.7之间,配位数为6;
0.7~1.0之间的,配位数为8。
配位数与 r+/r- 之比的关系:
0.225 ---- 0.414 结构
4配位 ZnS 式晶体
0.414 ---- 0.732 结构
6配位 NaCl式晶体
0.732 ---- 1.000 结构
8配位 CsCl式晶体
Co,其特征配位数为6,例[Co(NH3)2( HO)4]。
但配体电荷的增加对形成高配位数是 不利的,因为它增加了配体之间的斥力, 使配位数减少。如[Co(HO)6]同[CoCl4]相 比,前者的配体是中性分子,后者是带 负电荷的Cl离子,使Co的配位数由6降为
12
bcc 2
8
CsCl Cs+ 1
8
Cl- 1
最近邻距离
2a 2
3a 2
3a 2
结构
典型的晶体结构
晶胞中的 原子个数
配位数
金刚石
8
4
ZnS
Na+ 4
NaCl
6
Cl- 4
最近邻距离
3a 4
a 2
二、离子晶体
一般离子晶体配位数由阴阳离子半径决定:
一般来说半径比(rˉ/r+)在0.2~0.4之间的,配 位数为4;
于 2 1 1
3 3 2
, 即:
r 2a 1b 1c 332
c
b a
(2)立方密积 (Au,Ag,Cu,Al,Ni)
第一层:每个球与6个球相切,有6个空隙,如编 A
号为1,2,3,4,5,6。
