制碱工业
制碱工艺介绍

制碱工艺纯碱概述纯碱即碳酸钠,系单斜体晶体,化学分子式Na2CO3,也称苏打(Soda)或碱灰(Soda ash),外观呈白色粉末。
从化学分子式来看应为盐,但由于水溶液呈强碱性(1mol/L水溶液,25℃,PH=11.84),故称之为碱。
因天津碱厂合成碱纯度高,故将合成碱称之为纯碱,一直沿用至今。
纯碱的真实密度为2.533 g/cm3(20℃),熔点851℃,随颗粒大小不同,堆积密度也随之而变,因而有轻质纯碱和重质纯碱之分。
碳酸钠易溶于水,形成3种水合物:Na2CO3.10H2O;Na2CO3.7H2O;Na2CO3.H2O;当温度高于109℃时从水溶液中析出无水物。
十水碳酸钠简称十水碱亦称晶碱或洗涤碱,在32℃以下稳定存在。
当夏日气温超过32℃会溶解在自己的结晶水中,在低空气温度时,就会分化,脱除部分结晶水而成粉末。
因其在水中速溶,故在家庭中乐于用作洗涤剂和食用面碱。
一水碳酸钠简称一水碱,性质最为稳定,用于摄影行业中的显影液。
七水碳酸钠因为不稳定,在工业和民用方面无大用途,故不成为商品。
纯碱基本上可以称得上是无毒无害的安全物质。
但由于它呈碱性,如果人体与之接触时会受到刺激,发生皮炎。
开始时双臂、双手和双腿发红,偶尔发生小脓包和溃疡,最终导致皮肤变厚,色素沉积和产生疤痕。
纯碱的最大用户是玻璃制造业(约50%),为玻璃容器、玻璃瓶、平板玻璃和玻璃纤维的制造原料。
其次是用于其它化学制品的生产,如烧碱、洁碱、各种磷酸钠、硅酸钠、氧化铝、硼砂、铬酸钠及其它铬化学制品。
纯碱也在洗涤剂中得到了大量应用;此外纯碱还大量用于纸浆、造纸和水处理中,并用作中和、沉淀和增溶的药剂。
因此纯碱作为基本化工原料,在国民经济中占有重要地位,它是世界上用量最大化工产品之一。
纯碱工业发展简史在很早以前,人们就开始使用天然碱湖中的碱以及海草灰中的碱供洗涤和制造玻璃之用,现在保存下来的最古老的埃及玻璃大约是公元前1800年制造的。
在我国1700年前的著名药书“本草纲目”中记载“菜蒿蓼之属、晒干、烧灰、以原水淋汁,去垢发面。
制碱工业发展史

制碱工业发展史一、古代制碱工业古代制碱工业可以追溯到5000多年前,早在公元前3500年,古巴比伦和苏美尔人就已掌握了制碱的技术。
其后,古埃及人也开始制碱的生产。
他们利用尼罗河的沉淀物和碳酸钠制取碱,这种碱在制皂和玻璃等行业中得到广泛应用。
古代中国也有制碱的传统,早在春秋战国时期,中国已经开始用木灰和石灰等物质制取碱。
古代希腊罗马时期,碳酸钠已经成为一种重要的商品,使用范围涵盖了许多领域,包括皂类、玻璃类、冶金工业等。
在制碱生产方面,古代人凭借其丰富的实践经验,探索出了一些简单的工艺方法。
这些方法虽然没有现代化工生产技术那么复杂,但通过长期实践和总结,实现了古代社会对碱的需求。
二、近代制碱工业的兴起16世纪后,伴随着工业革命的兴起和科学研究的发展,制碱工业进入了一个新的发展阶段。
这一时期,以法国为代表的欧洲国家开始了制碱工业的兴起。
法国科学家Leblanc于1791年成功发明了蒸馏盐法,这一方法将盐从海水中提取出来,并通过一系列的反应制取出了碳酸钠。
这种方法成为了当时最主要的碱生产工艺。
很快,英国、德国、美国也开始效仿法国的方法大规模生产碱。
在19世纪初期,随着化学工业的发展,碱的需求量逐渐增加,制碱工业也迎来了全面的发展。
当时的制碱工艺主要有盐湖蒸发法、蒸馏法和氯化钠电解法等。
其中氯化钠电解法的发明,开辟了新型制碱工艺的先河。
三、现代制碱工业的发展20世纪初,随着化学工业的迅速发展和科学技术的进步,制碱工业进入了现代化生产阶段。
在20世纪30年代,氯化钠电解法逐渐成为了主流的碱生产工艺。
这种技术具有高效、节能、环保的特点,使得生产成本大大降低,质量也得到了进一步提升。
同时,氯化钠电解法也拓宽了碱的应用领域,使得碱可以广泛应用于化工、冶金、轻工、建材等领域。
20世纪中叶,我国的碱业也逐渐发展起来,成为了国民经济的重要支柱产业。
中国的碱业以天然碱为主,主要有盐湖提碱和碱性泉水提碱两大类。
其中,盐湖提碱主要分布在青海和内蒙古等地,以镁盐、钠硫盐等为原料;碱性泉水提碱主要分布在重庆、西藏、贵州等地,以温泉和电泳泉为原料。
5.3化工生产--侯氏制碱法1-lu

a、c
(a)增大NH4+的浓度,使NH4Cl更多地析出
(b)使NaHCO3更多地析出
(c)使NaHCO3转化为Na2CO3,提高析出的 NH4Cl纯度
侯德榜制碱法 原料: CO2 、NH3、NaCl
2NaHCO3 产物的生成: △
Na2CO3 + CO2 + H2O
滤液:NaCl 滤渣:NH4Cl
1、通入NH3: a、增大NH4+的浓度,使NH4Cl更多地析 出 b 、使 NaHCO3 转化为 Na2CO3 ,提高析 出NH4Cl的纯度 2 、 降 温 , 并 加 入 过 量 NaCl : 低 温 时 NH4Cl 溶解度比NaCl小,所以可 以使NH4Cl析出,同时补充Na+
CO2 :高温下焦炭与水蒸气的反应 NH3 :工业合成氨的反应
22 n
原料来 源 循环物 质 优缺点
CO2 :石灰石的煅烧 NH3 :Ca(OH)2与NH4Cl的反应
CO2
NH3
CO2
NaCl
优点: 1、原料(食盐和石灰石)便宜; 2、产品纯碱的纯度高; 3、副产品氨和二氧化碳都可以回收循 环使用; 4、制造步骤简单,适合于大规模生产。 1、 NaCl利用率低 缺点: 2、生成用途不大的CaCl2
索尔维制碱法
原料: CO2 、 NaCl、 NH3
△ 产物的生成: 2NaHCO3
Na2CO3 + CO2 + H2O
Ca(OH)2 NH3 + CaCl2 滤液的处理( NH4Cl、NaCl)
索尔维法的优点: 1、原料(食盐和石灰石)便宜;
2、产品纯碱的纯度高; 3、副产品氨和CO2都可循环使用; 4、步骤简单,适合于大规模生产。
纯碱工业制法

纯碱工业制法
氯化钠、石灰石(经煅烧生成生石灰和二氧化碳)、氨气为原料来制取纯碱。
先使氨气通入饱和食盐水中而成氨盐水,再通入二氧化碳生成溶解度较小的碳酸氢钠沉淀和氯化铵溶液。
将经过滤、洗涤得到的NaHCO3微小晶体,再加热煅烧制得纯碱产品。
放出的二氧化碳气体可回收循环使用。
含有氯化铵的滤液与石灰乳[Ca(OH)2]混合加热,所放出的氨气可回收循环使用。
氨碱法的优点是:原料(食盐和石灰石)便宜;产品纯碱的纯度高;副产品氨和二氧化碳都可以回收循环使用;制造步骤简单,适合于大规模生产。
但氨碱法也有许多缺点:首先是两种原料的成分里都只利用了一半——食盐成分里的钠离子和石灰石成分里的碳酸根离子结合成了碳酸钠,可是食盐的另一成分氯离子和石灰石的另一成分钙离子却结合成了没有多大用途的氯化钙,因此如何处理氯化钙成为一个很大的负担。
氨碱法的最大缺点还在于原料食盐的利用率只有72%~74%,其余的食盐都随着氯化钙溶液作为废液被抛弃了,这是一个很大的损失。
NaCl +NH3+H2O +CO2=NaHCO3+NH4Cl 。
2NaHCO3=Na2CO3+H2O +CO2。
纯碱工业_精品文档

氨
副产品氨、二氧化碳可循环使用
碱
步骤简单, 适用于大规模生产
法
两种原料的成分里只利用了一半
缺 点
食盐的利用率只有72%-74%
侯氏制碱法工业流程图
饱
过滤
和 食
通氨气
氨 洗涤 盐
盐 水
水 通CO2
煅烧 碳酸氢钠
加氯化钠 细粉、通 滤液 氨气
氨气
NH4Cl NaCl
二氧化碳
冷却、 过滤、 洗涤、 干燥
二氧化碳 (循环 使用)
纯碱(产品)
氯化铵(产品)
饱和NaCl(循环 使用)
合成氨工厂
联 食盐的利用率提高到96%以上 合 制 碱 综合利用了氨厂的二氧化碳和碱厂 法 的氯离子, 生产出纯碱和氯化铵。
侯氏制碱法的主要步骤:
①向饱和的NaCI溶液中通入NH3至饱和 , 再 通入过量CO2得到固体NaHCO3 ②再将所得NaHCO3焙烧制得纯碱 ③向析出小苏打的母液中加入研细的NaCI, 还得到另一产品NH4CI固体
绿色化学
• 绿色化学是研究和寻找能充分利用的无毒害原 材料,最大程度的节约能源,在各环节上实现 净化和无污染的反应途径。它的过程为零排放 和污染。具体内还体现在五个“R”上。
• 1、减量(Reduction) • 2、重复使用(Reuse) • 3、回收(Recycling) • 4、再生(Regeneration) • 5.拒用(Rejection)
减小。 溶解度
(5)向母液中加入研细50 的氯化钠后NH4,Cl 为什
40
么会析出固体氯化铵呢?
30
NaCl
20
10
0
10 20 图301 40 50 60 温度
纯碱的工业生产方法

CO2 + H2
侯德榜制碱法的优点: ——联合制碱法
1、提高了氯化钠的利用率
2、同时得到了纯碱和氯化铵两种产品 3、综合利用了氨厂的废弃物 CO2,工厂设 备比氨碱法简单
3、氨碱法和联合制碱法比较
化工生产基本原理 优点 缺点
工艺不同料低廉,成本降低, 氨循环利用;产品纯度 高;制造步骤简单
(一)氨碱法生产纯碱(索尔维制碱法)
CaCO3→CO2+CaO
CaO+H2O→Ca(OH)2
NaCl NaCl+NH3+CO2+H2O→NaHCO3+NH4Cl
2NaHCO3→N产a2品CO3+CO2+H2O
2NH4Cl+Ca(OH)2 →2NH3+CaCl2+2H2O
NaCl
副产品
NaCl
优点:
纯碱的工业生产方法
纯碱的用途
玻璃
食品
造纸
制皂 纺织
纯碱的制法
目前纯碱的生产方法有索尔维法 (氨碱法)、联碱法及天然碱法。美 国是世界纯碱生产第一大国,纯碱全 部来自天然碱。亚洲纯碱以合成碱为 主,主要生产国家为中国、印度和日 本。
天然盐湖制碱法 索尔维法(氨碱法) 侯氏制碱法(联合制碱法)
内蒙古鄂尔多斯 合同查汗淖碱湖
原料便宜易得,产品纯度高,氨和部 分二氧化碳可以循环使用,制作步骤简单。
缺点:
副产物氯化钙的处理,食盐的利用率 不高,大约只有70%。
如何进一步提高食盐的利用率,不生成无用 的CaCl2是必须要解决的问题。
1939年,侯德榜改良了索尔维制碱法, 摒弃了氨碱法的缺点,被称为侯德榜制碱法。
侯德榜
工业制碱的三种方法

工业制碱的三种方法工业制碱是指利用化学反应的方法大规模生产碱性物质的过程。
在工业生产中,制碱的方法有多种,其中比较常用的有盐湖卤水法、氯碱法和氧化铝法。
下面将分别介绍这三种工业制碱的方法。
一、盐湖卤水法盐湖卤水法是利用含有丰富盐碱资源的盐湖卤水进行制碱的方法。
具体步骤如下:1. 提取盐湖卤水:将盐湖卤水提取出来,通常采用蒸发结晶或离心等方式。
2. 氯化钙反应:将提取的盐湖卤水与氯化钙反应,生成氯化钠和氯化镁。
3. 碳酸钠析出:将氯化钠溶液与二氧化碳反应,生成碳酸钠溶液。
4. 结晶分离:将碳酸钠溶液进行蒸发结晶,得到固体碳酸钠。
盐湖卤水法的优点是原料丰富,生产成本低,但同时也存在一些问题,如资源的限制和环境污染等。
二、氯碱法氯碱法是利用氯气和氢气通过电解盐溶液制取碱性物质的方法。
具体步骤如下:1. 电解盐溶液:将盐溶液注入电解槽中,通入氯气和氢气。
2. 电解反应:在电解槽中,氯气在阳极上发生氧化反应,生成氯气和氧气,氢气在阴极上发生还原反应,生成氢气。
3. 氢氧化钠析出:由于阴极反应生成的氢气和氢氧化钠反应,生成氢氧化钠溶液。
氯碱法是目前工业生产碱性物质最常用的方法之一,因其原料广泛,生产过程稳定,成本相对较低。
三、氧化铝法氧化铝法是利用氧化铝和碳酸钠反应制取碱性物质的方法。
具体步骤如下:1. 氧化铝制备:将铝矾土经过破碎、煅烧等工艺制成氧化铝。
2. 碳酸钠反应:将氧化铝与碳酸钠溶液反应,生成氢氧化铝和碳酸钠溶液。
3. 氢氧化铝析出:将碳酸钠溶液进行蒸发结晶,得到固体氢氧化铝。
氧化铝法在工业生产中应用较少,因为其原料稀缺,生产成本较高。
盐湖卤水法、氯碱法和氧化铝法是工业制碱的三种常用方法。
每种方法都有其特点和适用范围。
随着科技的发展,工业制碱的方法也在不断改进和创新,以提高生产效率和降低成本,为人们的生活和工业生产提供更多碱性物质的需求。
第五章-制碱工业

内厂家较少采用。
• 转鼓式真空过滤器,依次完成吸碱,吸干,洗涤,挤压,刮 卸,吹除过程。
五)重碱煅烧得纯碱成品及CO2
煅烧原理:
2NaHCO3 → Na2CO3+ CO2 + H2O
重碱 晶浆 过滤 母液 蒸氨 煅烧
6)母液中氨的蒸发与回收
母液中气态氨通过蒸发回收,液体中NH4Cl与石灰乳反应回 收氨气:
2.操作指标
△H>0 放热 △H<0 吸热
温度:940~1200℃,加快反应速度,但温度过高会烧结; 窑气中CO含量小于0.6%,O2含量小于0.3% 理论上,窑气中CO2含量为44.2%,但一般在40%左右。
3、石灰乳制备的原理
1)消化反应 CaO(s) +H2O(l) = Ca(OH)2(s) △H<0 MgO(s) +H2O(l) = Mg(OH)2(s) △H<0 放热反应。 2)四种产品(根据加入水的量) 消石灰,细粉末; 水少量 水稍多 石灰膏,稠厚; 水适量 石灰乳,悬浮液,氨回收需要; 水过量 石灰水,溶液。
2NH3(l)+CO2 (g)+H2O (l) = (NH4 ) 2CO3 (aq)
3.钙镁离子的沉淀反应
△H<0
三)氨盐水碳化制得重碱;
• NaCl+NH3+CO2 + H2O =NaHCO3 +NH4Cl 目的:制造碳酸氢钠结晶 工艺要求: • 碳酸氢钠的产率高(氯化钠和氨的利用率高); • 碳酸氢钠的结晶质量高(结晶颗粒要大)。
NaCl 盐析
过滤 吸氨
冷析 换热降温
分离 氯化铵
MI,NaHCO3,NH4Cl,NH4HCO3,NaCl
侯氏制碱的工业流程

侯氏制碱的工业流程## Industrial Flow of the Hou Process for Alkali Production.Introduction.The Hou process is an industrial process developed in China in the early 20th century to produce sodium carbonate (soda ash) from salt. It is based on the Solvay process, which is the main industrial process for producing soda ash worldwide. However, the Hou process has some advantages over the Solvay process, such as lower energy consumption and no production of ammonium chloride as a by-product.Process Flow.The Hou process consists of the following steps:1. Brine preparation.Seawater or natural brine is purified to remove impurities such as calcium and magnesium ions. This is done by adding lime (calcium oxide) to the brine, which precipitates the impurities as insoluble carbonates. The clarified brine is then concentrated by evaporation.2. Ammoniation.The concentrated brine is cooled and then saturated with ammonia gas. This forms ammonium bicarbonate, which precipitates out of solution.3. Carbonation.The ammonium bicarbonate is heated in a reactor with carbon dioxide gas under pressure. This converts the ammonium bicarbonate to sodium bicarbonate, which is insoluble in water and precipitates out of solution.4. Calcination.The sodium bicarbonate is filtered out of the solutionand then calcined in a kiln at high temperature. This drives off the carbon dioxide and water, leaving behind sodium carbonate.5. Causticization.The sodium carbonate is dissolved in water to form a solution of sodium hydroxide (caustic soda). This solution is then concentrated by evaporation.Advantages of the Hou Process.The Hou process has several advantages over the Solvay process, including:Lower energy consumption.The Hou process requires less energy than the Solvay process because it does not require the production of ammonium chloride.No production of ammonium chloride as a by-product.Ammonium chloride is a by-product of the Solvay process, and it can be difficult to dispose of. The Hou process does not produce ammonium chloride, so this problem is avoided.Higher purity of the sodium carbonate product.The sodium carbonate produced by the Hou process is of higher purity than that produced by the Solvay process.This is because the Hou process does not produce any ammonium chloride, which can contaminate the sodium carbonate product.Disadvantages of the Hou Process.The Hou process also has some disadvantages, including:Higher capital cost.The Hou process requires a more complex reactor thanthe Solvay process, which increases the capital cost.Longer production time.The Hou process takes longer to produce sodium carbonate than the Solvay process.Overall, the Hou process is a viable alternative to the Solvay process for the production of sodium carbonate. It has several advantages, but it also has some disadvantages. The choice of which process to use depends on the specific needs of the producer.## 侯氏制碱工业流程。
侯氏制碱的工业流程

侯氏制碱的工业流程下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by the editor. I hope that after you download them, they can help yousolve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!In addition, our shop provides you with various types of practical materials, such as educational essays, diary appreciation, sentence excerpts, ancient poems, classic articles, topic composition, work summary, word parsing, copy excerpts,other materials and so on, want to know different data formats and writing methods, please pay attention!侯氏制碱的工业流程是一项在化工行业中广泛应用的生产工艺,它通过一系列复杂的步骤将氯化氢和氢氧化钠进行反应,最终产出氢氧化钠和盐酸。
近代纯碱和烧碱工业

2NaCl+H₂SO₄==Na₂SO₄+2HCl
(1)吕布兰制纯碱法
Na₂SO₄+4C==Na₂S+4CO Na₂S+CaCO₃==Na₂CO₃+CaS 这一生产过程有两种副产品一一一氯化氢和硫化钙。最初,它们作为废料被遗弃,结果造成 了严重的环境污染,使生产商大伤脑筋。于是,一些工业化学家开始研究回收的办法 1822年,英国工业化学家钱斯(A. M. Chance,1844—1917)利用将含有二氧化硫的烟道气通 入废料中,使硫化钙先转变成硫化氢,再氧化成硫磺的方法回收硫化钙 CaS+CO十Ho==CaCO+H2S H2S+O2==2S+H20 1836年,哥塞创造性地使用焦炭充填的洗涤塔使上升的氯化氢气体下降而被水吸收的方法, 得到了盐酸。1866年,狄青和胡尔特将氯化氢气体与预热的空气混合后通过铜或锰的氧化 物变成氯气,然后将氯气用石灰水吸收制成漂白粉,获得专利 4HCI+02==2H2O+2Cl
命名为"侯氏制碱法",在化学工业发展历程上留下了光辉的足迹,充分显示了中华民族的智慧和力量
4 (4)近代烧碱工业
(4)近代烧碱工业
1890年,德国人斯特劳夫和 布劳尔开发了水泥隔膜式电 解槽,使阳极上产生的氯气 和阴极产生的氢氧化钠分开
但由于当时电力不发达,未 能工业化生产
8 7
1807年 ,戴维电解氯化钠水 溶液,在阴极得到金属钠,
展奠定了基础
尽管吕布兰法曾盛行一时,但其高耗能、 低产量、劣质量和恶劣的生产条件等不 可回避的缺点,迫使人们寻找更完美的
工业化学-第三章纯碱工业

3 第 章 制碱工业
3.2 石灰石的煅烧和盐水吸氨 3.2.3 石灰窑的主要操作指标
2.窑上下部温度 通常维持较低温度,既可减少过程的热损失,又可减轻窑气 洗气塔的冷却负荷,并且保护旋转灰盘。生产上窑气温度为 50~100℃,出灰温度为30~60℃。
3 第 章 制碱工业
3.2 石灰石的煅烧和盐水吸氨
2、氨盐水的制备 饱和盐水的制备和精制;盐水吸氨生成氨盐水:
NH3 + H2O = NH4OH + Q
3 第 章 制碱工业
3.1 概 述
3.1.3 氨碱法生产纯碱的主要过程
3、氨盐水碳酸化 NaCl + NH3 + CO2 + H2O = NH4Cl + NaHCO3 + Q NaHCO3的结晶(重碱)用过滤法从母液中分离出来。
3.2.4 盐水的精制与吸氨
3-4
吸氨塔结构及吸氨流程见右图。 塔体为24层塔圈连接而成,上半部 装有单泡罩塔板。塔自上而下分洗 涤段,吸收段,循环贮槽,氨盐水 贮槽4部分。精制盐水经冷却排管 送入塔顶,靠重力作用逐板流下。 气体则通过泡罩边缘分散成细泡, 扩大气液间的接触。氨气在塔中部 引入,将循环贮槽(8~10圈)中的溶 液冷却后送回氨气入塔部位,降温 以提高吸氨效果。部分氨盐水经澄 清桶排泥、排管冷却后送入氨盐水 贮槽(1~7圈)。
3 第 章 制碱工业
3.1 概 述
3.1.2 纯碱的工业生产方法
2、联碱法 1942年化学家侯德榜的研究成果,科学地将合成氨与制碱工 艺联合起来,称“联合制碱法”,或“侯氏制碱法”。 联碱法以食盐(NaCl)、合成氨装置的产品氨(NH3)、副 产品二氧化碳(CO2),产品为纯碱和氯化铵(NH4Cl)。 联碱法具有原料利用率高,可达95%以上,不需石灰石和焦 炭,节省了原料、能量及运输等的消耗,故成本低,流程短, 无大量废液、废渣等优点。
微专题化工生产纯碱工业(侯氏制碱法和索氏制碱法)
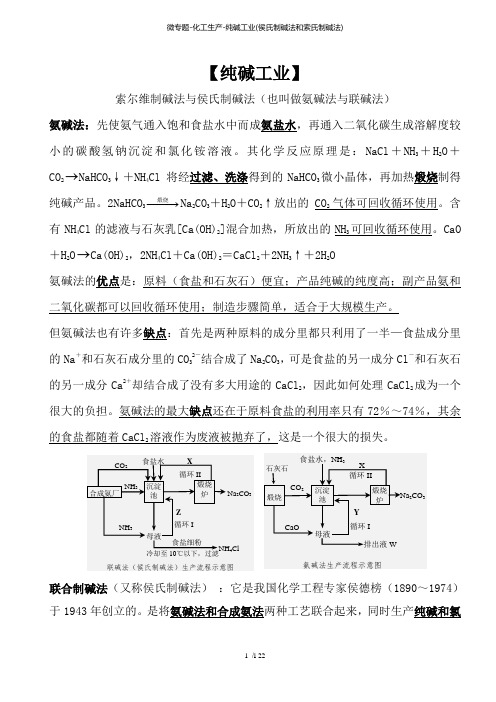
【纯碱工业】索尔维制碱法与侯氏制碱法(也叫做氨碱法与联碱法)氨碱法:先使氨气通入饱和食盐水中而成氨盐水,再通入二氧化碳生成溶解度较小的碳酸氢钠沉淀和氯化铵溶液。
其化学反应原理是:NaCl +NH 3+H 2O +CO 2→NaHCO 3↓+NH 4Cl 将经过滤、洗涤得到的NaHCO 3微小晶体,再加热煅烧制得纯碱产品。
2NaHCO 3−−−→煅烧Na 2CO 3+H 2O +CO 2↑放出的CO 2气体可回收循环使用。
含有NH 4Cl 的滤液与石灰乳[Ca(OH)2]混合加热,所放出的NH 3可回收循环使用。
CaO +H 2O →Ca(OH)2,2NH 4Cl +Ca(OH)2=CaCl 2+2NH 3↑+2H 2O氨碱法的优点是:原料(食盐和石灰石)便宜;产品纯碱的纯度高;副产品氨和二氧化碳都可以回收循环使用;制造步骤简单,适合于大规模生产。
但氨碱法也有许多缺点:首先是两种原料的成分里都只利用了一半—食盐成分里的Na +和石灰石成分里的CO 32-结合成了Na 2CO 3,可是食盐的另一成分Cl -和石灰石的另一成分Ca 2+却结合成了没有多大用途的CaCl 2,因此如何处理CaCl 2成为一个很大的负担。
氨碱法的最大缺点还在于原料食盐的利用率只有72%~74%,其余的食盐都随着CaCl 2溶液作为废液被抛弃了,这是一个很大的损失。
联合制碱法(又称侯氏制碱法) :它是我国化学工程专家侯德榜(1890~1974)于1943年创立的。
是将氨碱法和合成氨法两种工艺联合起来,同时生产纯碱和氯化铵两种产品的方法。
原料是食盐、氨和二氧化碳(合成氨厂用水煤气制取氢气时的废气,其化学反应原理是:C+H2O→CO+H2 CO+H2O→CO2+H2)联合制碱法包括两个过程:第一个过程与氨碱法相同,将氨通入饱和食盐水而成氨盐水,再通入二氧化碳生成碳酸氢钠沉淀,经过滤、洗涤得NaHCO3微小晶体,再煅烧制得纯碱产品,其滤液是含有氯化铵和氯化钠的溶液。
候式制碱法的故事

候式制碱法的故事
侯氏制碱法是我国化学工程专家侯德榜于1943 年创立的,是将氨碱法和合成氨法两种工艺联合起来,同时生产纯碱和氯化铵两种产品的方法。
20 世纪20 年代,比利时人索尔维发明了氨碱法制纯碱,使制碱工业发生了重大变化。
氨碱法在生产过程中,需要使用大量的氯化钠,同时会产生大量的氯化钙,氯化钙难以处理,会造成环境污染。
此外,氨碱法还需要消耗大量的石灰和煤炭,生产成本较高。
为了解决这些问题,侯德榜经过多年的努力,终于在1943 年发明了侯氏制碱法。
侯氏制碱法的主要原理是利用合成氨工业中的废气二氧化碳来代替氨碱法中的石灰,从而减少了氯化钙的生成,同时也降低了生产成本。
侯氏制碱法还可以利用氯化铵来回收氨,使氨得到循环利用,降低了氨的消耗。
侯氏制碱法的发明,是我国制碱工业的一项重大技术创新,为我国的制碱工业做出了重要贡献。
同时,侯氏制碱法的成功,也为其他国家的制碱工业提供了有益的借鉴和启示。
侯德榜为了探索制碱技术,曾远渡重洋到美国学习,回国后经过不断的摸索和试验,终于成功地发明了侯氏制碱法。
他的故事告诉我们,只要有坚定的信念和不懈的努力,就能够克服困难,取得成功。
纯碱工业的发展历程

纯碱制造工艺的发展历程纯碱,化学名叫做碳酸钠,俗名苏打。
化学式:Na2CO3,普通情况下为白色粉末,为强电解质。
密度为2.532g/cm3,熔点为851℃,易溶于水,具有盐的通性。
纯碱是一种重要的基本化工原料,广泛应用于建材、轻工、化工、冶金、纺织等工业部门和人们的日常生活。
在建材方面主要用于制造平板玻璃;在轻工方面主要用于洗衣粉、三聚磷酸钠、保温瓶、灯泡、白糖、塘瓷、皮革、日用玻璃、造纸等;在化工方面主要用于苛化烧碱、小苏打、红矾钠、硝酸钠、亚硝酸钠、硅酸钠、硼砂等;在冶金方面主要用作冶炼助熔剂等。
另外,纯碱还可用于显像管、石油、医药、国防军工等部门。
早期纯碱都是取自天然的植物碱或矿物碱,由于技术落后,产量很低,渐渐地无法满足人们的生活需求。
随着18世纪中期工业革命从英国开始后,纺织、印染、造纸、制皂和玻璃等工业需求的碱量剧增,单靠从植物碱和矿物碱提取的碱明显不足,人工制碱在这个时候诞生了。
一、吕布兰法1.产生背景1783年,法国科学院以1200法郎高额奖金悬赏征求制造纯碱的方法。
1789年,法国奥尔良地区封建主公爵的侍从医生吕布兰(N.Leblanc,1742—1806)成功地创造了一种制碱的方法,1791年获得专利,建立起日产250—300 kg的碱厂。
吕布兰制碱法所用的原料主要有食盐、硫酸、木炭和石灰石。
直到20世纪20年代被索尔维法所取代。
2.生产工艺第一步利用硫酸将食盐转变为硫酸钠:2NaCl + H2SO4===Na2SO4 + 2HCl第二步将硫酸钠与木炭、石灰石在炉中共热。
炉中硫酸钠与木炭作用后生成硫化钠和一氧化碳:Na2SO4 + 4C===Na2S + 4CO↑接着硫化钠与石灰石(CaCO3)进行反应,生成碳酸钠和硫化钙:Na2S + CaCO3===Na2CO3 + CaS由于产物中混有未反应的黑炭,因此产物成黑色灰状物,称为黑灰。
黑灰中含40%—45%的碳酸钠。
第三步将黑灰用水浸取,溶液经浓缩后碳酸钠结晶析出。
索尔维制碱法历史

索尔维制碱法历史导语:索尔维制碱法是一种常见的制碱工艺,它以盐湖中的矿石为原料,通过一系列的化学反应,生产出纯净的碱。
本文将介绍索尔维制碱法的历史,从其起源到发展演变,带您一起了解这一历史悠久的工艺。
一、起源与发展索尔维制碱法起源于十九世纪初的法国,由法国化学家尚蒂安·索尔维于1807年首次提出。
尚蒂安·索尔维发现,通过加热盐湖中的矿石,可以获得一种含有氢氧化钠的溶液。
这一发现为后来的索尔维制碱法奠定了基础。
随着科学技术的发展,索尔维制碱法逐渐得到改进和完善。
1838年,法国化学家路易·博瓦尔成功地将索尔维制碱法应用于实际生产中,并取得了较为显著的成果。
此后,索尔维制碱法得到了广泛的应用和推广。
二、制碱原理索尔维制碱法是一种通过加热盐湖中的矿石,使其分解产生氢氧化钠溶液的工艺。
具体来说,制碱的原理可以分为以下几个步骤:1. 矿石的提取:首先需要从盐湖中提取出富含碱金属的矿石,常见的有纯碱石和重晶石等。
2. 矿石的煅烧:将提取出的矿石进行煅烧,使其分解产生氧化物。
煅烧温度和时间的控制对后续的反应过程至关重要。
3. 氧化物的溶解:将煅烧后的氧化物溶解于水中,生成氢氧化钠溶液。
溶解过程中需要控制温度和浓度,以保证产物的纯度和质量。
4. 结晶和精制:通过结晶和精制过程,将氢氧化钠溶液中的杂质去除,得到纯净的碱。
三、优缺点索尔维制碱法作为一种传统的制碱工艺,具有以下优点:1. 原料丰富:盐湖中的矿石资源非常丰富,可以持续供应制碱工业的原料需求。
2. 工艺成熟:索尔维制碱法经过长期实践和改进,工艺流程已相对成熟,操作简单可靠。
3. 产品纯度高:制碱的产物纯净度高,可以满足各种工业和农业领域的需求。
然而,索尔维制碱法也存在一些缺点:1. 能源消耗大:制碱过程中需要大量的能源供应,对环境造成一定的压力。
2. 溶液浓度限制:索尔维制碱法在溶液浓度方面存在一定的限制,对于高浓度碱的生产较为困难。
纯碱的生产工艺

纯碱的生产工艺一、纯碱的工艺简述纯碱工艺简述:化学名称:碳酸钠;俗名:纯碱、重灰或轻灰;分子式:Na2CO3;分子量:105.99(按79年国际原子量);生产原料原盐、氨(NH3)、二氧化碳、水;生产基本原理:该厂采用联合制碱法生产纯碱和氯化氨。
联碱法生产采用一次加盐,两次吸氨,一次碳化,两次取出的冷法流程。
生产分为两个过程进行:?过程为纯碱生产过程,?过程为氯化氨生产过程。
两个过程构成一个封闭循环系统,不断投入原料(NH3、NaCl、H2O、CO2),同时不断地生产出纯碱和氯化氨两种产品。
联碱过程,即?和?过程:主要化学反应:N a Cl+NH3+H2O+CO2?NH4Cl+NaHCO3?+95.05kJ/mol二、纯碱工程设计中非金属管道材料的选用纯碱生产中的工作介质多为腐蚀性介质或冲刷磨损性介质,以往有的金属管道在使用较短时间就会损坏或泄漏,严重影响生产连续性,恶化了工艺指标。
从而加了大管道维护、检修工作量,增加了产品成本。
非金属管道与金属管道相比具有如下优点:?非金属管道没有电化学腐蚀,耐腐蚀性能好,不需对其进行防腐处理,维修费用低,寿命长;?非金属管道较金属管道更有内壁光滑,流体阻力小,不易结疤;?非金属管道重量轻,安装检修方便。
因此,为了改善生产条件,提高经济效益和竞争力,合理地选用新型非金属材料势在必行。
三、纯碱工业的发展纯碱是重要的工业原料,广泛应用于玻璃、化工、轻工、冶金等行业。
有人称纯碱是工业之母,其消费水平可以衡量一个国家的工业化水平,其实并不过分。
事实上,我国的民族工业也正是从范旭东先生创建永利碱厂起步的。
目前,我国的纯碱产量在国内化工产品中仅次于合成氨、化肥、硫酸,而列第四位。
在美国,尽管纯碱的产值在整个国民产值中比例很小,但由于其终端用户如汽车业、建筑业,对整个国民经济举足轻重,因此,联邦储备局将其月产量纳入工业生产经济指数,足见纯碱在国民经济中的重要性。
四、纯碱装置碳化塔的温度控制铵盐水吸收二氧化碳的碳酸化过程俗称碳化,碳化是纯碱生产过程中的一个关键工序。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Na2CO3 + CO2
NH3和NaCl
NH4Cl
CO2 NH3 NaCl H 2O
NaHCO3
NH4Cl
侯德榜的铜像
索尔维
索尔维国际会议
索尔维国际会议
; / 唐山办公宾馆家具厂家 bgk081vfc 孤独晓寂笑得腼腆的回应“啊,真是抱歉,我没有第一时间认出你来!”她的语气温和的让人没有办法继续跟她较真!这不能怪她,她平时放 假在家便几乎不出家门,况且莫艳艳他们家在高中过后便搬离了那个地方,她又向来无暇顾及其他。 莫艳艳又回到一开始的话题“我说、高材生,你怎么都沦落到端盘子的份上了?” 孤独晓寂并不气恼依旧笑的温和,难得遇上一个旧识,她心情居然莫名的变好了起来“我现在在读研,这家酒店要求会说意大利文,时薪也不 错,所以我在这里打零工!” 莫艳艳一下子被掐灭了火焰“哦,我就说呢!”略显心虚的笑了笑,又问道“那你一直在这个地方吗?” 孤独晓寂点点头“嗯”了声。 莫艳艳忽然笑着看向她“把你手机给我下”,然后在孤独晓寂的手机上点了一串数字,等到自己手机响铃过后便将手机还给了孤独晓寂“把我 的存上,以后常联系”。 那之后孤独晓寂不曾接到莫艳艳的,她也不甚在意,直到有一天莫艳艳打来“孤独晓寂,我能不能跟你合租?” 孤独晓寂似没反应过来的“啊?”了声。 莫艳艳不容她抗拒般的继续开口“你在哪里,我去找你!”。 孤独晓寂便听话的说出了住址,不到一个小时的时间,莫艳艳便打来让她在住房哪里去找她。倚在白色跑车上的莫艳艳,淡淡的看上一眼就会 让人感到有一种被时光艳羡了的感觉。 莫艳艳看到孤独晓寂之后笑呵呵的向她招了招手“你来了”,然后驾驶座上的男子便拎了一个行李箱下来,轻柔的问了莫艳艳一句“需不需要 我帮你送上去?” 莫艳艳笑的谄媚“不需要了,今天谢谢你送我过来!” 目送走了跑车男之后,莫艳艳看向孤独晓寂“过来帮我抬一下呀!”她说的甚是随意,似乎她们之间没有任何的隔阂,而事实是,孤独晓寂不 过是停留在快十年没见过的一个人的第二次见面中。
NH3 + CO2 + H2O == NH4HCO3 CO2和NH3应采取怎样的方式进行反应, 才能使溶液中产生较高浓度的HCO3- ? 注:物质的溶解性受其他物质的影响
以下是在一定温度下一些物质的溶解度。
溶解性 物质
0℃ 100℃
固体的溶解度(/100g H2O)
NaCl NaHCO3 NH4HCO3 NH4Cl
总反应方程式:
NaCl + CO2 + H2O + NH3 == NaHCO3 + NH4Cl
索尔维制碱法 原料:CO2 、NH3、NaCl、
产物:NaHCO3
滤液中
CБайду номын сангаасO
Na2CO3 + CO2 NH3 + CaCl2
侯德榜制碱法 原料:CO2 、NH3、NaCl、
产物:NaHCO3
35.7 39.12
6.9 16.4 0.08
11.9 分解 0.15
29.7 75.8 0.56
0℃时饱和溶 液中的物质的 0.61 量(100gH2O)
思考:
在室温条件下,向已被NaCl饱和的浓氨 水中通入CO2,首先会析出的物质是什么? ______。为什么?_____________。 注:不考虑物质溶于水时,在溶液中的相互影响。
溶液中c(HCO3-) > 1mol· L-1.
标准状况下CO2和NH3在水中的溶解度 如下表所示:
溶解性(体积比) 溶液的密度 (g ·cm-3) 饱和溶液的物质的量 浓度(mol ·L-1)
CO2 1.7 : 1 ~1 ~0.05
NH3 700 : 1 0.88 ~18
思考:
如果NH3与CO2在水溶液发生如下反应:
纯碱的工业制法
已知:在室温条件下NaHCO3的溶解度为 9 g/100gH2O,NaHCO3饱和溶液的物质的量 浓度大约为___mol· L-1。 1 1 溶液中c(Na+) = ____mol· L-1. 1 溶液中c(HCO3-) = ____mol· L-1.
思考:
要使溶液中析出NaHCO3晶体,该溶液 应满足的基本条件是: 溶液中c(Na+) > 1mol· L-1.
