高中化学选修五《有机化学基础》总结课件:有机化学之官能团
有机化学高中官能团总结

有机化学高中官能团总结有机化学中,官能团是决定有机化合物化学性质的关键部分。
在高中有机化学中,常见的官能团及其性质如下:1. 烃基(Alkyl Groups):烃分子中失去一个或几个氢原子而剩余的部分。
它们没有特殊的化学性质,但可以根据其碳原子数来命名,如甲基(CH₃−)、乙基(CH3CH2−)等。
2. 羟基(Hydroxyl Group, -OH):存在于醇类化合物中,具有弱酸性,能发生取代、酯化等反应。
3. 羧基(Carboxyl Group, -COOH):存在于羧酸中,具有酸性,能发生酯化反应。
4. 醛基(Aldehyde Group, -CHO):存在于醛类中,具有还原性,能发生氧化、加成等反应。
5. 酮基(Ketone Group, -CO-):存在于酮类中,具有还原性,能发生加成、氧化等反应。
6. 酯基(Ester Group, -COO-):存在于酯类中,能发生水解反应生成酸和醇。
7. 氨基(Amino Group, -NH2):存在于胺类中,具有碱性,能发生取代、酰化等反应。
8. 卤素原子(Halogen Atoms, -X, X=F, Cl, Br, I):存在于卤代烃中,能发生取代、消除等反应。
9. 双键(Double Bond, =C=):存在于烯烃中,能发生加成、氧化、还原等反应。
10. 三键(Triple Bond, ≡C≡):存在于炔烃中,能发生加成、氧化、还原等反应。
11. 苯环(Benzene Ring):存在于芳香烃中,具有特殊的稳定性,能发生取代、加成等反应。
了解这些官能团的性质,对于理解和预测有机化合物的化学行为至关重要。
在高中有机化学学习中,应熟练掌握这些官能团的基本性质和反应类型。
有机化学常见官能团总结.ppt

Ph
Ph
解答: H
Ph
Br2
H
Br
Ph +
Ph
CC
H
H
Br-
例如:
H B r
B r
Br H Ph H Ph
Br Br
Ph H Ph H
Br
Ph H Br Br H
Ph
Ph Br H H Br
Ph
4.涉及碳正离子的重排:
例如:
C H 2O H
H 2SO 4 175oC
CH2OH
CH2O +H2
+
CH2
R’X仅限于伯卤(1oRX, C6H5-X, CH2=CH-X,CH2=CH-CH2-X, C6H5-CH2-X),R2CuLi中的R可以是伯、仲烃基。
R2CuLi中,二甲基铜锂进行甲基化的产率最高,其次为伯烃基铜 锂试剂,仲、叔烃基的产率很低。
B r + ( C H 3 ) 2 C u L id ie t h y le t h e r
} R CH=CH Cl 硝 酸 银 的 醇, 加 溶热 液,Ag无 Cl Cl
} R CH=CH CH2Cl
CH2Cl
硝 酸 银 的 醇 ,A溶 gCl液
醇:Lucas试剂,ZnCl2/浓HCl(只能鉴别6个C以下的醇) 酸性KMnO4区分伯、仲、叔醇。
OH
烯醇( CH=CH 或
OH):FeCl3溶液显色反应
有机化学常见官能团总结
有机化学重点掌握的反应机理:
1. 自由基取代反应
例如:
R O O R
+C H C l3
C l C l
C l
解答:主要过程:
CHCl3 + RO
官能团ppt课件

②A+RCOOH
有香味的产物
③A
苯甲酸
④其催化脱氢的产物不能发生银镜反应
⑤脱水反应的产物,经聚合反应可制得一种塑料制品(它是目前造成
“白色污染”主要来源之一)。
试回答:
(1)根据上述信息,对该化合物的结构可作出的判断是
.
a.苯环上直接连有羟基
b.肯定有醇羟基
c.苯环侧链末端有甲基
d.肯定是芳香烃
(2)化合物A的结构简式为
有机化合物中官能团知识的整合
江西省吉安县立中学: 曾效林
1
一、考纲揭密
2.理解基团、官能团、同分异构、同系物等概念。 能够识别结构式(结构简式)中各原子的连接次 序和方式、基团和官能团。能够辨认同系物和列 举同分异构体。了解烷烃的命名原则。
4.以一些典型的烃类衍生物(乙醇、溴乙烷、苯 酚、甲醛、乙醛、乙酸、乙酸乙酯、脂肪酸、甘油 酯、多羟基醛、氨基酸等)为例,了解官能团在化 合物中的作用。掌握各主要官能团的性质和主要化 学反应。
5.加入溴水出现白色沉淀为苯酚
6.遇FeCl3溶液显紫色,有机物中含有酚羟基,遇浓HNO3变黄为含苯
基的蛋白质,遇I2变蓝为淀粉
12
[高考真题] 5.烯烃通过臭氧化并经锌和水处理得到醛或酮。例如:
I.已知丙醛的燃烧热为1815kJ·mol-1,丙酮的燃烧热为1 789kJ·mol-1, 试写出丙醛燃烧的热化学方程式 II.上述反应可用来推断烯烃的结构。一种链状单烯烃A通过臭氧化并经 锌和水处理得到B和C。化合物B含碳69.8%,含氢11.6%,B无银镜反应, 催化加氢生成D。D在浓硫酸存在下加热,可得到能使溴水褪色且只有一 种结构的物质E。反应图示如下:
2
二、有机化学考查特点
2020高考化学热门专题: 选修5——有机化学基础(50张ppt)

+(2n-1)H2O
羟基酸之间的缩聚:
+(n-1)H2O
反应类型
重要的有机反应
氨基酸之间的缩聚:nH2NCH2COOH+
缩聚反应
+(2n-1)H2O 苯酚与HCHO的缩聚:n +nHCHO
+(n-1)H2O
催化氧化:2CH3CH2OH+O2
2CH3CHO+2H2O
氧化反应 还原反应
醛基与银氨溶液的反应:CH3CHO+2Ag(NH3)2OH CH3COONH4+2Ag↓+3NH3+H2O
思考方向 1个双键或1个环 1个三键或2个双键(或考虑环结构) 3个双键或1个双键和1个三键(或考虑环结构) 考虑可能含有苯环
(2)化学性质与结构关系
化学性质 能与金属钠反应 能与碳酸钠溶液反应 与氯化铁溶液发生显色反应 发生银镜反应 发生水解反应
(3)核磁共振氢谱与结构关系 ①确定有多少种不同化学环境的氢。 ②判断分子的对称性。
可能的同分异构体的结构简式
、 、
一、高考题型的特点 高考化学试题中对有机化学基础的考查题型比较固定,通常以药物、材料、新物质的 合成为载体考查有机化学的核心知识。命题形式总体可分为三类:第一类是有机推断 型,即在合成路线中各物质的结构简式是未知的,需要结合反应条件、分子式、目标产 物、题给信息等进行推断;第二类是结构已知型,即合成路线中各物质的结构简式是已 知的,此类试题中所涉及的有机物大多是陌生且比较复杂的,需要根据前后的变化来分 析其反应特点;第三类是“半推半知”型,即合成路线中部分有机物的结构简式是已知 的,部分是未知的,审题时需要结合条件及已知结构去推断未知有机物的结构。涉及的 常见考点有:有机物结构简式的确定、官能团的名称、反应类型的判断、有机物的命 名、化学方程式的书写、同分异构体的分析和书写等。要求考生能够通过题给情境进 行分析、合理的迁移,运用所学知识解决实际问题。
选修5-有机化学基础基础知识梳理PPT

目 录
• 有机化学概述 • 烃类化合物 • 烃的衍生物 • 有机合成与反应机理 • 有机化学在生活中的应用 • 实验技能与安全意识培养
01 有机化学概述
有机化学定义与发展
定义
有机化学是研究有机化合物的结 构、性质、合成、反应机理以及 应用的一门科学。
发展历程
从18世纪末开始,随着化学学科 的不断发展,有机化学逐渐从无 机化学中分离出来,成为一门独 立的学科。
生物医用材料
如可生物降解高分子材料,用于手术缝合线、骨 修复材料等。
农业领域中的有机化学应用
01
02
03
04
农药
用于防治农作物病虫害,保障 粮食产量和质量安全。
化肥
提供植物生长所需的氮、磷、 钾等营养元素,促进作物生长
。
植物生长调节剂
通过调节植物内源激素水平, 促进或抑制植物生长和发育。
土壤改良剂
不对称合成法
通过手性辅助剂或手性催化剂,合成具有特定立体构型的手性化合 物。
反应机理类型及特点
取代反应机理
涉及原子或原子团的替换,如 卤代、硝化、磺化等反应。
加成反应机理
发生在不饱和键上,如烯烃、 炔烃的加成反应。
消除反应机理
从一个有机分子中消去两个原 子或原子团的反应,如醇的脱 水、卤代烃的脱卤化氢等。
醛、酮、醌
醛的分类和命名
根据醛基所连碳原子的类型,醛可分 为甲醛、乙醛和其他醛类。命名时, 将醛基作为取代基进行命名。
醛的物理性质
大多数醛是无色透明的液体或固体, 具有刺激性气味。低级醛具有还原性 ,能被弱氧化剂氧化成羧酸。
醛的化学性质
醛的主要化学性质包括氧化反应、还 原反应、缩合反应和歧化反应等。其 中,氧化反应是醛被氧化成羧酸的过 程;还原反应是醛被还原成醇的过程; 缩合反应是两个醛分子在碱性条件下 生成β-羟基醛的过程;歧化反应是醛 在特定条件下同时发生氧化和还原的 过程。
高中化学 选修5 有机化学基础课件

①1 mol 该有机物最多可与________mol H2 发生加成反应。 ②写出该物质在碱性条件(NaOH 溶液)下水解生成两种产物的结构简式。
(2)青蒿酸是合成青蒿素的原料,可以由香草醛合成:
判断下列说法是否正确,正确的打“√”,错误的打“×”。 ①用 FeCl3 溶液可以检验出香草醛 ②香草醛可与浓溴水发生反应 ③香草醛中含有 4 种官能团 ( ( ) ) ( ) ( ) )
答案:
(1)碳碳双键、羰基
(2)碳碳双键、羟基、醛基 (3)碳碳双键、(酚)羟基、羧基、酯基 (4)醚键、羰基 (5)醛基、碳碳双键
题组二
官能团与性质
2.从金银花中提取的绿原酸结构简式如图所示,其有抗菌、消炎、解毒、利 胆、降压和增加胃肠蠕动的作用,用于急性细菌性感染及放、化疗所致的白细胞 减少症。下列说法不正确的是( )
[互动拓展]
由于含有碳碳双键,绿原酸可以与 Br2 加成;与 H2 加成时,
可以与 1 mol H2 加成,苯环可以与 3 mol H2 加成,故绿原酸可与 4 mol H2 加成;由于含有碳碳双键、醇羟基和酚羟基等还原性官能团,故绿原酸可以使酸 性 KMnO4 溶液褪色。
3.按要求回答下列问题: (1)CPAE 是蜂胶的主要活性成分,其结构简式如图所示:
[破题关键] 氧化 羧基
酯基
酚羟基
醇羟基
羧基
酚羟基
解析: 绿原酸及其水解后的含酚羟基官能团的产物, 能被空气中的 O2 氧化, 故 B 项不正确;1 个绿原酸分子中的 1 个羧基、1 个酯基、2 个酚羟基,都能与 NaOH 反应,故 C 项正确;1 个绿原酸分子中的 1 个羧基、3 个醇羟基、2 个酚羟 基,都能与 Na 发生置换反应而放出氢气,故 1 mol 绿原酸与足量金属 Na 反应时 能产生 3 mol H2。 答案: B
有机化学之官能团性质总结
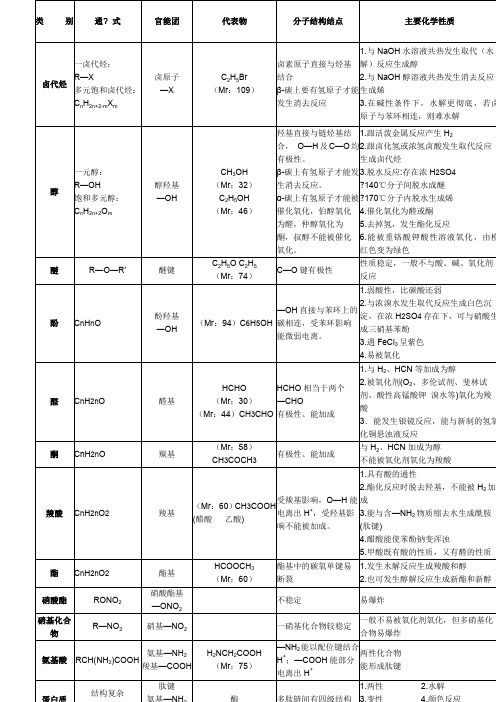
类别通? 式官能团代表物分子结构结点主要化学性质卤代烃一卤代烃:R—X多元饱和卤代烃:C n H2n+2-m X m卤原子—XC2H5Br(Mr:109)卤素原子直接与烃基结合β-碳上要有氢原子才能发生消去反应1.与NaOH水溶液共热发生取代(水解)反应生成醇2.与NaOH醇溶液共热发生消去反应生成烯3.在碱性条件下,水解更彻底,若卤原子与苯环相连,则难水解醇一元醇:R—OH饱和多元醇:C n H2n+2O m醇羟基—OHCH3OH(Mr:32)C2H5OH(Mr:46)羟基直接与链烃基结合,O—H及C—O均有极性。
β-碳上有氢原子才能发生消去反应。
α-碳上有氢原子才能被催化氧化,伯醇氧化为醛,仲醇氧化为酮,叔醇不能被催化氧化。
1.跟活泼金属反应产生H22.跟卤化氢或浓氢卤酸发生取代反应生成卤代烃3.脱水反应:存在浓H2SO4?140℃分子间脱水成醚?170℃分子内脱水生成烯4.催化氧化为醛或酮5.去掉氢,发生酯化反应6.能被重铬酸钾酸性溶液氧化,由橙红色变为绿色醚R—O—R′醚键C2H5O C2H5(Mr:74)C—O键有极性性质稳定,一般不与酸、碱、氧化剂反应酚C n H n O 酚羟基—OH(Mr:94)C6H5OH—OH直接与苯环上的碳相连,受苯环影响能微弱电离。
1.弱酸性,比碳酸还弱2.与浓溴水发生取代反应生成白色沉淀,在浓H2SO4存在下,可与硝酸生成三硝基苯酚3.遇FeCl3呈紫色4.易被氧化醛C n H2n O 醛基HCHO(Mr:30)(Mr:44)CH3CHOHCHO相当于两个—CHO有极性、能加成1.与H2、HCN等加成为醇2.被氧化剂(O2、多伦试剂、斐林试剂、酸性高锰酸钾溴水等)氧化为羧酸3.能发生银镜反应,能与新制的氢氧化铜悬浊液反应酮CnH2n O 羰基(Mr:58)CH3COCH3有极性、能加成与H2、HCN加成为醇不能被氧化剂氧化为羧酸羧酸C n H2n O2羧基(Mr:60)CH3COOH(醋酸乙酸)受羰基影响,O—H能电离出H+,受羟基影响不能被加成。
高中化学有机官能团总结

高中化学有机官能团总结
正文:
本文旨在为高中化学研究者总结有机官能团的基本概念和特点。
了解有机官能团的性质对于理解有机化合物的结构和性质至关重要。
1. 烷基官能团
烷基官能团是一类碳链上仅有碳—碳单键的官能团,例如甲基(-CH3)、乙基(-C2H5)等。
烷基官能团在有机化合物中常常作
为取代基,能够影响化合物的物理性质和化学反应。
2. 烯基官能团
烯基官能团是含有碳—碳双键的官能团,例如乙烯基(-
CH=CH2)。
烯基官能团具有不饱和性,容易进行加成反应和氧化
反应。
3. 炔基官能团
炔基官能团是含有碳—碳三键的官能团,例如乙炔基(-
C≡CH)。
炔基官能团具有高度不饱和性,容易进行加成反应和断
裂反应。
4. 羟基官能团
羟基官能团是含有羟基(-OH)的官能团,例如甲醇基(-
CH2OH)和乙醇基(-CH2CH2OH)。
羟基官能团具有亲水性,能够进行酸碱中和等反应。
5. 羰基官能团
羰基官能团是含有碳氧双键(C=O)的官能团,例如醛基(-CHO)和酮基(-C=O)。
羰基官能团具有重要的化学活性,可以进行加成反应、氧化反应和还原反应。
6. 羧酸官能团
羧酸官能团是含有羧基(-COOH)的官能团,例如甲酸基(-CHO2H)和乙酸基(-CH2COOH)。
羧酸官能团具有酸性,能够进行酸碱反应等。
总结:有机官能团是有机化学中的重要概念,不同的官能团对化合物的性质和反应有着不同的影响。
了解有机官能团的特点和反应特性有助于高中化学研究者更好地理解和应用有机化学知识。
(字数:210)。
官能团总结

官能团总结1. 引言在有机化学中,官能团是指化合物中具有特定性质和反应的基团。
官能团的存在决定了化合物的化学性质和反应类型,因此对官能团的深入研究对理解有机化学具有重要意义。
本文将对常见的官能团进行总结,包括官能团的命名规则、结构特征以及常见的反应类型。
2. 碳氢键在有机化合物中,最基本的键是碳和氢之间的键,通常称为碳氢键(C-H键)。
碳氢键的强度适中,能够提供稳定性和化学活性。
在有机化学中,碳氢键通常参与官能团的形成和反应。
3. 碳碳键除了碳氢键之外,碳和碳之间的键也是有机化合物中重要的键。
碳碳键能够提供分子的骨架稳定性,决定了分子的形状和空间构型。
在碳碳键的基础上,各种官能团以不同的方式连接,形成了大量的有机化合物。
4. 烷基官能团烷基官能团是最简单的官能团之一,其通式为CnH2n+1。
其中,n为整数,代表烷基官能团中碳的个数。
烷基官能团中的碳原子只与碳和氢原子形成碳碳键和碳氢键,不具有其他官能团的特性。
常见的烷基官能团包括甲基、乙基、丙基等。
5. 烯烃官能团烯烃官能团是含有碳碳双键的官能团。
烯烃官能团的通式为CnH2n,其中,n为整数,代表烯烃官能团中碳的个数。
烯烃官能团具有较高的反应活性,常参与加成、消除和重排等反应。
常见的烯烃官能团包括乙烯、丙烯等。
6. 炔烃官能团炔烃官能团是含有碳碳三键的官能团。
炔烃官能团的通式为CnH2n-2,其中,n为整数,代表炔烃官能团中碳的个数。
炔烃官能团具有较高的反应活性,常参与加成、消除和重排等反应。
常见的炔烃官能团包括乙炔、丙炔等。
7. 羟基官能团羟基官能团是含有氢氧基(OH基)的官能团。
羟基官能团的通式为ROH,其中,R代表一个有机基团。
羟基官能团具有较高的极性和氢键形成能力,能够参与许多酸碱、加成和酯化等反应。
8. 羰基官能团羰基官能团是含有碳氧双键(C=O键)的官能团。
羰基官能团的通式为RC=O,其中,R代表一个有机基团。
羰基官能团具有很强的极性和电子云的偏移,因此参与了许多重要的反应,如加成、亲核取代和氧化等反应。
高中化学—官能团和有机反应 ppt课件

•5.加聚反应
(1)相对分子质量小的化合物(也叫单体)通过加成反 应互相聚合成为高分子化合物的反应叫做加聚反应。
(2)加聚反应的特点
①链节(也叫结构单元)的相对分子质量与单体的相 对分子质量(或相对分子质量之和)相等。
②产物中仅有高聚物,无其他小分子生成,但生成 的高聚物由于n值不同,是混合物。
③实质上是通过加成反应得到高聚物。
• 6.缩聚反应 • (1)单体间相互反应生成高分子,同时还生成
小分子(如H2O、HX等)的反应叫做缩聚反应。 • (2)常见发生缩聚反应的官能团有羧基和羟基、
羧基和氨基、苯酚和醛等。
• 7.显色反应 • (1)某些有机物跟某些试剂作用而产生特征颜
色的反应叫显色反应。 • (2)苯酚遇FeCl3溶液显紫色,淀粉遇碘单质显
2.有机化学反应主要发生在官能团Leabharlann ,官能团对有机物的 性质起决定作用。
常见官能团的性质比较 1.醇、酚、羧酸分子中羟基上氢原子的活泼性比较
名称 结构简式
乙醇
CH3CH2OH
苯酚
羟基氢的 活泼性
不电离
电离
逐―渐―增→强
酸性 与Na 与NaOH 与Na2CO3 与NaHCO3
中性 反应 不反应 不反应
不反应
极弱酸性 反应 反应 反应
不反应
乙酸
电离
弱酸性 反应 反应 反应 反应
• 2.烃的羰基衍生物比较
名称 结构 简式 与H2 加成
其他 性质
乙醛
乙酸
乙酸乙酯
CH3CHO
CH3COOH CH3COOC2H5
能
醛基中C—H 键易被氧化
不能
羧基中C—O 、O—H键易
高中化学官能团总结

高中化学官能团总结1. 引言化学是一门研究物质组成、性质和变化的科学。
在高中化学学习中,我们需要掌握各种有机和无机化合物的结构和性质。
其中,了解和理解官能团的概念是非常重要的。
本文将对高中化学官能团进行总结,包括官能团的定义、分类和常见的官能团。
2. 官能团的定义官能团指的是分子中能够特定反应的原子团或原子的集合。
官能团能够决定化合物的特性和反应性。
官能团在分子中通常通过共价键与其他原子连接。
在有机化学中,官能团往往由碳、氧、氮、硫和卤素等原子组成。
3. 官能团的分类根据化学性质和功能性,官能团可以分为多种不同类型。
以下是常见的几类官能团:3.1 羟基 (-OH)羟基是一个由氧原子和氢原子组成的官能团。
它是醇类化合物的特征性官能团。
羟基具有亲水性,可以参与酸碱中和反应以及氧化还原反应。
3.2 羰基 (>C=O)羰基是碳氧双键 (C=O) 的官能团。
常见的羰基化合物包括酮和醛。
酮是羰基位于内部碳原子的化合物,而醛是羰基位于链的末端碳原子的化合物。
羰基具有极性,可以参与亲核加成反应和氧化还原反应。
3.3 羧基 (-COOH)羧基是由羰基和羟基组合而成的官能团。
羧基是酸的特征性官能团,例如甲酸和乙酸。
羧基具有酸性,可以参与酸碱反应和酯化反应。
3.4 氨基 (-NH2)氨基是由氮原子和氢原子组成的官能团。
它是胺类化合物的特征性官能团。
氨基具有碱性,可以参与与酸的酸碱反应和亲电取代反应。
3.5 卤素官能团 (-F, -Cl, -Br, -I)卤素官能团是由卤素原子组成的官能团,包括氟、氯、溴和碘。
卤素官能团常见于有机化合物中,可以参与取代反应和亲电取代反应。
4. 常见官能团示例以下是一些常见的有机化合物和它们的官能团示例:4.1 甲醇 (CH3OH)甲醇是一种醇类化合物,其官能团为羟基。
4.2 乙醛 (CH3CHO)乙醛是一种醛类化合物,其官能团为羰基。
4.3 乙酸 (CH3COOH)乙酸是一种羧酸化合物,其官能团为羧基。
《高中化学课件:有机官能团基本概念与性质》

胺官能团的性质与应用
胺化合物可分为一级胺、二级胺和三级胺。它们具有碱性和缓冲作用,广泛应用于制药和有机合成。
其他常见的有机官能团及其性 质
除了以上提到的有机官能团,还有酰胺、酰卤、硝基、烃类等。它们具有各 自独特的化学性质和用途,如硝基具有爆炸性。
高中化学课件:有机官能团基 本概念与性质
有机官能团的定义和作用
有机官能团是有机化合物中具有特定化学性质和功能的结构基团。它们决定 了有机化合物的性质和反应,如羧酸的酸性和醇的亲水性。
有机官能团的分类和特点
有机官能团可分为羧酸、酯、醇、醚、醛、酮、胺等多种类型。它们具有不同的化学性质和用途,如酯具有香 味和用于制造涂料。
羧酸与酯官能团的性质与应用
羧酸具有酸性,可与碱中和生成盐。酯是羧酸与醇发生酯化反应得到的产物, 广泛用于食品香料和塑料制造。
醇与醚官能团的性质与应用
醇具有亲水性和溶解性,常用作溶剂和消毒剂。醚是氧原子连接两个碳原子 的结构,可用于溶剂、麻醉药物和染料的合成。
醛与酮官能团的性质与应用
醛具有较强的还原性和氧化性,可用于制备醇和酸。酮是两个碳原子之间有 一个
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
常用的氧化剂:氧气、高锰酸钾、溴水、银氨溶液、新制氢氧化铜等。
③苯酚在空气中放置转化为粉红色物质。
④苯的同系物被酸性KMnO4溶液氧化。
⑤
、
的氧化。
9.常见的缩聚反应
10.常见的消去反应 ①氯代烃: 氢氧化钠的醇溶液、加热,消去卤原子和邻位H。 ②醇:浓硫酸、加热,消去羟基和邻位H。
规律:邻碳无氢不消去,无邻碳不消去,苯环上(卤原子、羟基)不消去。
有机化学之官能团
化学组:夏伟
1
1、使酸性高锰酸钾溶液褪色的有机物有: ①不饱和的有机物:含碳碳双键、碳碳三键 注意:碳氧双键中仅有醛可以被氧化
②苯的同系物
③醇类被酸性高锰酸钾氧化
④酚类 ⑤含醛基的有机物:醛、甲酸、甲酸酯、甲酸盐。 ⑥石油产品(裂解气、裂化气、裂化石油)。 ⑦天然橡胶。
2.能使溴水褪色的物质有: ①含有碳碳双键和碳碳叁键的(加成) ②苯酚等酚类物质(取代) ③含醛基物质(氧化) ④有机溶剂,如苯及其同系物、四氯化碳、已烷等,属于萃取, 使水层褪色而有机层呈橙红色。
5.和氢氧化钠水解反应的有机物: ①含卤原子的有机物 ②酯、油脂 ③含肽键的
练习:写出下列物质和氢氧化钠反应的方程式
6.硫酸催化的反应有哪些? ①苯、甲苯的硝化 ②醇的消去 ③醇分子间脱水制醚 ④酯的生成、酯的水解 ⑤酚醛的缩聚 ⑥淀粉、纤维素、蔗糖、麦芽糖的水解 ⑦肽的生成、肽的水解 思考:以上使用的是稀硫酸还是浓硫酸?酸碱共同催化的有哪些?
3.能使溴的四氯化碳溶液褪色的物质: ①含有碳碳双键和碳碳叁键的有机物 ②酚类物质(无沉淀现象) 思考:
己烯、裂化汽油能使溴的四氯化碳溶液褪色,苯、己烷能使溴的 四氯化碳溶液褪色吗?
醛能使溴水褪色,醛能使溴的四氯化碳溶液褪色吗?
4.羟基的活泼性: ①可以与钠反应的__醇__羟___基__(__-_O__H__)__酚__羟___基__(__-_O__H__)__羧___基__(__-_C__O_O__H__)__________ ②可以与氢氧化钠反应的__酚___羟__基__(__-_O__H__)_____羧___基__(__-_C__O_O__H__)_________________ ③可以与碳酸钠反应的____酚__羟___基__(__-_O__H__)___羧__基__(___-_C_O__O__H__)__________________ ④可以与碳酸氢钠反应的______羧__基__(__-_C__O__O_H__)_________________________________
7.碳碳叁键、碳碳双键和碳氧双键的区别
①和H2加成的:
、
、C=O中的醛酮、苯环。
羧酸、酯和H2不加成。
②、酯)和Br2一律不加成。 苯环和Br2不加成。
8.常见的氧化反应 ①醇的催化氧化:铜或银作用下加热,脱去羟基H和羟基碳上的H 氧化
②醛基的氧化:R—CHO → R—COOH,即在醛基的C—H键中插入氧原子。
