烃的衍生物知识总结
烃的衍生物知识总结

Na2CO3 反应生成硝 酸钠、水和 CO2
NaHCO3 反应生成硝 酸钠、水和 CO2
反应生成 反应生成酚
CH3COONa、 钠C6H5ONa
水和CO2
和NaHCO3
反应生成 CH3COONa、 水和CO2
不反应
不反应 不反应
PPT文档演模板
烃的衍生物知识总结
•几种物质与高锰酸钾和溴水的作用:
PPT文档演模板
烃的衍生物知识总结
•卤代烃
•烃的衍生物知识总结
•醇类
•烃的衍生物
•醛类
•羧酸
•酯(油脂)
•酚
•通式:CnH2n-6O(n≥6)
•(1)易被氧化变质(氧化反应)
•酚
•代表
物•OH
•化性•(2)与Br2发生取代(取代反应) •(3)与FeCl3显紫色(显色反应) •(4)弱酸性(比碳酸的酸性弱)
• 卤代烃的水解
• 酯化反应
• 酯的水解
PPT文档演模板
烃的衍生物知识总结
PPT文档演模板
2.加成反应:
烯(C=C)、 炔烃(加H2、HX、H2O), 苯(加H2)、 醛(加H2)、酮 油脂氢化(加H2)。
烃的衍生物知识总结
PPT文档演模板
3.消去反应:
乙醇(分子内脱H2O)
•卤代烃(脱HX)
烃的衍生物知识总结
• 例5.已知乙炔(C2H2)、苯 (C6H6)、乙醛(C2H4O)的混 合气体中含氧元素的质量分数为 8%,则混合气体中碳元素的质 量分数为( )
•A.84%
B.
60%
•C.91%
D.
42%
PPT文档演模板
烃的衍生物知识总结
• 例6、下列各组混合物中,总质量一定时,
烃的衍生物重要知识点总结
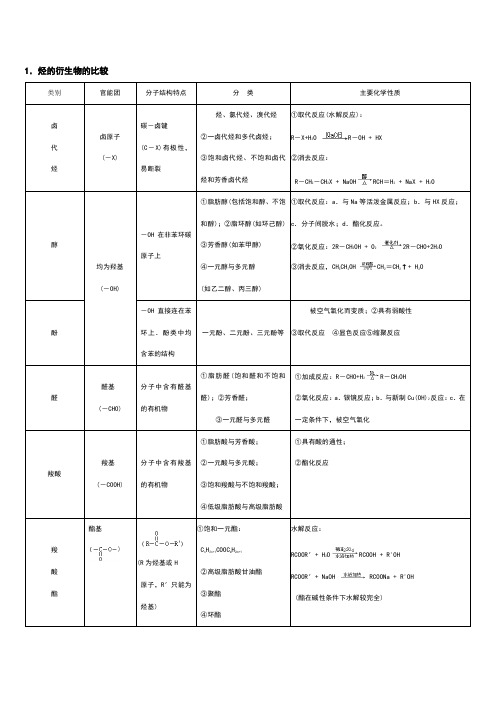
1.烃的衍生物的比较类别官能团分子结构特点分类主要化学性质卤代烃卤原子(-X)碳-卤键(C-X)有极性,易断裂烃、氯代烃、溴代烃②一卤代烃和多代卤烃;③饱和卤代烃、不饱和卤代烃和芳香卤代烃①取代反应(水解反应):R-X+H2O R-OH + HX②消去反应:R-CH2-CH2X + NaOH RCH=H2 + NaX + H2O醇均为羟基(-OH)-OH在非苯环碳原子上①脂肪醇(包括饱和醇、不饱和醇);②脂环醇(如环己醇)③芳香醇(如苯甲醇)④一元醇与多元醇(如乙二醇、丙三醇)①取代反应:a.与Na等活泼金属反应;b.与HX反应;c.分子间脱水;d.酯化反应。
②氧化反应:2R-CH2OH + O22R-CHO+2H2O③消去反应,CH3CH2OH CH2=CH2↑+ H2O酚-OH直接连在苯环上.酚类中均含苯的结构一元酚、二元酚、三元酚等被空气氧化而变质;②具有弱酸性③取代反应④显色反应⑤缩聚反应醛醛基(-CHO)分子中含有醛基的有机物①脂肪醛(饱和醛和不饱和醛);②芳香醛;③一元醛与多元醛①加成反应:R-CHO+H2R-CH2OH②氧化反应:a.银镜反应;b.与新制Cu(OH)2反应:c.在一定条件下,被空气氧化羧酸羧基(-COOH)分子中含有羧基的有机物①脂肪酸与芳香酸;②一元酸与多元酸;③饱和羧酸与不饱和羧酸;④低级脂肪酸与高级脂肪酸①具有酸的通性;②酯化反应羧酸酯酯基(R为烃基或H原子,R′只能为烃基)①饱和一元酯:C n H2n+1COOC m H2m+1②高级脂肪酸甘油酯③聚酯④环酯水解反应:RCOOR′+ H2O RCOOH + R'OHRCOOR′+ NaOH RCOONa + R'OH(酯在碱性条件下水解较完全)2.有机反应的主要类型反应类型定义举例(反应的化学方程式)消去反应有机物在一定条件下,从一个分子中脱去一个小分子(如H2O、HBr等)而生成不饱和(含双键或叁键)化合物的反应C2H5OH CH2=CH2↑+ H2O苯酚的显色反应苯酚与含Fe3+的溶液作用,使溶液呈现紫色的反应还原反应有机物分子得到氢原子或失去氧原子的反应CH≡CH + H2CH2=CH2 CH2=H2 + H2CH3CH3 R—CHO + H2R-CH2OH氧化反应燃烧或被空气中的O2氧化有机物分子得到氧原子或失去氢原子的反应2CH3CH2OH + O2 2CH3CHO + 2H2O2CH3CHO + O2 2CH3COOH银镜反应CH3CHO + 2Ag(NH3)2OH CH3COONH4+2Ag↓+ 3NH3↑+ H2O红色沉淀反应CH3CHO + 2Cu(OH)2CH3COOH + Cu2O↓+ 2H2O取代反应卤代烃水解NaOH水溶液,卤代烃水解,生成醇和卤化氢的反应R-CH2X + H2O RCH2OH + HX 酯化反应酸(无机含氧酸或羧酸)与醇作用,生成酯和水的反应RCOOH + R'CH2OH RCOOCH2R′+ H2O 酯的水解反应在酸或碱存在的条件下,酯与水作用生成醇与酸的反应RCOOR′+ H2O RCOOH + R'OHRCOOR′+ NaOH → RCOONa + R'OH4.醇、酚、羧酸中羟基的活性比较羟基种类重要代表物与Na反应与NaOH反应与Na2CO3反应醇羟基CH3CH2-OH√××酚羟基HO√√√但不放出气体羧酸羟基CH3-C-OHO√√√放出CO2。
高一化学烃的衍生物知识点讲解

高一化学烃的衍生物知识点讲解
高一化学烃的衍生物知识点讲解
以下是查字典化学网为大家整理的关于《高一化学烃的衍生物知识点讲解》的文章,供大家学习参考!
烃的衍生物
①乙醇:
a、物理性质:无色,有特殊气味,易挥发的液体,可和水以任意比互溶,良好的溶剂
b、分子结构:分子式C2H6O,结构简式CH3CH2OH或C2H5OH,官能团羟基,OH
c、化学性质:ⅰ、与活泼金属(Na)反应:
2CH3CH2OH+2Na 2CH3CH2ONa+H2
ⅱ、氧化反应:燃烧:C2H5OH+3O2 2CO2+3H2O
催化氧化:2CH3CH2OH+O2 2CH3CHO+2H2O
ⅲ、酯化反应:CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O
d、乙醇的用途:燃料,医用消毒(体积分数75%),有机溶剂,造酒
②乙酸:
a、物理性质:无色,,有强烈刺激性气味,液体,易溶于水和乙醇。
纯净的乙酸称为冰醋酸。
b、分子结构:分子式C2H4O2,结构简式CH3COOH,官能团羧基,COOH
c、化学性质:ⅰ、酸性(具备酸的通性):比碳酸酸性强。
高中化学烃和烃的衍生物知识点总结
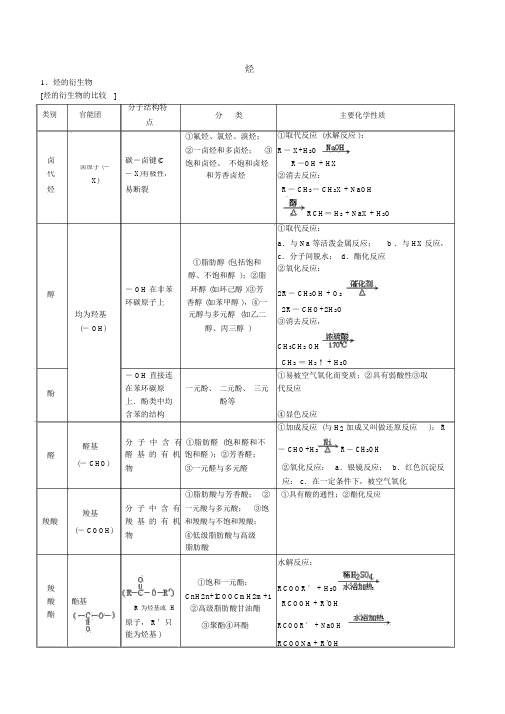
烃1.烃的衍生物[烃的衍生物的比较]分子结构特类别官能团点卤碳-卤键(C卤原子(-代- X)有极性,X)易断裂烃分类主要化学性质①氟烃、氯烃、溴烃;①取代反应 (水解反应 ):②一卤烃和多卤烃;③R- X+H2O饱和卤烃、不炮和卤烃R-OH + HX和芳香卤烃②消去反应:R- CH2- CH2X + NaOH醇均为羟基(- OH)酚RCH= H2 + NaX + H2O①取代反应:a.与 Na 等活泼金属反应; b .与 HX 反应,①脂肪醇 (包括饱和c.分子间脱水; d.酯化反应②氧化反应:醇、不饱和醇 );②脂- OH 在非苯环醇 (如环己醇 )③芳2R- CH2OH + O2环碳原子上香醇 (如苯甲醇 ),④一2R- CHO+2H2O元醇与多元醇 (如乙二③消去反应,醇、丙三醇 )CH3CH2 OHCH2= H2↑ + H2O- OH 直接连①易被空气氧化而变质;②具有弱酸性③取在苯环碳原一元酚、二元酚、三元代反应醛基醛(- CHO)上.酚类中均酚等含苯的结构分子中含有①脂肪醛(饱和醛和不醛基的有机饱和醛 );②芳香醛;物③一元醛与多元醛④显色反应①加成反应 (与 H2加成又叫做还原反应): R- CHO+H2R- CH2OH②氧化反应:a.银镜反应;b.红色沉淀反羧基羧酸(- COOH)应: c.在一定条件下,被空气氧化①脂肪酸与芳香酸;②①具有酸的通性;②酯化反应分子中含有一元酸与多元酸;③饱羧基的有机和羧酸与不饱和羧酸;物④低级脂肪酸与高级脂肪酸水解反应:羧酸酯基(R 为烃基或H 酯原子, R′只能为烃基 )①饱和一元酯:RCOOR′ + H2O CnH2n+lCOOCmH2m+1RCOOH + R'OH ②高级脂肪酸甘油酯③聚酯④环酯RCOOR′ + NaOHRCOONa + R'OH(酯在碱性条件下水解较完全)2.有机反应的主要类型反应类型定义举例 (反应的化学方程式)有机物在一定条件下,从一个CH2= H2↑ + H2O 消去反应分子中脱去一个小分子(如C2H5OHH2O、 HBr 等 )而生成不饱和 (含双键或叁键 )化合物的反应苯酚的显色反应苯酚与含 Fe3+的溶液作用,使溶液呈现紫色的反应CH≡ CH + H2CH2= H2还原反应有机物分子得到氢原子或失去CH2=H2 + H2氧原子的反应CH3CH3R— CHO + H2R- CH2OH燃烧或被空2CH3CH2OH + O22CH3CHO + 2H2O 气中的 O2氧氧化有机物分子得到氧原子或失去2CH3CHO + O22CH3COOH化反氢原子的反应CH3CHO + 2Ag(NH3)2OH银镜反应CH3 COONH4+2Ag↓ + 3NH3↑ + H2O应红色沉淀反CH3 CHO + 2Cu(OH)2CH3COOH + Cu2 O↓ + 2H2O 应卤代烃的在 NaOH 水溶液的条件下,卤R- CH2X + H2O RCH2OH + HX 代烃与水作用,生成醇和卤化水解反应氢的反应取酸 (无机含氧酸或羧酸)与醇作代用,生成酯和水的反应RCOOH + R'CH2OH酯化反应反RCOOCH2R′ + H2O应在酸或碱存在的条件下,酯与酯的水解反RCOOR′ + H2O RCOOH + R'OH水作用生成醇与酸的反应应RCOOR′ + NaOH →RCOONa + R'OH3.同分异构体的有关知识[同分异构体的熔点、沸点高低的规律]①当为脂肪烃的同分异构体时,支链越多 (少 ),沸点越低 (高 );②当为含两个侧链的苯的同系物时,侧链相隔越远 (近 ),沸点越高 (低 ).[同分异构体的书写规律]①同分异构体的书写规律:要准确、完全地写出同分异构体,一般按以下顺序规律进行书写:类别异构+ 碳链异构一位置异构.②碳链异构 (烷烃的同分异构体)的书写技巧:a.先写出不含支链的最长碳链;b.然后写出少 1 个碳原子的主链,将余下的 1 个碳原子作支链加在主链上,并依次变动支链位置;c.再写出少 2 个碳原子的主链,将余下的 2 个碳原子作为一个乙基或两个甲基加在主链上,并依次变动其位置(注意不要重复);d.以此类推,最后分别在每个碳原子上加上氢原子,使每个碳原子有 4 个共价键.说明a.从上所述可归纳为:从头摘、挂中间,往端移、不到边,先甲基、后乙基,先集中、后分散,变换位、不能同. b .在书写烯烃或炔烃的同分异构体时,只要在碳链异构的基础上依次变动碳碳双键或碳碳叁键位置即可.[烃的同分异构体种数的确定方法]①等效氢法.烃分子中同一种类的氢原子称为等效氢原子.有机分子中有几种不等效氢原子,其氢原子被一种原子或原子团取代后的一取代物就有几种同分异构体.等效氢原子的一般判断原则:a.位于同一碳原子上的H 原子为等效H 原子.如CH4中的 4 个 H 原子为等效 H 原子. b.位于同一 C 原子上的甲基上的 H 原子为等效H 原子.如新戊烷 (CH3)4C 上的 12 个 H 原子为等效 H 原子. c.同一分子中处于对称位置或镜面对称位置上的H 原子为等效 H 原子.对于含苯环结构的分子中等效 H 原子的种数的判断,应首先考虑苯环所在平面上是否有对称轴,若没有,则还应考虑是否有垂直于苯环平面的对称轴存在,然后根据对称轴来确定等效H 原子的种数.②换元法.换元法是要找出隐含在题目中的等量关系,并将所求对象进行恰当地转换.例如,已知正丁烷的二氯代物有 6 种同分异构体,则其八氯代物的同分异构体有多少种正丁烷 C4 H10。
烃的衍生物知识点归纳

烃的衍生物知识点归纳烃是由碳和氢元素组成的有机化合物家族,是天然气、煤油和石油的主要成分。
由于其分子结构简单,烃具有许多重要的应用领域,包括燃料、化学原料和制药等。
本文将整理烃的衍生物知识点,以帮助读者更好地了解烃化合物的特性和应用。
1. 烃的分类烃可以根据碳原子的结构和连接方式进行分类。
最简单的烃是烷烃,由单个碳-碳单键组成。
其他类别包括烯烃(含有碳-碳双键)和炔烃(含有碳-碳三键)。
2. 烃的命名烃的命名方法基于碳原子的数量和连接方式。
烷烃的命名使用前缀和后缀的组合,例如甲烷、乙烷、丙烷等。
烯烃和炔烃的命名使用前缀、中缀和后缀,例如乙烯、丙烯、乙炔等。
3. 烃的物理特性烃的物理特性与其分子结构和分子量有关。
通常,烃具有较低的沸点和熔点,是易燃的液体或气体。
随着分子量的增加,烃的密度和黏度也会增加。
4. 烃的化学性质烃的化学性质主要与有机反应有关。
对于烃基本上是非极性分子,它们通常不会发生直接的化学反应。
然而,通过在化学反应中引入适当的催化剂、温度和压力条件,烃可以被氧化、加成、取代等。
5. 烃的衍生物烃衍生物是通过对烃进行功能化改变而产生的化合物。
主要的烃衍生物包括醇、醚、酮、羧酸、醛、胺、卤代烃等。
6. 烯烃的衍生物烯烃衍生物是通过对烯烃进行不同的反应而形成的。
烯烃的衍生物包括环烯烃、烯烃醇、烯烃醛、烯烃酸等。
7. 炔烃的衍生物炔烃衍生物是通过对炔烃进行不同的反应而形成的。
炔烃的衍生物包括环炔烃、炔烃醇、炔烃醛、炔烃酸等。
8. 烷烃的衍生物烷烃衍生物是通过对烷烃进行不同的反应而形成的。
烷烃的衍生物包括醇、醚、酮、醛、胺、酸等。
9. 烃衍生物的应用烃衍生物广泛应用于多个领域。
醇是重要的溶剂和溶剂中间体,醚常用作溶剂、非极性溶剂和反应中间体,酮可以用作溶剂、溶剂中间体和有机合成中间体,羧酸常用于制备酯类化合物,胺是重要的有机合成试剂等。
10. 烃衍生物的制备方法烃衍生物的制备方法多种多样,包括催化加氢、氧化、取代、加成等。
烃的衍生物知识总结

烃的衍生物知识总结一、卤代烃(代表物C 2H 5Br ):烃分子中的氢原子被卤素原子取代后的产物。
(卤素原子) 1、通式: C n H 2n+1X 、 R —X 2、化学性质:(1)、取代反应:C 2H 5Br + H 2O C 2H 5OH + HBr (水解反应)C 2H 5Br + NaOH C 2H 5OH + NaBr(2)、消去反应:C 2H 5Br + NaOH CH 2==CH 2↑+ NaBr +H 2O 3、卤代烃中卤素原子的检验:取少量卤代烃,加NaOH 溶液,加热,一段时间后加HNO 3酸化后再加AgNO 3,如有白色沉淀说明有Cl ¯,如有浅黄色沉淀则有Br ¯,如有黄色沉淀则有I ¯。
二、醇(代表物:CH 3CH 2OH )1、通式:R —OH ,饱和一元醇C n H 2n+1OH 2、化学性质:(1)非电解质,中性,不电离出H+; (2)与K 、Ca 、Na 等活泼金属反应放出H 2; 2C 2H 5OH + 2Na 2C 2H 5ONa + H 2↑(3)氧化反应:燃烧:C 2H 5OH +3O 2 2CO 2+3H 2O 催化氧化:2C 2H 5OH + O 2 2CH 3CHO + H 2O(4)脱水生成乙烯或乙醚。
消去反应: C 2H 5OH CH 2==CH 2↑+ H 2O 取代反应:2C 2H 5OH CH3CH 2OCH 2CH 3+ H 2O(5)酯化成酯;酸脱羟基,醇脱氢,脱一分子水后形成COO 键.(6) C n H 2n+1nCO 2+(n+1) H 2O) 1、化学性质:(1)2O2O + CO 23(强酸制弱酸)(2)2 ↓ + 3HBr (3)、显色反应:与Fe 3+反应生成紫色物质 四、醛(代表物:CH 3CHO 、HCHO )1、通式:RCHO ,一元饱和醛:C n H 2n+1CHO ,分子式:C n H 2n O2、化学性质:(1)、加成反应:CH 3CHO + H 2催化剂 △CH 3CH 2OH (还原反应)(2)、氧化反应:①催化氧化:2CH 3CHO + O 2催化剂 △2CH 3COOHNaOH △醇 △OH OHONaONa OH OH OH 点燃Cu 或Ag △浓硫酸170℃浓硫酸 140℃△点燃②银镜反应:CH 3CHO +2 Ag (NH 3)2OH△2Ag ↓+ CH 3COONH 4 +3 NH 3 + H 2O③与新制Cu (OH )2反应:CH 3CHO + 2Cu (OH )2△Cu 2O + CH 3COOH + 2H 2O3、制法:(1)乙烯氧化法 (2)乙炔水化法 (3)乙醇氧化法 五、羧酸(代表物: CH 3COOH 、HCOOH )1、通式:R —COOH ,一元饱和酸C n H 2n+1COOH ,分子式C n H 2n O 22、化学性质:(1)具有酸的通性(羧酸盐几乎全溶于水):CH 3COOH + NaOH === CH 3COONa + H 2O2CH 3COOH +2 Na → 2CH 3COONa + H 2↑ CH 3COOH + NaHCO 3→ CH 3COONa + H 2O+CO 2↑ (2)与醇酯化成酯(酸脱羟基醇脱氢): CH 3COOH + CH 3CH 2OH浓硫酸 △CH 3COOCH 2CH 3 + H 2O(3)甲酸、甲酸盐、甲酸形成的酯都具有醛基能发生银镜反应。
高二化学下学期烃的衍生物知识总结
酚
制法:
烃的衍生物概述
类别 官能团
—OH
通式
R—OH CnH2n+2O
Ar—OH CnH2n-6O R—CHO CnH2nO R—COOH CnH2nO2 RCOOR` CnH2nO2
代表物
CH3CH2OH
主要化学性质
(1)与钠反应 (2)取代反应 (3)消去反应 (4)分子间脱水 (5)氧化反应 (6)酯化反应
红热铜丝插入醇中有3)显色反应
与FeCl3显紫色
苯、甲苯、苯酚的结构与性质的比较
类别 苯
不被高锰酸钾 溶液氧化 液溴 催化剂 C6H5Br
甲苯
—CH3 可被高锰酸钾溶 液氧化 液溴 催化剂 邻、间、对三种 一溴甲苯
苯酚
—OH 常温下在空气中被氧 化呈红色 溴水 无催化剂 三溴苯酚
化性
(1)具有酸的通性(羧酸盐几乎全溶于水) (2)与醇酯化成酯 (3)甲酸有醛基能发生银镜反应 (1)乙烯氧化法 (2)烷烃氧化法 (3)淀粉发酵法
制法
烃的衍生物知识总结
烃的衍生物
卤代烃 醇类 O 通式:R`—C—O—H,油脂的通式 酯(油脂) 代 表 物 CH3COOC2H5 C17H35COOCH2 醛类 羧酸 酯(油脂) R`—COO—CH2 酚
(1)有弱酸性 (2)取代反应 (3)显色反应 (4)缩聚反应 (1)氧化反应 (2)还原反应 (1)具有酸性 (2)酯化反应 水解反应
醇
酚 醛 羧酸 酯
—OH
C6H5—OH
—CHO
CH3CHO
—COOH
CH3COOH
—COO—
CH3COOC2H5
各类有机物的衍变关系
烃 R—H
卤代 消去
高二化学下学期烃的衍生物知识总结
醇类
化性
代表物 CH3CH2OH
制法 (1)乙烯水化 (2)淀粉发酵
烃的衍生物知识总结
烃的衍生物
卤代烃 醇类 醛类 羧酸 酯(油脂) 酚
通式:RCHO,一元饱和醛CnH2n+1CHO,分子式CnH2nO
醛类
化性
代表物 CH3CHO (1)乙烯氧化法 制法 (2)乙炔水化法 HCHO (3)乙醇氧化法
(1)氧化反应:银镜反应、与新制Cu(OH)2反应 能使溴水、高锰酸钾溶液褪色 (2)还原反应:加氢被还原成乙醇 (3)甲醛与苯酚缩聚成酚醛树脂
烃的衍生物知识总结
烃的衍生物
卤代烃 醇类 醛类 羧酸 酯(油脂) 酚
通式:R—COOH,一元饱和酸CnH2n+1COOH,分子式CnH2nO2
羧酸
代表物 CH3COOH HCOOH
烃的衍生物知识总结
烃的衍生物
卤代烃 醇类 醛类 羧酸 酯(油脂) 酚 通式:R—OH,饱和一元醇CnH2m+1OH (1)中性不电离出OH-和H+; (2)与Na、K、Mg、Al等活泼金属反应放出H2; (3)脱氢生成醛; (4)与HX取代生成卤代烃; (5)酯化成酯; (6)脱水生成乙烯或乙醚。
烃的衍生物知识总结
烃的衍生物 卤代烃 通式 代表物 醇类 通式 代表物 醛类 羧酸 酯(油脂) 酚
通式
代表物
通式
代表物
通式
代表物
通式
代表物
烃的衍生物知识总结
烃的衍生物
卤代烃 醇类 醛类 羧酸 酯(油脂) 酚
通式:R—X,一元饱和卤代烃为CnH2n+1X 卤代烃 代表物 CH3CH2Br 化性:①强碱溶液中发生水解生成醇(取代反应) ②在强碱的醇溶液里发生消去反应生成乙烯 制法:①乙烯加HBr ② CH3—CH3取代 ③C2H5OH、NaBr、H2SO4混合加热
新教材人教版高中化学选择性必修3第3章烃的衍生物 知识点考点归纳总结

第3章烃的衍生物第一节卤代烃一、卤代烃1.定义烃分子中的氢原子被卤素原子取代后生成的化合物称为卤代烃。
官能团是碳卤键,可表示为R—X(X=F、Cl、Br、I)。
2.分类3.物理性质(1)状态:常温下,卤代烃中除个别为气体外,大多为液体或固体。
如一氯甲烷为气体。
(2)溶解性:卤代烃不溶于水,可溶于有机溶剂,某些卤代烃本身就是很好的有机溶剂,如CCl4、氯仿(CHCl3)等。
(3)密度与沸点:①卤代烃的密度和沸点都高于相应的烃;②卤代烃的密度一般随烃基中碳原子数目的增加而减小,如ρ(CH3Cl)>ρ(CH3CH2Cl);③卤代烃的沸点一般随碳原子数目的增加而升高,如沸点CH3Cl<CH3CH2Cl。
4.卤代烃的系统命名——类似于烃的命名方法二、溴乙烷的结构与性质1.溴乙烷的物理性质纯净的溴乙烷是无色液体,沸点是38.4 ℃,密度比水的大,难溶于水,可溶于多种有机溶剂(如乙醇、苯、汽油等)。
2.溴乙烷的分子结构3.溴乙烷的化学性质(1)取代反应——又称水解反应①条件:NaOH水溶液、加热。
②反应方程式:C 2H5—Br+NaOH――→水△C2H5—OH+NaBr。
③反应原理:(2)消去反应——又称为消除反应。
①条件:NaOH的乙醇溶液、加热。
②反应方程式:(以溴乙烷为例)CH3CH2Br+NaOH――→乙醇△CH2===CH2↑+NaBr+H2O。
③反应原理:④定义:有机化合物在一定条件下,从一个分子中脱去一个或几个小分子(如H2O、HX等),而生成含不饱和键的化合物的反应叫做消去反应(消除反应)。
(3)加成和加聚反应含有不饱和键(如)的卤代烃也可以发生加成和加聚反应。
①氯乙烯加聚反应生成聚氯乙烯:。
②四氟乙烯加聚反应生成聚四氟乙烯:。
三、卤代烃破坏臭氧层原理(了解)氟利昂可在强烈的紫外线作用下分解,产生的氯原子自由基会对臭氧层产生长久的破坏作用。
以CCl3F为例,它破坏臭氧层的反应过程可表示为:CCl3F――→紫外线CCl2F·+Cl·卤代烃的主要性质及检验1.卤代烃的消去反应和取代反应的比较消去反应取代反应卤代烃的结构特点与卤素原子相连的碳原子的邻位碳原子上有氢原子一般是1个碳原子上只有1个—X反应实质脱去1个HX分子,形成不饱和键—X被—OH取代反应条件强碱的醇溶液、加热强碱的水溶液、加热化学键变化主要产物烯烃或炔烃醇2.卤代烃消去反应的规律(1)没有邻位碳原子的卤代烃不能发生消去反应。
烃的衍生物重要知识点总结
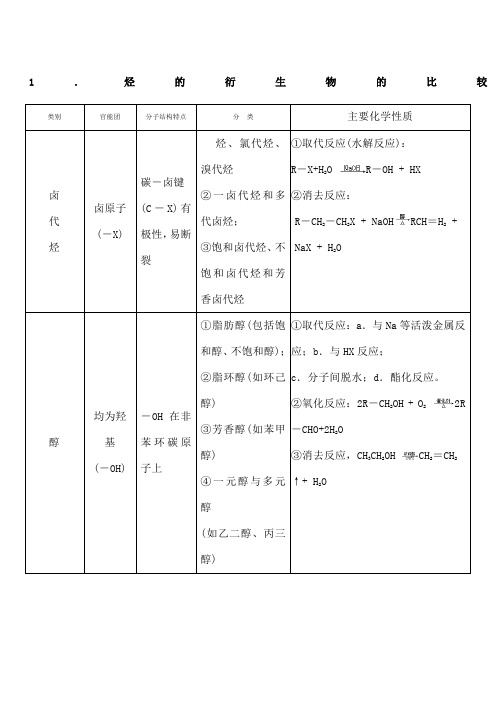
1.烃的衍生物的比较类别官能团分子结构特点分类主要化学性质卤代烃卤原子(-X)碳-卤键(C-X)有极性,易断裂烃、氯代烃、溴代烃②一卤代烃和多代卤烃;③饱和卤代烃、不饱和卤代烃和芳香卤代烃①取代反应(水解反应):R-X+H2O R-OH + HX②消去反应:R-CH2-CH2X + NaOH RCH=H2+NaX + H2O醇均为羟基(-OH)-OH在非苯环碳原子上①脂肪醇(包括饱和醇、不饱和醇);②脂环醇(如环己醇)③芳香醇(如苯甲醇)④一元醇与多元醇(如乙二醇、丙三醇)①取代反应:a.与Na等活泼金属反应;b.与HX反应;c.分子间脱水;d.酯化反应。
②氧化反应:2R-CH2OH + O22R-CHO+2H2O③消去反应,CH3CH2OH CH2=CH2↑+ H2O酚-OH直接连在苯环上.酚类中均含苯的结构一元酚、二元酚、三元酚等被空气氧化而变质;②具有弱酸性③取代反应④显色反应⑤缩聚反应醛醛基(-CHO)分子中含有醛基的有机物①脂肪醛(饱和醛和不饱和醛);②芳香醛;③一元醛与多元醛①加成反应:R-CHO+H2R-CH2OH②氧化反应:a.银镜反应;b.与新制Cu(OH)2反应:c.在一定条件下,被空气氧化羧酸羧基(-COOH)分子中含有羧基的有机物①脂肪酸与芳香酸;②一元酸与多元酸;③饱和羧酸与不饱和羧酸;④低级脂肪酸与高级脂肪酸①具有酸的通性;②酯化反应羧酸酯酯基(R为烃基或H原子,R′①饱和一元酯:CnH2n+1COOCmH2m+1②高级脂肪酸甘油酯水解反应:RCOOR′+ H2O RCOOH + R'OHRCOOR′+ NaOH RCOONa + R'OH(酯在碱性条件下水解较完全)只能为烃基)③聚酯④环酯2.有机反应的主要类型反应类型定义举例(反应的化学方程式)消去反应有机物在一定条件下,从一个分子中脱去一个小分子(如H2O、HBr等)而生成不饱和(含双键或叁键)化合物的反应C2H5OH CH2=CH2↑+ H2O苯酚的显色反应苯酚与含Fe3+的溶液作用,使溶液呈现紫色的反应还原反应有机物分子得到氢原子或失去氧原子的反应CH≡CH + H2CH2=CH2CH2=H2+ H2CH3CH3R—CHO + H2R-CH2OH氧化反应燃烧或被空气中的O2氧化有机物分子得到氧原子或失去氢原子的反应2CH3CH2OH + O22CH3CHO + 2H2O2CH3CHO + O22CH3COOH银镜反应CH3CHO + 2Ag(NH3)2OH CH3COONH4+2Ag↓+3NH3↑+ H2O红色沉淀反应CH3CHO + 2Cu(OH)2CH3COOH + Cu2O↓+2H2O取代卤代烃水解NaOH水溶液,卤代烃水解,生成醇和卤化氢的反应R-CH2X + H2O RCH2OH + HX反应酯化反应酸(无机含氧酸或羧酸)与醇作用,生成酯和水的反应RCOOH + R'CH2OH RCOOCH2R′+ H2O酯的水解反应在酸或碱存在的条件下,酯与水作用生成醇与酸的反应RCOOR′+ H2O RCOOH + R'OHRCOOR′+ NaOH → RCOONa + R'OH4.醇、酚、羧酸中羟基的活性比较羟基种类重要代表物与Na反应与NaOH反应与Na2CO3反应醇羟基CH3CH2-OH√××酚羟基HO√√√但不放出气体羧酸羟基CH3-C-OHO√√√放出CO2。
烃的衍生物知识归纳总结

烃的衍生物知识归纳总结一、溴乙烷与卤代烃溴乙烷1、溴乙烷的分子组成:结构简式:。
注意:(1)乙烷分子为非极性分子,而溴乙烷为极性分子。
(2)溴乙烷的官能团为溴原子。
(3)溴乙烷是非电解质,在水溶液中(实际上不溶于水)或熔化状态下均不电离。
2、溴乙烷的物理性质:纯净的溴乙烷是无色液体,沸点38.4度,密度比水轻不溶于水,易溶于乙醇等多种有机溶剂。
3、溴乙烷的化学性质a 溴乙烷的水解反应:b 溴乙烷的消去反应反应方程式:反应条件:有强碱的醇溶液存在,加热。
反应特点:溴乙烷的反应是从分子中相邻的碳原子上脱去一个溴化氢分子,有机物由饱和变为不饱和。
消去反应的概念:有机化合物在一定条件下,从一个分子中脱去一个小分子生成不饱和化合物的反应叫消去反应。
卤代烃1、卤代烃的概念:烃分子中的氢原子被卤素原子取代后生成的化合物叫卤代烃2、卤代烃的分类:根据卤素原子的不同可以分为氟代烃、氯代烃、溴代烃和碘代烃。
根据卤素原子的个数不同,可以分为一卤代烃和多卤代烃。
根据烃基的种类不同可以分为饱和卤代烃和不饱和卤代烃。
3、卤代烃的物理性质:(1)溶解性:不溶于水可以溶于大多数有机溶剂。
(2)有关卤代烃沸点的总结:1在一系列正某烷的一氯代烃中,随分子里的碳原子数增加(相对分质量逐渐增大),物质的沸点逐渐升高。
2、分子数相同的一氯代烷中,主链长的比主链短的沸点高。
4、卤代烃的化学性质:(1)取代反应(水解反应):所有卤代烃都可以发生水解反应。
(2)消去反应:a 能发生消去反应的氯代烃必须具备两个条件:一是分子中碳原子大于二;二是与卤原子相连的碳原子的邻碳上必须有氢原子。
(3)卤代烃发生消去反应和水解反应的外界条件不同:在碱和醇存在的的条件的条件下发生消去反应,在碱和水存在的条件下发生水解反应。
5、卤代烃中卤素元素的检验:卤代烃不溶于水,也不能电离出卤素原子,分子中的卤素原子检验步骤如下:(1)首先将卤代烃与过量的氢氧化钠溶液混合,充分震荡,加热。
高中化学烃及其衍生物知识点

高中化学烃及其衍生物知识点详解一、烃的概念与分类1. 概念:烃是只含有碳和氢两种元素的有机物。
2. 分类:饱和烃(烷烃):分子中所有的碳原子都形成四个单键,如甲烷(CH₄)、乙烷(C₂H₆)等。
不饱和烃:分子中含有碳碳双键或碳碳三键的烃。
烯烃:分子中含有一个或多个碳碳双键的烃,如乙烯(C₂H₄)、丙烯(C₃H₆)等。
炔烃:分子中含有一个或多个碳碳三键的烃,如乙炔(C₂H₂)、丙炔(C₃H₄)等。
二、烃的物理性质状态:随着碳原子数的增加,烷烃由气态逐渐过渡到液态、固态。
熔沸点:随着碳原子数的增加,熔沸点逐渐升高。
溶解度:烃类都不溶于水,但易溶于有机溶剂。
三、烃的化学性质1. 取代反应:烷烃在光照条件下与卤素单质发生取代反应,生成卤代烃和卤化氢。
例如:CH₄ + Cl₂ →CH₃Cl + HCl2. 加成反应:烯烃和炔烃能与卤素单质、氢气等发生加成反应。
例如:CH₂=CH₂ + Br₂ →CH₂BrCH₂BrCH₂=CH₂ + H₂ →CH₃CH₃3. 氧化反应:烷烃在燃烧时发生氧化反应,生成二氧化碳和水。
烯烃和炔烃也能被高锰酸钾等氧化剂氧化。
例如:2CH₃CH₂CH₂CH₃ + 13O₂ →8CO₂ + 10H₂OCH₂=CH₂ + KMnO₄ →CO₂ + H₂O四、烃的衍生物烃分子中的氢原子被其他原子或原子团所取代而生成的一系列化合物称为烃的衍生物。
常见的烃的衍生物包括卤代烃、醇、酚、醛、酮、羧酸、酯等。
1. 卤代烃:烃分子中的氢原子被卤素原子取代而形成的化合物。
例如:氯乙烷(CH₃CH₂Cl)、溴苯(C₆H₅Br)等。
2. 醇:烃分子中的一个或多个氢原子被羟基(-OH)取代而形成的化合物。
例如:乙醇(C₂H₅OH)、丙三醇(C₃H₈O₃)等。
3. 酚:苯环上的氢原子被羟基取代而形成的化合物。
例如:苯酚(C₆H₅OH)。
4. 醛:烃基与醛基(-CHO)相连而形成的化合物。
例如:甲醛(HCHO)、乙醛(CH₃CHO)等。
烃的衍生物的归纳与整理
不反应
不反应
四种物质的结构简式为 A CH3CH2COOH B HOCH2CH2CHO或CH3CH(OH)CHO ; C HCOOCH2CH3 D CH3COOCH3 。
讨论2:伞形酮可用作荧光指示剂和酸碱指示剂。其合成方法为:
下列说法正确的是 (
)
A.每个雷琐苯乙酮、苹果酸和伞形酮分子中均含有1个手性碳原子
CH3 CH2ON a
CH3 COOC 2H5
CH4
三、有机反应的类型:
反应类型
取代反应 加成反应 聚合反应 消去反应 氧化反应 还原反应 酯化反应
定义
举例(反应的化学方程式)
四、有机实验问题
1、有机物的分离提纯与鉴别 (1)分离提纯及除杂
分离提纯 分液法:互不相溶的液体与液体的混合物。
蒸馏法(分馏):沸点差较大的物质组成的“固—液” 混合物或“液—液”混合物。
O
R─C─H O
酯
R─C─O─H O
R─C─O─R’
=
= =
讨论1:四种有机物A、B、C、D分子式均为C3H6O2, 把它们分别进行实验并记录现象如下:
NaOH溶液 A 发生中和反应 B 不反应 银氨溶液 不反应 新制Cu(OH)2 溶解 金属钠 生成氢气
有银镜反应 有红色沉淀 放出氢气
C 发生水解反应 有银镜反应 有红色沉淀
CH3— CH3
CH2 =CH2
CH CH2=CHCl
CH
氧化
[CH 2 — CH] n Cl OH
Cl
OH Br
[CH 2— CH2] n
[
CH3CHO
CH2
]n
CH3COOH
烃的衍生物复习[1]
![烃的衍生物复习[1]](https://img.taocdn.com/s3/m/e391fc17cc7931b765ce15ea.png)
(苏丹红一号)
(苯胺)
(2-萘酚)
(A)
(B)
(C)
(D) 。
1、苏丹红一号的化学式(分子式)为
2、在下面化合物(A)~(D)中,与2-萘酚互 为同分异构体的有(填字母代号) 。 3、上述化合物(C)含有的官能团是
。
(08四川卷)胡椒酚是植物挥发油的成分之一,它的结构简式为: HO- -CH2CH=CH2,下列叙述中不正确的是( ) B A.1mol胡椒酚最多可与4molH2发生反应 B.1mol胡椒酚最多可与4mol溴发生反应 C.胡椒酚可与甲醛发生反应,生成聚合物 D.胡椒酚在水中的溶解度小于苯酚在水中的溶解度
C 酸性高锰酸钾溶液、溴水 D 酸性高锰酸钾溶液、氯化铁溶液
4、考查有机反应类型
分析:这是近年来浙江卷考查的热
点,出现频率较高。
策略:把握中学常见的有机反
应类型的概念及本质。取代反应、 消去反应、加成反应、聚合反应、 氧化反应、还原反应、酯化反应 等。
5、考查有机官能团的性质
分析:这是有机化学学习中最基本 的知识点,特点是基础、简单、易 得分。 策略:掌握羟基、羧基、醛基、 卤原子、碳碳双键、碳碳三键等官 能团和酯基、苯环的化学性质。 规律:有机化合物的性质一般看局 部的性质,既官能团的性质即可。
1、写出官能团的名称
分析:这是近年来高考的热点之一,
它考察了最基本的化学知识,但因为 大家很熟悉,平时就容易忘记它。
策略:平时多练习以下的官能团
名称:羟基、羧基、醛基、卤原 子、碳碳双键、碳碳三键等。
2、考查有机物的命名
分析:高中化学中只介绍了烷烃的命
名方法,对于其他类别的有机物没有 专门讨论,但课本中分散地出现过其 他类型的有机物的命名的知识,故高 考试题中常以选择题或者填空题形式 考查。
烃的衍生物知识总结(优秀版)

洁心与大熊在进入高中的第一天相识,两人都是大个子,分座位的时候,老师让男女生各排一队,一队一个次第走到座位上,最后一排有六张桌子,洁心谦虚地站到一个比自己矮一点 点的女生前面,与大熊成了同桌
他们一个15岁,一个16岁,花开的季节。初学立体几何,大熊用小纸壳手工助洁心理解立体与平面的迥异,地理考试这对同桌囊括了班里两个第一,大熊94分,第一名,洁心47分, 倒数第一。大熊不知怎么就让无论如何都搞不懂季风洋流方向的洁心尤如神助,醍醐灌顶。洁心盼着上作文课,老师会朗读几篇上榜佳作,每每读到洁心的作文,大熊会看洁心一眼, 好像在说我知道这一篇是你写的,洁心也会漫不经心瞥一眼,故作平淡地回复嗯,是我。不知从何时起,他们走进彼此的心。大学毕业的第二年,他们结了婚,第三年,有了一个可爱 的孩子。洁心的日常开始以大熊小熊为中心,辞去优渥工作,成为家庭主妇,曾经的诗情画意干练要强变成琐碎的柴米油盐酱醋茶,窈窕淑女变成自带三层救生圈的黄脸婆,大熊成为 业内认可的职业经理人,小熊也取得全国乃至世界各大数学竞赛计算机竞赛的各色奖牌。被大熊小熊的光环映着,洁心日复一日忙忙活活庸庸碌碌地快乐着。人和人之间的比较,是丢 失快乐最简单的方式。昔日的同学大多事业有成,成为各自领域的精英,而洁心日渐落伍,好像被抛弃在另一个时代。比较也是客观认识自己最直接的方式。失落带来思考,洁心终于 意识到这十几二十年的岁月她把自己搞丢了。洁心想重回轨道却无力又无助,知识陈旧,书生意气,与社会严重脱节,抱怨,她偏执地认为大熊消耗了她的青春改写了她的命运,而人 到中年的大熊再不会像过去只要听到洁心呼唤,马上放下全世界飞奔而来,事业有成的他也不再对洁心的发号施令全盘言听计从,洁心觉得自己失去了整个世界。洁心没有意识到很多 时候大熊只是在迁就她,不和她计较,也没有意识到一个企业高管若凡事对一个家庭主妇唯命是从究竟是好事还是坏事,她越来越暴躁,越来越容易愤怒,家庭气氛像一只随时会被引 爆的火药桶,说不定什么琐事就会成为导火索。大熊忙碌粗心,洁心心灰意冷,俩人之间有了罅隙,有了不满,洁心不止一次发怒时大喊分手。洁心最脆弱的时候,大熊没有及时给予 支持和关注,洁心撕心裂肺的难过,大熊忙于工作,浑然不觉,洁心认为大熊不再爱自己,痴心错付,悔不当初,对自己的婚姻感到绝望,她给自己7天的时间思考,要不要走出这曾 欣欣然冲进来的围城。一位生性爱冒险的作家本杰明,无法走出半年前的丧妻之痛,带着一个青春期一个幼儿期的两个孩子,生活一团糟。本杰明放弃了专栏写作,拒绝开始新感情, 欲带着儿女换一个崭新环境开始新生活,于是他买了新房子,未曾想这房子却是一个经济窘迫、难以维系正常运转的动物园……本杰明走投无路之时,发现妻子给留下的“冒险基金”, 妻子自知无法常相陪伴,竭尽所能给丈夫最后的成全,这份爱让人唏嘘汗颜。本杰明给一双儿女讲述他和妻子初次见面,一见钟情,自惭形秽,踌躇不前时,自己骨子里天生的冒险精 神推着自己抓住了这份非你莫属的爱情。看着本杰明和一双儿女对着阴阳相隔的妻子、妈妈,互诉衷肠,洁心百感交集,泣不成声,她想世人听过见过无数美丽的爱情故事,但都是别 人的,现实的生活总会有种种难言的苦楚不如意,“万物皆有裂痕,那是光照进来的地方。”接受人和事的缺憾不完美,才是真实的生活。发起冷战的第三天,洁心不再继续臆想徒生 闷气,她决定给彼此一个机会,和大熊进行了一次推心置腹长谈,长谈的结果是洁心庆幸失而复得的婚姻和爱情,大熊说洁心没失去过,自己一直都在,从未离开,只是不该忽视了洁 心的内心需求。洁心开始找回自己的人生旅程,列清单,定目标,开始学习、锻炼、尝试,由内而外改变自己,每晚洁心大熊两人瑜伽对望,相伴练习腹肌撕裂。假期里,大熊更多地 陪伴洁心,两人相濡以沫走遍千山万水,洁心开始一展所长,用文字记录下他们的所见所闻,所感所悟。人到中年,两人相互珍惜,共同成长,生命和爱情焕发出绚丽光彩,照亮了彼 此的人生,很多小伙伴说因为他们,自己又开始相信并渴望爱情了。一日,,麦克是校园篮球明星,他本可以因篮球特长被全额奖学金保送进大学,但因女友怀孕他放弃了关键的冠军 赛而向女友求婚。20年后,麦克穷困潦倒,事业家庭均失意,戏剧性地他重返了17岁,仍是青春闪耀,17岁的他遇到现实中的一对儿女,中年的妻子,一切重来,当他��
烃的衍生物总结

甲烷燃烧CH4+2O2→CO2+2H2O(条件为点燃)甲烷隔绝空气高温分解甲烷分解很复杂,以下是最终分解。
CH4→C+2H2(条件为高温高压,催化剂)甲烷和氯气发生取代反应CH4+Cl2→CH3Cl+HClCH3Cl+Cl2→CH2Cl2+HClCH2Cl2+Cl2→CHCl3+HClCHCl3+Cl2→CCl4+HCl (条件都为光照。
)实验室制甲烷CH3COONa+NaOH→Na2CO3+CH4(条件是CaO 加热)乙烯燃烧CH2=CH2+3O2→2CO2+2H2O(条件为点燃)乙烯和溴水CH2=CH2+Br2→CH2Br-CH2Br乙烯和水CH2=CH2+H20→CH3CH2OH (条件为催化剂)乙烯和氯化氢CH2=CH2+HCl→CH3-CH2Cl乙烯和氢气CH2=CH2+H2→CH3-CH3 (条件为催化剂)乙烯聚合nCH2=CH2→-[-CH2-CH2-]n- (条件为催化剂)氯乙烯聚合nCH2=CHCl→-[-CH2-CHCl-]n- (条件为催化剂)实验室制乙烯CH3CH2OH→CH2=CH2↑+H2O (条件为加热,浓H2SO4)乙炔燃烧C2H2+3O2→2CO2+H2O (条件为点燃)乙炔和溴水C2H2+2Br2→C2H2Br4乙炔和氯化氢两步反应:C2H2+HCl→C2H3Cl--------C2H3Cl+HCl→C2H4Cl2乙炔和氢气两步反应:C2H2+H2→C2H4→C2H2+2H2→C2H6 (条件为催化剂)实验室制乙炔CaC2+2H2O→Ca(OH)2+C2H2↑以食盐、水、石灰石、焦炭为原料合成聚乙烯的方程式。
CaCO3 === CaO + CO2 2CaO+5C===2CaC2+CO2CaC2+2H2O→C2H2+Ca(OH)2C+H2O===CO+H2-----高温C2H2+H2→C2H4 ----乙炔加成生成乙烯C2H4可聚合苯燃烧2C6H6+15O2→12CO2+6H2O (条件为点燃)苯和液溴的取代C6H6+Br2→C6H5Br+HBr苯和浓硫酸浓硝酸C6H6+HNO3→C6H5NO2+H2O (条件为浓硫酸)苯和氢气C6H6+3H2→C6H12 (条件为催化剂)乙醇完全燃烧的方程式C2H5OH+3O2→2CO2+3H2O (条件为点燃)乙醇的催化氧化的方程式2CH3CH2OH+O2→2CH3CHO+2H2O(条件为催化剂)(这是总方程式)乙醇发生消去反应的方程式CH3CH2OH→CH2=CH2+H2O (条件为浓硫酸 170摄氏度)两分子乙醇发生分子间脱水2CH3CH2OH→CH3CH2OCH2CH3+H2O (条件为催化剂浓硫酸 140摄氏度)乙醇和乙酸发生酯化反应的方程式CH3COOH+C2H5OH→CH3COOC2H5+H2O乙酸和镁Mg+2CH3COOH→(CH3COO)2Mg+H2乙酸和氧化钙2CH3COOH+CaO→(CH3CH2)2Ca+H2O乙酸和氢氧化钠CH3COOCH2CH3+NaOH→CH3COONa+CH3CH2OH乙酸和碳酸钠Na2CO3+2CH3COOH→2CH3COONa+H2O+CO2↑甲醛和新制的氢氧化铜HCHO+4Cu(OH)2→2Cu2O+CO2↑+5H2O乙醛和新制的氢氧化铜CH3CH O+2Cu→Cu2O(沉淀)+CH3COOH+2H2O乙醛氧化为乙酸2CH3CHO+O2→2CH3COOH(条件为催化剂或加温)烯烃是指含有C=C键的碳氢化合物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
烷烃、烯烃、炔烃、 烷烃、烯烃、炔烃、芳香烃的比较
有机物 代表物
烷烃
烯烃
炔烃
芳香烃
CH4
C2H4
含碳碳双 键不饱和 平面型
C2H2
含碳碳叁 键不饱和
C6H6
含大π 含大π键 不饱和
平面正六边形
全部单键 结构特点 饱和烃 空间结构 正四面体型 物理性质 燃烧 与溴水 KMnO4 主要反应 类型
直线型
7、酯化反应(属于取代反应):酸(有机 酯化反应(属于取代反应):酸 ): 羧酸、无机含氧酸) 羧酸、无机含氧酸)与醇作用生成酯和水的 反应。 反应。
8、水解反应:有机物在一定条件下跟水作用 水解反应: 生成两种或多种物质的反应。 生成两种或多种物质的反应。 水解反应包括卤代烃水解、酯水解、 除单 水解反应包括卤代烃水解、酯水解、糖(除单 糖外)水解 蛋白质水解等。 水解、 糖外 水解、蛋白质水解等。
O
催化剂
+ 3H2
C 1 7 H3 5 C O
O O O
C H2 CH C H2
C 1 7 H 3 5C 加 热 ,加 压 O C 1 7 H3 5 C
6、 、 加聚反应: 加聚反应:通过加成反应聚合成高分子化合 物的反应(加成聚合)。 )。主要为含双键的单 物的反应(加成聚合)。主要为含双键的单 体聚合。 体聚合。
醛:
主要化学性质
催化剂
1、加成反应:CH3CHO + H2 、加成反应: 还原反应) (还原反应) 2、氧化反应: 、氧化反应: 催化剂 催化氧化: 催化氧化:2CH3CHO + O2
CH3CH2OH
2CH3COOH
银镜反应: 2Ag 银镜反应:CH3CHO +2 Ag(NH3)2OH ( + CH3COONH4 +3 NH3 + H2O 与Cu(OH)2反应:CH3CHO + 2Cu(OH)2 ( ) 反应: ( ) Cu2O + CH3COOH + 2H2O
二、各类物质间转化关系
酮氧 化 水解 Hຫໍສະໝຸດ 还 原烯烃HX 消去
卤代烃
醇
脱 水
氧化 还原
醛
氧化
羧酸
酯化 水解
酯
醚、烯
烃的衍生物概述
类别 醇 酚 醛 羧酸 酯 官能团
—OH
通式
R—OH CnH2n+2O Ar—OH CnH2n-6O R—CHO CnH2nO R—COOH CnH2nO2 RCOOR` CnH2nO2
C2H5Br + NaOH
CH2=CH2 + NaBr +H2O
4、氧化反应:有机物得氧或失氢的反应。 、氧化反应:有机物得氧或失氢的反应。
5、还原反应:有机物加氢或去氧的反应。 、还原反应:有机物加氢或去氧的反应。
O C 1 7 H3 3 C O C 1 7 H 3 3C O C 1 7 H 3 3C O O O C H2 CH C H2
1、取代反应:2C2H5OH + 2Na 取代反应: 2、消去反应: C2H5OH 消去反应:
浓H2SO4 1700C
3、氧化反应: 氧化反应: 点燃 燃烧: C2H5OH +3 O2 燃烧: 催化氧化: 催化氧化:2C2H5OH + O2 酯化反应: 4、酯化反应:
催化剂
2CO2 +3H2O 2CH3CHO + H2O
2、加成反应:有机物分子中未饱和的碳原子 、加成反应: 跟其它原子或原子团直接结合生成别的物质 的反应。 的反应。 加成反应试剂包括H 卤素)、 )、HX、 加成反应试剂包括 2、X2(卤素)、 、 HCN等。 等
例如: 例如:
3、消去反应:有机物在一定条件下,从一个分子 、消去反应:有机物在一定条件下, 中脱去一个小分子( 中脱去一个小分子(如:H2O、HX、NH3等)生 、 、 成不饱和化合物的反应(消去小分子)。 成不饱和化合物的反应(消去小分子)。
代表物
CH3CH2OH
主要化学性质
(1)与钠反应 (2)取代反应 与钠反应 取代反应 (3)消去反应 (4)分子间脱水 消去反应 分子间脱水 (5)氧化反应 (6)酯化反应 氧化反应 酯化反应 (1)有弱酸性 (2)取代反应 有弱酸性 取代反应 (3)显色反应 (4)缩聚反应 显色反应 缩聚反应
—OH —CHO —COOH —COO—
醇 △
CH2==CH2 + NaBr
卤代烃 卤代烃中卤素原子的检验: 取少量卤代烃,加NaOH溶液,一 段时间后加HNO3酸化后再加 AgNO3,如果有白色沉淀说明有Cl¯, 如有浅黄色沉淀则有Br¯,如有黄色沉 淀则有I¯。
烃的衍生物知识总结
烃的衍生物
卤代烃 醇类 醛类 羧酸 酯 酚
通式:R—OH,饱和一元醇CnH2n+1OH
羧酸: 羧酸
主要化学性质
1、酸的通性: 、酸的通性: CH3COOH + NaOH
CH3COONa + H2O
2、酯化反应: 、酯化反应: 浓H2SO4 CH3COOH + CH3CH2OH CH3COOCH2CH3 + H2O
烃的衍生物知识总结
烃的衍生物
卤代烃 醇类 醛类 羧酸 酯 酚
O 通式:R`—C—O—R,分子式CnH2nO2
CnH2n+1X
加成、加聚、 加成、加聚、氧化
取代、加成( )、 取代、加成(H2)、 氧化 水解→醇 水解 醇 消去→烯烃 消去 烯烃
二、有机化学的主要反应类型 有机化学的主要反应类型 的主要
1、取代反应
3、消去反应 、 5、还原反应 、 7、酯化反应 、 9、裂化反应 、
2、加成反应 、 4、氧化反应 、 6、聚合反应 、 8、水解反应 、
烃的衍生物知识总结
卤代烃 醇类 烃的衍生物 醛类 羧酸 酯 酚
子取代后的产物。(卤素原子) 通式
一、卤代烃:烃分子中的氢原子被卤素原
CnH2n+1X
代表物
C2H5Br
NaOH
1、取代反应:C2H5Br + H2O 、取代反应: 水解反应) (水解反应)
C2H5OH + HBr
2、消去反应:C2H5Br + NaOH 、消去反应: +H2O
八中 田春萍
链
烃 ---烃 --烃) 烃 烃 --烃 --
:CnH2n+2 :CnH2n :CnH2n-2 :CnH2n
基础知识回顾
烃的分类: 烃的分类:烃
烃
(
环 烃
烃
烃--烃 的 --:CnH2n-6
类烃的
烃的
:
烃的物理性质: 烃的物理性质: ①密度:所有烃的密度都比水小 密度: ②状态:常温下,碳原子数小于等于4的气态 状态:常温下,碳原子数小于等于 的气态 ③熔沸点:碳原子数越多,熔、沸点越高 ; 熔沸点:碳原子数越多, 碳原子数相同,支链越多,熔沸点越低; 碳原子数相同,支链越多,熔沸点越低;
(3)乙醇氧化法
1、常温下甲醛为无色有刺激性气味的气体 、常温下甲醛为无色有刺激性气味的气体 甲醛为无色有刺激性气味的 2、1mol醛生成 醛生成4molAg或需 或需4mol新制氢氧化铜。 新制氢氧化铜。 、 醛生成 或需 新制氢氧化铜 3、甲醛的水溶液 叫福尔马林, 、甲醛的水溶液(35%-40%)叫福尔马林,具有防腐和 叫福尔马林 具有防腐和 杀菌能力。 杀菌能力。
9、裂化反应:在一定温度下,把相对分子 、裂化反应:在一定温度下, 质量大、 质量大、沸点高的长链烃断裂为相对分子质 量小、沸点低的短链烃的反应。 量小、沸点低的短链烃的反应。
三 有关化学实验回顾 1 燃烧
2、取代反应
4 溴乙烷水解 与氢氧化钠溶液共热: 与氢氧化钠溶液共热:
你认为哪一套装置更好?它的优点有哪些? 你认为哪一套装置更好?它的优点有哪些?
烃的衍生物知识总结
烃的衍生物
卤代烃 醇类 醛类 羧酸 酯 酚
物理性质: 净的苯酚是没有颜色的晶 纯 体,具有特殊的气味,露置在空气中 氧化变成粉红色 因小部分发生氧化 氧化而显粉红色 常温 粉红色。常温 氧化 粉红色 代表物 时,苯酚在水中溶解度不大 溶解度不大,当温度 溶解度不大 (1)易被氧化变质(氧化反应) 高于65℃ 65℃时,能跟水以任意比互溶 任意比互溶。 65℃ 任意比互溶 OH (2)与Br2发生取代(取代反应) 化性 易溶于 苯酚易溶于 易溶于乙醇,乙醚等有机溶剂 有机溶剂。 有机溶剂 (3)与FeCl3显紫色(显色反应) 有毒,其浓溶液对皮肤有强烈的 苯酚有毒 有毒 (4)弱酸性(比碳酸的酸性弱) 腐蚀性,使用时要小心!如果不慎沾到 腐蚀性 如果不慎沾到 苯酚钠溶液通入CO 苯酚钠溶液通入CO2会出现浑浊。 皮肤上,应立即用酒精洗涤。 皮肤上,应立即用酒精洗涤
分类 烷烃 烯烃(环烷烃) 烯烃(环烷烃) 通式 官能团 特点: 特点: C—C 一个C= 一个 =C 一个C≡C 一个 一个苯基 一个苯基 —X 化学性质
CnH2n+2 CnH2n
稳定,取代、氧化、 稳定,取代、氧化、 裂化 加成、加聚、 加成、加聚、氧化
炔烃(二烯烃) 炔烃(二烯烃) CnH2n-2 苯及其同系物 卤代烃 CnH2n-6
C6H5—OH CH3CHO CH3COOH CH3COOC2H5
(1)氧化反应 氧化反应 (2)还原反应 还原反应 (1)具有酸性 具有酸性 (2)酯化反应 酯化反应 水解反应
练习1 练习
在下列物质中进行选择
A.HCHO B.CH3CH2OH C.CH3COOH D.HCOOCH3 E. OH 1.水溶液呈酸性的物质有 CE ) 水溶液呈酸性的物质有( 水溶液呈酸性的物质有 2.不能和 反应的物质有 AD) 不能和Na反应的物质有 不能和 反应的物质有( 3.能与 能与NaHCO3溶液反应的物质有 C ) 溶液反应的物质有( 能与 4.能发生银镜反应的物质有 AD ) 能发生银镜反应的物质有( 能发生银镜反应的物质有 5.能用于合成酚醛树脂的物质有 AE ) 能用于合成酚醛树脂的物质有( 能用于合成酚醛树脂的物质有 6.熔点最高的物质是 E ) 熔点最高的物质是( 熔点最高的物质是 7.对应同系物分子通式相同的物质有 CD ) 对应同系物分子通式相同的物质有( 对应同系物分子通式相同的物质有 浓硫酸 CH3—CH2OH CH2=CH2↑ +H2O 8.发生消去反应对应反应式为: 发生消去反应对应反应式为: 发生消去反应对应反应式为 170℃ ℃ HCOOCH3+H2O 酸或碱 HCOOH+CH3OH 9.发生水解反应对应反应式为: 发生水解反应对应反应式为: 发生水解反应对应反应式为 △ 10.某物质与少量 2CO3反应放出气泡,反应式为: 某物质与少量Na 反应放出气泡,反应式为: 某物质与少量
