配合物的性质
实验6 配合物的生成和性质

实验6 配合物的生成和性质
配合物的生成和性质是有机化学的重要内容。
它的研究主要围绕配体与配体作用、各种反应条件下的前趋分子合成及配体催化变化等进行。
配合物在一定的条件下可以生成,首先应满足的是反应的活性,所谓活性既指配体的活性,又指溶剂的活性。
其次,反应的时空控制对反应结果有极大影响,即在给定温度下保持适当时间。
再次,配合物在活性和时空控制条件下,需要足够的受体(即催化室内的受体),以交联紧束反应物,成为稳定的配合物。
配合物受配体的影响,其各种性质的优劣于受配体的类型,它们之间的对比性排列可以极大地影响配合物的催化性、结构和性能。
一般来说,活性更大的配体,催化性和结构也更好。
此外,体积越大的配体,其疏水性越强,配体的立体定位也更容易控制。
以上是配合物生成和性质的基本内容,经过仔细研究和研究能够帮助我们更加准确的分析配体的影响、控制配合物反应环境,优化反应条件和反应物,从而达到良好的催化作用和最好的产品效果。
实验十一-配合物的生成、性质与应用

实验十一-配合物的生成、性质与应用一、实验目的1.了解配合物的形成原理及其相关理论知识;2.掌握配合物的生成、性质和应用;3.学会使用一些化学实验技术,如分离、纯化、结晶等。
二、实验原理1. 配合物的定义配合物是由阳离子、阴离子或分子中心离子(配体)和周围的一个或多个配位体(也称配体)组成的化学物质。
配位体是一种能够向中心离子提供一个或多个共价键(配位键)的化合物或离子。
一般情况下,配位体都是较小的分子,如水分子、氨分子和氯离子等。
2. 配合物的形成原理配合物的形成受到多种因素的影响,主要有以下三方面:1.配位体的性质:配位体通常具有一个或多个孤对电子,可以与中心离子形成配位键。
2.中心离子的性质:中心离子通常具有空的d轨道或f轨道,可以接受来自配位体的电子形成配位键。
3.形成的稳定性:配合物的稳定性取决于配位键的强度、离子的电荷、配位体空间位阻等因素。
3. 配合物的性质配合物具有以下一些特征:1.配合物中心离子的化学性质发生变化。
2.配位体对中心离子的性质有重要影响。
3.配合物常呈现出较强的带电性。
4.配合物的化学性质受配位键性质、离子作用力等因素的影响。
4. 配合物的应用配合物具有广泛的应用,包括:1.工业上用于制造农药、颜料、化学催化剂等。
2.医学上用于治疗疾病,如铁离子配合物用于治疗缺铁性贫血等。
3.生物学上用于研究生物大分子结构和作用机制。
三、实验步骤1. 实验材料和仪器FeCl3·6H2O、KSCN、NaClO、稀盐酸、热水、恒温加热器、移液管、pH试纸、试管等。
2. 实验步骤1.制备混合物:将溶液A(5mL FeCl3·6H2O和4mL稀盐酸)和溶液B(5mL NaClO和4mL稀盐酸)混合,注意不要相互混合,避免产生气体。
2.稀释混合物:将混合溶液加入10mL的水中,形成红褐色混合物。
3.测量pH值:用pH试纸测量溶液的pH值,记录下来。
4.添加配体:加入2滴KSCN溶液,并轻轻摇动管子。
配合物的性质
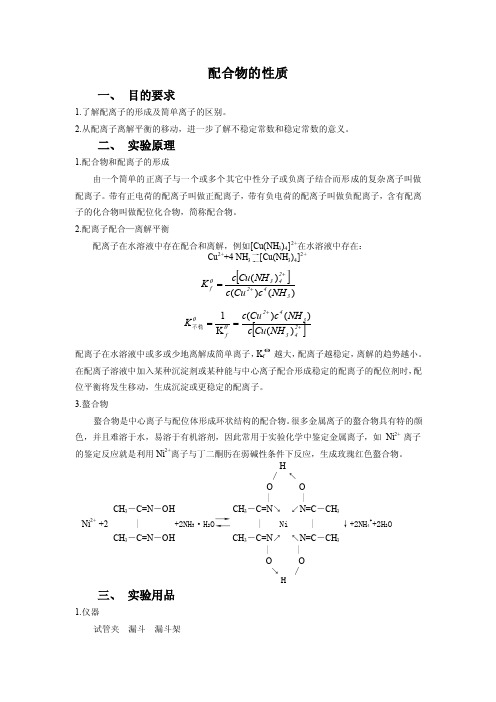
配合物的性质一、 目的要求1.了解配离子的形成及简单离子的区别。
2.从配离子离解平衡的移动,进一步了解不稳定常数和稳定常数的意义。
二、 实验原理1.配合物和配离子的形成由一个简单的正离子与一个或多个其它中性分子或负离子结合而形成的复杂离子叫做配离子。
带有正电荷的配离子叫做正配离子,带有负电荷的配离子叫做负配离子,含有配离子的化合物叫做配位化合物,简称配合物。
2.配离子配合—离解平衡配离子在水溶液中存在配合和离解,例如[Cu(NH 3)4]2+在水溶液中存在:Cu 2++4 NH 3→←[Cu(NH 3)4]2+ [])()()(342243f NH c Cu c NH Cu c K ++=θ []++==243342f NH Cu c NH c Cu c K )()()(K 1θθ不稳 配离子在水溶液中或多或少地离解成简单离子,K f θ越大,配离子越稳定,离解的趋势越小。
在配离子溶液中加入某种沉淀剂或某种能与中心离子配合形成稳定的配离子的配位剂时,配位平衡将发生移动,生成沉淀或更稳定的配离子。
3.螯合物螯合物是中心离子与配位体形成环状结构的配合物。
很多金属离子的螯合物具有特的颜色,并且难溶于水,易溶于有机溶剂,因此常用于实验化学中鉴定金属离子,如Ni 2+ 离子的鉴定反应就是利用Ni 2+离子与丁二酮肟在弱碱性条件下反应,生成玫瑰红色螯合物。
H↚ ↖O O| |CH 3-C=N -OH CH 3-C=N ↘ ↙N=C -CH 3Ni 2+ +2 | +2NH 3·H 2O →← | Ni | ↓+2NH 4++2H 2O CH 3-C=N -OH CH 3-C=N ↗ ↖N=C -CH 3| |O O↘ ↚H 三、 实验用品1.仪器试管夹 漏斗 漏斗架2.药品H2SO4 1mol·L-1,NH3·H2O 2mol·L-1、6mol·L-1,NaOH 0.1mol·L-1、2mol·L-1 ,AgNO3 0.1 mol·L-1,CuSO4 0.1 mol·L-1,HgCl2 0.1mol·L-1,KI 0.1 mol·L-1,K3[Fe(CN)6] 0.1 mol·L-1,KSCN 0.1 mol·L-1,NaF 0.1 mol·L-1,NH4F 4mol·L-1,NaCl 0.1 mol·L-1,FeCl3 0.1 mol·L-1,Na2S2O3 1 mol·L-1、饱和溶液,Ni(NO3) 2 0.1 mol·L-1,Na2S 0.1 mol·L-1,EDTA 0.1 mol·L-1,Na2CO3 0.1 mol·L-1,KBr 0.1 mol·L-1,C2H5OH 95%,CCl4,丁二酮肟试液。
配合物的性质与应用

配合物的性质与应用配合物是指由一个或多个中心离子或原子团与一些配体(通常为碳族或氮族元素的有机分子或无机分子)形成的具有特定性质的化合物。
配合物具有许多独特的性质和广泛的应用。
本文将从配合物的性质以及在生物医学、环境保护、材料科学等领域的应用方面进行探讨。
一、配合物的性质1.颜色很多配合物具有鲜明的色彩,这是由于配体中的某些成分可能在配合物中发生吸收和散射不同波长的光,从而导致颜色的变化。
例如,铁离子能与异氰酸根离子配合形成红色的[Fe(CN)6]^-4配合物,而四氨合钯离子能形成深红色的[Pd(NH3)4]Cl2配合物。
2.热稳定性配合物的热稳定性是指其在高温下的稳定性。
对于许多高价离子,其稳定性比低价离子要高许多,因为它们中心离子周围能够螯合的配体数更多。
例如,四氯合氧钴离子在高温下具有较高的热稳定性,因为它的钴离子在四个氯离子和一个氧分子的共同作用下变得更加稳定。
3.溶解度许多配合物具有比原始离子或原子更高或更低的溶解度。
例如,氧合钴的水溶性比钴离子高出很多,可能是因为它的配体氧分子增加了钴离子周围的配位位点数目。
类似地,金属的某些氢氧根配合物从水溶液中萃取出来可以制备出具有较高结晶度的晶体。
4.磁性配合物的磁性是指可在磁场中感应到的磁矩。
许多配合物是磁性的,这是因为它们中心离子中未被配位的轨道与配体构成的荷电云相互作用,发生了电子交换。
其中,低自旋配合物是指配体能够填满中心离子的轨道,从而减少了轨道角动量,使整个配合物呈现出极低的磁矩,反而高自旋配合物的磁矩则相对较大。
二、应用1.生物医学配合物在生物医学中有着重要的应用。
许多金属离子的配合物能够抑制癌症细胞的生长并减少病变部位对周围组织的影响。
例如,铂配合物氯铂酸(cisplatin)被广泛用于治疗癌症。
这些配合物利用中心离子的价电子,与DNA结合并抑制了细胞的增殖。
另外,一些抗菌和抗病毒药物也是配合物。
如金霉素是一种配合物,能杀菌和抑制生长。
配合物的性质实验报告

配合物的性质实验报告配合物的性质实验报告引言:配合物是由中心金属离子与配体形成的化合物,广泛应用于化学、医学和材料科学等领域。
通过实验研究配合物的性质,可以深入了解其结构和反应特性,为相关应用提供理论基础。
本实验旨在通过一系列实验,探究不同配体对配合物性质的影响。
实验一:配合物的颜色实验目的:通过观察不同配合物的颜色变化,了解配合物的电子跃迁和吸收光谱特性。
实验步骤:1. 准备不同金属离子和配体的溶液,如FeCl3、CuSO4、CoCl2等金属离子溶液,以及NH3、EDTA等配体溶液。
2. 将金属离子溶液和配体溶液按一定比例混合,观察溶液颜色变化。
实验结果与讨论:观察到不同配合物的颜色变化,如FeCl3与NH3反应生成红棕色的[Fe(NH3)6]3+配合物,CuSO4与NH3反应生成蓝色的[Cu(NH3)4]2+配合物。
这些颜色变化是由于配合物中金属离子的电子跃迁引起的。
不同金属离子和配体之间的相互作用导致电子能级发生变化,从而吸收不同波长的光,呈现出不同的颜色。
实验二:配合物的稳定性实验目的:通过观察配合物在不同条件下的稳定性,了解配合物的溶解度和配体交换反应。
实验步骤:1. 准备一系列含有不同金属离子的配合物溶液。
2. 分别在酸性、碱性和中性条件下观察配合物的溶解度变化。
3. 将配合物溶液与其他配体反应,观察配合物的配体交换反应。
实验结果与讨论:观察到在酸性条件下,某些配合物的溶解度增加,而在碱性条件下溶解度减少。
这是由于酸性条件下配体与金属离子形成更稳定的配合物,而碱性条件下配体与金属离子解离,导致配合物溶解度降低。
此外,通过与其他配体反应,观察到配合物的配体交换反应。
不同配体对配合物的稳定性有不同的影响,部分配体可以与配合物发生配体交换反应,形成新的配合物。
实验三:配合物的热稳定性实验目的:通过研究配合物在高温条件下的热稳定性,了解配合物的热分解反应和热稳定性。
实验步骤:1. 将配合物样品加热至一定温度,记录温度和观察样品的颜色和形态变化。
4.配合物的生成和性质

1
实验四 配合物的生成和性质
一、 实验目的
1. 加深理解配合物的组成和稳定性,了解配合物形成时的特性。
2. 初步学习利用配位溶解的方法分离常见混合阳离子。
3. 学习电动离心机的使用和固-液分离操作。
二、 实验原理
配位化合物与配位平衡
配位化合物的内、外层之间是靠离子键结合的,在水中是完全解离。
而配位个体在水中是部分的、分步的解离,因此就存在解离平衡。
配合物的标准平衡常数θ
f K ,也被称为稳定平衡常数。
θf K 越大,表明配合物越稳定。
形成配合物时,常伴有溶液颜色、酸碱性、难溶电解质溶解度、中心离子氧化还原性的改变等特征。
利用配位溶解可以分离溶液中的某些离子。
三、实验内容
2
3
4
四、注意事项
1.使用离心机时要注意安全。
2.及时记录实验过程中配合物的特征颜色。
3.节约药品,废液倒入废液缸。
5。
配位化学 第3章 配合物性质与表征

配合物的性质与表征
The properties and spectroscopic characterization
of coordination compounds
本章教学内容
3.1 配合物的性质 3.2 配合物的光谱表征
3.1 配合物的性质
在溶液中形成配合物时,常常出现颜色、溶解度、电 极电势以及pH 值的改变等现象。根据这些性质的变化,可 以帮助确定是否有配合物生成。
配体内的跃迁
有机配体分子中的电子跃迁包括σ→σ*,n→σ*,n→π*, π→π*四种。其中,大多数有机化合物的吸收光谱是电子 n→π*和π→π*跃迁的结果。因为紫外-可见光谱的波长范围在 200-700 nm,σ→σ*和n→σ*跃迁所需要的能量较大,所以, 能在紫外区观测到这两种跃迁的分子较少。而n→π*和π→π* 跃迁的吸收峰恰好位于200-700 nm范围内,因此,配体分子 内的跃迁主要是n→π*和π→π*跃迁。如果金属和配体之间主 要是静电作用,金属原子对配体吸收光谱的影响较小,配合 物的吸收光谱与配体的吸收光谱类似。如果金属和配体之间 形成共价键,则配合物的吸收峰向紫外方向移动,共价程度 越强,吸收峰移动得越远。
同一金属离子氢氧化物的碱性因形成配离子而有变化, 如[Cu(NH3)4](OH)2的碱性就大于Cu(OH)2。原因是 [Cu(NH3)4]2+的半径大于Cu2+离子的半径和OH-离子的结合 能力较弱,OH-离子易于解离。
3.2 配合物的光谱表征
电子光谱
(1)配合物价电子跃迁的类型
电子光谱是由于分子中的价电子吸收了光源能量后,从低 能级分子轨道跃迁到高能级分子轨道所产生的各种能量光 量子的吸收。其能量覆盖了电磁辐射的可见、紫外和真空 紫外区,所以又叫可见-紫外光谱。
第3章配合物性质与表征-

电荷跃迁: 在中心原子和配体间可能发生电子的跃迁,可以是由中 心原子的分子轨道向配体的分子轨道跃迁,也可以是由配体 的分子轨道向中心原子的分子轨道跃迁。当配体是可氧化的, 中心原子是高氧化态时,电子从配体向中心原子跃迁。且配 体还原能力越强,中心原子氧化能力越高,电荷跃迁的波长 就越长。当不饱和配体和低氧化态中心原子形成配合物时, 电子由中心原子向配体跃迁。一般说来,电荷跃迁波长比dd跃迁较短,强度更强。
d-d 跃迁:
过渡金属离子的 d 轨道或 f 轨道未被填满,常发生 d-d跃迁 或f-f跃迁, d-d跃迁是电子从中心原子的一个d轨道跃迁到较高能级的 d轨道,分为自旋允许跃迁和自旋禁阻跃迁两种。自旋允许跃 迁较强,而自旋禁阻跃迁由于是禁阻的,只是由于配体的微 扰效应引起的,故而较弱。 因为d-d间的能级差不大,因而常常处在可见光区。当配 合物中配位能力较弱的配体被配位能力更强的配体取代时, d-d间的能级差发生变化,d-d吸收带的位置会根据光谱化学 序发生移动。如果新配体的加入改变了配合物的对称性,吸 收带的强度也会发生变化。这些变化与配合物的反应有关, 故而,可以用于研究配合物的反应和组成。例如,当 [Co(H2O)6]2+中的水被 Cl-取代,配合物由八面体对称变为四 面体对称,配合物的颜色由粉红色变为蓝色,消光系数变得 更大。
配合物知识点总结

配合物知识点总结一、配合物的定义配合物是由金属离子和配体通过共价键结合而成的化合物。
金属离子在配合物中通常为正离子,配体是通过给电子对金属离子形成配位键。
配合物可以根据配体数目的不同,分为配位数配合物和低配位数配合物。
配合物具有特定的结构和性质,可以发挥重要的应用价值。
二、配合物的结构1. 配合物的中心离子配合物的中心离子通常是金属离子,其常见的价态有+1、+2、+3等。
金属离子的价态决定了配合物的性质和反应活性。
在配合物中,金属离子通常是八面体、四面体等形状的配位几何构型,取决于其配位数和电子排布。
2. 配位键配位键是配体与金属中心之间形成的化学键,通常由配体的一个或多个孤对电子与金属中心的空的d轨道形成。
配位键的强度和稳定性决定了配合物的性质和应用。
3. 配位数配位数是指一个金属离子中与配体形成共价键的个数。
配合物的配位数决定了其化学性质和反应活性。
配位数的不同可以导致配合物的结构和形态的差异,从而影响其性质和应用。
4. 配位几何构型配合物的配位几何构型是指配位体围绕金属中心排布的结构。
常见的配位几何构型有八面体、四面体、三角双锥等形状,配位几何构型决定了配合物的形态和稳定性。
三、配合物的性质1. 配合物的稳定性配合物的稳定性是指其在不同条件下的稳定程度。
配合物的稳定性受金属离子的化合价、配体的性质、配位数和配位方式等因素的影响。
稳定的配合物通常具有良好的溶解度和化学稳定性。
2. 配合物的光谱性质配合物在紫外可见光谱和红外光谱中表现出特定的吸收和发射特性,这些光谱性质可以用来确定配合物的结构和配位方式,从而揭示其化学性质和反应机理。
3. 配合物的磁性由于金属离子的d轨道电子结构的特殊性,配合物具有特定的磁性特性。
配合物可以表现出顺磁性、反磁性和铁磁性等磁性行为,这些性质对于配合物的结构和性质具有重要意义。
4. 配合物的溶解度配合物的溶解度受金属离子的价态、配体的性质和溶剂性质的影响。
溶解度的不同可以影响配合物的稳定性和应用。
配合物的概念

配合物的概念
配合物,又称化学配合物或络合物,是由两种或多种不同原子间的化学键结合形成的化合物。
配合物拥有特殊的物理和化学性质,可以应用于很多领域。
在催化剂中,配合物可以帮助加速反应速率。
在医药领域,配合物可以用作药物载体,提高药物的稳定性和生物利用度。
配合物还可以应用于材料科学中,如制备光电材料和磁性材料。
配合物的形成取决于中心金属离子和配体之间的相互作用。
中心金属离子常常是过渡金属离子,如铁、铜、镍等。
配体则可能是有机物(如氨、乙二胺)或无机物(如氯离子、水分子)等。
配体与中心金属离子之间的配位键主要包括配位键、共价配位键和氢键。
配合物的结构可以通过各种实验方法进行分析,如X射线晶体衍射、核磁共振和紫外可见光谱。
这些实验方法可以揭示配合物的几何构型、电子结构和化学键类型。
最后需要注意的是,配合物在实际应用中要考虑到其稳定性、毒性和可再生性等方面的问题,以确保其安全和可持续性。
无机化学中的配合物的合成与性质

无机化学中的配合物的合成与性质无机化学是研究无机物质的组成、结构、性质和变化规律的学科。
在无机化学中,配合物是一种由中心金属离子与配体(通常是一种或多种具有可提供孤对电子的分子或离子)通过配位键结合而成的化合物。
配合物具有丰富的结构和性质,对于理解无机化学的基本原理和应用具有重要意义。
一、合成配合物的方法1. 直接合成法:直接将金属离子与配体在适当的条件下反应,生成配合物。
例如,将氯化铜与氨水反应,可以得到淡蓝色的四水合氯化铜配合物。
2. 水合反应法:将金属离子与水分子反应生成水合配合物,然后再与其他配体反应生成目标配合物。
例如,将氯化铜与水反应生成氯化铜二水合物,再与乙二胺反应生成氯化铜乙二胺配合物。
3. 氧化还原法:通过氧化还原反应合成配合物。
例如,将铜离子与亚硝酸反应生成亚硝酸铜配合物。
4. 气相法:将金属离子和配体在气相条件下反应生成配合物。
例如,将金属蒸气与氨气反应生成金属氨合物。
二、配合物的性质1. 颜色:配合物常常具有鲜艳的颜色,这是由于配体的吸收和反射光的特性导致的。
例如,四水合铜离子呈现淡蓝色,是由于配体中的水分子吸收红光而呈现蓝色。
2. 稳定性:配合物的稳定性取决于金属离子和配体之间的配位键的强度。
一般来说,配位键越强,配合物越稳定。
例如,氯离子和铁离子形成的六氯合铁(III)离子比氯离子和铁离子形成的六氯合铁(II)离子更稳定。
3. 反应性:配合物的反应性主要取决于配体和金属离子之间的配位键的稳定性。
一些配合物在溶液中可以发生配体的置换反应,即原先与金属离子配位的配体被其他配体取代。
例如,氯化铜二水合物可以发生氨取代反应,生成氯化铜乙二胺配合物。
4. 磁性:配合物中的金属离子可以表现出不同的磁性。
根据金属离子的电子结构和配位键的类型,配合物可以是顺磁性的、抗磁性的或者发生自旋交叉的。
5. 光谱性质:配合物的光谱性质对于研究其结构和性质非常重要。
通过紫外可见吸收光谱、红外光谱和核磁共振光谱等技术,可以确定配合物的结构和配位键的类型。
配位化学与配合物的性质

配位化学与配合物的性质在化学领域中,配位化学是一个重要的研究方向,与之相关的配合物又是一个关键概念。
配位化学研究着重于探究金属离子与其周围配体之间的相互作用,从而形成稳定的配合物。
本文将介绍配位化学的基本原理以及配合物的性质。
一、配位化学的基本原理配位化学的核心概念是配位键的形成,即金属离子与配体之间形成的化学键。
在配位化学中,金属离子作为电子受体,配体则是电子给体。
配体通常是具有多个配位原子的有机或无机化合物,能够通过配位键与金属离子相连。
配位键的形成取决于多种因素,其中最主要的是配体的硬度和软度。
硬配体通常是电子密度较小的配体,如氨和水等,能够形成较强的配位键。
而软配体则具有较高的电子密度,如氯离子和硫化物离子等。
硬度和软度的概念由国际学术界的生物无机化学家Pearson提出,对于理解配位化学的基本原理至关重要。
二、配合物的性质配合物具有多种特殊的性质,这使得它们在诸多领域中具有广泛的应用。
以下将介绍配合物的稳定性、结构和磁性等方面的性质。
1.稳定性:配合物的稳定性取决于金属离子的电荷、大小以及配体的硬度和软度等因素。
一般来说,大部分配合物都是稳定的,但在特定条件下,一些配合物可能会发生配位键的解开和形成。
这种配位键变化的过程称为配位动力学,对于了解配合物的反应机制至关重要。
2.结构:配合物的结构通常由配位数和配位几何排列确定。
配位数指的是配体与金属离子形成的配位键数目,常见的有四配位、六配位等。
而配位几何排列则是指配体围绕金属离子形成的空间排布,如四方形平面、八面体等。
3.磁性:配合物的磁性是由其中的金属离子所决定的。
根据金属离子的未配对电子数目,配合物可分为高自旋和低自旋两种类型。
高自旋配合物具有较多的未配对电子,磁性较强;低自旋配合物则相反。
这些磁性特征使得配合物在磁共振成像等方面具有重要的应用。
除了上述性质外,配合物还具有颜色变化、化学活性以及生物活性等特点,使得它们在材料科学、生命科学以及环境科学等领域中得到广泛应用。
配合物的生成性质及应用

配合物的生成性质及应用配合物是由中心金属离子与配体通过共价键或均带离子键相结合而形成的化合物,具有丰富的生成性质和广泛的应用。
以下将对配合物的生成性质及应用进行详细阐述。
首先,配合物的生成性质主要包括稳定性、配位数和配体特性。
稳定性是指配合物形成后其在溶液中的稳定性,受到中心金属离子的电子轨道和配体配位能力的影响。
中心金属离子的稳定化是通过与配体形成配位键来实现的,一般来说,金属离子的空轨道与配体的空轨道之间的重叠越好,配合物的稳定性越高。
配位数是指一个中心金属离子与配体之间的配位键数量,一般为2、4、6、8等。
配体特性包括配体电荷、大小和位阻等,决定了配位键的形成能力和空间排布。
其次,配合物的生成性质与配位反应密切相关。
配位反应是指在配体作用下中心金属离子与溶液中的配体结合形成配合物的过程。
常见的配位反应包括取代反应、交换反应和加成反应。
取代反应是指一个或多个配体被其他配体取代的反应,可以通过配体之间的竞争结合来实现。
交换反应是指在溶液中不同的配合物之间发生配体的交换,可以通过添加适当的配体或改变溶液条件来实现。
加成反应是指在原有配合物基础上,进一步添加新的配体的反应,可以实现对配合物结构和性质的调控。
配合物具有广泛的应用价值。
首先,配合物在催化反应中发挥着重要的作用。
例如,过渡金属配合物可以作为催化剂催化各种有机反应,如氯化铱配合物在气相氯化甲烷反应中具有很高的活性和选择性。
其次,配合物在生物医学领域中具有重要应用。
铂配合物是世界上最重要的抗肿瘤药物之一,如顺铂和卡铂广泛应用于肿瘤化疗中。
此外,铁配合物可以用作治疗贫血的补铁剂。
再次,配合物在材料科学中有广泛的应用。
过渡金属配合物可以作为气体传感器、液晶显示材料、光学功能材料等。
最后,配合物在环境保护中也具有潜在应用。
例如,一些金属配合物可以作为吸附剂去除废水中的重金属离子,对工业废水的处理和环境保护具有重要意义。
综上所述,配合物具有丰富的生成性质和广泛的应用。
配合物的性质的实验报告

一、实验目的1. 了解配合物的定义、组成和结构;2. 掌握配合物性质的基本实验方法;3. 分析配合物的颜色、溶解度、稳定性等性质;4. 探讨配合物在化学实验中的应用。
二、实验原理配合物是由中心离子(或原子)与配体以配位键结合而成的化合物。
中心离子通常为金属离子,配体为能提供孤电子对的分子或离子。
配合物的性质与中心离子、配体和配位键等因素有关。
三、实验器材1. 烧杯、试管、滴定管、移液管、玻璃棒、镊子、滤纸;2. 实验试剂:氯化铁溶液、硫氰酸钾溶液、氨水、氢氧化钠溶液、硫酸铜溶液、硝酸银溶液、硫化钠溶液等。
四、实验步骤1. 配合物颜色实验(1)取少量氯化铁溶液于试管中,加入几滴硫氰酸钾溶液,观察溶液颜色变化;(2)取少量硫酸铜溶液于试管中,加入几滴氢氧化钠溶液,观察溶液颜色变化;(3)取少量硝酸银溶液于试管中,加入几滴硫化钠溶液,观察溶液颜色变化。
2. 配合物溶解度实验(1)取少量氯化铁溶液于试管中,加入少量氨水,观察溶液颜色变化及沉淀形成;(2)取少量硫酸铜溶液于试管中,加入少量氢氧化钠溶液,观察溶液颜色变化及沉淀形成;(3)取少量硝酸银溶液于试管中,加入少量硫化钠溶液,观察溶液颜色变化及沉淀形成。
3. 配合物稳定性实验(1)取少量氯化铁溶液于试管中,加入几滴氨水,观察溶液颜色变化及沉淀形成;(2)取少量硫酸铜溶液于试管中,加入几滴氢氧化钠溶液,观察溶液颜色变化及沉淀形成;(3)取少量硝酸银溶液于试管中,加入几滴硫化钠溶液,观察溶液颜色变化及沉淀形成。
五、实验结果与分析1. 配合物颜色实验(1)氯化铁溶液与硫氰酸钾溶液反应生成血红色配合物;(2)硫酸铜溶液与氢氧化钠溶液反应生成蓝色沉淀;(3)硝酸银溶液与硫化钠溶液反应生成黑色沉淀。
2. 配合物溶解度实验(1)氯化铁溶液与氨水反应生成红褐色沉淀;(2)硫酸铜溶液与氢氧化钠溶液反应生成蓝色沉淀;(3)硝酸银溶液与硫化钠溶液反应生成黑色沉淀。
3. 配合物稳定性实验(1)氯化铁溶液与氨水反应生成的红褐色沉淀在加热后溶解;(2)硫酸铜溶液与氢氧化钠溶液反应生成的蓝色沉淀在加热后溶解;(3)硝酸银溶液与硫化钠溶液反应生成的黑色沉淀在加热后溶解。
配合物的性质实验报告

一、实验目的1. 了解配合物的生成原理及特点;2. 掌握配合物性质的测定方法;3. 通过实验,加深对配合物性质的理解。
二、实验原理配合物是由中心金属离子(或原子)与配体以配位键结合形成的化合物。
配位键是一种特殊的共价键,其中一个原子提供孤对电子,另一个原子提供空轨道,形成配位键。
配合物的性质与其结构密切相关,如颜色、溶解度、氧化还原性、酸碱性等。
三、实验仪器与试剂1. 仪器:试管、烧杯、滴定管、容量瓶、酒精灯、玻璃棒等;2. 试剂:K2[Fe(CN)6]、FeCl3、NaCl、NH3·H2O、H2SO4、KSCN、K4[Fe(CN)6]、NaOH、BaCl2、AgNO3、Na2S2O3等。
四、实验步骤1. 配合物颜色的观察:取少量K2[Fe(CN)6]溶液,加入少量NaOH溶液,观察溶液颜色的变化。
2. 配合物溶解度的测定:分别取K2[Fe(CN)6]、FeCl3、NaCl、NH3·H2O、H2SO4等溶液,加入少量水,观察溶解情况。
3. 配合物氧化还原性的测定:取少量K4[Fe(CN)6]溶液,加入少量FeCl3溶液,观察溶液颜色的变化。
4. 配合物酸碱性的测定:取少量K2[Fe(CN)6]溶液,加入少量NaOH溶液,观察溶液pH值的变化。
5. 配合物与沉淀剂的反应:取少量K2[Fe(CN)6]溶液,加入少量BaCl2溶液,观察沉淀的形成。
6. 配合物与配位剂的反应:取少量K2[Fe(CN)6]溶液,加入少量AgNO3溶液,观察沉淀的形成。
五、实验结果与分析1. 配合物颜色的观察:加入NaOH溶液后,K2[Fe(CN)6]溶液颜色由蓝色变为绿色,说明生成了配合物。
2. 配合物溶解度的测定:K2[Fe(CN)6]、FeCl3、NaCl、NH3·H2O、H2SO4等溶液均可溶解于水,说明它们在水中的溶解度较好。
3. 配合物氧化还原性的测定:加入FeCl3溶液后,K4[Fe(CN)6]溶液颜色由蓝色变为棕色,说明发生了氧化还原反应。
配合物的性质教案

配合物的性质教案一、教学目标。
1. 了解配合物的定义和特点;2. 掌握配合物的命名和表示方法;3. 理解配合物的性质和应用。
二、教学重点。
1. 配合物的定义和特点;2. 配合物的命名和表示方法;3. 配合物的性质和应用。
三、教学难点。
1. 配合物的性质及其应用;2. 配合物的命名和表示方法。
四、教学过程。
1. 导入新课。
通过展示一些常见的配合物的图片或实物,引导学生讨论它们的特点和用途,引发学生对配合物的兴趣。
2. 讲解配合物的定义和特点。
首先,讲解配合物的定义,配合物是由中心金属离子和周围的配体离子或分子通过配位键结合而成的化合物。
然后,介绍配合物的特点,具有比较复杂的结构、颜色鲜艳、易溶于水等。
3. 讲解配合物的命名和表示方法。
首先,讲解配合物的命名方法,中心金属离子的名称在前,配体的名称在后,使用罗马数字表示中心金属离子的化合价。
然后,介绍配合物的表示方法,用方括号括起中心金属离子,配体的名称写在方括号外侧。
4. 讲解配合物的性质和应用。
首先,讲解配合物的性质,颜色、溶解度、稳定性等。
然后,介绍配合物的应用,在催化剂、药物、化妆品等方面的应用。
5. 案例分析。
通过展示一些实际应用中的配合物案例,让学生分析其结构和性质,并讨论其在实际应用中的作用和意义。
6. 练习与讨论。
布置配合物命名和表示方法的练习题,让学生在课堂上进行讨论和交流,加深对配合物命名和表示方法的理解。
7. 总结与展望。
总结本节课的重点内容,强调配合物的定义、特点、命名和表示方法、性质及应用,并展望下节课的内容。
五、课堂小结。
通过本节课的学习,学生对配合物的定义、特点、命名和表示方法、性质及应用有了初步的了解,为深入学习打下了基础。
六、作业布置。
布置配合物的相关作业,加深对所学知识的理解和掌握。
七、板书设计。
配合物的定义和特点。
配合物的命名和表示方法。
配合物的性质和应用。
八、教学反思。
本节课采用了导入新课、讲解、案例分析、练习与讨论等多种教学方法,能够激发学生的学习兴趣,提高课堂教学效果。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
24-1 基本特征
d区金属(二)范围: 第五周期由Y到Pd元素和第六周期由La到Pt元素 原因: 第二过渡系元素(Y~Pd)和第三过渡系元素(La~Pt)有许多相似 的性质,它们与第一过渡系元素相比,又有一些显著的差别。 特征: 1.基态电子构型特例多; 2.原子半径很接近; 3.密度大,熔点、沸点高; 4.氧化态稳定,低氧化态不常见; 5.配合物的配位数较高,形成金属—金属键的元素较多; 6.磁性要考虑自旋—轨道偶合作用。
镐和铪的分离: •利用在盐酸中溶解度差别分离。 盐酸浓度小于8~9 mol· L-1时,溶解度 ZrOCl2与HfOCl2相同; 盐酸浓度大于8~9 mol· L-1时,溶解度 ZrOCl2大于HfOCl2。 •在673~723K时,金属锆可以将ZrCl4还原 为难挥发的ZrCl3,而HfCl4不会被锆还原 3ZrCl4 + Zr = 4ZrCl3
二、性质和用途
性质: 锆和铪都是有银色光泽的高熔点金属,具有 典型的金属的六方密堆积结构。加热到673~873K时, 表面生成一层致密的、有附着力的、能自行修补裂 缝的氧化物保护膜,因而表现突出的抗腐蚀能力。 锆的抗化学腐蚀性优于钛和不锈钢,接近于 钽。在373K以下,锆与各种浓度的盐酸,硝酸及浓 度低于50%硫酸均不发生作用;也不与碱溶液作用。 但溶于氢氟酸、浓硫酸和王水,被熔融碱所侵蚀。
用途: 锆主要用于原子能反应堆中作二氧化铀燃料棒的 包层。含有少量锆的各种合金钢有很高的强度和 耐冲击的韧性,用于制造坦克、军舰等。铪吸收 热中子能力特别强,用做原子反应堆的控制棒主 要用于军舰和潜艇的反应堆。
三、重要化合物
(一)氧化物 ZrO2和HfO2 制备:加热分解它们的水合氧化物或某些盐制得。 性质:白色固体、高熔点、惰性 酸碱性:ZrO2具有两性。溶于酸生成相应的盐, 在高温与碱共熔生成镐酸盐。在水溶液中不存在 Zr4+,而是以聚合态的ZrO2+镐氧、(NH4)2HfF6的 溶解度比锆的配合物大。 2. 锆和铪的烷氧基配合物M(OC4H7)的沸 点不同。 可利用此性质来分离镐和铪。
24-3
铌和钽
一、存在、性质与用途
存在: 原子半径和离子半径基本相同,化学性质相似, 在 自 然 界 中 共 生 。 主 要 矿 物 为 (Fe,Mn)[(Nb,Ta)O3] 用途: • 独特应用:制造合金钢 • 外科刀具 • 耐酸设备等
性质:
• 刚灰色金属,略带蓝色,具有体心立方结 构。 • 塑性和延展性 • 抵抗除氢氟酸以外的一切无机酸,包括王 水。钽是所有金属中最耐腐蚀的,但溶于硝 酸和氢氟酸的混合酸中。 • 在高温时可以与氧、氯、硫、碳等化合。
二、制备和分离 制备: • 矿石+碱-共熔 → 多铌 ( 钽酸盐 ) -酸煮 →Nb2O5(Ta2O5-还原→ Nb(Ta) • 电解法
24-2 锆和铪
一、存在、制备与分离
锆的存在:主要矿石为锆英石ZrSiO4和斜锆石ZrO2。 制备:将锆矿石转变为氯化物,然后以活泼金属在氩气中还 原为金属粗锆。粗锆与碘共热转变为碘化物,热分解碘化物 制金属锆。 ZrSiO4 + 4C = ZrC + SiO2 + CO ZrC + 2Cl2 = ZrCl4 + C ZrCl4+ 2Mg = 2MgCl2+Zr(粗锆) Zr(粗锆) + 2I2 =ZrI4 ZrI4 = Zr + 2I2 Zr和Hf的分离: 离子交换法和溶剂萃取法。
第 24 章 d 区金属(二) 第五、第六周期 d 区金属
[教学要求]
1.掌握第五、第六周期 d 区金属的基本特征 及其周期性规律。 2.了解锆铪分离和铌钽分离。 3.了解 VIB族钼、钨元素及其重要化合物的 性质和用途;掌握同多酸、杂多酸及其盐 的概念。 4.了解铂系元素及其化合物的性质和用途以 及铂系金属周期性规律。
分离: 采用溶剂萃取法
[教学重点]
第五、第六周期 d 区金属的基本特征; 同多酸、杂多酸及其盐。
[教学难点]
锆铪分离和铌钽分离,同多酸、杂多酸。
[主要内容]
1.第五、第六周期 d 区金属的基本特征及其周 期性规律。 2.锆和铪的单质、氧化物、卤化物、配合物的性 质,锆和铪的分离。 3.铌和钽的单质、氧化物、水合氧化物、卤化物 的性质,铌和钽的分离。 4.钼和钨的单质、氧化物、含氧酸、同多酸、杂 多酸及其盐的性质。 5.锝和铼的单质、氧化物、含氧酸、配合物的性 质。 6.铂系元素的单质、氧化物、含氧酸、卤化物、 配合物的性质。
ZrO2 + 2H2SO4(浓)=Zr(SO4)2 + 2H2O
Zr(SO4)2 + H2O = ZrOSO4 + H2SO4 3ZrCl4 + Zr ===4ZrCl3
二氧化锆的水合物ZrO2 · xH2O,也称а 型锆酸H4ZrO4 制备:Zr(IV)盐溶液与酸作用或氯化氧锆水解可得: ZrOCl2 + (x+1) H2O = ZrO2 · xH2O + 2HCl 性质:白色凝胶。溶于酸,加热时转变为β型 H3ZrO3(偏锆酸)。 偏锆酸溶于热的浓硫酸或氢氟酸中。 锆酸盐的水解: 碱金属的锆酸盐溶解度小,发生水解: Na2ZrO3 + 2H2O = ZrO(OH)2 + 2NaOH
铪盐: 铪酸在水中也发生水解,水解倾向比锆盐小。
(二)卤化物
ZrCl4:白色固体,在604K升华,在潮湿空气中 冒烟,遇水强烈水解: ZrCl4 +9H2O = ZrOCl2· 8H2O + 2HCl 在浓盐酸中可结晶出ZrOCl2· 8H2O晶体,是含有 四聚合的阳离子[Zr4(OH)8(H2O)16]8+
(三)锆的配合物
锆和铪的配合物主要以配阴离子[MX6]2-形
式存在。
在M2IZrF6型配合物中,K2ZrF6的溶解度
随温度的升高而增大,利用此性质可进行重
结晶提纯。 (NH4)2ZrF6 稍加热即可分解: (NH4)2ZrF6 = ZrF4 + 2NH3+ 2HF (ZrF4 在873K升华,可以用以提纯锆)
