溶液热力学、相图热力学与化学平衡复习共45页
高中化学热力知识点总结

高中化学热力知识点总结一、热力学基本概念1. 热力学系统:被研究的对象,可以是固体、液体或气体。
2. 环境:系统之外的所有物体。
3. 边界:系统与环境之间的分界面。
4. 状态:系统在某一时刻的所有宏观性质的集合。
5. 状态函数:系统的宏观性质,其值只与系统的状态有关,如温度、压力、体积等。
6. 过程:系统从一个状态变化到另一个状态的一系列状态的集合。
7. 热力学平衡:系统与环境之间没有能量和物质交换的状态。
二、热力学第一定律1. 内能:系统内部所有微观粒子的动能和势能之和。
2. 热力学第一定律:能量守恒定律在热力学中的表现形式,即系统内能的变化等于系统与环境之间能量交换的净效应。
3. 热量:系统与环境之间因温度差而产生的热能传递。
4. 功:力作用在物体上并使物体发生位移所产生的能量转换。
5. 等容过程:系统体积不变的热力学过程。
6. 等压过程:系统压力不变的热力学过程。
7. 等温过程:系统温度不变的热力学过程。
三、热力学第二定律1. 熵:系统无序度的量度,也是能量分散程度的指标。
2. 热力学第二定律:自然过程总是向着熵增加的方向进行。
3. 可逆过程:系统和环境都能完全恢复原状的过程。
4. 不可逆过程:系统或环境不能完全恢复原状的过程。
5. 熵变:系统经历一个过程后熵的增加量。
四、化学反应热力学1. 化学反应:原子重新排列形成新物质的过程。
2. 反应热:化学反应发生时吸收或放出的热量。
3. 热化学方程式:表示化学反应及其伴随热量变化的方程式。
4. 燃烧热:1摩尔物质完全燃烧时放出的热量。
5. 中和热:酸和碱中和反应生成1摩尔水时放出的热量。
6. 电化学:研究化学反应与电能转换的科学。
五、溶液与电解质1. 溶液:一种或几种物质以分子或离子形式分散在另一种物质中形成的均匀混合物。
2. 饱和溶液:在一定温度下,溶质在溶剂中达到最大溶解度的溶液。
3. 电解质:在溶液或熔融状态下能导电的物质。
4. 非电解质:在溶液或熔融状态下不能导电的物质。
工程热力学第13讲-第7章-2理想溶液、相平衡基础

若溶液中有A, B 同时存在,平衡时,
pB (T ) RT ln p
l B g B
B
在上两式中消去
B
则得
pB (T , p ) RT ln * pB
过程装备与控制工程专业
工程热力学
第十三讲
山东大学机械工程学院 过程装备与控制工程研究所
本讲内容
7-2 溶液热力学
1 理想溶液 2 逸度和活度
7-3 相平衡基础
3 汽液相平衡 4 汽液平衡相图 5 汽液相平衡关系
6 汽液相平衡关系的应用
学习要求
1 掌握逸度、逸度系数、活度、活度系数、理想溶液、非 理想溶液、汽液相平衡等基本概念。 2 3 掌握理想溶液有关定律和相图的应用。 掌握低压汽液相平衡的计算。
V B ,m V m ( B )
(2)
mixV n BV B , m n BV m ( B ) 0
B B
mix S 0 定温定组成条件下:
* B (T , p ) B * B (T , p ) RT ln x B R ln x B T p ,n T p , n T p ,n
4
了解中、高压汽液相平衡的计算。
1.理想溶液
理想溶液的引入
理想溶液,顾名思义,就是理想化的溶液,是实际不存在的 溶液。 科学研究的前提往往是要首先建立一个理想化的模型,这个 模型是从各种实际现象中抽出来的,求其共性,舍其差异。 这就大大简化了科研中的困难,从而建立一套思想体系,在 具体应用中加以修正,就可以用于实际体系。
无机材料科学基础相图热力学基本原理及相平衡PPT课件

3、自由度 (f) 定义: 温度、压力、组分浓度等可能影响系统平衡状态的变量中, 可以在一定范围内改变而不会引起旧相消失新相产生的 独立变量的数目 具体看一个二元系统的自由度。
L f=2
L+A f=1
f =0 E L+B f=1
A+B f=1
A
B
第7页/共124页
相律应用必须注意以下四点: 1. 相律是根据热力学平衡条件推导而得,因而只能处理真实 的热力学平衡体系。 2. 相律表达式中的“2”是代表外界条件温度和压强。 如果电场、磁场或重力场对平衡状态有影响,则相律中的 “2”应为“3”、“4”、“5”。如果研究的体系为固态物质,可以 忽略压强的影响,相律中的“2”应为“1”。 3. 必须正确判断独立组分数、独立化学反应式、相数以及限 制条件数,才能正确应用相律。 4. 自由度只取“0”以上的正值。如果出现负值,则说明体系可 能处于非平衡态。
第1页/共124页
2. 介稳态 即热力学非平衡态,经常出现于硅酸盐系统中。
如:
α-石英
870 ℃
573℃
α-鳞石英 163℃
1470℃ α-方石英 180~270℃
β-石英
β-鳞石英 117℃
β-方石英
γ-鳞石英
说明:介稳态的出现不一定都是不利的。由于某些介稳态具有 所需要的性质,因而创造条件(快速冷却或掺加杂质) 有意把它保存下来。 如:水泥中的β -C2S,陶瓷中介稳的四方氧化锆 ; 耐火材料硅砖中的鳞石英以及所有的玻璃材料。
B%
B
(1) T1: 固相量 S% = 0 ; 液相量 L%=100%;
(2) T2: S% = M2L2/S2L2 ×100% ;L% =M2S2/S2L2 ×100%
化学平衡和热力学的关系

化学平衡和热力学的关系化学平衡是指在一个封闭系统中,化学反应达到动态平衡的状态。
在此状态下,反应物与生成物的浓度保持不变,反应速率正反两向相等。
而热力学是研究热能转化和热现象的科学,也是化学平衡的重要理论基础之一。
本文将探讨化学平衡和热力学之间的紧密联系。
一、热力学基础知识热力学关注热能的转移和转化,其中三大定律为热力学的基础。
第一定律(能量守恒定律)说明系统的内能是可以变化的,而永远不会被创造或者消灭。
第二定律(熵增原理)指出一个封闭系统的熵总是随时间增加,即系统趋向于无序状态。
第三定律(绝对零度定律)说明在绝对零度时,所有物质的熵为零。
二、化学平衡和热力学的联系化学反应达到平衡时,反应物与生成物的浓度保持不变,反应速率正反两向相等。
热力学提供了解释化学平衡背后原因的理论依据。
1. 热力学平衡在化学反应过程中,发生放热或吸热。
热力学平衡是指系统在熵最大的状态下达到的平衡状态。
系统会倾向于最大化熵,即趋向于无序状态。
当反应物和生成物的浓度达到一定比例时,自由能(G)最小,系统就达到热力学平衡状态。
2. 平衡常数和热力学函数关系平衡常数(K)是描述化学平衡的一个重要参数,它定义了反应物与生成物浓度之间的关系。
根据平衡常数的定义,当反应进行到平衡时,由反应物生成生成物的速度等于由生成物生成反应物的速率。
而平衡常数与热力学函数之间有着密切的关系。
自由能变化(ΔG)与平衡常数的关系由下式给出:ΔG = -RT ln K其中,ΔG是系统的自由能变化,R是理想气体常数,T是温度,K是平衡常数。
该方程表明,当ΔG小于零时,反应是自发进行的,反之则不是。
即当ΔG等于零时,反应达到平衡。
3. 应用热力学计算平衡常数根据热力学理论,可以通过测量反应物和生成物的浓度以及系统的温度,计算出平衡常数。
这对于了解反应体系的平衡性质和预测反应方向具有重要意义。
4. 热力学对反应条件的影响热力学对反应条件的影响是化学平衡的基础。
热力学中的相图和平衡状态

热力学中的相图和平衡状态热力学是关于热能的科学,它是物理、化学、生物学等科学中应用广泛的一门学科。
热力学中的相图和平衡状态是热力学的基本概念和方法。
在热力学中,物质的状态一般用三个基本量来描述:温度、压力和物质的组成。
相图则是给定组成下,不同条件下物质的各个相态出现的图解。
而平衡状态则是指系统所达到的最稳定状态,它可能是热力学极小值的位置,也可能是平衡态分界面。
相图是描绘物质的不同相态之间转换及稳定区域的图示。
它是通过测定物质在一定温度和压力下所出现的物态变化来绘制的。
在相图中,一条曲线代表两个相相平衡的条件,也就是共存条件。
这些条件通常称为共存曲线。
这些曲线分割相图中的不同相区域。
在相图中,曲线以上的区域为单相区域,也就是只包含一种相的区域;而曲线以下的区域为多相区域,也就是有两种或以上的相存在的区域。
对于多相混合系统,相图是非常重要的。
它可以帮助我们理解诸如溶解度限度等问题。
当两种物质混合时,我们希望知道当其中一种物质加入到另一种物质中时,两者之间会发生什么。
在一些情况下,混合是产生单一均相溶液的,但在其他情况下,混合后的物质会分成两个或更多的相。
这些分开的相在相图中显示为多相区域。
通过查找相图,我们可以了解物质混合会产生多少个相,该相的化学组成和比例,以及相是如何相互作用的。
相图是实验观察和理论计算相结构的研究工具。
除了相图,平衡状态也是热力学的基本概念之一。
平衡态是指系统所达到的最稳定状态。
在热力学中,存在多种平衡态,如热力学平衡态、力学平衡态、化学平衡态等。
这些平衡态是物态转化和反应的关键。
在平衡态下,一般没有净变化,因为系统已经达到最小自由能或最大熵的状态。
在这个状态下,任何额外的能量或物质的注入或移除都会导致系统远离平衡态,直到它再次达到平衡态。
平衡态存在的根本原因是系统的自由能达到了最小值,它是热力学的基本原理之一。
在热力学中,相图和平衡态是不可分割的。
相图展示了平衡态下物质的相变和稳定区域。
工程热力学第16讲-第三部分复习-溶液热力学、热化学计算

dS 0
dGp,T 0
i i
f i f i
二组分理想溶液汽液平衡相图
这类相图是汽液平衡相图中最有规律、最重要的相图。
常用相图主要包括: 1. 压力-组成图 p-x-y:在一定的温度下,气液平衡的压力 与组成的关系图。 2. 温度-组成图 T-x-y:在一定的压力下,气液平衡的温度 与组成的关系图。 3. 汽-液组成图 y-x 要求能看懂、会计算。
dG = -SdT + Vdp H U pV A pV
dG
TS
TS
G
dH
变组成的热力学性质关系式
dU TdS pdV i dni
dH TdS Vdp i dni dG SdT Vdp i dni dA SdT pdV i dni
_
由于没有体积效应 由于没有热效应 由于相互作用力相同
H i H mi
_
U i U mi
G i Gmi RmTlnxi
_
_
S i S mi Rmlnxi
_
Sid 0
逸度和逸度系数
逸度 f 是由美国物理化学家Gibbs Nenton Lews 提出的, 用其代替压力,以修正非理想气体与理想气体的偏差。 dG=-SdT+Vmdp 对理想气体 对真实气体 恒T:dG=Vmdp
物理化学第四章

• 但碳的相图中最多只能三相共存,不可能四相共存.
一.克-克方程(Clausius-Clapeyron equation)
• 当单组分体系两相共存时,自由度f=3-2=1, 体系只有一个自由度。 • 单组分的相变温度与压力之间存在一定的关 系, 此关系即为克-克方程. • 设一纯物质在T,p下达两相平衡:
相图:表示体系状态变化的图形
•
• 相(phase): 体系内物理性质和化学性质
完全均匀的部分. • 均匀的要求: •
均匀到分子水平
• 一个体系中可以含有多个相,这些相与相 之间一般存在明显的界面,界面处体系的 热力学性质是间断的.
气体:凡气体成一相.
气体体系无论有多少种气体,一般都达到分子水 平的混合,故为一相。
• (3)式称为克拉贝龙方程. • 克拉贝龙方程适用于纯物质任何平衡相变过 程,应用范围很广.
• 1. 气-液,气-固两相平衡:
• 纯物质的两相平衡中有一相为气相,另一相必为 凝聚相. 以气-液平衡为例,有: • dp/dT=Hm/TVm= Hm/T(Vm,g-Vm,l) (4) • ∵ Vm,g>>Vm,l • ∴ Vm,g-Vm,l≈ Vm,g=RT/p • 代入(4)式: • dp/dT= Hm/[T(RT/p)] •
• 体系的独立变量数f(即自由度)应该等于总变量 数减去关系式总数: • 总变量数:S+2 • 关系式数:+S(-1) • •
f = S+2--S+S
f = S- + 2
(1)
• (1)式就是相律的数学表达式. • 相律的物理含义是:
体系的自由度等于体系的物种数S减去相 数再加上环境变量数2(温度和压力).
热力学

1、相、相律、相图、零变量反应类型、Gibbs自由能能、化学势、活度、活度系数、焓、熵等相图与热力学的基础知识。
相:体系的内在性质在物理上和化学上都是均匀的部分,不同相之间由界面隔开。
相平衡:平衡体系各相温度相等;平衡体系各相压强相等;平衡体系中各相组分的化学势相等。
相律: F=C-P+2 F:自由度数,C:组元数,P:相数相图表达在平衡条件下环境约束(如温度和压力)、组分、稳定相态及相组成之间关系的几何图形。
相区接触法则:1、单相区和单相区只能有一个点接触,而不应有一条边界线;2、相邻相区的相数相差为1(点接触除外);3、一个三相反应的水平线和三个两相区相遇,共有6条边界线;4、如有两个三相反应中有两个共同的相,则此两个共同的相组成两个三相水平线之间的两相区;5、所有两相区的边界线不应延伸到单相区,而应伸向两相区。
零变量反应:垂直截面、等温截面、液相投影面。
ΔG=ΔH-TΔS (Kj/mol) 吉布斯自由能吉布斯自由能又叫吉布斯函数,(英Gibbs free energy,Gibbs energy or Gibbs function; also known as free enthalpy)是热力学中一个重要的参量,常用G表示,它的定义是:G =U -TS + pV = H- TS,其中U是系统的内能,T是温度,S是熵,p是压强,V是体积,H是焓。
吉布斯自由能的微分形式是:dG = - SdT + Vdp + μdN,其中μ是化学势,也就是说每个粒子的平均吉布斯自由能等于化学势。
化学势多组分均相系统中,在等温等压并保持系统中其他物质的量都不变的条件下,系统的吉布斯由能随某一组分的物质的量的变化率。
G叫做吉布斯自由能。
因为H、T、S均为状态函数,所以G为状态函数ΔG叫做吉布斯自由能变吉布斯自由能的变化可作为恒温、恒压过程自发与平衡的判据。
吉布斯自由能改变量。
表明状态函数G是体系所具有的在等温等压下做非体积功的能力。
相平衡、化学平衡和热力学PPT模板

15-6.其他热力学函 数的偏克分子数量
第七章化学 热力学概论
§15.化学势和偏克分子数 量
15-7.气体中 组分的化学势
等温公式
01
03 思考题和习
题
02 1 5 - 8 . 溶 液中组分的
化学势等温
公式
第七章化学热力学概论
§16.气体的热力学
01 16-1.热力学状态 02 16-2.多孔塞实验
§5.二元溶液的各种类型及其特 点
5-2.共沸 和分层现象 的实质
5-1.溶液 相图的四种 类型
思考题和习 题
05
第三章相平衡概论
第三章相平衡概论
§7.相平衡理论联系实际的主要渠道 7-1.组分的分离和提纯
7-2.相组成的分析和控制 思考题和习题
§6.关于相平衡规律的总结 6-1.相平衡定律
6-2.相律 6-3.相平衡的质量作用定 律 6-4.达成相平衡的速度和 传质过程 思考题和习题
系数
10
附录一常数表
附录一常数表
11
附录二石油化学组分的热力学函数表
附录二石油化学组分的热力 学函数表
感谢聆听
思考题和习题
第二章二元溶液的相平衡
§4.溶液的蒸气分压定律
4-1.蒸气分压定律公 式
4-3.多元溶液的蒸气 分压定律公式
4-5.溶剂蒸气压降低 定律和气体溶度定律
4-2.溶液相平衡数据 的推算
4-4.理想溶液模型
4-6.相对挥发度
第二章二元溶液的相平衡
§4.溶液的蒸气分压定律
思考题和习题
第二章二元溶 液的相平衡
方程
和焦耳-汤姆孙效应
03 16-3.等压和等体 04 16-4.气体不完全
初一化学常见的化学反应热力学与溶液总结

初一化学常见的化学反应热力学与溶液总结化学是我们在初中学习的一门重要科目,而在化学学习的过程中,我们不可避免地会接触到各种各样的化学反应以及涉及到的热力学与溶液相关知识。
下面,我将对初一化学中常见的化学反应热力学与溶液进行总结,以帮助同学们更好地理解与掌握这些知识。
一、化学反应热力学常识化学反应热力学是研究化学反应与能量转化关系的学科,它主要涉及到热、焓变化、熵变化以及自由能变化等内容。
1. 焓变化(ΔH):焓是热力学量,一般指体系在恒压下的能量变化。
当化学反应发生时,如果反应物释放热量,则焓变化为负值,表示反应放热;反之,如果吸收热量,则焓变化为正值,表示反应吸热。
2. 熵变化(ΔS):熵是衡量系统混乱程度的物理量,与反应物和生成物的粒子的自由度有关。
熵变化正值表示反应使体系变得更加混乱,负值则相反。
3. 自由能变化(ΔG):自由能是描述系统稳定性及反应方向的重要指标。
当自由能变化ΔG为负时,反应为自发反应,反之,为不自发反应。
二、常见的化学反应1. 酸碱中和反应:这是一类常见的化学反应,酸和碱在适当的条件下反应生成盐和水。
如HCl(盐酸)与NaOH(氢氧化钠)反应生成NaCl(氯化钠)和H2O(水)。
2. 氧化还原反应:氧化还原反应是指化学反应中电子的转移。
其中,氧化是指物质失去电子,而还原是指物质获得电子。
如2Na(钠)+Cl2(氯气)→ 2NaCl(氯化钠)。
3. 合成反应:合成反应是指将两种或多种物质结合成一种物质。
如2H2(氢气)+ O2(氧气)→ 2H2O(水)。
4. 分解反应:分解反应是指一种物质分解成两种或多种物质。
如2H2O2(过氧化氢)→ 2H2O(水)+ O2(氧气)。
三、溶液与溶解度1. 溶液:溶液是由溶剂和溶质组成的均匀混合物。
其中,溶剂是指溶解其他物质的物质,而溶质是指被溶解的物质。
2. 饱和溶液与溶解度:饱和溶液是指在一定温度和压力条件下溶剂所能溶解的最大量的溶质。
相图热力学

两相平衡的自由能曲线
因为该公切线与A组元纵坐标的截距,表示A组元在两平衡相
切点成分时的化学势即 A A ,而公切线与B组元纵坐标
的截距,表示B组元在两平衡相切点成分时的化学势
即 B B 。公切线与两平衡相的自由能—成分曲线的切点的
结构也相同,而且无限互溶,由此可得组员混合前后的体
积不变,及混合前后的 V 0
H u
即焓的变化主要反映在内能的变化上,内能的变化是由
最近邻原子的结合健能的变化引起的。
H m x A xB
混合后的自由能为:
说明其与温度和Байду номын сангаас分均有关,在一定温度下,可
作出吉布斯自由能—成分曲线,对不同的固溶体,
多相平衡的公切线法则
由相平衡热力学条件的介绍可知,合金系实现多相平衡的 条件是同一组元在各平衡相中的化学势相等,即
A A A
若A-B二元合金系在某一温度时,实现
, A A B B
两相平衡
要满足该相平衡热力学条件,只有作该温度时
具有调幅分解的二元合金相图
调幅分解:单相固溶体分解为两相混合物的一种特殊方式, 其特殊之点是在这一分解过程中不需要新相的形核。 在调幅曲线成分范围内,固溶体将自发地分离成两个结构相 同而成分不同的两相,这种固溶体的分解不需要成核阶段, 可以说是一种自发的偏聚,即一部分为溶质原子的富集区, 另一部分为溶质原子的贫乏区。固溶体的这种分解方式即所
相图热力学
1 固溶体的自由能—成分曲线 2 多相平衡的公切线原理 3 混合物的自由能和杠杆法则 4 从自由能—成分曲线推测相图
溶液热力学、相图热力学与化学平衡复习

四、理想溶液和非理想溶液的化学位
(1)两个定律
拉乌尔定律:定温下,在稀溶液中,溶剂的蒸气压等于纯溶剂 的蒸气压乘以溶液中溶剂的摩尔数。
PAPA0xA
P
0 A
代表纯溶剂A的蒸气压,
x A 代表溶液中A的摩尔分数
6
亨利定律:在一定温度和平衡状态下,挥发性溶质i的分压力 和它在液体里的溶解度(摩尔分数)成正比。
X 1 : 组分1的偏摩尔量 当混合物系的温度和压力恒定时,各组分的偏摩 尔量将只随组成而变化。
对二元系
y 1 d X 1 y 2 d X 2 0
y1 和 y2是组分1,2的摩尔分数。
---吉布斯-杜核姆方程
2
2、化学位
物系中某组分的偏摩尔自由焓又称组分的化学位,常用 符号µi表示,所以化学位的定义即:
3、溶体的结构
YCXCXCXN14XC YNnXXnnXnacc
Pi kixi
Ki是比例常数,称为亨利常数。 稀溶液中的溶剂符合拉乌尔定律,溶质符合亨利定律
7
(2)稀溶液中溶剂和溶质的化学位
稀溶液中的溶剂的化学位为: A0 A (T ,P )RlT n xA
0 A
纯A液体(纯溶剂)的化学位,即稀溶液中溶剂
的标准态是纯溶剂。
稀溶液中溶质B的化学位为: BB 0(T ,P )RlT n xB
1、理想溶体与实际溶体
理想溶体
SiMR Kxilnxi
i1
S m R ( X i A l x X A n X B lX B n )
Hm(id)(x1,x2, ,xk)0
G m (id )(x1,x2, ,xk)R K Txiln xi
i 1
G m X A G 0 A X B G B 0 R ( X A T lX n A X B l11 X n B )
第三章化学热力学初步和化学平衡ppt文档

四、内能(Internal Energy)又称为热力学能
1.体系内部所包含的各种能量之总和,绝对数值不可测。 2.广度(Extensive)状态函数。 3.内能的变化量有意义 4、理想气体的内能只是温度的函数, 即ΔUid = f ( T )
不同途径等温膨胀体系对环境做的功 随着步骤的增加,W越来越小,直到沿着等温线往下,W最小
不同途径等温压缩环境对体系做的功
随着步骤的增加,W越来越小,直到沿着等温线往上,W最小
可逆过程(reversible process):一个体系能通 过原途往返而环境无功损失的过程
可逆过程的基本特点: (1)逆转不流痕迹 可逆过程 (2) 理想过程 (3) W可逆<W不可逆
2、恒压化学反应热(Q p)
1)在恒压过程中完成的化 学反应,称为恒压反应。
2)恒压反应热一般用保 温杯式量热计(coffeecup calorimeter)测定。
保温杯式量热计示意图
3)焓与焓变(enthalpy and the change in enthalpy)
恒压时: U =Q p+W =Q p-P V
状态I到状态II
II
W = -F l= -P 外 S l= -P 外 V
l
注意:这里P外为环境强
I
自由膨胀(free expansion)没有体积功
例题:恒温下,压力为106Pa的2m3理想气体在恒外压 5×105Pa膨胀直到平衡,此过程环境对体系作功多少?
解:∵
p1 V2 p2 V1
∴
106 5105
溶液热力学、相图热力学与化学平衡复习共47页文档

1、纪律是管理关系的形式。——阿法 纳西耶 夫 2、改革如果不讲纪律,就难以成功。
3、道德行为训练,不是通过语言影响 ,而是 让儿童 练习良 好道德 行为, 克服懒 惰、轻 率、不 守纪律夸 美纽斯
5、教导儿童服从真理、服从集体,养 成儿童 自觉的 纪律性 ,这是 儿童道 德教育 最重要 的部分 。—— 陈鹤琴
谢谢你的阅读
❖ 知识就是财富 ❖ 丰富你的人生
71、既然我已经踏上这条道路,那么,任何东西都不应妨碍我沿着这条路走下去。——康德 72、家庭成为快乐的种子在外也不致成为障碍物但在旅行之际却是夜间的伴侣。——西塞罗 73、坚持意志伟大的事业需要始终不渝的精神。——伏尔泰 74、路漫漫其修道远,吾将上下而求索。——屈原 75、内外相应,言行相称。——韩非
溶液热力学基础PPT课件
第4页/共33页
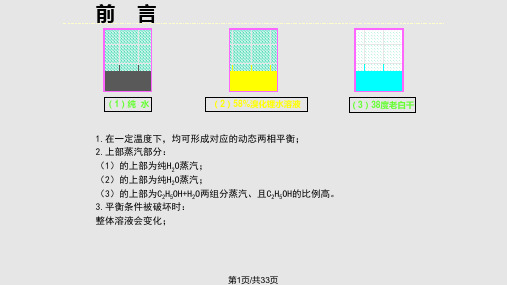
5.2 相、独立组分数、自由度和相 率
(2)58%溴化锂水溶液
一.相 体系内物理和化学性质完全均匀一致的部 分称之为相。
相与相之间有明显分界面。 体系内相的数目用Φ表示。 举例: 空气,只有气相,Φ=1; 湿饱和蒸汽,有液、汽两相,Φ =2。
(2)58%溴化锂水溶液
二.独立组分数
平衡体系中独立存在的物质称为独立组 分,其数目为独立组分数,用k表示。
m1、h1
P=const
m3、h3
Q m1 m2 h3 m1h1 m2h2
m2、h2
q h3 ξ1h1 ξ2h2
h ξ的出现自然是顺理成章。
第21页/共33页
5.5 两组分体系的焓-浓图(h-ξ图)
一. h-ξ图上的等温线 1.最简单的问题 先讨论溶液焓(h溶液)与组分的比焓(h1, h2)之间的关系。
氧气,f=2,如p和t,在一定范围内这两 个量(因素)可以自由改变,但p、t、v三个 量不能同时自由改变。
f=体系最小不可同时改变的状态参数的数 目-1
f k2
①氧气: k=1,Φ =1,f=2; 有两个独立可变的因素——p、t,p、v 或t、v。 不会是p、t、v三个都独立可变,f≠3。
第6页/共33页
①气相、液相之间的转移产生了质量和 能量的交换;
②在转移过程中,当两种转移的速度相 等时,在系统中所有各部分的全部状态参数 都保持不变,实现溶液的相平衡状态。
“所有各部分”即每一部分,如液相部 分、气相部分;也包括整体系统;
相平衡是动态平衡;
溶液的相平衡与纯物质的相
溴化锂水溶液
平衡有相同之处,又有一定的差别——二者 都是动态平衡,但溶液的液相在相变时成分 也同时发生变化。
第一章热力学和相图

偏摩尔量和化学位
化学位(化学势) Chemical potential
U H F G n n n n i S ,V ,n j ni i S ,P ,n j ni i T ,V ,n j ni i T ,P ,n j ni i
4
偏摩尔量和化学位 偏摩尔量 Partial molar quantities
• 在多组元系统,热力学函数不仅与温度和压力有关,还与各组元的数 量(质量)有关,成份也是一个变量。
Z f ( T , P,n1 ,n2 ,n j )
Z Z Z dZ dni dT dP T P ,n j P T ,n j j ni T ,P ,n n j i
• 化学位i 表示特征变量恒定以及其它组元数量不变时,溶液中i组元改变 1mol导致热力学函数的变化,即其溶液的热力学函数随组元i数量的变化 率。 • 在等温等压条件下,组元i的偏摩尔吉布斯自由能等于该组元的化学位。
G Gi i n i T ,P ,n
j ni
13
固态溶液的吉布斯自由能
• 混合前,系统摩尔自由能为G1
G1 X AGA X BGB (J/mol)
• 混合后,固溶体的摩尔自由能为G2
G2 GA X A GB X B
G2 G1 Gm
14
固态溶液的吉布斯自由能
G1 H1 TS1
G 2 H 2 TS 2
(5)吉布斯自由能与二元相图
2
二元系的热力学平衡与相图
固溶体 Cu-Ni ZrO2-CeO2 分子 H2 N2 单质 共价晶体 C, Si 金属晶体 Fe,Al Cu,Zn
