天然产物化学全套 - 黄酮类化合物的提取与分离
天然药物化学黄酮类ppt课件

这些化合物通常以苷的形式存在,苷 元与糖通过糖苷键相连,形成黄酮苷 。
黄酮类化合物的结构特点
黄酮类化合物的基本结构是由两个芳香环通过一个三碳桥连接而成的,其中连接的 两个芳香环可以是相同的,也可以是不同的。
芳香环上的取代基可以是羟基、甲氧基、羰基等,这些取代基的种类和数量对黄酮 类化合物的生物活性具有重要影响。
实现黄酮类化合物的分离纯化,常用的色谱分离技术包括硅胶柱色谱、
大孔吸附树脂柱色谱等。
黄酮类化合物的分离实例
槐米中芦丁的分离
采用乙醇提取、硅胶柱色谱分离、重 结晶等方法,从槐米中分离得到芦丁 。
山楂中总黄酮的分离
采用乙醇提取、大孔吸附树脂柱色谱 分离、结晶等方法,从山楂中分离得 到总黄酮。
05
黄酮类化合物的应用与开发
黄酮类化合物的保健功能与食品添加剂
抗氧化作用
黄酮类化合物具有抗氧化作用, 能够清除自由基,减轻氧化应激 反应对人体的损伤,对预防衰老
和慢性疾病有积极作用。
改善心血管健康
黄酮类化合物具有改善心血管健 康的作用,能够降低血压、血脂 ,对预防和治疗心血管疾病有辅
助效果。
食品添加剂
黄酮类化合物因其良好的抗氧化 和保健功能,被广泛应用于食品 添加剂领域,以提高食品的营养
价值和保健功能。
黄酮类化合物的其他应用领域
化妆品
黄酮类化合物具有抗氧化 、抗炎等作用,被广泛应 用于化妆品领域,如美白 、抗衰老等产品。
农业
黄酮类化合物具有抗菌、 抗病毒等作用,可用于农 业领域,如植物保护、土 壤改良等。
环保
黄酮类化合物具有降解污 染物、净化环境等作用, 可用于环保领域,如水处 理、空气净化等。
通过结构优化和技术改进,提高黄酮类化合物的 生物利用度和药效。
黄酮类化合物的提取

黄酮类化合物的提取黄酮类化合物是一类具有重要药用价值的天然产物,其具有抗氧化、抗炎、降血压、降血脂等多种生物活性。
因此,黄酮类化合物的提取和分离一直是天然药物研究领域的热点之一。
本文将从黄酮类化合物的来源、提取方法以及提取过程中的优化等方面进行详细介绍。
一、黄酮类化合物的来源黄酮类化合物广泛存在于植物中,包括花、果实、叶子等部位。
其中,柑橘属植物中含有较为丰富的黄酮类化合物,如柚皮中含有丰富的柚皮素和橙皮素等。
此外,苦楝属植物也是黄酮类化合物的重要来源之一,如苦楝素和芦丁等。
二、黄酮类化合物的提取方法1.传统提取方法传统提取方法主要包括水浸提法、乙醇浸提法和超声波辅助浸提法等。
(1)水浸提法水浸提法是最为简单的提取方法之一,其操作简单、成本低廉。
但是,由于黄酮类化合物在水中的溶解度较低,因此水浸提法提取效率较低。
(2)乙醇浸提法乙醇浸提法是常用的黄酮类化合物提取方法之一。
乙醇具有良好的溶解性和挥发性,可有效地溶解黄酮类化合物。
但是,乙醇浸提法存在一定的毒性和燃爆风险。
(3)超声波辅助浸提法超声波辅助浸提法是一种新型的黄酮类化合物提取方法。
其利用超声波对植物细胞壁进行破碎,从而促进黄酮类化合物的释放和溶解。
该方法具有操作简单、高效快捷等优点。
2.现代提取方法现代提取方法主要包括超临界流体萃取法、微波辅助萃取法和固相萃取法等。
(1)超临界流体萃取法超临界流体萃取法是目前最为先进的黄酮类化合物提取方法之一。
其利用超临界流体对植物组织进行萃取,具有高效、环保等特点。
(2)微波辅助萃取法微波辅助萃取法是一种快速高效的黄酮类化合物提取方法。
其利用微波加热对植物组织进行破碎和溶解,具有操作简单、高效快捷等优点。
(3)固相萃取法固相萃取法是一种基于化学吸附原理的黄酮类化合物提取方法。
其利用具有亲和力的固相材料对黄酮类化合物进行选择性吸附,从而实现分离和提纯。
三、黄酮类化合物提取过程中的优化1.影响因素影响黄酮类化合物提取效率的因素主要包括原料质量、溶剂种类、浸提时间、浸提温度等。
黄酮类化合物提取和分离方法研究进展

收稿日期:2007205225作者简介:梁 丹(19852),女,河南鹿邑人,贵州大学农药学硕士研究生,研究方向为植物源农药.第24卷第5期周口师范学院学报2007年9月Vol.24No.5Jo urnal of Zhoukou Normal U niversity Sept.2007黄酮类化合物提取和分离方法研究进展梁 丹1,张保东2(1.贵州大学农学院,贵州贵阳550025;2.周口师范学院继续教育学院,河南周口466001)摘 要:黄酮类化合物具有多种生理活性,从天然产物中提取和分离黄酮类化合物,引起了人们的广泛关注,其提取和分离方法也不断地改进和发展.文章主要综述了近几年来不同的提取和分离方法在黄酮类化合物中的应用进展.随着科技的进步,黄酮类化合物的提取和分离方法将更加快速、高效、完善.关键词:黄酮;提取;分离;进展中图分类号:O652 文献标识码:A 文章编号:167129476(2007)0520087203 黄酮类化合物是植物界分布广泛的天然酚类化合物,植物中的黄酮大体上可分为“黄酮类”与“黄烷酮类”两大类物质,已知化学结构的黄酮类物质至少有4000余种.黄酮类化合物具有广泛的生理功能,是许多中草药的有效成分,具有很高的药用价值,如有抗癌、抗肿瘤、抗心脑血管疾病、抗炎镇痛、免疫调节、降血糖、治疗骨质疏松、抑菌抗病毒、抗氧化、抗衰老、抗辐射等作用[1,2].黄酮类化合物还在食品、化妆品等行业中广泛应用.随着市场需求量的增加,经济效益的提高,黄酮类化合物提取和分离方法也在不断地改进和提高.1 黄酮类化合物提取方法的研究进展1.1 按所用溶剂不同分类(1)热水提取法(以水作溶剂).热水一般仅限于提取苷类.在提取过程中要考虑加水量、浸泡时间、煎煮时间及煎煮次数等因素.此工艺成本低、安全,适合于工业化大生产.郭京波等[3]以水做溶剂,同时提高浸提温度、延长浸提时间和增加液料比(60倍),可以明显提高芦丁的产率.(2)有机溶剂萃取法.乙醇和甲醇是提取黄酮类化合物的最常用溶剂.高浓度的醇(90%~95%)适合提取苷元,60%左右的醇适合提取苷类,提取的次数一般为2~4次[4].胡福良等[5]提取蜂胶液中黄酮类化合物,以80%乙醇提取的总黄酮的含量最高.其他有机溶剂法是根据相似相溶原理,对不同性质的黄酮选择最佳的有机溶剂进行提取.(3)碱提取酸沉淀法.黄酮类成分大多具有酚羟基,易溶于碱水(如碳酸钠、氢氧化钠、氢氧化钙水溶液)和碱性稀醇.因此,可先用碱性水提取,碱性提取液加酸后黄酮苷类即可沉淀析出.提取时应控制酸碱的浓度,以免在强碱下加热时破坏黄酮类化合物的母核.当有邻二酚羟基时可加硼酸保护.此方法简便易行,橙皮苷、黄芩苷、芦丁等都可用此法提取.1.2 按提取条件不同分类(1)回流提取法.本法是加热回流提取黄酮类化合物的一种方法.所用回流剂一般有水、醇及混合溶剂.此法操作简便,但效率不够高,一般很难一次性完全提出黄酮化合物,需要反复回流提取[6,7].(2)索式提取法.该法是用索式提取器,多次提取黄酮,其溶剂可反复利用,操作方便,价格低廉且提取效率高,但此法所需时间较长.索式提取黄酮类化合物的方法已广泛为人们所利用[8].(3)微波辅助提取法.该法是利用微波加热的特性对成分进行选择性提取的方法.此法具有快速、高效、高选择性、对环境无危害等特点.刘峙嵘等采用微波萃取银杏叶中黄酮类化合物及唐课文等采用微波辅助法从黎蒿中提取黄酮类化合物,与传统溶剂萃取方法相比,微波萃取法更简单,而且具有萃取时间短、成本低、萃取效率高等优点[9,10].(4)超声提取法.该法是利用超声波浸提黄酮类化合物的一种方法.其基本原理是利用超声波的空化作用,破坏植物的细胞,使溶剂易于渗入细胞内,同时超声波的强烈振动能给植物和溶剂传递巨大的能量,使它们做高速的运动,加速细胞内物质的释放和溶解以及有效成分的浸出,大大提高了提取效率.超声提取法具有提取时间短、效率高、无需加热等优点[4].刘海鹏等[11]用超声波提取银杏叶总黄酮比回流法提取率高,且操作简便,节省时间,其最佳条件为:提取时间25min,温度10℃,连续提取3次,总黄酮提取率达96%.霍丹群等[12]在综合考虑成本等可行性因素下,提取山楂中黄酮类物质,提取时间大大缩短,产率较高,且实验可在室温下进行,设备简单,操作方便.(5)超滤法.该法是一种膜分离法,而且是唯一能用于分子分离的过滤方法,能从周围的介质中分离出100~1000nm的微粒.因此,超滤既可应用于除去溶液中胶体悬浮微粒,又能分离出溶液中的溶质.超滤的工作原理是:凡含有两种或两种以上溶质的溶液,通过滤膜分离流动时,其中分子体积小的溶质,经滤膜流出,而分子体积较大的溶质,不能通过滤膜而被截留[13].超滤法以多孔薄膜为分离介质,依靠薄膜两侧压力差作为推力来分离溶液中不同分子量的物质,从而起到提纯的作用.它具有不需加热,操作条件温和,不必添加化学试剂,不损坏黄酮类化合物,不存在相的转换,耗能低,分离率高,超滤装置可反复使用等优点.控制超滤膜孔径大小能有效除去溶液中大分子物质,选用适宜孔径的超滤膜是提高产品收率和质量的关键.20世纪80年代后期,采用超滤技术提取黄芩苷,收到了较好的效果.在溶液温度为14℃, p H=1.5时,提取黄酮类化合物的收率较高[14].(6)酶提取法.植物的有效成分往往被包裹在细胞壁内,提取时细胞壁造成传质阻力,使提取效果受到很大的限制.酶的作用可使细胞壁疏松、破裂,因此需要减小传质阻力,加速有效成分的释放,从而提高提取效率[15].毕会敏等[6]用纤维素酶法提取红景天总黄酮,最佳工艺条件为:加酶量1.95%(以原料干重计),液料比70∶1(体积质量比,mL∶g),p H 值5.5,酶解温度40℃,酶解时间5h,红景天总黄酮的浸出率为4.385%.研究表明,采用纤维素酶对红景天进行酶解处理,可提高黄酮类物质的浸出率,且粗提物产率高,DPP H清除活性强.(7)超临界流体提取法.该法(Supercritical Flu2 ids Ext raction,SFE)是20世纪80年代发展起来的一项提取分离技术,利用超临界流体(Supercritical Fluids,SCE)为萃取剂,从液体或固体中萃取出待测组分,其中超临界二氧化碳最为常用(SCF2 CO2)[16].SFE具有提取效率高、无溶剂残留、天然植物中活性成分和热不稳定成分不易被分解破坏等优点,同时还可以通过控制临界温度和压力的变化,达到选择性提取和分离化合物的目的.2 黄酮类化合物分离方法的研究进展由于黄酮化合物的性质不同,其分离原理有: (1)极性大小不同,利用吸附能力或分配原理进行分离;(2)酸性强弱不同,利用p H梯度萃取进行分离;(3)分子大小不同,利用葡聚糖凝胶分子筛进行分离;(4)分子中某些特殊结构,利用与金属盐络合能力的不同进行分离[17].2.1 p H梯度萃取p H梯度萃取适合分离酸性强弱不同的游离黄酮类化合物.将混合物溶于有机溶剂(如乙醚),依次用5%碳酸氢钠(萃取7,4′2二羟基黄酮)、5%的碳酸钠(萃取72羟基黄酮或4′2羟基黄酮)、0.2%氢氧化钠(萃取一般酚羟基黄酮)、4%氢氧化钠(萃取52羟基黄酮)萃取而使其分离[3].2.2 高效液相色谱分析(HPL C)法运用H PL C法分离黄酮类化合物的报道很多.有人对18种黄酮及黄酮苷类化合物在C8、C18和CN3种固定相上洗脱的RP2H PL C法分离做了研究,结果表明C18基本可以使植物黄酮苷元和配基实现分离,但它对极性大的苷部分洗脱出峰快,分离效果不大理想.而C8介于C18和CN之间,因而对黄酮苷的分离比较理想,峰形和分离也最好[18].H PL C 也可以用来测定黄酮的含量[19].2.3 高速逆流色谱分离法高速逆流色谱分离法(high speed co untercur2 rent chro matograp hy,HSCCC)是一种新的分离技术.其具有两大突出特点:(1)线圈中固定相不需要载体,因而清除了气液色谱中由于使用载体而带来的吸附现象;(2)特别运用于制备性分离,每次进样体积较大,进样量也较多[16].李彩侠等[20]提取荷叶中黄酮类化合物,经HSCCC分离纯化的效果很好,结合TL C分析、颜色反应鉴定得到两种纯度很高的黄酮醇类化合物.HSCCC对分离和制备黄酮类化合物有很大的优势,其应用前景越来越受到人们的关注.2.4 柱色谱法(1)硅胶柱色谱[17,18].此法应用范围最广,非极性与极性化合物都能用,适用于分离黄酮类、黄酮醇类、二氢黄酮醇类、二氢黄酮类、异黄酮类、黄酮苷元类.少数情况下,在加水活化后也可以用于分离极性较大的化合物,如羟基黄酮醇类及其苷类等.与硅胶88 周口师范学院学报2007年9月混存的微量金属离子,应预先用浓盐酸处理,以免干扰分离效果.(2)聚酰胺柱色谱[17,18].分离黄酮类化合物,聚酰胺是较为理想的吸附剂.其吸附强度主要取决于黄酮类化合物分子中羟基的数目、位置及溶剂与黄酮类化合物或与聚酰胺之间形成氢键缔合能力的大小.由己内酰胺聚合而成的尼龙-66及由己二酸与己二胺聚合而成的尼龙-66,最早应用于黄酮类化合物的分离.此法是目前最有效而简便的方法.(3)葡聚糖凝胶(Sep hadex gel)柱色谱[18].黄酮类化合物的分离,主要使用两种型号的凝胶:Sep ha2 dex G型和Sep hadex L H220型.其原理主要是吸附作用.凝胶对黄酮类化合物的吸附程度取决于游离羟基的数目.但分离黄酮苷时,分子筛的性质起主导作用.在洗脱时,黄酮苷类大体上是按相对分子质量由大到小的顺序流出柱体.(4)大孔吸附树脂分离法.该法是以大孔吸附树脂为吸附剂和分子筛的柱色谱分离形式.其原理是吸附性和分子筛性.吸附性主要来源于范德华力和氢键作用力;分子筛性来源于大孔树脂的多孔性结构产生的渗透和过滤作用.被分离的成分根据其分子的大小不同和吸附能力的差异而分离[3].近年来大孔吸附树脂在中药成分(如黄酮、生物碱等)精制纯化等领域中应用越来越广泛[21223].刘健伟等[22]对D101型(非极性)、Hz2806型(中等极性)和AB28型(弱极性)3种大孔吸附树脂进行了筛选,并对甘草中总黄酮分离纯化工艺进行了研究;王雅君等[23]则用D101大孔树脂进行了制备菟丝子总黄酮的研究.这些研究表明,大孔吸附树脂对于黄酮类化合物具有良好的分离纯化效果,与传统的分离方法相比,具有操作简便、树脂再生容易、耗费有机溶剂少、提取率高等优点.3 展望近几年来,科学家对黄酮进行了广泛而深入的研究,发现了黄酮不少令人感兴趣的新用途,黄酮类天然产物是近年来天然药物和人类健康产品研究开发的热点.从药用植物和经济植物中提取具有生理活性的黄酮作为天然药物、保健品和化妆品等行业的原料,已日益引起重视,其应用前景无限广阔.随着科学技术的不断进步和发展,黄酮类化合物的独特效能将得到不断的发掘及应用.因此,黄酮类化合物的提取和分离方法也将得到更加深层的研究和开发,已有的方法将会日趋成熟和完善,各种高效、方便快捷的新方法将会不断涌现.参考文献:[1]黄锁义,黎海妮,余美料.益母草总黄酮的提取及鉴别[J].时珍国医国药,2005,16(5):3982399.[2]姚小敏,覃成箭,羊金梅.茶叶中总黄酮的提取、鉴别及其含量测定[J].右江民族医学院学报,2005,27(6):7792 781.[3]郭京波,王向东,张燕,等.不同提取方法对苦荞类黄酮提纯得率的影响分析[J].食品科学,2006,27(10):4332 436.[4]杨红.中药化学实用技术[M].北京:化学工业出版社,2004:9.[5]胡福良,李英华,朱威,等.不同方法提取的蜂胶液中总黄酮含量的测定及抗肿瘤与抗炎作用研究[J].2005,5(3):11215.[6]毕会敏,张守勤,刘长姣.纤维素酶提取红景天总黄酮的研究[J].天然产物研究与开发,2006,18:8182821. [7]陈燕清,颜流水,黄智敏.醇溶剂回流法提取藜蒿中黄酮类化合物方法研究[J].南昌航空工业学院学报,2004, 18(3):61264.[8]徐洁昕,周方钦.白花败酱中总黄酮的提取研究[J].广州食品工业科技,2004,82(4):42243.[9]刘峙嵘,俞自由,方裕勋.微波萃取银杏叶黄酮类化合物[J].东华理工学院学报,2005,128(12):1512154. [10]唐课文,易健民,张跃超.微波辅助法从黎蒿中提取黄酮类化合物的研究[J].天然产物研究与开发,2005, 117(5):6622664.[11]刘海鹏,刘延成,马东升,等.超声波/回流法银杏叶总黄酮提取的研究[J].化学工程师,2005,119(8):49250.[12]霍丹群,张文.超声波法与热提取法提取山楂总黄酮的比较研究[J].中成药,2004,26(12):106321065. [13]李毓群,施顺清.采用先进的提取方法促进中药制剂现代化[J].中草药,2002,33(6):5722574.[14]李苑,张敏.中草药中黄酮类化合物提取工艺的研究概况[J].广东药学,1999,9(2):426.[15]Wu M L,Zhou C S,Chen L S,et al.Study on the ex2traction of total flavonoids f rom G inkgoleaves by en2 zyme hydrolysis[J].Nat Prod Res Dev,2004,16: 5572560.[16]周文华,杨辉荣,岳庆磊.生物碱提取和分离方法的研究新进展[J].当代化工,2003,32(2):1112113. [17]刘湘,汪秋安.天然产物化学[M].北京:化学工业出版社,2005:3.[18]宋晓凯.天然药物化学[M].北京:化学工业出版社,2004:8.[19]董文庚,邓晓丽.HPL C法测定银杏叶中黄酮的含量[J].理化检验:化学分册,200541(8):5632565. [20]李彩侠,张赟彬,黄国纲.荷叶提取物的分离和纯化[J].食品工业,2006(1):40241. (下转第97页)98第24卷第5期梁 丹,等:黄酮类化合物提取和分离方法研究进展 Hereditas ,1997,126(3):2112217.[18]Jiang J M ,G ill B S ,Wang G L ,et al.Metaphase andinterphase fluorescence in situ hybridization mapping of thericegenomewithbacterialartificialchromosome[J ].Proceedings of the National Academy of Science of USA ,1995,92:448724491.[19]Wei W H ,Qin R ,Song Y C ,et parativeanalyses to diseases resistant and nonresistant linesf rom maize ×Zea diploperennis by GISH[J ].Botanical Bulletin of Academia Sinica ,2001,42:1092114.[20]Li C B ,Zhang D M ,Ge S ,et al.Identification ofgenome constitution of Oryza malampuzhaen Οsis ,O.minuta ,and O.punctata by multicolor genomic in situ hybridization[J ].Theor ApplGenet ,2001,103:2042211.Analysis of ti f olia and O.alt a with genomic in situ hybridizationGUAN Ni 1,Q IU Xiao Οfen 1,SON G Fa Οjun 1,Q IN Rui 1,2(1.College of Life Science ,South ΟCentral University For Nationalities ,Wuhan 430074;2.College of Life Science ,Wuhan University ,Wuhan 430072,China )Abstract :Genomic in situ hybridization (GISH )method was used to study differentiation and relationship s between the ti f olia and O.alta genomes in the officinalis complex of the genus Ory z a .The chromosomes of ti f olia (CCDDgenomes )were hybridized with labelled probes of two CCDD genome f rom ti f olia and O.alta separating.The GISH results indicate that the homology between these two CCDD genomes is very close and differentiation is also clearly.Karyotype analysis is made based on the similar band patterns of the hybridization signal.K ey w ords :ti f olia ;O.alta ;GISH(上接第89页)[21]米靖宇,宋纯清.大孔吸附树脂在中草药研究中的应用[J ].中草药,2001,23(1):911.[22]刘健伟,陈勇,熊富良,等.骨碎补总黄酮提取和大孔吸附树脂纯化的工艺研究[J ].中国药学杂志,2006,41(16):122221224.[23]王雅君,郭澄.应用大孔吸附树脂吸附分离技术制备菟丝子总黄酮的研究[J ].中药材,2004,27(11):8612862.The ne w extraction and isolation progress of flavonoidsL IAN G Dan 1,ZHAN G Bao Οdong 2(1.College of Agriculture ,Guizhou University ,Guiyang 550025;2.School of Continuing Education ,Zhoukou Normal University ,Zhoukou 466001,China )Abstract :Flavonoids have a wide variety of physiological activity ,and many valuable results had been made.How to ex 2tract and isolate of flavonoids f rom the natural product made widely concern and its extraction and isolation methods are im 2proving .This paper reviews the application and progress of flavonoids ′different extraction and isolation methods in the re 2cent years.With the advancement of technology ,extraction and isolation methods of flavonoids will be more rapid ,efficient and perfect.K ey w ords :flavonoid ;extraction ;isolation ;progress79第24卷第5期关 妮,等:两种CCDD 型野生稻的基因组原位杂交比较分析 。
黄酮类化合物的提取与分离工艺研究

黄酮类化合物的提取与分离工艺研究黄酮类化合物是一类具有丰富生物活性的植物次生代谢产物,被广泛应用于医药、食品和化妆品等领域。
本文将围绕黄酮类化合物的提取与分离工艺展开探讨。
一、黄酮类化合物的概述黄酮类化合物是一类含有两个苯环的多羟基化合物,具有较强的抗氧化作用和抗炎作用。
它们被广泛存在于许多植物中,如花朵、果实、根茎等部位。
由于其生物活性的独特性,研究人员对黄酮类化合物的提取与分离工艺进行了深入研究。
二、提取工艺的研究1. 溶剂提取法溶剂提取法是目前较为常用的提取黄酮类化合物的方法之一。
该方法利用溶剂对植物样品进行浸提,使黄酮类化合物溶于溶剂中,然后通过浓缩和干燥等步骤得到目标产物。
常用的溶剂有乙酸乙酯、甲醇等。
此方法对设备要求较低,但可能导致有机溶剂残留和产物的破坏。
2. 超声波辅助提取法超声波辅助提取法是一种改进的提取方法,通过超声波的作用,可以增加植物样品与提取溶剂的接触面积和渗透速度,加速黄酮类化合物的溶解和迁移。
该方法提取效果较好,但对设备要求较高,操作难度也较大。
三、分离工艺的研究1. 柱层析法柱层析法是一种常用的分离黄酮类化合物的方法。
该方法利用固定相和流动相之间的相互作用,根据黄酮类化合物的不同物理化学性质进行分离。
常用的固定相有硅胶柱、C18柱等。
该方法分离效果较好,但操作较为繁琐。
2. 薄层层析法薄层层析法是一种简便、快速的分离方法。
该方法将样品溶液涂布在薄层层析板上,通过固定相对黄酮类化合物进行分离,然后用显色剂喷洒在薄层层析板上,可通过色谱带的出现判断黄酮类化合物的位置。
该方法缺点是分离效果较差,但操作简便。
四、工艺优化与产物应用在黄酮类化合物的提取与分离工艺研究中,工艺的优化是十分重要的。
通过对溶剂种类、提取温度、提取时间等参数的不断调整,可以提高黄酮类化合物的提取率和纯度。
此外,对于产物的应用也是研究的重点,黄酮类化合物广泛应用于医药领域的抗炎药物、抗氧化剂和化妆品中的护肤成分等方面。
天然药物化学概述黄酮类化合物性质、提取与分离

三、 黄酮类化合物的提取与分离
兹以从槐米中提取芦丁为例说明该法的操 作过程。
槐米(槐树Sophora japonica L. 花蕾)加约6倍
量水,煮沸,在搅拌下缓缓加入石灰乳至pH8~9,在此 pH条件下微沸20~30分钟,趁热油滤,残渣同上再加4 倍水煎1次,乘热抽滤。合并滤液在60~70℃下,用浓 盐酸调至pH为5,搅匀,静置24小时,抽滤。沉淀物水
天然药物化学概述 黄酮类化合物性质、提取和分离
天然药物化学概述黄酮类化合物性 质、提取和分离
第五章 黄酮类化合物 一、黄酮类化合物的概述
二、黄酮类化合物的性质 与颜色反应
三、黄酮类化合物的提取与分离 四、黄酮类化合物的波谱
一、 概述
黄酮类化合物广泛分布于植物界中,而且生理活 性多种多样,引起了国内外的广泛重视,研究进展很 快。仅截止到1974年为止,国内外已发表的黄酮类化 合物共1674个(主要是天然黄酮类,也有少部分为合 成品,其中甙元902个,甙722个),并以黄酮醇类最 为常见,约占总数的三分之一,其次为黄酮类,占总 数的四分之一以上,其余则较少见。至于双黄酮类多 局限分布于裸子植物,尤其松柏纲,银杏纲和凤尾纲 等植物中。至1980年,黄酮类化合物总数已达到2721 个。
O
高异黄酮类 (homoisoflavones)
一、 概述
OH OH
HO
O
OH O
OH OH OH
HO
O
Oglc rha OH O
Quercetin 槲皮素
Rutin 芦丁
一、 概述
少数黄酮类化合物结构较为复杂,如水飞蓟素 (silybin)为黄酮木脂体类化合物。
OH
HO
O
OLeabharlann OCH3O CH2OH
天然产物化学全套 - 黄酮类化合物的检识与结构鉴定

B
6' 5'
OR'
~ 7.10, d, J ≈ 8.5 Hz ~ 7.90, d, J ≈ 2.5 Hz ~ 7.90, d, J ≈ 8.5, 2.5 Hz
25
第四节 分析:
检识与结构鉴定
二、紫外光谱
OH HO O OH
黄酮或3-O-苷 I=410-359=51nm,4'-OH
O-Glycosyl OH O
II=271-259=12nm,7-OH
I=387-359=28nm,B环有邻二OH AlCl3/HCl与AlCl3相比, I=402-433= -31nm, B环有邻二OH AlCl3/HCl与MeOH相比,
(但不包括5, 6-位)
O
注:与其在甲醇溶液中的光谱进行比较
19
第四节
检识与结构鉴定
二、紫外光谱
4、三氯化铝及三氯化铝/盐酸(AlCl3及AlCl3/HCl)
AlCl3可与下列结构系统络合,引起相应吸收带红移。
O O
OH
OH OH O O
OH
生成的铝络合物的相对稳定性顺序: 黄酮醇3-OH > 黄酮5-OH > 二氢黄酮5-OH > 邻二酚OH > 二氢黄酮醇3-OH
3
处理、喷2%AlCl3甲醇溶液(UV下检查)等
第四节
检识与结构鉴定
一、色谱法
(一)双向纸色谱法
第一向展开 —— 分配作用
展开剂:醇性溶剂,
如 n-BuOH-HOAc-H2O(BAW, 4:1:5上层)
Rf值:苷元>单糖苷>双糖苷, 一般苷元 > 0.7,苷 < 0.7
4
34532黄酮类化合物的分离

O
OCH3
>
OH O
OH O
橙皮查耳酮
橙皮素
OH OCH3
黄酮类化合物的提取分离
4)不同类型的黄酮类化合物,先后出柱顺序: 异黄酮>二氢黄酮醇>黄酮>黄酮醇
5)各种溶剂在聚酰胺柱上的洗脱能力由弱至强的顺序: 水<甲醇或乙醇<丙酮<稀氢氧化钠水溶液<甲酰胺<二甲基甲酰胺
聚酰胺色谱法总结
吸附规律:与酚羟基的数目、位置及溶剂介质有关。 与溶剂介质的关系: 吸附力:水﹥甲醇乙醇(浓度由低到高)﹥碱性溶剂 洗脱规律: 与吸附规律正好相反,即吸附力越强,越难洗脱
例:
HO
O
OH
HO
OH O
OH
OH OH O
OH OH O
山柰酚
桑色素
黄酮类化合物的提取分离
2)当分子中羟基数目相同时,吸附力与形成氢键的位置有关。 例:
HO
O
HO
O
OH O
A
OHOΒιβλιοθήκη OHBO H
O CH3
黄酮类化合物的提取分离
3)分子内芳香化程度越高,共轭双键越多,则吸附越强。
例:
OH
HO
OH
HO
1 pH梯度萃取法
总游离黄酮的乙醚液
依次以5%NaHCO3 、5%NaCO3、 0.2%NaOH、4%NaOH
5%NaHCO3 酸化
7,4`-二OH
5%NaCO3 酸化
7-或4`-OH
0.2%NaOH 酸化
一般酚OH
4%NaOH 酸化
5-OH
2 聚酰胺柱色谱(分离黄酮最理想的吸附剂)
分离原理:氢键吸附
黄酮类化合物的提取分离
二、 黄酮类化合物的分离
黄酮类化合物提取分离.

➢乙醇或甲醇 ➢高浓度 苷元 ➢60% 苷类。 ➢提取的次数: 2~4次。 ➢提取方法:加热 回流法或冷浸法。
➢仅用于提取苷类 ➢成本低,无污染, 适合工业化生产 ➢提取出的杂质较 多
➢用极性由小到大 的溶剂依次将同样 极性顺序的黄酮类 分别提取出来
Page 3
分离——pH梯度萃取法
原理
利用黄酮苷元中酚OH数目及位置不同, 其酸性强弱不 同的性质来分离。
酸性
7, 4'-OH > 7-或4'-OH > 一般酚OH > 3-OH, 5-OH
溶于5%NaHCO3 溶于5%Na2CO3 溶于不同浓度的NaOH中
方法
总黄酮溶于Et2O,再用5%NaHCO3, 5%Na2CO3, 0.2% NaOH, 4%NaOH依次萃取(碱性由弱强),达到分离目的。 Page 4
黄酮类化合物 提取分离
Page 1
提取——碱溶酸沉法
➢可用碱性水溶液(如碳酸钠、氢氧化钠、氢氧化 钙等水溶液)或碱性稀醇溶液(如50%乙醇)浸出。 ➢用碱性溶剂提取时,所用的碱浓度不宜过高,以 免在强碱下加热时破坏黄酮类化合物结构。 ➢ 当有邻二酚羟基存在时,应加硼酸保护。
Page 2
提取——溶剂提取法
例: 查耳酮 > 二氢黄酮
➢当苷元相同时,被吸附的强弱顺序为: 苷元>单糖苷 >二糖苷 >三糖苷
例:在聚酰胺薄层上,吸附力 槲皮素>芸香苷(芦丁)
➢ 与介质的关系:吸附力 水(中)> 甲醇、乙醇(浓度由 低到高)> 碱性溶剂
相反,溶剂在聚酰胺柱上对黄酮类化合物洗脱能力顺序为:水(中) <甲醇、乙醇(浓度由低到高)<碱性溶剂
黄酮类化合物的提取_分离_纯化研究进展

3讨 论 ,
文献青海蕨麻中类黄酮的提取及其抗氧化性研究报道采用半 黄 酮类 化合物近年被 做为保健产品被越来越 多的国家开发 , 大 微量超声波甲醇提取蕨麻类黄酮比常规索氏提取法的提取率高出 量 的新技术应用于提取分离黄酮类化合 物。
5 4% 嗍 。
1 . 1 . 1乙醇提取工艺 可重复利用 , 已有树脂法被用于工业 生产 。
文献蕨菜黄酮类化合物的提取与分析报道 “ 用7 0 %的乙醇对 2 . 3 溶剂萃取法 蕨菜浸提 , 发现蕨菜的黄酮非常高, 可得到含量达百分之三十七点 利用化合 物在两种互 零三的蕨菜黄酮” 嘲 。文献葛根黄酮的提取与应用报道“ 对葛根黄酮 系数 的不 同 , 使化合物从一种溶剂 内转移到另外一种溶剂 中。经过 进行乙醇提取研究, 得到百分之七点四三的总黄酮” 『 3 】 。文献报道在 反复多次萃取 , 将绝大部分的化合物提取 出来 。可 以通过黄酮类化 提取银杏叶总黄酮过程中使用百分之七十乙醇提取明显高于水煎 合物极性 不同采用不 同极性 的有机溶剂进行萃取 , 达到 分离黄酮的 法的收率。 目的 。
1 . 2 超 声提取法
法。 超声波产生的冲击流使植物细胞壁及整个生物体的破裂在瞬间 2 0 0 4 , ( 6 ) : 1 - 4 . 完成, 并释放出内含物质 , 具有低温操作、 能耗低、 效率高、 传质速度 [ 3 降 洪雄 ,彭志远 , 邹海英.葛根黄酮的提取与应用[ J 】 . 吉首大学学 快、 溶解能力强、 不破坏有效成分的特点。 多篇文献报道超声提取葛 报( 自然科学版) , 2 0 0 6, 2 7 ( 3 ): 1 1 3— 1 1 6. 根、 甘薯叶、 山楂叶、 元宝枫叶、 桑叶中的黄酮都得到很好的收率 。 [ 4 ] 韩志萍. 青海蕨麻 中类黄酮的提取及其抗氧化, 巨研究[ J 】 . 食 品研 究
黄酮类化合物的提取分离方法
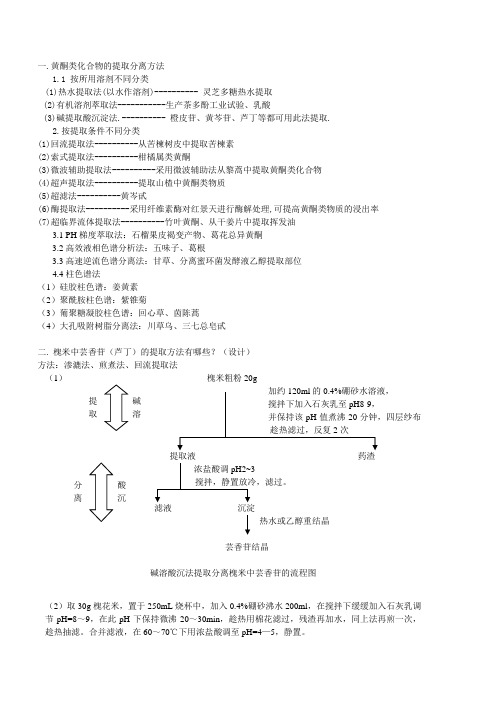
抽滤,少量水洗涤沉淀
滤液沉淀(粗品芦丁)
(4)大孔吸附树脂分离法:川草乌、三七总皂甙
二.槐米中芸香苷(芦丁)的提取方法有哪些?(设计)
方法:渗漉法、煎煮法、回流提取法
(1)槐米粗粉20g
加约120ml的0.4%硼砂水溶液,
搅拌下加入石灰乳至pH8-9,
并保持该pH值煮沸20分钟,四层纱布趁热滤过,反复2次
提取液药渣
浓盐酸调pH2~3
搅拌,静置放冷,滤过。
一.黄酮类化合物的提取分离方法
1.1 按所用溶剂不同分类
(1)热水提取法(以水作溶剂)---------- 灵芝多糖热水提取
(2)有机溶剂萃取法-----------生产茶多酚工业试验、乳酸
(3)碱提取酸沉淀法.---------- 橙皮苷、黄芩苷、芦丁等都可用此法提取.
2.按提取条件不同分类
(1)回流提取法----------从苦楝树皮中提取苦楝素
滤液沉淀
热水或乙醇重结晶
芸香苷结晶
碱溶酸沉法提取分离槐米中芸香苷的流程图
(2)取30g槐花米,置于250mL烧杯中,加入0.4%硼砂沸水200ml,在搅拌下缓缓加入石灰乳调节pH=8渣再加水,同上法再煎一次,趁热抽滤。合并滤液,在60~70℃下用浓盐酸调至pH=4—5,静置。
(2)索式提取法----------柑橘属类黄酮
(3)微波辅助提取法----------采用微波辅助法从黎蒿中提取黄酮类化合物
(4)超声提取法----------提取山楂中黄酮类物质
(5)超滤法----------黄岑甙
(6)酶提取法----------采用纤维素酶对红景天进行酶解处理,可提高黄酮类物质的浸出率
(7)超临界流体提取法----------竹叶黄酮、从干姜片中提取挥发油
天然产物化学全套---黄酮类化合物的提取与分离

第五章 黄酮类化合物 (Flavonoids)
天然药化教研室 主讲教师:宋少江
1
本章内容
第一节 概述 第二节 理化性质及显色反应
第三节 提取与分离 第四节 检识与结构鉴定 第五节 结构研究实例
2
第三节 提取与分离
一、提取与粗分
苷元:用氯仿、乙醚、乙酸乙酯等回流提取。 苷及极性大的苷元:用丙酮、乙酸乙酯、乙醇、 甲醇、醇-水加热提取。 提取黄酮苷类成分时,应避免发生水解,可按一般 苷的提取方法先破坏酶的活性。
A> B > C > D D>B>C>A
17
第三节 提取与分离
(三)根据分子中某些特定官能团进行分离
如:醋酸铅沉淀法(目前已不使用) ➢ 具有邻二酚羟基,可被醋酸铅沉淀 ➢ 不具有邻二酚羟基,可被碱式醋酸铅沉淀
二、分离
18
12
第三节 提取与分离
二、分离
黄酮类化合物在Sephadex LH-20(甲醇)上的Ve/V0
黄酮类化合物 芹菜素
木樨草素 槲皮素 杨梅素
山奈酚-3-半乳鼠李糖-7-鼠李糖苷 槲皮素-3-芸香糖苷 槲皮素-3-鼠李糖苷
取代图式 5,7,4'-三羟基 5,7,3',4'-四羟基 3,5,7,3',4'-五羟基 3,5,7,3',4',5'-六羟基
第三节 提取与分离
二、分离
(一)柱色谱法
1、硅胶柱色谱 主要用于分离弱极性和中等极性的化合物,应用最为广泛。 吸附规律:极性大的物质易于被吸附 一般洗脱顺序:苷元>单糖苷>双糖苷>多糖苷
9
第三节 提取与分离
二、分离
天然产物提取与分离第三章_黄酮类化合物

(一)酸性
• 黄酮类化合物因分子中多具有酚羟基,故
显酸性,可溶于碱性水溶液、吡啶、甲酰
胺及二甲基酰胺(形成氢键)中。
• 酚羟基位臵及数目不同,酸性强弱也不同,黄酮
的酚羟基酸性强弱顺序为:
• (7,4‘)二个羟基 > (7或4’)一个羟基 >一
个一般酚羟基>一个(5-)羟基
2’ HO A O 2 1‘ C 6’ O C6-C3-C6 B 5‘ 3‘ 4’ OH
第三章、黄酮类化合物
第一节 概述
黄酮类化合物:
• 以前,主要指基本母核为2-苯基色原酮类化 合物; • 现在,泛指两个具有酚羟基的苯环通过中央 三碳原子相互连接而成的一系列化合物。
8 7 6 5
1 O
2’ O 2 1‘ 6’ O
3‘ 4’ 5‘
4 O 色原酮
2-苯基色原酮
2’ HO A O 2 1‘ C 6’ O C6-C3-C6 B
CoA
O
CO
OH
HO
OH OH
OH
O
O
O
HO O OH
OH
O
桂皮酸途径形成黄酮类化合物
二、黄酮类化合物结构分类
• 黄酮类化合物结构中常连接有酚羟基、甲 氧基、甲基、异戊烯基等官能团。
• 黄酮类化合物常与糖结合成苷。
• 根据中央三碳链的氧化程度、B-环连接位 臵(2-或3-位)以及三碳链是否构成环状 等特点,可将主要黄酮类化合物分类如下:
一、黄酮类化合物生物合成途径
• 多数科学家认为黄酮类化合物的基本骨架是 由三个丙二酰辅酶A和一个桂皮酰辅酶A生 物合成。 • A环来自于三个丙二酰辅酶A,B环来自于桂 皮酰辅酶A 。
COOH -NH 2 NH 2
天然药物化学黄酮类化合物

抗菌活性
总结词
黄酮类化合物具有抗菌作用,能够抑制 细菌的生长和繁殖。
VS
详细描述
黄酮类化合物对多种细菌如葡萄球菌、大 肠杆菌、链球菌等具有一定的抗菌作用, 其抗菌机制主要包括抑制细菌细胞壁合成 、干扰细菌蛋白质合成、抑制细菌DNA 复制等。
03
黄酮类化合物的提取与 分离
提取方法
溶剂提取法
利用有机溶剂如甲醇、乙醇等 从植物中提取黄酮类化合物。
超声波辅助提取法
利用超声波的振动和空化作用 ,加速黄酮类化合物的溶出。
微波辅助提取法
利用微波的加热作用,提高黄 酮类化合物的提取效率。
超临界流体萃取法
利用超临界流体如二氧化碳作 为萃取剂,具有较高的萃取效
直接作用机制
抗氧化作用
黄酮类化合物具有清除自由基、 抑制氧化应激反应的作用,能够 保护细胞免受氧化损伤。
抗炎作用
黄酮类化合物能够抑制炎症介质 的产生和释放,减轻炎症反应, 对多种炎症性疾病具有治疗作用 。
抗菌抗病毒作用
黄酮类化合物具有广谱抗菌抗病 毒活性,对细菌、病毒等微生物 的生长和繁殖具有抑制作用。
详细描述
黄酮类化合物通过抑制氧化酶的活性、螯合金属离子、清除自由基等方式发挥抗 氧化作用,有助于预防和延缓衰老、心血管疾病、癌症等疾病的发生。
抗炎活性
总结词
黄酮类化合物具有抗炎作用,能够抑制炎症反应和缓解疼痛。
详细描述
黄酮类化合物通过抑制炎症介质如前列腺素、白三烯等的产生,减轻炎症反应,缓解疼痛和肿胀等症状,对关节 炎、痛风、消化道炎症等疾病具有一定的治疗作用。
黄酮类化合物的分离方法

黄酮类化合物的分离方法黄酮类化合物是植物中丰富的一类复合物,参与着植物的成长和繁殖,对人体有重要的作用和意义。
因其多种作用而深受人们的重视,尤其是在医药、轻工、农业和烹饪等领域。
提取和分离黄酮类化合物是研究它们分子特性和生理活性的重要基础。
为此,提出了层析分离、液相色谱分离、分子膜分离及无机装配剂等分离方法。
下面将对这些黄酮类化合物的分离方法进行简要分析。
一、层析分离通过将溶液中的复合物用各种不同的溶剂溶解,然后将溶解的调和液分成各个层,并在每一层中有不同的溶剂分离,这些溶剂可以使复合物分离出来,就叫层析分离。
它以底物组分(溶解液)、溶剂介质(萃取液)和量等有机溶剂进行组分,以及通过水合溶液的循环组合成不同层析液,然后经沉淀和析出的步骤,从而获得不同的化合物。
二、液相色谱液相色谱法分离是一种常用的分子结构非常精确的分离方法,它具有效率高、分离比武高的优点。
它的原理是利用液相色谱仪将物质加入到色谱柱,然后利用沿色谱柱流动,并在相应位置发生吸附现象,根据靶物发生吸附驻留时间的不同快速分离,从而获得不同的黄酮类化合物。
它具有灵敏度高、分辨率高、时间短等优点,是黄酮类化合物分离与研究的常用方法。
三、分子膜分离分子膜分离是实践中最经久耐用的一种分离方法,它可以精确的将靶黄酮类化合物从混合溶液中分离出来,包括气体、液体、固体等不同形式的物质。
它利用了膜的分子筛选特性,根据物质的分子大小和性质,通过穿膜、吸附、屏蔽的不同物理作用和化学作用,只选择某些目标分子通过膜进入新的空间,从而对靶黄酮类化合物进行准确的分离。
选择分子膜分离法可以降低分离操作温度,避免化合物被破坏,以较高的精度获得分离产物。
四、无机装配剂无机装配剂是一种新型的分离抽提技术,在研究黄酮类化合物的分离与提取方面具有较强的分离效能。
通过利用装配剂对黄酮类化合物进行抽提,使成份与其无关的杂质从系统中分离出来,精确达到分离提取的目的。
装配剂分离黄酮类化合物时,抽提产物具有清晰的化学性质,释放产物不受微量有机物影响,可提高设备使用率,降低运输量,有利于保护环境。
黄酮类化合物的提取

黄酮类化合物的提取1. 引言黄酮类化合物是一类具有重要生物活性的天然产物,广泛存在于植物中。
它们具有抗氧化、抗炎、抗肿瘤、抗菌等多种药理活性,对人体健康具有积极影响。
因此,黄酮类化合物的提取和研究对于开发新药、保健品以及食品添加剂等具有重要意义。
本文将介绍黄酮类化合物的提取方法,包括传统的溶剂提取法和现代的超声波辅助提取法。
同时还将讨论一些常见的黄酮类化合物提取实验中需要注意的问题,并介绍一些常用的分析方法。
2. 黄酮类化合物的溶剂提取法溶剂提取法是一种常用且有效的黄酮类化合物提取方法。
其基本原理是利用溶剂与植物材料中的黄酮类化合物发生相互作用,从而使黄酮类化合物从植物材料中转移到溶剂中。
2.1 实验步骤1.准备植物材料:选择含有丰富黄酮类化合物的植物材料,如柑橘皮、茶叶等。
2.粉碎植物材料:将植物材料研磨成粉末,增加溶剂与植物材料的接触面积。
3.溶剂选择:选择适当的溶剂,常用的溶剂有乙醇、甲醇、乙酸乙酯等。
溶剂的选择应考虑黄酮类化合物在该溶剂中的溶解度以及对环境和人体的安全性。
4.提取过程:将粉碎后的植物材料与选择好的溶剂混合,进行提取。
可以采用冷浸提取、热浸提取或回流提取等方法。
5.过滤和浓缩:将提取液通过滤纸过滤去除固体残渣,并利用旋转蒸发仪等设备将溶剂蒸发浓缩,得到黄酮类化合物的浓缩液。
2.2 实验注意事项1.操作环境要求:在通风良好的实验室中进行操作,避免溶剂蒸气对人体造成伤害。
2.溶剂选择:根据需要提取的黄酮类化合物种类选择合适的溶剂,并注意其安全性。
3.植物材料的处理:植物材料应干燥并研磨成细粉末,以增加提取效果。
4.提取时间和温度:提取时间和温度会影响黄酮类化合物的提取效率,需根据实验需要进行优化。
5.过滤和浓缩:过滤时要注意使用适当的滤纸,以防止黄酮类化合物丢失。
浓缩时要控制温度和压力,避免黄酮类化合物的分解。
3. 黄酮类化合物的超声波辅助提取法超声波辅助提取法是一种高效、快速且环境友好的黄酮类化合物提取方法。
黄酮类化合物的提取与分离

滤液 浓缩至小体积, 冰箱放置 黄色结晶 乙醇重结晶
沉淀(PbS)
同铅盐(A)法进行复分解 晶块 溶于少量乙醇中,放置 黄色结晶 乙醇重结晶 浅黄色针晶(graveobioside B) (II)
浅黄色蔟状结晶(graveobioside A)(I)
有邻二酚羟基的黄酮可与硼酸络合,
生成物易溶于水,可与不具上述结 构的黄酮类化合物相互分离。
举例:从芹菜[Apium graveolens L.]种子 中分离芹菜双糖苷(graveobiodide) A及B
OH RO O OH RO O OH OCH3
OH
O
R=芹菜糖
OH
O
I(具有邻二酚羟基)
II(无邻二酚羟基)
原料(种子) 石油醚浸泡脱脂 脱脂药料 乙醇提取 提取液 减压浓缩后,用醚处理杂质 醚不溶物 溶于热水中,煮沸,逐滴加入中性醋酸铅的热水溶液, 直至不再析出沉淀为止,乘热过滤
棕色沉淀(A) 悬浮乙醇中,通H2S,过滤
滤液 加入碱式醋酸铅的热水溶液至沉淀完全,过滤 黄色铅盐沉淀(B)
第三节 黄酮类化合物的提取与分离
一、提取 黄酮苷类以及极性稍大的苷元(如 羟基黄酮、双黄酮等),一般可用 丙酮、醋酸乙酯、乙醇提取。一些 多糖苷类可用沸水提取。在提取花 青素类化合物时,可加入少量酸 (0.1%盐酸,如果是黄酮苷应当慎 用,避免苷键发生水解)。
大多数黄酮苷元宜用用氯仿、乙醚、
醋酸乙酯等中极性溶剂提取,而对 多甲氧基黄酮类游离苷元,甚至可 用苯等低极性溶剂进行提取。
酸 性 :7 , 4- 二 OH 溶 于 5%NaHCO3 液 ) 7-或4-OH (5%Na2CO3液) 一般OH(0.2%NaOH) 5-OH (4% NaOH液)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第三节
提取与分离
一、提取与粗分
加酸
(二)碱提取酸沉淀法 —— 利用化合物的酸性
原理:黄酮 + 碱
成盐(溶于水)
沉淀
槐花米粗粉 加水,搅拌下加入石灰乳至 pH8-9,微沸30min,趁热抽滤 残渣
OH HO O OH O OH O rutinose
滤液 在60-70℃下用浓盐酸调至 pH3-4,静置1hr,抽滤 滤液 沉淀 (粗制芦丁)
14
第三节
提取与分离
二、分离
(二)梯度pH萃取法
适于分离酸性强弱不同的黄酮苷元
酸性:
7,4'-二OH > 7-或4'-OH > 一般酚OH > 5-OH
溶于NaHCO3中 溶于Na2CO3中 溶于不同浓度NaOH中
15
第三节
提取与分离
样品乙醚液 5%NaHCO3
二、分离
(二)梯度pH萃取法
碱液 (7,4'-二羟基黄酮)
R 1 = R2 = H R1 = H, R2 = Rha R1 = Glc, R2 = H R1 = Glc, R2 = Rha
试比较四种化合物的酸性: A > C > B > D 极性大小: D > C > B > A 比较它们的Rf值大小顺序: (1)硅胶TLC
A> B > C > D
7
沸水洗脱液
沸甲醇洗脱液
乙醚层(酚)
第三节
提取与分离
二、分离
极性 —— 硅胶 化 合 物 的 性 质
酸性 —— pH梯度萃取、离子交换树脂 形成氢键的能力 —— 聚酰胺 分子大小 —— 葡聚糖凝胶
特殊结构 —— 金属盐络合 (如邻二酚羟基)
8
第三节
提取与分离
二、分离
(一)柱色谱法
1、硅胶柱色谱
主要用于分离弱极性和中等极性的化合物,应用最 为广泛。
天然药物化学
第五章 黄酮类化合物 (Flavonoids)
天然药化教研室 主讲教师:宋少江
1
本 章 内 容
第一节 概述 第二节 理化性质及显色反应
第三节 提取与分离
第四节 检识与结构鉴定 第五节 结构研究实例
2
第三节
提取与分离
一、提取与粗分
苷元:用氯仿、乙醚、乙酸乙酯等回流提取。 苷及极性大的苷元:用丙酮、乙酸乙酯、乙醇、 提取黄酮苷类成分时,应避免发生水解,可按一般
17
(2)聚酰胺TLC D > B > C > A离
(三)根据分子中某些特定官能团进行分离
如:醋酸铅沉淀法(目前已不使用)
具有邻二酚羟基,可被醋酸铅沉淀 不具有邻二酚羟基,可被碱式醋酸铅沉淀
18
甲醇、醇-水加热提取。
苷的提取方法先破坏酶的活性。
3
第三节
提取与分离
一、提取与粗分
(一)溶剂萃取法 —— 利用化合物的极性
药材 水或醇-水,加热提取 提取液 (水提醇沉法) 浓缩,加3~4倍量醇
醇水液 浓缩,回收醇,加水混悬
沉淀(水杂)
水混悬液 (系统溶剂萃取) 依次用石油醚、氯仿、乙酸乙酯、正丁醇萃取 石油醚层 氯仿层 (叶绿素胡萝卜 (黄酮苷元) 素脂溶性成分) 乙酸乙酯层 (极性大苷元 极性小的苷) 水层 正丁醇层 (黄酮苷) (多糖蛋白质)
黄酮类化合物 芹菜素 木樨草素 槲皮素 杨梅素 山奈酚-3-半乳鼠李糖-7-鼠李糖苷 取代图式 5,7,4'-三羟基 5,7,3',4'-四羟基 3,5,7,3',4'-五羟基 3,5,7,3',4',5'-六羟基 三糖苷 Ve/V0 5.3 6.3 8.3 9.2 3.3
槲皮素-3-芸香糖苷
槲皮素-3-鼠李糖苷
6
第三节
提取与分离
一、提取与粗分
(三)炭粉吸附法 —— 主要用于黄酮苷的精制
药材甲醇提取物 分次加入活性炭,搅拌,静置, 直至上清液无黄酮反应,过滤 滤液 吸苷炭末 依次用沸水、沸甲醇、7%苯酚 /水、15%酚/醇溶液进行洗脱 7%苯酚/水洗脱液 15%酚/醇洗脱液 浓缩,加乙醚萃取 水层(黄酮苷)
第三节
提取与分离
二、分离
3、葡聚糖凝胶柱色谱
常用型号:Sephadex LH-20 分离原理:
黄酮苷元 —— 吸附作用,取决于游离酚羟基的数目(与 位置无关),苷元的羟基数越多, 越难洗脱。 黄酮苷 —— 分子筛,按分子量由大到小的顺序流 出柱体。
12
第三节
提取与分离
二、分离
黄酮类化合物在Sephadex LH-20(甲醇)上的Ve/V0
10
练习: 下列黄酮化合物:
(1)用聚酰胺柱色谱,含水甲醇梯度洗脱, (2)用硅胶柱色谱分离,氯仿-甲醇梯度洗脱, 分别写出洗脱顺序
Rha GlcO O O
O
HO
O OH
OH
O
A
OH
Rha GlcO
OH
O
D
OH OH
O
HO
O OH
OH
OH O
OH
O
GlcO
O OH
E
B
OH O
C
聚酰胺:D > E > C > B > A 硅胶:A > B > C > D > 11 E
乙醚液 5%Na2CO3 乙醚液 0.2%NaOH 乙醚液 4%NaOH
碱液 (7或4'-羟基黄酮)
碱液 (一般羟基黄酮)
碱液 (仅含3-OH或5-OH黄酮)
乙醚液 16 (脂杂)
第三节
提取与分离
二、分离
练习:从某植物中分离出四种化合物,其结构如下:
R2O O OH OR1 OH O
A B C D
双糖苷
单糖苷
4.0
4.9
苷元的羟基数越多,越难以洗脱;
苷的分子量越大,连接糖的数目越多,越容易洗脱。 13
第三节
提取与分离
二、分离
3、葡聚糖凝胶柱色谱
常用洗脱剂: (1)醇或含水醇,如 甲醇、甲醇-水、乙醇 等。 (2)其它溶剂:如 丙酮-水、氯仿-甲醇 等。 进行洗脱剂更换时,要注意不同溶剂对填料的溶胀 度差别不能过大。
5
芦丁
第三节
提取与分离
一、提取与粗分
(二)碱提取酸沉淀法 —— 利用化合物的酸性
碱:Ca(OH)2水溶液、Na2CO3水溶液或稀NaOH溶液 (即石灰乳或石灰水)
使含酚羟基化合物成盐溶解
使含COOH的果胶、粘液质、蛋白质等杂质形成 沉淀而除去
提取时,碱性不宜过强,以免破坏黄酮母核; 酸化时,酸性不宜过强,以免形成盐而溶解。
吸附规律:极性大的物质易于被吸附 一般洗脱顺序:苷元>单糖苷>双糖苷>多糖苷
9
第三节
提取与分离
二、分离
2、聚酰胺柱色谱
吸附原理:氢键缔合
洗脱顺序规律:(先→后)
(1)苷元相同,三糖苷>双糖苷>单糖苷>苷元 (2)母核上羟基增加,洗脱速度减慢 (3)羟基数目相同,有缔合羟基>无缔合羟基 (4)不同类型黄酮化合物,异黄酮>二氢黄酮醇> 黄酮>黄酮醇 (5)分子中芳香核、共轭双键多则易被吸附,故查耳 酮往往比相应的二氢黄酮难于洗脱。
