《离子晶体》
【教学课件】《离子晶体》(人教)

人民教育出版社 九年级 | 上册
(3)金属晶体中,离子半径越 小,离子电荷越高,金属键就越 强,熔点就越高。合金的熔点比 它的各成分金属的熔点低。
人民教育出版社 九年级 | 上册
练习
下列物质的晶体,按其熔点由低到高的排列顺序正确的是() A.NaCl|、SiO2、CO2 B.NaCl、CO2、SiO2 C.NaCl、MgO、SiO2 D.NaCl、SiO2、MgO
1、什么是离子键?什么是离子化合物?
离子键:使阴、阳离子结合成离子化合物的静电作用; 离子化合物:由阳离子和阴离子组成的化合物。
人民教育出版社 九年级 | 上册
知识回顾
2、我们已经学过几种晶体?它们的结构微粒和微粒间的相互作用 分别是什么?
(1)分子晶体 ①定义:分子间通过分子间作用力构成的晶体; ②构成微粒:分子; ③微粒间作用:a.分子间作用力,部分晶体中存在氢键;b.分子内 存在化学键,在晶体状态改变 时不被破坏。
人民教育出版社 九年级 | 上册
离子晶体与离子化合物之间的关系?
离子化合物不一定是离子晶体,离子晶体一定是离 子化合物。
人民教育出版社 九年级 | 上册
判断正误:
1、离子晶体一定是离子化合物。 2、含有离子的晶体一定是离子晶体。 3、离子晶体中只含离子键。 4、离子晶体中一定含金属阳离子。 5、由金属元素与非金属元素组成的晶体一定是
决定离子晶体结构的因素
几何因素: 晶体中正负离子的半径比。 电荷因素: 晶体中正负离子的电荷比。 键性因素: 离子键的纯粹程度。
离子晶体

几种晶体结构与性质的比较 晶体类型 离子晶体 分子晶体 原子晶体 金属晶体
金属阳离子 原子) (原子)自由 电子
构成晶 阴阳离子 分子 原子 结 体微粒 构 微粒间 范德华力、 范德华力、 离子键 共价键 作用力 氢键 性 熔沸点 硬度 质 导电 较高 较大 脆 较低 较小 高 很大 脆、耐磨
金属键 较高 较大 延展性好 导电
(2)电荷因素 正负离子的电荷数比等于该晶 体晶胞中(化学式) 体晶胞中(化学式)正负离子 个数的反比, 个数的反比,等于正负离子配 位数之比。 位数之比。 (3)键性因素
Ca2+ F-
5、晶格能 气态离子形成1摩尔离子晶体释放的能量称为晶 气态离子形成1摩尔离子晶体释放的能量称为晶 形成 格能。通常取正值 正值。 格能。通常取正值。 (1)晶格能正比于正负离子电荷数的乘积,与正 晶格能正比于正负离子电荷数的乘积, 负离子的核间距成反比。 负离子的核间距成反比。 (2)晶格能越大,离子晶体越稳定,熔点越高, 晶格能越大,离子晶体越稳定,熔点越高, 硬度越大。 硬度越大。
固体不导电, 固体不导电, 固体和熔融 一般不导 熔融或水溶 都不导电 电 液导电
3、几种常见的离子晶体
每个NaCl晶胞中包含Cl 个数为:8X1/8+6X1/2=4 每个NaCl晶胞中包含Cl-个数为:8X1/8+6X1/2=4; NaCl晶胞中包含 个数为:12X1/4+1=4 Na+个数为:12X1/4+1=4。 每个CsCl晶胞中包含Cl 个数为:8X1/8=1 每个CsCl晶胞中包含Cl-个数为:8X1/8=1;Cs+个 CsCl晶胞中包含 数为: 数为:1。
配位离子(原子):与中心离子(原子) 配位离子(原子):与中心离子(原子)直接成键 ):与中心离子 的离子(原子)。 的离子(原子)。 配位离子(原子)的数目称为配为数。 配位离子(原子)的数目称为配为数。
离子晶体
6 2
4
这几个Na+在空间
构成的几何构型 为 正八面体 。
3
6
1
2
5
4
每个Cl- 周围 与之最接近且 距离相等的Na+ 共有 6 个。
1每个Na+周围最近且等距的Cl-有 6 个
它们围成的几何空间构型为 正八面体 2每个Cl-周围最近且等距的Na+有 6 个 它们围成的几何空间构型为 正八面体
3每个Na+周围最近且等距的Na+有 12 个 4每个Cl-周围最近且等距的Cl-有 12 个
离子键的强弱在一定程度上可 以用离子晶体的晶格能来衡量。
晶格能:定义是气态离子形成l摩离子晶 体释放的能量,通常取正值。
4、离子晶体的晶格能
仔细阅读课本 P80 表3—8,离子晶体的晶格能与哪些 因素有关?
(1)、影响晶格能大小因素
小结:离子晶体中 阴阳离子半径越小,所带电荷,越多 离子键越强,晶格能越大,简言之:晶格能的大
NaCl:95/181=0.525 CsCl:169/181=0.933
(2)电荷因素
由正负离子的电荷比影响 离子晶体的配位数学.科.网的因素, 称为电荷因素。
CaF2的晶胞
例和:F-C的aF个2的数晶之体比中_1_:,_2_C,a电2+ 荷数之比_2_:_1__,Ca2+配位 数是__8___,F-的配位数是
第四节 离子晶体
一、离子晶体
1、定义: 由阳离子和阴离子通过离子键结合 而成的晶体。
2、构成粒子: 阴、阳离子
3、相互作用力: 离子键
4、常见的离子晶体:强碱、 活泼金属氧化物、 大部分的盐类。
二、晶胞结构特点 1、几种常见的晶体类型
化学:3.4《离子晶体》PPT课件(新人教版-选修3)

综合应用
NiO的摩尔质量M g/mol,密度为ρg/mL,阿伏 加德罗常数为NA,
求晶胞中两个距离最近的氧离子中心间的距 离为多少cm?
综合应用
Hale Waihona Puke (2)天然的和大部分人工制备的 晶体都存在各种缺陷,例如在 某种NiO晶体中就存在以下缺陷: 一个Ni2+空缺,另有两个Ni2+被 两个Ni3+所取代。其结果晶体仍 呈电中性,但化合物中Ni和O的 比值却发生了变化。某氧化镍 样品组成为Ni0.97O, 试计算该晶体中Ni3+与Ni2+的离子数之比。 参考答案: Ni3+ :Ni2+=6 :91
计算方法:均摊法 顶点占1/8;棱占1/4;面心占1/2;体心占1
(3)与Na+等距离且最近的Na+ 、Cl- 各有几个?
与Na+等距离且最近的Cl- 有:6个
与Na+等距离且最近的Na+ 有:12个
(2)氯化铯型晶胞
CsCl晶胞
(1)铯离子和氯离子的位置:
铯离子:体心
氯离子:顶点;或者反之。
(2)每个晶胞含铯离子、氯 离子的个数 铯离子:1个 ;氯离子:1个 (3)与铯离子等距离且最近 的铯离子、氯离子各有几个? 铯离子:6个 ;氯离子:8个
3.4《离子晶体》
2Na + Cl2 == 2NaCl
Na
+11
+17
Cl
Na+
+11
+17
Cl-
Na+ Cl-
一、离子键
1、定义:
2、常见物质
一、离子晶体
1、定义:由阳离子和阴离子通过离
人教版化学选修三《离子晶体》精品课件

---Cs+
①铯离子和氯离子的配位数: 每个Cs+周围同时吸引8个Cl-,每个Cl-周 围同时吸引8个 Cs + 化学式:CsCl
②每个晶胞含 1 个铯离子、 1 个氯离子。 化学式:CsCl ③与铯离子等距离且最近的铯离子有 6 ④与氯离子等距离且最近的氯离子有 6 个。 个。
3.CaF2晶体的结构模型
第四节 离子晶体
离子晶体定义、成键粒子、相互作用力
定义: 由阳离子和阴离子通过离子键结合而 成的晶体。
成键粒子: 阴、阳离子
相互作用力:离子键
常见晶体离子:强碱、活泼金属氧化物、大 部分的盐类。
离子晶体的结构特征
①离子键没有饱和性和方向性,在晶体中 阴阳离子尽可能采取最密堆积; ②离子晶体中不存在单独的分子,化学式 代表阴阳离子最简个数比;
晶格能定义、符号和单位 1.定义:气态离子形成1摩尔离子晶体时释放 的能量。 2.符号:U 3.单位:kJ/mol
晶格能的大小的影响因素
离子电荷越大,阴、阳离子半径越小,即 阴、阳离子间的距离越小,则晶格能越大。简 言之,晶格能的大小与离子带电量成正比,与离
子半径成反比。
晶格能的作用和意义
晶格能越大 ,则 ①形成的离子晶体越稳定;(离子键越强) ②熔点越高;
①Ca2+的配位数: 8 F-的配位数:4 化学式:CaF2 ②一个CaF2晶胞中含: 4个Ca2+和8个F化学式:CaF2
---Ca2+ ---F-
4.ZnS晶体的结构模型
①Zn2+离子的配位数: 4 S2-的配位数: 4 化学式:ZnS ②一个ZnS晶胞中含:4个阳离子和4 个阴离子 化学式:ZnS
决定离子晶体结构的因素
第四节离子晶体

7、几种常见离子晶体: 、几种常见离子晶体:
配位数: 离子晶体中离子的配位数 离子晶体中离子的配位数:一个离子周围最邻 近的异电性离子的数目。 异电性离子的数目 近的异电性离子的数目。缩写为 C.N.
⑴
NaCl晶胞 NaCl晶胞
注意Na+、Cl-离 注意 子的排布位置
(1)每个晶胞含( 4 ) 个”NaCl”? NaCl”? 每个晶胞含( NaCl晶体中 晶体中, 配位数是( (2)在NaCl晶体中,Na+配位数是( 6 ) 配位数是( );Na 周围的Cl Cl-配位数是( 6 );Na+周围的Cl-在空间构 成的几何构型为( 正八面体 ) 成的几何构型为( (3)在NaCl晶体中,每个Na+周围与之 NaCl晶体中,每个Na 晶体中 距离最近且相等的Na 距离最近且相等的Na+ 共有 个; 12
规律总结 题型二:物质的熔沸点与晶体类型的关系 题型二 物质的熔沸点与晶体类型的关系
1、常温下的状态: 、常温下的状态: 熔点:固体> 熔点:固体>液体 沸点:液体> 沸点:液体>气体 2、若晶体类型不同,一般情况下: 、若晶体类型不同,一般情况下: 原子晶体>离子晶体> 原子晶体>离子晶体>分子晶体 3、若晶体类型相同,构成晶体质点间的作用大,则熔 、若晶体类型相同,构成晶体质点间的作用大, 沸点高,反之则小。 沸点高,反之则小。 离子晶体中,结构相似时,离子半径越小, ⑴离子晶体中,结构相似时,离子半径越小, 离子电荷越高,离子键就越强,熔沸点就越高。 离子电荷越高,离子键就越强,熔沸点就越高。 原子晶体中,结构相似时,原子半径越小, ⑵原子晶体中,结构相似时,原子半径越小, 键长越小、键能越大,熔沸点越高。 键长越小、键能越大 熔沸点越高。 熔沸点越高
3.3离子晶体
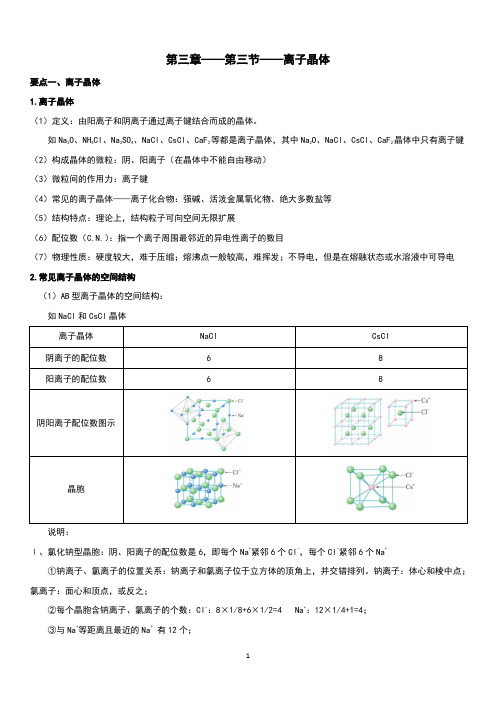
第三章——第三节——离子晶体要点一、离子晶体1.离子晶体(1)定义:由阳离子和阴离子通过离子键结合而成的晶体。
如Na2O、NH4Cl、Na2SO4、NaCl、CsCl、CaF2等都是离子晶体,其中Na2O、NaCl、CsCl、CaF2晶体中只有离子键(2)构成晶体的微粒:阴、阳离子(在晶体中不能自由移动)(3)微粒间的作用力:离子键(4)常见的离子晶体——离子化合物:强碱、活泼金属氧化物、绝大多数盐等(5)结构特点:理论上,结构粒子可向空间无限扩展(6)配位数(C.N.):指一个离子周围最邻近的异电性离子的数目(7)物理性质:硬度较大,难于压缩;熔沸点一般较高,难挥发;不导电,但是在熔融状态或水溶液中可导电2.常见离子晶体的空间结构(1)AB型离子晶体的空间结构:如NaCl和CsCl晶体说明:Ⅰ、氯化钠型晶胞:阴、阳离子的配位数是6,即每个Na+紧邻6个Cl-,每个Cl-紧邻6个Na+①钠离子、氯离子的位置关系:钠离子和氯离子位于立方体的顶角上,并交错排列。
钠离子:体心和棱中点;氯离子:面心和顶点,或反之;②每个晶胞含钠离子、氯离子的个数:Cl-:8×1/8+6×1/2=4 Na+:12×1/4+1=4;③与Na+等距离且最近的Na+有12个;④Na+、Cl-比例为1︰1,化学式为NaCl,属于AB型离子晶体。
Ⅱ、氯化铯型晶胞:阴、阳离子的配位数是8,即每个Cs+紧邻8个Cl-,每个Cl-紧邻8个Cs+每个Cs+周围最邻近的Cl-有8个,每个Cl-周围最邻近的Cs+有8个,则Cs+、Cl-的配位数都是8。
因此整个晶体中,Cs+、Cl-比例为1︰1,化学式为CsCl,属于AB型离子晶体。
同是AB型离子晶体, CsCl与NaCl的晶体结构和配位数不一样(2)CaF2晶体的空间结构由图可知,Ca2+的配位数为8,F-的配位数是43.决定离子晶体结构的主要因素:(1)几何因素:正、负离子的半径比的大小晶体的阴、阳离子所带的电荷数相同的AB型离子晶体的几何因素与配位数(阴、阳离子个数相同,配位数也相同)的关系:r+/ r-配位数0.225-0.414 40.414-0.732 60.732-1.00 8(2)电荷因素:正、负离子所带电荷的多少晶体中阴、阳离子的电荷数不相同,阴、阳离子个数不相同,各离子的配位数也不相同。
离子晶体的基本特点

离子晶体的基本特点离子晶体一般硬而脆,具有较高的熔沸点,熔融或溶解时可以导电。
晶体主要分为离子晶体、分子晶体、金属晶体和原子晶体。
离子晶体是指由离子化合物结晶成的晶体,离子晶体属于离子化合物中的一种特殊形式,不能称为分子。
由正、负离子或正、负离子集团按一定比例通过离子键结合形成的晶体称作离子晶体。
强碱、活泼性金属氧化物和大多数的盐类均为离子晶体。
离子晶体一般硬而脆,具有较高的熔沸点,熔融或溶解时可以导电。
(注:不同于离子化合物。
)1.结构特征:离子晶体中正、负离子或离子集团在空间排列上具有交替相间的结构特征,因此具有一定的几何外形,例如NaCl是正立方体晶体,Na+离子与Cl-离子相间排列,每个Na+离子同时吸引6个Cl-离子,每个Cl-离子同时吸引6个Na+。
不同的离子晶体,离子的排列方式可能不同,形成的晶体类型也不一定相同。
离子晶体不存在分子,所以没有分子式。
离子晶体通常根据阴、阳离子的数目比,用化学式表示该物质的移动图片组成,如NaCl表示氯化钠晶体中Na+离子与Cl-离子个数比为1:1, CaCl2表示氯化钙晶体中Ca2+离子与Cl-离子个数比为1:2。
2.电性:离子晶体整体上具有电中性,这决定了晶体中各类正离子带电量总和与负离子带电量总和的绝对值相当,并导致晶体中正、负离子的组成比和电价比等结构因素间有重要的制约关系。
3.离子键:如果离子晶体中发生位错即发生错位,正正离子相切,负负离子相切,彼此排斥,离子键失去作用,故无延展性。
如CaCO3可用于雕刻,而不可用于锻造。
因为离子键的强度大,所以离子晶体的硬度高。
又因为要使晶体熔化就要破坏离子键,所以要加热到较高温度,故离子晶体具有较高的熔沸点。
离子晶体在固态时有离子,但不能自由移动,不能导电,溶于水或熔化时离子能自由移动而能导电。
因此水溶液或熔融态导电,是通过离子的定向迁移导电,而不是通过电子流动而导电。
离子晶体一般硬而脆,具有较高的熔沸点,熔融或溶解时可以导电。
高中化学离子晶体教案设计

高中化学离子晶体教案设计作为高中化学的一部分,离子晶体是一个重要的内容。
离子晶体是由离子组成的有序排列的结晶固体,由于其独特的物理和化学性质,有着广泛的应用。
本文将围绕离子晶体的基本概念、晶体结构、特性、制备以及应用等方面,结合教学内容,设计一份完整的化学教案,旨在帮助学生更好的掌握化学中离子晶体的相关知识。
一、教学目标1、了解离子晶体的基本概念,包括离子晶体是如何形成的,它们的化学组成,因离子晶体结构而产生的特殊性质等。
2、了解离子晶体的种类和晶体结构,包括简单离子晶体和复合离子晶体等。
3、了解晶体结构的模型,包括离子晶体的离子键模型、离子晶体的离子键/电子共价键模型等。
4、学习离子晶体的制备方法,包括凝胶法、熔融法、水热法等。
5、了解离子晶体的消光性质,了解偏振镜的基本原理,理解所观察到的消光现象。
6、学习离子晶体的应用,包括在生产生活中的应用和其它方面的应用。
二、教学方法1、讲授教学法通过教学的方式,讲解离子晶体的相关概念、结构、特性、制备以及应用等方面的内容,引导学生对离子晶体的认知。
2、实验教学法通过实验尝试,让学生对离子晶体的制备、消光、性质等方面的知识有更深入的了解,同时培养学生的实验操作能力和实验观察能力。
3、讨论教学法以小组讨论的方式,引导学生自觉思考问题,互相交流讨论,提高学生的能力和兴趣。
三、教学过程1、对离子晶体基本概念的讲解分别从离子晶体的形成、化学组成、特殊性质等方面进行讲解,引导学生了解离子晶体的形成及其特点。
了解离子晶体的化学组成,了解离子晶体的性质。
2、离子晶体的种类和晶体结构分别介绍了简单离子晶体和复合离子晶体的种类,从晶体结构的角度讲解了离子晶体的结构模型,包括离子键模型、离子键/电子共价键模型等方面的内容。
3、离子晶体的制备按照不同的制备方法,分别讲解凝胶法、熔融法、水热法等制备离子晶体的方法和步骤,并结合实验进行讲解。
4、离子晶体的消光特性通过实验,让学生亲身体验离子晶体的消光性质并了解偏振镜的基本原理,让学生观察到消光现象。
《离子晶体》ppt课件

( 配位数)
科学探究:
• 找出NaCl、CsCl两种离子晶体中阳离子和 阴离子的配位数,它们是否相等?
离子晶体 阴离子的配位数 阳离子的配位数
NaCl
6
பைடு நூலகம்
6
CsCl
8
8
13
(3)立方ZnS型(BeO、BeS)
14
NaCl CsCl
熔点℃ 801 645
沸点℃ 1413 1290
●阴阳离子间通过离子键结合而成的晶体。
食盐(晶体)的形成:
Na+Cl-CNl-a+NaCN+laN-+aC+l- Na+
Na+ClC- l-
NaC+ l-
Cl- NaN+a+NCa+l--
Na+
ClNa+ Cl-
Cl-
Na+
1
NaCl的晶体结构示意图
Cl2
Na+
每个Na+周围有六个Cl3
每个Cl-周围有六个Na+ 4
18、只要愿意学习,就一定能够学会。——列宁 19、如果学生在学校里学习的结果是使自己什么也不会创造,那他的一生永远是模仿和抄袭。——列夫·托尔斯泰
20、对所学知识内容的兴趣可能成为学习动机。——赞科夫 21、游手好闲地学习,并不比学习游手好闲好。——约翰·贝勒斯 22、读史使人明智,读诗使人灵秀,数学使人周密,自然哲学使人精邃,伦理学使人庄重,逻辑学使人善辩。——培根 23、我们在我们的劳动过程中学习思考,劳动的结果,我们认识了世界的奥妙,于是我们就真正来改变生活了。——高尔基 24、我们要振作精神,下苦功学习。下苦功,三个字,一个叫下,一个叫苦,一个叫功,一定要振作精神,下苦功。——毛泽东 25、我学习了一生,现在我还在学习,而将来,只要我还有精力,我还要学习下去。——别林斯基 13、在寻求真理的长河中,唯有学习,不断地学习,勤奋地学习,有创造性地学习,才能越重山跨峻岭。——华罗庚52、若不给自己设限,则人生中就没有限制你发挥的藩篱。
离子晶体ppt课件

【练一练】
4、MgO、Rb2O、CaO、BaO四种离子晶体熔点的高低顺序是( B ) A.MgO>Rb2O>BaO>CaO B.MgO>CaO>BaO>Rb2O C.CaO>BaO>MgO>Rb2O D.CaO>BaO>Rb2O>MgO
3、晶格能与离子晶体性质的关系
因为晶格能的大小标志着离子晶体裂解成气态阴、阳离子的难易程 度,反映着离子晶体中离子键的强度,故它与离子晶体的性质有着 密切联系。
比较项目离 子化合物
NaBr NaCl MgO
离子电荷 数 1 1 2
核间距 /pm 298 282 210
晶格能 /kJ·mol-1
747 786 3791
8
4
4
阳离子的配位数 6
8
4
8
(2)影响配位数的因素
①几何因素:晶体中正、负离子的半径比。离子半径比值越大, 配位数就越大 (见下表)
离子晶体 NaCl CsCl ZnS
正、负离子半径比(r+/r-) r+/r-=0.52(0.414~0.732) r+/r-=0.93(0.732~1.00) r+/r-=0.27(0.225~0.414)
【练一练】
1、仅由下列各组元素所构成的化合物,不可能形成离子晶体的是 (A )
A.H、O、S B.Na、H、O C.K、Cl、O D.H、N、Cl 2、下列关于离子化合物的叙述正确的是( C ) A.离子化合物中都只含有离子键 B.离子化合物中的阳离子只能是金属离子 C.离子化合物如能溶于水,其所得溶液一定可以导电 D.溶于水可以导电的化合物一定是离子化合物
①1个CaF2的晶胞中,有4个Ca2+,有4个F- ②CaF2的晶体中,Ca2+和F-的配位数不同, Ca2+配位数是8,F-的配位数是4源自5、离子晶体中离子的配位数
离子晶体

小结2:晶体熔沸点高低的判断 ⑴不同晶体类型的熔沸点比较
一般:原子晶体>离子晶体>分子晶体 金属晶体熔点差异性太大,一般不纳入比较 ⑵同种晶体类型物质的熔沸点比较 ①离子晶体: 阴、阳离子电荷越多,半径越小
熔沸点越高
Hale Waihona Puke ⑵同种晶体类型物质的熔沸点比较
②原子晶体:
原子半径越小→键长越短→键能越大
③分子晶体:
离子晶体熔融态均导电、溶于水导电;分子 晶体为非导体,部分分子溶于水能导电,原子 晶体多为非导体,有些为半导体,如:硅、锗
5)依据硬度和机械性能判断:
原子晶体硬度大,离子晶体硬度介于原子晶体 和分子晶体之间且脆,分子晶体硬度小
②阴、阳离子配位数均为:8 ③每个Cs+ 周围最近的等距离的Cs+ 有6个, 每个Cl- 周围最近的等距离的Cl- 有6个; ④不存在单个的CsCl分子,每个晶胞平均 含Cs+ 和Cl-各1个。化学式CsCl仅表示该离子 晶体中阴、阳离子的个数比为1:1.
科学探究:
离子晶体 阴离子的配位数 阳离子的配位数
熔沸点越高
相对分子质量越大(注意氢键),分子的极性越大
④金属晶体:
熔沸点越高
金属阳离子电荷数越多,半径越小
熔沸点越高
小结3:判断晶体类型的方法
1)依据组成晶体的微粒和微粒间的作用力判断:
构成离子晶体的微粒是离子,作用力是离子键; 构成原子晶体的微粒是原子,作用力是共价键;构 成分子晶体的微粒是分子,作用力是分子间作用力。
3.2 2.5 <2.5 <2.5 6.5 4.5 3.5 3.3
晶格能越大,形成的离子晶体越稳定,而 且熔点越高,硬度越大。
2、晶格能的大小的影响因素
离子晶体

•
Wi
Wa
•
从元素周期表中看,Ⅰ族元素的电负性最小,Ⅶ族元素电负性最大。 对每一族元素来看,随着周期数的增加,原子的电负性减小。这是由 于原子核内质子越多,原子核对外层电子的吸引力越强;电子层数越 多,原子半径越大,原子核对最外层电子吸引力越小。
1.2 晶体原子间的排斥吸引
• 晶体中个原子间总是同时存在吸 引力和排斥力,如图,排斥力仅 是当r较小的时候才出现的短程 力,当r稍大就很快衰减
离子晶体
ggg21004
离子晶体名词解释
•
•
由正、负离子或正、负离子集团按一定的比例通过离子键结合形成的晶 体。 价电子由一种原子完全转移到另一种原子上形成正、负离子,正负离子 之间的静电吸引(库仑力)使彼此结合到一起。
目录
1 2
离子对的形成
电离能、亲和能及电负性、晶体原子间的排斥吸引
离子晶体的内能
解离能、内聚能
一、离子对的形成 1.1 电离能、亲和能及电负性
• • • 总体来说这三个物理量均反映了原子对价电子的束缚能力 电离能:一个价电子摆脱原子A的束缚必须对它施加的能量。
A Wi A e A (e) A Wi
6. 3
亲和能:一个中性电子从外界获得一个电子而转变为负电子时可以 释放的能量。 为了总体描述原子对价电子的束缚能力而引入电负性概念,定义为 : 1
所以当以孤立原子能量总和为零起点时,离子晶体内能为:
Uc U吸引 (r0) U排斥 (r0) (Wi Wa )
A
B
•
各公式
•
又由晶体间排斥吸引能图中r0点几何意义可算得:
•
所以结合以上可得:若以独立原子系统总内能为零基准,则离子系统 内能为:
离子晶体

2.有一AB型离子晶体,正负离子半径比为0.57,则正离 子的配位数为( )
A.4 B.6 C.8 D.12 3.AgF属于NaCl型晶体,一个晶胞中含( )个Ag +?
A. 6 B.4 C.2 D.1
例题2:KCl属于NaCl型晶体,实验测得晶胞参 数a=6.28 Å,已知Cl-半径为1.81 Å,求K+半径?
2a 2r 3a 2(r r )
3 (r r ) 2 a
3 2 ( 2r )
6 2 r 1.225r r / r 0.225
三配位的正三角形空隙
r r 2 r sin
60 2 3
2 r
3 2 23
2 r 3
1 . 155
r
r / r 0 . 155
这是三配位时半径比的最低临界值。
从理论上讲小于此值时 CN+会下降, 但大于此值时 CN+并不会立即上升, 而是要达到下一个更大临界值时才会
上升。后面讲到的临界值也都是如此。
离子半径比与配位数的关系
r+/r-= 0.155 0.225 0.414 0.732 1
CN+= 3
46
8
(12)
配位体 正三角形 正四面体 正八面体 正方体
每个晶胞含 有4个Na+和Cl-, 结构基元1个Na+, 一个或Cl- .
正负离子配位数之比 CN+/CN- =6:6 CN+=6 CN-=6
正离子所占空隙种类: 正八面体
正八面体空隙 (CN+=6)
例题1:选择
1.NaCl晶体的结构基元为( )
A. 一个Na+
ቤተ መጻሕፍቲ ባይዱ
B.一个正当晶胞
离子晶体定义

离子晶体定义离子晶体是一种特殊的晶体,其结构由离子而不是分子构成。
离子晶体在晶体结构中担当电极,以强烈的离子相互作用电聚变作用把原子排列到晶体晶格中,使其形成晶体结构。
离子晶体有多种性质,包括电导性、热性能、光学性能和磁性能。
离子晶体有许多不同的种类,其中最常贴近的是钙钛矿晶体、钙和镧晶体。
钙钛矿晶体是一种具有电极的离子晶体,由钙和钛的离子构成,具有卓越的光学性能和非常好的热性能,例如太阳能电池。
钙和镧晶体是一种具有色素特性的离子晶体,由钙和镧的离子构成,具有卓越的热稳定性和一定的热敏性,用于制造色变器件。
离子晶体的研究主要集中在结构和性能的探索上。
研究人员正在研究电聚变作用如何影响晶体的结构,以及离子晶体的性质和结构如何影响其光学性质、热性能和磁性能。
这些研究对许多应用领域的性能有着重大作用,包括制造军事装备,制备光器件和电子器件,以及分析材料和环境。
离子晶体的发展可以追溯到20世纪60年代,当时研究人员把他们的研究重点放在晶体结构的研究上,将离子以规则方式排列在晶体中,从而构成离子晶体结构。
此后,随着研究和技术的发展,离子晶体在各个领域逐步得到应用,今天已经成为科学研究和工业应用的重要分支。
离子晶体除了具有独特的晶体结构外,还具有各种特殊的性质,因而在许多领域得到应用。
离子晶体在制备太阳能电池和固态照明器件中发挥着重要作用;广泛用于电子器件的制备,例如芯片,显示器,电路板和电阻等;用于分析材料和环境中的电荷;广泛用于生物研究,例如荧光成像和免疫组化;广泛用于军事装备的制造,例如目标探测和传感器,以及穿戴式智能装置的制造。
离子晶体技术正在不断发展,研究人员正在努力开发出新的离子晶体材料,通过改变离子晶体的结构和性质,探索以更高效的方式制备多种用途的器件。
例如,研究人员正在利用离子晶体技术开发新型的太阳能电池,以高效地将光能转换为电能;正在利用离子晶体技术开发新型的灯具,以更加高效地将电能转换为光能;正在开发新型的非晶材料,以提高热性能和电导率,并且具有良好的电学稳定性。
离子晶体的名词解释

离子晶体的名词解释离子晶体是一种固态物质,由离子构成的有序排列形成晶格结构。
离子是带有正电荷或负电荷的原子或分子,在形成晶体结构时通过静电力互相聚集在一起。
离子晶体通常具有高熔点、高硬度和良好的导电性能,因此在许多领域有着广泛的应用。
1. 离子与晶格离子晶体的基本结构是由正离子和负离子组成的晶格。
正离子和负离子之间通过静电相互作用力形成稳定的晶格结构。
正离子和负离子的数目必须相等,以保持整体电中性。
离子晶体的晶格结构对其性质起着重要的影响。
2. 离子晶体的物理性质离子晶体通常具有高熔点和高硬度。
这是因为在离子晶体中,正离子和负离子之间的静电相互作用力较强,需要很高的能量才能破坏这种结构。
因此,离子晶体往往具有非常稳定的结构。
此外,离子晶体还具有良好的光学性能。
离子晶体中的离子对光的吸收和发射起着重要作用,因此离子晶体通常具有特殊的光学效应,例如双折射和荧光。
3. 离子晶体的导电性由于离子晶体中带电离子的存在,它们通常具有良好的导电性能。
当离子晶体受到外界电场的作用时,带电离子会迅速在晶体内部移动,从而产生电流。
这种特性使离子晶体被广泛应用于电池、电解质和导电材料等领域。
4. 离子晶体的应用离子晶体在日常生活中有着广泛的应用。
其中一个典型的应用是在电子设备中的显示技术。
例如,液晶显示屏就是一种以离子晶体为基础的显示技术。
液晶分子具有可控的旋转和排列方式,通过控制电场来改变液晶分子的排列状态,从而实现图像的显示。
此外,离子晶体还常用于人工合成宝石的制备。
通过控制离子的成分和结构,制造出具有与天然宝石相似甚至更好的光学性能的合成宝石。
另外,离子晶体还在能源领域有着重要的应用。
例如,某些离子晶体在高温下具有良好的离子导电性能,可以用于制造固体氧化物燃料电池。
总之,离子晶体作为一种固态物质,在物理性质、导电性以及应用方面都具有独特的特点和广泛的应用前景。
通过深入研究离子晶体的结构和性质,我们可以更好地理解和应用这种材料,推动科学技术的发展。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1、定义:由阳离子和阴离子通过离
晶体。
子键结合而成的
2、成键粒子:阴、阳离子
3、相互作用力:离子键 4、常见的离子晶体:
强碱、活泼金属氧化物、大部分的盐 类。
5、晶胞类型: (1)氯化钠型晶胞
Na+Cl-CNl-a+NaCN+laN-+aC+l- Na+
Na+ClC- l-
NaC+ l-
Cl- NaN+a+NaCC+ll--
差别较大
差别较大
无(硅为半导体) 无
导体
实例
金刚石、二氧化硅、 晶体硅、碳化硅
Ar、S等
Au、Fe、Cu、钢 铁等
氯化钠晶体 实用文档
粉末状氯化钠晶体 实用文档
3.4离子晶体
氯化钠的形成过程: 2Na + Cl2 == 2NaCl
Na
+11
+17
Cl
Na+
+11
+17
Cl-
Na+ Cl-
一、离子晶体
NaCl的晶体结构模型
---Cl- --- Na+
NaCl晶体中阴、阳离子配位数
(2)氯化铯型晶胞
CsCl的晶体结构及晶胞构示 意图
---Cs+ ---Cl-
CsCl晶胞
(1)铯离子和氯离子的位置:
铯离子:体心
氯离子:顶点;或者反之。
(2)每个晶胞含铯离子、氯 离子的个数 铯离子:1个 ;氯离子:1 (个3)与铯离子等距离且最近 的铯离子、氯离子各有几个?
Na+
ClNa+ Cl-
Cl-
Na+
Cl- Na+ Na+
Cl- NaC-+ l
Na+ ClNa+
NaC+ l-
Cl-
Na+
Cl-
Na+ Cl-
Na+
Cl-
Cl- Na+ Na+
NaC-+ l
ClNa+
ClNa+
可见:在NaCl晶 体中,钠离子、 氯离子按一定的 规律在空间排列 成立方体。
氯化钠的晶胞
二、晶格能
❖ 定义:气态离子形成1摩离子晶体时释放的
能量。 仔细阅读表3—8,分析 ❖ 晶格能的晶大格小能与阴的、大阳小离与子离所子带晶电荷的乘积
成正比,体与的阴熔、阳点离有子什间么的关距系离?成反比。 简言之,晶格离能子的大晶小体与的离子晶带格电能量与成正哪比,与离子半
径成反比. 晶些格因能素越有大关:?
铯离子:6个 ;氯离子:8
(3)CaF2型晶胞
①Ca2+的配位数: 8 ②F-的配位数: 4
③一个CaF2晶胞中含: 4 个Ca2+和 个F-
8
(4)ZnS型晶胞
①阳离子的配位数:4 ②阴离子的配位数:4 ③一个ZnS晶胞中含: 4个阳离子和4个阴离子
科学探究:
❖ 找出CsCl、NaCl两种离子晶体中阳离子和阴 离子的配位数,它们是否相等?
总结一
❖ 离子晶体有什么特点? 无单个分子存在;NaCl不表示分子式。 熔沸点较高,硬度较大,难挥发难压缩。 且随着离子电荷的增加,核间距离的缩短 ,晶格能增大,熔点升高。
一般易溶于水,而难溶于非极性溶剂。 固态不导电,水溶液或者熔融状态下能导
电。
❖ 哪些物质属于离子晶体? 强碱、部分金属氧化物、部分盐类。
形成的离子晶体越稳定;(离子键越强)
熔点越高;硬度越大。 晶格能 q1q2 r
【总结归纳二】
物质的熔点与晶体类型的关系 1、若晶体类型不同,一般情况下:原子晶体>离子晶 体>分子晶体。 2、若晶体类型相同,则有: ⑴离子晶体中,结构相似时,离子半径越小,离子电荷 越高,晶格能越大,离子键就越强,熔点就越高。 ⑵原子晶体中,结构相似时,原子半径越小,共价键键 长越短,键能越大,熔点越高。 ⑶分子晶体中(不含氢键时),分子组成和结构相似时, 相对分子质量越大,范德华力就越强,熔点就越高。 ⑷金属晶体中,离子半径越小,离子电荷越高,金属键 就越强,熔点就越高。合金的熔点比它的各成分金属的熔 点低。
离子晶体 NaCl CsCl
阴离子的配位数
6 8
阳离子的配位数
6 8
决定离子晶体结构的因素
❖几何因素
晶体中正负离子的半径比
❖电荷因素
晶体中正负离子的电荷比
❖键性因素
离子键的纯粹程度(纯粹因素)
科学视野
[阅读思考] 碳酸盐热分解的实质是什么?
表3-7的有关数值说明 了什么?
组成碳酸盐中阳离子的金属的 金属性越弱,金属阳离子的半径越小, 碳酸盐的热稳定性越差,反之越好。
练习
❖ 1、下表列出了有关晶体的知识,其中错误的是( B )
A
B
C
D
晶体
硫化钾 干冰 金刚石 碘
组成晶体的微粒 阴阳离子 分子 原子 分子
晶体微粒间存在的 离子键 作用力
共价键 共价键 范德华力
❖ 2、下列物质的晶体,按其熔点由低到高的排列顺序正确的 是( C )
A.NaCl、SiO2、CO2 B.NaCl、CO2、SiO2 C.NaCl、MgO、SiO2 D.NaCl、SiO2、MgO ❖ 3、用离子的电荷和半径解释下列离子晶体熔点高低的顺序
实例
KBr AgCl、 MgO、CaS、 BaSe
CsCl、CsBr、 CsI、TlCl
ZnS型
Zn2+: 4
Zn2+:4 ZnS、AgI、
S2-: 4 ----------- S2-: 4 BeO
AB2 CaF2 型
Ca2+: 8 ----------F-: 4
实用文档
Ca2+: 4 F-: 8
碱土金属卤化 物、碱金属氧 化物。
知识回顾:三种晶体类型与性质的比较
Байду номын сангаас
晶体类型
概念
作用力
构成微粒 熔沸点
物 理 硬度 性 质 导电性
原子晶体
相邻原子之间以共价 键相结合而成具有空 间网状结构的晶体
分子晶体
金属晶体
分子间以范德 华力相结合而
成的晶体
通过金属键形成的 晶体
共价键
范德华力
金属键
原子
很高 很大
分子 很低 很小
金属阳离子 和自由电子
(1)钠离子和氯离子的位置:
①钠离子和氯离子位于立方体的顶角上,并交错排列。 ②钠离子:体心和棱中点;氯离子:面心和顶点,或者 反之。
(2)每个晶胞含钠离子、氯离子的个数 计算方法:均摊法 顶点占1/8;棱占1/4;面心占1/2;体心占1
(3)与Na+等距离且最近的Na+ 、Cl- 各有几个?
与Na+等距离且最近的Na+ 有: 12个 与Na+等距离且最近的Cl- 有: 6个
各类型离子晶体晶胞的比较
晶体 晶胞 类型 类型
晶胞结构 示意图
距离最近 每个晶 配位数 且相等的 胞含有
相同离子 离子数
NaCl 型
Na+: 6 Na+: 12 Na+: 4 Cl-: 6 Cl-: 12 Cl-: 4
AB CsCl 型
Cs+: 8 Cs+: 6 Cl-: 8 Cl-: 6
Cs+:1 Cl-:1
