初三化学教案-几种常见的酸
九年级化学常见的酸和碱教案

九年级化学常见的酸和碱教案九年级化学常见的酸和碱教案(精选6篇)作为一位不辞辛劳的人民教师,通常会被要求编写教案,编写教案助于积累教学经验,不断提高教学质量。
来参考自己需要的教案吧!以下是店铺帮大家整理的九年级化学常见的酸和碱教案,供大家参考借鉴,希望可以帮助到有需要的朋友。
九年级化学常见的酸和碱教案篇1教学目标:学会用pH试纸测溶液的酸碱度;能用所学的知识和方法去测试一些物质的pH。
通过对各种操作的比较及对测试数据的分析,建立正确的测试和读数方法。
让学生自主测试,拓展活动的空间,培养尊重事实的观念和关注生活、关注社会的意识。
教学疑点:不同生长时期的水果和蔬菜pH是否相同,建议测不同生长时期番茄pH进行了解。
观察头发光泽需要哪些条件,建议增强光线和利用放大镜观察。
头发耐拉力,用手拉能否准确感知?建议用测力计去测更科学。
为使测出的数据具有科学性,可引导学生取几次的平均值。
重点和难点:测试方法。
活动方式:学生主持;分组实验。
实验准备:①分组准备:每组有5个烧杯分别装20 mL pH为1、4、7、10、13的溶液,头发五束(同一个人的头发)。
②稀硫酸、稀盐酸、蒸馏水、氢氧化钠溶液。
③洁厕精、醋、洗洁精、石灰水、牙膏、西红柿、牛奶、鸡蛋、萝卜、纯碱溶液、草木灰水、泡菜水、橘子、苹果、造纸厂排放的废水、点滴板、pH试纸、玻璃棒、镊子、小刀、纱布、放大镜、弹簧秤等。
教学过程:师:先请同学们将5束头发分别放进盛有不同pH(1、4、7、10、13)溶液的小烧杯中,等会观察。
师:再请同学们看61页内容,回答,我们从书中获得了哪些信息?生1:溶液的pH<7显酸性,ph>7显碱性,pH=7显中性。
生2:测定pH的最简单的方法是用pH试纸。
反思:让每位学生都有机会做主持,本身就是对能力的训练,把讲台让给学生,同学们相互理解与支持,合作有了更大的自主空间,行为和表达更具有学生自身的特点。
但主持人和同学们是处于同一知识平台,随时需要老师的指点,老师在课前要帮助主持人理好提纲。
九年级常见的酸教案

九年级常见的酸教案教案标题:探索酸的性质与应用教学目标:1. 理解酸的性质与特征。
2. 掌握常见酸的命名与化学式。
3. 了解酸的应用领域。
教学重点:1. 酸的性质与特征。
2. 常见酸的命名与化学式。
教学难点:1. 酸的应用领域。
教学准备:1. 实验室用具和试剂:盐酸、硫酸、醋酸等。
2. 多媒体设备及相关教学资源。
教学过程:一、导入(5分钟)通过展示一张有关酸的图片或视频,引起学生对酸的兴趣,并激发学生的思考,如:“你们平时都接触过哪些酸性物质?它们有什么特点?”二、理论讲解(15分钟)1. 介绍酸的定义和性质,包括酸的味道、腐蚀性、导电性等。
2. 解释酸的离子理论和酸的电离过程。
3. 引导学生了解常见酸的命名规则和化学式,如盐酸(HCl)、硫酸(H2SO4)、醋酸(CH3COOH)等。
三、实验操作(30分钟)1. 分组进行实验操作,每组提供不同的酸性物质。
2. 学生通过实验现象和实验结果,观察和验证酸的性质与特征,如酸与金属的反应、酸与碱的中和反应等。
四、实验结果分析与讨论(15分钟)1. 学生根据实验结果,总结酸的性质与特征。
2. 学生分享实验中观察到的现象和对酸的理解,进行讨论和交流。
五、拓展应用(15分钟)1. 引导学生了解酸的应用领域,如酸的工业应用、生活中的酸等。
2. 分组小研究:学生自主选择一个酸的应用领域进行研究,并撰写一份小研究报告。
六、小结与评价(5分钟)对本节课的重点内容进行小结,并进行学生的评价和反馈。
教学延伸:1. 学生可进一步了解酸的强弱和pH值的概念。
2. 学生可进行更多的实验操作,探索酸与其他物质的反应。
教学评价:1. 观察学生在实验中的操作情况和实验结果的准确性。
2. 评价学生在讨论中的参与度和思考深度。
3. 评价学生撰写的小研究报告的内容和表达能力。
教学反思:通过本节课的教学,学生能够全面了解酸的性质与特征,掌握常见酸的命名与化学式,并了解酸的应用领域。
同时,通过实验操作和讨论,学生的动手能力和合作精神得到了锻炼。
最新初中教案-几种常见的酸4 精品
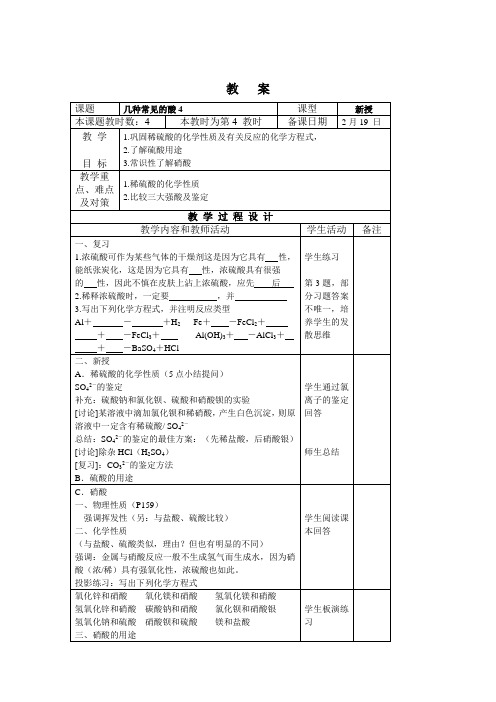
课题
几种常见的酸4
课型
新授
本课题教时数:4
本教时为第4教时
备课日期
2月19日
教学
目标
1.巩固稀硫酸的化学性质及有关反应的化学方程式,
2.了解硫酸用途
3.常识性了解硝酸
教学重点、难点及对策
1.稀硫酸的化学性质
2.比较三大强酸及鉴定
教学过程设计
教学内容和教师活动
学生活动
某些气体的干燥剂这是因为它具有性,能纸张炭化,这是因为它具有性,浓硫酸具有很强
的性,因此不慎在皮肤上沾上浓硫酸,应先后
2.稀释浓硫酸时,一定要,并
3.写出下列化学方程式,并注明反应类型
Al+-+H2Fe+-FeCl2+
+-FeCl3+Al(OH)3+-AlCl3+
+-BaSO4+HCl
学生练习
第3题,部分习题答案不唯一,培养学生的发散思维
二、新授
A.稀硫酸的化学性质(5点小结提问)
师生总结
C.硝酸
一、物理性质(P159)
强调挥发性(另:与盐酸、硫酸比较)
二、化学性质
(与盐酸、硫酸类似,理由?但也有明显的不同)
强调:金属与硝酸反应一般不生成氢气而生成水,因为硝酸(浓/稀)具有强氧化性,浓硫酸也如此。
投影练习:写出下列化学方程式
学生阅读课本回答
氧化锌和硝酸氧化镁和硝酸氢氧化镁和硝酸
2.硝酸
3.三大强酸的鉴别
教后记
授课日期_____月______日
SO42-的鉴定
补充:硫酸钠和氯化钡、硫酸和硝酸钡的实验
[讨论]某溶液中滴加氯化钡和稀硝酸,产生白色沉淀,则原溶液中一定含有稀硫酸/ SO42-
总结:SO42-的鉴定的最佳方案:(先稀盐酸,后硝酸银)
九年级化学几种常见的酸教案

一、教学目标:1.了解常见的酸的种类及其化学式;2.了解酸的常见性质;3.掌握酸的分类和命名规则;4.了解酸在生活中常见的应用。
二、教学内容:1.常见酸的种类及其化学式;2.酸的常见性质;3.酸的分类和命名规则;4.酸在生活中的应用。
三、教学过程:第一课时:常见酸的种类及其化学式1.导入(5分钟):向学生展示一些常见的酸的实物或图片,如盐酸、硫酸、柠檬酸等,引导学生回忆并讨论这些酸在生活中的应用。
2.导入活动(15分钟):分组让学生自愿报名,每组选择一种常见酸,然后在课堂上给其他学生简单介绍这种酸的性质、应用和化学式。
每组成员分别介绍一点,确保每个学生都参与到小组活动中。
3.拓展(10分钟):老师展示常见酸的种类和化学式的列表,让学生进行集体讨论,准确列出这些酸的化学式。
老师指导学生回顾酸的性质和特点,引导学生自主发现和总结。
第二课时:酸的常见性质1.导入(5分钟):简单回顾上节课学习的酸的种类和化学式。
然后提出问题,引导学生思考酸在溶液中的酸性特征是由什么因素决定的。
2.实验环节(20分钟):让学生观察实验现象,并与学生进行分组讨论,然后归纳出酸的常见性质。
以下是一些实验活动的建议:a.试纸颜色变化实验:将不同酸溶液滴在相应的试纸上,学生观察试纸颜色的变化;b.金属与酸反应实验:将不同金属放入不同的酸中,学生观察反应和气体的产生。
3.总结(10分钟):老师和学生一起总结酸的常见性质,并通过对实验结果的分析,引导学生理解这些性质背后的原理。
第三课时:酸的分类和命名规则1.导入(5分钟):简单回顾前面两节课学习的酸的种类和性质。
2.知识讲解(20分钟):讲解酸的分类和命名规则,并通过例题让学生进行练习,确保学生掌握酸的分类和命名规则。
3.拓展(10分钟):提供一些复杂化学式的酸,让学生尝试进行命名,加深对酸命名规则的理解。
第四课时:酸的应用1.导入(5分钟):回顾前面三节课学习的内容,引导学生思考酸在生活中的应用。
人教版化学九年级下册《常见的酸》教案

人教版化学九年级下册《常见的酸》教案一. 教材分析人教版化学九年级下册《常见的酸》是学生在初中阶段学习的最后一部份内容,对学生理解和掌握酸的性质有着重要的意义。
本节课通过介绍几种常见的酸,如盐酸、硫酸、硝酸等,使学生了解酸的化学性质,如酸碱中和反应、金属与酸的反应、非金属与酸的反应等,从而使学生能够运用所学知识解释生活中的现象。
二. 学情分析学生在学习本节课之前,已经学习了酸、碱、盐的相关知识,对化学方程式的书写、物质的性质等有了一定的了解。
但学生的知识水平参差不齐,对酸的性质的理解和运用能力不同,因此,在教学过程中要注重因材施教,引导学生通过自主学习、合作学习等方式,提高对酸的性质的理解和运用能力。
三. 教学目标1.让学生了解几种常见酸的化学性质,如酸碱中和反应、金属与酸的反应、非金属与酸的反应等。
2.培养学生运用化学知识解释生活中的现象的能力。
3.提高学生自主学习、合作学习的能力。
四. 教学重难点1.几种常见酸的化学性质的理解和运用。
2.酸碱中和反应、金属与酸的反应、非金属与酸的反应的原理。
五. 教学方法采用“问题驱动”的教学方法,引导学生通过自主学习、合作学习等方式,发现问题、解决问题,从而提高学生对酸的性质的理解和运用能力。
六. 教学准备1.准备几种常见酸的实验试剂,如盐酸、硫酸、硝酸等。
2.准备相关的实验器材,如试管、烧杯、滴定管等。
3.准备相关的教学课件和教学素材。
七. 教学过程1.导入(5分钟)通过展示一些生活中的现象,如铁器生锈、胃药的成分等,引导学生思考这些现象与酸的性质有什么关系,从而激发学生的学习兴趣。
2.呈现(10分钟)教师通过PPT展示几种常见酸的化学性质,如酸碱中和反应、金属与酸的反应、非金属与酸的反应等,同时进行讲解,让学生对这些性质有清晰的认识。
3.操练(15分钟)学生分组进行实验,观察几种常见酸与金属、非金属的反应,记录实验现象,从而加深对酸的性质的理解。
4.巩固(10分钟)学生通过回答问题、讨论等方式,巩固所学知识,提高运用能力。
几种常见的酸 教案三

几种常见的酸教案三【教学目标】1.了解几种常见的酸的性质和用途。
2.学会正确使用酸溶液进行实验操作。
3.培养学生的观察能力和实验操作能力。
【教学重点】1.几种常见酸的性质和用途。
2.酸溶液的实验操作。
【教学难点】1.酸溶液的实验操作技巧。
2.酸的性质和用途的理解。
【教学准备】1.实验室用具:试管、滴管、烧杯、玻璃棒等。
2.实验试剂:硫酸、盐酸、硝酸、醋酸等。
3.教案、PPT等教学辅助材料。
【教学过程】一、导入1.引导学生回顾之前学过的酸的概念和性质。
2.提问:同学们,我们之前学过哪些酸?它们有什么性质和用途呢?二、探究几种常见的酸的性质1.硫酸a.介绍硫酸的物理性质:无色、粘稠的液体。
b.介绍硫酸的化学性质:强酸,具有腐蚀性。
c.介绍硫酸的用途:制造肥料、农药、火药等。
2.盐酸a.介绍盐酸的物理性质:无色、有刺激性气味的气体。
b.介绍盐酸的化学性质:强酸,具有腐蚀性。
c.介绍盐酸的用途:制造氯化物、盐酸溶液等。
3.硝酸a.介绍硝酸的物理性质:无色、有刺激性气味的液体。
b.介绍硝酸的化学性质:强酸,具有腐蚀性。
c.介绍硝酸的用途:制造肥料、火药、染料等。
4.醋酸a.介绍醋酸的物理性质:无色、有刺激性气味的液体。
b.介绍醋酸的化学性质:弱酸,具有腐蚀性。
c.介绍醋酸的用途:食品调味、制造醋酸纤维等。
三、实验操作1.实验一:观察硫酸和盐酸的反应a.准备试管、滴管、硫酸溶液、盐酸溶液。
b.将硫酸溶液滴入盐酸溶液中,观察反应现象。
c.记录实验结果,分析原因。
2.实验二:观察硝酸和醋酸的反应a.准备试管、滴管、硝酸溶液、醋酸溶液。
b.将硝酸溶液滴入醋酸溶液中,观察反应现象。
c.记录实验结果,分析原因。
2.反思实验操作中的注意事项和技巧。
3.提问:同学们,通过本节课的学习,你们对几种常见的酸有什么新的认识和体会?五、作业布置1.复习几种常见酸的性质和用途。
2.完成实验报告。
【教学反思】1.在实验操作中,要强调安全注意事项,避免学生受伤。
化学教案-几种常见的酸:盐酸

化学教案-几种常见的酸:盐酸课程名称:化学课时:1课时教学内容:几种常见的酸:盐酸教学目标:1. 了解盐酸的定义和性质;2. 掌握盐酸的制备方法;3. 了解盐酸在日常生活和工业中的应用。
教学准备:1. 盐酸的化学式和分子结构模型;2. 实验室用具和试剂:氯气、氢气、盐酸。
教学步骤:第一步:导入(5分钟)通过提问和讨论,引导学生回顾酸的概念,以及常见的酸和碱的性质。
第二步:讲解盐酸的定义和性质(10分钟)1. 向学生介绍盐酸的化学式HCl和分子结构模型,解释盐酸是一种单质酸。
2. 引导学生回顾盐酸的性质:a. 盐酸是无色、刺激性气味的液体;b. 盐酸可以与金属反应生成对应的氯化物和氢气;c. 盐酸可以与碱反应生成盐和水;d. 盐酸可以与金属碱土和过渡金属氧化物反应。
第三步:讲解盐酸的制备方法(10分钟)1. 示范盐酸的制备实验过程。
2. 介绍盐酸的两种主要制备方法:a. 通过氢气和氯气的直接反应制备盐酸:H2 + Cl2 → 2HCl;b. 通过氯气和水的反应制备盐酸:Cl2 + H2O → HCl + HClO。
第四步:讨论盐酸的应用(15分钟)1. 通过案例分析和学生参与讨论,介绍盐酸在日常生活和工业中的应用,如:a. 在实验室中用作酸碱中和反应的试剂;b. 在冶炼和电镀过程中用作脱氧剂和氧化剂;c. 在制药工业中用于制备药物;d. 在清洁卫生产品和消毒剂中的应用。
第五步:小结和课堂练习(5分钟)对本节课学习的内容进行小结,并提问学生盐酸的性质和应用,检查学生对本节课内容的掌握情况。
教学扩展:提供实验机会,让学生进行盐酸制备实验,进一步巩固对盐酸性质和制备方法的理解。
教学评价:1. 教师对学生的课堂表现进行观察和评估;2. 课后布置相关练习题进行作业;3. 学生提交实验报告,评价实验的设计和操作能力。
九年级化学下册《几种常见的酸》教案、教学设计

6.课后布置实践性作业,让学生观察生活中与酸相关的现象,并尝试用所学知识解释,提高学生的理论联系实际能力。
7.定期组织小组讨论,让学生分享学习心得,互相借鉴,共同提高。
2.注重启发式教学,激发学生的思维,培养他们分析问题和解决问题的能力。
3.针对学生个体差异,实施分层教学,使每个学生都能在原有基础上得到提高。
4.加强对学生的学法指导,培养他们自主学习和合作学习的能力,提高学习效率。
三、教学重难点和教学设想
(一)教学重点
1.掌握几种常见酸的性质、制备方法和应用。
2.学会使用酸碱指示剂,判断溶液的酸碱性。
(二)过程与方法
在教学过程中,采用以下方法使学生达到教学目标:
1.采用启发式教学,引导学生通过观察实验现象,发现酸的化学性质。
2.利用小组合作学习,让学生在讨论、交流中掌握酸的相关知识。
3.设计实验,让学生亲自动手操作,培养实验操作能力和观察能力。
4.通过对生活中的实际案例进行分析,培养学生理论联系实际的能力。
2.创设生活情境,让学生了解酸在日常生活和工业中的应用,提高学生的学习兴趣。如讲解醋酸时,可以举例说明其在食品、药品等方面的应用。
3.利用多媒体辅助教学,通过动画、图片等形式,直观地展示酸的微观结构和反应过程,降低学习难度。
4.教学过程中,注重师生互动,鼓励学生提问、发表观点,充分调动学生的主观能动性。
九年级化学下册《几种常见的酸》教案、教学设计
一、教学目标
(一)知识与技能
1.了解常见酸的定义、性质和分类,包括盐酸、硫酸、硝酸和醋酸等。
人教版初中化学常见的酸教案

人教版初中化学常见的酸教案
教学目标:
1. 了解常见的酸,包括硫酸、盐酸、硝酸等;
2. 了解酸的性质和应用;
3. 掌握酸的一般性质,包括呈酸性、与金属生成氢气等;
4. 能够正确区分常见酸的性质和用途。
教学重点与难点:
重点:常见酸的性质和应用;
难点:酸与金属生成氢气的反应机理。
教学准备:
1. 实验器材:试管、试管架、玻璃棒等;
2. 实验药品:稀盐酸、稀硫酸、锌粒等;
3. 图片或视频资料:展示不同酸的分子结构和应用场景。
教学过程:
一、导入(5分钟)
介绍酸的概念和常见的酸的名称,引出本节课的主题。
二、讲解酸的基本性质(10分钟)
1. 酸的定义:酸是一类常见的化合物,能在水中产生质子(H+)的物质;
2. 酸性:探讨酸的呈酸性的特征,如酸液的酸味、酸液的导电性等;
3. 与金属反应:介绍酸与金属生成氢气的反应机理。
三、实验操作(15分钟)
1. 实验一:硫酸与锌的反应;
2. 实验二:盐酸与铁的反应;
3. 实验三:硝酸与镁的反应。
四、实验结果分析(10分钟)
根据实验结果,让学生总结不同酸与金属的反应特点和产生的气体。
五、应用拓展(10分钟)
分组讨论不同酸的应用领域和方法,展示不同酸在生活和工业中的应用。
六、课堂小结(5分钟)
回顾本节课的重点内容,强调学生掌握的知识点,鼓励学生深入学习酸的更多性质和应用。
教学反思:
通过本教案的设计和实施,学生可以深入了解常见的酸的基本性质和应用,培养学生的实
验探究能力和科学思维能力,激发学生对化学知识的兴趣和学习动力。
常见的酸和碱教案优秀9篇

常见的酸和碱教案优秀9篇【设计理念】2.教师主导,学生主体,为学生创造问题情境,启发学生思考,激活学生思维,培养学生能力。
【复习目标】1.了解几种常见酸和碱的物理性质和化学性质。
2.会用酸碱指示剂检验溶液的酸碱性,会用ph试纸检验溶液的酸碱度。
【教学方法】实验探究法。
问题探究法。
讨论归纳等【复习流程】一、酸和碱的概念1.酸常见酸的化学式:2.碱常见能溶于水的碱的化学式:二、酸和碱的物理性质浓硫酸浓盐酸状态气味密度打开瓶口的现象naohca(oh)2俗名颜色。
状态溶解性露置在空气中的现象三、酸和碱的化学性质稀盐酸稀硫酸酸的化学性质指示剂1.使石蕊溶液变色2.使酚酞溶液变色zn+hcl-fe+h2so4-金属氧化物fe2o3+hcl-cuo+h2so4-碱fe(oh)3+hcl-cu(oh)2+h2so4-盐agno3+hcl-bacl2+h2so4-氢氧化钠氢氧化钙碱的化学性质指示剂1.使石蕊溶液变色2.使酚酞溶液变色氧化物co2+naohso2+naohco2+ca(oh)2—酸naoh+hclca(oh)2+hcl—盐cuso4+naohna2co3+ca(oh)2例题:有下列四种实验设计及操作,实验过程中其现象不能说明co2与naoh溶液发生了反应的是四、ph应用1.溶液酸碱度测定方法在_________或___________上放一小片ph试纸,用__________或________将被测液滴到_______上,把试纸显示的颜色与____________比较,即可得出被测液的ph。
2.向盛有naoh的烧杯中滴入几滴酚酞溶液,溶液变为____色,此时溶液的ph____,向此溶液中滴加稀盐酸,并不断振荡,直至溶液刚好无色时,溶液呈____性,ph____继续滴加稀盐酸,溶液呈____色,ph____,在整个实验中溶液发生了____反应,化学方程式为___________________。
3.现有白纸和几种溶液,有人用这些材料设计了一个名为“雨落叶出红花开”的趣味实验。
初中化学常见的酸的教案

初中化学常见的酸的教案
一、教学内容:常见酸的性质和用途
1. 酸的性质:酸味、腐蚀性、导电性、与金属反应、与碱反应。
2. 常见酸的名称及化学式:盐酸(HCl)、硫酸(H₂SO₄)、硝酸(HNO₃)、乙酸(CH₃COOH)等。
3. 常见酸的用途:医药、制造化肥、制造合成纤维、食品添加剂等。
二、教学目标:
1. 了解酸的性质和特征。
2. 了解常见酸的名称、化学式和用途。
3. 能够用简单的实验验证酸的性质和用途。
三、教学过程:
1. 导入:通过观察实验现象,引入酸这一概念,让学生探讨酸对物质的作用。
2. 探究:通过实验验证酸的性质和用途,让学生亲自操作、观察和总结。
3. 练习:通过小组讨论或个人练习,巩固对酸的性质和用途的理解。
4. 总结:总结本节课的重点内容,梳理酸的性质、常见酸的名称及用途。
四、教学评估:
1. 实验报告:让学生根据实验结果,撰写实验报告,评分。
2. 课堂问答:随堂问答,检验学生对酸的理解程度。
3. 练习题:分发练习题,测试学生对酸的性质和用途掌握情况。
五、教学反思:
1. 教学方法如何创新?
2. 学生的学习兴趣如何激发?
3. 是否能够帮助学生将所学知识应用于实际生活中?
希望以上教学方案能够帮助您更好地教授化学课程,让学生对酸有更深入的理解和应用。
祝教学顺利!。
初中常见酸教案

初中常见酸教案教学目标:1. 了解酸的定义和基本性质。
2. 掌握常见酸的名称、化学式和特点。
3. 学习酸的用途和酸碱中和反应。
教学重点:1. 常见酸的名称、化学式和特点。
2. 酸的用途和酸碱中和反应。
教学难点:1. 酸的化学式的记忆和理解。
2. 酸碱中和反应的原理和应用。
教学准备:1. 实验室用具:烧杯、试管、滴定管等。
2. 实验试剂:盐酸、硫酸、硝酸、醋酸等。
3. 课件和教学素材。
教学过程:一、导入(5分钟)1. 通过提问方式引导学生回顾学过的物质分类,引出酸的概念。
2. 讲解酸的定义和基本性质。
二、新课内容(15分钟)1. 介绍常见酸的名称、化学式和特点。
举例说明:- 盐酸(HCl):无色透明液体,有刺激性气味,溶于水,是一种强酸。
- 硫酸(H2SO4):无色透明液体,有刺激性气味,溶于水,是一种强酸。
- 硝酸(HNO3):无色透明液体,有刺激性气味,溶于水,是一种强酸。
- 醋酸(CH3COOH):无色透明液体,有醋味,溶于水,是一种弱酸。
2. 讲解酸的用途和酸碱中和反应。
举例说明:- 盐酸的用途:制取氯气、制造化学品、钢铁除锈等。
- 硫酸的用途:制取肥料、制造化学品、电池等。
- 硝酸的用途:制取肥料、制造化学品、炸药等。
- 醋酸的用途:食品添加剂、制药、制造化学品等。
三、实验演示(15分钟)1. 演示盐酸与氢氧化钠的酸碱中和反应,观察现象。
2. 演示硫酸与氢氧化钠的酸碱中和反应,观察现象。
3. 演示硝酸与氢氧化钠的酸碱中和反应,观察现象。
4. 演示醋酸与氢氧化钠的酸碱中和反应,观察现象。
四、学生实验操作(15分钟)1. 学生分组进行实验,操作酸碱中和反应,观察并记录现象。
2. 学生填写实验报告。
五、课堂小结(5分钟)1. 回顾本节课所学内容,总结常见酸的性质和用途。
2. 强调酸碱中和反应的重要性和应用。
六、作业布置(5分钟)1. 复习本节课所学内容,记忆常见酸的名称、化学式和特点。
2. 完成课后练习,掌握酸碱中和反应的计算。
九年级化学《几种常见的酸》教学设计

九年级化学《几种常见的酸》教学设计九年级化学《几种常见的酸》教学设计在教学工作者开展教学活动前,常常要根据教学需要编写教学设计,教学设计是一个系统设计并实现学习目标的过程,它遵循学习效果最优的原则吗,是课件开发质量高低的关键所在。
那么你有了解过教学设计吗?以下是小编精心整理的九年级化学《几种常见的酸》教学设计,仅供参考,大家一起来看看吧。
教学目标1.掌握盐酸、硫酸的化学性质及有关的化学方程式,了解其物理性质和用途。
2.理解复分解反应。
3.了解酸碱指示剂、浓H2SO4的特性及稀释。
4.通过展示样品及演示实验,培养学生的观察能力和分析实验现象的能力。
重点盐酸、稀H2SO4的`化学性质。
难点化学方程式的书写。
教学用品纯净浓盐酸、工业浓盐酸、稀盐酸、NaOH溶液、Zn粒、铁丝段、锈铁钉、Cu(OH)2、CuO、AgNO3溶液、浓H2SO4、稀H2SO4、BaCl2溶液,浓HNO3、稀HNO3、石蕊试液、酚酞试液、水、玻璃棒、试管架、试管、烧杯、酒精灯、火柴等。
教学过程【提问】什么叫酸?写出盐酸、硫酸、硝酸的电离方程式[引言]不同的酸在水溶液中电离出的阳离子全部为H+,决定它们必有相同的化学性质,但因酸根离子不同,必然又有各自的特性,即共性与个性的并存。
我们分别学习几种常见的、重要的酸。
【板书】一、盐酸(HCl)盐酸是氯化氢的水溶液。
【演示】浓盐酸的物理性质:展示纯净浓盐酸和工业盐酸各一瓶,要求学生注意观察其色、态、闻气味(注意煽风闻味)。
待学生观察后,请一个学生回答浓盐酸的颜色、状态、气味。
【阅读】课本相关内容。
【思考】1.瓶口的白雾是什么?如何形成的?说明浓盐酸具有什么性质?2.如何保存浓盐酸?敞口放置后的浓盐酸质量和溶质的质量分数有何改变?【板书】投影1.盐酸的物理性质无色、有刺激性气味液体;有挥发性,常用浓盐酸密度1.19g/cm3,HCl的质量分数37%左右。
[讲解]烟与雾的区别。
烟是固体小颗粒,雾为液体小液滴。
几种常见的酸:盐酸 —— 初中化学第一册教案

几种常见的酸:盐酸——初中化学第一册教案教案:初中化学第一册主题:酸的种类教学目标:1. 了解酸的定义和性质;2. 掌握几种常见的酸的名称和特点。
教学内容:1. 酸的定义和性质;2. 盐酸的名称和特点;3. 其他常见的酸。
教学步骤:步骤一:导入(5分钟)1. 准备一些酸的实验室试剂瓶,用盐酸、硫酸、醋酸等酸来进行展示。
2. 通过问题引导学生思考:“你们知道酸是什么吗?酸有哪些性质?它们在生活中有什么应用?”3. 让学生自由讨论一分钟,然后请几位同学分享自己的观点。
步骤二:理论知识讲解(10分钟)1. 定义酸:酸是指能够产生氢离子(H+)的化合物。
它们通常具有酸味、可以与金属产生反应、能够腐蚀有颜色的蓝色纸,并且能够将酚酞溶液变红。
2. 盐酸的特点:盐酸是一种无色透明的液体,具有刺激性气味,并且可以溶解多种金属。
它能与氢氧化钠等碱性物质中和生成盐和水。
步骤三:实验展示与互动(15分钟)1. 展示盐酸的实验室试剂瓶,让学生观察它的颜色和气味。
2. 请学生试验盐酸与不同金属的反应,观察并记录反应结果。
3. 引导学生发现盐酸的腐蚀性质,让学生讨论盐酸对金属、布料等物质的影响。
4. 让学生探究盐酸与氢氧化钠的中和反应,观察生成的物质。
步骤四:其他常见的酸(10分钟)1. 对于其他常见的酸,可以在黑板上或投影仪上展示它们的名称和特点:- 硫酸:具有强烈的刺激性气味,能与金属反应生成氢气。
- 醋酸:是一种透明的液体,常见于醋中,具有酸味、有颜色的蓝色纸可以变红。
步骤五:小结与讨论(10分钟)1. 小结盐酸和其他常见酸的名称和特点。
2. 引导学生讨论酸在生活中的应用,例如:柠檬汁、果酸等。
3. 提问学生:“你们认为酸是好的还是坏的?有什么例子可以说明酸的作用是好的?还是坏的?”并留意学生的回答。
步骤六:作业布置(5分钟)1. 委托学生回家找出家中的一种酸,记录下酸的名称和特点。
2. 要求学生预习下一节课的内容。
九年级化学下学期几种常见的酸教案

九年级化学下学期几种常见的酸教案-CAL-FENGHAI-(2020YEAR-YICAI)_JINGBIAN第八章酸碱盐(二)几种常见的酸知识点精析学习目标一、常识性了解浓硫酸的特性、稀释方法和硝酸的性质。
二、了解酸碱指示剂在酸、碱溶液里呈现的颜色。
三、理解复分解反应的概念,能判断常见反应的所属类型。
四、掌握盐酸、稀硫酸的性质和用途及有关反应的化学方程式。
学会Cl-和-2SO的检验方法。
4重、难点提示一、重点1. 盐酸和稀硫酸的化学性质。
2. 指示剂在酸、碱溶液里的颜色变化。
3. 复分解反应的概念。
二、难点1. 书写有关酸的化学性质的化学方程式。
2. 盐酸和可溶性氯化物、硫酸和可溶性硫酸盐的检验。
知识点精析一、浓盐酸、浓硫酸、浓硝酸的比较注意:①工业盐酸常因含有铁离子(Fe3+)而带黄色。
浓盐酸在空气中,因挥发出的氯化氢气体与水蒸气接触生成盐酸小液滴会形成白雾。
“雾”是液体小珠滴分散在空气中的现象;“烟”是固体小颗粒分散在空气中的现象。
②正确稀释浓硫酸的方法是:一定要把浓硫酸沿着器壁慢慢地注入水里,并不断搅动,切不可把水倒进浓硫酸里。
如果不慎将浓硫酸沾在皮肤或衣服上,应立即用抹布擦拭,然后用水冲洗,再用3%~5%的碳酸氢钠溶液来冲洗。
二、指示剂能跟酸或碱的溶液起作用而显示不同颜色的物质,叫酸碱指示剂,简称指示剂。
注意:①实验室配制使用的石蕊试液呈紫色,也可叫做紫色石蕊试液,它在中性溶液中不变色,即仍显紫色。
而酚酞试液呈无色,也可叫做无色酚酞试液,它在酸性溶液和中性溶液里都不变色,即仍呈无色。
所以不使酚酞试液变为红色的溶液,不一定是酸性溶液。
②使用指示剂试液时,用量不能多,应用滴管滴加1~2滴试液于待测溶液中,振荡,即可观察其颜色变化。
三、盐酸、稀硫酸的化学性质NaOH+HCl=NaCl+H2O Cu OH2+2HCl=CuCl2+2H2O 2NaOH+H2SO4=Na2SO4+2H2O Cu OH2+H2SO4=CuSO4+2H2O注意:①硝酸因具有很强的氧化性,跟金属反应一般不生成氢气而生成水,出除此而外与盐酸和硫酸相似,也能发生上述类似的反应。
初中化学下学期几种常见的酸教案

初中化学下学期几种常见的酸教案教案题目:常见的酸教学目标:1.了解常见的酸的种类及其性质;2.能够分辨和识别常见的酸;3.掌握常见酸的化学式、名称和用途;4.培养学生的观察能力和实验操作能力。
教学重点:1.常见酸的种类;2.常见酸的性质和用途;3.常见酸的化学式和名称。
教学难点:1.学生辨别和识别各种常见酸的能力;2.常见酸的性质与用途的理解。
教学准备:1.酸溶液的化学品(如:硫酸、盐酸、乙酸、柠檬酸等);2.酸的性质和用途的实验及展示所需的器材、材料;3.课堂展示所需的PPT或黑板、粉笔。
教学过程:Step 1 导入(10分钟)1.预估活动:请学生想一想在日常生活中常见的酸有哪些?并列举出他们所知道的酸。
2.引入话题:根据学生预估活动的结果,引导学生进一步思考,为什么我们要学习酸?酸在我们生活中扮演着什么样的角色?引导学生讨论。
Step 2 酸的种类及其性质(20分钟)1.酸的种类:通过PPT或黑板上的酸的种类分类表,向学生介绍常见的酸的种类和化学式,如:硫酸、盐酸、乙酸、柠檬酸等。
可结合物质的名称及图像给予学生强化记忆。
2.常见酸的性质:通过实验演示以及化学方程式的引导,向学生介绍酸的常见性质,如:酸味、酸的酸性比较、酸和金属的反应等。
Step 3 酸的用途(15分钟)1.酸的用途:通过观察、实验演示以及生活实例,向学生介绍酸的广泛用途,如:硫酸可用于制造化肥、食品加工等;盐酸可用于清洗金属、除垢等;柠檬酸可用于食品添加剂等。
2.学生讨论:请学生结合自身生活,补充酸的其他应用领域,并与其他同学分享。
Step 4 实验操作和展示(25分钟)1.实验演示:通过实验演示来加深学生对酸的印象,让学生更加直观地了解酸的性质和用途。
比如,用硫酸与镁粉反应制氢气,并通过点燃集气瓶中的氢气等实验。
2.学生展示:学生根据自己文化课中所学习到的酸的相关知识,自行准备并展示酸的有关实验演示或研究成果。
Step 5 小结和拓展(10分钟)1.小结:通过概括,对本节课所学的内容进行简要总结。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第二节几种常见的酸
(2课时)
一.知识教学点
1.盐酸、稀硫酸的性质和用途.
2.常见的酸、碱指示剂。
3.浓硫酸的稀释及一些特性。
4.硝酸的性质和用途。
5.复分解反应。
二.重、难、疑点
1.重点:盐酸的性质及用途。
2.难点:教会学生学习酸、碱、盐知识的基本学习思路。
3.疑点:(1)为什么锌与浓硫酸或硝酸反应时不产生氢气?
(2)为什么稀释浓硫酸时,必须将酸倒入水中?
三.教学过程
[导入]:由复习提问引入新课。
[板书]:一.盐酸(HCl)
[演示实验]:演示实验8-5,出示一瓶纯净浓盐酸和一瓶工业盐酸,并分别打开瓶盖。
[提问]:请同学们思考:1.你们观察到什么现象?这种现象是怎样形成的?2.联系硫燃烧生成二氧化硫气体,磷燃烧生成五氧化二磷的白烟相对比,气、烟、雾三者
的不同。
3.通过观察,你能得出盐酸有哪些物理性质?
[学生活动]:在讨论的基础上,得出盐酸的物理性质。
[板书]:1.盐酸的物理性质
纯净的盐酸是无色具有刺激气味的液体,是挥发性的酸。
工业盐酸由于含有Fe3+等杂质而呈黄色。
2.盐酸的化学性质
[演示实验]:做实验8-6,并观察实验现象,得出两种指示剂在酸、碱溶液里的变色规律。
结果紫色石蕊试液遇酸变红,遇碱变蓝。
无色酚酞试液遇酸不变色,遇碱
溶液变红色。
并由此得出:
[板书]:(1)与酸碱指示剂反应
使紫色石蕊试液变红色,使无色酚酞试液不变色。
[复习提问]:氢气的实验室制法,写出化学方程式,并给各物质进行分类,由此得出规律:
[板书]:(2)与金属反应(盐酸+活泼金属=盐+氢气)
2HCl+Zn=ZnCl2+H2↑ 2HCl+Mg=MgCl2+H2↑
2HCl+Fe=FeCl2+H2↑
[演示实验]:做实验8 -7,并观察实验现象。
教师启发学生思考:不溶于水的铁锈到哪里去了,此实验中反应物、生成物各是什么?最后经过学生讨论加上教师
提示,请学生自己写出化学方程式。
[板书]:(3)与金属氧化物反应(盐酸+金属化合物=盐+水)
6HCl+Fe2O3=2FeCl3+3H2O 2HCl+CuO=CuCl2+H2O
[教师活动]:根据观察到生绣的铁钉放到盐酸溶液中,过了一会儿变成光亮的铁钉的实
验现象,说出此反应在实际生产中的应用。
教师趁此机会讲:物质的用途
是由物质决定。
我们生活在化学的世界里,学好了化学,能解决许多生活
和生产的实际问题。
提高学生学习化学的积极性。
[演示实验]:做实验8-8,观察现象并根据教师提出的问题(颜色的变化能否帮助我们判断是否发生了化学反应?)
[板书]:(4)跟碱反应(盐酸+碱=盐+水)
2HCl+Cu(OH)2= CuCl2+2H2O HCl+NaOH=NaCl+H2O
[演示实验]:做实验8-9,观察并思考,再做一个对比实验:石灰水跟碳酸钠溶液,并在反应后的白色沉淀中滴加稀硝酸。
通过实验对比得出重要结论:用硝酸银
溶液和稀硝酸,可检验盐酸和可溶性的氯化物。
[板书]:(5)跟盐的反应(盐酸+(某些)盐=新盐+新酸)
HCl+AgNO3=AgNO3↓+HNO3 2HCl+CaCO3=CaCl2+2H2O+CO2↑
[教师活动]:下面请同学们分析一下盐酸与碱、与盐反应的化学方程式与已学过的化合、分解、置换反应对比,看反应物与生成物之间有什么特点,并引导学生得出
复分解反应的定义:
[板书]:3.复分解反应:由两种化合物互相交换成分,生成另外两种化合物的反应。
[提问]:通过刚才对盐酸性质的研究并阅读课本,总结一下盐酸有哪些用途?这些用途是由它的什么性质决定的?
[板书]:4.盐酸的用途
重要的化工材料及金属表面的除锈等。
二.硫酸(H2SO4)
1.浓硫酸的物理性质
[演示实验]:做实验8-11,学生观察现象及分析讨论其本质,最后在教师的引导下得出结论:
[板书]:硫酸是没有颜色、粘稠、油状的液体,不易挥发,具有强烈的吸水性,腐蚀性,脱水性,氧化性;常用的浓硫酸的质量分数为1.84g/ml。
2.浓硫酸的稀释
[演示实验]:做实验8-12,观察实验现象并分析讨论,最后得出结论:[板书]:浓硫酸溶于水时放出大量的热。
[提问]:根据浓硫酸的性质及其溶于水中放出大量的热,请同学们互相讨论:如何稀释浓硫酸?最后根据得出的结果,请一位同学操作实验8-13。
[板书]:3.稀硫酸的化学性质和用途
[教师活动]:学习这一部分知识时,边复习盐酸的化学性质,边做实验边讨论,得出稀硫酸的化学性质。
这样既学习了稀硫酸的化学性质,又巩固了盐酸的化学性
质,并为下一节“酸的通性”做了准备。
[板书]:(1)与酸碱指示剂反应
使紫色石蕊试液变红色,使无色酚酞试液不变色。
(2)与金属反应
H2SO4+Zn=ZnSO4+H2↑ H2SO4+Mg=MgSO4+H2↑
H2SO4+Fe=FeSO4+H2↑
稀硫酸+活泼金属=盐+氢气
(3)与金属氧化物反应
3H2SO4+Fe2O3=Fe2(SO4)3+3H2O H2SO4+CuO=CuSO4+H2O
稀硫酸+金属化合物=盐+水
(4)跟碱反应
H2SO4+Cu(OH)2= CuSO4+2H2O H2SO4+2NaOH=Na2SO4+2H2O
稀硫酸+碱=盐+水
(5)跟盐的反应
H2SO4+Ba(OH)2= BaSO4↓+2H2O H2SO4+Na2CO3=Na2SO4+2H2O+CO2↑
盐酸+(某些)盐=新盐+新酸
[板书]:三.硝酸(HNO3)
[教师活动]:这部分知识,采取与盐酸,稀硫酸的化学性质相比较的方法,预测硝酸跟金属、金属氧化物、碱、盐及酸碱指示剂的反应,最后实验加以验证,得
出硝酸与盐酸、稀硫酸化学性质的相似点和不同点。
[板书]:1.硝酸的物理性质
纯净的浓硝酸是无色、有刺激性气味的液体,具有挥发性,能在空气中
形成白雾。
2.硝酸的化学性质
(1)与酸碱指示剂反应
使紫色石蕊试液变红色,使无色酚酞试液不变色。
(2)与金属反应:不生成氢气
(3)与金属氧化物反应(硝酸+金属化合物=盐+水)
2HNO3+ZnO=Zn(NO3)2+H2O
(4)跟碱反应(硝酸+碱=盐+水)
2HNO3+Mg(OH)2=Mg(NO3)2+H2O
(5)跟盐的反应[盐酸+(某些)盐=新盐+新酸]
2HNO3+CaCO3=Ca(NO3)2+H2O+CO2↑
[板书]:四.磷酸(H3PO4)
[教师活动]:这部分知识学习通过学生看书自学而掌握。
