2008年全国高中学生化学竞赛(省级赛区)试题及答案
2008年全国高中学生化学竞赛试题及参考答案

中国化学会第22届全国高中学生化学竞赛(省级赛区)试题、标准答案及评分细则题号 1 2 3 4 5 6 7 8 9 10 11 总分满分14 5 4 10 5 11 14 9 7 11 10 100第1题(14分)1-1EDTA是乙二胺四乙酸的英文名称的缩写,市售试剂是其二水合二钠盐。
(1)画出EDTA二钠盐水溶液中浓度最高的阴离子的结构简式。
(2) Ca(EDTA)2-溶液可用于静脉点滴以排除体内的铅。
写出这个排铅反应的化学方程式(用Pb2+ 表示铅)。
(3)能否用EDTA二钠盐溶液代替Ca(EDTA)2-溶液排铅?为什么?1-2氨和三氧化硫反应得到一种晶体,熔点205o C,不含结晶水。
晶体中的分子有一个三重旋转轴,有极性。
画出这种分子的结构式,标出正负极。
1-3 Na2[Fe(CN)5(NO)]的磁矩为零,给出铁原子的氧化态。
Na2[Fe(CN)5(NO)]是鉴定S2-的试剂,二者反应得到紫色溶液,写出鉴定反应的离子方程式。
1-4 CaSO4• 2H2O微溶于水,但在HNO3 ( 1 mol L-1)、HClO4 ( 1 mol L-1)中可溶。
写出能够解释CaSO4在酸中溶解的反应方程式。
1-5取质量相等的2份PbSO4 (难溶物)粉末,分别加入HNO3 ( 3 mol L-1) 和HClO4 ( 3 mol L-1),充分混合,PbSO4在HNO3 能全溶,而在HClO4中不能全溶。
简要解释PbSO4在HNO3中溶解的原因。
1-6X和Y在周期表中相邻。
CaCO3与X的单质高温反应,生成化合物B和一种气态氧化物;B与Y的单质反应生成化合物C和X的单质;B水解生成D;C水解生成E,E水解生成尿素。
确定B、C、D、E、X和Y。
第2题 (5分) 化合物X 是产量大、应用广的二元化合物,大量用作漂白剂、饮水处理剂、消毒剂等。
年产量达300万吨的氯酸钠是生产X 的原料,92%用于生产X —在酸性水溶液中用盐酸、二氧化硫或草酸还原。
2008年浙江省高中学生化学竞赛试题(A组)参考答案和评分标准

2008年浙江省高中学生化学竞赛试题(A 组)参考答案和评分标准一.选择题(本题包括10小题,每小题4分,共40分。
每小题只有一个选项符合题意。
)1.B 。
2.C 。
3.B 。
4.A 。
5.D 。
6.D 。
7.C 。
8.C 。
9.A 。
10.D 。
二.选择题(本题包括8小题,每小题4分,共32分。
每小题可能有1或2个选项符合题意,若有2个正确选项,只选1个且正确给2分,多选、错选都给0分。
)11.AB 。
12.B 。
13.AC 。
14.AD 。
15.C 。
16.BC 。
17.CD 。
18.AD 。
三.本题共包括2小题,共20分19.(11分)(1)ABD (3分,选C 倒扣1分,只选C 得0分)(2)+3NaOH ++NaCl+H 2O (3分,反应物、产物中只要写错一种或漏写都不给分,不配平扣1分)(3)5(2分)(3分,其它形式的结构简式不给分)20.(9分) (1)CH 3COOCH 2CH 2CH 3(1分)(2)2CH 3CH 2CH 2OH+O 22CH 3CH 2CHO+2H 2O (2分)(3)①CH 3CHO (1分) ②酯化反应(或取代反应)(1分)③nCH 2=CHCOOH CH 2(2分)④CH 3COOH+NH 3CH 3COOH+HCl或CH 3COOH+3NH 3CH 3COONH 4+NH 4Cl (2分) 四.本题包括2小题,27分。
21.(每空2分,共14分)(1)⑥ ⑧ ⑩(2)使茶叶灰分中的钙、铁、铝等难溶化合物转化成可溶性氯化物在pH=6~7左右时加热至沸30min 可保证Fe 3+、Al 3+完全沉淀除去溶液中的Fe 3+离子,防止Fe 3+干扰铝元素的检验(其它合理解释也可给分)(3)Fe 3++3OH -=Fe(OH)3↓ Al 3++3OH -=Al(OH)3↓(2分,写成AlO 2-不给分)22.(13分)(1)甲 乙 50mL 碱式滴定管(每空1分,3分)(2)D 、E 、G (3分,全对给分)。
2008全国高中学生化学竞赛备用卷试题及解析

● 竞赛时间3小时。
迟到超过半小时者不能进考场。
开始考试后1小时内不得离场。
时间到,把试卷(背面朝上)放在桌面上,立即起立撤离考场。
● 试卷装订成册,不得拆散。
所有解答必须写在指定的方框内,不得用铅笔填写。
草稿纸在最后一页。
不得持有任何其他纸张。
● 姓名、报名号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论处。
●允许使用非编程计算器以及直尺等文具。
1.008Zr Nb M o TcRu Rh Pd Ag Cd In Sn Sb Te I Hf Ta W Re OsIr Pt Au Hg Tl Pb Bi Po At Ac-LrHLiBeB C N O F Na M g Al Si P Cl S K Ca Sc Ti V Cr M n Fe Co Ni Cu Zn Ga Ge As Se BrRb Cs Fr Sr Ba RaY La Lu -6.9419.01222.9924.3139.1040.0885.4787.62132.9137.3[223][226]44.9647.8850.9452.0054.9455.8558.9363.5558.6965.3910.8126.9869.7212.0128.0972.61114.8204.4118.7207.2112.4200.6107.9197.0106.4195.1102.9192.2101.1190.298.91186.295.94183.992.91180.991.22178.588.9114.0116.0019.0030.9774.92121.8209.032.0778.96127.6[210][210]126.979.9035.45 4.00320.1839.9583.80131.3[222]He Ne Ar Kr Xe Rn 相对原子质量Rf Db Sg Bh Hs Mt第1题(8分)X 是碘一氧系中研究得最多的稳定化合物,白色粉状固体,分解温度573K ,相对分子质量334。
2008年全国高中化学竞赛江苏省预赛试题及答案

For personal use only in study and research; not for commercialuse2008年江苏省化学竞赛试题一、选择题(每小题有1-2个选项符合题意,每小题4分,共60分)1.嫦娥工程标志着我国航天技术已经达到世界先进水平。
近年来我国科学家研制的新型“连续纤维增韧”航空材料主要成分是由碳化硅、陶瓷和碳纤维复合而成的,下列有关该材料的叙述,正确的是()For personal use only in study and research; not for commercial useA.它耐高温、但抗氧化性差B.它的密度小,质地较脆C.它没有固定熔、沸点D.它是一种新型合金材料2.化学家庭小实验是利用家庭日常生活用品进行化学学习和研究的活动,利用日常生活用品,下列实验设计不能完成的是()For personal use only in study and research; not for commercial useA.用粥汤检验碘盐中是否含有KIO3B.用醋酸除去热水瓶中的水垢C.用食用碱(Na2CO3)溶液洗涤餐具上的油污For personal use only in study and research; not for commercial useD.淀粉溶液具有丁达尔现象3.下列化学用语或模型表示正确的是()A.硝基苯的结构简式:O2NB.CO2分子比例模型:C.NH4I的电子式:D.NaCl的晶体模型:4.2008年北京奥运会主体育场的外形好似“鸟巢”。
有一类硼烷也好似鸟巢,故称为巢式硼烷。
巢式硼烷除B10H14不与水反应外,其余均易与水反应生成氢气和硼烷。
硼烷易被氧化。
下图是三种巢式硼烷,有关说法不正确的是()A.硼烷与水反应是氧化还原反应B.2B5H9+12O2=5B2O3+9H2O,1mol B5H9完全燃烧转移25mol电子C.8个硼原子的巢式硼烷的化学式应为B8H10D.这类巢式硼烷的通式是B n H n+45.二氯化二硫(S2Cl2)广泛用作橡胶工业的硫化剂,常温下它是一种橙黄色有恶臭的液体,它的分子结构与H2O2相似,熔点为193K,沸点为411K,遇水很容易水解,产生的气体能使品红褪色,S2Cl2可由干燥的氯气通入熔融的硫中制得。
全国化学竞赛初赛2008年答案

评分通则:1.凡要求计算的,没有计算过程,即使结果正确也不得分。
2有效数字错误,扣0.5分,但每大题只扣1次。
3单位不写或表达错误,扣0.5分,但每大题只扣1次。
4只要求1个答案、而给出多个答案,其中有错误的,不得分。
5方程式不配平不得分。
6不包括在此标准答案的0.5分的题,可由评分组讨论决定是否给分。
第1题 (14分)1-1 EDTA 是乙二胺四乙酸的英文名称的缩写,市售试剂是其二水合二钠盐。
(1)画出EDTA 二钠盐水溶液中浓度最高的阴离子的结构简式。
C H 2NC H 2H 2C N H 2C CH 2H 2CCOO -COO --OOC-OOC H H (2分)答(-OOCCH 2)2NCH 2CH 2N(CH 2COO -)2H H或CH 2NH(CH 2COO -)22 得2分,质子必须在氮原子上。
(2) Ca(EDTA)2-溶液可用于静脉点滴以排除体内的铅。
写出这个排铅反应的化学方程式(用Pb 2+ 表示铅)。
Pb 2+ + Ca(EDTA)2- = Ca 2+ + Pb (EDTA)2-(1分)(3)能否用EDTA 二钠盐溶液代替Ca(EDTA)2-溶液排铅?为什么?不能。
若直接用EDTA 二钠盐溶液,EDTA 阴离子不仅和Pb 2+反应, 也和体内的Ca 2+结合造成钙的流失。
(答案和原因各0.5分,共 1分)1-2 氨和三氧化硫反应得到一种晶体,熔点205o C ,不含结晶水。
晶体中的分子有一个三重旋转轴,有极性。
画出这种分子的结构式,标出正负极。
(2分)硫氧键画成双键或画成S →O ,氮硫键画成N →S ,均不影响得分。
结构式1分,正负号1分。
答H 3NSO 3、H 3N-SO 3等不得分。
正确标出了正负号,如+H 3NSO 3-、+H 3N-SO 3-得1分。
其他符合题设条件(有三重轴,有极性)的结构,未正确标出正负极,得1分,正确标出正负极,得2分。
1-3Na2[Fe(CN)5(NO)]的磁矩为零,给出铁原子的氧化态。
第22届全国高中生化学竞赛(省级赛区)试题及答案

评分通则:1.凡要求计算的,没有计算过程,即使结果正确也不得分。
2有效数字错误,扣0.5分,但每大题只扣1次。
3单位不写或表达错误,扣0.5分,但每大题只扣1次。
4只要求1个答案、而给出多个答案,其中有错误的,不得分。
5方程式不配平不得分。
6不包括在此标准答案的0.5分的题,可由评分组讨论决定是否给分。
第1题 (14分)1-1 EDTA 是乙二胺四乙酸的英文名称的缩写,市售试剂是其二水合二钠盐。
(1)画出EDTA 二钠盐水溶液中浓度最高的阴离子的结构简式。
C H 2NC H 2H 2C N H 2C CH 2H 2CCOO -COO --OOC-OOC H H (2分)答(-OOCCH 2)2NCH 2CH 2N(CH 2COO -)2H H或CH 2NH(CH 2COO -)22 得2分,质子必须在氮原子上。
(2) Ca(EDTA)2-溶液可用于静脉点滴以排除体内的铅。
写出这个排铅反应的化学方程式(用Pb 2+ 表示铅)。
Pb 2+ + Ca(EDTA)2- = Ca 2+ + Pb (EDTA)2-(1分)(3)能否用EDTA 二钠盐溶液代替Ca(EDTA)2-溶液排铅?为什么?不能。
若直接用EDTA 二钠盐溶液,EDTA 阴离子不仅和Pb 2+反应, 也和体内的Ca 2+结合造成钙的流失。
(答案和原因各0.5分,共 1分)1-2 氨和三氧化硫反应得到一种晶体,熔点205o C ,不含结晶水。
晶体中的分子有一个三重旋转轴,有极性。
画出这种分子的结构式,标出正负极。
(2分)硫氧键画成双键或画成S →O ,氮硫键画成N →S ,均不影响得分。
结构式1分,正负号1分。
答H 3NSO 3、H 3N-SO 3等不得分。
正确标出了正负号,如+H 3NSO 3-、+H 3N-SO 3-得1分。
其他符合题设条件(有三重轴,有极性)的结构,未正确标出正负极,得1分,正确标出正负极,得2分。
1-3Na2[Fe(CN)5(NO)]的磁矩为零,给出铁原子的氧化态。
全国高中学生化学竞赛(省级赛区)试题与答案(Word版)1

全国奥林匹克化学竞赛(浙江赛区)试题第1题(6分)配平方程式(1)CrCl3+KMnO4+H2O=K2Cr2O7+MnCl2+HCl+MnCr2O7(2)As2S2+HNO3+H2O=H3AsO4+NO↑+H2SO4第2题(12分)(1)实验证明,硫化铜与硫酸铁在细菌作用下,在潮湿多雨的夏季,成为硫酸和硫酸盐而溶解于水,这就是废石堆渗沥水,矿坑水成为重金属酸性废水的主要原因,试写出配平的化学方程式。
(2)从金矿中提取金,传统的也是效率极高的方法是氰化法。
氰化法提金是在氧存在下氰化物盐类可以溶解金。
试写出配平的化学方程式。
(3)对二乙苯在酸性高锰酸钾溶液中被氧化并有气体产生,试写出配平的反应式。
第3题(12分)(1)用石灰乳跟硫熬煮而成的石硫合剂含多硫化钙(CaS n)。
多硫化钙在空气中与二氧化碳等酸性物质接触易析出多硫化氢,多硫化氢是一种极不稳定的黄色液体,试用化学方程式说明多硫化钙具有杀虫作用的原因。
(2)在强碱B-:(如NH4+NH2-),的存在下CH3CH2CH2CH2Cl可按下列两种历程发生消除反应,分别称之为Eα消除和E2消除:Eα:E2:试构思一个实验证实上述历程。
第4题(12分)(1)实验室中所用的氧化钢(CuO)是黑色粉末。
在使用电烙铁时,其头部是一铜制的烙铁头,长期使用,表面被氧化,但脱落下来的氧化膜却是红色的,试说明原因。
(2)法医鉴定砷中毒(通常为砒霜)的方法是用锌、盐酸和试样混在一起,将生成的气体导入热玻璃管,如果试样中有砷化物存在,则在玻璃管的壁上出现亮黑色的“砷镜”。
试写出有关的反应式。
(3)把CO2气体通入澄清的石灰水,立即会产生浑浊,但把SO2气体通入澄清的石灰水,却不容易看那浑浊,而CaCO3和CaSO3都是难溶的电解质,试说明原因。
第5题(6分)分子式为C7H10的开经烃A,可发生下列反应:(1)A经催化加氢可生成3一乙基戊烷。
(2)A与硝酸银氨溶液反应可产生白色沉淀。
2008年全国高中学生化学竞赛陕西赛区初赛试题参考答案

2008年全国高中学生化学竞赛(陕西赛区)初赛试题参考答案第Ι卷1.(1)C8H18(l)+12.5O2(g)=8CO2(g)+9H2O(l)-5518kJ·mol-1或2C8H18(l)+25O2=16CO2(g)+9H2O(l)-1.104×103kJ·mol-1..........(1分) (2)优点:清洁、安全、高效.........................................(1分) 缺点:成本过高;储存和输送难...................................(1分) 2.(1)同主族元素原子的结构相似,元素的化学性质相似.....................(1分)(2)①<.......(1分) ②CH3CH2Br + NaHS = CH3CH2SH + NaBr.......(1分)(3)①6Li + N2 2Li3N.....(2分)②Be+2OH-= BeO22-+H2.....(2分)3.(1)90% .................(1分)减小................(1分)(2)0.6 .................(0.5分)0.3...............(0.5分)(3) 0.4................(0.5分) 0.2................(0.5分)4.(1(1分)H O O H...................(1分)1:2..............(1分)(2) C2H2(g) + 5/2 O22CO2(g) + H2O (l) ......................(1分)ΔH= -1300 kJ·mol-1 ........................................(1分)(3) H2O2 H++ HO2-........(1分) H2O- H++ O22-........(1分)(4) 12 .........(1分)NaH + H2O = NaOH + H2........(1分)2H2+ O2 = 2H2O....(1分)或2NaH + O2 2NaOH . .(2分)5.(1)检查装置的气密性 .............................................(1分)(2)水与浓硫酸作用放热,有利于SO2的放出 ...........................(1分)(3)缓冲防止倒吸 ....................................(各0.5分,共1分)(4)浓硫酸①干燥SO2和O2②使SO2和O2混合均匀③通过观察控制气体比例和气流速度...........................................(各0.5分,共2分)点燃点燃点燃(5)温度过高不利于SO 2的生成,且影响催化剂的活性....................(1分)(6)无(白)色晶(固)体...........................................(1分)(7)防止水蒸气SO 2与接触...........................................(1分)(8)用NaOH 溶液吸收 ...............................................(1分)6.(1)CH 3COONa HCOOCH 2CH 3 CH 3CH 2Cl .....................(各1分,共3分) (2)复分解 水解 消去 .................................(各1分,共3分)(3)CH 3COOH +CH 3CH 2CH 2OH浓硫酸 △ CH 3COOCH 2CH 2CH 3 +H 2O ..............(1分) HCOOH +2[Ag(NH 3)2]OH △CO 2↑+2Ag ↓+4NH 3+2H 2O ... .. .......(1分)(4)3[CH 3COOCH(CH 3)2 HCOOC(CH 3)3 (CH 3)2CHCOOCH 3]....... .. ........(1分)7.(1)取代反应(或硝化反应) 还原反应 .... .. .........(各1分,共2分) (2)C 6H 12O 6 催化剂2C 2H 5OH +2CO 2↑...... .. .......................(1分) .........................................(2分)(3) (各1分,共2分)8. (1) 2Ca(OH)2+2Cl 2CaCl 2+Ca(ClO)2+2H 2O .......................(1分) (2) 1.5 ...............(1分) (3) 370...............(2分)(4) 8(a + 5)/a + 3................................................(2分)9. (1) 60 N A ........................................................(1分)(2) HI 具有还原性,能将已生成的碘酸氢钾还原 ........................(1分)(3) Cl 2及Cl 2与KOH 反应生成的KClO ,能将KIO 3氧化成KIO 4 .............(1分)(4) 漏斗、烧杯、玻璃棒.............................................(1分)(5) KH(IO 3)2 + KOH = 2KIO 3 +H 2O ...................................(1分)(6) 蒸发结晶.......................................................(1分)10.(1) 固体完全溶解,溶液呈血红色....................................(1分) O 2N C O OH +2C 2H 5O 2N C OO CH 2CH 3+H 2O H 2N C H CH 3O CH OH 2N CH 2COOH(2) 不合理 ........................................................(1分)当原固体粉末为Fe2O3和Cu2O的混合物时,加入稀H2SO4后产生的Fe3+与Cu反应生成Fe2+,滴加KSCN溶液后也可以不变红色 .......................(1分)(3) Fe2O3和Cu2O .....(0.5分)Fe2O3+6H+ =2Fe3++ 3H2O ......(0.5分)Cu2O+2H+=Cu+Cu2++H2O...(0.5分) 2Fe3++Cu = 2Fe2++Cu2+...(0.5分)(4) 9(b-a)/a或900(b-a)/a% .......................................(1分)(5) ①B、D ..........................................(各0.5分,共12分)②F e(OH)3....................................................(1分)③加热浓缩,降温结晶... ........................................(1分)第Ⅱ卷1.(1) 3d6 d2sp3 .......................................(各1分,共2分)(2)绿色化合物[Co(NH3)3(H2O)Br2]Br2 ..................................(1分)红色化合物[CoNH3)3(H2O)3]Br3 .....................................(1分)(3)3种几何异构体,其中还存在1对旋光异构体 ........................(1分)(4)熵效应驱动的反应;该反应的焓效应为0.B式的结构为面式。
2002~2008年全国高中学生化学竞赛(江苏赛区)夏令营选拔赛试题分类 原子分子、晶体结构

2002~2008年全国高中学生化学竞赛(江苏省赛区)夏令营选拔赛试题分类原子、分子结构(2002年)1.(12分)⑴如果已经发现167号元素A,若已知的原子结构规律不变,167号元素应是第周期、第族元素;可能的最高氧化态为;氢化物的化学式为。
⑵某一放射性物质衰变20%需15天,该物质的半衰期是。
⑶化合物C H3C H C H2O分子中有种化学环境不同的氢原子。
如果用氯取代分子中的氢原子,生成的一氯代物可能有种。
⑷硅与碳为同族元素,呈四价。
然而,与碳化合物相比,硅化合物的数量要少得多。
碳易于形成双键,硅则不易形成双键。
但据美国《科学》杂志2000年报道,已合成了分子中既有Si-Si单键,又有Si=Si双键的化合物X。
X的分子式为Si5H6,红外光谱和核磁共振表明X分子中氢原子的化学环境有2种,则X的结构式是:。
(2002年)2.(13分)⑴磷和氢能组成一系列的氢化物,如PH3,P2H4,P12H16等。
其中最重要的是PH3。
PH3称为膦,它是一种无色剧毒的有类似大蒜臭味的气体。
它可由NaOH和白磷反应来制备,其制备反应的化学方程式为,P2H4的沸点比PH3(填“高”或“低”),原因是。
AsH3又称胂,试写出由As2O3制备胂的反应方程式,胂的汽化热比膦(填“大”或“小”)。
⑵①根据VSEPR理论,SCl3+和ICl4-的空间构型分别是和,S和I 分别以_______和杂化轨道同Cl形成共价键。
② SCl3+和PCl3是等电子体,其S-Cl键键长(填>、=或<)P-Cl键键长,原因是。
(2003年)第2题(共8分)⑴根据杂化轨道理论,下列离子或分子:NH3、NF3、NO2+中氮分别采用、、__________杂化轨道同相应的键合原子成键。
其中NH3的键角(填“大于”或“小于”)NF3的键角的原因是。
⑵最近,德国科学家在医学杂志《柳叶刀》上发表文章,他们研究发现一种名为甘草甜素的物质可以有效抑制非典病毒的增殖,有望用其研制出治疗非典的特效药。
2008年全国高中学生化学竞赛(决赛)获奖学生名单

2008年全国高中学生化学竞赛(决赛)获奖学生名单一等奖姓名学校姓名学校姬少博石家庄市第二中学刘吉湖南师大附中刘文驰陕西师范大学附中储鹏翔安徽师范大学附属中学肖艺能四川成都七中李祥波福建省三明第一中心江嘉骏上海市上海中学陈立华南师大附中朱如意重庆市第一中学黄昕晨广东深圳中学赵秋晨东北师范大学附属中学周凌云西安交通大学附中马迪陕西师范大学附中严佳骏华东师范大学第二附属学胡剑书辽宁省实验中学刘楚龙西安市铁一中学张涛山西大学附属中学吴宗凯天津市新华中学宋泽昊河北省唐山市第一中学李清目广东深圳中学施杰河北省衡水中学赵虔诚四川绵阳中学王睿博湖北省华中师大一附中温健西北工业大学附中贾殷秋湖北省华中师大一附中王抒扬东北师范大学附属中学谭羚迪福建省厦门第一中学王萌西安市铁一中学王志鹏重庆市南开中学邱天湖北省武汉二中梁冰玉湖南省长沙长郡中学陈斌波山西大学附属中学刘原君四川成都七中郭嘉琦内蒙呼伦贝尔海拉尔二中王苑先吉林省第一中学杨涛重庆市第一中学林晓文福建省武平县第一中学许言南京师范大学附属中学李雨舟四川绵阳中学吴雨桓陕西师范大学附中伍陈诚马鞍市市第二中学冯想湖北省黄冈中学何遥四川绵阳南山中学刘驰马鞍市市第二中学黄泽寰福建省厦门市双十中学张玮湖北省武钢三中田宇北京八十中学师帅山西省实验中学刘天依浙江省嘉兴第一中学陈凯华南师大附中二等奖姓名学校姓名学校张骏江苏省常熟中学张俭湖南省长沙市一中颜余真湖南师大附中吕少清福建省南安市第一中学刘敬源山东省聊城第一中学王钢北京二中章治城上海市复兴高级中学黄铮马鞍市市第二中学杨晨河南省郑州外国语学校苏琮钦福建省莆田第一中学周天江苏省梁丰高级中学谢国俊广东深圳中学姬昱天津市第一中学郝骥腾石家庄市第二中学张剑箫浙江省杭州市第二中学张茜河南省郑州外国语学校方堃江西省万年中学周行浩浙江省宁波勤州中学张利平广东中山纪念中学陈冲重庆巴蜀中学黄杨子君江西省鹰潭市第一中学郑凯元山西省实验中学毛崴芃江西省鹰潭市第一中学李凌风上海市曹杨第二中学鲁扬安庆市第一中学王一帆清华附中刘宁宇河南省郑州一中刘同舟重庆巴蜀中学王惟臻海南中学李鹏鹏江苏省通州高级中学黄金紫内蒙呼伦贝尔海拉尔二中金云鹤辽宁省东北育才学校李琪广西柳州高中黄映涵四川绵阳南山中学胡元晖辽宁省大连育明高级中学王岩天津市实验中学吴宇奇云南师大附中令狐昌洋贵州省贵阳一中田慧杰天津市南开中学王腾乌鲁木齐市第一中学冯凯波江西师范大学附属中学赵诗杰浙江省杭州市第二中学毛佳昕广西南宁三中刘一芾海南中学刘苏萌南京师范大学附属中学曲培源辽宁省沈阳二中徐嘉苏江苏省常州高级中学郭沛骅河南省实验中学吴海培山东师范大学附属中学魏远明山东省寿光市第一中学舒啸河北省唐山市第一中学张博杰河南省郑州一中曾志勇江西省南昌市第二中学张龙天海南中学韩冬北京四中周扬山西省忻州一中李一乌鲁木齐市高级中学关尔佳东北师范大学附属中学陶船思博哈尔滨师范大学附中刘宇甘肃省西北师大附中赵路睿甘肃省兰州一中高可言辽宁省实验中学许强黑龙江佳木斯市第三中学张凯冬浙江省杭州外国语学校李琦湖南省长沙市雅礼中学李柏亨云南昆明三中三等奖姓名学校姓名学校曹志超云南昆明一中崔汉超黑龙江齐齐哈尔实验中学陆元诚上海市格致中学李文轩新疆实验中学莫军广西南宁二中王玞琳山东省实验中学张龙飞山东省寿光现代中学闫鹏起甘肃省西北师大附中马欣欣天津市南开中学张逸尘内蒙古包头市第九中学王涛宁夏银川二中刘天泽北京四中曹晏铭吉林省第一中学罗茜元广西桂林中学刘麟盛甘肃省西北师大附中江晓宇广西柳州地区高中黄思海南中学赵泉朴甘肃省西北师大附中聂静怡贵州师大附中段文舟云南师大附中李夏路海南中学杨嘉铭贵州省贵阳一中王明鼎贵州师大附中陈浩鹏新疆实验中学苏舒云南曲靖一中贾若溪宁夏银川一中张嘉洋内蒙古通辽市第五中学李春炎内蒙古赤峰市乌丹一中黄宣睿新疆兵团二中郜勋宁夏银川二中张汇卓宁夏银川二中侯世安哈尔滨市第三中学夏薇贵州师大附中欧伟豪澳门濠江中学梁书祺澳门培正中学黄东伟澳门粤华中学马强青海省西宁市湟川中学丁冉升青海省西宁市湟川中学黎曉欣香港圣保禄学校唐嘉燕澳门濠江中学鍾沅珺香港圣保禄学校林昕香港圣保禄学校张永臻澳门培正中学杨辰凌青海省西宁市湟川中学卢嘉毅青海省西宁市湟川中学柳杨宁夏银川一中黃凊嵐香港圣保禄学校黃瑞羚香港圣保禄学校2008年全国高中学生化学竞赛(省级赛区)获一等奖学生名单北京市姓名学校编号姓名学校编号韩冬北京四中 C080101 管紫轩人大附中 C080102 王一帆清华附中 C080103 周晗北京市十一学校 CO80104 解析汇文中学 C080105 高鸿信北师大实验中学 C080106 方梓元北京四中 C080107 李熠烺北京101中 C080109 王钢北京二中 C080110 王宁梓人大附中 C080111 刘同悄人大附中 C080112 刘晓光北师大实验中学 C080113 司星宇北京四中 C080114 阮东辉北京市十一学校 C080115 李昂北京市十一学校 C080116 张翼清华附中 C080117 白阳北京市十一学校 C080118 董超北京市十一学校 C080119 田宇北京八十中学 C080121 丁端尘人大附中 C080122 马祥雄北师大二附中 C080123 杨天放人大附中 C080124 张泽琛北大附中 C080125 柯逸楠清华附中 C080126 王敬锋人大附中 C080127上海市姓名学校编号姓名学校编号张嘉俊华东师大第二附属中学 C080202 严佳骏华东师大第二附属中学 C080204 王昊禺华东师大第二附属中学 C080205 舒清雅华东师大第二附属中学 C080206 王晟华东师大第二附属中学 C080207 何康复旦大学附属中学 C080208 徐冠峣上海交通大学附属中学 C080209 胡一川上海市曹杨第二中学 C080210 黄俊骁复旦大学附属中学 C080211 章治城上海市复兴高级中学 C080212 胡瀚林华东师范大学第二附属中学 C080213 关亦周上海交通大学附属中学 C080214 周益良上海交通大学附属中学 C080215 江嘉骏上海市上海中学 C080216 竺翀宇复旦大学附属中学 C080217 李可骞上海市七宝中学 C080218 陈太中上海市大同中学 C080219 陆元诚上海市格致中学 C080221 王彬上海交通大学附属中学 C080222 李一帆上海交通大学附属中学 C080223 李凌风上海市曹杨第二中学 C080225 蔡稼翔上海市格致中学 C080226 孟亦田上海市格致中学 C080227 朱怡然上海交通大学附属中学 C080228 汪立维华东师大第二附属中学 C080229 丁佳靓上海市晋元高级中学 C080230 龚顺上海市上海中学 C080231 金海云上海交通大学附属中学 C080232天津市姓名学校编号姓名学校编号田慧杰南开中学 C080301 吴宗凯新华中学 C080302 姬昱天津市第一中学 C080303 马欣欣南开中学 C080304 王岩天津市实验中学 C080305 康旭阳新华中学 C080306 李超群南开中学 C080308 李季芃南开中学 C080309 赵梦尧天津市实验中学 C080310 袁悦宝坻一中 C080312 刘学嘉天津市实验中学 C080313 武鹏博天津市实验中学 C080314 王健南开中学 C080315 赵健驰天津市第一中学 C080316 刘子谞新华中学 C080317 蒋天宇天津市第一中学 C080318 赵洪凯新华中学 C080320 廉玺桢南开中学 C080322 崔鹏天津市第一中学 C080323 姜彤新华中学 C080324 李耕南开中学 C080325 李凤江天津市第一中学 C080326 戴鹏天津二中 C080327 谢浩枫新华中学 C080328 齐朝博耀华中学 C080329重庆市姓名学校编号姓名学校编号朱如意重庆市第一中学 C080401 杨涛重庆市第一中学 C080402 刘同舟重庆市巴蜀中学 C080403 舒畅重庆市巴蜀中学 C080404 陈冲重庆市巴蜀中学 C080405 吴若邻重庆市第一中学 C080406 向光昭重庆市第一中学 C080407 田路重庆市第一中学 C080408 罗彬恒重庆市第八中学 C080409 罗建重庆市第一中学 C080410 王志鹏重庆市南开中学 C080411 邓力宾重庆市巴蜀中学 C080412 曹雯婧重庆市巴蜀中学 C080413 高洪成重庆市南开中学 C080414梁晓军重庆市巴蜀中学 C080415 程农壹重庆市南开中学 C080416 赵勇重庆市第一中学 C080417 张绍勇重庆市第八中学 C080418 李坤重庆市第一中学 C080419 易竺倩重庆市第八中学 C080421 陈嗣炫重庆市巴蜀中学 C080422 谯跃银重庆市巴蜀中学 C080423 张元通重庆市巴蜀中学 C080425 杨明朗重庆市第一中学 C080426 李康南重庆市第一中学 C080427 陶鑫重庆市南开中学 C080429 洪雪麟重庆市南开中学 C080430河北省姓名学校编号姓名学校编号姬少博石家庄市第二中学 C080501 吴若嘉石家庄市第二中学 C080502 赵伯阳邯郸市第一中学 C080503 冯岩松石家庄市第二中学 C080504宋泽昊唐山市第一中学 C080505 施杰衡水中学 C080506 郑文山邯郸市第一中学 C080507 郝骥腾石家庄市第二中学 C080508 李浩明石家庄市第二中学 C080509 于海涛唐山市第一中学 C080510 刘海亭邯郸市第一中学 C080511 谢华梁秦皇岛市第一中学 C080512 息冬阳衡水中学 C080513 高晨曦石家庄市第二中学 C080514 韩志鹏衡水中学 C080515 王龙衡水中学 C080516 舒啸唐山市第一中学 C080517 徐肇中唐山市第一中学 C080518 唐阳邯郸市第一中学 C080519 李淳洋唐山市第一中学 C080520 李柏达衡水中学 C080521 梁和乐石家庄市第二中学 C080522 李峰保定市第二中学 C080523 孙斌唐山市第一中学 C080524 吴桢衡水中学 C080525 陈琳浩邯郸市第一中学 C080526 张晨枫唐山市第一中学 C080527 王之朔石家庄市第二中学 C080528 李杨柳衡水中学 C080529 董金虎石家庄市第二中学 C080530 李光煜唐山市第一中学 C080531 刘士朝石家庄市第二中学 C080532 王超邯郸市第一中学 C080533 宋天航石家庄市第二中学 C080534山西省姓名学校编号姓名学校编号陈斌波山西大学附中 C080601 张涛山西大学附中 C080602 师帅山西省实验中学 C080603 史天宇山西省实验中学 C080604 褚桥山西省实验中学 C080605 王文婷山西大学附中 C080606 马晟宇山西大学附中 C080607 孙茵山西大学附中 C080608 王洪波山西大学附中 C080609 白雅婧忻州一中 C080610 张月皎山西大学附中 C080611 郑凯元山西省实验中学 C080612 薛懿山西省实验中学 C090613 周扬忻州一中 C080614 王振华山西大学附中 C080615 张江山西省实验中学 C080616 张敏山西省实验中学 C080617 李洋冰山西省实验中学 C080618 马鹏勇山西大学附中 C080619 张斐山西大学附中 C080620 宋健平定一中 C080621 陈思康杰中学 C080622 安劼山西省实验中学 C080623 孙竞达太原市十二中学 C080624 冯旭光山西省实验中学 C080625 赵业炫山西大学附中 C080626 郉弘博山西省实验中学 C080627 孙亮山西大学附中 C080628 曹泽宇山西大学附中 C080629内蒙古姓名学校编号姓名学校编号孙萌内蒙古呼和浩特市第二中学 C080701 阳光内蒙古呼和浩特市第二中学 C080702 卢毅忱内蒙古师大附中 C080703 莎日娜内蒙古呼和浩特市第二中学 C080704郭嘉琦内蒙古海拉尔二中 C080705 孔祥宇内蒙古包头市一机一中 C080706 陶佳睿内蒙古包头市一机一中 C080707 刘玉炯内蒙古包头市一机一中 C080708 黄金紫内蒙古海拉尔二中 C080709 杨之涵内蒙古师大附中 C080710 霍华德内蒙古师大附中 C080711 马琼内蒙古包头市第九中学 C080712 崔荔内蒙古包头市一机一中 C080713 张逸尘内蒙古包头市第九中学 C080714 李春炎内蒙古赤峰乌丹一中 C080715 赵昱凝内蒙古包头市一机一中 C080716 康元基内蒙古海拉尔二中 C080717 张嘉洋内蒙古通辽市五中 C080718 陈伟中内蒙古呼和浩特市第二中学 C080719 金欣内蒙古鄂尔多斯市一中 C080720 王雪内蒙古呼和浩特市第二中学 C080721辽宁省姓名学校编号姓名学校编号胡剑书辽宁省实验中学 C080801 金云鹤东北育才学校 C080802 胡元晖大连育明高级中学 C080803 曲培源沈阳二中 C080804 高可言辽宁省实验中学 C080805 王子鹤东北育才学校 C080806 王作宸大连市第八中学 C080807 荆慧泽东北育才学校 C080808 孙伯文东北育才学校 C080809 刘翰文辽河油田第一高级中学 C080810 刘剑南辽宁省实验中学 C080811 由思宇辽宁省实验中学 C080812 王斯博大连育明高级中学 C080813 黄贤睿大连育明高级中学 C080814 万富强大连市第八中学 C080815 韩明宇本溪市第一中学 C080816 刘子华东北育才学校 C080817 刘子枫大连市第二十四中学 C080818 崔知涵大连市第二十四中学高二C080819 张艺家大连育明高级中学 C080820 孙鹏轩大连育明高级中学 C080821 赵鸿翔大连育明高级中学 C080822 张博大连育明高级中学 C080823 赵证辽河油田第一高级中学 C080824 孙浩辽河油田第一高级中学 C080825 谢纬岳辽河油田第一高级中学 C080826 许文博沈阳市第120中学 C080827 李源晋东北育才学校 C080828 徐巧童辽宁省实验中学 C080829 杨梦曦辽宁省实验中学 C080830 常一阳大连育明高级中学 C080831 高培鑫大连育明高级中学 C080832 雷玉大连育明高级中学 C080833 惠玺璇大连育明高级中学 C080834 师帅大连育明高级中学 C080835吉林省姓名学校编号姓名学校编号王抒扬东北师大附属中学 C080901 王苑先吉林市第一中学 C080902 李钊吉林市第一中学 C080903 赵秋辰东北师大附属中学 C080904 张弛吉林省实验中学 C080905 于一洋长春市十一高中 C080906 刘贺男四平市第一高级中学 C080907 关尔佳东北师大附属中学 C080908 吕航延边第二中学 C080909 曹晏铭吉林市第一中学 C080910谢方超东北师大附属中学 C080911 张力元吉林市第一中学 C080912 张峣东北师大附属中学 C080913 朴俊宇吉林市第一中学 C080914 陈野长春市十一高中 C080915 刘小晴东北师大附属中学 C080916 张睿东北师大附属中学 C080917 王宇豪吉林市第一中学 C080918 安彤吉林市江城中学 C080919 孙铭泽东北师大附属中学 C080920 于松民长春市十一高中 C080921 杨肖易吉林油田高级中学 C080922 武诣霖东北师大附属中学 C080923 张维一吉林市第一中学 C080924 张芳宇东北师大附属中学 C080925 杨添舒长春第二实验中学 C080926 刘家成四平市第一高级中学 C080927 丁仲博东北师大附属中学 C080928 王赫吉林油田高级中学 C080929 凌龙长春市十一高中 C080930 程子豪吉林省实验中学 C080931 焦阳四平市第一高级中学 C080932 任来东北师大附属中学 C080933 马一嘉东北师大附属中学 C080934 刘博长春市第六中学 C080935 张巍钟东北师大附属中学 C080936黑龙江省姓名学校编号姓名学校编号侯世安哈尔滨市第三中学 C081001 张卓然佳木斯市第一中学 C081002 陶船思博哈尔滨师范大学附属中学高二C081003 崔汉超齐齐哈尔实验中学 C081004 许强佳木斯市第一中学 C081005 陈石哈尔滨师范大学附属中学 C081006 郭杰夫齐齐哈尔实验中学 C081007 李竹哈尔滨师范大学附属中学 C081008 曲世联齐齐哈尔实验中学 C081009 檀宇石哈尔滨市第三中学 C081010 王诗槐大庆铁人中学 C081011 吴玉祥齐齐哈尔实验中学 C081012 张穹哈尔滨市第三中学 C081013 李卓哈尔滨师范大学附属中学 C081014 沈智恒佳木斯市第一中学 C081015 刘洪权齐齐哈尔实验中学 C081016 张天佳木斯市第一中学 C081017 周炜琦大庆实验中学 C081018 刘养鹏齐齐哈尔实验中学 C081019 姜蕴哲齐齐哈尔实验中学 C081020 申弘光哈尔滨师范大学附属中学高二C081021 祝云齐哈尔滨师范大学附属中学 C081022陕西省姓名学校编号姓名学校编号王维侬西安交通大学附中 C081101 刘晨昊西安交通大学附中 C081102 吴雨桓西安交通大学附中 C081104 薛博阳西安高新一中 C081105 温健西北工业大学附中 C081106 周凌云陕西师范大学附中 C081107 王萌西安市铁一中学 C081108 张凯强西安交通大学附中 C081109 马迪西安交通大学附中 C081110 安泰桦西安高新一中 C081111 高唯陕西师范大学附中 C081112 赵潇西安交通大学附中 C081113 王雨陕西师范大学附中 C081114 朱轶伦西安交通大学附中 C081116 王西蒙西安交通大学附中 C081117 刘楚龙西安市铁一中学 C081118董艺萌西安交通大学附中 C081119 崔保全长安一中 C081120 张睿智西安高新一中 C081121 许骁西安交通大学附中 C081122 刘文驰陕西师范大学附中 C081123 王贺西安交通大学附中 C081124 康冠宇西安高新一中 C081126 薛瑞文西北工业大学附中 C081127 王绍辉西安交通大学附中 C081128 李钰西安高新一中 C081129 岳骁陕西师范大学附中 C081130甘肃省姓名学校编号姓名学校编号赵泉朴西北师大附中 C081201 闫鹏起西北师大附中 C081202 赵路睿兰州一中 C081203 许鑫西北师大附中 C081204 吴昊西北师大附中 C081206 王野峰兰州一中 C081208 陈庆智西北师大附中 C081210 赵玉文西北师大附中 C081211 郑凯元兰州一中 C081212 张理升西北师大附中 C081214 阎婷西北师大附中 C081215 汪璐西北师大附中 C081216 富多勋民勤一中 C081218 孙振尧西北师大附中 C081219 毛汉冬酒泉中学 C081220 李亨德武威一中 C081221 宋彦蓉西北师大附中 C081222 杨怡欣西北师大附中 C081223 罗宇峰西北师大附中 C081224 许逸飞西北师大附中 C081225宁夏省姓名学校编号姓名学校编号贾若溪宁夏银川一中 C081301 王涛银川市第二中学 C081302 柳杨宁夏银川一中 C081303 张汇卓银川市第二中学 C081304 郜勋银川市第二中学 C081305 李一同宁夏银川一中 C081306 石梦瑶宁夏银川一中 C081307 刘逸帆宁夏银川一中 C081308 张艳宁夏银川一中 C081309 马媛宁夏银川一中 C081310青海省姓名学校编号姓名学校编号杨辰凌湟川中学 C081401 丁冉升湟川中学 C081402 马强湟川中学 C081403 卢嘉毅湟川中学 C081404姓名学校编号姓名学校编号王腾乌鲁木齐市第一中学 C081501 李一乌鲁木齐市高级中学 C081502 李文轩乌鲁木齐市实验中学 C081503 陈浩鹏乌鲁木齐市实验中学 C081504 黄宣睿乌鲁木齐市兵团二中 C081505 周佳静乌鲁木齐市第一中学 C081506 牛晓宇乌鲁木齐市实验中学 C081507 杨鹤乌鲁木齐市第一中学 C081508 范鹏飞米泉一中 C081509 张姝婷乌鲁木齐市实验中学 C081510 张娟乌鲁木齐市实验中学 C081511 刘亮乌鲁木齐市第一中学 C081512 魏聪睿乌鲁木齐市第一中学 C081513 周禾乌鲁木齐市第八中学 C081514 唐瑞乌鲁木齐市实验中学 C081515 范腾远乌鲁木齐市高级中学 C081516 邓瑗瑗乌鲁木齐市第一中学 C081517 刘昕乌鲁木齐市兵团二中 C081518 胡宗羽乌鲁木齐市第一中学 C081519 冯路遥乌鲁木齐市实验中学 C081520 赵子丰乌鲁木齐市兵团二中 C081521山东省姓名学校编号姓名学校编号魏远明寿光市第一中学 C081601 张明达山东省实验中学 C081602 刘祎阳山东省实验中学 C081603 察明扬山东省实验中学 C081604 常睿东营市胜利一中 C081605 臧正山东省实验中学 C081606 王璨山东省实验中学 C081607 申伟日照市第一中学 C081608 刘敬源聊城市第一中学 C081609 康峻莱阳市第一中学 C081610 郭小璇聊城市第一中学 C081611 马建青高密市第一中学 C081612 沈蒙泰安市第一中学 C081614 任东东营胜利一中 C081615 刘冬宇山东省实验中学 C081616 徐伟东营胜利一中 C081617 傅佳驹山东省实验中学 C081618 王建功寿光市第一中学 C081619 王玞琳山东省实验中学 C081620 吴海培山东师范大学附中 C081621 贾斐山东省实验中学 C081622 李剑山东省实验中学 C081625 马睿琦山东省实验中学 C081626 刘宇辰山东师范大学附中 C081627 付申强高密市第一中学 C081629 万东俨东营胜利一中 C081630 张烨聊城一中 C081631 张恒志寿光市第一中学 C081632 袁孟腾寿光市第一中学 C081633 李辰寿光现代中学 C081634 张迎新青岛二中 C081635 张龙飞寿光现代中学 C081636 李凡淄博实验中学 C081637 徐嘉炜潍坊市第一中学 C081638 毕舟东营胜利一中 C081639 张晓辉潍坊市第一中学 C081640 李根山东师范大学附中 C081641 王文浩广饶市第一中学 C081643姓名学校编号姓名学校编号许言南师附中 C081701 李超江苏省梁丰高级中学 C081702 刘苏萌南师附中 C081703 左淦丞金湖中学 C081704 杨海洋江苏省常熟中学 C081705 姜蔚蔚通州中学 C081706 戚举鹏大丰高级中学 C081707 周天江苏省梁丰高级中学 C081708 张耀康江苏省常州高级中学 C081709 徐振东南师附中 C081710 吴凌皓如皋中学 C081711 沈蔚然如皋中学 C081712 刘任翔金陵中学 C081713 连宸南京外国语学校 C081714 宋超常州市第一中学 C081715 顾同涵南师附中 C081716 吴子毅金陵中学 C081717 杨骏骋金陵中学 C081718 席桂鹏大丰高级中学 C081719 王宇翔大丰高级中学 C081720 张骏江苏省常熟中学 C081721 段西嘉江苏省常州高级中学 C081722 韩浩江苏省东台中学 C081723 毛俊骅金陵中学 C081725 何晨江苏省东台中学 C081726 叶宇轩南师附中 C081727 冯天恒大丰高级中学 C081728 陈熹海门中学 C081730 徐嘉苏江苏省常州高级中学 C081731 蒋奕江苏省常州高级中学 C081732 尤宇江苏省泰州中学 C081733 王际栋南师附中 C081734 戴晔如皋中学 C081735 顾贤睿通州中学 C081736 江湧江苏省东台中学 C081737 蔡陈骋海门中学 C081738 谢家晔江苏省常州高级中学 C081739 张弛江苏省启东中学 C081740 张昊威南师附中 C081741 李凡南京外国语学校 C081742 毛欣月无锡市第一中学 C081743 李鹏鹏通州中学 C081744浙江省姓名学校编号姓名学校编号赵诗杰杭州二中 C081801 崔飘扬嘉兴一中 C081802 柴鹏飞金华一中 C081803 施力杭州二中 C081804 张一科慈溪中学 C081805 林智豪镇海中学 C081806 喻佳兵金华一中 C081807 何力学军中学 C081809 王浩博舟山中学 C081810 刘易杭州二中 C081811 吴航通杭州二中 C081812 徐可成镇海中学 C081813 任梁鲁迅中学 C081814 胡昭熙镇海中学 C081815 杜纬辰金华一中 C081816 沈涤嘉兴一中 C081817 周行浩鄞州中学 C081818 方金达慈溪中学 C081819 张超诸暨中学 C081820 陈烈春晖中学 C081821 陈声远杭州二中 C081822 樊亚文桐乡市高级中学 C081823 洪莉莎杭州二中 C081824 王垚祺舟山中学 C081825 王东睿杭州二中 C081826 陈彦宁波效实中学 C081827张凯冬杭州外语学校 C081828 蒋中平嘉兴一中 C081829 陈凌峰诸暨中学 C081830 吴思彧镇海中学 C081831 冯奇嘉兴一中 C081832 李天君鄞州中学 C081833 陆海东萧山中学 C081834 刘天依嘉兴一中 C081835 刘祎旸学军中学 C081836 沃泽华北仑中学 C081837 金睿杭州余杭第二高级中学 C081838 李博闻学军中学 C081839 俞浩新昌中学 C081840 林文锋温州中学 C081841 周才强台州一中 C081842 刘斌温岭中学 C081843 缪仁梁温州中学 C081844安徽省姓名学校编号姓名学校编号储鹏翔安徽师范大学附属中学 C081901 刘驰马鞍山市第二中学 C081902 刘琪安徽师范大学附属中学 C081903 柏力晨马鞍山市第二中学 C081905 何景熙铜陵市第一中学 C081906 晏子聪芜湖市第一中学 C081907 高原马鞍山市第二中学 C081908 陈硕嵩合肥一六八中学 C0819O9 谢诗航屯溪一中 C081910 魏泽华马鞍山市第二中学 C081911 金灿灿安徽师范大学附属中学 C081912 赵洁旻合肥市第六中学 C081913 邸世宇铜陵市第一中学 C081914 朱丹娜安徽师范大学附属中学 C081915 伍陈诚马鞍山市第二中学 C081916 赵笑然安徽师范大学附属中学 C081917 恽歌安徽师范大学附属中学 C081918 韩靖安徽师范大学附属中学 C081919 邓耿安徽省六安第一中学 C081920 陶平洋马鞍山市第二中学 C081921 胡骁翔马鞍山市第二中学 C081922 徐方达安徽师范大学附属中学 C081923 李鑫铜陵市第一中学 C081924 曹世杰安徽师范大学附属中学 C081925 殷久超安徽省宣城中学 C081926 鲁扬安庆市第一中学 C081927 程玺安庆市第一中学 C081928 卢亚骏铜陵市第一中学 C081929 申国华合肥市第一中学 C081930 黄铮马鞍山市第二中学 C081931 王昊人合肥市第一中学 C081933江西省姓名学校编号姓名学校编号辜梓健江西师范大学附属中学 C082001 郑凰临川第二中学 C082002 游峰南昌市第二中学 C082003 章方励南昌市第二中学 C082004 郑嘉楠南昌市铁路第一中学 C082005 胡兴好万年县中学 C082006 周萌江西师范大学附属中学 C082007 郭洋裕吉安市第一中学 C082008 徐非凡南昌市外国语学校 C082009 王任广煜江西师范大学附属中学 C082010 徐素琴贵溪市第一中学 C082011 黎浪宜春中学 C082012 毛崴芃鹰潭市第一中学 C082013 邓喆抚州市第一中学 C092014。
08年全国化学竞赛(初赛)试题与答案

最新高中化学(初赛)试题第1题 (15分)1-1 2009年10月合成了第117号元素,从此填满了周期表第七周期所有空格,是元素周期系发展的一个里程碑。
117号元素是用249Bk 轰击48Ca 靶合成的,总共得到6个117号元素的原子,其中1个原子经p 次α衰变得到270Db 后发生裂变;5个原子则经q 次α衰变得到281Rg 后发生裂变。
用元素周期表上的117号元素符号,写出得到117号元素的核反应方程式(在元素符号的左上角和左下角分别标出质量数和原子序数)。
1-3 一氯一溴二(氨基乙酸根)合钴(III)酸根离子有多种异构体,其中之一可用如下简式表示。
请依样画出其他所有八面体构型的异构体。
第2题 (5 分) 最近我国有人报道,将0.1 mol L -1的硫化钠溶液装进一只掏空洗净的鸡蛋壳里,将蛋壳开口朝上,部分浸入盛有0.1 mol L -1的氯化铜溶液的烧杯中,在静置一周的过程中,蛋壳外表面逐渐出现金属铜,同时烧杯中的溶液渐渐褪色,并变得混浊。
2-1设此装置中发生的是铜离子和硫离子直接相遇的反应,已知φӨ(Cu 2+/Cu)和φӨ(S/S 2-)分别为0.345 V 和 -0.476 V ,nFE Ө =RT ln K ,EӨ表示反应的标准电动势,n 为该反应得失电子数。
计算25o C 下硫离子和铜离子反应得到铜的反应平衡常数,写出平衡常数表达式。
2-2金属铜和混浊现象均出现在蛋壳外,这意味着什么?2-3 该报道未提及硫离子与铜离子相遇时溶液的pH 。
现设pH = 6,写出反应的离子方程式。
2-4请对此实验结果作一简短评论。
第3题( 7分) 早在19世纪人们就用金属硼化物和碳反应得到了碳化硼。
它是迄今已知的除金刚石和氮化硼外最硬的固体。
1930年确定了它的理想化学式。
左下图是2007年发表的一篇研究论文给出的碳化硼晶胞简图。
3-1该图给出了晶胞中的所有原子,除“三原子”(中心原子和与其相连的2个原子)外,晶胞的其余原子都是B12多面体中的1个原子,B12多面体的其他原子都不在晶胞内,均未画出。
赛(省级赛区)获一等奖学生名单
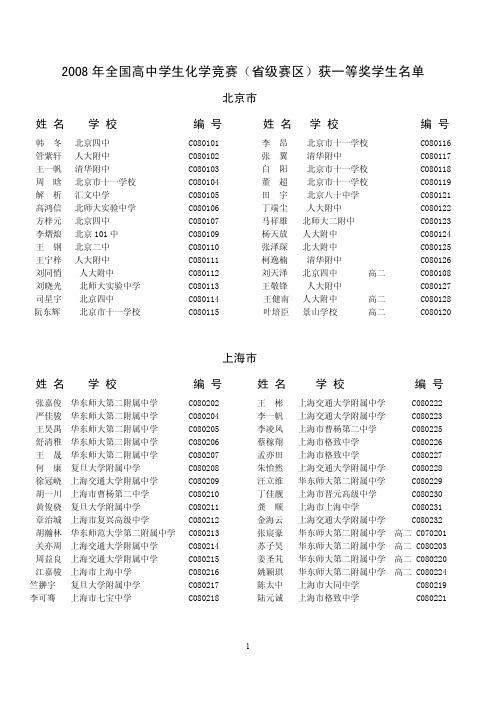
C080701 C080702 C080703 C080704 C080705 C080706 C080707 C080708 C080709 C080710 C080711
姓名
马琼 崔荔 张逸尘 李春炎 赵昱凝 康元基 张嘉洋 陈伟中 金欣 王雪
学校
编号
内蒙古包头市第九中学 内蒙古包头市一机一中 内蒙古包头市第九中学 内蒙古赤峰乌丹一中 内蒙古包头市一机一中 内蒙古海拉尔二中 内蒙古通辽市五中 内蒙古呼和浩特市第二中学 内蒙古鄂尔多斯市一中 内蒙古呼和浩特市第二中学
编号
C080101 C080102 C080103 CO80104 C080105 C080106 C080107 C080109 C080110 C080111 C080112 C080113 C080114 C080115
姓名 学校
李昂 张翼 白阳 董超 田宇 丁端尘 马祥雄 杨天放 张泽琛 柯逸楠 刘天泽 王敬锋 王健南 叶培臣
高二
重庆市
编号
C080401 C080402 C080403 C080404 C080405 C080406 C080407 C080408 C080409 C080410 C080411 C080412 C080413 C080414 C080420
姓名 学校
编号
王新阳 秦朗 梁晓军 程农壹 赵勇 张绍勇 李坤 易竺倩 陈嗣炫 谯跃银 张元通 杨明朗 李康南 陶鑫 洪雪麟
C080712 C080713 C080714 C080715 C080716 C080717 C080718 C080719 C080720 C080721
姓名 学校
胡剑书 金云鹤 胡元晖 曲培源 高可言 王子鹤 王作宸 荆慧泽 孙伯文 刘瀚文 刘剑南 由思宇 王斯博 黄贤睿 万富强 韩明宇 刘子华 刘子枫
2008年福建省化学竞赛初赛试题及答案2008年福建省化学竞赛初赛试题及答案
2008年福建省高中学生化学竞赛预赛试题一.(10分)填空1.教科书中将铝酸盐表面描述为强Br nsted酸,而硅胶则是非常弱的酸。
SiO2晶格中有了Al3+后酸性加强的原因。
的是尽兴、舒畅、透彻,故应选“淋漓尽致”试卷试题“当是”,侧重应当;“便是”侧重在某种条件或、2.已知有两种形式的氮化硼,常见的一种是滑的灰色的物质,第二种是在高压下合成的,是已知最硬的物质之一。
在300℃以下,两者皆保持固体状态,这两种构型的氮化硼分别类似于和。
3.已知某黄色固体是一种主族元素的简单化合物,它不溶于热水而溶于热的稀盐酸,生成一种橙红色溶液。
当这一溶液冷却时,有一种白色晶态沉淀物析出。
加热溶液时,白色沉淀物又溶解,这个化合物是。
4.酸化某溶液得S和H2SO3,则原溶液中可能含哪些含硫化合物广府人族群的风味菜点试卷试题C试卷试题“菜点选编”丛书化学教案把潮菜与福建菜合编在一起化学教案说明在。
二.(10分)绿色化学法制备天青石有效地克服了传统生产方法中转化率较低、三废污染严重、能耗高、生产复杂等种种弊端。
制备的碳酸锶产品化学纯度平均达到99. 5%,并且可制备质量较高的工业副产品硫酸铵,从而大大降低了生产成本。
我国鄂东某地的天青石,其中有效成分的平均质量分数为80% ,同时含有少量的Ba, Ca, Mg, SiO2 , Fe2O3 , FeO等杂质。
天青石可以同NH4HCO3 溶液在一定的条件下发生化学反应,而生成含有某些杂质的SrCO3 粗级产品。
在上述反应过程中,添加适量的NH4Cl作为催化剂,可以使反应速度明显加快。
将分离出(NH4)2SO4溶液后的沉淀物用HCl溶解,以制取含有可溶性SrCl2及某些杂质的锶盐溶经净化除去其中的Ba2 + , Ca2 +等杂质后,即可制成纯度较高的SrCl2溶液。
此时向其中加入经过净化的碳酸氢铵溶液,经反应生成纯净的碳酸锶沉淀,沉淀物碳酸锶经脱水、洗涤、干燥、粉碎,得到高纯碳酸锶产品。
2008年全国高中学生化学竞赛四川省预赛

2008年全国高中学生化学竞赛四川省预赛自贡市获奖名单各区县教研室、各直属高中学校:2008年全国高中学生化学竞赛四川省预赛(即自贡市预赛)已经结束,现将四川省预赛获奖学生及其省级“优秀指导教师”名单通知如下(同级别奖排名不分先后),请各单位速到市教科所中学室化学组(304室—电话:8125775)领取证书,并希望继续组织进行好2008年9月15日的全国高中学生化学竞赛四川省初赛。
四川省优秀指导教师奖(37人)熊建伟冷松胡元莉张仁惠黄德华李红卢平郭鸿肖兴蓉刘明亮张泽仪黄柳宋顺芳李涛徐裕钟光荣黄仲君王吉康姚旎杨仕学张云军郝丽清罗莉汤山平罗安富李长春侯岳方何启斌邹友才钟历芬唐方元李贤玲张义波陈银宗龙旭祥肖淑英李帮宁四川省(预赛)一等奖(90人)自贡一中:代楚睿柳智邹英吴利平邓润平朱熙毛露萍朱凯宁曾骏飞黄勇郑顺王彬曾友财曾斌毅廖强赖琴蜀光中学:许昱良黄潇易雪莹敖立翔刘斯伟童光华郭耀川陈信宇黄天意李杰丁枫李宗锐郭雨晨刘云逸何永权刘晓帆刘潘杨智伟彭泽鑫宋伟郭云飞郑婧谢方泉自贡六中:曾凯锋陈魏自贡十中:刘国强十四中:黄祥坤旭川中学:刘曼篱刘利自贡九中:罗林荣县中学:吴永利梁骏罗彬又胡再冉余洁张砚杨涛宋科康杨杨陈勇洁邹艾灵张磊毛达诚杨梅胡旭兰敏荣县一中:彭真骐刘昌洪富顺一中:刘正雄邹建梁井龙管锋富顺二中:吴相猴张万斌胡瑞莉吴一川江先富彭继光龚小平杠王庆洪祥平周铭芝谢莉黄硕王世权陈世伟龙成平黄敏龙鑫杨婵陈丹阳忠义富顺三中:刘军王大召四川省(预赛)二等奖(122人)自贡一中:林钰东刘云卿邓仁君晏文炬王欢王旷达朱月婷曾和璧刘军张盛金雪峰郭飞朱慧余涯若殷利洪王嘉礼赵晨陈蜀光中学:林聪景予张楷婧邹福强赵佳文柳菁翠蒙冰皓黄欢黄雷蕾张袁蕾黄斯毅李晓丹江体强谢钊懿王逸凡李若丹王精政钟钥莹李思桥陈宇汪翊周鑫宏谢跃朱汭罗利平唐新雨自贡六中:卢小刚虞文庆陈晓东余蛟龙自贡十中:李洪十四中:邵强旭川中学:刘建航陈家飞钟巧文余冰阳黄宴曦陈金凤陈凌佚荣县中学:梁东伟李航刘焱滨罗刚彭维英赵恒博徐鸿霖莫娟曹丽娟邓国杰童茂佳冯洧荣范庆谢超欧政义邱羽杨梅詹亮钟直成童誉伍崇毅邓雄车甜婷罗俊欣荣县一中:王清伟李德曾治翔邱春溶富顺一中:叶刚蔡勇伍雪梅康承兰王序丹李林峰徐辉谭英明富顺二中:黄礼王能杰张美霞吕太洪王文学江元杨郑超张世平周鹏曾伟岳珊陈永龙陈军李德明罗章陶郑传禧余金鸿宋信健刘杰罗晓勇富顺三中:陈超陈联彬舒云洁永年中学:赵兴洪范清涛城关中学:陈树明方俊平陈健超李万桥吴从铭四川省(预赛)三等奖(195人)自贡一中:田成城彭文杰王潇豪范利军荣浩余倩陈超范亚莉朱泽培梁泊钟庆玲刘明洋刘强吴琪韩王耀周月项建超袁楷廖秀梅柳正渊陈骏骄黄磊代文超李辰戈蜀光中学:代鹏王浩王川袁柳钱美君罗玮玮杨皓罗杨胡浩翔刘珂名张涛张利刘腾姣张寒希张梦雨罗莅陈峻平刘隽颖陈成钟玲杨珍万文静李振唐陈思何凤兰代佶果邹咏刘思言宋礼重范坤杰戴旎艟周俊陈烨牟亚玲王莉蔡根蒂刘承祥刘川郑姮唐鑫媛陈自强牟红钟陈牟冬梅卢丽洋何雨曾芸晶龙春梅詹涵钰范骢骧倪芸璐李沛琳王丹萍张柯罗俊松倪倩朱凡刘丹周律宇周依琳杨路曾逸哲黄兮吴杨肖玉梅黄远超杨胜平钟洲杨建丁梦西李旭自贡六中:李秀敏汤荟玉易玉陈梅郑华丽苗学军自贡十中:杨彩玲十四中:朱大勇旭川中学:吴芊王静罗国松陈健罗练廖玉波自贡九中:夏建路邹林詹智荣县中学:夏晨李浩然曹俊张静胡清泉肖凯强邱菊郭晓琴黄铭建刘侨李舒吴兴龚亮黄治翔邓海东胡彬李泉松李熙贾茂乔方文静陈莉李全代溢张荣圆曹雪梅张继东严武军邱文博荣县一中:张若澜晏杰曹勇林平刘勇富顺一中:吴彬张建桥伍连萍李凤杨彬卓磊喻华江黄祥斌谢山付欢崔洪欧洪封强代仕超张天泉彭传金富顺二中:陈寿长冯钰淋张品张伟牟宗元邹付强高亚琳郭朝科罗政莲范善东胡吉东廖欢胡敬强杨阳马礼鹏黄亚运叶超余婷聂自强陈洪刘东源刘宏薛波高仁才富顺三中:郑华陶伟傲元富洪祥盛陈果吴超城关中学:金钰陈涛刘小波邓宗权自贡市教育科学研究所2008年7月3日附:2008年全国高中学生化学竞赛四川省初赛时间:9月15日(周一)上午9∶00—12∶00地点:四区竞赛地点在自贡蜀光中学,两县自定人数:自贡一中62蜀光中学120自贡六中11自贡14中 2贡井19荣县132富顺133。
中国化学会全国高中学生化学竞赛省级赛区试题及答案

第27届中国化学奥林匹克初赛试题、解答、评分标准及评分细则第1题12分 写出下列化学反应的方程式1-1 加热时;三氧化二锰与一氧化碳反应产生四氧化三锰..1-2 将KCN 加入到过量的CuSO 4水溶液中..1-3 在碱性溶液中;Cr 2O 3和K 3FeCN 6反应..1-4 在碱性条件下;ZnCN 42 和甲醛反应..1-5 FeOH 2在常温无氧条件下转化为Fe 3O 4..1-6 将NaNO 3粉末小心加到熔融的NaNH 2中;生成NaN 3没有水生成..1-1 3Mn 2O 3+CO =2Mn 3O 4+CO 2 2分1-2 4CN +2Cu 2+=2CuCN +CN 2 2分1-3 Cr 2O 3+6FeCN 63 +10OH =2CrO 42 +6FeCN 64 +5H 2O 2分1-4 ZnCN 42 +4H 2CO +4H 2O =4 HOCH 2CN +ZnOH 42 2分1-5 3FeOH 2=Fe 3O 4+H 2+2H 2O 2分1-6 NaNO 3+3NaNH 2=NaN 3+NH 3+3NaOH 2分1方程式正确才能得满分..2若全部物质皆写对而未配平;可得1分..第2题23分 简要回答或计算2-1 Bi 2Cl 82-离子中铋原子的配位数为5;配体呈四角锥型分布;画出该离子的结构并指出Bi 原子的杂化轨道类型..Bi 2Cl 82-的结构:BiClClBi Cl ClCl 2-或 BiCl Cl Bi Cl Cl Cl 2- 2分.......未画成楔形键不扣分;不画电子对不扣分;若画了电子对且画成如上图蓝所示的连线;则与电子对相连的线不画成虚线左、虽画成虚线但远离Bi 原子;扣0.5分杂化轨道类型:sp 3d 2 1分2-2在液氨中;E θNa +/Na =-1.89V;E θMg 2+/Mg =-1.74V ;但可以发生Mg 置换Na 的反应:Mg +2NaI =MgI 2+2Na;指出原因..MgI 2在液氨中难溶.. 1分答微溶或溶解度小;也可得1分..2-3将Pb 加到氨基钠的液氨溶液中;先生成白色沉淀Na 4Pb;随后转化为Na 4Pb 9绿色而溶解..在此溶液中插入两块铅电极;通直流电;当1.0 mol 电子通过电解槽时;在哪个电极阴极或阳极上沉积出铅写出沉积铅的量..阳极 1分9/4mol 1分2-4下图是某金属氧化物的晶体结构示意图..图中;小球代表金属原子;大球代表氧原子;细线框出其晶胞..2-4-1写出金属原子的配位数m 和氧原子的配位数n ..2-4-2写出晶胞中金属原子数p和氧原子数q..2-4-3写出该金属氧化物的化学式金属用M表示..2-4-1:m=4;n=4..m: 0.5分; n: 0.5分2-4-2:p=4;q=4.. p: 0.5; q:0.5分2-4-3:MO.. MO:1分2-5向含cis-CoNH34H2O23+的溶液中加入氨水;析出含{CoCoNH34OH23}6+的难溶盐..{ CoCoNH34OH23}6+ 是以羟基为桥键的多核络离子;具有手性..画出其结构..4分未画成楔形键;也得4分只画出1个对应体;也得4分2-6向K2Cr2O7和NaCl的混合物中加入浓硫酸制得化合物X154.9 g mol-1..X为暗红色液体;沸点117 o C;有强刺激性臭味;遇水冒白烟;遇硫燃烧..X分子有两个相互垂直的镜面;两镜面的交线为二重旋转轴..写出X的化学式并画出其结构式..X的化学式:CrO2Cl2 2分X的结构式:1分若画成两个Cr-O单键;只得0.5分; 若画成一个Cr-O单键和一个Cr=O双键;不得分..2-7实验得到一种含钯化合物PdC x H y N z ClO42;该化合物中C和H的质量分数分别为30.15% 和5.06%..将此化合物转化为硫氰酸盐PdC x H y N z SCN2;则C和H的质量分数分别为40.46%和5.94%..通过计算确定PdC x H y N z ClO42的组成..解法一:PdC x H y N z ClO42中;C和H的比例为30.15/12.01 : 5.06/1.008 =1:2即y=2x 1 1分PdC x H y N z SCN2中; C和H的比例为40.46/12.01 : 5.94/1.008 = 0.572即x+2 / y=0.572 2综合1、2;解得:x=13.89 ≈ 14; y=28 1分设PdC x H y N z ClO42的摩尔质量为M:则14×12.01/M=30.15%; 得M=557.7 g mol-11分z={557.7–106.4+12.01×14+ 1.008 28+2×35.45+64.00}/14.01= 3.99= 40.5分PdC x H y N z ClO42的组成为PdC14H28N4ClO42 ..0.5分解法二:设PdC x H y N z ClO42的摩尔质量为M;比较PdC x H y N z ClO42和PdC x H y N z SCN2知;PdC x H y N z SCN2的摩尔质量为:M-2×35.45+64.00-32.01+12.01+14.01=M-82.74 g mol-1根据C的质量分数;有:12.01×x=0.3015 M12.01×x+2 =0.4046 ×M-82.7424.02 =0.4046-0.3015 M-0.4046 ×82.74解得:M=557.7; x=142分根据H的质量分数;有:y =557.7×0.0506 / 1.008 =27.99 =28 1分则:z={557.7-106.4+12.01×14+1.008 ×28+2 ×35.45+64.00}/14.01=3.99=41分其他合理计算且得出正确结果亦得4分2-8甲烷在汽车发动机中平稳、完全燃烧是保证汽车安全和高能效的关键..甲烷与空气按一定比例混合;氧气的利用率为85%;计算汽车尾气中O2、CO2、H2O和N2的体积比空气中O2和N2体积比按21: 79计;设尾气中CO2的体积为1..甲烷完全燃烧:CH4+2O2=CO2+2H2O1体积甲烷消耗2体积O2生成1体积CO2和2体积H2O1分由于O2的利用率为85%;反应前O2的体积2/0.85=2.35剩余O2的体积:2.35 – 2 =0.35 1分混合气中N2的体积:2.35 79/21= 8.84 N2不参与反应;仍保留在尾气中..汽车尾气中;O2、CO2、H2O和N2的体积比为0.35:1:2:8.84.. 1分第3题11分白色固体A;熔点182o C;摩尔质量76.12 g mol 1;可代替氰化物用于提炼金的新工艺..A的合成方法有:1142o C下加热硫氰酸铵;2CS2与氨反应;3CaCN2和NH42S水溶液反应放出氨气..常温下;A在水溶液中可发生异构化反应;部分转化成B..酸性溶液中;A在氧化剂如Fe3+、H2O2和O2存在下能溶解金;形成取sp杂化的AuI 配合物..3-1画出A的结构式..3-2分别写出合成A的方法2、3中化学反应的方程式..3-3画出B的结构式..3-4写出A在硫酸铁存在下溶解金的离子方程式..3-5 A和AuI形成的配合物中配位原子是什么3-6在提炼金时;A可被氧化成C:2A→C + 2e ;C能提高金的溶解速率..画出C的结构式..写出C和Au反应的方程式..3-12分3-2反应2:1分反应3:1分3-32分3-4 1分3-5 配位原子为S.. 1分3-6或2分写成下二式不得分:和C和Au反应的方程式:S2C2NH242+ +2Au + 2SCNH22 → 2AuSCNH222+ 1分第4题7分人体中三分之二的阴离子是氯离子;主要存在于胃液和尿液中..可用汞量法测定体液中的氯离子:以硝酸汞II为标准溶液;二苯卡巴腙为指示剂..滴定中Hg2+与Cl 生成电离度很小的HgCl2; 过量的Hg2+与二苯卡巴腙生成紫色螯合物..4-1 简述配制硝酸汞溶液时必须用硝酸酸化的理由..抑制Hg2+水解..1分H3O+浓度增大;阻止HgOHNO3的生成..若写出了水解产物;但又错写为HgO;不扣分..4-2 称取1.713g HgNO32 x H2O;配制成500 mL溶液作为滴定剂..取20.00 mL 0.0100 molL 1 NaCl标准溶液注入锥形瓶;用1mL 5% HNO3酸化;加入5滴二苯卡巴腙指示剂;用上述硝酸汞溶液滴定至紫色;消耗10.20 mL..推断该硝酸汞水合物样品的化学式..n HgNO32=1/2n NaCl=1/2×20.00 mL×10-3L mL-1×0.0100 mol L-1 =1.00 ×10-4 molc HgNO32=1.00 ×10-4 mol÷10.20 mL×10-3L mL-1=9.80×10-3 mol L-1500 mL溶液中硝酸汞的摩尔数即水合物的摩尔数=9.80×10-3 mol L-1×0.500 L=4.90×10-3 mol硝酸汞水合物摩尔质量M=m/n=1.713g /4.90×10-3mol=350 g.mol-1结晶水的摩尔质量M H2O=M HgNO32 .x H2O-M HgNO32=350-324.6 g.mol-1=25 gmol-1 x=n H2O=25 g mol-1÷18.0 g mol-1=1.4该硝酸汞水合物样品的化学式: HgNO32 ·1.4H2O 2分4-3 取0.500 mL血清放入小锥形瓶;加2mL去离子水、4滴5%的硝酸和3滴二苯卡巴腙指示剂;用上述硝酸汞溶液滴定至终点;消耗1.53mL..为使测量结果准确;以十倍于血清样品体积的水为试样进行空白实验;消耗硝酸汞溶液0.80 mL..计算该血清样品中氯离子的浓度毫克/100毫升..0.500 mL血清样品实际消耗的硝酸汞标准溶液为1.53-0.80×0.1 mL=1.45 mL 1分n Cl-=n Hg NO32×2=9.80 ×10-3 mol L-1×1.45×10-3 L×2=2.84×10-5 mol 1分c Cl-=n Cl-/V试样=2.84×10-5 mol÷0.500 mL×10-3L mL-1=5.68 ×10-2 mol L-1 1分相当于35.45 g mol-1×5.68 ×10-2 mol L-1=2.01×102 mg/100mL1分第5题10分M3XY呈反钙钛矿结构;是一种良好的离子导体..M为金属元素;X和Y为非金属元素;三者均为短周期元素且原子序数Z X<Z M<Z Y..M3XY可由M和X 、M和Y的二元化合物在约500K;3MPa的惰性气氛中反应得到..为避免采用高压条件;研究者发展了常压下的合成反应:M + MXA + MY → M3XY + 1/2A2gA2无色无味..反应消耗0.93g M可获得0.50 L A2气体25o C; 100kPa..气体常量R=8.314 kPa L mol-1 K-15-1计算M的摩尔质量..5-2 A、M、X、Y各是什么5-3写出M3XY发生水解的方程式..5-4 M3XY晶体属于立方晶系;若以X为正当晶胞的顶点;写出M和Y的坐标以及该晶体的最小重复单位..5-1 PV=nRTn A2=PV/RT=100 kPa×0.50 L / 8.314 kPa L mol-1 K-1×298K =0.020 mol由反应式知;消耗0.040 mol MM的摩尔质量:0.93 g / 0.040 mol=23 g mol-1 2分5-2 A:H;M:Na;X:O;Y:Cl 每个0.5分;共2分5-3 Na3OCl+H2O 2NaOH+NaCl 1分5-4 M的坐标:1/2; 0; 0;0; 1/2; 0;0; 0; 1/2..Y的坐标:1/2; 1/2; 1/2.. 4分Na3OCl;或1个正当晶胞;或1个素晶胞.. 1分第6题10分某同学从书上得知;一定浓度的Fe2+、CrOH4 、Ni2+ 、MnO42 和CuCl3 的水溶液都呈绿色..于是;请老师配制了这些离子的溶液..老师要求该同学用蒸馏水、稀硫酸以及试管、胶头滴管、白色点滴板等物品和尽可能少的步骤鉴别它们;从而了解这些离子溶液的颜色..请为该同学设计一个鉴别方案;用离子方程式表述反应并说明发生的现象若A与B混合;必须写清是将A滴加到B中还是将B滴加到A中..答案:第1步:在点滴板上分别滴几滴试样;分别滴加蒸馏水;颜色变蓝者为CuCl3 1分CuCl3 +4H2O =CuH2O42++3Cl 1分第2步:另取其他4种溶液;滴加到点滴板上;分别滴加稀硫酸..生成绿色沉淀的是CrOH4 随酸量增加又溶解;溶液变紫红且生成棕色沉淀的是MnO42-.. 2分CrOH4 +H+=CrOH3+H2O 1分CrOH3+3H+ =Cr3++3H2O3MnO42 +4H+=2MnO4 +MnO2+2H2O 1分若第1步用稀H2SO4;评分标准同上..第3步:将CrOH4 分别滴加到Fe2+ 和Ni2+ 的试液中;都得到氢氧化物沉淀..颜色发生变化的是Fe2+;不发生变化的是Ni2+ .. 2分Fe2++2CrOH4 =FeOH2 +2CrOH3 0.5分4FeOH2+O2+2H2O=4FeOH3 0.5分Ni2++2CrOH4=NiOH2 +2CrOH3 1分第7题5分根据所列反应条件;画出A、B、C、D和F的结构简式..每个结构简式1分;其他答案不得分..第8题10分画出下列反应中合理的、带电荷中间体1、3、5、7和8以及产物2、4、6、9和10的结构简式..8-18-28-38-4答案:8-1每结构简式1分;其他答案不得分;8-2每结构简式1分;画成也得分;其他答案不得分;8-3每结构简式1分;5也得1分; 6画成或没有标出得0.5分;其他答案不得分8-4每结构简式1分;其他答案不得分..第9题12分9-1常用同位素标记法研究有机反应历程..如利用18O标记的甲醇钠研究如下反应;发现最终产物不含18O..根据实验事实画出中间体的结构简式..答案:A: 2分B和C可互换;每结构简式2分其他答案不得分..9-2某同学进行如下实验时在碱性条件下得到了两个产物D和E;产率分别为74.3%和25.7%.. 1画出产物D和E的结构简式..2指明此反应所属的具体反应类型..3简述D产率较高的原因..4简述反应体系加入二氧六环的原因..1每结构简式1分;其他答案不得分..2芳香亲核取代反应1分;只答取代反应给0.5分..3正丁胺中氮原子的亲核能力比水中氧原子的强;而二级芳香胺中氮原子的亲核能力比水中氧原子的弱;因此使得D的产率高..2分4为了增加正丁胺和2;4-二硝基氯苯在水中的溶解度.. 1分其他答案不得分..郑重声明:本试题及答案版权属中国化学会所有;未经中国化学会化学竞赛负责人授权;任何人不得翻印;不得在出版物或互联网网站上转载、贩卖、赢利;违者必究..本试卷和相应答案将分别于2013年9月8日12:00和15日12:00在网站http:上公布..。
(完整word)2002~2008年全国高中学生化学竞赛(江苏赛区)夏令营选拔赛试题分类化学平衡

2002~2008年全国高中学生化学竞赛 (江苏省赛区)夏令营选拔赛试题分类化学平衡(2002年)7.(6分)已知,CrO 42-离子和Cr 2O 72-离子在水溶液中存在如下平衡: 2CrO 42-(aq)+2H +(aq)Cr 2O 72-(aq)+H 2O(1),K =1422242242102.1][][][⨯=+--H O Cr O Cr ⑴ 要使平衡向左移动,可以加 ,或加 ,或加某些金属离子如Ba 2+。
⑵ 请自行设计两个实验(简单说明实验操作和实验现象)来验证Ba 2+确实能使平衡向左移动。
(2003年)3.(共6分)提出查理定律的查理很幸运,碰巧开始时没有以N 2O 4来研究气体行为,否则他或许会得出一种相当特殊的温度效应。
对于平衡N 2O 4(g)2NO 2 (g),在 298K 时其K p = 0.1 p θ,而p K p 2214αα-=,α为N 2O 4的离解度,p 为平衡体系的总压。
假设,298 K 时,查理把0.015 mol 的N 2O 4放于一只2.44×103-m 3的烧杯中,当离解达到平衡后,他将看到平衡压力等于0.205p θ。
其对应的α = 0.33⑴ 在保持体积不变的前提下,查理做把温度升高10%的实验,即把温度升高至328K 。
根据理想气体定律,其压力也应只增大10%,即等于0.226p θ,但查理发现这时的压力为0.240p θ。
自然,问题是出在N 2O 4的离解度增加上了。
试求此时的α和K p 。
⑵ 若NO 2在298K 下的标准摩尔生成自由能为51.463kJ·mol 1-,试计算N 2O 4在298K下的标准摩尔生成自由能。
(2004年)2.(共9分)⑴ 谷氨酸的系统名为:2-氨基戊二酸(pKa 1=2.19,pKa 2=4.25,pKa 3=9.67)。
请回答下列问题:① 写出其结构式 ; ② 写出谷氨酸在pH=10.00的水溶液中,占优势的离子结构 ; ③ 若谷氨酸溶于pH=7的纯水中,所得溶液的pH 是x ,则x 7(填“>”或“<”);此氨基酸等电点是大于x 还是小于x?为什么? 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2008年9月18日评分通则:1.凡要求计算的,没有计算过程,即使结果正确也不得分。
2有效数字错误,扣0.5分,但每大题只扣1次。
3单位不写或表达错误,扣0.5分,但每大题只扣1次。
4只要求1个答案、而给出多个答案,其中有错误的,不得分。
5方程式不配平不得分。
6不包括在此标准答案的0.5分的题,可由评分组讨论决定是否给分。
第1题 (14分)1-1 EDTA 是乙二胺四乙酸的英文名称的缩写,市售试剂是其二水合二钠盐。
(1)画出EDTA 二钠盐水溶液中浓度最高的阴离子的结构简式。
C H 2NC H 2H 2C N H 2C CH 2H 2COO -COO --OOC-OOC H H (2分) 答(-OOCCH 2)2NCH 2CH 2N(CH 2COO -)2H H 或CH 2NH(CH 2COO -)22 得2分,质子必须在氮原子上。
(2) Ca(EDTA)2-溶液可用于静脉点滴以排除体内的铅。
写出这个排铅反应的化学方程式(用Pb 2+ 表示铅)。
Pb 2+ + Ca(EDTA)2- = Ca 2+ + Pb (EDTA)2-(1分)(3)能否用EDTA 二钠盐溶液代替Ca(EDTA)2-溶液排铅?为什么?不能。
若直接用EDTA 二钠盐溶液,EDTA 阴离子不仅和Pb 2+反应, 也和体内的Ca 2+结合造成钙的流失。
(答案和原因各0.5分,共 1分)1-2 氨和三氧化硫反应得到一种晶体,熔点205o C ,不含结晶水。
晶体中的分子有一个三重旋转轴,有极性。
画出这种分子的结构式,标出正负极。
(2分)硫氧键画成双键或画成S →O ,氮硫键画成N →S ,均不影响得分。
结构式1分,正负号1分。
答H 3NSO 3、H 3N-SO 3等不得分。
正确标出了正负号,如+H 3NSO 3-、+H 3N-SO 3-得1分。
其他符合题设条件(有三重轴,有极性)的结构,未正确标出正负极,得1分,正确标出正负极,得2分。
1-3Na2[Fe(CN)5(NO)]的磁矩为零,给出铁原子的氧化态。
Na2[Fe(CN)5(NO)]是鉴定S2-的试剂,二者反应得到紫色溶液,写出鉴定反应的离子方程式。
Fe(II)答II 或+2也可(2分)[Fe(CN)5(NO)]2-+S2- = [Fe(CN)5(NOS)]4-配合物电荷错误不得分(1分)1-4CaSO4• 2H2O微溶于水,但在HNO3 ( 1 mol L-1)、HClO4 ( 1 mol L-1)中可溶。
写出能够解释CaSO4在酸中溶解的反应方程式。
CaSO4 + H+ = Ca2+ + HSO4-(1分)写成2CaSO4+ 2HNO3 = Ca(NO3)2+ Ca(HSO4)2也得分。
高氯酸同。
答案若生成H2SO4不得分。
1-5取质量相等的2份PbSO4 (难溶物)粉末,分别加入HNO3 ( 3 mol L-1) 和HClO4 ( 3 mol L-1),充分混合,PbSO4在HNO3 能全溶,而在HClO4中不能全溶。
简要解释PbSO4在HNO3中溶解的原因。
Pb2+与NO3-形成络离子(配离子或配合物)。
(1分)写方程式也可,如PbSO4 + H+ + NO3- = HSO4- + Pb(NO3)+。
若将络离子(配离子或配合物)写成Pb(NO3)2或Pb(NO3)3-也得分,但方程式须配平。
1-6 X和Y在周期表中相邻。
CaCO3与X的单质高温反应,生成化合物B和一种气态氧化物;B与Y的单质反应生成化合物C和X的单质;B水解生成D;C水解生成E,E水解生成尿素。
确定B、C、D、E、X和Y。
B: CaC2 C: CaCN2D: C2H2 或Ca(OH) 2E: NH2CN[C(NH)2也可]X: C Y: N(各0.5分,共3分)第2题(5分) 化合物X是产量大、应用广的二元化合物,大量用作漂白剂、饮水处理剂、消毒剂等。
年产量达300万吨的氯酸钠是生产X的原料,92%用于生产X—在酸性水溶液中用盐酸、二氧化硫或草酸还原。
此外,将亚氯酸钠固体装柱,通入用空气稀释的氯气氧化,也可生产X。
X有极性和顺磁性,不形成二聚体,在碱性溶液里可发生歧化反应。
2-1写出X的分子式和共轭π键(m nπ)。
π(各1分,共2分) ClO2532-2分别写出上述用草酸还原和用氯气氧化生产X的反应方程式。
2ClO3- + H2C2O4 + 2H+ = 2ClO2 + 2CO2 + 2H2O (1分)或2NaClO3 + H2C2O4 + H2SO4 = 2ClO2 + 2CO2 + Na2SO4 + 2H2O2NaClO2+ Cl2 = 2ClO2 + 2NaCl (1分)NaClO2是固体,写成ClO2-,不得分。
2-3写出上述X歧化反应的化学方程式。
2ClO2 + 2NaOH= NaClO2 + NaClO3 + H2O (1分)或2ClO2 + 2OH-= ClO2- + ClO3- + H2O第3题 (4分) 甲醛是一种重要的化工产品,可利用甲醇脱氢制备,反应式如下:CH 3CH 2O(g) + H 2(g) mr H ∆= 84.2 kJ mol -1 (1) 向体系中通入空气,通过以下反应提供反应(1) 所需热量:H 2(g) + ½O 2(g) H 2O(g) mr H ∆=–241.8 kJ mol -1 (2) 要使反应温度维持在700˚C ,计算进料中甲醇与空气的摩尔数之比。
已知空气中氧气的体积分数为0.20。
要使反应维持在一定温度持续进行,应保证反应(2)放出的热量恰好被反应(1) 全部利用,则:甲醇与氧气的摩尔比为:n (CH 3OH) : n (O 2) = (2 ⨯ 241.8) / 84.2 = 5.74 (2分) 甲醇与空气的摩尔比为:n (CH 3OH) : n (空气) = 5.74 / 5 = 1.1 (2分)答成1.15或1.148得1.5分。
答(写)成1 : 0.87也得2分。
考虑到实际情况,将上式的等号写成小于或小于等于,得2分。
算式合理,结果错误,只得1分。
只有结果没有计算过程不得分。
第4题 (10分) (CN)2被称为拟卤素,它的阴离子CN - 作为配体形成的配合物有重要用途。
4-1 HgCl 2 和Hg(CN)2反应可制得 (CN)2, 写出反应方程式。
HgCl 2 + Hg(CN)2 = Hg 2Cl 2 + (CN)2 (1分)4-2 画出CN -、(CN)2的路易斯结构式。
C N -[] N C C (各1分,共2分)短线画成电子对同样得分;不画孤对电子不得分。
4-3 写出(CN)2 (g) 在O 2 (g) 中燃烧的反应方程式。
(CN)2(g) + 2O 2(g) = 2CO 2(g) + N 2(g) (1分)不标物态也可。
4-4 298 K 下,(CN)2 (g) 的标准摩尔燃烧热为 -1095 kJ mol -1,C 2H 2 (g) 的标准摩尔燃烧热为 -1300 kJ mol -1,C 2H 2 (g) 的标准摩尔生成焓为227 kJ mol -1,H 2O (l) 的标准摩尔生成焓为 -286 kJ mol -1,计算 (CN)2 (g) 的标准摩尔生成焓。
(CN)2(g) + 2O 2(g) = 2CO 2(g) + N 2(g)2Δf H m (CO 2) -Δf H m [(CN)2] = -1095 kJ mol -12Δf H m (CO 2) = -1095 kJ mol -1 +Δf H m [(CN)2]C 2H 2(g) + 2.5O 2(g) = 2CO 2(g) + H 2O(l)2Δf H m (CO 2) +Δf H m (H 2O) - Δf H m (C 2H 2) = -1300 kJ mol -12Δf H m (CO 2) = -1300 kJ mol -1 + 286kJ mol -1 + 227 kJ mol -1Δf H m [(CN)2] = 1095 kJ mol -1 - 1300 kJ mol -1 + 286kJ mol -1 + 227 kJ mol -1= 308 kJ mol -1 (2分)计算过程正确计算结果错误只得1分。
没有计算过程不得分。
Δf H m [(CN)2] = 1095 - 1300 + 286 + 227 = 308(kJ mol -1)也可以。
但不加括号只得1.5分。
4-5 (CN)2在300~500 o C 形成具有一维双链结构的聚合物,画出该聚合物的结构。
C CN N n或 C C N C C N N C C N N N (2分) 画成 N N N N N N 也得2分。
但画成N N N N N N 只得1分。
4-6 电镀厂向含氰化物的电镀废液中加入漂白粉以消除有毒的CN -,写出化学方程式(漂白粉用ClO -表示)。
2CN - + 5ClO - + H 2O = 2HCO 3- + N 2 + 5Cl - (2分)产物中写成CO 32-, 只要配平,也得2分。
第5题 (5分) 1963年在格陵兰Ika 峡湾发现一种水合碳酸钙矿物ikaite 。
它形成于冷的海水中,温度达到8o C 即分解为方解石和水。
1994年的文献指出:该矿物晶体中的Ca 2+ 离子被氧原子包围,其中2个氧原子来自同一个碳酸根离子,其余6个氧原子来自6个水分子。
它的单斜晶胞的参数为:a = 887 pm, b = 823 pm, c = 1102 pm, β = 110.2°,密度d = 1.83 g cm -3,Z = 4。
5-1 通过计算得出这种晶体的化学式。
ikaite 晶胞体积:V = abc sin β = (8.87 ⨯ 8.23 ⨯ 11.02 ⨯ 10-24 cm 3) ⨯ sin110.2° = 7.55 ⨯ 10-22 cm 3 (0.5分) 设晶胞中含有n 个水分子,晶胞的质量:m = 4 ⨯ (100 + 18 n ) / N A (g) (0.5分) 晶体密度:d = m /V = 4 ⨯ (100 + 18 n ) / ( 6.02 ⨯ 1023 ⨯ 7.55 ⨯ 10-22)(g cm -3)= 1.83 g cm -3100 + 18 n = 208 n = 6 (0.5分)该晶体的化学式为 CaCO 3 ⋅ 6H 2O(0.5分)算出6个水分子,未写化学式,得1.5分。
5-2研究了这种晶体在加压下受热膨胀体积增大的情形,并与冰及钙离子配位数也是8的二水合石膏晶体(gypsum)作了对比,结果如下图所示(纵坐标为相对体积):为什么选取冰和二水合石膏作对比?实验结果说明什么?Ikaite 在冷水中形成,而且含有大量结晶水,分解温度又接近冰的熔点,可能与冰的结构有相似性,故选取冰作参比物;(0.5分)石膏是带结晶水的钙的含氧酸盐,而且钙的配位数也是8,可能与ikaite结构相似,故选取石膏作参比物。
