高中有机化学方程式汇总(写化学方程式和反应类型)
高中有机化学方程式总结

高中有机化学方程式总结高中有机化学方程式综述一、碳氢化合物甲烷烷烃通式:CnH2n-2 (1)氧化反应燃烧甲烷燃烧:CH4+2O2 CO2+2H2O甲烷不能使酸性高锰酸钾溶液和溴水变色。
(2)取代反应光线氯甲烷:CH4+Cl2 CH3Cl+HCl2.乙烯乙烯的制备:烯烃通式:(1)乙烯的氧化反应燃烧:乙烯会使酸性高锰酸钾溶液褪色并引起氧化反应。
(2)加成反应丙烯和溴水加成:丙烯和氢加成:丙烯和氯化氢加成:丙烯和水加成:(3)聚合反应丙烯加成聚合,3.1,3丁二烯向溴中加入1,3丁二烯:1:1加入1,3丁二烯:4。
乙炔乙炔的制备:(1)乙炔在氧化反应中的燃烧;乙炔会使酸性高锰酸钾溶液变色并引起氧化反应。
(2)加成反应和溴水添加:加入氢气;加入氯化氢;图2乙炔(3)聚合反应的制备丙烯加聚:5。
苯苯的同系物具有以下通式:(1)氧化反应苯的燃烧:(苯不能淡化溴水和酸性高锰酸钾溶液。
(2)取代反应①苯和溴反应(2)硝化反应高中化学方程式概述(第二部分),第2-1页,共6页(3)加成反应甲苯(1)氧化甲苯的燃烧:甲苯不能使溴水褪色,但能使酸性高锰酸钾溶液褪色。
(2)取代反应:与溴的反应甲苯硝化反应产生2,4,6-三硝基甲苯,简称三硝基甲苯,也称为三硝基甲苯,是一种淡黄色晶体,不溶于水。
它是一种烈性炸药,广泛用于国防、采矿等。
二。
碳氢化合物衍生物烃类衍生物的重要类别及主要化学性质:卤代烃类醇酚醛羧酸酯代表物质通式为R-X R-羟基溴乙烷C2H5Br乙醇C2H5OH苯酚-羟基乙醛O | | CH3-C-H分子结构特征C-X键具有极性,易断裂的C-O键和O-H 键具有极性;-羟基直接与链烃基相连-羟基直接与苯环相连。
碳氧双键具有极性,并具有不饱和的主要化学性质。
1.取代反应:用氢氧化钠溶液进行取代反应生成乙醇;2.消除反应:与强碱醇溶液共同加热生成烯烃。
1.与钠反应生成醇钠并释放氢气;2.氧化反应:O2:产生CO2和H2O;;氧化剂:产生乙醛;3.脱水反应:140℃;乙醚;170℃:乙烯;4.酯化反应。
有机化学方程式(70个)

有机化学基础反应方程式汇总1. 甲烷(烷烃通式:C n H 2n +2)甲烷的制取:CH 3CaO △2CO 3+CH 4↑(1)氧化反应甲烷的燃烧:CH 4+2O 2 点燃CO 2+2H 2O甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应CH 4+Cl 光照3Cl(一氯甲烷)+HClCH 3Cl+Cl 光照2Cl 2(二氯甲烷)+HClCH 2Cl 2+Cl 光照3(三氯甲烷)+HCl (CHCl 3又叫氯仿)CHCl 3+Cl 光照4(四氯化碳)+HCl(3)分解反应甲烷分解:CH 高温22. 乙烯(烯烃通式:C n H 2n )乙烯的制取:CH 3CH 2浓硫酸170℃2=CH 2↑+H 2O(消去反应)(1)氧化反应乙烯的燃烧:CH 2=CH 2+3O 点燃2+2H 2O乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:CH 2=CH 2+Br 2Br —CH 2Br与氢气加成:CH 2=CH 2+H 2催化剂CH 3CH 3 与氯化氢加成:CH 2=CH 2+HCl 催化剂CH 3CH 2Cl 与水加成:CH 2=CH 2+H 2O催化剂CH 3CH 2OH(3)聚合反应 乙烯加聚,生成聚乙烯:n CH 2=CH 2催化剂 [CH 2—CH 2 ] n 适当拓展:CH 3CH =CH 2+Cl 3׀ Cl CH -׀ ClCH 2 CH 3CH =CH 2+H 2催化剂CH 3CH 2CH 3 CH 3CH =CH 2+HCl 催化剂CH 3CH 2CH 2Cl 或CH 3׀ ClCHCH 3 CH 3CH =CH 2+H 2O 催化剂CH 3CH 2CH 2OH 或CH 3׀ OHCHCH 3 n CH 2=CH -CH 3催化剂 [CH 2—׀ CH 3CH ] n (聚丙烯) 3. 乙炔(炔烃通式:C n H 2n-2)乙炔的制取:CaC 2+2H 2 CH ↑+Ca(OH)2(1)氧化反应乙炔的燃烧:HC ≡CH+5O 点燃2+2H 2O乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
高中化学方程式(烃、卤代烃、醇、苯、醛)

有机化学方程式总结一、烃1.甲烷烷烃通式:(1)氧化反应甲烷的燃烧:。
甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应一氯甲烷:CH4+Cl2。
二氯甲烷:CH3Cl+Cl2。
三氯甲烷:CH2Cl2+Cl2。
四氯化碳:CHCl3+Cl2。
2.乙烯乙烯的制取:。
烯烃通式:(1)氧化反应乙烯的燃烧:乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应(3)聚合反应乙烯加聚,生成聚乙烯:。
3.乙炔乙炔的制取:。
炔烃的通式:。
(1)氧化反应乙炔的燃烧:。
乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应图1 乙烯的制取图2 乙炔的制取与溴水加成:HC CH+Br 2CHBr=CHBr+Br 2与氢气加成:与氯化氢加成:(3)聚合反应氯乙烯加聚,得到聚氯乙烯: 。
乙炔加聚,得到聚乙炔: 。
4.苯苯的同系物通式:(1)氧化反应苯的燃烧: 。
苯不能使溴水和酸性高锰酸钾溶液褪色。
(2)取代反应①苯与溴反应②硝化反应(3)加成反应5.甲苯(1)氧化反应甲苯的燃烧: 。
甲苯不能使溴水褪色,但可以使酸性高锰酸钾溶液褪色。
(2)取代反应(与HNO 3)甲苯硝化反应生成2,4,6-三硝基甲苯,简称 ,又叫 ,是一种 色晶体,不溶于水。
它是一种 ,广泛用于 。
注意:甲苯在光照条件下发生侧链的取代,而在催化剂条件下发生苯环上的取代。
注意:制取乙烯、乙炔均用排水法收集;乙烯、乙炔的加成反应(3)加成反应二、烃的衍生物6.溴乙烷纯净的溴乙烷是 ,沸点 ,密度比水 。
(1)取代反应溴乙烷的水解: 。
(2)消去反应:。
7.乙醇(1)取代反应:①与钠反应 。
②与HBr 反应 。
(2)氧化反应①催化剂催化氧化:②燃烧(3)消去反应C 2H 5OHC 2H 5-OH + OH-C 2H 58.苯酚苯酚是 ,露置在空气中会因 。
苯酚具有 气味,水中溶解度 ,易溶于 。
苯酚有 ,是一种重要的化工原料。
如果苯酚沾到皮肤上,应该用 处理。
(完整版)(完美版)高中有机化学方程式总结
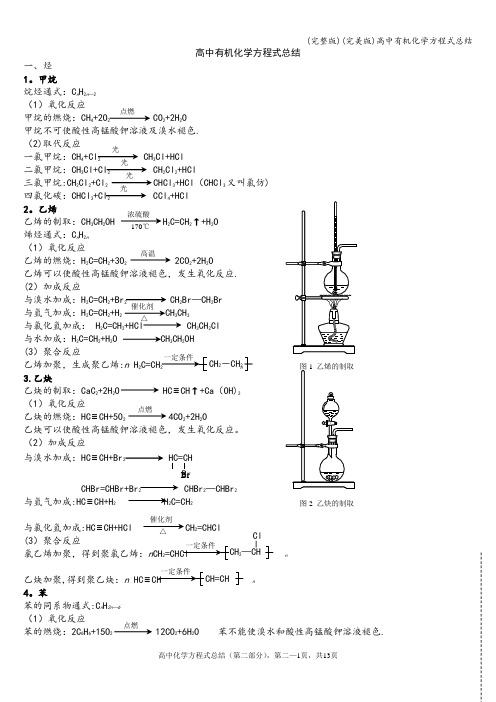
高中有机化学方程式总结一、烃 1。
甲烷烷烃通式:C n H 2n —2 (1)氧化反应甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O甲烷不可使酸性高锰酸钾溶液及溴水褪色. (2)取代反应一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl 二氯甲烷:CH 3Cl+Cl 2 CH 2Cl 2+HCl 三氯甲烷:CH 2Cl 2+Cl 2 CHCl 3+HCl (CHCl 3又叫氯仿)四氯化碳:CHCl 3+Cl 2 CCl 4+HCl 2。
乙烯 乙烯的制取:CH 3CH 2OH H 2C=CH 2↑+H 2O 烯烃通式:C n H 2n (1)氧化反应乙烯的燃烧:H 2C=CH 2+3O 2 2CO 2+2H 2O 乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应. (2)加成反应与溴水加成:H 2C=CH 2+Br 2 CH 2Br —CH 2Br 与氢气加成:H 2C=CH 2+H 2 CH 3CH 3 与氯化氢加成: H 2C=CH 2+HCl CH 3CH 2Cl 与水加成:H 2C=CH 2+H 2O CH 3CH 2OH(3)聚合反应乙烯加聚,生成聚乙烯:n H 2n 3.乙炔乙炔的制取:CaC 2+2H 2O HC ≡CH ↑+Ca (OH)2 (1)氧化反应 乙炔的燃烧:HC ≡CH+5O 2 4CO 2+2H 2O 乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:HC ≡CH+Br2 HC=CHBrCHBr=CHBr+Br 2 CHBr 2—CHBr 2与氢气加成:HC ≡CH+H 2 H 2C=CH 2与氯化氢加成:HC ≡CH+HCl CH 2=CHCl (3)聚合反应 氯乙烯加聚,得到聚氯乙烯:n CH 2=CHCl n乙炔加聚,得到聚乙炔:n HC ≡CH n4。
苯苯的同系物通式:C n H 2n —6 (1)氧化反应苯的燃烧:2C 6H 6+15O 2 12CO 2+6H 2O 苯不能使溴水和酸性高锰酸钾溶液褪色.点燃光光光光浓硫酸170℃ 高温催化剂 △2-CH 2点燃图2 乙炔的制取催化剂△Br 2—CHCl点燃(2)取代反应 ①苯与溴反应(溴苯)②硝化反应+HO-NO +H 2O (硝基苯) (3)加成反应(环己烷)。
高中有机化学方程式汇总(全)(已免费)

光照 光照 光照 光照 高温 CaO△ 催化剂加热、加压 催化剂催化剂△ 催化剂 △ 催化剂 催化剂催化剂 催化剂△ 催化剂催化剂浓硫酸△ △CH 3 NO 2O 2N CH 3催化剂△高中有機化學方程式匯總1. CH 4 + Cl 2 CH 3Cl + HCl2. CH 3Cl + Cl 2 CH 2Cl 2 + HCl3. CH 2Cl + Cl 2 CHCl 3 + HCl4. CHCl 3 + Cl 2 CCl 4+ HCl5. CH 4 C +2H 26. C 16H 34 C 8H 18 + C 8H 167. CH 3COONa + NaOH CH 4↑+ Na 2CO 38. CH 2 = CH 2 + Br 2 CH 2Br —CH 2Br9. CH 2 = CH 2 + H 2O CH 3CH 2OH10. CH 2 = CH 2 + HBr CH 3—CH 2Br11. CH 2 = CH 2 + H 2 CH 3—CH 312. nCH 2 = CH 2 [ CH 2—CH 2 ] n13. nCH 2=CH-CH=CH 2 [CH 2-CH=CH-CH 2] n14. 2CH 2 = CH 2 + O 2 2CH 3CHO15. CH ≡CH + Br 2 CHBr = CHBr16. CHBr = CHBr+ Br 2 CHBr 2-CHBr 217. CH ≡CH + HCl H 2C = CHCl18. nCH 2 = CH [ CH 2-CH ] nCl Cl19. CH ≡CH + H 2O CH 3CHO20. CaC 2 + 2H 2O CH ≡CH ↑+ Ca(OH)221. + Br 2 Br + HBr22. + HO -NO 2 NO 2 +H 2O23. + HO -SO 3H SO 3H+H 2O24. + 3H 2催化剂NaOH H 2O 醇△ 催化剂 △ 浓硫酸 170℃ 浓硫酸140℃OH Br Br OH 催化剂 △ 催化剂△△ △ 浓硫酸△ Br25. +3HO -NO 2 +3H 2O26. 3CH ≡CH →27. CH 3CH 2Br + H 2O CH 3CH 2OH + HBr28. CH 3CH 2Br + NaOH CH 3CH 2OH + NaBr29. CH 3CH 2Br+ NaOH CH 2 = CH 2 + NaBr +H 2O30. 2CH 3CH 2OH+2Na 2CH 3CH 2ONa + H 2↑31. 2CH 3CH 2OH+O 2 2CH 3CHO + 2H 2O 32. CH 3CH 2OH CH 2 = CH 2↑+ H 2O 33.C 2H 5OH+C 2H 5OH C 2H 5OC 2H 5+H 2O 34. OH+NaOH ONa+H 2O35. OH+H 2O O -+H 3O +36. ONa+H 2O+CO 2 OH+ NaHCO 337. +3Br 2 ↓ +3HBr 38. CH 3CHO + H 2 CH 3CH 2OH39. 2CH 3CHO + O 2 2CH 3COOH 40. CH 3CHO+2Ag(NH 3)2OH CH 3COONH 4+2Ag ↓+3NH 3+H 2O41CH 3CHO+2Cu(OH)2 CH 3COOH+Cu 2O ↓+2H 2O 42. 2CH 3COOH+2Na 2CH 3COONa+H 2↑43.2CH 3COOH+Na 2CO 3 2CH 3COONa+H 2O+CO 2↑44. CH 3COOH+NaHCO 3 CH 3COONa+H 2O+CO 2↑45. CH 3COOH + NaOH CH 3COONa + H 2O46. 2CH 3COOH + Cu(OH)2 (CH 3COO)2Cu + 2H 2O47.CH 3COOH+CH 3CH 2OH CH 3COOCH 2CH 3 +H 2O 48. CH 3COOCH 2CH 3+NaOH CH 3COONa+CH 3CH 2OH催化剂催化剂催化剂催化剂催化剂△催化剂加热、加压+ 浓硫酸△+ 2H2O O OC — CO OCH2-CH249. nOHCH2CH2COOH→ [ OCH2CH2C ] n +H2O50. C6H12O6 (s)+ 6O2 (g)6CO2 (g)+ 6H2O(l)51. C6H12O62CH3CH2OH + 2CO252. C12H22O11+H2O C6H12O6+ C6H12O6蔗糖葡萄糖果糖53. C12H22O11+ H2O2C6H12O6麦芽唐葡萄糖54. (C6H10O5)n+ nH2O n C6H12O6淀粉葡萄糖55. (C6H10O5)n+ nH2O n C6H12O6纤维素葡萄糖56.C17H33COO-CH2 C17H35COO-CH2C17H33COO-CH +3H2 C17H35COO-CHC17H33COO-CH2 C17H35COO-CH2 57. C17H35COO-CH2 CH2-OH C17H35COO-CH +3NaOH 3C17H35COONa+ CH-OHC17H35COO-CH2 CH2-OH 58. CH2OH COOHCH2OH COOH1.HClClCHClCH+−→−+324光2.3.4.5.6.7.8.9.10.11.12.13.14.15.16.17.18.19.20.21.高中有机化学知识点总结1.需水浴加热的反应有:(1)、银镜反应(2)、乙酸乙酯的水解(3)苯的硝化(4)糖的水解(5)、酚醛树脂的制取(6)固体溶解度的测定凡是在不高于100℃的条件下反应,均可用水浴加热,其优点:温度变化平稳,不会大起大落,有利于反应的进行。
(完美版)高中有机化学方程式总结

高中有机化学方程式总结一、烃1.甲烷烷烃通式:C n H 2n -2(1)氧化反应 甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O 甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应 一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl 二氯甲烷:CH 3Cl+Cl 2CH 2Cl 2+HCl 三氯甲烷:CH 2Cl 2+Cl 2 CHCl 3+HCl (CHCl 3又叫氯仿) 四氯化碳:CHCl 3+Cl 2 CCl 4+HClCH4 C +2H 2(3)裂化反应C 16H 34 C 8H 18 + C 8H 162.乙烯 乙烯的制取:CH 3CH 2OH H 2C=CH 2↑+H 2O 烯烃通式:C n H 2n(1)氧化反应 乙烯的燃烧:H 2C=CH 2+3O 2 2CO 2+2H 2O乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应 与溴水加成:H 2C=CH 2+Br 2 CH 2Br —CH 2Br 与氢气加成:H 2C=CH 2+H 2 CH 3CH 3 与氯化氢加成: H 2C=CH 2+HCl CH 3CH 2Cl 与水加成:H 2C=CH 2+H 2O CH 3CH 2OH (3)聚合反应 乙烯加聚,生成聚乙烯:n H 2C=CH n(氢加氢多)丙烯的加成CH 2=CH -CH 3+HBrCH 2-CH -CH 3 主要产物| |H BrCH 2-CH -CH 3| |Br H点燃 光 光 光 光 浓硫酸 170℃高温 催化剂 △ 2-CH 2 图1 乙烯的制取 图2 乙炔的制取高温 高温 催化剂加热3.乙炔乙炔的制取:CaC 2+2H 2O ≡CH ↑+Ca(OH)2(1)氧化反应 乙炔的燃烧:HC ≡CH+5O 24CO 2+2H 2O乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:HC ≡CH+Br 2 HC=CHCHBr=CHBr+Br 2CHBr 2—CHBr 2与氢气加成:HC ≡CH+H 2 H 2C=CH 2与氯化氢加成:HC ≡CH+HCl CH 2=CHCl(3)聚合反应 氯乙烯加聚,得到聚氯乙烯:n CH 2n乙炔加聚,得到聚乙炔:n HC ≡ n4.苯 苯的同系物通式:C n H 2n-6(1)氧化反应苯的燃烧:2C 6H 6+15O 2 12CO 2+6H 2O 苯不能使溴水和酸性高锰酸钾溶液褪色。
高中有机化学反应方程式总结(较全)

高中有机化学反应方程式总结(较全)
简介
这份文档总结了高中有机化学中常见的反应方程式,旨在帮助学生更好地理解和记忆有机化学反应。
以下是一些常见的有机化学反应类型及其方程式。
1. 烷烃类反应
1.1 烷烃燃烧反应
烷烃 + 氧气→ 二氧化碳 + 水
例如:甲烷 + 氧气→ 二氧化碳 + 水
1.2 烷烃与卤素反应
烷烃 + 卤素→ 卤代烷 + 氢卤酸
例如:甲烷 + 溴→ 溴代甲烷 + 氢溴酸2. 烯烃类反应
2.1 烯烃与卤素反应
烯烃 + 卤素→ 二卤代烷
例如:乙烯 + 光→ 过氧化氢 + 氯乙烷3. 醇类反应
3.1 醇脱水反应
醇→ 烯烃 + 水
例如:乙醇→ 乙烯 + 水
3.2 醇氧化反应
醇 + 氧气→ 酮/醛 + 水
例如:乙醇 + 氧气→ 乙酸 + 水
4. 酮类反应
4.1 酮的高温还原反应
酮 + 还原剂→ 伯胺
例如:丙酮+ NaBH4 → 正丙胺
5. 羧酸类反应
5.1 羧酸与醇酸酐化反应
羧酸 + 醇酸酐→ 酯 + 水
例如:乙酸 + 乙酸酐→ 乙酸乙酯 + 水
5.2 羧酸与碱反应
羧酸 + 碱→ 盐 + 水
例如:乙酸 + 氢氧化钠→ 乙酸钠 + 水
6. 醛类反应
6.1 醛还原反应
醛 + 还原剂→ 一级醇
例如:乙醛+ NaBH4 → 乙醇
以上是高中有机化学反应方程式的一些简单总结。
更详细的反应方程式及反应条件请参考有机化学教材或咨询化学老师。
注意:文档中的所有反应方程式仅供参考,请在实验操作时遵循正确的操作规程和安全注意事项。
高中有机化学反应类型及典型方程式例子(高三复习)

有机反应类型及典型方程式例子【必备知识】一、常见有机反应类型总结1、取代反应(1)定义:有机物分子里的某些原子或原子团被其他原子或原子团所代替的反应叫取代反应(2)特点:上一下一,有进有出,饱和度不变,反应中一般有副产物生成,类似无机反应中的复分解反应(3)取代反应类型有机物类别实例卤代反应饱和烃CH4+Cl2−−→−光照CH3Cl+HCl烯烃CH2=CH—CH3+Cl2−−→−高温CH2=CH—CH2Cl+HCl 苯和苯的同系物硝化反应苯和苯的同系物CCSOHNOHO︒︒−−−→−-+60~55242浓NO2OH2+磺化反应苯和苯的同系物HSO3−−−→−-+C80~C703..HSOHO OH2+水解反应卤代烃CH3CH2—Br+NaOH∆−→−水CH3CH2—OH+NaBr酯CH3COOC2H5+H2O CH3COOH+C2H5OHCH3COOC2H5+NaOH CH3COONa+C2H5OH油脂二糖及多糖(C6H10O5)n(淀粉)+n H2O−−→−酸或酶n C6H12O6(葡萄糖)(C6H10O5)n(纤维素)+n H2O∆−−−→−浓硫酸%90n C6H12O6(葡萄糖) 多肽、蛋白质(1)定义:有机物分子里不饱和的碳原子跟其他原子或原子团直接结合生成新物质的反应(2)特点:“断一,加二,都进来,不饱和度降低”;“断一”是指双键中的一个不稳定键断裂;“加二”是指加上两个其他原子或原子团,一定分别加在两个不饱和碳原子上,此反应类似无机反应中的化合反应,理论上原子利用率为100%(3)能发生加成反应的物质有:烯烃(碳碳双键)、炔烃(碳碳三键)、苯环、醛、酮等有机物类别实例烯烃(与X 2、H 2、HX 、H 2O)的加成CH 2==CH 2+Br 2−−→−4CCl CH 2Br —CH 2BrCH 2==CH 2+H 2O 加热、加压催化剂−−→−CH 3CH 2OH CH 2==CH 2+HCl ∆−−→−催化剂CH 3CH 2Cl CH 2==CH 2+H 2∆−→−NiCH 3—CH 3炔烃(与X 2、H 2、HX 、H 2O)的加成HC≡CH +H 2∆−→−Ni CH 2==CH 2,CH 2==CH 2+H 2∆−→−NiCH 3—CH 3 HC≡CH +Br 2―→CHBr ==CHBr ,CHBr==CHBr +Br 2―→CHBr 2—CHBr 2HC≡CH +HCl ∆−−→−催化剂CH 2==CHC l (氯乙烯) HC≡CH +H 2O −−→−催化剂CH 3CHO苯环只能与氢气加成醛(醛基)只能与氢气加成CH 3CHO +H 2∆−→−NiCH 3CH 2—OH 酮(羰基)只能与氢气加成+H 2∆−→−Ni不饱和油脂与H 2加成Diels-Alder 反应3(1)定义:有机化合物在一定条件下,从一个分子中脱去一个或几个小分子(如水、卤化氢等),而生成含不饱和键化合物的反应。
高中有机化学反应方程式汇总

高中有机化学反应方程式汇总
1. 烷烃的燃烧反应
烷烃是一类只含有碳和氢元素的有机化合物。
烷烃在氧气存在下燃烧时,产生二氧化碳和水。
以甲烷(CH₄)为例:
CH₄ + 2O₂ -> CO₂ + 2H₂O
2. 单宁酸与金属离子的反应
单宁酸是一类含有羟基和酚羟基的有机酸,能与多种金属离子发生反应。
以单宁酸与铁离子(Fe³⁺)为例:
Fe³⁺ + 3C₇H₅O₅⁻ -> Fe(C₇H₅O₅)₃
3. 醇的脱水反应
醇是一类含有羟基的有机化合物。
醇在加热条件下可以发生脱水反应,生成烯烃。
以乙醇(C₂H₅OH)为例:
C₂H₅OH -> C₂H₄ + H₂O
4. 羧酸与碱的中和反应
羧酸是一类含有羧基的有机酸,能与碱发生中和反应,生成相应的盐和水。
以乙酸(CH₃COOH)与氢氧化钠(NaOH)为例:
CH₃COOH + NaOH -> CH₃COONa + H₂O
5. 醛酮的氧化反应
醛酮是一类含有羰基的有机化合物。
醛酮在氧化剂作用下可以发生氧化反应,生成酸和水。
以乙醛(CH₃CHO)为例:
CH₃CHO + [O] -> CH₃COOH
以上是高中有机化学中常见的反应方程式的汇总。
这些方程式有助于理解有机化学反应的基本原理和机制。
请注意,以上反应方程式仅供参考,实际反应条件可能会有所不同。
使用时请参考相关化学教材和实验指导。
有机化学方程式汇总

有机化学方程式汇总有机化学是研究有机化合物及其反应的化学分支,有机化学方程式是描述有机化合物反应过程的化学式。
以下是一些常见的有机化学方程式汇总:1.反应类型:取代反应取代反应是指有机化合物中的一个原子或官能团被另一个原子或官能团所取代的反应。
例如:2-溴丙烷+氢氧化钠→丙烯醇+氯化钠在上述反应中,溴代烷2-溴丙烷中的溴原子被氢氧化钠中的羟基(-OH)所取代,生成丙烯醇。
2.反应类型:加成反应加成反应是指两个或多个分子中的原子或官能团结合为一个新的分子的反应。
例如:乙烯+水→乙醇在上述反应中,乙烯分子中的双键上的碳原子与水分子中的氢原子和羟基结合,生成乙醇。
3.反应类型:消除反应消除反应是指有机化合物中的一个官能团和另一个官能团之间发生反应,原子或官能团从有机分子中失去,生成一个新的官能团。
例如:乙醇→乙烯+水在上述反应中,乙醇分子中的羟基和氢原子结合生成水,同时分子中的碳原子通过失去一个碳-碳单键形成一个双键,生成乙烯。
4.反应类型:酯化反应酯化反应是指醇与酸酐或酸发生反应,生成酯和水。
例如:醋酸+乙醇→乙酸乙酯+水在上述反应中,醋酸和乙醇反应生成乙酸乙酯和水。
5.反应类型:重排反应重排反应是指有机化合物分子中的原子或官能团重新排列生成不同结构的化合物。
例如:异丙醇→丙烯+水在上述反应中,异丙醇分子中的羟基和氢原子失去,重新排列为丙烯分子和水。
以上只是一些常见的有机化学方程式,实际上有机化学方程式非常复杂且多样化,依赖于反应类型、底物的结构以及反应条件等因素。
有机化学的研究是一个深奥而丰富的领域,对于化学和生物学的研究具有重要意义。
(完整版)高中有机化学方程式汇总

姓名高中有机化学方程式汇总甲烷及烷烃的反应(烷烃性质较稳定,主要是燃烧和取代反应)1. 甲烷的取代反应(一氯取代) CH 4 + Cl 2 CH 3Cl + HCl(取代反应)2. 甲烷的高温分解3. 甲烷的实验室制取4. 石油气的裂化5. 有机物的燃烧通式CxHyOz + (x+y/4-z/2)O 2 == xCO 2 + y/2H 2O乙烯的化学性质(乙烯产量标志着一个国家石油工业的发展水平)6. 乙烯与溴水的反应 (加成反应)7. 乙烯与水的反应 (加成反应)8. 乙烯与溴化氢反应(加成反应) 9. 乙烯与氢气反应 (加成反应) 10. 乙烯的催化氧化(氧化反应)11. 烯烃的燃烧通式12. 乙烯的加聚反应(加聚反应)苯密度比水小,沸点为80.1℃,不能使酸性高锰酸钾褪色,能萃取溴使溴水褪色。
13. 苯与液溴的反应 (催化剂为铁粉)(取代反应)14. 苯与浓硝酸的反应 (硝化反应)(取代反应) 15. 苯与浓硫酸反应(磺化反应)(取代反应)16. 苯与氢气反应(加成反应)17. 苯的生成反应18. 甲苯与浓硝酸反应(取代反应)浓硫酸Δ光照19. 甲苯被酸性高锰酸钾氧化(高锰酸钾褪色)(氧化反应)卤代烃的化学性质(卤代烃连接着烃及烃的衍生物,是有机反应的纽带)20. 卤代烃生成醇(水解反应)21. 卤代烃生成烯烃(消去反应)醇类的化学性质(甲乙丙等低级醇均可与水混溶,不能充当溶液的萃取剂)22. 工业上制乙醇 (加成反应)乙醇和氢卤酸反应→ 23. 乙醇和钠反应 (取代反应) 24. 乙醇的催化氧化(氧化反应) 25. 乙醇的脱水反应(分子内) (消去反应)乙醇的脱水反应(分子间)(取代反应)26. 乙醇与酸的酯化反应(取代反应)醛的化学性质(甲醛是市内装修的主要污染物,其水溶液叫福尔马林)27. 乙醛与氢气的加成 (加成反应) 28. 乙醛的催化氧化 (氧化反应)29. 银镜反应(氧化) 30. 醛与新制氢氧化铜的反应(氧化)羧酸的化学性质(甲酸的分子结构决定了它既有酸的性质,又有醛的性质)31. 冰醋酸与金属钠反应 (置换/取代)32. 醋酸与纯碱反应 (复分解) 33. 醋酸与小苏打反应 (复分解)34. 醋酸与烧碱反应(中和)C 2H 5OH+H —Br ΔCH 3CH 2Br+H 2O (取代反应)35. 醋酸与弱碱反应(中和)36. 醋酸与醇的酯化反应 (酯化/取代)37. 甲酸的银镜反应(氧化)酯的化学性质(有催化剂及加热情况下才会水解;碱存在时完全水解,反应不可逆;酸存在时,部分水解,反应可逆)38. 酯的碱性水解(取代反应)39. 酯的酸性水解(取代反应) 40. 酯键的缩聚 (缩聚反应) 41. 丁二烯烃的加聚反应(加聚反应)炔烃的化学性质(可加成、加聚,可使酸性高锰酸钾褪色)42. 实验室制乙炔43. 乙炔与溴水1:1加成(加成反应)乙炔与氢气足量加成((加成反应) 乙炔与水1:1加成(加成反应)44. 1,2-二溴乙烯与液溴的加成(加成反应) 45. 氯乙烯的加聚反应(加聚反应)苯酚(易被氧气氧化成粉红色,有毒,沾到皮肤时,应立即用酒精清洗;常温下微溶于水,65℃以上时与水混溶;能使高锰酸钾褪色)46. 苯酚与强碱的反应(复分解反应)(可用于除去苯中混有的少量苯酚)47. 苯酚的电离(弱酸性)48. 苯酚钠与二氧化碳反应(复分解反应)(比较碳酸与石炭酸的酸性强弱)49. 苯酚与浓溴水的取代反应(取代反应)⇋2H 2CH 3CH 350.苯酚与浓硝酸的硝化反应(取代反应)51.酚类的显色反应(紫色,可用于检验酚类物质)52.苯酚与氢气的加成反应(加成反应)53.苯酚的缩聚反应基本营养物质的组成及性质54.葡萄糖的彻底氧化55.二糖蔗糖的水解(取代反应)(水解反应)二糖麦芽糖的水解56.多糖淀粉的水解(取代反应)(水解反应)多糖纤维素的水解57.植物油的硬化反应58.油脂的水解反应(皂化反应)59.乙二醇与乙二酸的聚合反应。
高中有机化学公式

高中有机化学公式以下为你介绍部分高中有机化学公式:1. 甲烷燃烧:CH4+2O2→CO2+2H2O(条件为点燃)2. 甲烷隔绝空气高温分解:CH4→C+2H2(条件为高温高压,催化剂)3. 甲烷和氯气发生取代反应:CH4+Cl2→CH3Cl+HCl;CH3Cl+Cl2→CH2Cl2+HCl;CH2Cl2+Cl2→CHCl3+HCl;CHCl3+Cl2→CCl4+HCl(条件都为光照。
)4. 实验室制甲烷:CH3COONa+NaOH→Na2CO3+CH4(条件是CaO加热)5. 乙烯燃烧:CH2=CH2+3O2→2CO2+2H2O(条件为点燃)6. 乙烯和溴水:CH2=CH2+Br2→CH2Br-CH2Br7. 乙烯和水:CH2=CH2+H20→CH3CH2OH(条件为催化剂)8. 乙烯和氯化氢:CH2=CH2+HCl→CH3-CH2Cl9. 乙烯和氢气:CH2=CH2+H2→CH3-CH3(条件为催化剂)10. 乙烯聚合:nCH2=CH2→-[-CH2-CH2-]n-(条件为催化剂)11. 氯乙烯聚合:nCH2=CHCl→-[-CH2-CHCl-]n-(条件为催化剂)12. 实验室制乙烯:CH3CH2OH→CH2=CH2↑+H2O(条件为加热,浓H2SO4)13. 乙炔燃烧:C2H2+3O2→2CO2+H2O(条件为点燃)14. 乙炔和溴水:C2H2+2Br2→C2H2Br415. 乙炔和氯化氢:两步反应:C2H2+HCl→C2H3ClC2H3Cl+HCl→C2H4Cl216. 乙炔和氢气:两步反应:C2H2+H2→C2H4→C2H2+2H2→C2H6(条件为催化剂)17. 实验室制乙炔此外,还有天干命名、燃烧公式、耗氧量、不饱和度等知识点。
如需获取更多公式,建议查阅高中化学教材或咨询化学老师。
(完美版)高中有机化学方程式汇总1(可编辑修改word版)

一、烃1. 甲烷烷烃通式:C n H 2n -2 (1) 氧化反应高中有机化学方程式总结点燃 甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O 甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2) 取代反应 光一氯甲烷:CH 4+Cl 2 光二氯甲烷:CH 3Cl+Cl 2 光三氯甲烷:CH 2Cl 2+Cl 2 光CH 3Cl+HClCH 2Cl 2+HClCHCl 3+HCl (CHCl 3 又叫氯仿) 四氯化碳:CHCl 3+Cl 2CCl 4+HCl2. 乙烯乙烯的制取:CH 3CH 2OH 烯烃通式:C n H 2n (1) 氧化反应浓硫酸170℃点燃H 2C=CH 2↑+H 2O乙烯的燃烧:H 2C=CH 2+3O 2 2CO 2+2H 2O 乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2) 加成反应与溴水加成:H 2C=CH 2+Br 2 CH 2Br —CH 2Br催化剂 与氢气加成:H 2C=CH 2+H 2 △CH 3CH 3催化剂与氯化氢加成: H 2C=CH 2+HCl△CH 3CH 2Cl催化剂与水加成:H 2C=CH 2+H 2O (3) 聚合反应加热加压 CH 3CH 2OH 图 1 乙烯的制取乙烯加聚,生成聚乙烯:n H 2C=CH 23. 乙炔CH 2-CH 2 n 乙炔的制取:CaC 2+2H 2O HC ≡ C H ↑+Ca(OH)2 (1) 氧化反应 点燃乙炔的燃烧:HC ≡ CH+5O 2 4CO 2+2H 2O 乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2) 加成反应 与溴水加成:HC ≡ CH+Br 2HC=CH Br BrCHBr=CHBr+Br 2CHBr 2—CHBr 2图 2 乙炔的制取与氢气加成:HC ≡ CH+H催化剂 H C=CH2与氯化氢加成:HC ≡ CH+HCl(3) 聚合反应△2催化剂 22=CHClCl 氯乙烯加聚,得到聚氯乙烯:n CH 2=CHCl2—CH乙炔加聚,得到聚乙炔:n HC ≡ CHCH=CH n4. 苯催化剂催化剂n催化剂苯的同系物通式:C n H 2n-6 (1) 氧化反应 点燃苯的燃烧:2C 6H 6+15O 2 12CO 2+6H 2O 苯不能使溴水和酸性高锰酸钾溶液褪色。
高中有机化学方程式汇总:自己整理

高中有机化学方程式汇总:自己整理高中有机化学方程式汇总课题1:烷烃烷烃主要反应是燃烧和取代反应。
甲烷及烷烃的取代反应如下:一氯甲烷:CH4 + Cl2 → CH3Cl + HCl(光)二氯甲烷:CH3Cl + Cl2 → CH2Cl2 + HCl(光)三氯甲烷:CH2Cl2 + Cl2 → CHCl3 + HCl(光,CHCl3又叫氯仿)四氯化碳:CHCl3 + Cl2 → CCl4 + HCl(光)这些反应需要光照,且要求卤族元素都必须是气态纯净物。
与烯烃炔烃的加成反应条件不同。
另外,有机物的燃烧通式为CxHyOz + (x+y/4-z/2)O2 → xCO2+ y/2H2O(光)。
课题2:烯烃烯烃的加成反应包括与溴水、水、溴化氢和氢气的反应。
当双键两端的碳不同时,遵循马氏规则,即门当户对。
乙烯还有加聚反应和氧化反应。
乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
催化剂H2C=CH2 + H2O + CH3OH →CH3CHOHCH3(加热加压)。
课题3:炔烃炔烃的加成反应包括与溴水、氢气、水和氯化氢的反应。
乙炔还有加聚反应和氧化反应。
乙炔可以使酸性高锰酸钾溶液褪色,实验室制取乙炔需要点燃。
乙炔的燃烧通式为HC≡CH + 5O2 → 4CO2 + 2H2O。
课题4:苯及其同系物苯密度比水小,沸点为80.1℃,不能使酸性高锰酸钾褪色,能萃取溴使溴水褪色。
苯及其同系物的1卤代反应需要铁粉或FeCl3,反应温度在30℃到55-60℃之间。
一、取代反应在浓硫酸的存在下,将4个硝酸和H2O2加入到55-60℃的环境中,可以得到发烟的硝酸。
将这个硝酸和NO2一起加入到浓硫酸中,加热至295℃,可以得到NO和NO2.在30℃下,将NO2和HNO3加入到浓硫酸中,可以得到NO2和HNO3.将这个化合物和H2SO4加入到CH3CH3中,加热至30-50℃,可以得到NO2和NO。
将这个化合物和H2SO4加热至180℃,可以得到SO3H。
有机化学方程式总结

有机化学方程式总结有机化学是一门研究有机化合物的组成、结构、性质和变化的科学。
在有机化学的学习中,掌握各种有机化合物的化学反应方程式是非常重要的一部分。
下面是对一些常见有机化学反应方程式的总结:1、烷烃的取代反应CH4 + Cl2 → CH3Cl + HCl2、烯烃的加成反应CH2=CH2 + H2 → CH3CH33、炔烃的加成反应CH≡CH + 2H2 → CH3CH34、醇的氧化反应2CH3CH2OH + O2 → 2CH3CHO + 2H2O5、酮的氧化反应2RCOCH3 + O2 → 2RCOCHO + 2H2O6、羧酸的酯化反应CH3COOH + CH3CH2OH → CH3COOCH2CH3 + H2O7、酯的水解反应CH3COOCH2CH3 + H2O → CH3COOH + CH3CH2OH8、醛的还原反应R-CHO + H2 → R-CH2OH9、酮的还原反应R-CO-R' + H2 → R-CH2-R' + H2O10、酰胺的水解反应NH2CO-R + H2O → NH3 + R-COOH以上仅是一些常见的有机化学反应方程式,但它们是学习有机化学的基础。
通过理解和记忆这些反应方程式,可以更好地理解有机化学的原理和应用。
对于一些复杂的有机化学反应,需要更加深入的学习和理解。
真空泄污系统自控系统是一种高效、环保的自动化设备,专门设计用于处理和减少废物排放。
此系统利用真空技术,自动抽取和处理废气、废液等污染物,达到国家环保排放标准。
真空泵:用于产生负压,从污染源抽取污染物。
传感器:检测污染物的种类和浓度,以便控制系统能够做出相应的调整。
控制系统:根据污染物的种类和浓度,自动调整真空泵的工作状态和净化设备的运行。
净化设备:对抽取的污染物进行过滤、吸附、化学反应等处理,降低或消除污染。
排放系统:经过处理的污染物被安全地排放到大气中。
自动检测:系统自动检测污染物的种类和浓度,实时调整处理策略。
高中化学所有有机物的反应方程式

甲烷乙炔乙烯苯乙醇燃烧甲烷隔绝空气高温分解分解复杂,以下是最终分解。
CH4→C+2H2(条件为高温高压,催化剂)甲烷和氯气发生取代反应CH4+Cl2→CH3Cl或到 CCl4+HCl(条件都为光照。
)乙烯和溴水CH2=CH2+Br2→CH2Br-CH2Br乙烯和水CH2=CH2+H20→CH3CH2OH(条件为催化剂)乙烯和氯化氢CH2=CH2+HCl→CH3-CH2Cl乙烯和氢气CH2=CH2+H2→CH3-CH3 (条件为催化剂)乙烯聚合nCH2=CH2→-[-CH2-CH2-]n-(条件为催化剂)氯乙烯聚合nCH2=CHCl→-[-CH2-CHCl-]n-(条件为催化剂)乙炔和溴水C2H2+2Br2→C2H2Br4乙炔和氯化氢两步反应: C2H2+HCl→C2H3Cl-------- C2H3Cl+HCl→C2H4Cl2乙炔和氢气两步反应: C2H2+H2→C2H4→C2H2+2H2→C2H6(条件为催化剂)以食盐、水、石灰石、焦炭为原料合成聚乙烯的方程式。
CaCO3 === CaO +CO2 2CaO+5C===2CaC2+CO2CaC2+2H2O→ C2H2+Ca(OH )2C+H2O===CO+H2----- 高温 C2H2+H2→ C2H4---- 乙炔加成生成乙烯C2H4可聚合苯和液溴的取代C6H6+Br2→C6H5Br+HBr苯和浓硫酸浓硝酸C6H6+HNO3→C6H5NO2+H2O(条件为浓硫酸)苯和氢气C6H6+3H2→C6H12(条件为催化剂)乙醇的催化氧化的方程2CH3CH2OH+O2→CH3CHO+2H2O(条件为催化剂)乙醇消去反应CH3CH2OH→CH2=CH2+H2O(条件为浓硫酸170 摄氏度)乙醇发生分子间脱水2CH3CH2OH→C H3CH2OCH2CH3+H2O条件为催化剂浓硫酸140 度乙醇和乙酸发生酯化反应CH3COOH+C2H5OH→CH3COOC2H5+H2O乙酸和镁Mg+2CH3COOH→(CH3COO)2Mg+H2乙酸和氧化钙2CH3COOH+CaO→(CH3CH2) 2Ca+H2O乙酸和氢氧化钠CH3COOCH2CH3+NaOH→3COONa+CH3CH2OH乙酸和碳酸钠Na2CO3+2CH3COOH→2CH3COONa+H2O+CO2↑甲醛和新制的氢氧化铜HCHO+4Cu(OH)2→2Cu2O+CO2↑+5H2O乙醛和新制氢氧化铜CH3CHO+2Cu( OH ) 2→Cu2O( 沉淀 )+CH3COOH+2H2O乙醛氧化为乙酸2CH3CHO+O2→2CH3COOH(条件为催化剂或加温)烯烃是指含有C=C 键的碳氢化合物。
