金属性和金属活波性的区别
金属性和金属活动性的区别和联系

金属性强的元素,一般来说它的活动性也大,但也有不一致的情况。例如,钠的第一电离能比钙的第一电离能要小,因此钠的金属性要比钙强。但是钙在水溶液中形成水合离子的倾向比钠大,即钙的标准电极电势比钠要负,所以钙的金属活动性比钠大。铜和银也有类似上述的情况。由此可见,金属性与金属活动性两者概念是有区别的。
金属性和金属活动性的区别和联系
金属元素的原子在化学反应中,通常表现出失去电子成为阳离子的倾向。金属性的强弱通常用金属元素原子的的能量)大小来衡量。
金属的活动性是反映金属在水溶液里形成水合离子倾向的大小,也就是反映金属在水溶液里起氧化反应的难易,它是以金属的标准电极电势为依据的。从能量角度来看,金属的标准电极电势除了与金属元素原子的电离能有关外,同时还与金属的升华能(固态单质变为气态原子时所需的能量)、水合能(金属阳离子与水化合时所放出的能量)等多种因素有关。
金属活动性

金属活动性定义金属活动性指金属单质在水溶液中失去电子生成金属阳离子的性质。
概述金属的活动性是反映金属在水溶液里形成水合离子倾向的大小,也就是反映金属在水溶液里起氧化反应的难易,它是以金属的标准电极电位为依据的。
标准电极电位越小,其金属活动性越强,在水溶液里形成水合离子倾向越强,在水溶液里越容易被还原。
从能量角度来看,金属的标准电极电位除了与金属元素原子的电离能有关外,同时还与金属的升华能(固态单质变为气态原子时所需的能量)、水合能(金属阳离子与水化合时所放出的能量)等多种因素有关。
金属的活动性顺序最初是由化学家根据金属间的置换反应,还有金属跟水和各种酸、碱的反应总结而成。
金属性是指元素的原子在化学反应中失去价电子成为阳离子的的能力。
金属性的强弱用金属元素原子的最外层电子的电离能(基态的气态原子或基态的气态阳离子失去一个电子形成基态的气态阳离子所需要的最小能量称为元素的电离能)大小来衡量。
电离能可以定量的比较气态原子失去电子的难易,电离能越大,原子越难失去电子,其金属性越弱;电离能越小,原子越易失去电子,其金属性越强。
影响电离能大小的因素是:有效核电荷、原子半径、和原子的电子构型金属性强的元素,一般来说它的活动性也大,但也有不一致的情况。
例如,钠的第一电离能比钙的第一电离能要小,因此钠的金属性要比钙强。
但是钙在水溶液中形成水合离子的倾向比钠大,即钙的标准电极电势比钠要负,所以钙的金属活动性比钠大。
铜和银也有类似上述的情况。
由此可见,金属性与金属活动性两者概念是有区别的。
应用(1)排在前面的金属可以将排在后面的金属从它们的金属溶液中置换出来。
(2)理论上讲,排在氢(H)前的金属才能和有氧化性的酸反应,置换出氢。
(3)排在越后的金属越容易,也越先从它们的化合物中被置换出来。
(4)排在越前的金属越容易,也越先把其他化合物中的金属置换出来。
在判断溶液中的置换反应能否发生,以及发生置换反应的次序时,使用它是一种很简便的办法切记!金属活动性和反应的剧烈程度无关!大多数人认为铯与水反应会爆炸,而锂与水反应很平和,误以为铯比锂活泼,但这种观点是错误的。
金属性与金属活动性
金属性与金属活动性
胡征善
金属性和金属活动性是两个不同的概念。
对多数金属而言,金属性的排序和金属活动性的排序是一致的,因此往往将这两个概念混在一起,造成了“概念混淆”,有必要澄清。
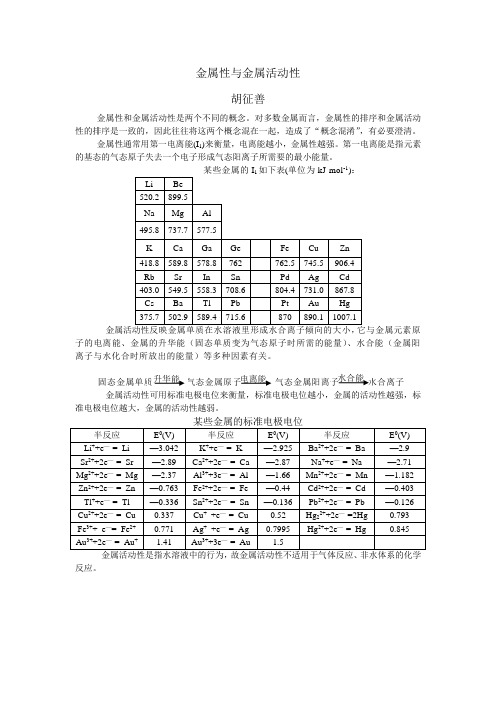
金属性通常用第一电离能(I 1)来衡量,电离能越小,金属性越强。
第一电离能是指元素的基态的气态原子失去一个电子形成气态阳离子所需要的最小能量。
某些金属的I
如下表(单位为kJ·mol -1
子的电离能、金属的升华能(固态单质变为气态原子时所需的能量)、水合能(金属阳离子与水化合时所放出的能量)等多种因素有关。
金属活动性可用标准电极电位来衡量,标准电极电位越小,金属的活动性越强,标准电极电位越大,金属的活动性越弱。
金属活动性是指水溶液中的行为,故金属活动性不适用于气体反应、非水体系的化学
反应。
金属活动性的比较

金属活动性的比较金属是自然界中一类具有特殊化学性质的物质,其活动性水平可以比较其在化学反应中与其他物质的反应能力。
金属活动性的比较主要通过比较金属与酸、氧、水及盐的反应情况来进行。
首先,让我们来比较金属与酸的反应。
金属和酸之间的反应产生盐和氢气。
一般来说,金属的活动性越大,其与酸反应的剧烈程度越高。
例如,钠是一种高度活泼的金属,在与酸反应时会产生剧烈的气体生成和溶液的变色。
而相对而言,铁和锌则要活泼得多,与酸反应时会有明显的气体生成,但没有溶液的变色现象。
此外,铝、镁和铬也是具有一定活性的金属,在与酸反应时产生气体,但反应不如前面所述的金属剧烈。
其次,我们来比较金属与氧的反应。
金属和氧反应形成金属氧化物,即金属氧化。
活泼的金属与氧反应会释放出大量的能量,形成明亮的火花。
例如,钠与氧反应会迅速燃烧,产生明亮的火花。
铁和铝等金属也能与氧反应,但反应较钠来说较为缓慢。
金属与氧反应的能力是衡量金属活动性的重要指标之一。
再次,我们来比较金属与水的反应。
金属和水反应形成金属氢氧化物和氢气。
金属与水反应的剧烈程度也是衡量金属活动性的重要指标之一。
钠是一种高度活泼的金属,与水反应时会剧烈燃烧,并产生大量氢气。
铝和镁等金属与水反应也会产生氢气,但反应相对来说较为缓慢。
相比之下,铁和铜等金属则不与水反应。
最后,我们来比较金属与盐的反应。
金属与盐的反应产生金属替代反应,即金属取代了盐溶液中的其他金属离子,生成新的金属盐和自由金属。
金属活泼性越大,其取代能力越强。
例如,钠可以取代金盐溶液中的铜离子,生成金盐和自由钠。
相对而言,铜则不太容易被其他金属所取代。
通过比较金属和盐的反应,我们可以得出金属活动性的差异。
综上所述,金属活动性的比较是通过比较金属与酸、氧、水及盐的反应情况进行的。
金属的活动性级别可以根据其在化学反应中与其他物质的反应能力来确定。
通过了解金属活动性的比较,我们可以更好地理解金属的化学性质以及其在各种化学反应中的应用。
金属活动性和元素金属性的区别-精品文档

金属活动性和元素金属性的区别教学人教版高一《化学》“物质结构元素周期律”一课,在学习元素的金属性和非金属性时,会和常见金属的活动性顺序联系起来。
值得注意的是,这是两个不同的概念,尤其是第三周期的Na 、Mg、 Al元素的金属性逐渐减弱,又恰巧和常见金属的活动性顺序:K、Ca、Na、Mg、Al……相同,这使得许多教师、学生误把它们二者混为一谈,以至造成知识上的混乱而影响学生的发展。
如对于Zn和Fe,Sn和Pb等的活性和金属性的不同,未能引起应有的发现、重视或对二者不加区别,不知其所以然。
在金属活动顺序中,活泼性Sn>Pb,Zn>Fe;在元素周期表中,金属性Pb>Sn,Fe>Zn。
两者并不矛盾。
元素的金属性是指元素原子在气态时失去电子的能力。
原子的第一电离能是元素的金属性的一种衡量尺度。
气原子失去一个电子形成+1价气态阳离子时所需要消耗的能量,这个能量叫原子的第一电离能。
金属的电离能越大,元素的金属性越弱,失去电子的能力越弱;金属的电离能越小,金属性越强,失去电子的能力越强。
在一个族中,从上向下随原子半径增大,外层电子逐渐离核更远,原子的第一电离能逐渐减小。
例如:碱金属Li(126)、Na(120)、K(102)、Rb(98)、Cs(91)[括号内的数值表示元素原子的第一电离能,单位为千卡/摩尔];又如IB族的元素:Cu(180)、Ag(176)、Au(214),由此可以看出,在各族中由上到下,原子的第一电离能逐渐减少,元素的金属性逐渐增强,所以金属性Pb>Sn,第IA族下方的铯Cs有最低电离能,是周期系中最活泼的金属。
同理在同一周期中从左到右元素的金属性逐渐减弱。
例如:K(102)、Ca(142)、Sc(153)、Ti(160)、Fe(183)、Zn(218)等。
当然是金属性Fe>Zn。
在金属活动顺序中金属单质的活泼性,即金属单质在水溶液中失去电子能力的大小就要用标准电极电势来比较。
金属活动性和元素金属性的区别

金属活动性和元素金属性的区别作者:罗井林来源:《江西教育·综合版》2011年第06期教学人教版高一《化学》“物质结构元素周期律”一课,在学习元素的金属性和非金属性时,会和常见金属的活动性顺序联系起来。
值得注意的是,这是两个不同的概念,尤其是第三周期的Na 、Mg、 Al元素的金属性逐渐减弱,又恰巧和常见金属的活动性顺序:K、Ca、Na、Mg、Al……相同,这使得许多教师、学生误把它们二者混为一谈,以至造成知识上的混乱而影响学生的发展。
如对于Zn和Fe,Sn和Pb等的活潑性和金属性的不同,未能引起应有的发现、重视或对二者不加区别,不知其所以然。
在金属活动顺序中,活泼性Sn>Pb,Zn>Fe;在元素周期表中,金属性Pb>Sn,Fe>Zn。
两者并不矛盾。
元素的金属性是指元素原子在气态时失去电子的能力。
原子的第一电离能是元素的金属性的一种衡量尺度。
气原子失去一个电子形成+1价气态阳离子时所需要消耗的能量,这个能量叫原子的第一电离能。
金属的电离能越大,元素的金属性越弱,失去电子的能力越弱;金属的电离能越小,金属性越强,失去电子的能力越强。
在一个族中,从上向下随原子半径增大,外层电子逐渐离核更远,原子的第一电离能逐渐减小。
例如:碱金属Li(126)、Na(120)、K (102)、Rb(98)、Cs(91)[括号内的数值表示元素原子的第一电离能,单位为千卡/摩尔];又如IB族的元素:Cu(180)、Ag(176)、Au(214),由此可以看出,在各族中由上到下,原子的第一电离能逐渐减少,元素的金属性逐渐增强,所以金属性Pb>Sn,第IA族下方的铯Cs有最低电离能,是周期系中最活泼的金属。
同理在同一周期中从左到右元素的金属性逐渐减弱。
例如:K(102)、Ca(142)、Sc(153)、Ti(160)、Fe(183)、Zn(218)等。
当然是金属性Fe>Zn。
在金属活动顺序中金属单质的活泼性,即金属单质在水溶液中失去电子能力的大小就要用标准电极电势来比较。
金属活动性的比较及金属的活动性顺序

金属活动性的比较及金属的活动性顺序金属活动性是指金属元素与非金属元素反应的趋势和能力。
金属中的原子倾向于失去电子,并形成带正电荷的离子,这使得金属具有良好的导电性和导热性。
活动性较高的金属往往更容易与非金属发生反应,而活动性较低的金属则相对稳定。
了解金属的活动性顺序对于理解金属反应及其应用具有重要意义。
1. 金属活动性的比较在自然界中共有约80种金属元素,它们的活动性各不相同。
下面将对一些常见金属进行活动性的比较。
1.1 锂(Li)锂是一种非常活泼的金属,在空气中与氧气迅速反应生成氧化锂。
锂在水中也能与水剧烈反应产生氢气。
由于锂的活泼性,它常以化合物的形式存在,如氢氧化锂(LiOH)和硝酸锂(LiNO3)。
1.2 钠(Na)钠是一种常见的活泼金属,在空气中容易氧化,形成氧化钠(Na2O)。
钠与水反应会剧烈放热,并产生氢气。
由于钠的活泼性,它常以盐类的形式存在,如氯化钠(NaCl)和硫酸钠(Na2SO4)。
1.3 钾(K)钾是一种活泼金属,与水反应产生氢气,并放出大量热能。
钾与许多非金属元素也能发生反应,例如与氧气反应生成氧化钾(K2O)。
1.4 镁(Mg)镁是一种活泼的碱土金属,在空气中能够自燃并形成氧化镁(MgO)。
镁与酸反应会放出氢气。
1.5 铝(Al)铝是一种活泼的轻金属,在空气中氧化形成氧化铝(Al2O3)。
铝的活泼性相较于钠和钾较低,但仍能与多种非金属元素反应。
1.6 镓(Ga)镓是一种较活泼的金属,但在空气中不易氧化。
镓的活泼性介于铝和锌之间。
1.7 铁(Fe)铁是一种较活泼的过渡金属,容易与氧气反应形成氧化铁(Fe2O3)。
铁还能与酸反应产生氢气。
1.8 锌(Zn)锌是一种活泼的过渡金属,在空气中能形成氧化锌(ZnO)。
锌与酸反应产生氢气。
1.9 铝(Cu)铜是一种不太活泼的金属,与氧气反应不剧烈。
铜通常以它的氧化物的形式存在。
2. 金属活动性顺序基于金属反应的观察和实验数据,我们可以得出金属的活动性顺序。
金属与非金属的活动性与化学反应性质的比较

金属与非金属的活动性与化学反应性质的比较金属和非金属是化学中两个重要的概念。
金属通常具有良好的电导性和热导性,而非金属则通常是非导电和不导热的。
除了这些基本性质之外,金属和非金属在其活动性和化学反应性质上也有很大的区别。
在本文中,我们将探讨金属和非金属的活动性和化学反应性质之间的比较。
1. 活动性:金属通常比非金属更活泼。
活动性是指物质与其他物质发生反应的倾向。
金属具有较低的电离能和较高的亲电性,这使得它们更容易与其他物质结合形成化合物。
非金属则相对不太活泼,因为它们通常具有较高的电离能和较低的亲电性。
2. 氧化性:金属通常具有较高的氧化性。
氧化性是物质从其他物质中获取电子的能力。
金属通常容易失去电子,因此具有较高的氧化性。
在化学反应中,金属通常以阳离子的形式存在,并且容易与其他物质形成化合物。
相反,非金属具有较低的氧化性,它们通常以阴离子或共价键的形式存在,与其他物质形成化合物的倾向较小。
3. 常见化合物:金属和非金属形成的化合物也有很大的不同。
金属通常与非金属和阴离子形成离子化合物,例如氧化物、氯化物等。
这些化合物通常具有锐利的晶体结构和高熔点。
非金属通常与非金属和阳离子形成共价化合物,例如氧气、二氧化碳等。
这些化合物通常具有较低的熔点和较高的沸点。
4. 化学反应:金属和非金属在化学反应中的行为也有所不同。
金属通常容易与酸反应,产生气体和盐。
例如,金属与稀酸反应会生成氢气和相应的盐。
非金属通常容易与氧气反应,形成氧化物。
例如,非金属与氧气反应会生成二氧化碳和水。
5. 腐蚀性:金属通常易于腐蚀。
腐蚀是指金属在与环境中的物质接触时受到的损害。
金属通常容易与水和氧气发生化学反应,形成金属氧化物和金属氢氧化物。
这些化合物通常是可见的,并可进一步腐蚀金属。
相反,非金属通常具有较高的抗腐蚀性,因为它们本身就是不易腐蚀的。
总的来说,金属和非金属在活动性和化学反应性质上有很大的差异。
金属通常比非金属更活泼,具有较高的氧化性和易于腐蚀的倾向。
主族元素金属“活泼性”和非金属“活泼性”规律的探讨

主族元素金属“活泼性”和非金属“活泼性”规律的探讨
主族元素的“活泼性”是指元素化学性质的特性,可以直接影响某物体表面和
空间的性能,从而影响到物质的形态和物理环境的稳定性。
主族元素中的金属和非金属都具有其特有的“活泼性”规律。
首先,主族元素中的金属具有较强的“活泼性”。
金属元素具有较强的活性,
有较多的电子可以与氧或水之间附着,并发生反应,例如铜、锌、铝和锰等可以与水、空气中的氧或氢结合,形成多种化合物。
同时,金属元素容易与有机物质结合,从而形成有效的保护层,以维持元素的活泼性。
其次,非金属元素也具有独特的“活泼性”规律。
非金属元素更具活化性,其
原子中的电子较少,它们可以与空气中的硫化氢、氧、氟等气体结合,形成以气态元素为主的复合物。
由于气态会使元素更强地活跃,它们可以形成一些氢键和共价键,以影响这些物质的特性,例如碳、氮、氧、氯等等。
总之,主族元素中的金属和非金属都具有其特有的“活泼性”规律。
它们均可
与气体反应,生成复合物,从而具有电导性、能量有效性及以改善物质性能等作用。
在实际应用中,应根据不同元素的“活泼性”而采取相应的技术,以发挥元素的最佳性能。
元素的金属性、非金属性与单质的活动性的关系

课程教育研究 Course Education Ressearch 2015年10月 下旬刊 考索·探微217· ·二、河州花儿典型语气词“哩”的分析河州花儿中的语气词很多,例如花儿歌词:“上去个高山者望平了川,望平了川,平川里有一朵牡丹;看去是容易摘去是难,摘去是难,摘不到手里是枉然。
”“兰州城里有一个铁桥呢,还有个握桥的寺呢;这们着想你是想死呢,想死是谁知道的呢。
”“清水的河里磨一盘,三道山,牛羊们往下者赶哩,陪上尕妹者坐一天,六月六,日子们还嫌短哩。
”除了以上所叙述的这些语气词外,在花儿的演唱过程中演唱者也会加一些语气词,如“哎哟”、“哎西”、“呀哎”、“啊呀”等,这里主要分析河州花儿中的典型语气词“哩”。
“哩”在《现代汉语词典》(2002年增订版)有两种解释:1、跟普通话的“呢”相同,但只用于非疑问句,例如:山上的雪还没化哩。
2、用于列举,跟普通话的“啦”相同,例如:碗哩,筷子哩,都已经摆好。
由以上的例子可以看出,在普通话中语气词“哩”只是出现在非疑问句句末或是句中,用于陈述或是列举,表达一种肯定的语气。
而在河州花儿中语气词“哩”除了用于非疑问句,表达肯定的语气外,还依据不同的唱词,具有跟普通话语气词“哩”不同的功能。
例如:“我提上罗锅你背上枪,上山走,要吃个黄羊的肉哩;我拿上黄表你拿上香,上庙走,要吃个不罢的咒哩。
”“天上的星宿明者哩,月影下雪者哩;尕妹的大门上蹲着哩,毡帽哩焐脚着哩。
”“千里的大路上红旗绕,辕门上斩宗保哩;尕妹的大门上领个教,相思病啊门着好哩。
”以上是所选的三首花儿,从这三首中可以看出语气词“哩”在花儿唱词中的位置也是不固定的,有时位于句末,比如第一首,有时句中句末都有,比如第三首,但有时是每句唱词的句末都有“哩”,如第二首主要是为了满足花儿独有的押韵,“河州方言中因语气转换需要的一些虚词被大量地用于花儿的韵角,形成了花儿独有的节奏感和音韵之美,显示出花儿独有的押韵特色。
金属性金属活泼性辨析

金属性金属活泼性辨析这里有他山之石,可助您一臂之力,李老师欢迎您的到来。
元素的金属性通常是指元素的气态原子失去电子的能力。
非金属性则是指元素的气态原子获得电子的能力。
而元素的原子失去电子或获得电子的能力都是相对的,因此,元素的金属性和非金属性也是相对的。
元素的气态原子失去电子的倾向通常用电离能来衡量。
电离能是指处于基态的气态原子生成气态阳离子所需要的能量。
元素的原子电离能越小,表示气态时越容易失去电子,即该元素在气态时金属性就越强。
金属活泼性是指金属单质在水溶液中生成水合离子的倾向大小,亦即金属活泼性大小,它是用标准电极电势来衡量的。
它不仅与金属的电离能有关,而且还与金属的升华热和电离后金属离子水合能有关。
1.1金属性与金属活泼性的联系因为表现溶液中金属活泼性的失电子过程,包含金属原子的电离,所以一般说来,元素金属性越强,金属活泼性就越强,就越容易与水或酸反应,金属元素最高价氧化物对应的水化物的碱性就越强。
1.2金属性与金属活泼性的区别①概念不同: 金属性是指气态金属原子失去电子的能力,是元素的性质,对象是元素;而金属活泼性则是指金属单质在水溶液中形成水合离子倾向的大小,是金属单质的性质,对象是金属单质。
②判断方法不同:金属性可以通过分析金属原子的电子层结构(即电子层、原子半径、最外层电子数)来判断金属性的强弱,其它判定方法参见下面附录一。
而金属活泼性除了与原子结构及电离能有关以外,还与水合能、升华能有关,标准电极电势值(参见下面附录二)就是这几方面综合的结果。
③衡量角度及表现形式不同:金属性是从微观角度得出的关于金属原子的性质。
而金属活泼性则是从热力学始末态宏观的角度得出金属单质在水溶液中的性质,它是定量衡量金属活泼性强弱的尺度。
我们平时所使用的金属活动顺序表,就是金属活泼性的一种表现形式,它是根据标准电极电势值由低到高的顺序排出来的。
④分析、讨论两者的环境不同:金属性是在气态情况下讨论的;金属活泼性是在水溶液中进行分析的。
单元课时复习:对比辨析金属性和金属活动性

【单元课时复习】对比辨析金属性与金属活动性湖北省石首市文峰中学刘涛一、金属性与金属活动性的区别与联系“金属性”是指金属的原子在化学反应中失去电子成为阳离子的性质。
金属性与原子结构密切相关。
一般说来,元素原子的电子层数越多,原子半径越大,最外层电子数越少,原子变为阳离子的倾向就越大,金属性就越强。
否则,金属性就越弱。
金属性通常可用金属元素最外层电子的电离能(气态原子失去电子成为气态离子所需要的能量)来衡量。
“金属活动性”是指金属单质在水溶液中失去电子生成金属阳离子的倾向,也就是反映金属在水溶液里起氧化反应的难易,是以金属的标准电极电势为依据的。
这种倾向的大小,不仅与金属本身的性质有关,还与它所处的环境——水有关。
元素的金属性强,一般来说对应金属单质的活动性越强,也就是还原性越强。
但也有不一致的情况。
例如,例如在金属活动性顺序中,虽然钙排在钠的前面,但钙的金属性却弱于钠。
铜和银也有类似上述的情况。
由此可见,金属性和金属活动性是两个不同的概念。
二、金属活动性的实际应用:⑴金属活动性可以预言金属矿石的提炼难易程度,如排在末位的一些金属,加热即可使他们从氧化物中分解出来,而排在最前面的金属,则需要使用电解法(如钠)或活泼金属置换法(如钾)来提取。
⑵金属活动性还可以预言金属被腐蚀的难易程度,如金即使加热也不与氧反应,而铁、铜在空气中会缓慢生锈,钠、钾等金属在空气中则极容易与氧化合,一般只能现取现用。
⑶金属性强弱的判断方法:①根据金属活动性顺序表判断,金属活动性顺序表中从前到后,常见金属的活动性逐渐减弱。
②可利用金属与氧气反应进行金属活动性的判断,因为相同条件下,金属与氧气反应越容易,金属的活动性就越强。
③可利用金属与酸的反应,来进行金属活动性的判断,依据能否进行反应,反应进行的快慢、剧烈的程度进行判断。
④可利用金属能否与盐溶液能否发生反应,来进行金属活动性的判断。
金属活动性强的金属可将金属活动性弱的金属从其盐溶液中置换出来。
金属活动性顺序

金属活动性顺序要全的,不是现有20种的,K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au是包括Ba在内的.最好是60种金属.Li、CS、Rb、K、Ra 、Ba 、Sr、Ca、Na 、Ac、La、Ce、Pr 、Nd 、Pm 锂、铯、铷、钾、镭、钡、锶、钙、钠、锕、镧、铈、镨、钕、钷、Sm 、Eu、Gd 、Tb 、Y 、Mg 、Am、Dy 、Ho、Er 、Tm 、Yb、Lu 、(H)、Sc、Pu 、Th 、Np 、Be 钐、铕、钆、铽、钇、镁、镅、镝、钬、铒、铥、镱、镥、(氢)、钪、钚、钍、镎、铍、Uv、Hf 、Al 、Ti 、Zr 、V 、Mn、Sm、Nb、Zn、Cr 、Ga 、Fe 、Cd 、In 、Tl 、Co 铀、铪、铝、钛、锆、钒、锰、钐、铌、锌、铬、镓、铁、镉、铟、铊、钴、Ni、Mo、Sn 、Tm 、Pb 、(D2)、(H2)、Cu、Tc、Po、Hg 、Ag、Rh 、Pd 、Pt 、Au 镍、钼、锡、铥、铅、(氘分子)、(氢分子)、铜、锝、钋、汞、银、铑、钯、铂、金网友:判断金属性与非金属的强弱,应抓住金属与非金属的分界线,如第二周期由六种非金属,第三周期由五种,依此类推(包括稀有气体在内)在同一周期内,从左到右,金属性逐渐减弱,非金属姓逐渐增强金属活动性顺序金属的活动性顺序是指标准状态下金属在酸溶液中活动性相对大小的顺序。
1865年,贝开托夫(Beketob)在实验的基础上,根据金属和金属离子间互相置换能力的大小,以及金属跟酸、水等反应的剧烈程度,首先确定了金属活动性顺序,在这个顺序里包括了氢。
因为氢可以被位于它前面的金属从稀酸里置换出来,而氢也可以把位于它后面的金属,从它们的盐溶液里置换出来,而氢后面的金属不能从酸中置换出氢。
这就是说,贝开托夫当时区分金属的活泼与不活泼,是以氢作为标准的。
当然,早期的化学家把金属跟酸、水等反应的剧烈程度作为衡量金属活动性大小的标志,是不严格的。
金属与非金属的活动性与电位

金属与非金属的活动性与电位金属和非金属是化学元素的两大主要分类。
它们在化学性质和反应活性上有很大的差异。
其中一个重要的差异是它们的活动性和电位。
本文将讨论金属和非金属的活动性与电位之间的关系,并对其应用进行探讨。
一、金属的活动性与电位金属通常具有较低的电负性和较高的反应活性。
根据活动性顺序,金属可以分为活泼金属和不活泼金属。
1. 活泼金属的活动性和电位活泼金属指的是在常温下易与非金属反应,发生氧化反应。
它们的电子亲和能较低,易失去电子并形成阳离子。
以钾(K)为例,它在常温下非常活泼,可以迅速与氧气反应,发生氧化反应生成氧化钾(K2O)。
活泼金属的电位相对较低,其电位趋势与周期表的排列顺序相反。
电位越低,活动性越大。
在活泼金属中,钠(Na)、钾(K)和镁(Mg)的电位相对较低。
2. 不活泼金属的活动性和电位不活泼金属指的是在常温下较难与非金属发生反应。
它们的电负性较高,倾向于从其他元素那里获取电子,形成阴离子。
不活泼金属的电位相对较高,其电位趋势与周期表的排列顺序相同。
电位越高,活动性越小。
在不活泼金属中,银(Ag)和铜(Cu)的电位相对较高。
二、金属的活动性和电位的应用1. 电池工作原理电池是利用金属的活动性差异来产生电能的设备。
电池由正极、负极和电解质组成。
正极采用活泼金属,如锌(Zn),负极采用不活泼金属,如铜(Cu)。
在电解质的作用下,锌发生氧化反应,Cu离子还原为铜。
这种反应过程中释放出的电子在电路中流动,产生电流,从而实现了能量的转换。
2. 金属腐蚀金属的活动性决定了其是否容易被氧化或腐蚀。
活泼金属容易被氧化,形成金属离子,如铁(Fe)在湿气中容易生锈。
而不活泼金属的反应性较小,不容易被氧化或腐蚀,如金(Au)是一种稳定的金属,不易受到化学反应的影响。
三、非金属的活动性与电位非金属通常具有较高的电负性和较低的反应活性。
它们更倾向于从其他元素获得电子,并形成阴离子。
1. 氧化剂与还原剂非金属在化学反应中常常具有氧化剂或还原剂的性质。
金属的活泼性

金属的活泼性金属是一种常见的材料,具有许多优异的性质,其中之一就是它的活泼性。
金属的活泼性指的是它在化学反应中的反应性和易于与其他物质发生化学反应的特性。
金属的活泼性不仅使其在工业和日常生活中得到广泛应用,还有助于人们理解许多化学过程和现象。
首先,金属的活泼性与其在元素周期表中的位置有关。
对于元素周期表上的主要金属元素,它们通常位于周期表的左侧。
这些金属通常具有较低的电离能和较小的电负性,使它们更易于失去电子,并在化学反应中作为阳离子存在。
因此,这些金属相对来说更容易与非金属元素反应,形成化合物。
其次,金属的活泼性还与其电子结构有关。
金属元素的原子通常具有少数几个外层电子,而且这些电子容易被其他原子接受。
当金属元素发生化学反应时,其外层电子可以轻易地迁移到其他原子中,形成阴离子或共用价键。
这使得金属具有优良的导电性和热传导性,因为电子能够在金属结构中自由移动。
另外,金属的活泼性还与其离子化倾向有关。
金属通常具有较低的电离能,这意味着很容易使其原子失去外层电子,并形成带正电荷的金属离子。
这些金属离子可以与其他离子或化合物发生作用,形成新的物质。
例如,钠金属与氯气发生反应,生成氯化钠,这是一种常见的盐类。
此外,金属的活泼性还影响了金属与非金属之间的电子转移过程。
当金属与非金属发生化学反应时,金属原子往往会失去电子,而非金属原子则会接受这些电子。
这种电子转移使金属形成正离子,非金属形成负离子,最终形成离子晶格结构。
这种离子晶格结构是金属强度和韧性的原因之一。
金属的活泼性还决定了它在腐蚀和氧化过程中的行为。
金属的活泼性越高,它与氧气和水分子之间的反应速度就越快和剧烈。
例如,铁这种常见的金属,在湿润的环境中容易发生氧化反应,形成铁锈。
相反,金属如金和铂则由于活泼性较低而不容易被氧化。
总之,金属的活泼性是其在化学反应中的反应性和易于与其他物质发生化学反应的特性。
这种活泼性与金属元素在元素周期表中的位置、电子结构、离子化倾向等因素密切相关。
比较金属性强弱的方法

比较金属性强弱的方法金属性的强弱可以通过以下几个方面进行比较:1. 金属性在化学反应中的稳定性:金属元素通常具有良好的稳定性,金属的氧化还原性低于非金属元素。
金属元素通常容易失去电子,形成正离子。
而一些金属性元素如铜、铁、锌等具有相对良好的稳定性,并且可以用于制造耐久性强的金属制品。
2. 金属元素的熔点和沸点:金属元素通常具有较高的熔点和沸点。
例如,铁的熔点为1538,沸点为2862,而铝的熔点为660,沸点为2519。
高熔点和沸点意味着金属元素能够在高温下保持稳定性,因此可以在高温环境中使用。
3. 金属元素的导电性和热导性:金属元素通常具有较好的导电性和热导性。
金属的电子云结构使得电子可以在金属中自由移动,因此金属元素可以很好地导电。
同时,金属元素的结晶结构也有利于热传导。
导电性和热导性的好坏对金属的应用具有重要的影响,因为金属常用于制造电气设备和热交换器。
4. 金属元素的强度和硬度:金属元素通常具有较高的强度和硬度。
金属元素的晶体结构和金属键使得金属具有较高的强度,因此金属制品常常具有出色的抗拉强度和耐用性。
同时,金属的硬度也可以通过合金化等方法进行调整,以满足不同应用的需求。
5. 金属元素的延展性和韧性:金属元素通常具有良好的延展性和韧性。
延展性是指材料在拉伸时的变形能力,而韧性则是指材料在受到外力破坏时能够发生较大的变形而不断裂的能力。
金属元素的晶体结构和金属键结构使得金属元素在受力时可以发生塑性变形,因此金属制品通常具有较好的延展性和韧性。
6. 金属元素的抗腐蚀性:金属元素的抗腐蚀性也是衡量金属性强弱的一个重要指标。
一些金属性元素具有较好的抗腐蚀性,如铝、锌等,可以在恶劣的环境条件下长时间保持稳定性。
而一些金属如铁则会容易发生腐蚀。
因此,在选择材料时,抗腐蚀性也是需要考虑的一个因素。
总的来说,金属性强弱的比较需要综合考虑多个方面的因素。
不同的金属元素在不同的应用领域中具有不同的优劣势,因此在选择合适的金属材料时需要根据具体的需求进行权衡和比较。
金属性是什么意思

金属性
金属性是指在化学反应中金属元素的原子失去电子的能力。
失电子能力越强的粒子所属的元素金属性就越强;反之越弱,而其非金属性就越强。
金属性常表示元素的原子失去电子的倾向;元素的非金属性是指元素的原子得电子的能力。
中文名
金属性
基本概念
元素的金属性与非金属性是一个看似简单,却有着许多内容值得深思的知识点。
金属性与非金属性讨论的对象是元素,它是一个广义的概念,而元素的金属性与非金属性具体表现为该元素单质或特定化合物的性质,学生学习过程中,极易混淆。
元素的金属性是指金属元素的原子失电子的能力。
高中学习过程中学生容易把金属性、非金属性与还原性、氧化性混淆。
其实,它们的区别在于所指的对象不同,金属性和非金属性指的对象是元素,还原性和氧化性指的对象是物质。
金属活动性与金属的置换反应

金属活动性与金属的置换反应金属活动性是指金属元素在化学反应中与其他物质发生置换反应的能力大小。
它是衡量金属的化学活性的重要指标之一,在金属的使用、工业生产和环境保护等方面具有重要意义。
本文将探讨金属活动性与金属的置换反应之间的关系,并分析其在实际应用中的一些应用。
一、金属活动性的概念与分类金属活动性是指金属元素在化学反应中与其他物质发生置换反应的能力大小。
根据金属的活动性强弱,可以将金属分为活泼金属和稳定金属两类。
1. 活泼金属:活泼金属具有较强的还原性和较强的与酸反应的能力。
常见的活泼金属包括锂、钠、钾等。
2. 稳定金属:稳定金属指活性较低的金属,它们的还原性和与酸反应的能力较弱。
常见的稳定金属有铜、铝、锌等。
二、金属活动性与置换反应金属的活动性与其在化学反应中与其他物质发生置换反应的能力相关。
一般来说,活泼金属比稳定金属更容易与其他物质发生置换反应。
1. 金属与酸的置换反应活泼金属可以与酸反应生成相应的盐和氢气,反应方程式为:2M + 2HX → 2MX + H2↑其中,M表示活泼金属,HX表示酸,MX表示生成的盐,↑表示氢气的逸出。
例如,钠与盐酸反应生成氯化钠和氢气的反应方程式为:2Na + 2HCl → 2NaCl + H2↑稳定金属的置换反应相对较弱,需要在较高的温度和浓度条件下才能与酸发生反应。
2. 金属与水的置换反应活泼金属与水发生置换反应时,产生金属氢氧化物和氢气。
反应方程式为:2M + 2H2O → 2MOH + H2↑其中,M表示活泼金属,MOH表示生成的金属氢氧化物,↑表示氢气的逸出。
例如,钠与水反应生成氢氧化钠和氢气的反应方程式为:2Na + 2H2O → 2NaOH + H2↑稳定金属与水反应的速度较慢,需要在一定的条件下才能与水发生反应。
三、金属活动性与实际应用金属活动性与置换反应的特性在实际应用中具有广泛的应用。
1. 金属腐蚀与防护金属的活动性与其腐蚀速度有一定的关系。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
也谈元素的金属性和金属活动性
----教师岗位职务远程培训研修日志
作者彭剑锋陕西省汉中市勉县教育局邮编 724200
在普通初高中化学教学中,很多教师甚至教材中,通常都将金属性和金属活动性这两个概念也许不刻意区分而混淆使用。
诚然,这两个概念在绝大多数金属性质上表现是一致的,但严格意义上讲二者的准确界定是不同的。
这里结合实际教学体会,结合查阅有关资料,集中摘录以飨读者,并浅谈个人点滴拙见。
一曰:金属性就是仅在元素这个层面而言的,是指金属元素的原子失去电子的能力,并非只是它的物理性质。
而金属活泼性也称金属活动性,其实是将金属性具体化处理,排序比较之后归纳到一起就成为人们熟知的金属活动性顺序表:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt An 故它本质上仍是金属性。
二曰:金属性是指金属在真空气态原子失去电子成为阳离子的难易程度,通常用金属元素原子的最外层电子的电离能大小来衡量。
元素的电离能是一种重要化学参数。
电离能是指从处于基态的气态原子中去掉电子把它变成气态阳离子所需要克服核电荷的吸引力而消耗的能量。
第一电离能愈小其元素的金属性愈强。
金属的活动性是反映金属在水溶液里形成水合离子倾向的大小,也就是反映金属在水溶液里起氧化反应的难易,它是以金属的标准电极电势(E O A(M n+/M)为依据的,从能量角度来看,金属的标准电极电势除了与金属
元素原子的电离能有关外,同时还与金属的升华能(固态单质变为气态原子时所需的能量)、水合能(金属阳离子与水化合时所放出的能量)等多种因素有关。
金属性强的元素,一般来说它的活动性也大,但也有不一致的情况。
例如,钠的第一电离能比钙的第一电离能要小(I1:Na5.41<Ca6.11),因此钠的金属性要比钙强。
但是钙在水溶液中形成水合离子的倾向比钠大,即钙的标准电极电势比钠要负(E O Na+/Na-2.71>E O Ca2+/Ca-2.76),所以钙的金属活动性比钠大。
铜和银也有类似上述的情况。
由此可见,金属性与金属活动性两者概念是有区别的。
三曰:金属性是指元素的性质(包括元素的物理性质及化学性质),如导电性、延展性、单质的还原性等,金属性的强弱反映了元素原子失去电子的难易程度,判断元素金属性强弱是依据元素周期表。
金属活泼性是单质的性质,是指在水溶液里的臵换H的能力,判断金属活泼性是依据金属活动性顺序表即E O A(Mn+/M)由小到大排序.由此可见,金属性强的元素不一定金属活泼性也强,如金属性Na>Ca,但金属活泼性Ca>Na。
集思广益,博采众长。
综合归纳足以见得,金属性强弱和金属活动性强弱既有联系,又有区别。
金属活动性强弱是金属原子在水溶液中失电子形成水合阳离子能力的强弱。
一般来说,金属性强的元素,金属活动性也强,但金属活动性强的金属,金属性不一定强。
金属性要从以下三个方面综合考察:
1.单质还原性的强弱;
2.单质与水或酸反应臵换氢能力的强弱;
3.元素最高价氧化物对应水化物的碱性强弱。
而金属活动性强弱只是根据金属原子在水溶液中失电子形成水合阳离子能力的强弱来区分。
因此,不能认为金属活动性强的金属,金属性一定强。
例如,Al金属活动性强,在水溶液中易失电子转化成水合铝离子,但氢氧化铝呈两性,就不能认为它的金属性强,实际上铝为两性金属。
再如,根据元素周期律,可知金属性Pb>Sn,但金属活动性却是Pb<Sn。
凡此种种不一赘述。
综上所述,金属性与金属活泼性既有联系又有区别,因此教师在课堂教学中,根据学生认知水平和教学需要,必要时精准把握概念的外延和内涵,以示区分,在教学中应适当区别使用。
注:作者原系嘉峪关市酒钢三中高级教师邮箱 1654982514@。
