动物可食性组织中林可霉素和大观霉素残留检测方法_气相色谱法
林可霉素制剂中林可霉素含量测定方法研究进展

林可霉素制剂中林可霉素含量测定方法研究进展叶兆伟;吴海港;刘锦妮;李尽哲【摘要】林可霉素对革兰氏阳性球菌有较好抑制作用,主要是抑制细菌蛋白质的合成。
目前对林可霉素含量的检测方法有多种,本文主要通过查阅国内近期文献,归纳总结了不同林可霉素制剂中林可霉素的含量测定方法的研究进展,为其质量评价和体内药动学过程的研究提供依据,并为林可霉素含量测定方法的进一步研究提供文献依据和分析思路。
【期刊名称】《信阳农林学院学报》【年(卷),期】2016(026)002【总页数】5页(P102-106)【关键词】林可霉素 HPLC 紫外分光光度法【作者】叶兆伟;吴海港;刘锦妮;李尽哲【作者单位】信阳农林学院生物与制药工程学院,河南信阳464000【正文语种】中文【中图分类】O657.3数·理·化林可霉素,为窄谱抗生素,对革兰氏阳性球菌有较好抑制作用,尤其对金葡菌、厌氧菌、肺炎球菌高效,主要抑制细菌蛋白质合成。
林可霉素在治疗各种感染中得到广泛应用,因此建立不同样品中林可霉素快速而有效的含量检测方法尤为重要。
目前,色谱法、质谱法、光谱法都可用于林可霉素的含量测定,实际选择时,可视具体情况而定。
本文针对不同制剂中林可霉素含量测定方法作一介绍,并分析了各种方法的优劣,希望为林可霉素含量测定方法的选择提供参考。
色谱法,又称色层法或层析法,是一种物理化学分析方法,利用不同溶质与固定相和流动相之间的作用力(分配、吸附等)的差别,当两相做相对移动时,各溶质在两相间进行多次平衡,使之达到相互分离的目的。
色谱法测定林可霉素含量使用最多的是高效液相色谱法。
该法简便,快捷,灵敏度高。
1.1 胶体金免疫层析法李利芬等[1]采用胶体金免疫层析法对牛奶中林可霉素的含量进行定性检测。
用微量移液器分别吸取200μL、50μL待检样本和150μL样本稀释液于微孔中,缓慢抽吸且充分混匀。
用该法对阴性生乳、阳性加标样品分别做了10次重复性检测,检测结果相同,重复性好;对阴性生乳、阳性加标样品做了8类物质的抗干扰实验,检测结果一致。
动物及动物产品兽药残留检测方法

附录1动物性食品中金刚烷胺残留量的测定液相色谱-串联质谱法1范围本标准规定了动物性食品中金刚烷胺残留量检测的制样和液相色谱-串联质谱测定方法。
本标准适用于猪、鸡和鸭的可食性组织(肌肉、肝脏和肾脏)及禽蛋中金刚烷胺残留量的检测。
2规范性引用文件下列文件中的条款通过本标准的引用而成为本标准的条款。
凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。
凡是不注日期的引用文件,其最新版本适用于本标准。
GB/T 1.1-2009 标准工作导则第1部分:标准的结构和编写规则GB/T 6682 分析实验室用水规格和试验方法3原理试样中残留的金刚烷胺用1%乙酸乙腈溶液提取,正己烷液液分配去脂,基质固相分散净化,液相色谱-串联质谱正离子模式测定,内标法定量。
4试剂和材料以下所用的试剂,除特别注明外均为分析纯试剂;水为符合GB/T 6682规定的一级水。
4.1金刚烷胺标准品,含量≥98.0%。
4.2D15-金刚烷胺标准品,含量≥99.0%。
4.3甲醇:色谱纯。
4.4乙腈:色谱纯。
4.5正己烷:色谱纯。
4.6冰乙酸。
4.7甲酸:色谱纯。
4.8无水硫酸钠。
4.91%乙酸乙腈溶液:取冰乙酸10 mL,用乙腈稀释至1000 mL。
4.1050%乙腈水溶液:取50 mL乙腈,用水稀释至100 mL。
4.110.1%甲酸水溶液:取1 mL甲酸,用水稀释至1000 mL。
4.12金刚烷胺、D15-金刚烷胺标准贮备液:分别精密称取10 mg金刚烷胺和D15-金刚烷胺标准品分别于10 mL容量瓶中,用甲醇溶解并稀释至刻度,配制成浓度为1 mg/mL的金刚烷胺和D15-金刚烷胺标准贮备液,-20℃以下保存,有效期3个月。
4.13金刚烷胺、D15-金刚烷胺标准工作液:分别精密量取1 mg/mL的金刚烷胺和D15-金刚烷胺标准贮备液0.1 mL,分别于100 mL容量瓶中用甲醇稀释至刻度,配制成金刚烷胺浓度为1 µg/mL,D15-金刚烷胺浓度为1 µg/mL的标准工作液,2 8℃保存,有效期2周。
现行水产及水产加工品标准目录

3、
GB 2762-2005
食品中污染物限量
替代GB2762/4809/4810-/7104/9674/9677/13107/15198/15201/14935/14961/13105
4、
GB2763-2005
33.
SC/T 3037-2006
冻罗非鱼片加工技术规范
34.
SC/T 3038-2006
咸鱼加工技术规范
35.
SC/T 3039-2008
水产品中硫丹残留量的测定气相色谱法
2008-8-12发布并实施
36.
SC/T 3040-2008
水产品中三氯杀螨醇残留量的测定 气相色谱法
2008-8-12发布并实施
40.
SC/T 3047-2010
鳗鲡储运技术规程
2010-12-23发布,2011-2-1实施
鲜冻水产品
41.
SC/T 3101-2010
鲜大黄鱼、冻大黄鱼、鲜小黄鱼、冻小黄鱼
替代SC/T 3101-1984
2010-12-23发布,2011-2-1实施
SC/T 3101-1984
鲜大黄鱼、鲜小黄鱼
8、
GB 10138-2005
盐渍鱼卫生标准
替代GB 10138~10143-1988
9、
GB 10144-2005
动物性水产干制品卫生标准
替代GB 10144-1988、GB16324-1996、GB16328-1996
10、
GB 14939-2005
鱼类罐头卫生标准
替代GB 14939-1994
食品分析(鲁东大学)智慧树知到课后章节答案2023年下鲁东大学

食品分析(鲁东大学)智慧树知到课后章节答案2023年下鲁东大学鲁东大学第一章测试1.食品分析能检测出的微观营养物质有()。
答案:维生素和矿物质2.食品分析过程概括起来就是五步,第一步是( )。
答案:样品采集、制备和保存3.世界上最早的农产品、食品行业性国际标准化组织是( )。
答案:官方分析化学家协会(AOAC)4.对没有国家标准而又需要在全国某个行业范围内统一的技术要求,应当制定( )。
答案:省委标准5.食品分析中最基本、最重要的分析方法是( )。
答案:化学分析法6.同一个物质的测定可能有不同的方法,采取不同的方法得出的都是相同的结果。
( )答案:错7.食品分析的方法中感官检验法是成本最低、最简单的检测方法。
( )答案:对8.强制性标准必须执行,推荐性标准国家鼓励企业自愿采用。
( )答案:对9.电子鼻、电子舌等智能仿生技术可以降低食品感官评价的主观因素。
( )答案:对10.农药残留、兽药残留、重金属等是影响食品安全的主要因素。
( )答案:对第二章测试1.为了检验样品掺假、投毒或怀疑中毒的食物等,应注意采样的()。
答案:典型性原则2.保存容易腐败变质的样品时,我们可以将其在()摄氏度条件下贮藏。
答案:0~53.测定农药残留的样品的制备,对于肉类,要去除皮和骨,将肥肉与瘦肉混匀,之后还要进行()的测定答案:脂肪4.浸提法是利用()原理,将固体样品中某种待测成分浸提出来,因此又称“液—固萃取法”。
答案:相似相溶5.磺化法用()处理样品。
答案:浓硫酸6.样品的制备方法不包括以下哪个()?答案:灰化法7.制样过程中,应防止挥发性成分的逸散及避免样品组成和理化性质的变化。
()答案:对8.对于罐头食品,应该每一箱都抽出一瓶作为试样进行分析。
()答案:错9.在制备样品过程中,如果分析样品的体积或质量太大,应选择用粉碎法进行分析。
()答案:错10.超临界流体萃取技术的操作环境有毒,使用时应小心。
()答案:错第三章测试1.滴定分析时由于指示剂选择不当而引起的误差是随机误差。
兽药残留检测方法及残留限量
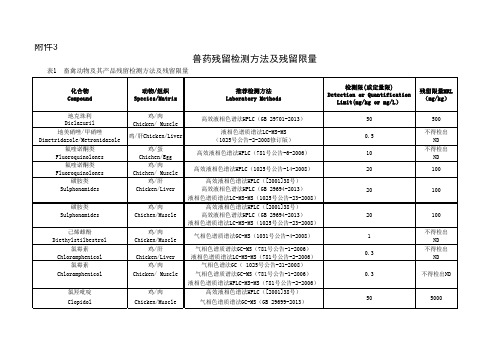
磺胺类
Sulphonamides
四环素类 Tetracyclines
头孢噻呋 Ceftiofur 氟喹诺酮类 Fluoroquinolones 替米考星 Tilmicosin 硝基呋喃类代谢物 Nitrofuran Metabolites (AOZ、AMOZ、AHD、SEM)
高效液相色谱法HPLC (1025号公告-10-2008)
液相色谱质谱法LC-MS-MS (781号公告-4-2006)
0.5
0.5(定量限) 20 15
100(定量限) 20 10 1
不得检出 ND
0.75 100
100 1000 100 100 不得检出ND
头孢噻呋 Ceftiofur
磺胺类 Sulphonamides
氯霉素 Chloramphenicol
β-受体激动剂 β-agonists
β-受体激动剂 β-agonists
卡巴氧和喹乙醇残留标示物 Marker Carbadox and Olaquindox Residues
牛/奶 Bovine/Milk
20
液相色谱质谱法LC-MS-MS(1025号公告-23-2008)
己烯雌酚 Diethylstilbestrol
鸡/肉 Chicken/Muscle
气相色谱质谱法GC-MS(1031号公告-4-2008)
1
氯霉素 Chloramphenicol
鸡/肝 Chicken/Liver
气相色谱质谱法GC-MS(781号公告-1-2006) 液相色谱质谱法LC-MS-MS(781号公告-2-2006)
氟喹诺酮类 Fluoroquinolones
鸡/肉 Chicken/Muscle
林可霉素大观霉素的兽医临床使用技术及配伍

林可霉素大观霉素的兽医临床使用技术及配伍林可霉素和大观霉素是兽医临床中常用的抗生素药物,具有广谱抗菌活性。
下面将详细介绍它们的兽医临床使用技术及配伍。
1.林可霉素林可霉素属于大环内酯类抗生素,可以静脉、肌肉以及皮下给药。
它对多种细菌有抗菌活性,并且对革兰氏阳性菌(如金黄色葡萄球菌、肺炎链球菌等)的效果较好。
其临床应用主要包括以下几个方面:(1)畜禽呼吸道感染:如鸡、鸭的鸡冠炎、鸭传染性流行性感冒等。
(2)泌尿生殖道感染:如犬的泌尿道感染、乳腺炎等。
(3)消化道感染:如猪的口蹄疫、猫的猫杆菌感染等。
在使用林可霉素时,需要注意以下几个方面:(1)用药剂量:不同动物的用药剂量有所不同,一般为每千克体重2-10毫克。
(2)用药时间:一般治疗期为3-7天。
(3)给药途径:可静脉、肌肉或皮下注射给药。
(4)有毒作用:林可霉素有一定的肾毒性和耳毒性,使用时需要遵守正确的用药剂量和用药时间,避免药物过量。
2.大观霉素大观霉素是一种氨基糖甙类抗生素,可抑制细菌蛋白质合成,从而达到抗菌的效果。
该药物可用于动物的静脉注射或皮下注射。
它主要用于治疗如牛、猪、鸡、猫、犬等动物的呼吸道、消化道、泌尿生殖系统等细菌感染性疾病。
使用大观霉素时需要注意以下几个方面:(1)用药剂量:用药剂量根据不同动物和疾病类型有所不同,一般为每千克体重10-50毫克。
(2)用药频率:一般每日1-2次。
(3)给药途径:可静脉注射或皮下注射,使用前需摇匀。
(4)肌注注意事项:大观霉素肌注对肌肉组织有一定的刺激性,注射时需要缓慢注入,并避免注射在易溃烂的皮下组织中。
配伍方面,林可霉素和大观霉素一般不宜与其他药物混合使用,以免发生相互作用或药物失效。
当需要同时应用其他药物时,医生需要权衡用药的必要性及可能的药物相互作用,并根据具体病情决定是否合并使用。
总体而言,林可霉素和大观霉素是兽医临床中常用的抗生素药物,在使用时需要根据动物种类和病情合理选用、正确配伍,同时注意合理用药剂量、用药时间和给药途径,以最大程度发挥药物的疗效。
林可霉素-大观霉素注射液在猪体内的残留消除研究

林可霉素-大观霉素注射液在猪体内的残留消除研究高艳;岳静;黄显会;曾振灵【摘要】[Objective]The residue depletion of lincomycin hydrochloride-spectinomycin sulfate injection in pigs was investigated in this study , and its withdrawal time was estimated .[Method] In routine breed-ing conditions , thirty healthy pigs were randomly allocated to six treatment groups .All of them were trea-ted with lincomycin hydrochloride-spectinomycin sulfate injection at a dosage of 15 mg/kg ( 5 mg linco-mycin and 10 mg spectinomycin ) once daily for 5 consecutive days .Five medicated pigs were slaughtered at 8, 24, 72, 144, 240 and 336 h after intramuscular administration, and muscle, liver, kidney, fat and injection site tissues were sampled .The tissue concentration of lincomycin and spectinomycin was ana-lyzed respectively by liquid chromatography-mass spsectrometry ( LC-MS/MS) and high-performance liq-uid chromatography ( HPLC ) .[Result and conclusion] At 6 days postmedication , all observations of spectinomycin and lincomycin were below the corresponding MRLs .In all of the detected tissues , kidney had the highest drug concentration followed by liver , injection site , muscle and fat with the lowest drug concentration , indicating that kidney was target tissue for spectinomycin and lincomycin .Based on the MRLs, which were established by the Chinese Agriculture Ministry , the withdrawal time in pigs was ana-lyzed by WT1.4 software.The results indicated that the withdrawal time of lincomycin hydrochloride-spectinomycin sulfateinjection should be 8 days after intramuscular administration of 15 mg/kgin pigs.%[目的]对一种盐酸林可霉素-硫酸大观霉素注射液在猪组织中的残留消除进行研究,并制订该制剂在猪体内的休药期.[方法]常规饲养条件下,将30头健康猪随机分为6组,按猪体质量以15 mg/kg (即林可霉素5 mg/kg和大观霉素10 mg/kg)剂量颈部肌内注射盐酸林可霉素-硫酸大观霉素注射液,每天1次,连用5 d,于最后一次给药后8、24、72、144、240、336 h各宰杀1组猪,分别采集每头猪的肌肉、肝脏、肾脏、脂肪和注射位点5种组织,采用LC-MS/MS 法和HPLC-UV法分别对林可霉素和大观霉素进行残留量测定.[结果和结论]林可霉素在猪组织中消除较快,大观霉素消除较慢,给药后第6天所有检测组织中的林可霉素和大观霉素已全部低于最高残留限量,林可霉素和大观霉素在猪体内各组织器官的残留浓度大小顺序均为:肾脏>肝脏>注射部位>肌肉>脂肪,表明肾脏是二者的靶组织.结合农业部规定的林可霉素、大观霉素在猪体内的最高残留限量和WT1.4休药期软件计算结果,建议该制剂在猪体内的休药期为8 d.【期刊名称】《华南农业大学学报》【年(卷),期】2014(000)001【总页数】4页(P106-109)【关键词】残留;猪;林可霉素;大观霉素【作者】高艳;岳静;黄显会;曾振灵【作者单位】华南农业大学,国家兽药残留基准实验室,广东广州510642;华南农业大学,国家兽药残留基准实验室,广东广州510642;华南农业大学,国家兽药残留基准实验室,广东广州510642;华南农业大学,国家兽药残留基准实验室,广东广州510642【正文语种】中文【中图分类】S859.79林可霉素为林可胺类抗生素,主要抗革兰阳性菌,大观霉素为氨基糖苷类抗生素,主要抗革兰阴性菌,两者联用可从不同环节阻碍细菌蛋白质的合成,具有较好的协同作用.林可霉素与大观霉素配伍常用于防治猪沙门菌病、支原体肺炎和敏感菌引起的母猪乳腺炎-子宫炎-无乳综合症等疾病,临床上还可用于治疗猪密螺旋体性痢疾[1].随着该复方制剂在畜牧业中的广泛使用,不可避免地引起动物组织或其产品中药物的滞留或蓄积,不仅影响了动物性产品的生产加工,而且还会以残留的方式进入人体和生态系统,严重影响消费者的身体健康[2].本文对一种盐酸林可霉素-硫酸大观霉素注射液在猪组织中的残留消除进行研究,旨在为临床上合理使用该制剂提供理论依据和指导,并为制订该制剂在猪体内的休药期和正确执行休药期的规定提供科学依据.1.1 主要药品与试剂15 %盐酸林可霉素-硫酸大观霉素注射液(其中含林可霉素50 mg/mL,大观霉素100 mg/mL),批号120614,由上海公谊兽药厂提供.Bond Elut C18固相萃取小柱(6 mL,500 mg),美国安捷伦公司.甲醇(色谱纯),乙腈(色谱纯),正己烷(分析纯),二氯甲烷(分析纯)等.水为符合GB/T 6682规定的二级水.1.2 主要溶液配制提取液:称取磷酸二氢钾1.36 g,加水溶解并稀释至1 000 mL,磷酸调节pH至4.0,加入三氯乙酸20 g溶解即得.十二烷基磺酸钠溶液:称取十二烷基磺酸钠2.78 g,加水溶解并稀释至50 mL,静置24 h后备用.十二烷基磺酸钠缓冲液:称取十二烷基磺酸钠2.78 g,用水溶解,加入乙酸1 mL,并用水稀释至500 mL.1.3 仪器美国应用生物系统公司API4000型串联质谱仪(配ESI离子源).戴安UltiMate 3000高效液相色谱仪(配四元泵、自动进样器、柱温箱等).德国Eppendorf公司高速离心机.色谱柱:Hypersil BDS C18(5 μm,4.6 mm×250 mm),大连伊利特分析仪器有限公司.超声机:HS10260D型,BENCHTOP公司.1.4 动物试验流程32 头健康猪,其中,2头为空白对照,其余的随机分为6组.按猪体质量以15mg/kg(林可霉素5 mg/kg和大观霉素10 mg/kg)剂量颈部肌内注射盐酸林可霉素-硫酸大观霉素注射液,每天给药1次,连续给药5 d,分别在给药后第8、24、72、144、240、336小时的时间点各宰杀1组猪,采集肌肉、肝脏、肾脏、脂肪及注射位点等5种组织,做好标记、包装,保存于-20℃冰箱,待测.1.5 组织样品前处理1.5.1 含林可霉素的样品前处理准确称取匀质试样(肌肉和脂肪各1 g,肝脏和肾脏各0.5 g),置于15 mL离心管中,加入2 mL乙腈涡旋混匀,超声10 min,振荡10 min,于4℃条件下8 000 r/min离心10 min,转移上清液,残渣用1 mL乙腈重复提取1次,合并上清液,蒸馏水稀释至10 mL.用4 mL正己烷除脂3次,8 000 r/min离心10 min,弃正己烷层,水层过0.22 μm滤膜,进行LC-MS/MS测定.1.5.2 含大观霉素的样品前处理含大观霉素的样品前处理过程包括提取、净化和衍生化.其中,提取和净化过程参照我国农业部已颁布的动物性食品中林可霉素和大观霉素残留检测气相色谱法(农业部1163号公告-2-2009);衍生化过程如下:洗脱液用氮气吹干,加100 μL水复溶,加入400 μL体积分数为6%的三氟乙酸-乙腈溶液和400 μL 5 mg/mL 2,4-二硝基苯肼-乙腈溶液,涡旋混匀,70℃衍生化1h,取出,冰浴2 min,加入100 μL丙酮,混匀后于70℃加热10 min终止反应,冷却至室温,过0.22 μm滤膜,进行HPLC测定.1.6 检测林可霉素和大观霉素的色谱条件1.6.1 检测林可霉素的高效液相色谱-串联质谱条件液相色谱条件:色谱柱:Hypersil GOLD C18(5 μm,150 mm×2.1 mm);流速:0.25 mL/min;柱温:35℃;进样量:5.00 μL;流动相:A为体积分数0.1%的甲酸水溶液,B为乙腈;洗脱梯度:流动相B的比例在1.5 min内由4%线性提高到85%,然后保持4 min,再在0.5 min内降至4%,柱平衡时间6 min.质谱条件:ESI+离子化模式;雾化气压力(GS1):344 kPa;辅助气压力(GS2):241 kPa;气帘气压力(CUR):68 kPa;喷雾电压(IS):5 500 V;离子源温度:650℃.1.6.2 检测大观霉素的高效液相色谱条件检测器:紫外检测器,检测波长500 nm;色谱柱:Hypersil BDS C18柱(5 μm,4.6 mm×250 mm);流动相:乙腈-四氢呋喃-水(体积比30∶35∶35);流速为1 mL/min;柱温30℃;进样量:50 μL.2.1 方法学考察在本试验色谱条件下,林可霉素和大观霉素与组织中其他组分分离良好,色谱峰峰形较佳,林可霉素在猪肌肉、肝脏、肾脏、脂肪中的检测限为3 μg/kg,定量限为10 μg/kg,保留时间6.5 min左右,大观霉素在各组织中的检测限均为50μg/kg,定量限为100 μg/kg,保留时间8.2 min左右.林可霉素在猪不同组织中的线性范围为1~200 ng/mL,大观霉素在猪不同组织中的线性范围为0.1~10μg/g,相关系数均在0.99以上,线性关系良好.林可霉素在猪不同组织中的回收率为70.00%~106.20%,批内变异系数为3.57%~11.18%,批间变异系数为4.13%~10.42%.大观霉素在猪不同组织中的回收率为85.64%~99.38%,批内变异系数为3.12%~6.17%,批间变异系数为4.09%~7.19%.2.2 组织中药物残留将冷冻保存组织样品自然解冻,依据上述建立的方法,对试验组猪在不同屠宰时间点采集的肌肉、肝脏、肾脏、脂肪及注射位点5种组织进行测定,以测得的组织样品药物峰面积代入标准曲线计算出药物残留量.结果见表1.2.3 数据处理我国农业部规定的林可霉素在猪组织中的最高残留限量为肌肉、脂肪100 μg/kg,肝脏500 μg/kg,肾脏1 500 μg/kg;大观霉素在猪组织中的最高残留限量为肌肉500 μg/kg,脂肪、肝脏2 000 μg/kg,肾脏5 000 μg/kg.经WT1.4休药期软件处理药物浓度-时间数据,计算得到林可霉素在各组织的休药期分别为:肌肉24 h、肝脏24 h、肾脏61.69 h、注射位点为42.26 h、脂肪24 h;大观霉素在猪各组织的休药期分别为:肌肉34.61 h、肝脏54.44 h、肾脏176.62 h、注射位点为67.58 h、脂肪8 h.根据农业部规定的最高残留限量标准及上述分析结果,可知该制剂以15 mg/kg肌注(每天1次,连用5 d)时在猪体内的休药期为8 d.3.1 检测方法先前报道的关于大观霉素的检测方法有高效液相色谱-电化学检测法[3-5],高效液相色谱-安培检测法[6],高效液相色谱-柱前/柱后衍生化法,薄层色谱分析法/密度测定法[7],以及气相色谱分析法[8-10].本研究中,大观霉素的检测采用的是高效液相色谱柱前衍生化法,选取2,4-二硝基苯肼作为衍生化试剂,该试剂可与大观霉素的羰基反应生成苯腙化合物二硝基苯肼-大观霉素[11],衍生过程及衍生产物均比较稳定.反应需在酸性条件下进行,故用三氟乙酸控制反应过程中的酸性条件.已报道三氟乙酸-乙腈溶液的体积分数有3%[12]和6%[11],通过比较发现体积分数为6%的三氟乙酸-乙腈溶液作为酸性条件控制反应过程时效果较好,因此本研究中大观霉素的衍生化反应采用体积分数为6%的三氟乙酸-乙腈溶液.此外,也有报道采用反相高效液相色谱法测定林可霉素在肾脏、肝脏、肌肉和牛奶中的残留[13],离子对反相高效液相色谱法测定林可霉素在鲑鱼肌肉和皮肤中的残留[14],但是这些方法都涉及到繁琐的样品提取及净化程序.Sin 等[13]报道了使用液相色谱电喷雾电离串联质谱法测定林可霉素在动物组织和牛奶中的残留,该方法准确、精确、灵敏,且样品制备过程简单.基于此,本研究依据实验室的实际状况对该方法进行了优化,用于测定林可霉素在猪组织的含量.3.2 残留消除及休药期林可霉素和大观霉素在猪组织中均以肾脏的残留量最高,其次是肝脏、注射位点、肌肉、脂肪,因此,肾脏是该2种药物在猪体内的靶组织.诸多对林可霉素在猪和鸡体内残留和消除规律研究表明,林可霉素在肝脏和肾脏中的残留量最高,其次为肌肉和脂肪;对大观霉素在畜禽体组织残留和消除规律研究表明,大观霉素在肾脏的残留量最高,其次为肝脏,肌肉和脂肪的残留量较低.Hornish等[16]利用原子示踪技术研究了给猪连续3 d饲喂含不同水平林可霉素的饲料,结果表明,林可霉素在肝脏及肾脏中的残留量远高于肌肉和脂肪中,但其消除速度很快.Hornish 等[16]对猪和肉鸡的研究均证明,猪、鸡组织中林可霉素的残留量与饲料中林可霉素的浓度呈强线性相关.因此,在实际应用中,超量添加可导致林可霉素在动物性食品中残留超标.Bergwerff等[17]的研究也证实了肾脏中大观霉素的残留量最高.兽药使用指南规定盐酸林可霉素硫酸大观霉素可溶性粉和预混剂在猪体内的休药期为5 d[18],但并未对复方注射液作出具体规定.根据农业部规定的林可霉素和大观霉素的最高残留限量和WT1.4休药期软件的计算结果,建议该制剂按猪体质量以15 mg/kg肌注(每天1次,连用5 d)时的休药期为8 d.【相关文献】[1]AIELLO S E.The merck veterinary manual[M].8th ed.Whitehouse Station(NJ):Merck Sharp&Dohme Corp,1998:2032-2033.[2]朱蓓蕾.动物性食品药物残留[M].上海:上海科学技术出版社,1994.[3]SCHERMERHORN P G,CHU P,KIJAK P J.Determination of spectinomycin residuesin bovine milk using liquid chromatography with electrochemical detection[J].J Agric Food Chem,1995(43):2122-2125.[4]ELROD L J,BAUER J F,MESSNER S L.Determination of spectinomycin dihydrochloride by liquid chromatography with electrochemical detection[J].Pharm Res,1988,5 (10):664-667.[5]DEBREMAEKER D,ADAMS E,NADAL E,et al.Analysis of spectinomycin by liquid chromatography with pulsed electrochemical detection[J].J Chromatogr A,2002,953 (1/2):123-132.[6]PHILLIPS J G,SIMMONDS C.Determination of spectinomycin using cation-exchange chromatography with pulsed amperometric detection[J].J Chromatogr A,1994,675 (1/2):123-128.[7]KRZEK J,KWIECIEN A,STAREK M,et al.Identification and determination of oxytetracycline,tiamulin,lincomycin,and spectinomycin in veterinary preparations by thin-layer chromatography/densitometry[J].J AOAC Int,2000,83(6):1502-1506. [8]HOEBUS J,YUN Liming,HOOGMARTENS J.An improved gas chromatographic assay for spectinomycin hydrochloride[J].Chromatographia,1994,39(1/2):71-73. [9]陶燕飞,于刚,陈冬梅,等.动物可食性组织中林可霉素和大观霉素残留检测方法:气相色谱法[J].中国农业科技导报,2008,10(S2):63-68.[10]TAO Yanfei,CHEN Dongmei,YU Gang,et al.Simultaneous determination of lincomycin and spectinomycin residues in animal tissues by gas chromatography-nitrogen phosphorus detection and gas chromatography-mass spectrometry with accelerated solvent extraction[J].Food Addit Contam:Part A:Chem Anal Control Expo Risk Assess,2011,28(2):145-154.[11]金燕华.大观霉素分析检测方法的比较与壮观链霉菌原生质体的制备[D].杭州:浙江工业大学,2008.[12]BURTON S D,HUTCHINS J E,FREDERICKSEN T L,et al.High-performance liquid chromatographoc method for the determination of spectinomycin in turkey plasma[J].J Chromatogr B:BiomedSci Applications,1991,571 (1/2):209-216.[13]MOATS W A.Determination of lincomycin in milk and tissues by reversed-phase liquid chromatography[J].J Agric Food Chem,1991,39(10):1812-1816.[14]LUO Wenhong,YIN Binzhi,ANG C Y W,et al.Determination of lincomycin residues in salmon tissues by gas chromatography with nitrogen-phosphorus detection [J].J Chromatogr B:Biomed Appl,1996,687(2):405-411.[15]SIN D W,WONG Y C,IP A C.Quantitative analysis of lincomycin in animal tissues and bovine milk by liquid chromatography electrospray ionization tandem massspectrometry[J].J Pharm Biomed Anal,2004,34(3):651-659.[16]HORNISH R E,GOSLINE R E,NAPPIER J parative metabolism of lincomycin in the swine,chicken,and rat[J].Drug Metab Rev,1987,18(2/3):177-214.[17]BERGWERFF A A,SCHERPENISSE P,HAAGSMA N.HPLC determination of residues of spectinomycin in various tissue types from husbandry animals[J].Analyst,1998,123(10):2139-2144.[18]中国兽药典委员会.中华人民共和国兽药典:兽药使用指南:化学药品卷[M].2010版.北京:中国农业出版社,2011:63-64.。
反相高效液相色谱测定动物源食品中大观霉素残留

・1 6・ 6
中 国抗 生 素 杂 志 2 0 年 3月 第 3 卷 第 3期 07 2
文章 编 号 :0 18 8 (0 70 —1 60 1 0— 6 9 20 )30 6— 3
反 相 高效 液相 色 谱测 定 动物 源食 品 中大观 霉 素残 留
w ih ee to he ia t c o s e t b ih d f r t t r n to f s e tn t lc r c m c lde e t r wa s a ls e o he de e mi a i n o p c i omy i e i e n a ma o d. c n r sdu s i ni lf o M e h ds Th s mpl s to e a e we e e o enie b t ihl r c tc c d, a d h f t y o u e u s a c s r d pr t i z d y rc o oa e i a i n t e a t s l bl s b t n e we e r ex r c e wih ta td t dihl r c o ome ha e Fo l t n. lowe by la d— p n IC— d c e ne u o a SCX po ii e o s i ph s e r c i s tv i n ol d— a e xt a ton c u n, t n he x r c s ol m he t e t a t we e e e mi e . The r d t r n d mob l ph s wa c ti a i i n— ar ie ae s irc cd o p i bufe s l i n f r o uto
用 三 氯 乙 酸 匀 浆 抽 提 以
大环内酯类和林可胺类药物残留测定方法——微生物法和气相色谱法

大环内酯类和林可胺类药物残留测定方法——微生物法和气相色谱法6.1.4.2 测定办法 MALs种类较多,结构相像,对于该类药物的平安用法和残留检测向来是各国关注的焦点和讨论的重点。
而林可胺类药物经常与MALs同时用法,因此需要举行多残留同时分析。
目前,国内外关于MALs和林可胺类药物残留分析的文献较多,其检测办法主要包括微生物法、免疫分析法(IA)、薄层色谱法(TLC)、毛细管电泳法(CE)、气相色谱法(GC)、高效液相色谱法(HPLC)、气质联使用(GC-MS)和液质联使用(LC-MS)等。
总体说来,大多仪器分析技术基本都可用于两类药物的残留检测,以HPLC和LC-MS最为常见。
随着残留分析技术的进展,CE和TLC因为敏捷度达不到要求而逐渐被色质联使用所代替。
(1)微生物法(microbiologicalanalysis) 微生物法是经典的MALs含量测定办法。
王敏等利用微生物生长抑制的原理,对6种MALs残留举行了定性检测。
该办法通过MALs敏感菌Bacillusstearothermophilus细菌的生长与否,来推断MALs的存在。
该办法对多种基质的动物源食品检测限低,能够达到食品中MALs的MRL的1/2,操作容易且不需要复杂的仪器设备,可作为有效的筛选办法。
Nouws等建立了微生物法测定牛奶中MALs等多种类药物的残留量。
该办法以枯草杆菌、、、表皮葡萄球菌等作为实验用菌株,通过平板上抑制区域的大小来推断药物残留量的多少,除了少数几种药物,大多数待测抗生素的敏捷度都能满足欧盟所规定的牛奶中抗生素MRLs的要求,待测的48种抗生素均未超过欧盟所规定的MPLs。
在规定MRLs水平上,7种培养板的平均CV为4.5%~9.8%。
黄晓蓉等利用微生物抑制法检测了肉类、水产品及蛋中的MALs残留量,办法的LOD值为0.05mg/kg。
采纳ATCC9341、ATCC663、蕈状变种ATCCI1778为敏感菌,一次操作可同时检测肉类、水产品及蛋中的四大类抗生素残留。
气相法测定盐酸大观霉素残媒FDA方法验证

气相法测定盐酸大观霉素残媒FDA方法验证秦朝英;闫春芝;王连尧;宋瑞芝;廖萍;周桂云【摘要】本文采用气相色谱法测定了盐酸大观霉素非无菌粉中丙酮的含量,以对FDA方法进行验证.【期刊名称】《中国兽药杂志》【年(卷),期】2006(040)008【总页数】2页(P19-20)【关键词】气相色谱;FDA认证;毛细管色谱柱;残留溶媒;丙酮【作者】秦朝英;闫春芝;王连尧;宋瑞芝;廖萍;周桂云【作者单位】山东鲁抗医药股份有限公司质监中心,山东济宁,272120;山东鲁抗医药股份有限公司质监中心,山东济宁,272120;山东鲁抗医药股份有限公司质监中心,山东济宁,272120;山东鲁抗医药股份有限公司质监中心,山东济宁,272120;山东鲁抗医药股份有限公司质监中心,山东济宁,272120;山东鲁抗医药股份有限公司质监中心,山东济宁,272120【正文语种】中文【中图分类】TQ460.72大观霉素非无菌粉是兽用抗生素,在生产过程中会有少量丙酮残留下来,这对动物的健康有不利影响,目前我国及美国等许多国家对大观霉素非无菌粉中丙酮的含量做出了严格的规定[1]。
为此,我们选择气相色谱法来测定大观霉素非无菌粉中丙酮的含量,结果如下。
1.1 仪器 GC-4890D型气相色谱仪,配氢熖离子化检测器;7694E型自动顶空进样器;HP-5毛细管色谱柱(30 m×0.25 mm×1.0μm);Agilen公司产品。
AE100天平,METTER公司。
超声波清洗器,山东济宁超声波厂。
1.2 试药与试剂1.2.1 试药盐酸大观霉素非无菌粉,批号0508073、0508074,山东鲁抗医药股份有限公司。
1.2.2 试剂与材料丙酮、正丙醇,AR级;纯化水,本公司自制。
氮气、氢气、空气及Agilen公司配套的顶空瓶。
2.1 溶液的配制方法2.1.1 内标液的制备精密吸取正丙醇100 uL于100 mL容量瓶中,用纯化水稀释并定容至刻度。
动物来源食品中林可霉素的检测方法研究进展

动物来源食品中林可霉素的检测方法研究进展徐焘杰;龚丽贞;陈志;黄潇航;黄志坚;殷光文【摘要】本文的目的是为动物来源食品检验人员提供相关参考,通过列举动物来源食品中的林可霉素残留对人体产生不良反应和当前各种检验方法,最后充分说明了相关科研工作很到位.【期刊名称】《产业与科技论坛》【年(卷),期】2017(016)024【总页数】2页(P91-92)【关键词】林可霉素;不良反应;残留检测【作者】徐焘杰;龚丽贞;陈志;黄潇航;黄志坚;殷光文【作者单位】福建农林大学;福建农林大学动物科学学院/动物药物工程实验室;福建农林大学动物科学学院/动物药物工程实验室;福建农林大学动物科学学院/动物药物工程实验室;福建农林大学动物科学学院/动物药物工程实验室;福建农林大学【正文语种】中文林可霉素与大环内酯类的抗菌谱相似。
随着临床应用,其不良反应也与日俱增。
常见的不良反应有:1.腹或胃绞痛、疼痛、严重气胀;2.严重腹泻(水样或血样);3.发热;4.恶心、呕吐;5.异常口渴;6.异常疲乏或软弱;7.显著体重减轻(伪膜性肠炎)[1]。
利用各种高效精确的科学方法检测动物来源食品中的林可霉素残留量,显然是减轻或避免药残威胁的重要一环。
动物来源食品中林可霉素残留量常用的检测方法有高效液相色谱法(HPLC)、液相色谱-质谱联用技术(C-MS)、高效液相色谱串联质谱法(UPLC-MS/MS)、高效液相色谱一电喷雾串联质谱法(HPLC-ESI-MS/MS)、磁免疫化学发光法、胶体金免疫层析法、酶联免疫吸附法、气相色谱法[2]。
黄新球等[3]利用该方法测定蜂王浆中林可霉素的残留。
样品经乙腈(含3%的氨水)除蛋白,正己烷除脂肪,在217nm波长下用紫外检测器检测,平均回收率为102.6%~107.3%。
林可霉素在质量浓度5.0~100.0μg/mL范围内与峰面积呈良好的线性关系,最低检出限为0.09μg/mL。
该方法具有平行性好,成本低,加标回收率高等优势,很值得借鉴,是检测蜂王浆中林可霉素残留的好方法。
林可霉素在饲料中残留的微生物学检测方法

林可霉素在饲料中残留的微生物学检测方法
陈智慧;古丽曼
【期刊名称】《新疆畜牧业》
【年(卷),期】2009(000)004
【摘要】建立了林可霉素在配合饲料中残留的微生物学检测方法.样品用二氯甲烷提取经浓缩、溶剂转换,制成试样溶液,再用藤黄微球菌作为检定菌进行含量测定.结果显示,林可霉素在0.15~2.4μg/ml的浓度范围内具有良好线性关系(r=0.9991).配合饲料中3种添加浓度1.00μg/g、4.00μg/g、8.00μg/g的平均回收率为80.2%(n=9),RSD分别为5.7%、4.2%、2.2%(n=3).
【总页数】2页(P47-48)
【作者】陈智慧;古丽曼
【作者单位】新疆维吾尔自治区兽药饲料监察所,乌鲁木齐,830063;新疆维吾尔自治区兽药饲料监察所,乌鲁木齐,830063
【正文语种】中文
【中图分类】S816.3
【相关文献】
1.牛奶中残留麻保沙星的微生物学检测方法 [J], 陈秀金;任国艳;许凯旋;崔璨;张永丽;侯玉泽;胥传来;李根
2.牛奶中环丙沙星残留的微生物学检测方法研究 [J], 刘秀丽;郝永清;斯琴;包青山;苏日娜
3.预混料中金霉素的微生物学检测方法 [J], 傅师一;邹平道;谢世红
4.超高效液相色谱-串联质谱法同时测定饲料中林可霉素和克林霉素残留 [J], 韩镌竹;杨文腰
5.动物可食性组织中林可霉素和大观霉素残留检测方法——气相色谱法 [J], 陶燕飞;于刚;陈冬梅;王玉莲;袁宗辉
因版权原因,仅展示原文概要,查看原文内容请购买。
福建兽药残留检测方案

福建兽药残留检测方案1. 简介兽药是用于预防和治疗动物疾病的药物。
然而,若使用不当或滥用,兽药可能导致兽药残留,危害人们的健康和食品安全。
为了确保福建地区食品安全,福建省设立兽药残留检测方案。
2. 目的福建兽药残留检测方案的目的是检测食品和动物产品中的兽药残留,以确保食品安全,保护消费者的健康。
3. 检测方法福建兽药残留检测方案使用以下方法进行检测:3.1 高效液相色谱法高效液相色谱法是一种常用的兽药残留检测方法。
它利用样品中的兽药分子与色谱柱中的固定相发生相互作用,然后通过色谱柱进行分离和检测。
高效液相色谱法具有高灵敏度、高分辨率和高选择性的优点,可以准确测量兽药的残留量。
3.2 气相色谱法气相色谱法也是常用的兽药残留检测方法之一。
它利用样品中的兽药分子在高温下蒸发成气体,然后通过色谱柱进行分离和检测。
气相色谱法具有高分辨率、高选择性和高灵敏度的特点,可以快速准确地测量兽药残留物。
3.3 酶联免疫吸附测定法酶联免疫吸附测定法是一种基于抗体与抗原的反应进行检测的方法。
它利用兽药残留物与特定抗体结合,然后通过酶标记的二抗进行检测。
酶联免疫吸附测定法具有灵敏度高、特异性强和快速的特点,可以用于大规模兽药残留检测。
4. 样品采集和处理福建兽药残留检测方案中的样品采集和处理非常重要,它直接影响到检测结果的准确性和可靠性。
4.1 样品采集在样品采集过程中,应注意以下事项:•确保采集的样品代表性,避免人为干扰和污染。
•根据检测要求采集足够数量的样品。
•采集样品时,应使用干净的容器和工具,避免交叉污染。
4.2 样品处理在样品处理过程中,应注意以下事项:•样品处理过程应在洁净实验室环境中进行,避免污染。
•样品处理过程中,应根据检测要求采取适当的方法,例如样品提取、浓缩等。
•在样品处理过程中应遵循规范化的操作步骤,确保结果的准确性和可靠性。
5. 结果解读和审定在福建兽药残留检测方案中,检测结果的解读和审定非常重要,它决定了最终的判定结果。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
中国农业科技导报,2008,10(S2):63-68Journa l of A gr icu lt ura l Sc i ence and T echno logy收稿日期:2008 07 10;修回日期:2008 10 19作者简介:陶燕飞,博士研究生,主要从事兽药安全评价研究。
Te:l 027 ********。
通讯作者:袁宗辉,教授,博士生导师,主要从事兽医药学及毒理学、兽药残留与食品安全及兽药学研究。
T e:l 027 ********;E m ai:l yuan5802@ma i .l 动物可食性组织中林可霉素和大观霉素残留检测方法气相色谱法陶燕飞, 于 刚, 陈冬梅, 王玉莲, 袁宗辉(华中农业大学,国家兽药残留基准实验室(H ZAU ),农业部食品安全评价重点开放实验室,武汉430070)摘 要:大观霉素、林可霉素两者联合使用是兽医上常用的复方制剂。
但是不规范用药可导致在动物组织或其产品中残留,会产生较明显副作用,不仅影响动物性产品的加工生产,而且还会严重影响消费者的身体健康。
实验建立了检测动物可食性组织中林可霉素和大观霉素残留量的气相色谱法,线性实验和回收率实验结果表明,该方法测定可食性组织中的林可霉素和大观霉素的残留量准确可靠,组织中添加林可霉素的定量限为30 g /kg ,大观霉素定量限为40 g /kg 。
在组织中添加30~3000 g /kg 林可霉素或40~10000 g /kg 大观霉素,回收率为73.2%~85.7%。
该法能同时检测林可霉素和大观霉素两种药物,缩短了分析时间,有机试剂用量少,前处理简单,回收率高。
关键词:林可霉素;大观霉素;可食性组织;残留检测;固相萃取;气相色谱中图分类号:S816.17文献标识码:A 文章编号:1008 0864(2008)S2 0063 06D eter m i nation of L i nco mycin and Specti no myci n i n Edi bleT issues of Ani m al by Gas Chro m atographyTAO Yan fe,i YU Gang ,C H EN Dong m e,i WANG Yu lian ,YUAN Zong hu i(H uazhong Agricu l turalUn i versit y ,Nati onalReference Laboratory ofVeteri nary Drug Res i dues (H ZA U ),MOA K ey Laborat oryofFood S af ety E val u ati on,W uhan 430070,Ch i na)Abstrac t :Co m bined use of lincomyc i n and specti no m yc i n is co mmonly i n veteri nary treat ment .N on standard druguse can lead to obv i ous s i de effect due t o the surv i va l residues i n an i m al tissues and products .It w ou l d i nfl uence not on l y t he processi ng and produc i ng o f an i m al products ,but also the healt h of custo m ers .A GC m et hod o f s i m u ltaneous detecti ng li ncomyc i n and specti no m yc i n w as establi shed and va li dated i n all an i m a l ed i b l e ti ssues to a l ow concentra ti on (li m it o f quantitation)o f 30 g /kg for li nco m yc i n or 40 g /kg fo r spec tinomy ci n ,respec ti ve l y .T he recover i es o f li ncomy ci n i n the range of 30~3000 g /kg and specti nom ycin i n the range o f 40~10000 g /kg spi ked i n all tis sues w ere from 73.2%to 85.7%.T his m ethod cou l d m on iter li nco m yc i n and spec tinomy ci n s i m u ltaneously w ith short ana l ysis ti m e ,less o rganic so l ution ,si m ple pretreat m ent and h i gh recovery rate .K ey word s :li ncomy ci n ;specti no m ic i n ;ed i ble tissues ;resi due de tecti on ;so lid phase ex tracti on ;g as chro m atography林可霉素(li n co m ycin)属于林可胺类抗生素,对革兰氏阳性菌(葡萄球菌、溶血性链球菌和肺炎球菌等)有较强抗菌作用,对支原体也有抑制作用,但对革兰氏阴性菌如(粪链球菌、某些梭状芽胞杆菌、奴卡菌、酵母菌等)无效[1,2]。
大观霉素(specti n o m yc i n )属于氨基糖苷类抗生素,对革兰氏阴性菌(如布鲁氏菌、克雷伯菌属、变形杆菌、沙门氏菌、巴氏杆菌等)有较强作用,对革兰氏阳性菌(链球菌、葡萄球菌等)作用较弱,对支原体亦有一定作用[3~6]。
大观霉素、林可霉素两者联合使用具有协同作用,常用于防治猪腹泻、猪的支原体肺炎和败血支原体引起的鸡慢性呼吸道病等。
大观霉素可损害第八对脑神经,有肾脏毒性及对神经肌肉的阻断作用。
林可霉素对敏感人群副作用较强,可引起消化道反应,如恶心、呕吐等,还可导致过敏反应,如皮疹、荨麻疹、多形性红斑等。
不规范用药可导致在动物组织或其产品中残留,不仅影响动物性产品的加工生产,而且还会严重影响消费者的身体健康。
欧盟2002年颁布了关于大观霉素和林可霉素在组织中的最大残留限量(残留标示物均为原形)[9~11]。
所有食品动物的肌肉、脂肪、肝、肾中大观霉素的最大残留限量分别为300 g/kg、500 g/kg、1000 g/kg和1500 g/kg;林可霉素在牛/羊/猪/禽的肌肉、脂肪、肝、肾中的最大残留限量分别为100 g/kg、50 g/kg、500 g/kg和1500 g/kg。
我国农业部于2003年也颁布了关于大观霉素和林可霉素在组织中的最大残留限量[3]。
大观霉素在牛/羊/猪/鸡的肌肉、脂肪、肝、肾中最大残留限量分别为500 g/kg、2000 g/kg、2000 g/kg和5000 g/kg;林可霉素在牛/羊/猪/禽的肌肉、脂肪、肝和肾中最大残留限量分别是100 g/kg、100 g/kg、500 g/kg和1500 g/kg[12]。
目前还未见报道同时检测动物可食性组织中林可霉素和大观霉素残留的方法,因此加强二者残留检测技术的研究,是有效控制动物组织中药物残留关键措施,也是建立和完善兽药残留监控体系的任务之一。
1 材料与方法1.1 试剂林可霉素盐酸盐标准品(C18H34N2O6S HC l),含量!99%;大观霉素硫酸盐标准品(C14 H24N2O7H2SO4),含量!98%。
N,O-双(三甲基硅烷基)三氟乙酰胺(BSTFA,N,O bis(tri m eth ylsily)trifl u oroaceta m i d e),甲醇,乙睛,正己烷,磷酸二氢钾,磷酸,氢氧化钾,三氯乙酸,十二烷基磺酸钠,乙酸,均为分析纯试剂。
水为符合GB/T 6682规定的一级水。
1.2 主要仪器气相色谱仪(配氮磷检测器),分析天平,高速冷冻离心机,电热恒温水浴锅,旋涡混合器,组织匀浆机,W aters oasisHLB SPE柱(60m g/3mL)或相当者。
1.3 色谱条件色谱柱采用H P 5型,30.0m∀320 m∀0.25 m;进样口温度为280#;进样方式为不分流;进样体积为1 L;恒流模式;载气为氮气(99.999%);柱流速为1mL/m in;检测器温度为325#;辅助气为氢气3mL/m i n,空气60mL/m i n;尾吹气为氮气12m L/m i n;柱温升温程序见表1。
表1 柱温升温程序T able1 T he prog ra m of te m pe rature r i sing.起始温度(#) Initial te mperature(#)终止温度(#)T er m i nate temperature(#)升温速率(#/m i n)T emp r isi ng veloc i ty(#/m i n)保持时间(m i n)H oldi ng ti m e(m i n)总时间(m i n)T ota l ti m e(m i n)150150-2.02.0 150300201019.51.4 标准曲线的测定分别精密量取适量标准贮备液,制成混合标准溶液,再用甲醇稀释,制成林可霉素和大观霉素浓度分别为20000 g/L、10000 g/L、5000 g/ L、1000 g/L、500 g/L、100 g/L和50 g/L的工作液。
按照衍生化反应步骤,得到系列衍生化产物,供气相色谱分析。
1.5 样品的前处理1.5.1 提取 称取试料(2∃0.05)g于50mL聚四氟乙烯离心管中,加提取液15mL。
漩涡混匀,摇床振荡30m i n,5000rp m离心10m i n。
取上清液,残渣用10mL提取液重复提取一次。
合并上清液,5000rpm离心15m i n。
水层用40%或10%氢氧化钾和1m o l/L盐酸调节p H到5.8∃0.2,加十二烷基磺酸钠溶液2mL,漩涡混匀后静置15m in,备用。
1.5.2 净化 固相萃取柱依次用甲醇、水、十二烷基磺酸钠缓冲液各3mL预洗,取备用液过柱,再3mL用水淋洗两次,4mL甲醇洗脱,收集洗脱液,40#水浴下氮气吹干至约100 L左右时取出,室温下吹干。
加500 L硅烷化试剂(BSTFA)和100 L乙腈,涡旋混合1分钟,密封,75#恒温箱中,衍生反应1h;于室温下氮气吹干;加1.064中国农业科技导报10卷mL 正己烷,涡旋混合2m i n ,作为试样溶液,供GC NPD 分析。
