(百色专版)2019届中考化学复习第10单元酸和碱第1讲常见的酸和碱(精练)课件
【一遍过 中考篇】专题10 酸和碱【复习课件】-中考化学一轮大单元复习(人教版)

考点一、常见酸的性质及用途
3. 浓硫酸的腐蚀性和稀释方法
(1)浓硫酸能夺取纸张、木材等中的水,生成黑色的碳,具有强脱水性 ,有强烈的腐_蚀__性_____,如不慎将浓硫酸沾在衣服或皮肤上,立即用大量水冲洗 __________,然后再涂上3%~5%的碳酸氢钠溶液。
A.
B.
C.
D.
考点二、常见碱的性质及用途
1. 碱的构成: 金属离子 + OH- 。2. 盐酸
和硫酸的物理性质及用途
俗称
氢氧化钠(NaOH) 火碱、__烧__碱__或_苛__性__钠___
氢氧化钙(Ca(OH)2) _熟__石__灰__或消石灰
物 色、态
白色固体
白色固体
理 性
溶解性
__易__溶于水并放出大量的热
均变__小___
溶剂质量增加 溶质质量减少
浓硫酸/浓盐酸均要___密_封____保存
考点一、常见酸的性质及用途
4. 酸的化学性质(酸具有相似化学性质的原因: 溶液中都含有H+ )
(1)酸与指示剂的作用 紫色石蕊溶液遇酸变 红 ,无色酚酞溶液遇酸 不变色 。
(2)酸+金属→_盐__+_氢__气____
质
实质: H++OH-=H2O
中
用熟石灰改良酸性土壤
和
肥皂水涂抹蚊虫叮咬
应用
反 应
含碱药物治疗胃酸过多
酸和碱
碱的构成:金属离子+ OH-
常 见
氢氧化钠:吸水性
的
氢氧化钙
碱
氢氧化钾、氨水
碱 1.与酸碱指示剂作用
的 化
2.碱+非金属氧化物→盐+水
中考化学精练本 第一部分 考点过关练 第十单元 酸和碱 第1课时 常见的酸和碱

6.(2019·邵阳)下列物质不能与稀硫酸发生反应的是
A.CuO
B.Ag
C.BaCl2
D.Mg(OH)2
( B)
7.★(2020·郴州)H2SO4 是一种重要的化工原料。
(1)H2SO4溶液的 pH< < (选填“>”“<”或“=”)7,请写出用 pH 试纸
测定稀硫酸 pH 的正确方法:用干用燥干、燥洁净、的洁玻净璃棒的蘸玻取璃待测棒液蘸点取在 待pH 试pH纸试上纸,待上显,色待后,显与色标后准比,色与测卡标对液照准点,比在读色卡出对p照H 值,。 (读2)出浓硫pH酸值有吸水性,常用作某些气体的干燥剂,下列气体不能用浓硫酸
【应用与拓展】
(5)结合以上实验内容,请设计实验方案除去铜粉中混有的氧化铜,得到
纯净的铜:在在混有混C有uO C的uCOu的粉C中u加粉入中足加量稀入盐足酸量过滤稀,盐洗酸涤、过干滤燥,,获 得得纯纯净净的的C C洗uu涤。、干燥,获
(6)小明在征得老师的同意后,继续进行了如图所示实验。
由上述实验可以得出氢氧化钙的哪些性质:
到小的顺序是 a>b>c
8.(2020·吉林)学了酸的化学性质,某同学以稀硫酸为主题,绘制了“多 彩酸世界”思维导图。
(1)若用 Cu(OH)2 实现②,会得到蓝蓝色溶液。
(2)若想实现③,得到浅绿色溶液,可选用的单质是铁铁。
(3) 若 选 用 BaCl2 溶 液 实 现 ⑤ , 此 反 应 的 化 学 方 程 式
①①Ca(COaH()2O呈H)碱2呈性 碱,性②,Ca②(OHC)a2(可OH以)与2可稀盐以酸与发稀生中盐和酸反发应。 生中和反应。
考点 3:常见碱的性质及用途(2021 年考查 12 次,2020 年考查 7 次,2019
中考化学总复习 第十单元 酸和碱课件

一
二
三
四
五
(4)应用。 ①改良土壤的酸碱性:在农业上常用适量的熟石灰改良土壤的酸性。 ②处理工业废水:用熟石灰来中和硫酸厂中的污水,反应的化学方程式 为 Ca(OH)2+H2SO4 CaSO4+2H2O。 ③用于医药:常用含有碱性物质的药物中和过多的胃酸。 2.溶液酸、碱度的表示方法——pH (1)溶液酸碱性的测定。 实验室常用酸碱指示剂测定溶液的酸碱性,其中石蕊溶液和酚酞溶液 是两种常用的酸碱指示剂。 (2)溶液酸碱度的测定。 常用 pH 试纸测定溶液的酸碱性强弱即溶液的酸碱度,溶液的 pH 范围 通常在 0~14 之间。溶液 pH 与酸碱性关系为:
与盐作用
一
二
三
四
五
制取
Na2CO3+Ca(OH)2 CaCO3↓+2NaOH 化工原料,用于肥皂、石油、造 纸、纺织、印染等工业
CaO+H2O
Ca(OH)2
用途
建筑业、制三合土、抹 墙,农业上改良酸性土 壤、配制农药波尔多液 等,工业上制 NaOH 等
注意:使用 NaOH 必须十分小心,防止皮肤、衣服被它腐蚀,更应该防止 溅到眼睛里。如果万一将碱液沾到皮肤上,要用较多的水冲洗,再涂上硼酸 溶液。 2.碱的通性 (1)具有通性的原因。 由于碱溶于水生成(解离、电离)的阴离子全部是氢氧根离子,所以碱有 相似的化学性质。 (2)碱的通性。 ①使指示剂变色。②与某些非金属氧化物反应,生成盐和水。③与酸 反应,生成盐和水。④与某些盐反应生成另一种碱和另一种盐。 注意:只有溶于水的碱才能使指示剂变色。
溶液使紫色石蕊溶液变蓝色,无色酚酞溶液变红色 2NaOH+CO2 Na2CO3+H2O (故 NaOH 必须密封保存) NaOH+HCl NaCl+H2O 2NaOH+H2SO4 Na2SO4+2H2O FeCl3+3NaOH Fe(OH)3↓+3NaCl (常用于制取不溶性碱) Ca(OH)2+CO2 CaCO3↓+H2O Ca(OH)2+2HCl CaCl2+2H2O (常用于中和土壤的酸性) Ca(OH)2+ Na2CO3 CaCO3↓+2NaOH (工业制碱)
初中化学人教第十单元 常见的酸和碱 知识点整理(全面,带答案)
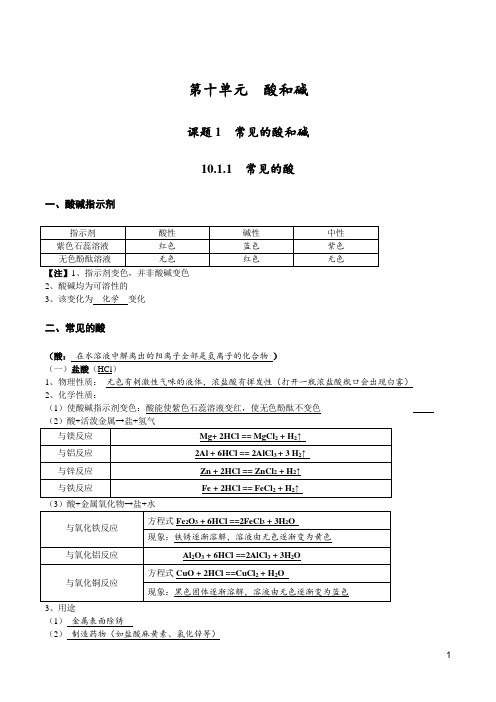
第十单元酸和碱课题1 常见的酸和碱10.1.1 常见的酸一、酸碱指示剂2、酸碱均为可溶性的3、该变化为化学变化二、常见的酸(酸:在水溶液中解离出的阳离子全部是氢离子的化合物)(一)盐酸(HCl)1、物理性质:无色有刺激性气味的液体,浓盐酸有挥发性(打开一瓶浓盐酸瓶口会出现白雾)2、化学性质:(1)使酸碱指示剂变色:酸能使紫色石蕊溶液变红,使无色酚酞不变色(1)金属表面除锈(2)制造药物(如盐酸麻黄素、氯化锌等)(3)人体胃液中的含有盐酸,可帮助消化(二)硫酸(H2SO4)1、浓硫酸(1)物理性质:无色粘稠油状液体,无气味,浓硫酸具有吸水性(2)化学性质:腐蚀性(3)浓硫酸的稀释:将浓硫酸沿着烧杯壁慢慢注入水中,并用玻璃棒不断搅拌(4)浓硫酸的事故处理:先用大量的水冲洗,再涂3%-5%的碳酸氢钠溶液。
2、稀硫酸的化学性质(1)使酸碱指示剂变色:酸能使紫色石蕊溶液变红,使无色酚酞不变色3、用途(1)用于生产化肥、农药、火药、燃料以及冶炼金属、精炼石油(2)金属除锈(3)汽车铅酸蓄电池中含有硫酸(4)浓硫酸在实验室常用作干燥剂三、酸的通性1、酸能与指示剂作用2、酸能与活泼金属反应3、酸能与金属氧化物反应4、酸能与碱反应5、酸能与盐反应注:酸溶液具有相似化学性质的原因:酸溶液中都含有H+四、复分解反应1、定义:两种化合物相互交换成分生成另外两种化合物的反应。
2、表达式:AB+CD=AD+CB3、反应前后各元素化合价不变(“变”或“不变”),属于基本反应类型。
4、10.1.2 常见的碱一、氢氧化钠(NaOH)1、俗称:烧碱、火碱、苛性钠2、物理性质:白色固体,易溶于水,溶解时放出大量的热。
3、化学性质(1)与酸碱指示剂反应:碱溶液能使紫色石蕊溶液变蓝,使无色酚酞变红、事故处理:先用大量的水冲洗,再涂上硼酸溶液5、制取:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH (化学方程式)6、密封保存的原因:(1)NaOH固体容易吸收空气中的水分发生潮解。
化学九年级下册第十单元课题一《常见的酸和碱》课堂达标测试题(含答案)

第十单元课题一《常见的酸和碱》课堂达标测试题(含答案)学校:___________姓名:___________班级:___________考号:___________一、选择题1.如图所示,将液体X加入到集气瓶中与固体Y作用,观察到气球逐渐变大,如表中液体X和固体Y的组合,符合题意的是A.①②⑤B.①③④C.①②④D.②③⑤2.下列溶液在空气中敞口放置后,溶液质量因发生化学反应而减小的是A.石灰水B.浓硫酸C.浓盐酸D.烧碱溶液3.下列物质能与NaOH反应的是A.Fe B.CO2C.Fe2O3D.NaCl4.如图,将充满CO2的试管倒扣在滴有紫色石蕊的蒸馏水中,一段时间后,下列实验现象描述正确的是①试管内液面上升②试管内溶液变红③试管内液面不上升④试管内溶液变蓝⑤试管内溶液不变色A.①②B.①④C.②③D.③⑤5.下列有关实验现象描述正确的是A.打开盛有浓盐酸试剂瓶的瓶塞,瓶口出现大量白烟B.将一氧化碳通入装有灼热氧化铜的玻璃管,生成铜和二氧化碳C.铁丝在空气中剧烈燃烧,火星四射,生成黑色固体D.向蒸馏水中加入适量肥皂水搅拌,产生大量泡沫6.下列试剂瓶应有标志的是A.氯化钠B.蒸馏水C.浓硫酸D.葡萄糖7.能除去铁锈的试剂是A.氯化钠溶液B.稀盐酸C.氢氧化钠溶液D.水8.下列操作能达到目的是A.稀释浓硫酸时,将水沿容器壁慢慢注入浓硫酸中,并不断搅拌B.溶解食盐时用玻璃棒搅拌以增大氯化钠的溶解度C.用湿润的pH试纸测量酸雨的酸碱度D.蒸发操作中,当蒸发中出现较多固体时,停止加热9.下列物质能使紫色石蕊溶液变红的是A.CO2B.O2C.NaCl D.NaOH10.下图是物质X溶于水中发生解离的微观示意图,其中能说明X是一种酸的是A.B.C.D.11.氢氧化钙俗称A.烧碱B.纯碱C.熟石灰D.石灰石12.紫甘蓝是大众爱吃的蔬菜,含有丰富的花青素,花青素遇酸性溶液变红色,遇碱性溶液变蓝色,在凉拌紫甘蓝丝时,观察到菜丝变成红色,可能是加入了下列哪种调味品A.食盐B.味精C.食醋D.香油13.下列关于氢氧化钠的描述中错误的是A.可用于改良酸性土壤B.易溶于水,溶解时放出大量的热C.能去除油污,可作炉具清洁剂D.对皮肤有强烈的腐独作用14.下面是某同学进行碱的化学性质实验时记录的实验现象,其中与事实不相符的是A.在Ca(OH)2溶液中加入稀盐酸,无明显变化B.在NaOH溶液中通入CO2气体,有白色沉淀生成C.在Ca(OH)2溶液中加入几滴石蕊溶液,溶液呈蓝色D.在NaOH溶液中加入CuSO4溶液,有蓝色沉淀生成15.除去下列物质中混有的少量杂质,所选试剂或方法不正确的是A.A B.B C.C D.D16.下列物质属于碱的是A.H2O B.NaHCO3C.Ca(OH)2D.H3BO317.下列“水”能使无色酚酞溶液变红的是A.氨水B.汽水C.冰水D.糖水18.柠檬酸(C6H8O7)是一种较强的有机酸,在水溶液中可以解离出来H+,从而呈现酸性,主要用于香料或作为饮料的酸化剂。
(中考化学)酸和碱【复习讲义】-年中考一轮化学复习过过过(人教版)
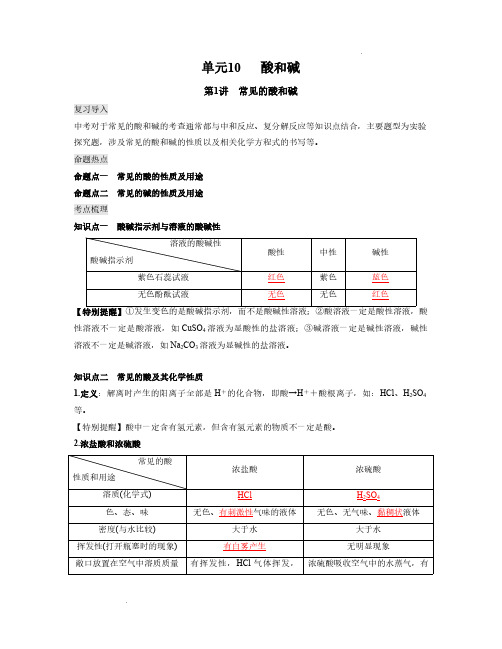
单元10 酸和碱第1讲常见的酸和碱复习导入中考对于常见的酸和碱的考查通常都与中和反应、复分解反应等知识点结合,主要题型为实验探究题,涉及常见的酸和碱的性质以及相关化学方程式的书写等。
命题热点命题点一常见的酸的性质及用途命题点二常见的碱的性质及用途考点梳理知识点一酸碱指示剂与溶液的酸碱性 溶液的酸碱性酸性中性碱性酸碱指示剂 紫色石蕊试液红色紫色蓝色无色酚酞试液无色无色红色【特别提醒】①发生变色的是酸碱指示剂,而不是酸碱性溶液;②酸溶液一定是酸性溶液,酸性溶液不一定是酸溶液,如CuSO4溶液为显酸性的盐溶液;③碱溶液一定是碱性溶液,碱性溶液不一定是碱溶液,如Na2CO3溶液为显碱性的盐溶液。
知识点二常见的酸及其化学性质1.定义:解离时产生的阳离子全部是H+的化合物,即酸→H++酸根离子,如:HCl、H2SO4等。
【特别提醒】酸中一定含有氢元素,但含有氢元素的物质不一定是酸。
2.浓盐酸和浓硫酸常见的酸浓盐酸浓硫酸性质和用途 溶质(化学式) HCl H2SO4色、态、味无色、有刺激性气味的液体无色、无气味、黏稠状液体密度(与水比较) 大于水大于水挥发性(打开瓶塞时的现象) 有白雾产生无明显现象敞口放置在空气中溶质质量有挥发性,HCl气体挥发,浓硫酸吸收空气中的水蒸气,有分数的变化及原因溶质质量减小,溶剂质量不变,溶液质量减小,溶质质量分数变小吸水性,溶质质量不变,溶剂质量增大,溶液质量减小,溶质质量分数变小保存密封保存,玻璃塞密封保存,玻璃塞主要用途重要化工产品。
用于金属表面除锈、制造药物等;人体胃液中含有盐酸,可帮助消化重要化工原料。
用于生产化肥、农药、火药、染料以及冶炼金属、精炼石油和金属除锈;浓硫酸有吸水性,在实验室中常用做干燥剂其他常见的酸除盐酸、硫酸外,还有硝酸(HNO3)、醋酸(CH3COOH)等。
3.浓硫酸的特性(1)吸水性:浓硫酸具有吸水性,在实验室中常用它作干燥剂。
常用来干燥O2、H2、CO2、CH4、CO等中性和酸性气体,不能用来干燥碱性气体,如NH3。
初三化学第十单元课题1常见的酸和碱学案

初三化学第十单元课题1常见的酸和碱学案(参考课时:3课时)第1课时一、学习目标:1、能说出常见的酸碱指示剂跟酸和碱溶液作用显示的不同颜色,并会用其检验溶液酸碱性。
2、能说出常见酸(盐酸和硫酸)的主要性质和用途以及知道浓硫酸的腐蚀性和稀释方法。
二、自主学习:【知识点1酸碱指示剂】首先教师完成【实验10-1】,之后再让学生仔细阅读课本第50页-第51页,填写下列空白:1、能跟或的溶液起作用而显示不同颜色的物质叫做酸碱指示剂,通常简称。
常见的有色的石蕊溶液和无色的溶液。
2、石蕊溶液遇酸溶液变色,遇碱溶液变色;酚酞溶液遇酸溶液变色,遇碱溶液变色。
【思考与交流】1、能使无色酚酞溶液变红的溶液,可使紫色石蕊溶液()A.变成红色B.变成无色C.变成蓝色D.不变色2、某些植物的花汁可作酸碱指示剂。
取三种花汁用稀酸溶液或稀碱溶液检验,颜色如下:花种花汁在酒精中稀酸中稀碱中玫瑰花粉红色粉红色绿色万寿菊花黄色黄色黄色大红花粉红色橙色绿色试回答下列问题:(1)若让你检验生活中的食盐水(不显酸碱性)、汽水(显酸性)、石灰水(显碱性)三种物质的酸碱性,你选择汁,不选用其他花汁的原因是。
(2)取所选花汁少量分别滴入上述物质中,请将显示的颜色填入下表中:食盐水石灰水汽水所显颜色【探究】让学生会家完成第51页的探究实验。
【知识点2几种常见的酸】教师首先完成【实验10-2】、【实验10-3】【实验10-4】,之后再让学生【阅读】课本第52页-第53页的内容,填写下列空白。
1、盐酸是颜色的液体,有气味。
打开盛有浓盐酸的试剂瓶盖,可以看到瓶口有产生,这说明浓盐酸具有性。
盐酸常用于金属表面除锈,还可以制造;人体的胃液中含有,可以帮助消化。
2、浓硫酸是色味液体,挥发。
浓硫酸露置在空气中时,能吸收空气中的水分,因此它具有吸水性,常可用作剂。
浓硫酸溶于水,溶解时会大量的热。
因此,在稀释浓硫酸时,一定要把沿器壁慢慢注入里,并不断搅拌。
且不可将倒进里。
中考化学精练本 第一部分 考点过关练 第十单元 酸和碱 第1课时 常见的酸和碱

8.(2021·丽水)物质结构决定性质,物质性质决定用途,反应本质决定 变化现象。如图是小科构建氢氧化钙部分知识网络,其中“—”表示相 连物质能发生化学反应,X 与图中所给物质的类别不同。请回答:
(1)酚酞溶液在 Ca(OH)2溶液中显红色,能使酚酞溶液变红的离子是_O_HO-H;
(2)列举熟石灰[Ca(OH)2]在工农业上的一种用途__改改良良酸酸性土性壤土__; (3)X 溶液能与 Ca(OH)2溶液反应并产生蓝色絮状沉壤淀,写出产生该实验现 象的一个化学方程式:_C_uCSuOS4O+4+CaC(aO(HO)H2=)=2==C=u=(COuH()O2H↓)2+↓C+aSCOa4 SO4__。
++HH22OO__。
10.下列物质长期放置在空气中,溶液质量因发生化学变化而减小的是
( D)
A.NaCl 溶液
B.NaOH 溶液
C.浓盐酸
D.石灰水
11.★向一定量的硫酸铜和稀硫酸的混合溶液中滴加氢氧化钠溶液,反
应过程中产生的沉淀质量与加入的氢氧化钠溶液质量关系如图所示。下
列说法不正确的是
( B)
9.(2021·北京)用下图装置研究酸、碱的性质。
(1)向 1 中滴加 Na2CO3溶液,观察到的现象是__有有白白色色沉沉淀产淀生__。 (2)向 2、3 中滴加无色酚酞溶液,溶液变红的是产蓝生2 (填序号);再向 3
中滴加 NaOH 溶液,NaOH 与盐酸反应的化学方程式为_N_aNOaHO+H+HCHlC=l====N=aNCalCl
2.某同学为了区别氢氧化钠溶液和澄清石灰水,设计了如图所示的四组
实验方案,其中能达到目的的是
( D)
A
B
C
D
3.(2021·台州)盐酸在生产和生活中的用途很广,能与多种物质发生反
中考化学人教版 精练本 第一部分 考点过关练 第十单元 酸和碱 第1课时 常见的酸和碱

9.(2018·北部湾第 28 题 8 分)利用以下装置对酸的化学性质进行探究。
(1)标号为①的仪器名称是试试管管。
(2)实验Ⅰ中,在点滴板的 a、b 穴中滴入酸溶液后,溶液变红色的是 aa (选
填“a”或“b”)。使用点滴板的优点之一是节节约约药药品(品合理(合即理可)。 (3)实验Ⅱ中,为了验证石灰石中含有碳酸根离即子可,)试剂 X 的名称是
12.(2020·潍坊)某同学总结的 Ca(OH)2的化学性质如图。下列说法错误
的是
( A)
A.甲一定是碳酸盐
B.反应②为放热反应
C.反应③可用于检验某种温室气体
D.向澄清石灰水中加入紫色石蕊溶液,溶液由紫色变
为蓝色
13.(2021·陕西)学习小组同学用下图装置进行实验。打开分液漏斗的 活塞,将 NaOH 浓溶液加入锥形瓶 A 中,关闭活塞,打开弹簧夹,观察到 A 中产生白色沉淀,烧杯 B 中液面降低。
7.(广西真题组合) (1)(2020·百色)浓硫酸不慎沾到皮肤上,应立即用大量水冲洗,然后再 涂上 3%~5%的碳碳酸酸氢氢钠钠(填名称)的溶液。 (2)(2020·百色)用稀硫酸清除铁制品表面的锈,反应的化学方程式为 3H22SSOO4+4+FFe2eO23O==3=Fe=2=(=SFOe4)23(+SO34H)2O3+3H2O。
能使酸碱指示剂变色
能与活泼金属反应
化学性质能与金属氧化物反应
能与碱反应
(
)
可以填入括号中的是 A.能与活泼非金属反应 B.能与某些酸反应 C.能与非金属氧化物反应 D.能与某些盐反应
( D)
7.(2021·荆州)物质 X 和 Ba(OH)2 在溶液中反应的化学方程式为 X+
Ba(OH)2===BaSO4↓+2Y,下列说法正确的是
九年级化学 第十单元 酸和碱知识点复习课件

D中的现象
水变浑浊 Ca__(O__H__)2_+_C__O__2_=__C__a_C__O_3_↓__+_H__2_O____
【讨论与反思】 (1)装置B中浓硫酸的质量增加,说明草酸的分解(fēnjiě)产物还有__ 水。
(2)根据实验结论,从环保角度考虑,实验装置中存在的不足是 _缺__少_尾__气__处__理__装__置__,正确的处理方法是_____将__尾__气_收__集__到__气__囊_。中
请你选择其中一种情况,设计实验证明,完成下列探究报告:
猜想
氯化钙和盐酸
实验步骤
取少量,加石蕊试液
第十三页,共二十二页。
实验现象及结论
紫色石蕊试液变红,
有盐酸和氯化钙
三、酸的通性
给下列酸命名:H2SO4 ____H3PO4 ____HClO3 _____H2S____
初中学到的酸都是易溶于水的,它们基本上有以下五点通性。
(或将尾气点燃)
第十二页,共二十二页。
典题3.实验室用大理石(杂质既不溶于水也不与稀盐酸反应)和稀盐
酸反应制取二氧化碳。实验结束后,锥形瓶内已无气泡产生,但还有
少量固体剩余。写出反应的化学方程式
复分解
_C_a_C__O_3__+_2_H_C__l=_C__a_C_l_2_+_H__2_O__+_C__O_2_↑__该反应的基本类型(lèixíng)是__(反fē_n应_ji_ě)__
的酸有醋酸、柠(hó檬ng酸sè) 、碳酸等。
盐酸、硫酸、硝酸
3.浓盐酸具有
,敞口放在空气中看到瓶口有 ,一段时间后,
溶液质量会减挥小发,性溶质(róngzhì)质量分数会
。 白雾
